Method Article
اختبار التمرير المختبري للسلامة Prion
In This Article
Summary
لا توجد طريقة لتقييم المناطق شائعة الاستخدام في البيئات المختبرية للتلوث بالبريون وإزالة التلوث بشكل فعال. يوفر البروتوكول الموضح هنا الأساسيات الأساسية لتنفيذ اختبار تمرير أمان المختبر الذي يمكن تعديله بسهولة لتلبية الاحتياجات الفردية لمختبرات معينة.
Abstract
حدث انتقال مرض البريون علاجي المنشأ من أدوات جراحة الأعصاب الملوثة ، ومواد الزرع ، والتعرض المهني لأدوات المختبر الملوثة بالبريون. تسبب البريونات المرض عن طريق الطي الخاطئ للشكل الخلوي الطبيعي لبروتين البريون ، PrPC ، في الشكل غير المطوي والممرض PrPSc وتكون قاتلة دائما. يعد الحد من انتقال البريون علاجي المنشأ والمهني أمرا صعبا. أولا ، يمكن أن ترتبط البريونات بالأسطح وتستمر على الأسطح لفترات طويلة من الزمن. ثانيا ، البريونات شديدة المقاومة للتعطيل. بالنظر إلى ذلك ، يمكن للأسطح أن تحتفظ بالعدوى لفترات طويلة من الزمن بعد إزالة التلوث غير الفعالة. لا يمكن أن يشكل هذا خطرا مهنيا محتملا على عمال مختبر البريون فحسب ، بل يمكن أن يؤدي إلى تلويث التجارب المعملية باستخدام تقنيات تضخيم البريون الحساسة. يتضمن البروتوكول الموصوف هنا لاختبار التمرير المختبري لسلامة البريون خطوات لتحديد وتوثيق مناطق المختبر ذات الازدحام الشديد ، وضوابط المسح الموصى بها لضمان صحة النتائج ، وخطوات لتحديد الاستجابات المناسبة لمواقع المسح السطحي الإيجابية ، والنتائج التمثيلية من اختبار تمرير البريون ، بالإضافة إلى النتائج الملموسة المحتملة. بشكل عام ، يمكن تنفيذ اختبار التمرير المختبري لسلامة البريون كجزء من برنامج سلامة البريون الأوسع لتقييم إزالة التلوث من الأسطح ، ومراقبة المساحات المشتركة لتلوث البريون ، وتنفيذ توثيق حالة إزالة تلوث البريون.
Introduction
أمراض البريون هي دائما أمراض تنكسية عصبية قاتلة بدون علاج أو علاج معروف. تحدث أمراض البريون بسبب PrPSc ، وهو الشكل غير المطوي والممرض للشكل الخلوي الطبيعي لبروتين البريون1،2،3،4،5 ، PrPC. من المعروف أن أمراض البريون تصيب البشر والعديد من الأنواع الحيوانية الأخرى. أحد أمراض البريون البشرية ، مرض كروتزفيلد جاكوب ، CJD ، له ثلاثة مسببات معروفة: متفرقة وموروثة ومكتسبة. يمكن أن يحدث مرض كروتزفيلد جاكوب المكتسب نتيجة للانتقال العرضي (علاجي المنشأ والمهني) ويعتقد أنه سبب كورو في شعب بابوا غينياالجديدة 6.
ارتبط انتقال البريون بالأجهزة الطبية الملوثة بالبريون ومواد الزرع7،8،9،10،11،12،13،14،15،16،17. يمكن أن يحدث انتقال علاجي المنشأ لمرض كروتزفيلد جاكوب عن طريق الدم أو الأنسجة أو من الأسطح الملوثة بالبريون18،19،20. على سبيل المثال ، يمكن أن يتطور مرض كروتزفيلد جاكوب علاجي المنشأ في المرضى الذين يتبعون مخطط كهربية الدماغ باستخدام أقطاب كهربائية كانت تستخدم سابقا على فرد في المرحلة قبل السريرية من مرض كروتزفيلد جاكوب والذي استسلم لاحقا لمرض كروتزفيلد جاكوب21. كما حدث انتقال مهني أحدث من المختبر حيث أصيب عامل مختبر بمرض البريون عن طريق ثقب الجلد باستخدام ملقط يستخدم للتعامل مع شرائح الدماغ من مصاب بمرض جنون البقر22،23. يمكن أن تحدث سيناريوهات الانتقال هذه داخل إعدادات المختبرات السريرية والمختبرتية والتشخيصية حيث يتم التعامل مع عينات البريون.
تقاوم البريونات تقنيات التطهير الشائعة ويمكن أن تستمر وتظل معدية على الأسطح لفترات طويلة من الزمن24،25،26،27،28،29. تقنيات التطهير الشائعة مثل استخدام الإيثانول والمنظفات الفينولية وبيروكسيد الهيدروجين وأشكال مختلفة من الإشعاع والفورمالديهايد غير كافية لتعطيل البريونات ، مما يسمح للأسطح بالاحتفاظ بالعدوى30،31،32،33،34،35،36،37. تساهم هذه الخصائص في انتقال البريونات أثناء التعرض علاجي المنشأ والمهني.
تم تطوير طرق للكشف عن البريونات البيئية مؤخرا فقط. يمكن لطريقة المسح البيئي إلى جانب التحويل الناجم عن الاهتزاز في الوقت الفعلي (RT-QuIC) تقييم عدوى البريون المتبقية من الأسطح البيئية وكذلك الأسطح المختبرية الشائعة بعد التطهير غير الفعال38،39،40،41،42. هنا ، نصف كيف يمكن دمج هذه التقنية في برنامج أمان البريون الأوسع. بشكل عام ، يمكن أن تسمح هذه الطريقة بمراقبة بروتوكولات التطهير المعتمدة على المختبر ، والتحقيق والتوثيق المناسب لحالة التلوث ، والتي يمكن أن تساعد في ضمان صحة التجارب عن طريق تقليل التلوث المتبادل ، وتقييم مساحات الاستخدام المشتركة لتلوث البريون والسماح بإعادة التدريب الاتجاهي للموظفين بناء على المناطق الملوثة بشكل شائع.
Protocol
تمت الموافقة على جميع الإجراءات المتعلقة بالحيوانات ووفقا لدليل رعاية واستخدام المختبر من قبل لجنة رعاية المؤسسية بجامعة كريتون واستخدامها.
ملاحظة: تظهر نظرة عامة تخطيطية على اختبار التمرير المختبري لسلامة البريون في الشكل 1.
1. اختيار مواقع المسح والتحضير للمسح السطحي
- تحديد وتصنيف مناطق المراقبة المناسبة للمسح. راجع النموذج المقدم للحصول على الوثائق والرجوع إليها (الشكل 2 والشكل التكميلي 1).
- قم بإعداد أنبوبين من أجهزة الطرد المركزي الدقيقة سعة 1.5 مل لكل منطقة من المناطق المحددة. أضف 250 ميكرولتر من محلول ملحي Dulbecco المخزن بالفوسفات إلى المجموعة الأولى من أنابيب أجهزة الطرد المركزي الدقيقة لاستخدامها في الخطوة 3.2. دع المجموعة الثانية من أنابيب الطرد المركزي الدقيقة تظل فارغة للاستخدام في الخطوة 4.3.
- استرجع المسحات ذات الرؤوس الرغوية من التخزين في منطقة خالية من تلوث البريون.
- قم بإعداد زجاجة ضغط بماء Milli-Q (MQ H2O) لاستخدامها في الخطوة 2.1.
2. إعداد مسحة التحكم الإيجابية والسلبية
- قم بإعداد المخففات لعناصر التحكم في المسحة الإيجابية والسالبة باستخدام أنواع التحكم ذات الصلة. مثال: للتحكم الإيجابي ، قم بإعداد تخفيف بنسبة 1٪ من تجانس الدماغ المصاب بالبريون في محلول ملحي مخزن بالفوسفات (DPBS) من Dulbecco. للتحكم السلبي ، قم بإعداد تخفيف بنسبة 0.1٪ من تجانس الدماغ غير المصاب (UN) (BH) من نفس النوع مثل التحكم الإيجابي في DPBS.
- باستخدام قفازات نظيفة ، استرجع العدد المناسب من المسحات من العبوة النظيفة وضع جانب المقبض لأسفل في رف أنبوبي ، مع الحرص على تباعد مسحات الرغوة حتى لا تلامس الأطراف المسحات أو الأسطح الأخرى. لكل عينة تحكم ، قم بإعداد ثلاث مسحات. قم بتغيير القفازات بين كل عينة.
- أمسك مسحة رغوة نظيفة من المقبض ، ضع 50 ميكرولتر من عينات التحكم الإيجابية والسلبية على أطراف مسحة الرغوة. تأكد من وضعه على جانبي طرف المسحة لضمان الامتصاص الكامل.
ملاحظة: قم دائما بتغيير القفازات قبل إزالة مسحة نظيفة من رف الأنبوب. - باستخدام المقص ، قم بقطع المقبض الزائد للمسحة (حوالي 1/2 من الطول) وضع المسحة في أنبوب الطرد المركزي الدقيق المحمل مسبقا مع توجيه جزء طرف الرغوة لأسفل. تأكد من غمر طرف الرغوة في DPBS وأن المقبض مقطوع بشكل كاف لإغلاق غطاء أنبوب الطرد المركزي الدقيق تماما.
- استمر في تطبيق عينات التحكم بعد تغيير القفازات حتى يتم تطبيق جميع العينات.
3. مسح السطح
- أمسك بقطعة مسحة من طرف الرغوة النظيفة من المقبض ، بلل طرف الرغوة مسبقا باستخدام MQ H2O وتخلص من الفائض. ضع طرف الرغوة المبلل للمسحة على المنطقة المختارة للمراقبة وقم بمسح المنطقة ذهابا وإيابا عشر مرات تقريبا مع تدوير طرف المسحة على السطح في نفس الوقت.
- باستخدام المقص ، قم بقطع المقبض الزائد للمسحة (حوالي 1/2 من الطول) وضع المسحة في أنبوب الطرد المركزي الدقيق المحمل مسبقا مع توجيه جزء طرف الرغوة لأسفل. تأكد من غمر طرف الرغوة في DPBS وأن المقبض مقطوع بشكل كاف لإغلاق غطاء أنبوب الطرد المركزي الدقيق تماما.
- تخلص من القفازات وضع قفازات جديدة قبل كل موقع مسح لتقليل احتمالية التلوث المتبادل.
- كرر الإجراء حتى يتم مسح جميع المناطق المختارة للمراقبة.
4. استخراج المسحة وتركيز الفراغ
ملاحظة: قم بتشغيل مكثف التفريغ قبل 30 دقيقة من الاستخدام للسماح للجهاز بالإحماء.
- ضع أنابيب أجهزة الطرد المركزي الدقيقة في رف أنبوب دائري. ضع رف أنبوب الطرد الدقيق في حمام مائي لبوق الكأس. تأكد من أن مسحات الرغوة في DPBS داخل أنابيب الطرد المركزي الدقيقة تحت سطح الماء في قرن الكوب (لا يلزم غمر جزء المقبض). قم بتطبيق الإعدادات التالية: إجمالي وقت التشغيل 15 ثانية (5 ثوان قيد التشغيل ، 5 ثوان إيقاف) عند ~ 75-85 واط.
- بعد الصوتنة ، قم بالطرد المركزي للأنابيب لمدة 15 ثانية تقريبا لجمع DPBS في الجزء السفلي من الأنبوب قبل النقل.
- باستخدام ماصة P1000 مضبوطة على 250 ميكرولتر، اجمع كل السائل (مستخلص المسحة) بعناية من قاع أنبوب الطرد المركزي الدقيق وانقله إلى أنبوب الطرد المركزي الدقيق المقابل من المجموعة الثانية الفارغة المسما. استخدم طرف الماصة لعصر أي سائل زائد من طرف الرغوة. تخلص من الأنابيب الفارغة التي تحتوي على مسحات.
- اضبط الإعدادات التالية على مكثف التفريغ: درجة الحرارة: 45 درجة مئوية ، وقت التسخين: 15 دقيقة ، وقت التشغيل: 2 ساعة ، الفراغ: 5.1.
- ضع أنابيب أجهزة الطرد المركزي الدقيقة التي تحتوي على مستخلصات المسحة في مكثف التفريغ ، مع التأكد من توازن الأنابيب وفتح جميع أغطية الأنابيب.
- عند اكتمال الدورة ، تأكد من تركيز العينات بالكامل (تبقى الحبيبات فقط). قم بتخزين الكريات عند -80 درجة مئوية حتى تستخدم في RT-QuIC.
ملاحظة: في بعض الحالات ، قد تكون هناك حاجة إلى وقت تركيز فراغ إضافي لضمان التركيز الكامل. قم بإزالة جميع العينات المركزة ، مع ترك الأنابيب التي لا تزال تحتوي على سائل. أعد موازنة الأنابيب المتبقية داخل المكثف وقم بتشغيلها بزيادات إضافية قدرها 1 ساعة حتى تتركز العينات بالكامل.
5. إعداد أدوات التحكم في المسح للاستخدام في RT-QuIC
ملاحظة: يجب إجراء ضوابط RT-QuIC قبل فحص مستخلصات المسحة البيئية لضمان عدم إدخال التلوث أثناء إجراءات المسح أو الاستخراج أو التركيز. على سبيل المثال التخطيطات، انظر الشكل 3 والشكل 4.
- قم بإعداد التحكم في لوحة RT-QuIC السلبية المناسبة (على سبيل المثال ، تجانس الدماغ غير المصاب [UN BH]) عن طريق التخفيف إلى التركيز المناسب في محلول تخفيف الأنسجة (N2-0.1٪ SDS / PBS). قم بإعداد تخفيف إيجابي للتحكم في اللوحة عن طريق تخفيف تجانس الدماغ المصاب بالبريون إلى تخفيف 10-3 في محلول تخفيف الأنسجة.
- قم بإزالة كريات مستخلص مسحة التحكم المخزنة مسبقا من -80 درجة مئوية وأعد تعليق كل منها ب 50 ميكرولتر من MQ H2O عن طريق سحب العينات لأعلى ولأسفل 10 مرات تقريبا ، متبوعا بالدوامة لفترة وجيزة. اسمح للعينات بالجلوس في درجة حرارة الغرفة (RT) أثناء تنفيذ الخطوات المتبقية.
- قم بتحميل 2 ميكرولتر من أدوات التحكم في اللوحة المحددة ، بما في ذلك أدوات التحكم في اللوحة السلبية (محلول تخفيف الأنسجة وحده وتجانس الدماغ غير المصاب) والتحكم الإيجابي في اللوحة (متجانس الدماغ المصاب).
- قم بتحميل 2 ميكرولتر من كل مسحة موجبة وسالبة يتكاثر تقنيا في ما لا يقل عن أربعة آبار لوحة RT-QuIC مكررة.
ملاحظة: إذا أظهرت عناصر التحكم السلبية في المسحة بذر RT-QuIC فوق معيار المختبر لتحديد إيجابي ، فهذا يشير إلى أن التلوث قد تم إدخاله أثناء عملية المسح والاستخراج والتركيز وأنه يجب إجراء تجربة المسح مرة أخرى
6. تحضير العينات لاستخدامها في RT-QuIC
- قم بإعداد تحكم سلبي مناسب في اللوحة (على سبيل المثال ، متجانس الدماغ غير المصاب ، والعقدة الليمفاوية غير المصابة ، وما إلى ذلك) عن طريق التخفيف إلى التركيز المناسب في محلول تخفيف الأنسجة (N2-0.1٪ SDS / PBS). قم بإعداد عناصر تحكم إيجابية في اللوحة عن طريق تخفيف تجانس الدماغ المصاب إلى تخفيف 10-3 في محلول تخفيف الأنسجة.
- قم بإزالة كريات مستخلص المسحة المخزنة مسبقا من -80 درجة مئوية وأعد تعليقها ب 20-50 ميكرولتر من محلول تخفيف الأنسجة (اعتمادا على كمية التلوث المشتبه بها) عن طريق سحب العينات لأعلى ولأسفل عشر مرات تقريبا ، متبوعا بالدوامة لفترة وجيزة. اسمح للعينات بالجلوس في RT أثناء تنفيذ الخطوات المتبقية.
- قم بتحميل 2 ميكرولتر من أدوات التحكم في اللوحة المحددة ، بما في ذلك أدوات التحكم في اللوحة السلبية (محلول تخفيف الأنسجة وحده وتجانس الدماغ غير المصاب) والتحكم الإيجابي في اللوحة (تجانس الدماغ المصاب) في آبار لوحة RT-QuIC.
- قم بتحميل 2 ميكرولتر من كل مستخلص مسحة في أربعة آبار مكررة.
7. تحليل RT-QuIC ونتائجه
- إجراء RT-QuIC وفقا لبروتوكولات المختبر الفردية (البروتوكولات الاختيارية38 ، 40).
- حدد المعلمات المطلوبة لتحديد إيجابية العينة (انظر النتائج التمثيلية ، الشكل 5).
ملاحظة: يتم تحديد هذه المعلمات بواسطة كل مختبر. - تسجيل النتائج في الجدول المقدم واتخاذ الإجراءات المناسبة بناء على أفضل الممارسات المختبرية (الجدول 1 والشكل التكميلي 2).
النتائج
وصف مكتوب للنتائج الإيجابية والسلبية (بما في ذلك أدوات التحكم في اللوحة والمسحات الإيجابية/السلبية)
يتم تضمين مسحات التحكم السلبية في مسحة المراقبة لمراقبة تلوث البريون المحتمل الذي يمكن إدخاله أثناء عملية المسح والاستخراج والتركيز. يجب أن تتضمن أول لوحة RT-QuIC التي يتم إجراؤها لترصد شهري معين ضوابط المسحة الإيجابية والسلبية. تفشل الضوابط السلبية الناجحة في عبور عتبة التألق الإيجابي (الشكل 6 أ). تشير هذه النتيجة إلى أن التلوث لم يدخل أثناء الإجراءات التجريبية. ستظهر مستخلصات مسحة التحكم الإيجابية الناجحة بذرا إيجابيا في جميع الآبار المكررة لعينة معينة (كانت مسحات التحكم الإيجابية ملوثة بسلالة اعتلال دماغي المنك القابلة للانتقال المتكيفة مع الهامستر Hyper (HY TME) متجانسة. يسمح تضمين سلسلة تخفيف التحكم الإيجابي بتحديد حساسية اكتشاف البريون لتجربة معينة (الشكل 6 أ).
عند فحص عينات مستخلص المسحة السطحية ، يمكن اعتبار الأسطح التي تفشل في إظهار البذر فوق عتبة التألق الإيجابية المحددة مسبقا سالبة بريون (الشكل 6 ب). على العكس من ذلك ، ستظهر مستخلصات المسحة السطحية الملوثة بالبريون قدرات بذر أعلى من عتبة التألق الإيجابية ، على الرغم من أن نسبة النقطة القصوى (MPR) ووقت التألق يمكن أن تختلف مقارنة بالتحكم في اللوحة الإيجابية المضمنة (الشكل 6 ب). يتم تسليط الضوء على قدرة الطريقة على تقييم التطهير الكافي من خلال الأسطح الملوثة بالبريون المعالجة بالتبييض ، والتي تفشل الآن في بذر RT-QuIC (الشكل 6 ب).
الأهم من ذلك ، في حين أن مختبرنا يعرف العينة الموجبة على أنها عينة تتجاوز عتبة التألق الإيجابية المحددة في نصف الآبار المتكررة على الأقل ، فمن الضروري لكل مختبر أن يضع معاييره الخاصة. يمكن أيضا استخدام معدل تكوين الأميلويد (RAF) ووقت التألق للمساعدة في تحديد عتبات خاصة بالمختبر للإيجابية.
لقد لاحظنا نتائج القطع الأثرية السطحية التي تتجاوز عتبة التألق الإيجابي ولكن مع منحنيات حركية متغيرة وبعد فترة طويلة بشكل غير طبيعي إلى التألق مقارنة بعينات التحكم الإيجابية (الشكل 6 ج). يجب تفسير هذه النتائج بحذر لأنها قد تكون ناتجة عن وجود غبار أو مواد كيميائية متبقية موجودة على السطح. تسلط هذه النتائج الضوء على ضرورة النظافة العامة للمختبرات ، وكذلك معايير التمييز بين البذر الإيجابي الحقيقي والإيجابي الكاذب.
يجب أن يتم التخلص من النفايات البيولوجية الصلبة والسائلة وفقا للمبادئ التوجيهية الحالية للتخلص من المخاطر البيولوجية لمؤسسة معينة. تشمل تقنيات تطهير البريون الشائعة العلاج بهيدروكسيد الصوديوم أو هيبوكلوريت الصوديوم (التبييض) أو التعقيم عند 134 درجة مئوية لمدة 18 دقيقة43،44،45،46.
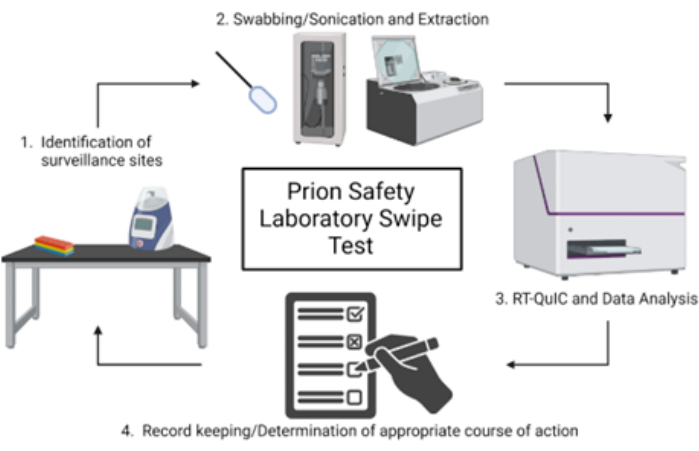
الشكل 1: نظرة عامة تخطيطية على اختبار التمرير المختبري لسلامة البريون. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
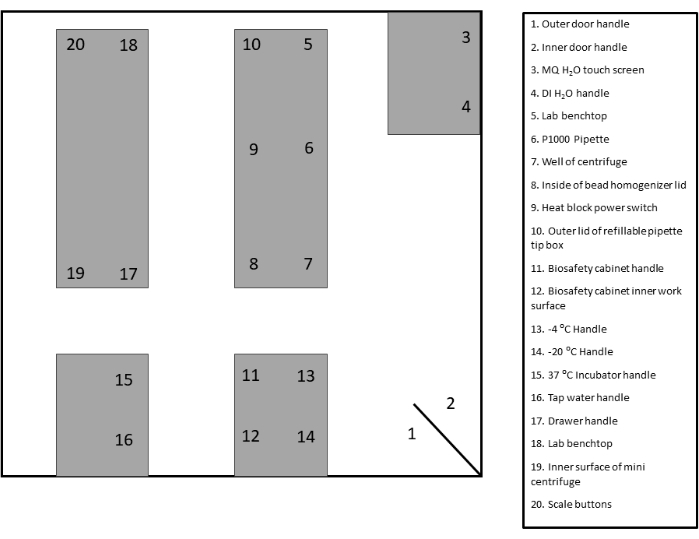
الشكل 2: نموذج تخطيط موقع المسح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
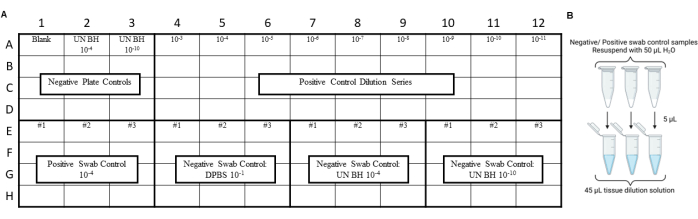
الشكل 3: تضمن تصميم تجربة العينة لأدوات التحكم في المسحة اختبار التمرير المختبري لسلامة البريون. (أ) تخطيط العينة لعناصر التحكم في مستخلص المسحة السلبية والإيجابية. (ب) ينبغي إعادة تعليق أدوات التحكم في مستخلص المسحات السلبية والإيجابية ب 50 ميكرولتر من H2O. يجب إنشاء تخفيف 10 أضعاف لمستخلص المسحة المعلقة عن طريق تخفيفه في محلول تخفيف الأنسجة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
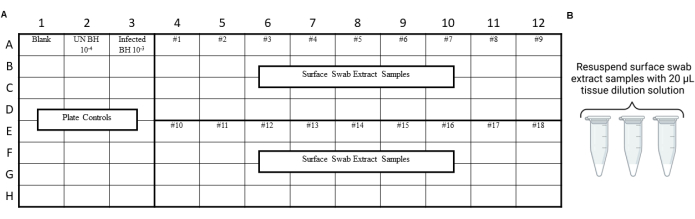
الشكل 4: تصميم تجربة عينة لمستخلصات مسحة السطح من اختبار التمرير المختبري لسلامة البريون. (أ) تخطيط العينة لمستخلصات المسحة السطحية. (ب) يجب إعادة تعليق عينات مستخلص المسحة السطحية ب 20 ميكرولتر من محلول تخفيف الأنسجة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
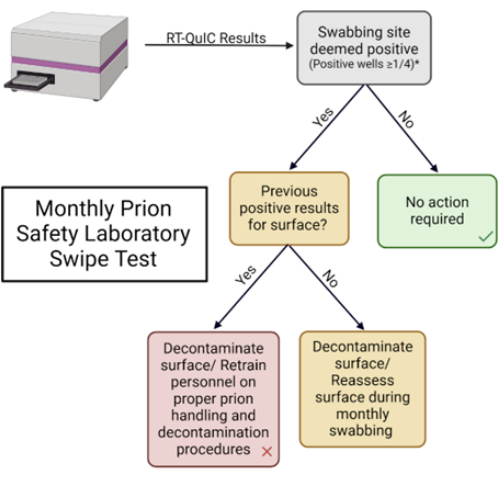
الشكل 5: اختبار التمرير الشهري لمختبر سلامة البريون. يستخدم المخطط الانسيابي لتفسير النتائج وتحديد الاستجابة المناسبة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
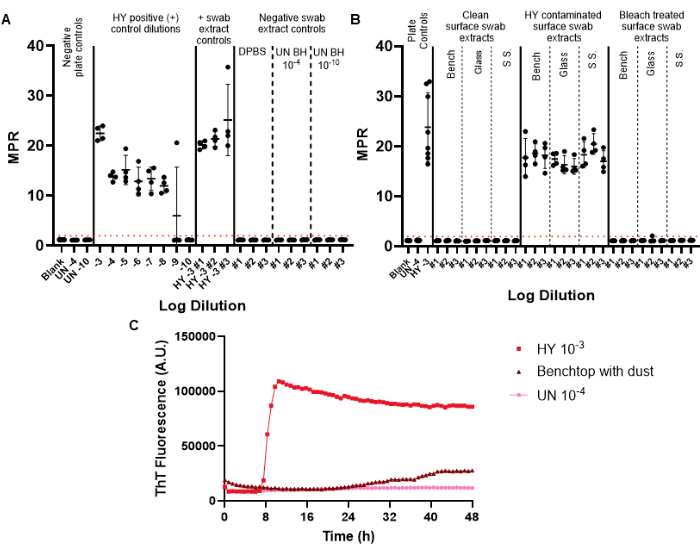
الشكل 6: تجربة مسح السطح التمثيلي. (أ) لوحة التحكم في المسحة السطحية التي تحتوي على عناصر تحكم سلبية في مستخلص المسحة في ثلاث نسخ (DPBS ، متجانس دماغ الهامستر غير المصاب 10-4 و 10-10) وعناصر التحكم في مستخلص المسحة الإيجابية في ثلاث نسخ (HY brain homogenate 10-3). (ب) مستخلصات المسحة التمثيلية للأسطح التي تم مسحها قبل التلوث ، بعد التلوث ب HY 10-3 ، وبعد معالجة الأسطح الملوثة بالتبييض. (ج) مقارنة تتبع التألق بين تجانس الدماغ غير المصاب 10-4 ، وتجانس الدماغ HY 10-3 ، ومستخلص المسحة من سطح الطاولة المغطى بغشاء ناعم من الغبار. تتضمن أدوات التحكم في اللوحة السلبية للوحتين A و B فارغة (محلول تخفيف الأنسجة) وتجانس دماغ الهامستر غير المصاب 10-4. تتضمن اللوحة B إضافة تجانس الدماغ غير المصاب 10-4 والتحكم الإيجابي في اللوحة لتجانس الدماغ HY 10-3. تم تحديد عتبة التألق الإيجابية (موضحة بخط أحمر متقطع) لتكون عند 2. نسبة النقطة القصوى (MPR) التي تم الإبلاغ عنها هي الحد الأقصى للتألق مقسوما على قراءة التألق الأولية التي حصل عليها قارئ اللوحة. تمثل كل نقطة مكررا تقنيا واحدا لنوع عينة معين. يتم تقديم المتوسط والانحراف المعياري. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: نموذج التوثيق الشهري لموقع المسحة. الرجاء النقر هنا لتنزيل هذا الجدول.
الشكل التكميلي 1: قالب تخطيط موقع المسح. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: نموذج التوثيق الشهري لموقع المسح. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يمكن استخدام طريقة مسح سلامة البريون الموصوفة لتعزيز تدابير سلامة البريون الحالية. يمكن لهذه الطريقة مراقبة مساحات ومعدات مختبرات البريون ، بالإضافة إلى مساحات المختبرات المشتركة ، بحثا عن تلوث البريون المحتمل. الأهم من ذلك ، يمكن تكييف هذه الطريقة لاختبار تقنيات التطهير الخاصة بالمختبر للتحقق من إزالة تلوث الأسطح الملوثة بالبريون. نظرا لأن سلالات البريون المختلفة تظهر حساسيات مختلفة لتقنيات التطهير ، يمكن أن تؤكد هذه الطريقة أن هذه التقنيات فعالة في التجارب المعملية الحالية ، مثل العلاج بهيدروكسيد الصوديوم أو هيبوكلوريت الصوديوم (المبيض) 43،44.
تشمل الخطوات الرئيسية لهذه المنهجية تحديد مواقع المسح المناسبة التي ستوفر عينة من كل من المناطق ذات الازدحام الشديد وكذلك المناطق المراد رصدها والتي قد تكون متورطة في التلوث المتبادل للتجارب. بالإضافة إلى ذلك ، يجب أن تستخدم المختبرات ضوابط إيجابية وسلبية تعكس عن كثب تلك المستخدمة بشكل شائع في مختبر أو عيادة معينة. على سبيل المثال ، إذا كنت تعمل مع بريونات القوارض ، يجب أن تتطابق الضوابط الإيجابية والسلبية مع هذا النوع. وأخيرا، ينبغي تحديث بيانات الترصد وتنظيمها بحيث يمكن بسهولة تحديد الاتجاهات في الإيجابية، مما يسمح بالتخفيف من حدة العاملين في المختبرات وإعادة تدريبهم في حالة تحقيق نتائج إيجابية متسقة في مجال معين.
أحد قيود هذا البروتوكول هو التوليد المحتمل لنتائج RT-QuIC الخاطئة. نظرا للطبيعة الحساسة ل RT-QuIC ، فإن وجود المنظفات المتبقية والملح والمواد الأخرى على أسطح المختبر يمكن أن يؤثر على نتيجةالتفاعل 39. بشكل عام ، بالنظر إلى هذه الملاحظة ، من المفيد أن تظل الأسطح خالية من المواد التي يمكن أن تتداخل مع RT-QuIC ، مثل الملح المتبقي والمنظفات والغبار. ومع توفر التحسينات التي تم إدخالها على منهجية RT-QuIC، نتوقع حل العديد من القيود الحالية لنظام تحديد جودة الراديو. لذلك ، نحن نشجع المستخدم النهائي على مواكبة الأدبيات للاستفادة من أحدث التحسينات في RT-QuIC.
تتمثل إحدى الفوائد الرئيسية لهذه الطريقة للمختبرات التي تبحث عن البريونات في القدرة على تقليل التلوث الذي قد يؤثر على نتائج فحوصات التضخيم الحساسة. عادة ما يتم تطهير أدوات التشريح قبل إعادة استخدامها في عمليات التشريح المستقبلية. توفر طريقة المسح الموصوفة طريقة لتقييم أدوات التشريح لعدوى البريون المتبقية التي قد تؤثر على النتائج النهائية. يمكن أن يوفر هذا مستوى إضافيا من الصرامة للتجارب لاستبعاد احتمال أن اكتشاف البريون في الأنسجة لم يكن بسبب التلوث من أدوات التشريح.
Disclosures
JCB و Q.Y. مخترعان في طلب براءة اختراع يتعلق بتقنية مسح سطح البريون.
Acknowledgements
تم دعم العمل بمنحة من مؤسسة كروتزفيلد جاكوب لأمراض الجاكوب. لم يكن للممولين أي دور في تصميم الدراسة وجمع البيانات وتفسيرها ، أو قرار تقديم العمل للنشر.
Materials
| Name | Company | Catalog Number | Comments |
| Fisherbrand PurSwab Foam Swabs | Fisher brand | Catalog #14-960-3E | |
| Milli-Q IQ 7005 Ultrapure Water System | MilliporeSigma | Q7005T0C | |
| Mini-centrifuge, 6000 rpm | Southern Labware | MLX-306 | |
| Omega plate reader | BMG Labtech | FLUOstar Omega plate reader | |
| Q700 sonicator | QSonica | Q700-110 | |
| Recombinant hamster prion protein | MNPRO | MNPROtein-Hamster | syrian hamster, amino acids 90-231 |
| Savant speedvac | Thermo Scientific | SPD1030-230 | |
| Silica nanospheres (50 nm) | nano Composix | SISN50-25M |
References
- Prusiner, S. B. Novel proteinaceous infectious particles cause scrapie. Science. 216 (4542), 136-144 (1982).
- Bolton, D. C., McKinley, M. P., Prusiner, S. B. Identification of a protein that purifies with the scrapie prion. Science. 218 (4579), 1309-1311 (1982).
- Oesch, B., et al. A cellular gene encodes scrapie PrP 27-30 protein. Cell. 40 (4), 735-746 (1985).
- Caughey, B., Raymond, G. The scrapie-associated form of PrP is made from a cell surface precursor that is both protease- and phospholipase-sensitive. J Biol Chem. 266 (27), 18217-18223 (1991).
- Deleault, N. R., Harris, B. T., Rees, J. R., Supattapone, S. Formation of native prions from minimal components in vitro. Proc Natl Acad Sci U S A. 104 (23), 9741-9746 (2007).
- Gajdusek, D. C., Zigas, V. Degenerative disease of the central nervous system in New Guinea: the endemic occurrence of "kuru" in the native population. N Engl J Med. 257, 974-978 (1957).
- Centers for Disease Control. Fatal degenerative neurologic disease in patients who received pituitary-derived human growth hormone. MMWR Morb Mortal Wkly Rep. 34, 359-361 (1985).
- Duffy, P., Wolf, J., Collins, G., DeVoe, A. G., Streeten, B., Cowen, D. Letter: possible person-to-person transmission of Creutzfeldt-Jakob disease. N Engl J Med. 290 (12), 692-693 (1974).
- Brown, P., et al. Iatrogenic Creutzfeldt-Jakob disease at the millennium. Neurology. 55 (8), 1075-1081 (2000).
- Huillard d'Aignaux, J., et al. Incubation period of Creutzfeldt-Jakob disease in human growth hormone recipients in France. Neurology. 53 (6), 1197-1201 (1999).
- Marzewski, D. J., Towfighi, J., Harrington, M. G., Merril, C. R., Brown, P. Creutzfeldt-Jakob disease following pituitary-derived human growth hormone therapy: a new American case. Neurology. 38, 1131-1133 (1988).
- Hannah, E. L., et al. Creutzfeldt-Jakob disease after receipt of a previously unimplicated brand of dura mater graft. Neurology. 56 (8), 1080-1083 (2001).
- Shimizu, S., et al. Creutzfeldt-Jakob disease with florid-type plaques after cadaveric dura mater grafting. Arch Neurol. 56 (3), 357-362 (1999).
- Antoine, J. C., et al. Creutzfeldt-Jakob disease after extracranial dura mater embolization for a nasopharyngeal angiofibroma. Neurology. 48 (5), 1451-1453 (1997).
- Esmonde, T., Lueck, C. J., Symon, L., Duchen, L. W., Will, R. G. Creutzfeldt-Jakob disease and lyophilised dura mater grafts: report of two cases. J Neurol Neurosurg Psychiatry. 56, 999-1000 (1993).
- Willison, H. J., Gale, A. N., McLaughlin, J. E. Creutzfeldt-Jakob disease following cadaveric dura mater graft. J Neurol Neurosurg Psychiatry. 54, 940 (1991).
- Diringer, H., Braig, H. R. Infectivity of unconventional viruses in dura mater. Lancet. 334, 439-440 (1989).
- Peden, A. H., Head, M. W., Ritchie, D. L., Bell, J. E., Ironside, J. W. Preclinical vCJD after blood transfusion in a PRNP codon 129 heterozygous patient. Lancet. 364 (9433), 527-529 (2004).
- Will, R. G., Matthews, W. B. Evidence for case-to-case transmission of Creutzfeldt-Jakob disease. J Neurol Neurosurg Psychiatry. 45, 235-238 (1982).
- el Hachimi, K. H., Chaunu, M. P., Cervenakova, L., Brown, P., Foncin, J. F. Putative neurosurgical transmission of Creutzfeldt-Jakob disease with analysis of donor and recipient: agent strains. C R Acad Sci III. 320 (4), 319-328 (1997).
- Alper, T., et al. Does the agent of scrapie replicate without nucleic acid. Nature. 214, 764-766 (1967).
- Casassus, B. France halts prion research amid safety concerns. Science. 373 (6554), 475-476 (2021).
- Brandel, J. P., et al. Variant Creutzfeldt-Jakob disease diagnosed 7.5 years after occupational exposure. N Engl J Med. 383 (1), 83-85 (2020).
- Flechsig, E., Hegyi, I., Enari, M., Schwarz, P., Collinge, J., Weissmann, C. Transmission of scrapie by steel-surface-bound prions. Mol Med. 7 (10), 679-684 (2001).
- Zobeley, E., Flechsig, E., Cozzio, A., Enari, M., Weissmann, C. Infectivity of scrapie prions bound to a stainless steel surface. Mol Med. 5 (4), 240-243 (1999).
- Brown, P., Gajdusek, D. C. Survival of scrapie virus after 3 years' interment. Lancet. 337 (8736), 269-270 (1991).
- Seidel, B., et al. Scrapie agent (strain 263K) can transmit disease via the oral route after persistence in soil over years. PLoS One. 2 (5), e435 (2007).
- Maddison, B. C., et al. Environmental sources of scrapie prions. J Virol. 84 (21), 11560-11562 (2010).
- Pritzkow, S., Morales, R., Lyon, A., Concha-Marambio, L., Urayama, A., Soto, C. Efficient prion disease transmission through common environmental materials. J Biol Chem. 293 (9), 3363-3373 (2018).
- Alper, T., Cramp, W., Haig, D., Clarke, M. Does the agent of scrapie replicate without nucleic acid. Nature. 214 (90), 764-766 (1967).
- Bernoulli, C., et al. Danger of accidental person-to-person transmission of Creutzfeldt-Jakob disease by surgery. Lancet. 309 (8009), 478-479 (1977).
- Brown, P., Rohwer, R. G., Green, E. M., Gajdusek, D. C. Effect of chemicals, heat, and histopathologic processing on high- infectivity hamster-adapted scrapie virus. J Infect Dis. 145 (5), 683-687 (1982).
- Brown, P., et al. Chemical disinfection of Creutzfeldt-Jakob disease virus. N Engl J Med. 306, 1279-1282 (1982).
- Dickinson, A. G., Taylor, D. M. Resistance of scrapie agent to decontamination. N Engl J Med. 299, 1413-1414 (1978).
- Hunter, G. D., Millson, G. C. Studies on the heat stability and chromatographic behavior of the scrapie agent. J Gen Microbiol. 37, 251-258 (1964).
- Pattison, I. H. Resistance of the scrapie agent to formalin. J Comp Pathol. 75, 159-164 (1965).
- Fraser, H., Farquhar, C., McConnell, I., Davies, D. The scrapie disease process is unaffected by ionising radiation. Prog Clin Biol Res. 317, 653-658 (1989).
- Yuan, Q., et al. Sensitive detection of chronic wasting disease prions recovered from environmentally relevant surfaces. Environ Int. 166, 107347 (2022).
- Simmons, S. M., et al. Rapid and sensitive determination of residual prion infectivity from prion-decontaminated surfaces. mSphere. 9, e00504-e00524 (2024).
- Orru, C. D., et al. Sensitive detection of pathological seeds of alpha-synuclein, tau and prion protein on solid surfaces. PLoS Pathog. 20 (4), e1012175 (2024).
- Wilham, J. M., et al. Rapid end-point quantitation of prion seeding activity with sensitivity comparable to bioassays. PLoS Pathog. 6 (12), e1001217 (2010).
- Srivastava, A., et al. Enhanced quantitation of pathological alpha-synuclein in patient biospecimens by RT-QuIC seed amplification assays. PLoS Pathog. 20 (9), e1012554 (2024).
- Hughson, A. G., et al. Inactivation of prions and amyloid seeds with hypochlorous acid. PLoS Pathog. 12 (9), e1005914 (2016).
- Williams, K., Hughson, A. G., Chesebro, B., Race, B. Inactivation of chronic wasting disease prions using sodium hypochlorite. PLoS One. 14 (10), e0223659 (2019).
- Taylor, D. M. Autoclaving standards for Creutzfeldt-Jakob disease agent [letter]. Ann Neurol. 22 (4), 557-558 (1987).
- Brown, P., Rohwer, R. G., Gajdusek, D. C. Newer data on the inactivation of scrapie virus or Creutzfeldt-Jakob disease virus in brain tissue. J Infect Dis. 153 (6), 1145-1148 (1986).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved