Method Article
Prueba de deslizamiento de laboratorio de seguridad priónica
En este artículo
Resumen
Falta un método para evaluar las áreas de uso común en entornos de laboratorio para detectar la contaminación priónica y una descontaminación efectiva. El protocolo descrito aquí proporciona los fundamentos clave para implementar una prueba de deslizamiento de seguridad priónica de laboratorio que se puede modificar fácilmente para satisfacer las necesidades individuales de laboratorios específicos.
Resumen
La transmisión de la enfermedad priónica iatrogénica ha ocurrido a partir de herramientas neuroquirúrgicas contaminadas, materiales de trasplante y exposición ocupacional a herramientas de laboratorio contaminadas con priones. Los priones causan enfermedad por el mal plegamiento de la forma celular normal de la proteína priónica, PrPC, en la forma mal plegada y patógena PrPSc y son invariablemente fatales. Reducir la transmisión iatrogénica y ocupacional de priones es un desafío. En primer lugar, los priones pueden unirse a las superficies y persistir en ellas durante largos períodos de tiempo. En segundo lugar, los priones son muy resistentes a la inactivación. Teniendo en cuenta esto, las superficies pueden retener la infectividad durante largos períodos de tiempo después de una descontaminación ineficaz. Esto no solo puede suponer un riesgo laboral potencial para los trabajadores del laboratorio de priones, sino que también podría contaminar los experimentos de laboratorio que utilizan técnicas sensibles de amplificación de priones. El protocolo descrito aquí para una prueba de deslizamiento de laboratorio de seguridad priónica incluye pasos para la identificación y documentación de áreas de laboratorio de alto tráfico, controles de hisopado recomendados para garantizar la validez de los resultados, pasos para identificar las respuestas adecuadas a los sitios de hisopado de superficie positivos, resultados representativos de la prueba de deslizamiento de priones, así como posibles resultados artefactuales. En general, la prueba de deslizamiento del laboratorio de seguridad de priones se puede implementar como parte de un programa de seguridad de priones más amplio para evaluar la descontaminación de superficies, monitorear espacios comunes para detectar contaminación por priones e implementar la documentación del estado de descontaminación de priones.
Introducción
Las enfermedades priónicas son enfermedades neurodegenerativas invariablemente mortales sin tratamiento ni cura conocida. Las enfermedades priónicas son causadas por PrPSc, la forma mal plegada y patógena de la forma celular normal de la proteína priónica 1,2,3,4,5, PrP C. Se sabe que las enfermedades priónicas afectan a los seres humanos y a otras especies animales. Una enfermedad priónica humana, la enfermedad de Creutzfeldt-Jakob, ECJ, tiene tres etiologías conocidas: esporádica, hereditaria y adquirida. La enfermedad de Creutzfeldt-Jakob adquirida puede ocurrir como resultado de una transmisión accidental (iatrogénica y ocupacional) y se cree que es la causa del Kuru en el pueblo Fore de Papúa Nueva Guinea6.
La transmisión de priones se ha asociado con dispositivos médicos contaminados con priones y materiales de trasplante 7,8,9,10,11,12,13,14,15,16,17. La transmisión iatrogénica de la enfermedad de Creutzfeldt-Jakob puede ocurrir a través de la sangre, los tejidos o desde superficies contaminadas con priones 18,19,20. Por ejemplo, la enfermedad de Creutzfeldt-Jakob iatrogénica puede desarrollarse en pacientes después de un electroencefalograma con electrodos utilizados previamente en un individuo en la etapa preclínica de la enfermedad de Creutzfeldt-Jakob que luego sucumbió a la enfermedad de Creutzfeldt-Jakob21. También se ha producido una transmisión ocupacional más reciente en el laboratorio, en la que un trabajador de laboratorio contrajo la enfermedad priónica a través de una punción cutánea con fórceps utilizados para manipular trozos de cerebro de un animal infectado con EEB22,23 adaptado a las ovejas. Estos escenarios de transmisión podrían ocurrir en entornos clínicos, de laboratorio y de laboratorio de diagnóstico donde se manipulan muestras de priones.
Los priones resisten las técnicas comunes de desinfección y pueden persistir y permanecer infecciosos en las superficies durante largos períodos de tiempo 24,25,26,27,28,29. Las técnicas comunes de desinfección, como el uso de etanol, limpiadores fenólicos, peróxido de hidrógeno, diversas formas de radiación y formaldehído, son inadecuadas para la inactivación de priones, lo que permite que las superficies retengan la infectividad 30,31,32,33,34,35,36,37. Estas características contribuyen a la transmisión de priones durante la exposición iatrogénica y ocupacional.
Los métodos para la detección de priones ambientales se han desarrollado recientemente. Un método de hisopado ambiental junto con la conversión inducida por temblores en tiempo real (RT-QuIC) puede evaluar la infectividad residual de los priones de las superficies ambientales, así como de las superficies comunes de laboratorio después de una desinfección ineficaz 38,39,40,41,42. Aquí, describimos cómo esta técnica puede incorporarse a un programa más amplio de seguridad priónica. En general, este método puede permitir el seguimiento de los protocolos de desinfección dependientes del laboratorio, la investigación y la documentación adecuada del estado de contaminación, lo que puede ayudar a garantizar la validez de los experimentos al minimizar la contaminación cruzada, la evaluación de los espacios de uso compartido para la contaminación por priones y permite el reentrenamiento direccional del personal en función de las áreas comúnmente contaminadas.
Protocolo
Todos los procedimientos que involucran animales fueron aprobados y cumplieron con la Guía para el Cuidado y Uso de Animales de Laboratorio por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Creighton.
NOTA: En la Figura 1 se muestra una descripción general esquemática de la prueba de deslizamiento del laboratorio de seguridad priónica.
1. Selección de los sitios de hisopado y preparación para el hisopado de superficie
- Identifique y etiquete las áreas de vigilancia apropiadas para la toma de muestras. Consulte la plantilla proporcionada para obtener documentación y referencia (Figura 2 y Figura complementaria 1).
- Prepare dos tubos de microcentrífuga de 1,5 mL para cada una de las áreas identificadas. Añada 250 μL de solución salina tamponada con fosfato de Dulbecco al primer juego de tubos de microcentrífuga para su uso en el paso 3.2. Deje que el segundo juego de tubos de microcentrífuga permanezca vacío para su uso en el paso 4.3.
- Recupere los hisopos con punta de espuma del almacenamiento en un área libre de contaminación priónica.
- Prepare una botella exprimible con agua Milli-Q (MQ H2O) para usar en el paso 2.1.
2. Preparación de hisopos de control positivos y negativos
- Prepare diluciones para controles de hisopos positivos y negativos utilizando los tipos de control relevantes. Ejemplo: Para un control positivo, prepare una dilución al 1% de homogeneizado cerebral infectado con priones en solución salina tamponada con fosfato (DPBS) de Dulbecco. Para el control negativo, prepare una dilución al 0,1% de homogeneizado cerebral (BH) no infectado (UN) de la misma especie que el control positivo en DPBS.
- Con guantes limpios, saque el número adecuado de hisopos del empaque limpio y coloque el mango hacia abajo en un soporte para tubos, teniendo cuidado de espaciar los hisopos de espuma para que las puntas no entren en contacto con otros hisopos o superficies. Para cada muestra de control, prepare tres hisopos. Cámbiese los guantes entre cada muestra.
- Sosteniendo un hisopo de espuma limpio por el mango, aplique 50 μL de las respectivas muestras de control positivas y negativas a las puntas de los hisopos de espuma. Asegúrese de aplicar en ambos lados de la punta del hisopo para garantizar una absorción completa.
NOTA: Siempre cambie los guantes antes de sacar un hisopo limpio de la rejilla para tubos. - Con unas tijeras, corte el exceso de mango del hisopo (aproximadamente 1/2 de la longitud) y coloque el hisopo en el tubo de microcentrífuga precargado con la parte de la punta de espuma apuntando hacia abajo. Asegúrese de que la punta de espuma esté sumergida en el DPBS y de que el mango esté cortado adecuadamente para cerrar completamente la tapa del tubo de microcentrífuga.
- Continúe aplicando muestras de control después de cambiar los guantes hasta que se hayan aplicado todas las muestras.
3. Hisopado de superficie
- Sosteniendo un hisopo limpio de punta de espuma por el mango, humedezca previamente la punta de espuma con MQ H2O y sacuda el exceso. Coloque la punta de espuma humedecida del hisopo en el área elegida para la vigilancia y frote el área hacia adelante y hacia atrás aproximadamente diez veces mientras gira simultáneamente la punta del hisopo sobre la superficie.
- Con unas tijeras, corte el exceso de mango del hisopo (aproximadamente 1/2 de la longitud) y coloque el hisopo en el tubo de microcentrífuga precargado con la parte de la punta de espuma apuntando hacia abajo. Asegúrese de que la punta de espuma esté sumergida en el DPBS y de que el mango esté cortado adecuadamente para cerrar completamente la tapa del tubo de microcentrífuga.
- Deseche los guantes y colóquelos nuevos antes de cada sitio de hisopado respectivo para minimizar la probabilidad de contaminación cruzada.
- Repita el procedimiento hasta que se hayan tomado muestras de todas las áreas elegidas para la vigilancia.
4. Extracción de hisopos y concentración al vacío
NOTA: Encienda el concentrador de vacío 30 minutos antes de usarlo para permitir que el instrumento se caliente.
- Coloque los tubos de microcentrífuga en una rejilla de tubos circular. Coloque la rejilla de tubos de microfuga en el baño de agua del sonicador de bocina de taza. Asegúrese de que los hisopos de espuma en DPBS dentro de los tubos de microcentrífuga estén debajo de la superficie del agua en el cuerno de la copa (la parte del mango no tiene que estar sumergida). Aplique los siguientes ajustes: 15 s de tiempo total de funcionamiento (5 s encendido, 5 s apagado) a ~75-85 vatios.
- Tras la sonicación, centrifugar los tubos durante aproximadamente 15 s para recoger DPBS en el fondo del tubo antes de la transferencia.
- Con una pipeta P1000 configurada a 250 μL, recoja cuidadosamente todo el líquido (extracto de hisopo) del fondo del tubo de microcentrífuga y transfiéralo al tubo de microcentrífuga correspondiente desde el segundo juego vacío preetiquetado. Utilice la punta de la pipeta para exprimir el exceso de líquido de la punta de espuma. Deseche los tubos vacíos que contengan hisopos.
- Ajuste los siguientes ajustes en el concentrador de vacío: Temperatura: 45 °C, Tiempo de calentamiento: 15 min, Tiempo de funcionamiento: 2 h, Vacío: 5,1.
- Coloque los tubos de microcentrífuga que contienen extractos de hisopos en el concentrador de vacío, asegurándose de que los tubos estén equilibrados y que todas las tapas de los tubos estén abiertas.
- Al finalizar el ciclo, asegúrese de que las muestras estén completamente concentradas (solo queda el pellet). Almacene los gránulos a -80 °C hasta que se utilicen para RT-QuIC.
NOTA: En algunos casos, puede ser necesario un tiempo adicional de concentración de vacío para garantizar una concentración completa. Retire todas las muestras concentradas, dejando solo los tubos que aún contienen líquido. Vuelva a equilibrar los tubos restantes dentro del concentrador y hágalo funcionar en incrementos adicionales de 1 hora hasta que las muestras estén completamente concentradas.
5. Preparación de los controles de hisopado para su uso en RT-QuIC
NOTA: Los controles RT-QuIC deben realizarse antes del ensayo de los extractos de hisopos ambientales para garantizar que no se haya introducido contaminación durante los procedimientos de hisopado, extracción o concentración. Para ver ejemplos de diseños, consulte la Figura 3 y la Figura 4.
- Prepare un control de placa RT-QuIC negativo adecuado (p. ej., homogeneizado cerebral no infectado [UN BH]) diluyendo a la concentración adecuada en una solución de dilución tisular (N2-0,1%SDS/PBS). Prepare una dilución de control en placa positiva diluyendo el homogeneizado cerebral infectado con priones a una dilución de 10-3 en una solución de dilución tisular.
- Retire los gránulos de extracto de hisopo de control almacenados previamente a -80 °C y vuelva a suspender cada uno con 50 μL de MQ H2O pipeteando hacia arriba y hacia abajo aproximadamente 10 veces, seguido de un breve vórtice. Deje que las muestras se asienten a temperatura ambiente (RT) mientras realiza los pasos restantes.
- Cargue 2 μL de los controles de placa especificados, incluidos los controles de placa negativa (solución de dilución tisular sola y homogeneizado de cerebro no infectado) y un control de placa positivo (homogeneizado de cerebro infectado).
- Cargue 2 μL de cada extracto de hisopo positivo y negativo replicado técnicamente en un mínimo de cuatro pocillos de placa RT-QuIC replicados.
NOTA: Si los controles de hisopado negativos muestran una siembra de RT-QuIC por encima del estándar de un laboratorio para una determinación positiva, esto indicaría que se ha introducido contaminación durante el proceso de hisopado, extracción y concentración y que el experimento de hisopado debe realizarse nuevamente
6. Preparación de muestras para su uso en RT-QuIC
- Prepare un control de placa negativo apropiado (p. ej., homogeneizado cerebral no infectado, ganglio linfático no infectado, etc.) diluyendo hasta la concentración adecuada en la solución de dilución tisular (N2-0.1%SDS/PBS). Prepare controles de placa positivos diluyendo el homogeneizado cerebral infectado a una dilución de 10-3 en una solución de dilución tisular.
- Retire los gránulos de extracto de hisopo previamente almacenados a -80 °C y vuelva a suspender con 20-50 μL de solución de dilución de tejido (dependiendo de la cantidad sospechada de contaminación) pipeteando hacia arriba y hacia abajo aproximadamente diez veces, seguido de un breve vórtice. Permita que las muestras se asienten en RT mientras realiza los pasos restantes.
- Cargue 2 μL de los controles de placa especificados, incluidos los controles de placa negativos (solución de dilución tisular sola y homogeneizado de cerebro no infectado) y un control de placa positivo (homogeneizado de cerebro infectado) en los pocillos de placa RT-QuIC.
- Cargue 2 μL de cada extracto de hisopo en cuatro pocillos replicados.
7. Análisis y resultados de RT-QuIC
- Realizar RT-QuIC de acuerdo con los protocolos individuales del laboratorio (protocolos opcionales38,40).
- Definir los parámetros necesarios para determinar la positividad de una muestra (ver resultados representativos, Figura 5).
NOTA: Estos parámetros son definidos por cada laboratorio. - Registre los resultados en la tabla proporcionada y tome las medidas adecuadas basadas en las mejores prácticas del laboratorio (Tabla 1 y Figura complementaria 2).
Resultados
Descripción escrita de los resultados positivos y negativos (incluyendo controles positivos/negativos en placa e hisopo)
Los hisopos de control negativo se incluyen en el hisopado de vigilancia para monitorear la posible contaminación priónica que podría introducirse durante el proceso de hisopado, extracción y concentración. La primera placa RT-QuIC realizada para una vigilancia mensual determinada debe incluir los controles de hisopado positivos y negativos. Los controles negativos exitosos no logran cruzar el umbral de fluorescencia positiva (Figura 6A). Este resultado indicaría que no se ha introducido contaminación durante los procedimientos experimentales. Los extractos de hisopos de control positivo exitosos exhibirían una siembra positiva en todos los pocillos replicados para una muestra dada (los hisopos de control positivo estaban contaminados con el homogeneizado cerebral de la cepa de encefalopatía de visón transmisible Hyper (HY TME) adaptado a hámster. La inclusión de una serie de dilución de control positivo permite determinar la sensibilidad de la detección de priones para un experimento determinado (Figura 6A).
Al examinar muestras de extracto de hisopo de superficie, las superficies que no muestran siembra por encima del umbral de fluorescencia positivo predeterminado pueden considerarse priónicas negativas (Figura 6B). Por el contrario, los extractos de hisopos de superficie contaminados con priones mostrarán capacidades de siembra por encima del umbral de fluorescencia positiva, aunque la relación de punto máximo (MPR) y el tiempo hasta la fluorescencia pueden variar en comparación con el control de placa positiva incluido (Figura 6B). La capacidad del método para evaluar una desinfección adecuada se pone de manifiesto por las superficies contaminadas con priones tratadas con lejía, que ahora no siembran RT-QuIC (Figura 6B).
Es importante destacar que, si bien nuestro laboratorio define una muestra positiva como una muestra que supera el umbral de fluorescencia positiva establecido en al menos la mitad de los pocillos replicados, es necesario que cada laboratorio establezca sus propios estándares. La tasa de formación de amiloide (RAF) y el tiempo hasta la fluorescencia también se pueden utilizar para ayudar a establecer umbrales específicos de laboratorio para la positividad.
Hemos observado resultados de artefactos de superficie que superan el umbral de fluorescencia positivo pero con curvas cinéticas alteradas y después de un tiempo anormalmente largo hasta la fluorescencia en comparación con las muestras de control positivas (Figura 6C). Estos resultados deben interpretarse con cautela, ya que pueden ser causados por la presencia de polvo o productos químicos residuales presentes en una superficie. Estos hallazgos ponen de manifiesto la necesidad de una limpieza general del laboratorio, así como los criterios para diferenciar entre la siembra de verdaderos positivos y falsos positivos.
La eliminación de los desechos sólidos y líquidos de riesgo biológico debe realizarse siguiendo las pautas actuales de eliminación de riesgo biológico de una institución determinada. Las técnicas comunes de desinfección de priones incluyen el tratamiento con hidróxido de sodio, hipoclorito de sodio (lejía) o autoclave a 134 °C durante 18 min 43,44,45,46.
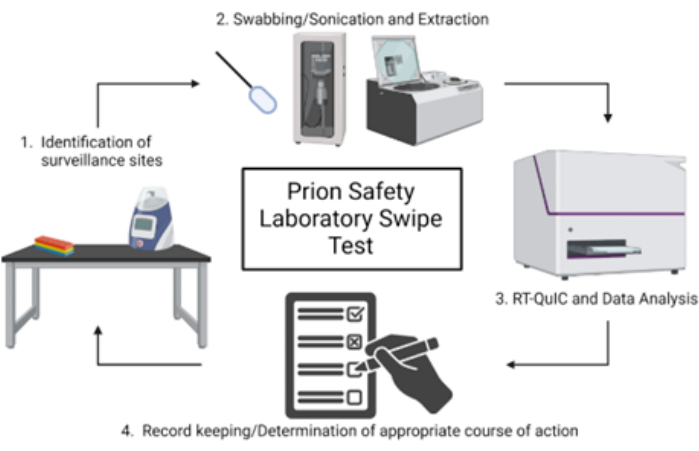
Figura 1: Vista general esquemática de la prueba de deslizamiento del laboratorio de seguridad priónica. Haga clic aquí para ver una versión más grande de esta figura.
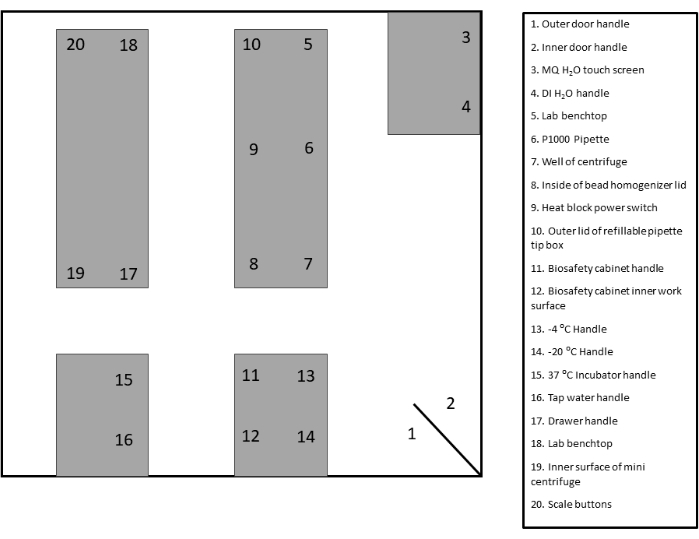
Figura 2: Ejemplo de diseño del sitio de hisopado. Haga clic aquí para ver una versión más grande de esta figura.
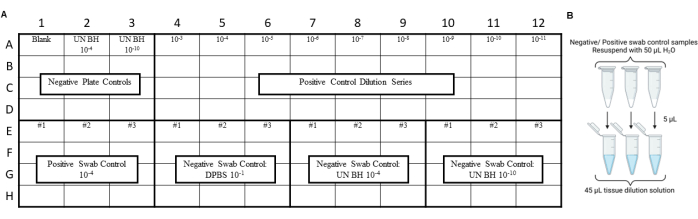
Figura 3: Diseño de experimento de muestra para controles de hisopo incluido en la prueba de deslizamiento de laboratorio de seguridad priónica. (A) Diseño de la muestra para controles de extracto de hisopo negativos y positivos. (B) Los controles de extracto de hisopo negativos y positivos deben resuspenderse con 50 μL deH2O. Se debe generar una dilución de 10 veces del extracto de hisopo resuspendido diluyéndolo en una solución de dilución tisular. Haga clic aquí para ver una versión más grande de esta figura.
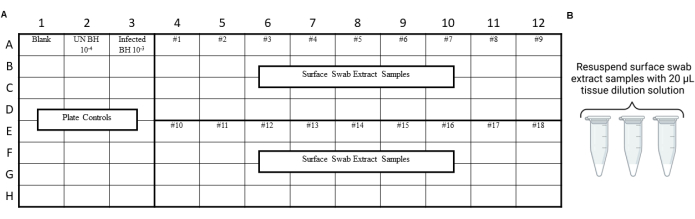
Figura 4: Diseño de experimento de muestra para extractos de hisopos de superficie de la prueba de deslizamiento del laboratorio de seguridad priónica. (A) Diseño de muestra para extractos de hisopos de superficie. (B) Las muestras de extracto de hisopo de superficie deben resuspenderse con 20 μL de solución de dilución de tejido. Haga clic aquí para ver una versión más grande de esta figura.
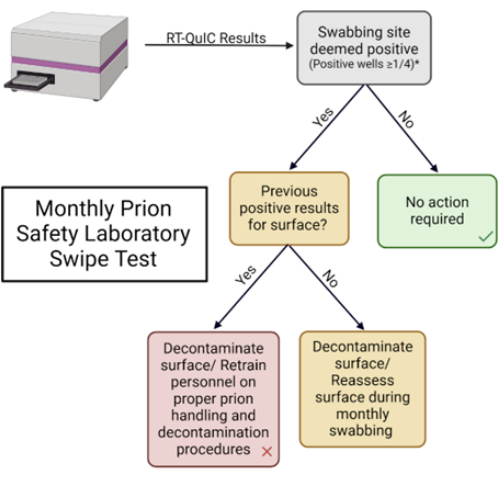
Figura 5: Prueba mensual de laboratorio de seguridad priónica. Diagrama de flujo utilizado para interpretar los resultados y determinar la respuesta adecuada. Haga clic aquí para ver una versión más grande de esta figura.
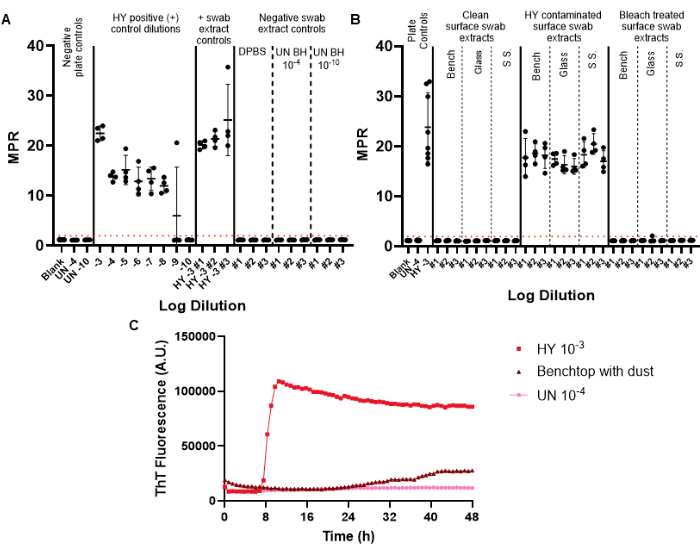
Figura 6: Experimento representativo de hisopado de superficie. (A) Placa de control de hisopo de superficie que contiene controles de extracto de hisopo negativos por triplicado (DPBS, homogeneizado de cerebro de hámster no infectado 10-4 y 10-10) y controles de extracto de hisopo positivos por triplicado (homogeneizado de cerebro HY 10-3). (B) Extractos de hisopos representativos para superficies de sobremesa, vidrio y acero inoxidable (SS) que se tomaron muestras antes de la contaminación, después de la contaminación con HY 10-3 y después del tratamiento con lejía de las superficies contaminadas. (C) Comparación de rastreo de fluorescencia del homogeneizado cerebral no infectado 10-4, el homogeneizado cerebral HY 10-3 y el extracto de hisopo de la mesa de trabajo recubierto con una fina película de polvo. Los controles de placa negativa para los paneles A y B incluyen un blanco (solución de dilución de tejido) y un homogeneizado de cerebro de hámster no infectado 10-4. El panel B incluye la adición de homogeneizado cerebral no infectado 10-4 y el control de placa positiva del homogeneizado cerebral HY 10-3. Se determinó que un umbral de fluorescencia positivo (ilustrado por una línea discontinua roja) estaba en 2. La relación de punto máximo (MPR) informada es la fluorescencia máxima dividida por la lectura de fluorescencia inicial obtenida por el lector de placas. Cada punto representa un pozo técnico replicado para un tipo de muestra determinado. Se presentan la media y la desviación estándar. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Ejemplo de formulario de documentación mensual del sitio de hisopado. Haga clic aquí para descargar esta tabla.
Figura complementaria 1: Plantilla de diseño del sitio de hisopado. Haga clic aquí para descargar este archivo.
Figura complementaria 2: Formulario de documentación mensual del sitio de hisopado. Haga clic aquí para descargar este archivo.
Discusión
El método de hisopado de seguridad de priones descrito se puede utilizar para mejorar las medidas de seguridad de priones existentes. Este método puede monitorear los espacios y equipos de laboratorio de priones, así como los espacios de laboratorio compartidos, para detectar una posible contaminación por priones. Es importante destacar que este método se puede adaptar para probar técnicas de desinfección específicas de laboratorio para verificar la descontaminación de superficies contaminadas con priones. Dado que varias cepas de priones muestran diferentes sensibilidades a las técnicas de desinfección, este método puede confirmar que estas técnicas son efectivas para los experimentos de laboratorio actuales, como el tratamiento con hidróxido de sodio o hipoclorito de sodio (lejía)43,44.
Los pasos clave para esta metodología incluyen la identificación de sitios apropiados para tomar muestras de las áreas de alto tráfico, así como de las áreas a monitorear que pueden estar involucradas con la contaminación cruzada de los experimentos aguas abajo. Además, los laboratorios deben utilizar controles positivos y negativos que se asemejen mucho a los que se utilizan habitualmente en un laboratorio o clínica determinados. Por ejemplo, si se trabaja con priones de roedores, los controles positivos y negativos deben coincidir con esa especie. Por último, los datos de vigilancia deben mantenerse actualizados y organizados de manera que se puedan identificar fácilmente las tendencias de positividad, lo que permite la mitigación y el reciclaje del personal de laboratorio en caso de resultados positivos constantes en una zona determinada.
Una limitación de este protocolo es la posible generación de resultados erróneos de RT-QuIC. Dada la naturaleza sensible del RT-QuIC, la presencia de detergentes residuales, sal y otras sustancias en las superficies de laboratorio puede afectar el resultado de la reacción39. En general, dada esta observación, es ventajoso que las superficies permanezcan libres de sustancias que puedan interferir con RT-QuIC, como sal residual, detergentes y polvo. A medida que se disponga de mejoras en la metodología RT-QuIC, anticipamos que se resolverán muchas de las limitaciones actuales de RT-QuIC. Por lo tanto, alentamos al usuario final a mantenerse al tanto de la literatura para aprovechar las últimas mejoras en RT-QuIC.
Un beneficio clave de este método para los laboratorios que investigan priones es la capacidad de minimizar la contaminación que puede afectar los resultados de los ensayos de amplificación sensibles. Las herramientas de necropsia se desinfectan comúnmente antes de ser reutilizadas para futuras necropsias. El método de hisopado descrito proporciona un método para evaluar las herramientas de necropsia en busca de infectividad priónica residual que puede afectar los resultados posteriores. Esto puede proporcionar un nivel adicional de rigor a los experimentos para excluir la posibilidad de que la detección de priones en los tejidos no se debiera a la contaminación de las herramientas de necropsia.
Divulgaciones
J.C.B. y Q.Y. son inventores de una solicitud de patente relacionada con la tecnología de hisopado de superficies priónicas.
Agradecimientos
El trabajo fue apoyado por una subvención de la Fundación de la Enfermedad de Creutzfeldt Jacob. Los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación de datos y la interpretación, ni en la decisión de presentar el trabajo para su publicación.
Materiales
| Name | Company | Catalog Number | Comments |
| Fisherbrand PurSwab Foam Swabs | Fisher brand | Catalog #14-960-3E | |
| Milli-Q IQ 7005 Ultrapure Water System | MilliporeSigma | Q7005T0C | |
| Mini-centrifuge, 6000 rpm | Southern Labware | MLX-306 | |
| Omega plate reader | BMG Labtech | FLUOstar Omega plate reader | |
| Q700 sonicator | QSonica | Q700-110 | |
| Recombinant hamster prion protein | MNPRO | MNPROtein-Hamster | syrian hamster, amino acids 90-231 |
| Savant speedvac | Thermo Scientific | SPD1030-230 | |
| Silica nanospheres (50 nm) | nano Composix | SISN50-25M |
Referencias
- Prusiner, S. B. Novel proteinaceous infectious particles cause scrapie. Science. 216 (4542), 136-144 (1982).
- Bolton, D. C., McKinley, M. P., Prusiner, S. B. Identification of a protein that purifies with the scrapie prion. Science. 218 (4579), 1309-1311 (1982).
- Oesch, B., et al. A cellular gene encodes scrapie PrP 27-30 protein. Cell. 40 (4), 735-746 (1985).
- Caughey, B., Raymond, G. The scrapie-associated form of PrP is made from a cell surface precursor that is both protease- and phospholipase-sensitive. J Biol Chem. 266 (27), 18217-18223 (1991).
- Deleault, N. R., Harris, B. T., Rees, J. R., Supattapone, S. Formation of native prions from minimal components in vitro. Proc Natl Acad Sci U S A. 104 (23), 9741-9746 (2007).
- Gajdusek, D. C., Zigas, V. Degenerative disease of the central nervous system in New Guinea: the endemic occurrence of "kuru" in the native population. N Engl J Med. 257, 974-978 (1957).
- Centers for Disease Control. Fatal degenerative neurologic disease in patients who received pituitary-derived human growth hormone. MMWR Morb Mortal Wkly Rep. 34, 359-361 (1985).
- Duffy, P., Wolf, J., Collins, G., DeVoe, A. G., Streeten, B., Cowen, D. Letter: possible person-to-person transmission of Creutzfeldt-Jakob disease. N Engl J Med. 290 (12), 692-693 (1974).
- Brown, P., et al. Iatrogenic Creutzfeldt-Jakob disease at the millennium. Neurology. 55 (8), 1075-1081 (2000).
- Huillard d'Aignaux, J., et al. Incubation period of Creutzfeldt-Jakob disease in human growth hormone recipients in France. Neurology. 53 (6), 1197-1201 (1999).
- Marzewski, D. J., Towfighi, J., Harrington, M. G., Merril, C. R., Brown, P. Creutzfeldt-Jakob disease following pituitary-derived human growth hormone therapy: a new American case. Neurology. 38, 1131-1133 (1988).
- Hannah, E. L., et al. Creutzfeldt-Jakob disease after receipt of a previously unimplicated brand of dura mater graft. Neurology. 56 (8), 1080-1083 (2001).
- Shimizu, S., et al. Creutzfeldt-Jakob disease with florid-type plaques after cadaveric dura mater grafting. Arch Neurol. 56 (3), 357-362 (1999).
- Antoine, J. C., et al. Creutzfeldt-Jakob disease after extracranial dura mater embolization for a nasopharyngeal angiofibroma. Neurology. 48 (5), 1451-1453 (1997).
- Esmonde, T., Lueck, C. J., Symon, L., Duchen, L. W., Will, R. G. Creutzfeldt-Jakob disease and lyophilised dura mater grafts: report of two cases. J Neurol Neurosurg Psychiatry. 56, 999-1000 (1993).
- Willison, H. J., Gale, A. N., McLaughlin, J. E. Creutzfeldt-Jakob disease following cadaveric dura mater graft. J Neurol Neurosurg Psychiatry. 54, 940 (1991).
- Diringer, H., Braig, H. R. Infectivity of unconventional viruses in dura mater. Lancet. 334, 439-440 (1989).
- Peden, A. H., Head, M. W., Ritchie, D. L., Bell, J. E., Ironside, J. W. Preclinical vCJD after blood transfusion in a PRNP codon 129 heterozygous patient. Lancet. 364 (9433), 527-529 (2004).
- Will, R. G., Matthews, W. B. Evidence for case-to-case transmission of Creutzfeldt-Jakob disease. J Neurol Neurosurg Psychiatry. 45, 235-238 (1982).
- el Hachimi, K. H., Chaunu, M. P., Cervenakova, L., Brown, P., Foncin, J. F. Putative neurosurgical transmission of Creutzfeldt-Jakob disease with analysis of donor and recipient: agent strains. C R Acad Sci III. 320 (4), 319-328 (1997).
- Alper, T., et al. Does the agent of scrapie replicate without nucleic acid. Nature. 214, 764-766 (1967).
- Casassus, B. France halts prion research amid safety concerns. Science. 373 (6554), 475-476 (2021).
- Brandel, J. P., et al. Variant Creutzfeldt-Jakob disease diagnosed 7.5 years after occupational exposure. N Engl J Med. 383 (1), 83-85 (2020).
- Flechsig, E., Hegyi, I., Enari, M., Schwarz, P., Collinge, J., Weissmann, C. Transmission of scrapie by steel-surface-bound prions. Mol Med. 7 (10), 679-684 (2001).
- Zobeley, E., Flechsig, E., Cozzio, A., Enari, M., Weissmann, C. Infectivity of scrapie prions bound to a stainless steel surface. Mol Med. 5 (4), 240-243 (1999).
- Brown, P., Gajdusek, D. C. Survival of scrapie virus after 3 years' interment. Lancet. 337 (8736), 269-270 (1991).
- Seidel, B., et al. Scrapie agent (strain 263K) can transmit disease via the oral route after persistence in soil over years. PLoS One. 2 (5), e435 (2007).
- Maddison, B. C., et al. Environmental sources of scrapie prions. J Virol. 84 (21), 11560-11562 (2010).
- Pritzkow, S., Morales, R., Lyon, A., Concha-Marambio, L., Urayama, A., Soto, C. Efficient prion disease transmission through common environmental materials. J Biol Chem. 293 (9), 3363-3373 (2018).
- Alper, T., Cramp, W., Haig, D., Clarke, M. Does the agent of scrapie replicate without nucleic acid. Nature. 214 (90), 764-766 (1967).
- Bernoulli, C., et al. Danger of accidental person-to-person transmission of Creutzfeldt-Jakob disease by surgery. Lancet. 309 (8009), 478-479 (1977).
- Brown, P., Rohwer, R. G., Green, E. M., Gajdusek, D. C. Effect of chemicals, heat, and histopathologic processing on high- infectivity hamster-adapted scrapie virus. J Infect Dis. 145 (5), 683-687 (1982).
- Brown, P., et al. Chemical disinfection of Creutzfeldt-Jakob disease virus. N Engl J Med. 306, 1279-1282 (1982).
- Dickinson, A. G., Taylor, D. M. Resistance of scrapie agent to decontamination. N Engl J Med. 299, 1413-1414 (1978).
- Hunter, G. D., Millson, G. C. Studies on the heat stability and chromatographic behavior of the scrapie agent. J Gen Microbiol. 37, 251-258 (1964).
- Pattison, I. H. Resistance of the scrapie agent to formalin. J Comp Pathol. 75, 159-164 (1965).
- Fraser, H., Farquhar, C., McConnell, I., Davies, D. The scrapie disease process is unaffected by ionising radiation. Prog Clin Biol Res. 317, 653-658 (1989).
- Yuan, Q., et al. Sensitive detection of chronic wasting disease prions recovered from environmentally relevant surfaces. Environ Int. 166, 107347 (2022).
- Simmons, S. M., et al. Rapid and sensitive determination of residual prion infectivity from prion-decontaminated surfaces. mSphere. 9, e00504-e00524 (2024).
- Orru, C. D., et al. Sensitive detection of pathological seeds of alpha-synuclein, tau and prion protein on solid surfaces. PLoS Pathog. 20 (4), e1012175 (2024).
- Wilham, J. M., et al. Rapid end-point quantitation of prion seeding activity with sensitivity comparable to bioassays. PLoS Pathog. 6 (12), e1001217 (2010).
- Srivastava, A., et al. Enhanced quantitation of pathological alpha-synuclein in patient biospecimens by RT-QuIC seed amplification assays. PLoS Pathog. 20 (9), e1012554 (2024).
- Hughson, A. G., et al. Inactivation of prions and amyloid seeds with hypochlorous acid. PLoS Pathog. 12 (9), e1005914 (2016).
- Williams, K., Hughson, A. G., Chesebro, B., Race, B. Inactivation of chronic wasting disease prions using sodium hypochlorite. PLoS One. 14 (10), e0223659 (2019).
- Taylor, D. M. Autoclaving standards for Creutzfeldt-Jakob disease agent [letter]. Ann Neurol. 22 (4), 557-558 (1987).
- Brown, P., Rohwer, R. G., Gajdusek, D. C. Newer data on the inactivation of scrapie virus or Creutzfeldt-Jakob disease virus in brain tissue. J Infect Dis. 153 (6), 1145-1148 (1986).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados