Method Article
Test par balayage du laboratoire de sécurité des prions
Dans cet article
Résumé
Il n’existe pas de méthode permettant d’évaluer la contamination par les prions et la décontamination efficace dans les zones couramment utilisées en laboratoire. Le protocole décrit ici fournit les principes fondamentaux clés de la mise en œuvre d’un test de sécurité par balayage de prions en laboratoire, qui peut facilement être modifié pour répondre aux besoins individuels de laboratoires spécifiques.
Résumé
La transmission de la maladie à prions iatrogène s’est produite à partir d’outils neurochirurgicaux contaminés, de matériaux de transplantation et d’une exposition professionnelle à des outils de laboratoire contaminés par des prions. Les prions provoquent la maladie par le mauvais repliement de la forme cellulaire normale de la protéine prion, PrPC, dans la forme mal repliée et pathogènePrP Sc et sont invariablement mortels. La réduction de la transmission iatrogène et professionnelle des prions est un défi. Tout d’abord, les prions peuvent se lier et persister sur des surfaces pendant de longues périodes. Deuxièmement, les prions sont très résistants à l’inactivation. Dans ce contexte, les surfaces peuvent conserver leur infectiosité pendant de longues périodes après une décontamination inefficace. Non seulement cela peut poser un risque professionnel potentiel pour les travailleurs de laboratoire de prions, mais cela pourrait également contaminer les expériences de laboratoire utilisant des techniques sensibles d’amplification des prions. Le protocole décrit ici pour un test d’effraction en laboratoire de sécurité des prions comprend des étapes pour l’identification et la documentation des zones de laboratoire à fort trafic, des contrôles d’écouvillonnage recommandés pour assurer la validité des résultats, des étapes pour identifier les réponses appropriées aux sites d’écouvillonnage de surface positifs, des résultats représentatifs des tests d’effacement de prions, ainsi que des résultats artificiels potentiels. Dans l’ensemble, le test de dépistage par balayage en laboratoire de la sécurité des prions peut être mis en œuvre dans le cadre d’un programme plus large de sécurité des prions afin d’évaluer la décontamination des surfaces, de surveiller les espaces communs pour détecter la contamination par les prions et de mettre en œuvre la documentation de l’état de décontamination des prions.
Introduction
Les maladies à prions sont invariablement des maladies neurodégénératives mortelles sans traitement ni remède connu. Les maladies à prions sont causées par la PrPSc, la forme mal repliée et pathogène de la forme cellulaire normale de la protéine prion 1,2,3,4,5, PrP C. Les maladies à prions sont connues pour affecter les humains et plusieurs autres espèces animales. Une maladie à prions humaines, la maladie de Creutzfeldt-Jakob, a trois étiologies connues : sporadique, héréditaire et acquise. La MCJ acquise peut survenir à la suite d’une transmission accidentelle (iatrogène et professionnelle) et on pense qu’elle est la cause du Kuru chez les Avant-peuples de Papouasie-Nouvelle-Guinée6.
La transmission de prions a été associée à des dispositifs médicaux contaminés par des prions et à des matériaux de transplantation 7,8,9,10,11,12,13,14,15,16,17. La transmission iatrogène de la MCJ peut se produire par le sang, les tissus ou à partir de surfaces contaminées par des prions 18,19,20. Par exemple, la MCJ iatrogène peut se développer chez des patients à la suite d’un électroencéphalogramme avec des électrodes précédemment utilisées sur une personne au stade préclinique de la MCJ qui a ensuite succombé à la MCJ21. Plus récemment, une transmission professionnelle en laboratoire s’est également produite lorsqu’un employé de laboratoire a contracté une maladie à prions par perforation cutanée à l’aide d’une pince utilisée pour manipuler des tranches de cerveau d’un animal infecté par l’ESB adaptée aux moutons22,23. De tels scénarios de transmission pourraient se produire dans des environnements cliniques, de laboratoire et de laboratoire de diagnostic où des échantillons de prions sont manipulés.
Les prions résistent aux techniques de désinfection courantes et peuvent persister et rester infectieux sur les surfaces pendant de longues périodes 24,25,26,27,28,29. Les techniques de désinfection courantes telles que l’utilisation d’éthanol, de nettoyants phénoliques, de peroxyde d’hydrogène, de diverses formes de rayonnement et de formaldéhyde sont inadéquates pour l’inactivation des prions, permettant aux surfaces de conserver leur infectiosité 30,31,32,33,34,35,36,37. Ces caractéristiques contribuent à la transmission de prions lors d’expositions iatrogènes et professionnelles.
Ce n’est que récemment que des méthodes de détection des prions environnementaux ont été mises au point. Une méthode d’écouvillonnage environnemental couplée à la conversion induite par le tremblement en temps réel (RT-QuIC) permet d’évaluer l’infectiosité résiduelle des prions des surfaces environnementales ainsi que des surfaces de laboratoire courantes après une désinfection inefficace 38,39,40,41,42. Nous décrivons ici comment cette technique peut être intégrée à un programme plus large de sécurité pour les prions. Dans l’ensemble, cette méthode peut permettre la surveillance des protocoles de désinfection en laboratoire, l’enquête et la documentation appropriée de l’état de contamination, ce qui peut aider à assurer la validité des expériences en minimisant la contamination croisée, l’évaluation des espaces à utilisation partagée pour la contamination par les prions et permet la formation directionnelle du personnel en fonction des zones fréquemment contaminées.
Protocole
Toutes les procédures impliquant des animaux ont été approuvées et conformes au Guide pour le soin et l’utilisation des animaux de laboratoire par le comité institutionnel de soin et d’utilisation des animaux de l’Université Creighton.
REMARQUE : La figure 1 présente un aperçu schématique du test de dépistage par balayage en laboratoire de la sécurité des prions.
1. Sélection des sites d’écouvillonnage et préparation pour l’écouvillonnage de surface
- Identifier et étiqueter les zones de surveillance appropriées pour l’écouvillonnage. Reportez-vous au modèle fourni pour la documentation et la référence (figure 2 et figure supplémentaire 1).
- Préparez deux tubes de microcentrifugation de 1,5 mL pour chacune des zones identifiées. Ajoutez 250 μL de solution saline tamponnée au phosphate de Dulbecco dans le premier ensemble de tubes de microcentrifugation à utiliser à l’étape 3.2. Laissez le deuxième ensemble de tubes de microcentrifugation vide pour l’utilisation à l’étape 4.3.
- Récupérez les écouvillons à bout de mousse de l’entreposage dans une zone exempte de contamination par des prions.
- Préparez un flacon compressible avec de l’eau Milli-Q (MQ H2O) à utiliser à l’étape 2.1.
2. Préparation de l’écouvillon de contrôle positif et négatif
- Préparez les dilutions pour les contrôles positifs et négatifs par écouvillonnage en utilisant les types de contrôle appropriés. Exemple : Pour un contrôle positif, préparer une dilution de 1 % d’homogénat cérébral infecté par des prions dans une solution saline tamponnée au phosphate de Dulbecco (DPBS). Pour le contrôle négatif, préparer une dilution de 0,1 % de l’homogénat de cerveau (BH) non infecté (UN) de la même espèce que le témoin positif dans le DPBS.
- À l’aide de gants propres, récupérez le nombre approprié d’écouvillons de l’emballage propre et placez la poignée, côté vers le bas, dans un support de tubes, en prenant soin d’espacer les écouvillons en mousse afin que les pointes n’entrent pas en contact avec d’autres écouvillons ou surfaces. Pour chaque échantillon de contrôle, préparez trois écouvillons. Changez de gants entre chaque échantillon.
- En tenant un écouvillon à mousse propre par la poignée, appliquez 50 μL d’échantillons de contrôle positifs et négatifs respectifs sur les pointes de l’écouvillon à mousse. Assurez-vous d’appliquer des deux côtés de l’embout de l’écouvillon pour assurer une absorption complète.
REMARQUE : Changez toujours de gants avant de retirer un écouvillon propre du support de tubes. - À l’aide de ciseaux, coupez l’excédent de poignée de l’écouvillon (environ 1/2 de la longueur) et placez l’écouvillon dans le tube de microcentrifugation préchargé avec la partie de l’embout de la mousse pointée vers le bas. Assurez-vous que l’embout en mousse est immergé dans le DPBS et que la poignée est correctement coupée pour fermer complètement le couvercle du tube de microcentrifugation.
- Continuer à appliquer les échantillons de contrôle après avoir changé de gants jusqu’à ce que tous les échantillons aient été appliqués.
3. Écouvillonnage de surface
- En tenant un écouvillon à mousse propre par la poignée, prémouillez l’embout en mousse avec MQ H2O et secouez l’excédent. Placez l’embout en mousse humidifiée de l’écouvillon sur la zone choisie pour la surveillance et écouvillonnez la zone d’avant en arrière environ dix fois tout en tournant simultanément l’extrémité de l’écouvillon sur la surface.
- À l’aide de ciseaux, coupez l’excédent de poignée de l’écouvillon (environ 1/2 de la longueur) et placez l’écouvillon dans le tube de microcentrifugation préchargé avec la partie de l’embout de la mousse pointée vers le bas. Assurez-vous que l’embout en mousse est immergé dans le DPBS et que la poignée est correctement coupée pour fermer complètement le couvercle du tube de microcentrifugation.
- Jetez les gants et placez-en de nouveaux avant chaque site d’écouvillonnage respectif afin de minimiser la probabilité de contamination croisée.
- Répétez la procédure jusqu’à ce que toutes les zones choisies pour la surveillance aient été prélevées.
4. Extraction par écouvillon et concentration sous vide
REMARQUE : Allumez le concentrateur sous vide 30 minutes avant l’utilisation pour permettre à l’instrument de se réchauffer.
- Placez les tubes de microcentrifugation dans un support de tube circulaire. Placez le support du tube de microfuge dans le bain-marie du sonicateur à corne de tasse. Assurez-vous que les écouvillons en mousse dans le DPBS à l’intérieur des tubes de microcentrifugation sont sous la surface de l’eau dans la corne de la tasse (la partie de la poignée n’a pas besoin d’être immergée). Appliquez les paramètres suivants : 15 s d’autonomie totale (5 s en marche, 5 s en arrêt) à ~75-85 watts.
- Après la sonication, centrifuger les tubes pendant environ 15 s pour recueillir les DPBS au fond du tube avant le transfert.
- À l’aide d’une pipette P1000 réglée à 250 μL, prélevez soigneusement tout le liquide (extrait d’écouvillon) au fond du tube de microcentrifugation et transférez-le dans le tube de microcentrifugation correspondant à partir du deuxième ensemble pré-étiqueté vide. Utilisez l’embout de la pipette pour presser l’excès de liquide de l’embout en mousse. Jetez les tubes vides contenant des écouvillons.
- Réglez les paramètres suivants sur le concentrateur de vide : Température : 45 °C, Temps de chauffage : 15 min, Temps de fonctionnement : 2 h, Vide : 5,1.
- Placez les tubes de microcentrifugation contenant des extraits d’écouvillon dans le concentrateur sous vide, en vous assurant que les tubes sont équilibrés et que tous les capuchons de tube sont ouverts.
- À la fin du cycle, assurez-vous que les échantillons sont complètement concentrés (il ne reste que la pastille). Conservez les granulés à -80 °C jusqu’à ce qu’ils soient utilisés pour RT-QuIC.
REMARQUE : Dans certains cas, un temps de concentration de vide supplémentaire peut être nécessaire pour assurer une concentration complète. Retirez tous les échantillons concentrés, en ne laissant que les tubes qui contiennent encore du liquide. Rééquilibrez les tubes restants à l’intérieur du concentrateur et faites fonctionner par incréments supplémentaires de 1 h jusqu’à ce que les échantillons soient complètement concentrés.
5. Préparation des commandes d’écouvillonnage pour une utilisation dans RT-QuIC
REMARQUE : Les contrôles RT-QuIC doivent être effectués avant l’analyse des extraits d’écouvillons environnementaux afin de s’assurer qu’aucune contamination n’a été introduite pendant les procédures d’écouvillonnage, d’extraction ou de concentration. Pour obtenir des exemples de dispositions, reportez-vous aux figures 3 et 4.
- Préparer un témoin sur plaque RT-QuIC négatif approprié (p. ex., homogénat de cerveau non infecté [UN BH]) en diluant à la concentration appropriée dans une solution de dilution tissulaire (N2-0,1 % SDS/PBS). Préparer une dilution positive sur plaque témoin en diluant l’homogénat cérébral infecté par les prions à une dilution de 10-3 dans une solution de dilution tissulaire.
- Retirer les pastilles d’extrait d’écouvillon témoin précédemment stockées à -80 °C et les remettre en suspension avec 50 μL de MQ H2O en pipetant de haut en bas environ 10 fois, puis en utilisant brièvement un vortex. Laissez les échantillons reposer à température ambiante (RT) pendant que vous effectuez les étapes restantes.
- Chargez 2 μL de témoins sur plaque spécifiés, y compris des témoins négatifs (solution de dilution tissulaire seule et homogénat de cerveau non infecté) et un témoin positif sur plaque (homogénat de cerveau infecté).
- Chargez 2 μL de chaque réplication technique d’extrait d’écouvillon positif et négatif dans un minimum de quatre puits de plaque RT-QuIC répliqués.
REMARQUE : Si les témoins d’écouvillonnage négatifs présentent un ensemencement RT-QuIC supérieur à la norme d’un laboratoire pour une détermination positive, cela indiquerait qu’une contamination a été introduite pendant le processus d’écouvillonnage, d’extraction et de concentration et que l’expérience d’écouvillonnage doit être effectuée de nouveau
6. Préparation des échantillons pour l’utilisation dans RT-QuIC
- Préparez un témoin de plaque négative approprié (p. ex., homogénat cérébral non infecté, ganglion lymphatique non infecté, etc.) en diluant à la concentration appropriée dans une solution de dilution tissulaire (N2-0,1 % SDS/PBS). Préparez des témoins positifs sur plaque en diluant l’homogénat cérébral infecté à une dilution de 10-3 dans une solution de dilution tissulaire.
- Retirez les pastilles d’extrait d’écouvillon précédemment stockées à -80 °C et mettez-les en suspension avec 20 à 50 μL de solution de dilution tissulaire (en fonction de la quantité suspectée de contamination) en pipetant de haut en bas une dizaine de fois, suivi d’un bref vortex. Laissez les échantillons reposer sur RT pendant que vous effectuez les étapes restantes.
- Chargez 2 μL de témoins de plaque spécifiés, y compris des témoins négatifs (solution de dilution tissulaire seule et homogénat de cerveau non infecté) et un témoin positif (homogénat de cerveau infecté) dans les puits de plaque RT-QuIC.
- Chargez 2 μL de chaque extrait d’écouvillon dans quatre puits répliqués.
7. Analyse et résultats de RT-QuIC
- Effectuer le RT-QuIC selon les protocoles de laboratoire individuels (protocoles facultatifs38, 40).
- Définir les paramètres nécessaires à la détermination de la positivité d’un échantillon (voir résultats représentatifs, Figure 5).
REMARQUE : Ces paramètres sont définis par chaque laboratoire. - Consigner les résultats dans le tableau fourni et prendre les mesures appropriées en fonction des pratiques exemplaires du laboratoire (tableau 1 et figure supplémentaire 2).
Résultats
Description écrite des résultats positifs et négatifs (y compris les contrôles positifs/négatifs sur plaque et par écouvillon)
Des écouvillons de contrôle négatif sont inclus dans l’écouvillonnage de surveillance afin de surveiller la contamination potentielle par des prions qui pourrait être introduite pendant le processus d’écouvillonnage, d’extraction et de concentration. La première plaque RT-QuIC réalisée pour une surveillance mensuelle donnée doit inclure les témoins positifs et négatifs par écouvillonnage. Les témoins négatifs qui réussissent ne franchissent pas le seuil de fluorescence positif (Figure 6A). Ce résultat indiquerait qu’aucune contamination n’a été introduite au cours des procédures expérimentales. Les extraits d’écouvillons de contrôle positif réussis présenteraient un ensemencement positif dans tous les puits de réplication pour un échantillon donné (les écouvillons de contrôle positif ont été contaminés par l’homogénat cérébral de la souche Hyper (HY TME) de l’encéphalopathie de vison transmissible adaptée au hamster. L’inclusion d’une série de dilutions de contrôle positif permet de déterminer la sensibilité de la détection des prions pour une expérience donnée (figure 6A).
Lors de l’examen d’échantillons d’extraits d’écouvillons de surface, les surfaces qui ne montrent pas d’ensemencement au-dessus du seuil de fluorescence positif prédéterminé peuvent être considérées comme étant négatives au prion (figure 6B). À l’inverse, les extraits par écouvillonnage de surface contaminés par des prions présenteront des capacités d’ensemencement supérieures au seuil de fluorescence positif, bien que le rapport de points maximaux (MPR) et le temps jusqu’à la fluorescence puissent varier par rapport au témoin positif sur plaque inclus (figure 6B). La capacité de la méthode à évaluer une désinfection adéquate est mise en évidence par les surfaces contaminées par des prions traitées à l’eau de Javel, qui ne parviennent plus à ensemencer le RT-QuIC (figure 6B).
Il est important de noter que, bien que notre laboratoire définisse un échantillon positif comme un échantillon qui dépasse le seuil de fluorescence positive défini dans au moins la moitié des puits répliqués, il est nécessaire que chaque laboratoire établisse ses propres normes. Le taux de formation d’amyloïde (RAF) et le temps jusqu’à la fluorescence peuvent également être utilisés pour aider à établir des seuils de positivité spécifiques au laboratoire.
Nous avons observé des résultats d’artefacts de surface qui dépassent le seuil de fluorescence positif mais avec des courbes cinétiques modifiées et après un temps anormalement long jusqu’à la fluorescence par rapport aux échantillons témoins positifs (Figure 6C). Ces résultats doivent être interprétés avec prudence car ils peuvent être causés par la présence de poussière ou de produits chimiques résiduels présents sur une surface. Ces résultats mettent en évidence la nécessité d’une propreté générale du laboratoire, ainsi que des critères permettant de différencier les vrais positifs et les faux positifs.
L’élimination des déchets biologiques solides et liquides doit être effectuée conformément aux lignes directrices actuelles d’un établissement donné en matière d’élimination des déchets biologiques. Les techniques courantes de désinfection par prions comprennent le traitement à l’hydroxyde de sodium, à l’hypochlorite de sodium (eau de Javel) ou l’autoclave à 134 °C pendant 18 min 43,44,45,46.
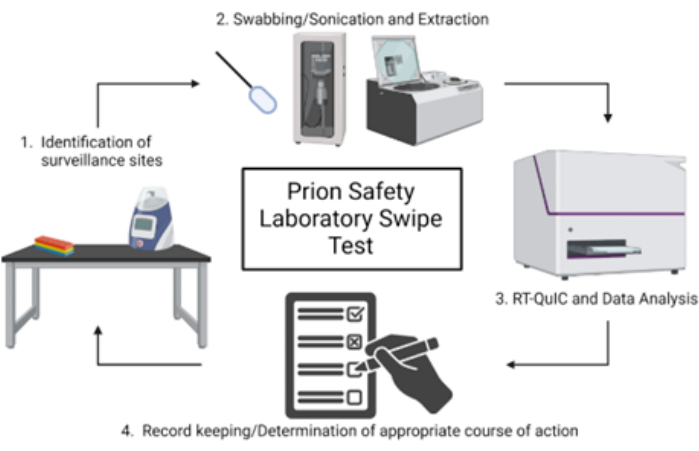
Figure 1 : Vue d’ensemble schématique du test par balayage en laboratoire de sécurité des prions. Veuillez cliquer ici pour voir une version agrandie de cette figure.
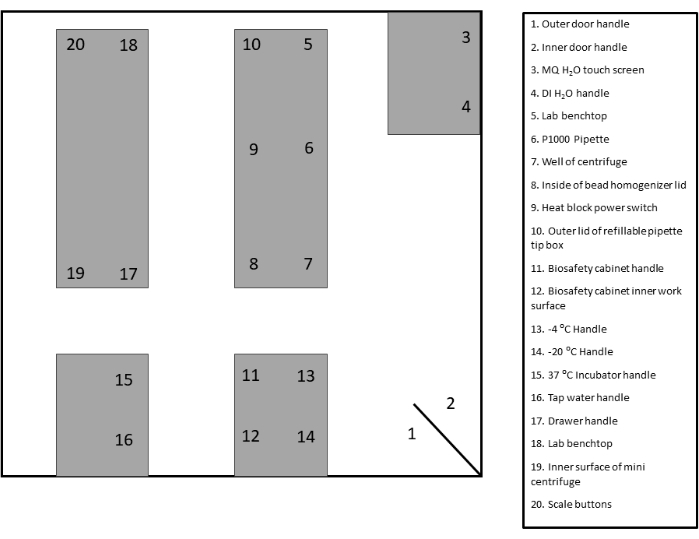
Figure 2 : Exemple de mise en page du site d’écouvillonnage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
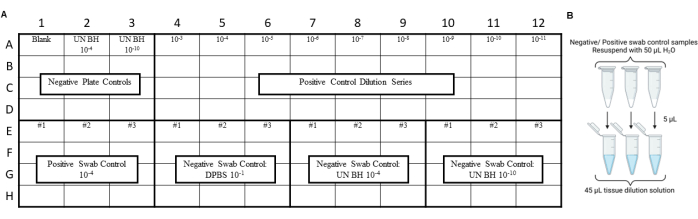
Figure 3 : Plan d’expérience de l’échantillon pour les témoins par écouvillon incluant le test de dépistage des prions en laboratoire. (A) Présentation de l’échantillon pour les témoins d’extraits par écouvillon négatifs et positifs. (B) Les témoins d’extrait par écouvillonnage négatif et positif doivent être remis en suspension avec 50 μL de H2O. Une dilution de 10 fois de l’extrait d’écouvillon remis en suspension doit être générée en le diluant dans une solution de dilution tissulaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
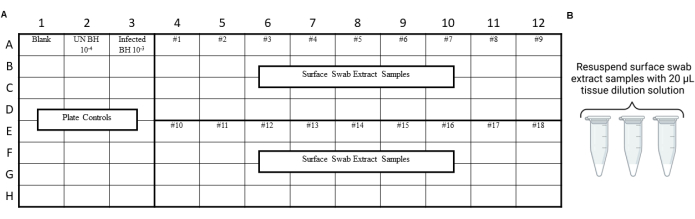
Figure 4 : Exemple de plan d’expérience pour les extraits d’écouvillons de surface issus d’un test de balayage de laboratoire de sécurité des prions. (A) Disposition de l’échantillon pour les extraits d’écouvillons de surface. (B) Les échantillons d’extrait d’écouvillon de surface doivent être remis en suspension avec 20 μL de solution de dilution tissulaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
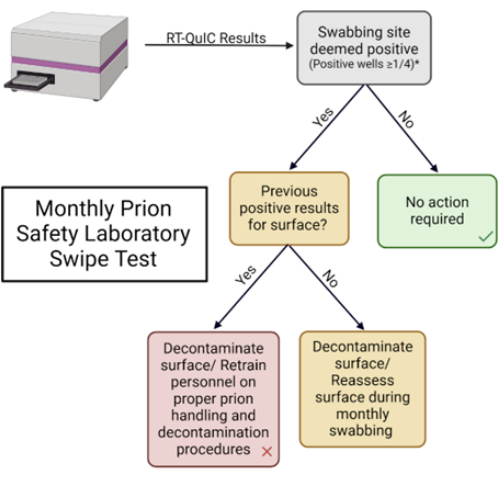
Figure 5 : Test mensuel de dépistage des prions en laboratoire. Organigramme utilisé pour interpréter les résultats et déterminer l’intervention appropriée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
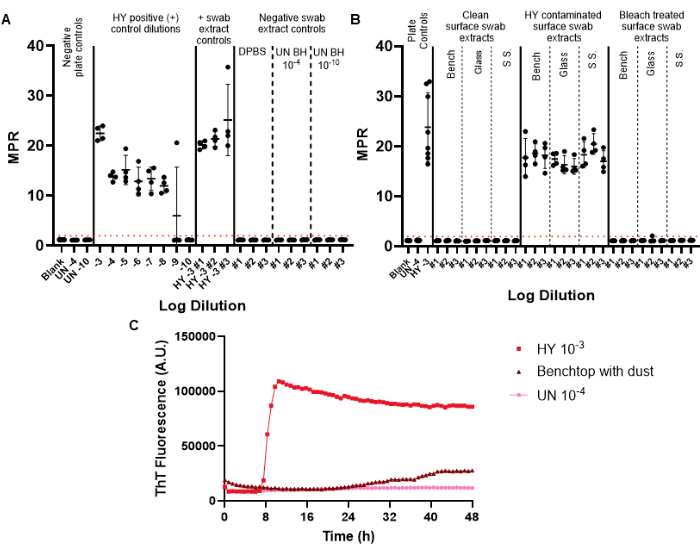
Figure 6 : Expérience représentative d’écouvillonnage de surface. (A) Plaque de contrôle d’écouvillon de surface contenant des témoins d’extrait d’écouvillon négatifs en trois exemplaires (DPBS, homogénat de cerveau de hamster non infecté 10-4 et 10-10) et témoins d’extrait d’écouvillon positifs en trois exemplaires (homogénat de cerveau HY 10-3). (B) Extraits représentatifs d’écouvillons pour les surfaces de paillasse, de verre et d’acier inoxydable (S.S.) qui ont été écouvillonnés avant la contamination, à la suite de la contamination par HY 10-3 et après le traitement à l’eau de Javel des surfaces contaminées. (C) Comparaison par traçage par fluorescence de l’homogénat de cerveau non infecté 10-4, de l’homogénat de cerveau HY 10-3 et de l’extrait d’écouvillon de la paillasse recouvert d’une fine pellicule de poussière. Les témoins négatifs des plaques pour les panneaux A et B comprennent un blanc (solution de dilution tissulaire) et un homogénat de cerveau de hamster non infecté 10-4. Le panel B comprend l’ajout d’homogénat cérébral non infecté 10-4 et le contrôle positif sur plaque d’homogénat cérébral HY 10-3. Un seuil de fluorescence positif (illustré par une ligne pointillée rouge) a été déterminé à 2. Le rapport maxpoint (MPR) rapporté est la fluorescence maximale divisée par la lecture initiale de fluorescence obtenue par le lecteur de plaques. Chaque point représente une répétition d’un puits technique pour un type d’échantillon donné. La moyenne et l’écart-type sont présentés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Formulaire de documentation mensuelle du site d’écouvillonnage. Veuillez cliquer ici pour télécharger ce tableau.
Figure supplémentaire 1 : Modèle de mise en page du site d’écouvillonnage. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Formulaire de documentation mensuelle du site d’écouvillonnage. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
La méthode d’écouvillonnage de sécurité pour les prions décrite peut être utilisée pour améliorer les mesures de sécurité existantes en matière de prions. Cette méthode permet de surveiller les espaces et l’équipement de laboratoire à prions, ainsi que les espaces de laboratoire partagés, pour détecter une contamination potentielle par les prions. Il est important de noter que cette méthode peut être adaptée pour tester des techniques de désinfection spécifiques au laboratoire afin de vérifier la décontamination des surfaces contaminées par des prions. Étant donné que diverses souches de prions présentent des sensibilités différentes aux techniques de désinfection, cette méthode peut confirmer que ces techniques sont efficaces pour les expériences de laboratoire actuelles, telles que le traitement à l’hydroxyde de sodium ou à l’hypochlorite de sodium (eau de Javel)43,44.
Les principales étapes de cette méthodologie comprennent l’identification de sites d’écouvillonnage appropriés qui fourniront un échantillon des zones à fort trafic ainsi que des zones à surveiller qui pourraient être impliquées dans la contamination croisée en aval des expériences. De plus, les laboratoires doivent utiliser des contrôles positifs et négatifs qui reflètent étroitement ceux couramment utilisés dans un laboratoire ou une clinique donnés. Par exemple, si vous travaillez avec des prions de rongeurs, les témoins positifs et négatifs doivent correspondre à cette espèce. Enfin, les données de surveillance doivent être tenues à jour et organisées de manière à ce que les tendances en matière de positivité puissent être facilement identifiées, ce qui permettrait d’atténuer et de recycler le personnel de laboratoire en cas de résultats positifs constants pour une zone donnée.
L’une des limites de ce protocole est la génération potentielle de résultats RT-QuIC erronés. Compte tenu de la nature sensible du RT-QuIC, la présence de détergents résiduels, de sel et d’autres substances sur les surfaces du laboratoire peut avoir un impact sur le résultat de la réaction39. Dans l’ensemble, compte tenu de cette observation, il est avantageux que les surfaces restent exemptes de substances pouvant interférer avec le RT-QuIC, telles que le sel résiduel, les détergents et la poussière. Au fur et à mesure que des améliorations de la méthodologie RT-QuIC seront disponibles, nous prévoyons que bon nombre des limites actuelles de RT-QuIC seront résolues. Nous encourageons donc l’utilisateur final à se tenir au courant de la littérature pour profiter des dernières améliorations de RT-QuIC.
L’un des principaux avantages de cette méthode pour les laboratoires qui étudient les prions est la capacité de minimiser la contamination qui peut avoir un impact sur les résultats des tests d’amplification sensibles. Les outils d’autopsie sont généralement désinfectés avant d’être réutilisés pour de futures nécropsies. La méthode d’écouvillonnage décrite fournit une méthode pour évaluer les outils de nécropsie pour détecter l’infectiosité résiduelle des prions qui peut affecter les résultats en aval. Cela peut fournir un niveau supplémentaire de rigueur aux expériences pour exclure la possibilité que la détection des prions dans les tissus n’était pas due à une contamination par les outils de nécropsie.
Déclarations de divulgation
J.C.B. et Q.Y. sont les inventeurs d’une demande de brevet portant sur la technologie d’écouvillonnage de surface au prion.
Remerciements
Les travaux ont été soutenus par une subvention de la Fondation Creutzzfeldt Jacob Disease. Les bailleurs de fonds n’ont joué aucun rôle dans la conception de l’étude, la collecte et l’interprétation des données, ni dans la décision de soumettre les travaux pour publication.
matériels
| Name | Company | Catalog Number | Comments |
| Fisherbrand PurSwab Foam Swabs | Fisher brand | Catalog #14-960-3E | |
| Milli-Q IQ 7005 Ultrapure Water System | MilliporeSigma | Q7005T0C | |
| Mini-centrifuge, 6000 rpm | Southern Labware | MLX-306 | |
| Omega plate reader | BMG Labtech | FLUOstar Omega plate reader | |
| Q700 sonicator | QSonica | Q700-110 | |
| Recombinant hamster prion protein | MNPRO | MNPROtein-Hamster | syrian hamster, amino acids 90-231 |
| Savant speedvac | Thermo Scientific | SPD1030-230 | |
| Silica nanospheres (50 nm) | nano Composix | SISN50-25M |
Références
- Prusiner, S. B. Novel proteinaceous infectious particles cause scrapie. Science. 216 (4542), 136-144 (1982).
- Bolton, D. C., McKinley, M. P., Prusiner, S. B. Identification of a protein that purifies with the scrapie prion. Science. 218 (4579), 1309-1311 (1982).
- Oesch, B., et al. A cellular gene encodes scrapie PrP 27-30 protein. Cell. 40 (4), 735-746 (1985).
- Caughey, B., Raymond, G. The scrapie-associated form of PrP is made from a cell surface precursor that is both protease- and phospholipase-sensitive. J Biol Chem. 266 (27), 18217-18223 (1991).
- Deleault, N. R., Harris, B. T., Rees, J. R., Supattapone, S. Formation of native prions from minimal components in vitro. Proc Natl Acad Sci U S A. 104 (23), 9741-9746 (2007).
- Gajdusek, D. C., Zigas, V. Degenerative disease of the central nervous system in New Guinea: the endemic occurrence of "kuru" in the native population. N Engl J Med. 257, 974-978 (1957).
- Centers for Disease Control. Fatal degenerative neurologic disease in patients who received pituitary-derived human growth hormone. MMWR Morb Mortal Wkly Rep. 34, 359-361 (1985).
- Duffy, P., Wolf, J., Collins, G., DeVoe, A. G., Streeten, B., Cowen, D. Letter: possible person-to-person transmission of Creutzfeldt-Jakob disease. N Engl J Med. 290 (12), 692-693 (1974).
- Brown, P., et al. Iatrogenic Creutzfeldt-Jakob disease at the millennium. Neurology. 55 (8), 1075-1081 (2000).
- Huillard d'Aignaux, J., et al. Incubation period of Creutzfeldt-Jakob disease in human growth hormone recipients in France. Neurology. 53 (6), 1197-1201 (1999).
- Marzewski, D. J., Towfighi, J., Harrington, M. G., Merril, C. R., Brown, P. Creutzfeldt-Jakob disease following pituitary-derived human growth hormone therapy: a new American case. Neurology. 38, 1131-1133 (1988).
- Hannah, E. L., et al. Creutzfeldt-Jakob disease after receipt of a previously unimplicated brand of dura mater graft. Neurology. 56 (8), 1080-1083 (2001).
- Shimizu, S., et al. Creutzfeldt-Jakob disease with florid-type plaques after cadaveric dura mater grafting. Arch Neurol. 56 (3), 357-362 (1999).
- Antoine, J. C., et al. Creutzfeldt-Jakob disease after extracranial dura mater embolization for a nasopharyngeal angiofibroma. Neurology. 48 (5), 1451-1453 (1997).
- Esmonde, T., Lueck, C. J., Symon, L., Duchen, L. W., Will, R. G. Creutzfeldt-Jakob disease and lyophilised dura mater grafts: report of two cases. J Neurol Neurosurg Psychiatry. 56, 999-1000 (1993).
- Willison, H. J., Gale, A. N., McLaughlin, J. E. Creutzfeldt-Jakob disease following cadaveric dura mater graft. J Neurol Neurosurg Psychiatry. 54, 940 (1991).
- Diringer, H., Braig, H. R. Infectivity of unconventional viruses in dura mater. Lancet. 334, 439-440 (1989).
- Peden, A. H., Head, M. W., Ritchie, D. L., Bell, J. E., Ironside, J. W. Preclinical vCJD after blood transfusion in a PRNP codon 129 heterozygous patient. Lancet. 364 (9433), 527-529 (2004).
- Will, R. G., Matthews, W. B. Evidence for case-to-case transmission of Creutzfeldt-Jakob disease. J Neurol Neurosurg Psychiatry. 45, 235-238 (1982).
- el Hachimi, K. H., Chaunu, M. P., Cervenakova, L., Brown, P., Foncin, J. F. Putative neurosurgical transmission of Creutzfeldt-Jakob disease with analysis of donor and recipient: agent strains. C R Acad Sci III. 320 (4), 319-328 (1997).
- Alper, T., et al. Does the agent of scrapie replicate without nucleic acid. Nature. 214, 764-766 (1967).
- Casassus, B. France halts prion research amid safety concerns. Science. 373 (6554), 475-476 (2021).
- Brandel, J. P., et al. Variant Creutzfeldt-Jakob disease diagnosed 7.5 years after occupational exposure. N Engl J Med. 383 (1), 83-85 (2020).
- Flechsig, E., Hegyi, I., Enari, M., Schwarz, P., Collinge, J., Weissmann, C. Transmission of scrapie by steel-surface-bound prions. Mol Med. 7 (10), 679-684 (2001).
- Zobeley, E., Flechsig, E., Cozzio, A., Enari, M., Weissmann, C. Infectivity of scrapie prions bound to a stainless steel surface. Mol Med. 5 (4), 240-243 (1999).
- Brown, P., Gajdusek, D. C. Survival of scrapie virus after 3 years' interment. Lancet. 337 (8736), 269-270 (1991).
- Seidel, B., et al. Scrapie agent (strain 263K) can transmit disease via the oral route after persistence in soil over years. PLoS One. 2 (5), e435 (2007).
- Maddison, B. C., et al. Environmental sources of scrapie prions. J Virol. 84 (21), 11560-11562 (2010).
- Pritzkow, S., Morales, R., Lyon, A., Concha-Marambio, L., Urayama, A., Soto, C. Efficient prion disease transmission through common environmental materials. J Biol Chem. 293 (9), 3363-3373 (2018).
- Alper, T., Cramp, W., Haig, D., Clarke, M. Does the agent of scrapie replicate without nucleic acid. Nature. 214 (90), 764-766 (1967).
- Bernoulli, C., et al. Danger of accidental person-to-person transmission of Creutzfeldt-Jakob disease by surgery. Lancet. 309 (8009), 478-479 (1977).
- Brown, P., Rohwer, R. G., Green, E. M., Gajdusek, D. C. Effect of chemicals, heat, and histopathologic processing on high- infectivity hamster-adapted scrapie virus. J Infect Dis. 145 (5), 683-687 (1982).
- Brown, P., et al. Chemical disinfection of Creutzfeldt-Jakob disease virus. N Engl J Med. 306, 1279-1282 (1982).
- Dickinson, A. G., Taylor, D. M. Resistance of scrapie agent to decontamination. N Engl J Med. 299, 1413-1414 (1978).
- Hunter, G. D., Millson, G. C. Studies on the heat stability and chromatographic behavior of the scrapie agent. J Gen Microbiol. 37, 251-258 (1964).
- Pattison, I. H. Resistance of the scrapie agent to formalin. J Comp Pathol. 75, 159-164 (1965).
- Fraser, H., Farquhar, C., McConnell, I., Davies, D. The scrapie disease process is unaffected by ionising radiation. Prog Clin Biol Res. 317, 653-658 (1989).
- Yuan, Q., et al. Sensitive detection of chronic wasting disease prions recovered from environmentally relevant surfaces. Environ Int. 166, 107347 (2022).
- Simmons, S. M., et al. Rapid and sensitive determination of residual prion infectivity from prion-decontaminated surfaces. mSphere. 9, e00504-e00524 (2024).
- Orru, C. D., et al. Sensitive detection of pathological seeds of alpha-synuclein, tau and prion protein on solid surfaces. PLoS Pathog. 20 (4), e1012175 (2024).
- Wilham, J. M., et al. Rapid end-point quantitation of prion seeding activity with sensitivity comparable to bioassays. PLoS Pathog. 6 (12), e1001217 (2010).
- Srivastava, A., et al. Enhanced quantitation of pathological alpha-synuclein in patient biospecimens by RT-QuIC seed amplification assays. PLoS Pathog. 20 (9), e1012554 (2024).
- Hughson, A. G., et al. Inactivation of prions and amyloid seeds with hypochlorous acid. PLoS Pathog. 12 (9), e1005914 (2016).
- Williams, K., Hughson, A. G., Chesebro, B., Race, B. Inactivation of chronic wasting disease prions using sodium hypochlorite. PLoS One. 14 (10), e0223659 (2019).
- Taylor, D. M. Autoclaving standards for Creutzfeldt-Jakob disease agent [letter]. Ann Neurol. 22 (4), 557-558 (1987).
- Brown, P., Rohwer, R. G., Gajdusek, D. C. Newer data on the inactivation of scrapie virus or Creutzfeldt-Jakob disease virus in brain tissue. J Infect Dis. 153 (6), 1145-1148 (1986).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon