Method Article
プリオン安全研究所 スワイプ試験
要約
実験室で一般的に使用される領域をプリオン汚染と効果的な除染のために評価する方法が不足しています。ここで説明するプロトコルは、特定のラボの個々のニーズに合わせて簡単に変更できるラボプリオン安全性スワイプテストを実装するための重要な基本を提供します。
要約
医原性プリオン病の伝染は、汚染された脳神経外科手術器具、移植材料、およびプリオンに汚染された実験器具への職業被ばくから発生しています。プリオンは、プリオンタンパク質の正常な細胞型であるPrPCが、誤って折り畳まれた病原性型のPrPSc にテンプレート化されたミスフォールディングによって病気を引き起こし、常に致命的です。医原性および職業性プリオンの伝播を減らすことは困難です。まず、プリオンは表面に結合し、長期間にわたって表面に残留する可能性があります。第二に、プリオンは不活化に対して非常に耐性があります。このため、表面は、効果のない除染後も長期間にわたって感染力を保持する可能性があります。これは、プリオン研究所の労働者に潜在的な職業上のリスクをもたらすだけでなく、高感度のプリオン増幅技術を利用した実験室実験を交差汚染する可能性があります。プリオン安全性実験室のスワイプテストについてここで説明するプロトコルには、交通量の多い実験室エリアの特定と文書化の手順、結果の有効性を確保するための推奨スワブ制御、陽性の表面スワブ部位に対する適切な反応を特定する手順、プリオンスワイプテストの代表的な結果、および潜在的な人工物の結果が含まれます。全体として、プリオン安全性ラボのスワイプテストは、表面の除染を評価し、共用スペースのプリオン汚染を監視し、プリオンの除染状況の文書化を実施するための広範なプリオン安全プログラムの一部として実施できます。
概要
プリオン病は、常に致命的な神経変性疾患であり、既知の治療法や治療法はありません。プリオン病は、プリオンタンパク質1,2,3,4,5、PrP Cの正常な細胞型の誤って折り畳まれた病原性の型であるPrP Scによって引き起こされます。プリオン病は、人間や他のいくつかの動物種に影響を与えることが知られています。ヒトのプリオン病の1つであるクロイツフェルト・ヤコブ病(CJD)には、散発性、遺伝性、後天性の3つの病因が知られています。後天性CJDは、偶発的な感染(医原性および職業性)の結果として発生する可能性があり、パプアニューギニア6のフォアピープルのクルの原因であると考えられています。
プリオン感染は、プリオンに汚染された医療機器および移植材料7,8,9,10,11,12,13,14,15,16,17に関連しています。CJDの医原性感染は、血液、組織、またはプリオンで汚染された表面から発生する可能性があります18,19,20。例えば、医原性CJDは、CJDの前臨床段階の個人に以前に使用された電極を用いた脳波検査の後、後にCJD21に死亡した患者に発症する可能性があります。より最近の実験室での職業感染は、実験室の労働者がヒツジに適応したBSEに感染した動物の脳切片を処理するために使用される鉗子による皮膚穿刺を介してプリオン病に感染した場所でも発生しています22,23。このような感染シナリオは、プリオンサンプルが取り扱われる臨床、実験室、および診断検査室で発生する可能性があります。
プリオンは一般的な消毒技術に抵抗し、長期間にわたって表面に持続し、感染性を維持する可能性があります24,25,26,27,28,29。エタノール、フェノール系洗浄剤、過酸化水素、様々な形態の放射線、ホルムアルデヒドの使用などの一般的な消毒技術は、プリオンの不活性化には不十分であり、表面が感染力を保持することを可能にする30,31,32,33,34,35,36,37 .これらの特性は、医原性および職業暴露中のプリオンの伝達に寄与します。
環境プリオンの検出方法が開発されたのはごく最近のことです。環境スワブ法とリアルタイム震波誘起変換(RT-QuIC)を組み合わせることで、効果のない消毒後の環境表面および一般的な実験室表面からの残留プリオン感染性を評価できます38,39,40,41,42。ここでは、この手法をより広範なプリオン安全プログラムに組み込む方法について説明します。全体として、この方法は、実験室に依存する消毒プロトコルのモニタリング、汚染状態の調査と適切な文書化を可能にし、交差汚染を最小限に抑えることで実験の有効性を確保し、プリオン汚染の共有使用スペースの評価を可能にし、一般的に汚染された領域に基づく人員の方向性の再教育を可能にします。
プロトコル
動物が関わるすべての手順は、クレイトン大学施設動物管理・使用委員会によって承認され、実験動物の世話と使用に関するガイドに準拠していました。
注:プリオン安全実験室のスワイプテストの概略図の概要を 図1に示します。
1.スワブ部位の選択と表面スワブの準備
- スワブの適切な監視エリアを特定し、ラベルを付けます。ドキュメントと参照用に提供されているテンプレートを参照してください(図2 および 補足図1)。
- 同定した各領域について、2本の1.5 mL微量遠心チューブを準備します。ステップ3.2で使用するマイクロ遠心チューブの最初のセットに、250 μLのダルベッコリン酸緩衝生理食塩水を加えます。ステップ4.3で使用するために、2番目のマイクロ遠心チューブセットを空のままにします。
- 先端が発泡スワブの入った綿棒は、プリオン汚染のない場所で保管してください。
- ステップ2.1で使用するためのMilli-Q水(MQ H2O)を入れたスクイーズボトルを準備します。
2.ポジティブコントロールとネガティブコントロールスワブの準備
- 関連するコントロールタイプを使用して、ポジティブおよびネガティブスワブコントロール用の希釈液を調製します。例:ポジティブコントロールのために、デュルベッコリン酸緩衝生理食塩水(DPBS)にプリオン感染脳ホモジネートを1%希釈して調製します。ネガティブコントロールの場合は、DPBSのポジティブコントロールと同じ種からの未感染(UN)脳ホモジネート(BH)を0.1%希釈して調製します。
- 清潔な手袋を使用して、清潔なパッケージから適切な数の綿棒を取り出し、ハンドル側を下にしてチューブラックに置き、先端が他の綿棒や表面に接触しないようにフォーム綿棒の間隔を空けるように注意します。コントロールサンプルごとに、3つの綿棒を準備します。各サンプル間で手袋を交換します。
- 清潔なフォームスワブをハンドルで持ち、50 μLのポジティブおよびネガティブコントロールサンプルをフォームスワブの先端に塗布します。完全に吸収されるように、綿棒の先端の両側に必ず塗布してください。
注意: チューブラックから清潔な綿棒を取り外す前に、必ず手袋を交換してください。 - はさみを使用して、綿棒の余分なハンドル(長さの約1/2)を切り取り、泡の先端部分を下に向けて、綿棒をプリロードされた微量遠心チューブに入れます。フォームチップがDPBSに沈んでいること、およびマイクロ遠心チューブの蓋を完全に閉じるためにハンドルが適切に切断されていることを確認してください。
- 手袋を交換した後も、すべてのサンプルが適用されるまで、コントロールサンプルの塗布を続けます。
3.表面スワブ
- 清潔なフォームチップスワブをハンドルで持ち、フォームチップをMQ H2Oで予め濡らし、余分なものを振り落とします。綿棒の湿らせたフォームの先端を監視用に選択した領域に置き、表面上で綿棒の先端を回転させながら、領域を前後に約10回綿棒で拭きます。
- はさみを使用して、綿棒の余分なハンドル(長さの約1/2)を切り取り、泡の先端部分を下に向けて、綿棒をプリロードされた微量遠心チューブに入れます。フォームチップがDPBSに沈んでいること、およびマイクロ遠心チューブの蓋を完全に閉じるためにハンドルが適切に切断されていることを確認してください。
- 手袋を廃棄し、相互汚染の可能性を最小限に抑えるために、それぞれの綿棒部位の前に新しい手袋を着用します。
- 監視用に選択したすべての領域が拭き取られるまで、手順を繰り返します。
4.綿棒抽出と真空濃縮
注意: 使用の30分前に真空濃縮器の電源を入れて、機器をウォームアップさせます。
- 微量遠心チューブを円形のチューブラックに入れます。マイクロチューブラックをカップホーンソニケーターウォーターバスに入れます。微量遠心チューブ内のDPBSのフォームスワブがカップホーン内の水面下にあることを確認します(ハンドル部分を水没させる必要はありません)。次の設定を適用します: ~75-85 ワットで 15 秒の合計実行時間 (5 秒がオン、5 秒がオフ)。
- 超音波処理後、チューブを約15秒間遠心分離して、移す前にチューブの底にDPBSを収集します。
- P1000ピペットを250 μLにセットし、マイクロ遠心チューブの底からすべての液体(綿棒抽出物)を慎重に収集し、2番目の空のプレラベルセットから対応するマイクロ遠心チューブに移します。ピペットチップを使用して、フォームチップから余分な液体を絞ります。綿棒の入った空のチューブは捨てます。
- 真空濃縮器で次の設定を行います:温度:45°C、加熱時間:15分、実行時間:2時間、真空:5.1。
- 綿棒抽出物が入った微量遠心チューブを真空濃縮器に入れ、チューブのバランスが取れ、すべてのチューブキャップが開いていることを確認します。
- サイクルが完了したら、サンプルが完全に濃縮されている(ペレットのみが残っている)ことを確認します。ペレットは、RT-QuICに使用するまで-80°Cで保存してください。
注:場合によっては、完全な濃縮を確保するために追加の真空濃縮時間が必要になることがあります。濃縮されたサンプルをすべて取り出し、液体が残っているチューブだけを残します。濃縮器内の残りのチューブのバランスを取り直し、サンプルが完全に濃縮されるまでさらに1時間刻みで実行します。
5. RT-QuIC用スワブコントロールの調製
注:RT-QuICコントロールは、環境スワブ抽出物のアッセイの前に実行して、スワブ、抽出、または濃縮手順中に汚染が導入されていないことを確認する必要があります。レイアウトの例については、 図 3 と 図 4 を参照してください。
- 組織希釈液(N2-0.1%SDS/PBS)で適切な濃度に希釈することにより、適切なネガティブRT-QuICプレートコントロール(例:未感染脳ホモジネート[UN BH])を調製します。プリオンに感染した脳ホモジネートを組織希釈液中で10-3 に希釈することにより、ポジティブプレートコントロール希釈液を調製します。
- -80°Cから以前に保存したコントロールスワブ抽出ペレットを取り出し、ピペッティングで約10回上下させて、それぞれを50μLのMQ H2Oで再懸濁し、その後短時間ボルテックスします。サンプルを室温(RT)で放置しながら、残りのステップを実行します。
- ネガティブプレートコントロール(組織希釈溶液のみおよび未感染の脳ホモジネート)およびポジティブプレートコントロール(感染した脳ホモジネート)を含む、指定されたプレートコントロールを2μLロードします。
- ポジティブおよびネガティブの各スワブ抽出物のテクニカルレプリケートを2 μLロードし、最低4つのリピートRT-QuICプレートウェルにロードします。
注:ネガティブスワブコントロールが、ラボのポジティブ判定基準を超えるRT-QuICシーディングを示している場合、これはスワブ、抽出、および濃縮プロセス中に汚染が持ち込まれたため、スワブ実験を再度実施する必要があることを示しています
6. RT-QuIC用サンプルの調製
- 組織希釈液(N2-0.1%SDS/PBS)で適切な濃度に希釈することにより、適切なネガティブプレートコントロール(例:非感染脳ホモジネート、非感染リンパ節など)を調製します。感染した脳ホモジネートを組織希釈液中で10-3 に希釈することにより、ポジティブプレートコントロールを調製します。
- 以前に保存したスワブ抽出ペレットを-80°Cから取り出し、20〜50μLの組織希釈液(疑わしい汚染量によって異なります)で約10回ピペッティングして再懸濁し、その後短時間ボルテックスします。サンプルをRTに置きながら、残りの手順を実行します。
- ネガティブプレートコントロール(組織希釈溶液のみおよび未感染の脳ホモジネート)およびポジティブプレートコントロール(感染した脳ホモジネート)を含む、指定されたプレートコントロールを2 μLをRT-QuICプレートウェルにロードします。
- 各スワブ抽出物の2 μLを4つのレプリケートウェルにロードします。
7. RT-QuICの分析と結果
- 個々のラボのプロトコル(オプションのプロトコル38,40)に従ってRT-QuICを実行します。
- サンプルの陽性率を決定するために必要なパラメータを定義します(代表的な結果、 図5を参照)。
注:これらのパラメータは、各ラボによって定義されます。 - 提供された表に結果を記録し、ラボのベストプラクティスに基づいて適切な措置を講じます(表1 および 補足図2)。
結果
陽性および陰性の結果の説明書(陽性/陰性プレートおよびスワブコントロールを含む)
ネガティブコントロールスワブは、スワブ、抽出、および濃縮プロセス中に導入される可能性のあるプリオン汚染を監視するために、監視スワブに含まれています。特定の月次サーベイランスに対して実施される最初のRT-QuICプレートには、陽性および陰性のスワブコントロールを含める必要があります。ネガティブコントロールが成功しても、ポジティブ蛍光の閾値を超えられません(図6A)。この結果は、実験手順中に汚染が導入されていなかったことを示しています。成功したポジティブコントロールスワブ抽出物は、特定のサンプルのすべての複製ウェルでポジティブシーディングを示します(ポジティブコントロールスワブは、ハムスターに適応した伝染性ミンク脳症株ハイパー(HY TME)脳ホモジネートで汚染されていました。ポジティブコントロール希釈シリーズを含めることで、特定の実験におけるプリオン検出の感度を決定することができます(図6A)。
表面スワブ抽出物サンプルを検査する場合、所定の正の蛍光閾値を超える播種を示さない表面は、プリオン陰性と見なすことができます(図6B)。逆に、プリオンで汚染された表面スワブ抽出物は、ポジティブ蛍光閾値を超える播種能力を示しますが、最大ポイント比(MPR)と蛍光までの時間は、付属のポジティブプレートコントロールと比較して異なる可能性があります(図6B)。この分析法が適切な消毒を評価する能力は、漂白剤処理されたプリオンで汚染された表面によって強調されており、現在はRT-QuICのシードに失敗しています(図6B)。
重要なことは、当研究室では、少なくとも半分のリピートウェルで設定された陽性蛍光閾値を超えるサンプルを陽性サンプルと定義していますが、各研究室が独自の基準を設定する必要があるということです。アミロイド形成率(RAF)と蛍光までの時間も、実験室固有の陽性率の閾値を確立するためにも使用できます。
ポジティブ蛍光の閾値を超えるが、運動曲線が変化し、ポジティブコントロールサンプルと比較して蛍光が異常に長い時間が経過した表面アーチファクトの結果が観察されました(図6C)。これらの結果は、表面に存在するほこりや残留化学物質の存在によって引き起こされる可能性があるため、慎重に解釈する必要があります。これらの知見は、一般的な実験室の清浄度の必要性と、真陽性と偽陽性の播種を区別するための基準を強調しています。
固体および液体のバイオハザード廃棄物の処分は、特定の機関の現在のバイオハザード処理ガイドラインに従って行う必要があります。一般的なプリオン消毒技術には、水酸化ナトリウム、次亜塩素酸ナトリウム(漂白剤)による処理、または134°Cで18分間のオートクレーブ処理が含まれます43,44,45,46。
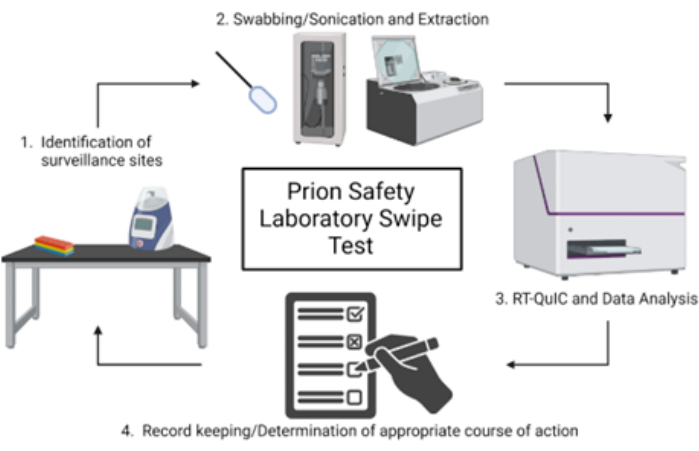
図1:プリオン安全実験室のスワイプテストの概略図概要。この図の拡大版を見るには、ここをクリックしてください。
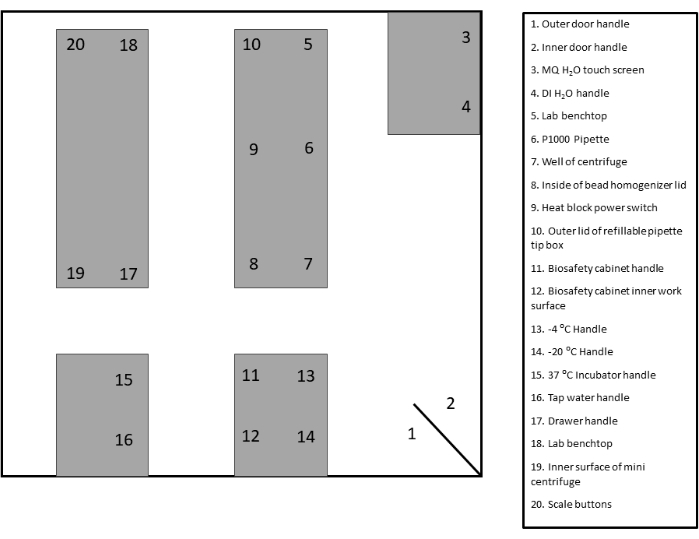
図 2: スワブ サイトのレイアウトのサンプル。この図の拡大版を表示するには、ここをクリックしてください。
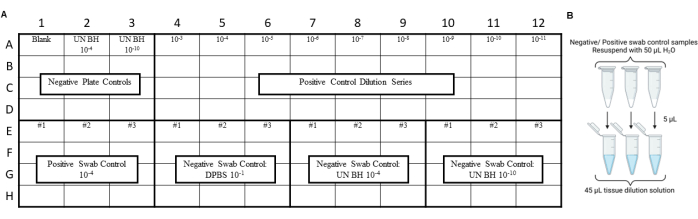
図3:スワブコントロールのサンプル実験デザインには、プリオン安全性実験室のスワイプテストが含まれていました。 (A)陰性および陽性のスワブ抽出コントロールのサンプルレイアウト。(B)陰性および陽性の綿棒抽出物コントロールは、50μLのH2Oで再懸濁する必要があります。再懸濁したスワブ抽出物を組織希釈溶液に希釈することにより、再懸濁したスワブ抽出物を10倍に希釈する必要があります。 この図の拡大版を表示するには、ここをクリックしてください。
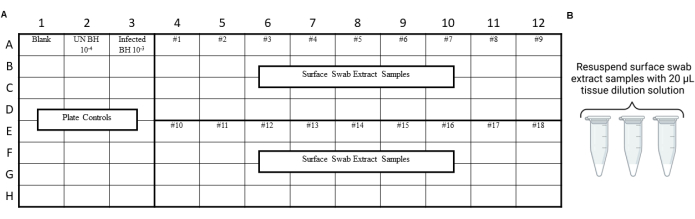
図4:プリオン安全性実験室のスワイプ試験からの表面スワブ抽出物のサンプル実験デザイン (A)表面スワブ抽出物のサンプルレイアウト。(B)表面スワブ抽出物サンプルは、20μLの組織希釈溶液で再懸濁する必要があります。 この図の拡大版を表示するには、ここをクリックしてください。
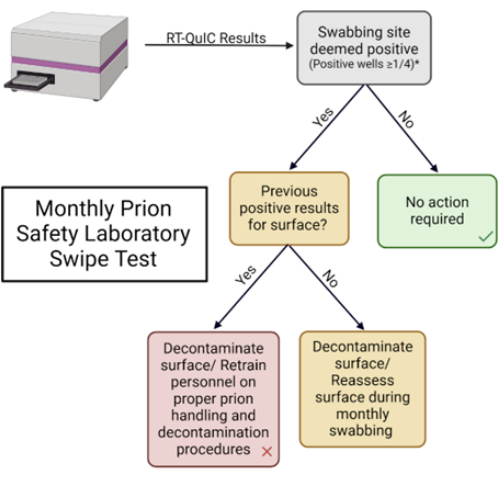
図5:毎月のプリオン安全性実験室のスワイプテスト。 結果を解釈し、適切な応答を決定するために使用されるフローチャート。 この図の拡大版を表示するには、ここをクリックしてください。
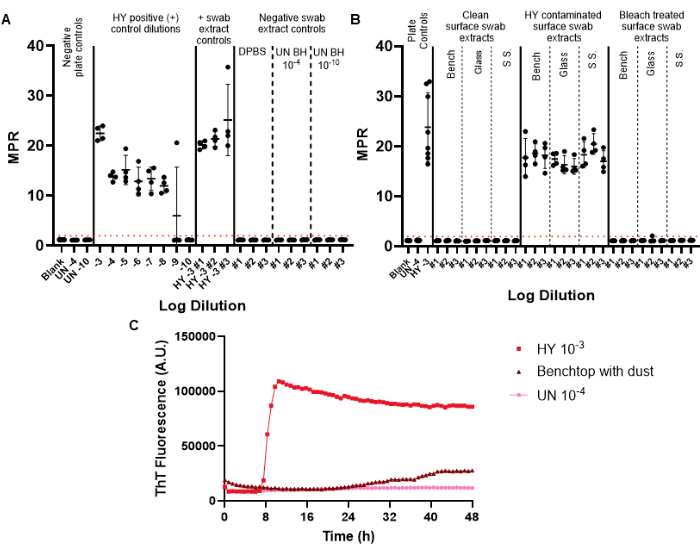
図6:代表的な表面スワブ実験 (A)陰性スワブ抽出物を含む表面スワブコントロールプレートは、トリプリケート(DPBS、未感染ハムスター脳ホモジネート10-4 および10-10)でコントロールし、ポジティブスワブ抽出物コントロールをトリプリケート(HY脳ホモジネート10-3)でコントロールします。(B)汚染前、HY 10-3による汚染後、および汚染された表面の漂白処理後に綿棒で拭かれたベンチトップ、ガラス、およびステンレス鋼(SS)表面の代表的な綿棒抽出物。(C)未感染の脳ホモジネート10-4、HY脳ホモジネート10-3 、および粉塵の微細な膜でコーティングされたベンチトップからの綿棒抽出物の蛍光追跡比較。パネルAおよびBのネガティブプレートコントロールには、ブランク(組織希釈溶液)および未感染のハムスター脳ホモジネート10-4が含まれる。パネルBは、未感染の脳ホモジネート10-4 の添加と、HY脳ホモジネート10-3のポジティブプレートコントロールを含む。正の蛍光閾値(赤い破線で示されている)は2であると決定されました。報告される最大ポイント比(MPR)は、最大蛍光をプレートリーダーによって得られた初期蛍光読み取り値で割ったものです。各ポイントは、特定のサンプルタイプに対する 1 つのテクニカルウェルレプリケートを表します。平均と標準偏差が表示されます。 この図の拡大版を表示するには、ここをクリックしてください。
表1:サンプルスワブサイトの月次ドキュメントフォーム。この表をダウンロードするには、ここをクリックしてください。
補足図1:スワブサイトレイアウトテンプレート。このファイルをダウンロードするには、ここをクリックしてください。
補足図2:スワブサイトの月次ドキュメントフォーム。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
記載されたプリオン安全スワブ法は、既存のプリオン安全対策を強化するために用いることができる。この方法では、プリオンの実験室スペースと機器、および共有の実験室スペースを監視して、プリオン汚染の可能性を検出できます。重要なことに、この方法は、プリオンで汚染された表面の除染を検証するための実験室固有の消毒技術の試験に適合させることができます。さまざまなプリオン株が消毒技術に対して異なる感受性を示すため、この方法は、これらの技術が水酸化ナトリウムまたは次亜塩素酸ナトリウム(漂白剤)による処理などの現在の実験室実験に有効であることを確認できます43,44。
この方法論の主なステップには、トラフィックの多い領域と、実験の下流の交差汚染に関与する可能性のある監視領域の両方のサンプルを提供する適切なスワブ部位の特定が含まれます。さらに、検査室は、特定の検査室や診療所で一般的に使用されるものと密接に反映したポジティブコントロールとネガティブコントロールを利用する必要があります。たとえば、げっ歯類のプリオンを使用する場合、ポジティブコントロールとネガティブコントロールはその種と一致する必要があります。最後に、サーベイランスのデータを最新の状態に保ち、整理して陽性傾向の傾向を簡単に特定できるようにし、特定のエリアで一貫して陽性の結果が出た場合に検査スタッフの緩和と再訓練を可能にする必要があります。
このプロトコルの1つの制限は、誤ったRT-QuIC結果を生成する可能性があることです。RT-QuICの感度が高い性質を考えると、実験室の表面に残留する界面活性剤、塩、およびその他の物質の存在は、反応の結果に影響を与える可能性があります39。全体として、この観察結果を考慮すると、残留塩分、洗剤、粉塵など、RT-QuICに干渉する可能性のある物質が表面に存在しないことが有利です。RT-QuICの方法論の改善が可能になれば、現在のRT-QuICの制限の多くが解決されると予想しています。したがって、エンドユーザーには、RT-QuICの最新の改良点を活用するために、文献に遅れないようにすることをお勧めします。
プリオンを研究するラボにとってこの方法の主な利点は、高感度増幅アッセイの結果に影響を与える可能性のある汚染を最小限に抑えることができることです。剖検ツールは、通常、将来の剖検に再利用する前に消毒されます。記載されたスワブ法は、下流の結果に影響を与える可能性のある残留プリオン感染性について剖検ツールを評価する方法を提供します。これにより、組織中のプリオン検出が剖検ツールによる汚染によるものではなかった可能性を排除するために、実験にさらなる厳密さを提供することができます。
開示事項
J.C.B.とQ.Y.は、プリオン表面スワブ技術に関する特許出願の発明者です。
謝辞
この研究は、クロイツフェルト・ヤコブ病財団からの助成金によって支援されました。資金提供者は、研究デザイン、データ収集、解釈、または研究を出版に提出する決定に関与していませんでした。
資料
| Name | Company | Catalog Number | Comments |
| Fisherbrand PurSwab Foam Swabs | Fisher brand | Catalog #14-960-3E | |
| Milli-Q IQ 7005 Ultrapure Water System | MilliporeSigma | Q7005T0C | |
| Mini-centrifuge, 6000 rpm | Southern Labware | MLX-306 | |
| Omega plate reader | BMG Labtech | FLUOstar Omega plate reader | |
| Q700 sonicator | QSonica | Q700-110 | |
| Recombinant hamster prion protein | MNPRO | MNPROtein-Hamster | syrian hamster, amino acids 90-231 |
| Savant speedvac | Thermo Scientific | SPD1030-230 | |
| Silica nanospheres (50 nm) | nano Composix | SISN50-25M |
参考文献
- Prusiner, S. B. Novel proteinaceous infectious particles cause scrapie. Science. 216 (4542), 136-144 (1982).
- Bolton, D. C., McKinley, M. P., Prusiner, S. B. Identification of a protein that purifies with the scrapie prion. Science. 218 (4579), 1309-1311 (1982).
- Oesch, B., et al. A cellular gene encodes scrapie PrP 27-30 protein. Cell. 40 (4), 735-746 (1985).
- Caughey, B., Raymond, G. The scrapie-associated form of PrP is made from a cell surface precursor that is both protease- and phospholipase-sensitive. J Biol Chem. 266 (27), 18217-18223 (1991).
- Deleault, N. R., Harris, B. T., Rees, J. R., Supattapone, S. Formation of native prions from minimal components in vitro. Proc Natl Acad Sci U S A. 104 (23), 9741-9746 (2007).
- Gajdusek, D. C., Zigas, V. Degenerative disease of the central nervous system in New Guinea: the endemic occurrence of "kuru" in the native population. N Engl J Med. 257, 974-978 (1957).
- Centers for Disease Control. Fatal degenerative neurologic disease in patients who received pituitary-derived human growth hormone. MMWR Morb Mortal Wkly Rep. 34, 359-361 (1985).
- Duffy, P., Wolf, J., Collins, G., DeVoe, A. G., Streeten, B., Cowen, D. Letter: possible person-to-person transmission of Creutzfeldt-Jakob disease. N Engl J Med. 290 (12), 692-693 (1974).
- Brown, P., et al. Iatrogenic Creutzfeldt-Jakob disease at the millennium. Neurology. 55 (8), 1075-1081 (2000).
- Huillard d'Aignaux, J., et al. Incubation period of Creutzfeldt-Jakob disease in human growth hormone recipients in France. Neurology. 53 (6), 1197-1201 (1999).
- Marzewski, D. J., Towfighi, J., Harrington, M. G., Merril, C. R., Brown, P. Creutzfeldt-Jakob disease following pituitary-derived human growth hormone therapy: a new American case. Neurology. 38, 1131-1133 (1988).
- Hannah, E. L., et al. Creutzfeldt-Jakob disease after receipt of a previously unimplicated brand of dura mater graft. Neurology. 56 (8), 1080-1083 (2001).
- Shimizu, S., et al. Creutzfeldt-Jakob disease with florid-type plaques after cadaveric dura mater grafting. Arch Neurol. 56 (3), 357-362 (1999).
- Antoine, J. C., et al. Creutzfeldt-Jakob disease after extracranial dura mater embolization for a nasopharyngeal angiofibroma. Neurology. 48 (5), 1451-1453 (1997).
- Esmonde, T., Lueck, C. J., Symon, L., Duchen, L. W., Will, R. G. Creutzfeldt-Jakob disease and lyophilised dura mater grafts: report of two cases. J Neurol Neurosurg Psychiatry. 56, 999-1000 (1993).
- Willison, H. J., Gale, A. N., McLaughlin, J. E. Creutzfeldt-Jakob disease following cadaveric dura mater graft. J Neurol Neurosurg Psychiatry. 54, 940(1991).
- Diringer, H., Braig, H. R. Infectivity of unconventional viruses in dura mater. Lancet. 334, 439-440 (1989).
- Peden, A. H., Head, M. W., Ritchie, D. L., Bell, J. E., Ironside, J. W. Preclinical vCJD after blood transfusion in a PRNP codon 129 heterozygous patient. Lancet. 364 (9433), 527-529 (2004).
- Will, R. G., Matthews, W. B. Evidence for case-to-case transmission of Creutzfeldt-Jakob disease. J Neurol Neurosurg Psychiatry. 45, 235-238 (1982).
- el Hachimi, K. H., Chaunu, M. P., Cervenakova, L., Brown, P., Foncin, J. F. Putative neurosurgical transmission of Creutzfeldt-Jakob disease with analysis of donor and recipient: agent strains. C R Acad Sci III. 320 (4), 319-328 (1997).
- Alper, T., et al. Does the agent of scrapie replicate without nucleic acid. Nature. 214, 764-766 (1967).
- Casassus, B. France halts prion research amid safety concerns. Science. 373 (6554), 475-476 (2021).
- Brandel, J. P., et al. Variant Creutzfeldt-Jakob disease diagnosed 7.5 years after occupational exposure. N Engl J Med. 383 (1), 83-85 (2020).
- Flechsig, E., Hegyi, I., Enari, M., Schwarz, P., Collinge, J., Weissmann, C. Transmission of scrapie by steel-surface-bound prions. Mol Med. 7 (10), 679-684 (2001).
- Zobeley, E., Flechsig, E., Cozzio, A., Enari, M., Weissmann, C. Infectivity of scrapie prions bound to a stainless steel surface. Mol Med. 5 (4), 240-243 (1999).
- Brown, P., Gajdusek, D. C. Survival of scrapie virus after 3 years' interment. Lancet. 337 (8736), 269-270 (1991).
- Seidel, B., et al. Scrapie agent (strain 263K) can transmit disease via the oral route after persistence in soil over years. PLoS One. 2 (5), e435(2007).
- Maddison, B. C., et al. Environmental sources of scrapie prions. J Virol. 84 (21), 11560-11562 (2010).
- Pritzkow, S., Morales, R., Lyon, A., Concha-Marambio, L., Urayama, A., Soto, C. Efficient prion disease transmission through common environmental materials. J Biol Chem. 293 (9), 3363-3373 (2018).
- Alper, T., Cramp, W., Haig, D., Clarke, M. Does the agent of scrapie replicate without nucleic acid. Nature. 214 (90), 764-766 (1967).
- Bernoulli, C., et al. Danger of accidental person-to-person transmission of Creutzfeldt-Jakob disease by surgery. Lancet. 309 (8009), 478-479 (1977).
- Brown, P., Rohwer, R. G., Green, E. M., Gajdusek, D. C. Effect of chemicals, heat, and histopathologic processing on high- infectivity hamster-adapted scrapie virus. J Infect Dis. 145 (5), 683-687 (1982).
- Brown, P., et al. Chemical disinfection of Creutzfeldt-Jakob disease virus. N Engl J Med. 306, 1279-1282 (1982).
- Dickinson, A. G., Taylor, D. M. Resistance of scrapie agent to decontamination. N Engl J Med. 299, 1413-1414 (1978).
- Hunter, G. D., Millson, G. C. Studies on the heat stability and chromatographic behavior of the scrapie agent. J Gen Microbiol. 37, 251-258 (1964).
- Pattison, I. H. Resistance of the scrapie agent to formalin. J Comp Pathol. 75, 159-164 (1965).
- Fraser, H., Farquhar, C., McConnell, I., Davies, D. The scrapie disease process is unaffected by ionising radiation. Prog Clin Biol Res. 317, 653-658 (1989).
- Yuan, Q., et al. Sensitive detection of chronic wasting disease prions recovered from environmentally relevant surfaces. Environ Int. 166, 107347(2022).
- Simmons, S. M., et al. Rapid and sensitive determination of residual prion infectivity from prion-decontaminated surfaces. mSphere. 9, e00504-e00524 (2024).
- Orru, C. D., et al. Sensitive detection of pathological seeds of alpha-synuclein, tau and prion protein on solid surfaces. PLoS Pathog. 20 (4), e1012175(2024).
- Wilham, J. M., et al. Rapid end-point quantitation of prion seeding activity with sensitivity comparable to bioassays. PLoS Pathog. 6 (12), e1001217(2010).
- Srivastava, A., et al. Enhanced quantitation of pathological alpha-synuclein in patient biospecimens by RT-QuIC seed amplification assays. PLoS Pathog. 20 (9), e1012554(2024).
- Hughson, A. G., et al. Inactivation of prions and amyloid seeds with hypochlorous acid. PLoS Pathog. 12 (9), e1005914(2016).
- Williams, K., Hughson, A. G., Chesebro, B., Race, B. Inactivation of chronic wasting disease prions using sodium hypochlorite. PLoS One. 14 (10), e0223659(2019).
- Taylor, D. M. Autoclaving standards for Creutzfeldt-Jakob disease agent [letter]. Ann Neurol. 22 (4), 557-558 (1987).
- Brown, P., Rohwer, R. G., Gajdusek, D. C. Newer data on the inactivation of scrapie virus or Creutzfeldt-Jakob disease virus in brain tissue. J Infect Dis. 153 (6), 1145-1148 (1986).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved