Method Article
Teste de furto do laboratório de segurança de príons
Neste Artigo
Resumo
Falta um método para avaliar áreas comumente usadas em ambientes de laboratório para contaminação por príons e descontaminação eficaz. O protocolo descrito aqui fornece os principais fundamentos para a implementação de um teste de segurança de príons em laboratório que pode ser facilmente modificado para atender às necessidades individuais de laboratórios específicos.
Resumo
A transmissão da doença iatrogênica do príon ocorreu a partir de ferramentas neurocirúrgicas contaminadas, materiais de transplante e exposição ocupacional a ferramentas laboratoriais contaminadas com príons. Os príons causam doença pelo desdobramento moldado da forma celular normal da proteína príon, PrPC, na forma mal dobrada e patogênica PrPSc e são invariavelmente fatais. Reduzir a transmissão iatrogênica e ocupacional de príons é um desafio. Primeiro, os príons podem se ligar e persistir em superfícies por longos períodos de tempo. Em segundo lugar, os príons são altamente resistentes à inativação. Diante disso, as superfícies podem reter a infectividade por longos períodos de tempo após uma descontaminação ineficaz. Isso não apenas pode representar um risco ocupacional potencial para os trabalhadores do laboratório de príons, mas também pode contaminar experimentos de laboratório utilizando técnicas sensíveis de amplificação de príons. O protocolo descrito aqui para um teste de furto de laboratório de segurança de príons inclui etapas para a identificação e documentação de áreas laboratoriais de alto tráfego, controles de swab recomendados para garantir a validade dos resultados, etapas para identificar respostas adequadas a locais de swab de superfície positivos, resultados representativos do teste de swipe de príon, bem como possíveis resultados artefactuais. No geral, o teste de furto do laboratório de segurança de príons pode ser implementado como parte de um programa mais amplo de segurança de príons para avaliar a descontaminação de superfícies, monitorar espaços comuns para contaminação de príons e implementar a documentação do status de descontaminação de príons.
Introdução
As doenças priônicas são invariavelmente doenças neurodegenerativas fatais, sem tratamento ou cura conhecidos. As doenças priônicas são causadas por PrPSc, a forma mal dobrada e patogênica da forma celular normal da proteína príon 1,2,3,4,5, PrP C. Sabe-se que as doenças priônicas afetam humanos e várias outras espécies animais. Uma doença priônica humana, a doença de Creutzfeldt-Jakob, CJD, tem três etiologias conhecidas: esporádica, hereditária e adquirida. A DCJ adquirida pode ocorrer como resultado de transmissão acidental (iatrogênica e ocupacional) e acredita-se que seja a causa de Kuru no povo Fore de Papua Nova Guiné6.
A transmissão de príons tem sido associada a dispositivos médicos contaminados com príons e materiais de transplante 7,8,9,10,11,12,13,14,15,16,17. A transmissão iatrogênica da DCJ pode ocorrer através do sangue, tecido ou de superfícies contaminadas com príons 18,19,20. Por exemplo, a DCJ iatrogênica pode se desenvolver em pacientes após um eletroencefalograma com eletrodos usados anteriormente em um indivíduo no estágio pré-clínico da DCJ que posteriormente sucumbiu à DCJ21. A transmissão ocupacional laboratorial mais recente também ocorreu quando um trabalhador de laboratório contraiu a doença do príon por meio de uma punção na pele com fórceps usado para manusear fatias de cérebro de um animal infectado com EEB adaptado a ovelhas22,23. Esses cenários de transmissão podem ocorrer em ambientes clínicos, laboratoriais e de laboratório de diagnóstico onde as amostras de príons são manuseadas.
Os príons resistem a técnicas comuns de desinfecção e podem persistir e permanecer infecciosos em superfícies por longos períodos de tempo 24,25,26,27,28,29. Técnicas comuns de desinfecção, como o uso de etanol, limpadores fenólicos, peróxido de hidrogênio, várias formas de radiação e formaldeído, são inadequadas para a inativação de príons, permitindo que as superfícies retenham a infectividade 30,31,32,33,34,35,36,37. Essas características contribuem para a transmissão de príons durante a exposição iatrogênica e ocupacional.
Métodos para a detecção de príons ambientais só recentemente foram desenvolvidos. Um método de swab ambiental acoplado à conversão induzida por tremores em tempo real (RT-QuIC) pode avaliar a infectividade residual do príon de superfícies ambientais, bem como de superfícies laboratoriais comuns após desinfecção ineficaz 38,39,40,41,42. Aqui, descrevemos como essa técnica pode ser incorporada a um programa mais amplo de segurança de príons. No geral, este método pode permitir o monitoramento de protocolos de desinfecção dependentes de laboratório, a investigação e documentação adequada do status de contaminação, o que pode ajudar a garantir a validade dos experimentos, minimizando a contaminação cruzada, a avaliação de espaços de uso compartilhado para contaminação por príons e permite o retreinamento direcional de pessoal com base em áreas comumente contaminadas.
Protocolo
Todos os procedimentos envolvendo animais foram aprovados e estão em conformidade com o Guia para o Cuidado e Uso de Animais de Laboratório pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Creighton.
NOTA: Uma visão geral esquemática do teste de furto do laboratório de segurança de príons é mostrada na Figura 1.
1. Seleção de locais de swab e preparação para swab de superfície
- Identifique e rotule as áreas de vigilância apropriadas para esfregaço. Consulte o modelo fornecido para documentação e referência (Figura 2 e Figura Suplementar 1).
- Prepare dois tubos de microcentrífuga de 1,5 mL para cada uma das áreas identificadas. Adicione 250 μL de solução salina tamponada com fosfato de Dulbecco ao primeiro conjunto de tubos de microcentrífuga para uso na etapa 3.2. Deixe o segundo conjunto de tubos de microcentrífuga vazio para uso na etapa 4.3.
- Recupere os cotonetes com ponta de espuma do armazenamento em uma área livre de contaminação por príons.
- Prepare uma garrafa squeeze com água Milli-Q (MQ H2O) para uso na etapa 2.1.
2. Preparação de swab de controle positivo e negativo
- Preparar diluições para controlos de zaragatoas positivas e negativas utilizando os tipos de controlo pertinentes. Exemplo: Para controle positivo, prepare uma diluição de 1% do homogeneizado cerebral infectado por príons em solução salina tamponada com fosfato de Dulbecco (DPBS). Para controle negativo, prepare uma diluição de 0,1% de homogeneizado cerebral não infectado (UN) (BH) da mesma espécie que o controle positivo em DPBS.
- Usando luvas limpas, recupere o número apropriado de cotonetes da embalagem limpa e coloque o lado da alça voltado para baixo em um suporte para tubos, tomando cuidado para espaçar os cotonetes de espuma para que as pontas não entrem em contato com outros cotonetes ou superfícies. Para cada amostra de controle, prepare três cotonetes. Troque as luvas entre cada amostra.
- Segurando um cotonete de espuma limpo pela alça, aplique 50 μL das respectivas amostras de controle positivo e negativo nas pontas do cotonete de espuma. Certifique-se de aplicar em ambos os lados da ponta do cotonete para garantir a absorção completa.
NOTA: Sempre troque as luvas antes de remover um cotonete limpo do suporte para tubos. - Usando uma tesoura, corte o excesso de alça do cotonete (aproximadamente 1/2 do comprimento) e coloque o cotonete no tubo de microcentrífuga pré-carregado com a parte da ponta de espuma apontada para baixo. Certifique-se de que a ponta de espuma esteja submersa no DPBS e que a alça esteja cortada adequadamente para fechar completamente a tampa do tubo da microcentrífuga.
- Continue aplicando amostras de controle após a troca de luvas até que todas as amostras tenham sido aplicadas.
3. Cotonete de superfície
- Segurando um cotonete de ponta de espuma limpo pela alça, umedeça previamente a ponta de espuma com MQ H2O e sacuda o excesso. Coloque a ponta de espuma umedecida do cotonete na área escolhida para vigilância e esfregue a área para frente e para trás aproximadamente dez vezes enquanto gira simultaneamente a ponta do cotonete na superfície.
- Usando uma tesoura, corte o excesso de alça do cotonete (aproximadamente 1/2 do comprimento) e coloque o cotonete no tubo de microcentrífuga pré-carregado com a parte da ponta de espuma apontada para baixo. Certifique-se de que a ponta de espuma esteja submersa no DPBS e que a alça esteja cortada adequadamente para fechar completamente a tampa do tubo da microcentrífuga.
- Descarte as luvas e coloque-as novas antes de cada local de coleta respectivo para minimizar a probabilidade de contaminação cruzada.
- Repita o procedimento até que todas as áreas escolhidas para vigilância tenham sido esfregadas.
4. Extração de swab e concentração de vácuo
NOTA: Ligue o concentrador de vácuo 30 minutos antes de usar para permitir que o instrumento aqueça.
- Coloque os tubos de microcentrífuga em um suporte de tubo circular. Coloque o suporte de tubo de microcentrífuga no banho-maria do sonicador de chifre de copo. Certifique-se de que os cotonetes de espuma no DPBS dentro dos tubos da microcentrífuga estejam abaixo da superfície da água no chifre do copo (a parte da alça não precisa ser submersa). Aplique as seguintes configurações: Tempo total de execução de 15 s (5 s ligado, 5 s desligado) a ~ 75-85 watts.
- Após a sonicação, centrifugue os tubos por aproximadamente 15 s para coletar DPBS no fundo do tubo antes da transferência.
- Usando uma pipeta P1000 ajustada para 250 μL, colete cuidadosamente todo o líquido (extrato de cotonete) do fundo do tubo de microcentrífuga e transfira para o tubo de microcentrífuga correspondente do segundo conjunto pré-rotulado vazio. Use a ponta da pipeta para espremer o excesso de líquido da ponta da espuma. Descarte os tubos vazios contendo cotonetes.
- Defina as seguintes configurações no concentrador de vácuo: Temperatura: 45 °C, Tempo de aquecimento: 15 min, Tempo de funcionamento: 2 h, Vácuo: 5.1.
- Coloque os tubos de microcentrífuga contendo extratos de swab no concentrador de vácuo, garantindo que os tubos estejam equilibrados e todas as tampas dos tubos estejam abertas.
- Após a conclusão do ciclo, certifique-se de que as amostras estejam completamente concentradas (apenas o pellet permanece). Armazene os pellets a -80 °C até serem utilizados para RT-QuIC.
NOTA: Em alguns casos, pode ser necessário um tempo adicional de concentração de vácuo para garantir a concentração completa. Remova todas as amostras concentradas, deixando apenas os tubos que ainda contêm líquido. Reequilibre os tubos restantes dentro do concentrador e opere em incrementos adicionais de 1 h até que as amostras estejam completamente concentradas.
5. Preparação de controles de swab para uso em RT-QuIC
NOTA: Os controles RT-QuIC devem ser realizados antes do ensaio de extratos de swab ambiental para garantir que a contaminação não tenha sido introduzida durante os procedimentos de swab, extração ou concentração. Para obter exemplos de layouts, consulte a Figura 3 e a Figura 4.
- Prepare um controle de placa RT-QuIC negativo apropriado (por exemplo, homogeneizado cerebral não infectado [UN BH]) diluindo até a concentração apropriada em solução de diluição tecidual (N2-0,1% SDS / PBS). Preparar uma diluição positiva do controlo em placas diluindo o homogeneizado cerebral infectado com priões para uma diluição de 10-3 em solução de diluição tecidual.
- Remova os pellets de extrato de swab de controle armazenados anteriormente a -80 ° C e ressuspenda cada um com 50 μL de MQ H2O pipetando para cima e para baixo aproximadamente 10 vezes, seguido de vórtice brevemente. Deixe as amostras em temperatura ambiente (RT) enquanto executa as etapas restantes.
- Carga de 2 μL de controles de placa especificados, incluindo controles de placa negativos (solução de diluição de tecido isolada e homogeneizado cerebral não infectado) e um controle de placa positivo (homogeneizado cerebral infectado).
- Carregue 2 μL de cada extrato de swab positivo e negativo replicado técnico em um mínimo de quatro poços de placa RT-QuIC replicados.
NOTA: Se os controles de swab negativos exibirem semeadura RT-QuIC acima do padrão de um laboratório para uma determinação positiva, isso indicaria que a contaminação foi introduzida durante o processo de swab, extração e concentração e que o experimento de swab deve ser realizado novamente
6. Preparação de amostras para uso em RT-QuIC
- Prepare um controle de placa negativa apropriado (por exemplo, homogeneizado cerebral não infectado, linfonodo não infectado, etc.) diluindo até a concentração apropriada em solução de diluição tecidual (N2-0,1% SDS / PBS). Prepare os controles de placa positivos diluindo o homogeneizado cerebral infectado para uma diluição de 10-3 em solução de diluição de tecido.
- Remover os grânulos de extracto de esfregaço previamente armazenados a -80 °C e ressuspender com 20-50 μL de solução de diluição tecidual (dependendo da quantidade suspeita de contaminação) pipetando para cima e para baixo cerca de dez vezes, seguido de um breve vórtice. Permita que as amostras fiquem em RT enquanto executam as etapas restantes.
- Carregue 2 μL de controles de placa especificados, incluindo controles de placa negativos (solução de diluição de tecido isolada e homogeneizado cerebral não infectado) e um controle de placa positivo (homogeneizado cerebral infectado) nos poços de placa RT-QuIC.
- Carregar 2 μL de cada extracto de zaragatoa em quatro alvéolos replicados.
7. Análise e resultados do RT-QuIC
- Realize o RT-QuIC de acordo com os protocolos laboratoriais individuais (protocolos opcionais 38,40).
- Defina os parâmetros necessários para determinar a positividade de uma amostra (ver resultados representativos, Figura 5).
NOTA: Esses parâmetros são definidos por cada laboratório. - Registre os resultados na tabela fornecida e tome as medidas apropriadas com base nas melhores práticas laboratoriais (Tabela 1 e Figura Suplementar 2).
Resultados
Descrição escrita dos resultados positivos e negativos (incluindo controles positivos/negativos em placas e swab)
Os swabs de controle negativo são incluídos no swab de vigilância para monitorar a potencial contaminação por príons que pode ser introduzida durante o processo de swab, extração e concentração. A primeira placa RT-QuIC realizada para uma determinada vigilância mensal deve incluir os controles de swab positivo e negativo. Os controlos negativos bem sucedidos não ultrapassam o limiar de fluorescência positivo (figura 6A). Esse resultado indicaria que a contaminação não foi introduzida durante os procedimentos experimentais. Extratos de swab de controle positivo bem-sucedidos exibiriam semeadura positiva em todos os poços replicados para uma determinada amostra (swabs de controle positivo foram contaminados com o homogeneizado cerebral de cepa de encefalopatia de vison transmissível adaptado a hamster Hyper (HY TME). A inclusão de uma série de diluições de controlo positivo permite determinar a sensibilidade da detecção de priões para um dado ensaio (figura 6A).
Ao examinar amostras de extrato de swab de superfície, as superfícies que não apresentam semeadura acima do limite de fluorescência positivo predeterminado podem ser consideradas príon negativo (Figura 6B). Por outro lado, os extratos de swab de superfície contaminados com príons mostrarão capacidades de semeadura acima do limite de fluorescência positivo, embora a razão do ponto máximo (MPR) e o tempo de fluorescência possam variar em comparação com o controle positivo da placa incluído (Figura 6B). A capacidade do método de avaliar a desinfecção adequada é destacada pelas superfícies contaminadas com príon tratadas com alvejante, que agora não conseguem semear RT-QuIC (Figura 6B).
É importante ressaltar que, embora nosso laboratório defina uma amostra positiva como uma amostra que ultrapassa o limite de fluorescência positiva definido em pelo menos metade dos poços replicados, é necessário que cada laboratório defina seus próprios padrões. A taxa de formação de amilóide (RAF) e o tempo de fluorescência também podem ser usados para ajudar a estabelecer limites de positividade específicos do laboratório.
Observamos resultados de artefatos de superfície que ultrapassam o limiar de fluorescência positivo, mas com curvas cinéticas alteradas e após um tempo anormalmente longo para fluorescência em comparação com amostras de controle positivo (Figura 6C). Esses resultados devem ser interpretados com cautela, pois podem ser causados pela presença de poeira ou produtos químicos residuais presentes em uma superfície. Esses achados destacam a necessidade de limpeza geral do laboratório, bem como critérios para diferenciar entre semeadura verdadeiro positivo e falso positivo.
O descarte de resíduos sólidos e líquidos de risco biológico deve ser feito seguindo as diretrizes atuais de descarte de risco biológico de uma determinada instituição. As técnicas comuns de desinfecção de príons incluem tratamento com hidróxido de sódio, hipoclorito de sódio (alvejante) ou autoclavagem a 134 °C por 18 min 43,44,45,46.
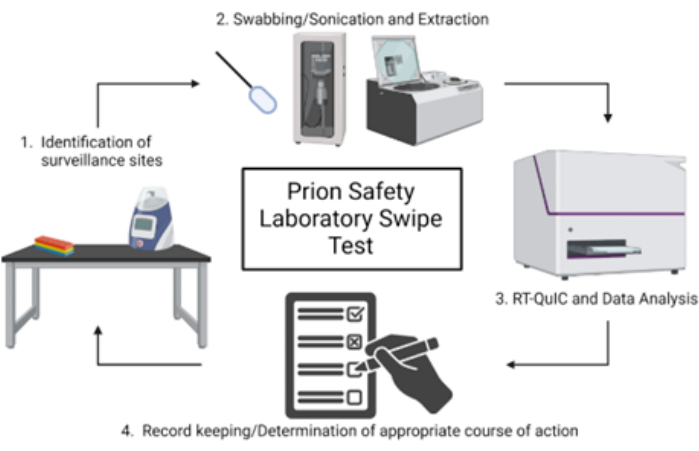
Figura 1: Visão geral esquemática do teste de furto do laboratório de segurança de príons. Clique aqui para ver uma versão maior desta figura.
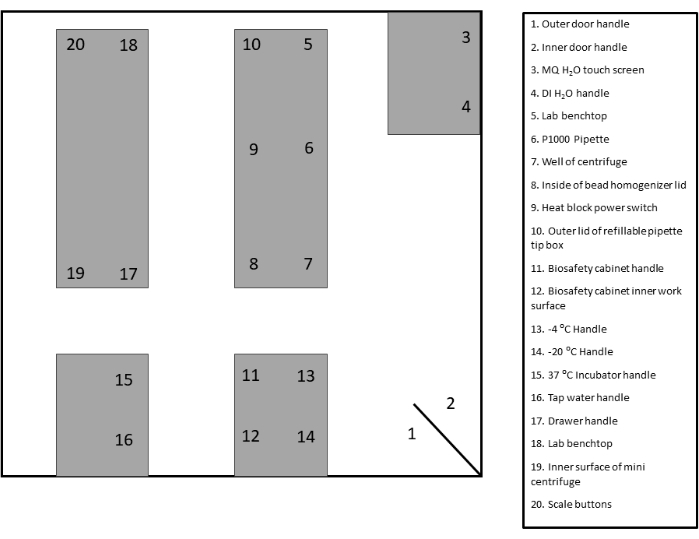
Figura 2: Exemplo de layout do site de swab. Clique aqui para ver uma versão maior desta figura.
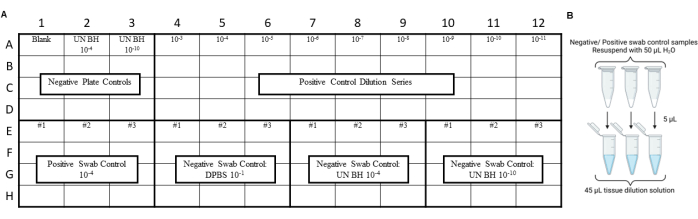
Figura 3: O projeto de experimento de amostra para controles de swab incluiu teste de swipe de laboratório de segurança de príon. (A) Layout de amostra para controles de extrato de swab negativo e positivo. (B) Os controles de extrato de swab negativo e positivo devem ser ressuspensos com 50 μL de H2O. Deve ser gerada uma diluição de 10 vezes do extracto de esfregaço ressuspenso diluindo-o numa solução de diluição tecidual. Clique aqui para ver uma versão maior desta figura.
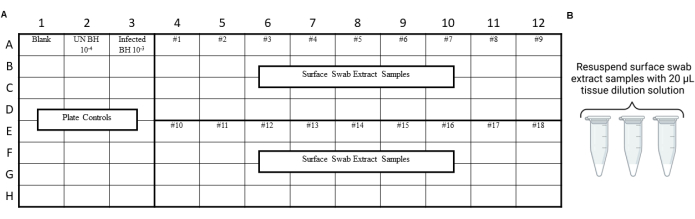
Figura 4: Projeto de experimento de amostra para extratos de swab de superfície do teste de furto de laboratório de segurança de príons. (A) Layout da amostra para extratos de swab de superfície. (B) As amostras de extrato de swab de superfície devem ser ressuspensas com 20 μL de solução de diluição de tecido. Clique aqui para ver uma versão maior desta figura.
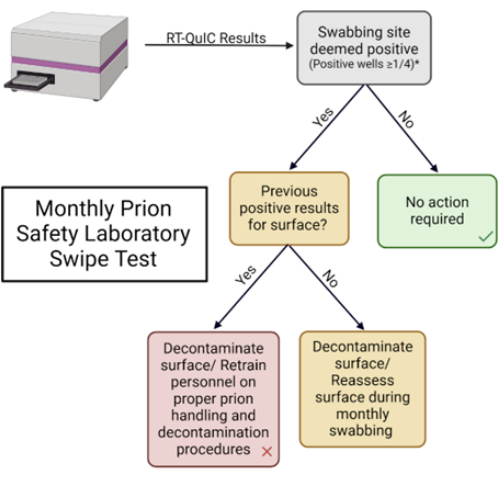
Figura 5: Teste mensal de furto de laboratório de segurança de príons. Fluxograma usado para interpretar os resultados e determinar a resposta apropriada. Clique aqui para ver uma versão maior desta figura.
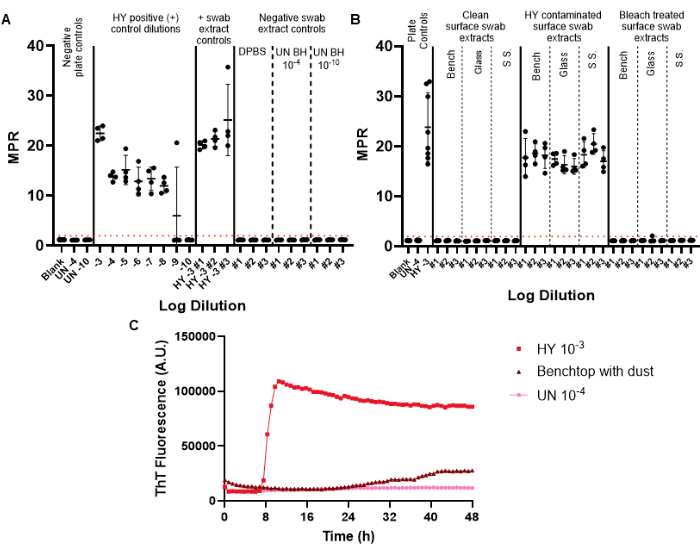
Figura 6: Experimento de swab de superfície representativo. (A) Placa de controle de swab de superfície contendo controles de extrato de swab negativo em triplicata (DPBS, homogeneizado de cérebro de hamster não infectado 10-4 e 10-10) e controles de extrato de swab positivo em triplicata (homogeneizado cerebral HY 10-3). (B) Extratos de swab representativos para superfícies de bancada, vidro e aço inoxidável (SS) que foram esfregadas antes da contaminação, após a contaminação com HY 10-3 e após o tratamento com alvejante de superfícies contaminadas. (C) Comparação de rastreamento de fluorescência de homogeneizado cerebral não infectado 10-4, homogeneizado cerebral HY 10-3 e o extrato de swab da bancada revestido com uma fina película de poeira. Os controles de placa negativa para os painéis A e B incluem um branco (solução de diluição de tecido) e um homogeneizado de cérebro de hamster não infectado 10-4. O painel B inclui a adição de homogeneizado cerebral não infectado 10-4 e o controle positivo da placa do homogeneizado cerebral HY 10-3. Um limiar de fluorescência positivo (ilustrado por uma linha tracejada vermelha) foi determinado como sendo 2. A razão do ponto máximo (MPR) relatada é a fluorescência máxima dividida pela leitura inicial de fluorescência obtida pelo leitor de placas. Cada ponto representa uma réplica técnica do poço para um determinado tipo de amostra. A média e o desvio padrão são apresentados. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Exemplo de formulário de documentação mensal do local de swab. Clique aqui para baixar esta tabela.
Figura suplementar 1: Modelo de layout do site de swabbing. Clique aqui para baixar este arquivo.
Figura suplementar 2: Formulário de documentação mensal do local de swabbing. Clique aqui para baixar este arquivo.
Discussão
O método de esfregaço de segurança de príons descrito pode ser usado para melhorar as medidas de segurança de príons existentes. Este método pode monitorar espaços e equipamentos de laboratório de príons, bem como espaços de laboratório compartilhados, quanto à potencial contaminação por príons. É importante ressaltar que este método pode ser adaptado para testar técnicas de desinfecção específicas de laboratório para verificar a descontaminação de superfícies contaminadas com príons. Como várias cepas de príons exibem diferentes sensibilidades às técnicas de desinfecção, esse método pode confirmar que essas técnicas são eficazes para experimentos laboratoriais atuais, como tratamento com hidróxido de sódio ou hipoclorito de sódio (alvejante) 43 , 44 .
As principais etapas dessa metodologia incluem a identificação de locais de coleta apropriados que fornecerão uma amostra de áreas de alto tráfego, bem como áreas a serem monitoradas que podem estar envolvidas com a contaminação cruzada de experimentos a jusante. Além disso, os laboratórios devem utilizar controles positivos e negativos que reflitam de perto aqueles comumente usados em um determinado laboratório ou clínica. Por exemplo, se estiver trabalhando com príons de roedores, os controles positivos e negativos devem corresponder a essa espécie. Por fim, os dados de vigilância devem ser mantidos atualizados e organizados de forma que as tendências de positividade possam ser facilmente identificadas, permitindo assim a mitigação e o retreinamento da equipe do laboratório em caso de resultados positivos consistentes para uma determinada área.
Uma limitação deste protocolo é a geração potencial de resultados errôneos de RT-QuIC. Dada a natureza sensível do RT-QuIC, a presença de detergentes residuais, sal e outras substâncias nas superfícies do laboratório pode afetar o resultado da reação39. No geral, dada essa observação, é vantajoso que as superfícies permaneçam livres de substâncias que possam interferir no RT-QuIC, como sal residual, detergentes e poeira. À medida que as melhorias na metodologia RT-QuIC se tornam disponíveis, prevemos que muitas das limitações atuais do RT-QuIC serão resolvidas. Portanto, incentivamos o usuário final a se manter atualizado com a literatura para aproveitar as melhorias mais recentes no RT-QuIC.
Um dos principais benefícios desse método para laboratórios que pesquisam príons é a capacidade de minimizar a contaminação que pode afetar os resultados de ensaios de amplificação sensíveis. As ferramentas de necropsia são comumente desinfetadas antes de serem reutilizadas para futuras necropsias. O método de swab descrito fornece um método para avaliar as ferramentas de necropsia quanto à infectividade residual do príon que pode afetar os resultados a jusante. Isso pode fornecer um nível adicional de rigor aos experimentos para excluir a possibilidade de que a detecção de príons nos tecidos não tenha sido devido à contaminação das ferramentas de necropsia.
Divulgações
J.C.B. e Q.Y. são inventores de um pedido de patente referente à tecnologia de swab de superfície de príons.
Agradecimentos
O trabalho foi apoiado por uma doação da Creutzfeldt Jacob Disease Foundation. Os financiadores não tiveram nenhum papel no desenho do estudo, coleta e interpretação de dados, ou na decisão de submeter o trabalho para publicação.
Materiais
| Name | Company | Catalog Number | Comments |
| Fisherbrand PurSwab Foam Swabs | Fisher brand | Catalog #14-960-3E | |
| Milli-Q IQ 7005 Ultrapure Water System | MilliporeSigma | Q7005T0C | |
| Mini-centrifuge, 6000 rpm | Southern Labware | MLX-306 | |
| Omega plate reader | BMG Labtech | FLUOstar Omega plate reader | |
| Q700 sonicator | QSonica | Q700-110 | |
| Recombinant hamster prion protein | MNPRO | MNPROtein-Hamster | syrian hamster, amino acids 90-231 |
| Savant speedvac | Thermo Scientific | SPD1030-230 | |
| Silica nanospheres (50 nm) | nano Composix | SISN50-25M |
Referências
- Prusiner, S. B. Novel proteinaceous infectious particles cause scrapie. Science. 216 (4542), 136-144 (1982).
- Bolton, D. C., McKinley, M. P., Prusiner, S. B. Identification of a protein that purifies with the scrapie prion. Science. 218 (4579), 1309-1311 (1982).
- Oesch, B., et al. A cellular gene encodes scrapie PrP 27-30 protein. Cell. 40 (4), 735-746 (1985).
- Caughey, B., Raymond, G. The scrapie-associated form of PrP is made from a cell surface precursor that is both protease- and phospholipase-sensitive. J Biol Chem. 266 (27), 18217-18223 (1991).
- Deleault, N. R., Harris, B. T., Rees, J. R., Supattapone, S. Formation of native prions from minimal components in vitro. Proc Natl Acad Sci U S A. 104 (23), 9741-9746 (2007).
- Gajdusek, D. C., Zigas, V. Degenerative disease of the central nervous system in New Guinea: the endemic occurrence of "kuru" in the native population. N Engl J Med. 257, 974-978 (1957).
- Centers for Disease Control. Fatal degenerative neurologic disease in patients who received pituitary-derived human growth hormone. MMWR Morb Mortal Wkly Rep. 34, 359-361 (1985).
- Duffy, P., Wolf, J., Collins, G., DeVoe, A. G., Streeten, B., Cowen, D. Letter: possible person-to-person transmission of Creutzfeldt-Jakob disease. N Engl J Med. 290 (12), 692-693 (1974).
- Brown, P., et al. Iatrogenic Creutzfeldt-Jakob disease at the millennium. Neurology. 55 (8), 1075-1081 (2000).
- Huillard d'Aignaux, J., et al. Incubation period of Creutzfeldt-Jakob disease in human growth hormone recipients in France. Neurology. 53 (6), 1197-1201 (1999).
- Marzewski, D. J., Towfighi, J., Harrington, M. G., Merril, C. R., Brown, P. Creutzfeldt-Jakob disease following pituitary-derived human growth hormone therapy: a new American case. Neurology. 38, 1131-1133 (1988).
- Hannah, E. L., et al. Creutzfeldt-Jakob disease after receipt of a previously unimplicated brand of dura mater graft. Neurology. 56 (8), 1080-1083 (2001).
- Shimizu, S., et al. Creutzfeldt-Jakob disease with florid-type plaques after cadaveric dura mater grafting. Arch Neurol. 56 (3), 357-362 (1999).
- Antoine, J. C., et al. Creutzfeldt-Jakob disease after extracranial dura mater embolization for a nasopharyngeal angiofibroma. Neurology. 48 (5), 1451-1453 (1997).
- Esmonde, T., Lueck, C. J., Symon, L., Duchen, L. W., Will, R. G. Creutzfeldt-Jakob disease and lyophilised dura mater grafts: report of two cases. J Neurol Neurosurg Psychiatry. 56, 999-1000 (1993).
- Willison, H. J., Gale, A. N., McLaughlin, J. E. Creutzfeldt-Jakob disease following cadaveric dura mater graft. J Neurol Neurosurg Psychiatry. 54, 940 (1991).
- Diringer, H., Braig, H. R. Infectivity of unconventional viruses in dura mater. Lancet. 334, 439-440 (1989).
- Peden, A. H., Head, M. W., Ritchie, D. L., Bell, J. E., Ironside, J. W. Preclinical vCJD after blood transfusion in a PRNP codon 129 heterozygous patient. Lancet. 364 (9433), 527-529 (2004).
- Will, R. G., Matthews, W. B. Evidence for case-to-case transmission of Creutzfeldt-Jakob disease. J Neurol Neurosurg Psychiatry. 45, 235-238 (1982).
- el Hachimi, K. H., Chaunu, M. P., Cervenakova, L., Brown, P., Foncin, J. F. Putative neurosurgical transmission of Creutzfeldt-Jakob disease with analysis of donor and recipient: agent strains. C R Acad Sci III. 320 (4), 319-328 (1997).
- Alper, T., et al. Does the agent of scrapie replicate without nucleic acid. Nature. 214, 764-766 (1967).
- Casassus, B. France halts prion research amid safety concerns. Science. 373 (6554), 475-476 (2021).
- Brandel, J. P., et al. Variant Creutzfeldt-Jakob disease diagnosed 7.5 years after occupational exposure. N Engl J Med. 383 (1), 83-85 (2020).
- Flechsig, E., Hegyi, I., Enari, M., Schwarz, P., Collinge, J., Weissmann, C. Transmission of scrapie by steel-surface-bound prions. Mol Med. 7 (10), 679-684 (2001).
- Zobeley, E., Flechsig, E., Cozzio, A., Enari, M., Weissmann, C. Infectivity of scrapie prions bound to a stainless steel surface. Mol Med. 5 (4), 240-243 (1999).
- Brown, P., Gajdusek, D. C. Survival of scrapie virus after 3 years' interment. Lancet. 337 (8736), 269-270 (1991).
- Seidel, B., et al. Scrapie agent (strain 263K) can transmit disease via the oral route after persistence in soil over years. PLoS One. 2 (5), e435 (2007).
- Maddison, B. C., et al. Environmental sources of scrapie prions. J Virol. 84 (21), 11560-11562 (2010).
- Pritzkow, S., Morales, R., Lyon, A., Concha-Marambio, L., Urayama, A., Soto, C. Efficient prion disease transmission through common environmental materials. J Biol Chem. 293 (9), 3363-3373 (2018).
- Alper, T., Cramp, W., Haig, D., Clarke, M. Does the agent of scrapie replicate without nucleic acid. Nature. 214 (90), 764-766 (1967).
- Bernoulli, C., et al. Danger of accidental person-to-person transmission of Creutzfeldt-Jakob disease by surgery. Lancet. 309 (8009), 478-479 (1977).
- Brown, P., Rohwer, R. G., Green, E. M., Gajdusek, D. C. Effect of chemicals, heat, and histopathologic processing on high- infectivity hamster-adapted scrapie virus. J Infect Dis. 145 (5), 683-687 (1982).
- Brown, P., et al. Chemical disinfection of Creutzfeldt-Jakob disease virus. N Engl J Med. 306, 1279-1282 (1982).
- Dickinson, A. G., Taylor, D. M. Resistance of scrapie agent to decontamination. N Engl J Med. 299, 1413-1414 (1978).
- Hunter, G. D., Millson, G. C. Studies on the heat stability and chromatographic behavior of the scrapie agent. J Gen Microbiol. 37, 251-258 (1964).
- Pattison, I. H. Resistance of the scrapie agent to formalin. J Comp Pathol. 75, 159-164 (1965).
- Fraser, H., Farquhar, C., McConnell, I., Davies, D. The scrapie disease process is unaffected by ionising radiation. Prog Clin Biol Res. 317, 653-658 (1989).
- Yuan, Q., et al. Sensitive detection of chronic wasting disease prions recovered from environmentally relevant surfaces. Environ Int. 166, 107347 (2022).
- Simmons, S. M., et al. Rapid and sensitive determination of residual prion infectivity from prion-decontaminated surfaces. mSphere. 9, e00504-e00524 (2024).
- Orru, C. D., et al. Sensitive detection of pathological seeds of alpha-synuclein, tau and prion protein on solid surfaces. PLoS Pathog. 20 (4), e1012175 (2024).
- Wilham, J. M., et al. Rapid end-point quantitation of prion seeding activity with sensitivity comparable to bioassays. PLoS Pathog. 6 (12), e1001217 (2010).
- Srivastava, A., et al. Enhanced quantitation of pathological alpha-synuclein in patient biospecimens by RT-QuIC seed amplification assays. PLoS Pathog. 20 (9), e1012554 (2024).
- Hughson, A. G., et al. Inactivation of prions and amyloid seeds with hypochlorous acid. PLoS Pathog. 12 (9), e1005914 (2016).
- Williams, K., Hughson, A. G., Chesebro, B., Race, B. Inactivation of chronic wasting disease prions using sodium hypochlorite. PLoS One. 14 (10), e0223659 (2019).
- Taylor, D. M. Autoclaving standards for Creutzfeldt-Jakob disease agent [letter]. Ann Neurol. 22 (4), 557-558 (1987).
- Brown, P., Rohwer, R. G., Gajdusek, D. C. Newer data on the inactivation of scrapie virus or Creutzfeldt-Jakob disease virus in brain tissue. J Infect Dis. 153 (6), 1145-1148 (1986).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados