Method Article
Prion 안전 연구소 스와이프 테스트
요약
실험실 환경에서 일반적으로 사용되는 영역을 프리온 오염 및 효과적인 오염 제거를 평가하는 방법은 부족합니다. 여기에 설명된 프로토콜은 특정 실험실의 개별 요구 사항을 충족하도록 쉽게 수정할 수 있는 실험실 프리온 안전 스와이프 테스트를 구현하기 위한 핵심 기본 사항을 제공합니다.
초록
의인성 프리온 질환의 전염은 오염된 신경외과 도구, 이식 재료 및 프리온에 오염된 실험실 도구에 대한 직업적 노출로 인해 발생했습니다. 프리온은 프리온 단백질의 정상적인 세포 형태인 PrPC가 잘못 접힌 병원성 형태인 PrPSc 로 잘못 접힘으로써 질병을 일으키며 항상 치명적입니다. 의인성 및 직업성 프리온 전염을 줄이는 것은 어려운 일입니다. 첫째, 프리온은 표면에 결합하여 장기간 동안 지속될 수 있습니다. 둘째, 프리온은 불활성화에 대한 저항력이 매우 높습니다. 이를 감안할 때 표면은 비효율적인 오염 제거 후 장기간 감염성을 유지할 수 있습니다. 이는 프리온 실험실 작업자에게 잠재적인 직업적 위험을 초래할 수 있을 뿐만 아니라 민감한 프리온 증폭 기술을 사용하는 실험실 실험을 교차 오염시킬 수 있습니다. 프리온 안전 실험실 스와이프 테스트에 대해 여기에 설명된 프로토콜에는 교통량이 많은 실험실 구역의 식별 및 문서화 단계, 결과의 유효성을 보장하기 위한 권장 면봉 대조군, 양성 표면 면봉 부위에 대한 적절한 반응을 식별하는 단계, 프리온 스와이프 테스트의 대표 결과 및 잠재적인 아티팩트 결과가 포함됩니다. 전반적으로 프리온 안전 실험실 스와이프 테스트는 표면의 오염 제거를 평가하고, 프리온 오염에 대한 공용 공간을 모니터링하고, 프리온 오염 제거 상태에 대한 문서화를 구현하기 위해 더 광범위한 프리온 안전 프로그램의 일부로 구현될 수 있습니다.
서문
프리온 질환은 알려진 치료법이나 치료법이 없는 치명적인 신경퇴행성 질환입니다. 프리온 질환은 프리온 단백질 1,2,3,4,5, PrP C의 정상 세포 형태의 잘못 접힌 병원성 형태인 PrPSc에 의해 발생합니다. 프리온 질병은 인간과 다른 여러 동물 종에 영향을 미치는 것으로 알려져 있습니다. 인간 프리온병의 하나인 크로이츠펠트-야콥병(CJD)은 산발성, 유전성, 후천성의 세 가지 원인으로 알려져 있습니다. 후천성 CJD는 우발적인 전염(의인성 및 직업적 전염)의 결과로 발생할 수 있으며, 파푸아뉴기니6의 포어(Fore)족에서 쿠루(Kuru)의 원인으로 생각된다.
프리온 전염은 프리온에 오염된 의료기기 및 이식 물질과 관련이 있습니다 7,8,9,10,11,12,13,14,15,16,17. CJD의 의원성 전염은 혈액, 조직 또는 프리온으로 오염된 표면을 통해 발생할 수 있습니다 18,19,20. 예를 들어, 의원성 CJD는 CJD의 전임상 단계에 있는 개인에게 이전에 사용된 전극으로 뇌파를 촬영한 후 나중에 CJD21에 굴복한 환자에서 발생할 수 있습니다. 보다 최근에는 실험실 기반 직업 전염이 발생했는데, 실험실 작업자가 양에 적응한 BSE에 감염된 동물의 뇌 조각을 처리하는 데 사용되는 집게로 피부를 뚫어 프리온 질병에 감염되었습니다22,23. 이러한 전염 시나리오는 프리온 샘플이 처리되는 임상, 실험실 및 진단 실험실 환경에서 발생할 수 있습니다.
프리온은 일반적인 소독 기술에 저항하며 장기간 표면에 남아 감염성을 유지할 수 있습니다 24,25,26,27,28,29. 에탄올, 페놀 세척제, 과산화수소, 다양한 형태의 방사선 및 포름 알데히드의 사용과 같은 일반적인 소독 기술은 프리온의 비활성화에 부적절하여 표면이 감염성을 유지할 수 있습니다 30,31,32,33,34,35,36,37. 이러한 특성은 의인성 및 직업적 노출 동안 프리온의 전파에 기여합니다.
환경 프리온을 검출하는 방법은 최근에 와서야 개발되었습니다. 실시간 떨림 유도 변환(RT-QuIC)과 결합된 환경 면봉 방법은 비효율적인 소독 후 일반적인 실험실 표면뿐만 아니라 환경 표면에서 잔류 프리온 감염성을 평가할 수 있습니다 38,39,40,41,42. 여기에서는 이 기술을 보다 광범위한 프리온 안전 프로그램에 통합할 수 있는 방법을 설명합니다. 전반적으로 이 방법은 실험실에 의존하는 소독 프로토콜의 모니터링, 오염 상태에 대한 조사 및 적절한 문서화를 가능하게 할 수 있으며, 이는 교차 오염을 최소화하여 실험의 타당성을 보장하는 데 도움이 될 수 있으며, 프리온 오염에 대한 공유 사용 공간 평가, 일반적으로 오염되는 영역을 기반으로 인력에 대한 방향성 재교육을 가능하게 합니다.
프로토콜
동물과 관련된 모든 절차는 Creighton University Institutional Animal Care and Use Committee에 의해 승인되었으며 실험실 동물의 관리 및 사용 가이드를 준수했습니다.
참고: 프리온 안전 실험실 스와이프 테스트의 개략적인 개요는 그림 1에 나와 있습니다.
1. 면봉 부위 선정 및 표면 면봉 준비
- 면봉 채취를 위한 적절한 감시 영역을 식별하고 레이블을 지정합니다. 설명서 및 참조용으로 제공된 템플릿을 참조하십시오(그림 2 및 보충 그림 1).
- 식별된 각 영역에 대해 2개의 1.5mL 마이크로 원심분리 튜브를 준비합니다. 3.2단계에서 사용하기 위해 Dulbecco의 인산염 완충 식염수 250μL를 첫 번째 마이크로 원심분리 튜브 세트에 추가합니다. 두 번째 미세 원심분리기 튜브 세트를 4.3단계에서 사용할 수 있도록 비워 둡니다.
- 프리온 오염이 없는 장소에 보관된 거품 면봉을 회수하십시오.
- 2.1단계에서 사용할 Milli-Q 물(MQ, H, 2O)이 담긴 스퀴즈 병을 준비합니다.
2. 양성 및 음성 대조군 면봉 준비
- 관련 대조군 유형을 사용하여 양성 및 음성 면봉 대조군에 대한 희석을 준비합니다. 예: 양성 대조군의 경우, Dulbecco의 인산염 완충 식염수(DPBS)에서 프리온에 감염된 뇌 균질산염을 1% 희석하여 준비합니다. 음성 대조군의 경우, DPBS의 양성 대조군과 동일한 종의 감염되지 않은(UN) 뇌 균질산염(BH)을 0.1% 희석하여 준비합니다.
- 깨끗한 장갑을 사용하여 깨끗한 포장에서 적절한 수의 면봉을 꺼내고 손잡이 쪽을 튜브 랙에 놓고 팁이 다른 면봉이나 표면에 닿지 않도록 거품 면봉의 간격을 주의합니다. 각 대조군 샘플에 대해 3개의 면봉을 준비합니다. 각 샘플 사이에 장갑을 교체하십시오.
- 깨끗한 면봉을 손잡이에 잡고 각각 50μL의 양성 및 음성 대조군 샘플을 면봉 팁에 도포합니다. 완전한 흡수를 위해 면봉 끝의 양쪽에 바르십시오.
알림: 튜브 랙에서 깨끗한 면봉을 제거하기 전에 항상 장갑을 교체하십시오. - 가위를 사용하여 면봉의 여분의 손잡이(길이의 약 1/2)를 자르고 폼 팁 부분이 아래를 향하도록 하여 면봉을 예압된 미세 원심분리기 튜브에 넣습니다. 폼 팁이 DPBS에 잠겨 있고 손잡이가 미세 원심분리기 튜브의 뚜껑을 완전히 닫을 수 있도록 적절하게 절단되었는지 확인하십시오.
- 장갑을 교체한 후 모든 샘플이 적용될 때까지 대조군 샘플을 계속 적용합니다.
3. 표면 면봉
- 깨끗한 폼 팁 면봉의 손잡이를 잡고 폼 팁에 MQ H2O를 미리 적시고 여분을 털어냅니다. 면봉의 축축한 거품 끝을 감시를 위해 선택한 영역에 놓고 면봉 끝을 표면에서 회전시키면서 해당 영역을 앞뒤로 약 10번 면봉으로 닦습니다.
- 가위를 사용하여 면봉의 여분의 손잡이(길이의 약 1/2)를 자르고 폼 팁 부분이 아래를 향하도록 하여 면봉을 예압된 미세 원심분리기 튜브에 넣습니다. 폼 팁이 DPBS에 잠겨 있고 손잡이가 미세 원심분리기 튜브의 뚜껑을 완전히 닫을 수 있도록 적절하게 절단되었는지 확인하십시오.
- 장갑을 버리고 각 면봉 부위 앞에 새 장갑을 끼워 교차 오염 가능성을 최소화하십시오.
- 감시를 위해 선택한 모든 영역을 면봉으로 채취할 때까지 절차를 반복합니다.
4. 면봉 추출 및 진공 농도
알림: 기기가 예열될 수 있도록 사용 30분 전에 진공 농축기를 켜십시오.
- 마이크로 원심분리기 튜브를 원형 튜브 랙에 놓습니다. 마이크로퓨지 튜브 랙을 컵 혼 초음파 발생기 수조에 놓습니다. 미세 원심분리기 튜브 내의 DPBS에 있는 거품 면봉이 컵 혼의 물 표면 아래에 있는지 확인합니다(손잡이 부분을 물에 잠길 필요는 없음). 다음 설정을 적용하십시오: ~75-85와트에서 총 실행 시간(5초 켜기, 5초 끄기).
- 초음파 처리 후 튜브를 약 15초 동안 원심분리하여 이송하기 전에 튜브 바닥에서 DPBS를 수집합니다.
- 250 μL로 설정된 P1000 피펫을 사용하여 마이크로 원심분리기 튜브 바닥에서 모든 액체(면봉 추출물)를 조심스럽게 수집하고 사전 라벨링된 두 번째 빈 세트에서 해당 마이크로 원심분리기 튜브로 옮깁니다. 피펫 팁을 사용하여 거품 팁에서 과도한 액체를 짜냅니다. 면봉이 들어 있는 빈 튜브는 버리십시오.
- 진공 농축기에서 다음 설정을 지정합니다: 온도: 45 °C, 가열 시간: 15분, 작동 시간: 2시간, 진공: 5.1.
- 면봉 추출물이 들어 있는 마이크로 원심분리기 튜브를 진공 농축기에 넣고 튜브가 균형을 이루고 모든 튜브 캡이 열려 있는지 확인합니다.
- 주기가 완료되면 샘플이 완전히 농축되었는지 확인합니다(펠릿만 남음). RT-QuIC에 사용될 때까지 펠릿을 -80°C에서 보관하십시오.
참고: 경우에 따라 완전한 농축을 보장하기 위해 추가 진공 농축 시간이 필요할 수 있습니다. 농축된 모든 샘플을 제거하고 액체가 여전히 들어 있는 튜브만 남깁니다. 농축기 내의 나머지 튜브를 재조정하고 샘플이 완전히 농축될 때까지 추가로 1시간 단위로 실행합니다.
5. RT-QuIC에 사용하기 위한 면봉 제어 준비
알림: RT-QuIC 제어는 면봉, 추출 또는 농축 절차 중에 오염이 발생하지 않았는지 확인하기 위해 환경 면봉 추출물을 분석하기 전에 수행해야 합니다. 레이아웃의 예는 그림 3 및 그림 4를 참조하십시오.
- 조직 희석 용액(N2-0.1%SDS/PBS)에 적절한 농도로 희석하여 적절한 음성 RT-QuIC 플레이트 제어(예: 감염되지 않은 뇌 균질산물[UN BH])를 준비합니다. 조직 희석 용액에서 프리온에 감염된 뇌 균질산염을 10-3 의 희석액으로 희석하여 positive plate control 희석액을 준비합니다.
- 이전에 저장된 대조군 면봉 추출물 펠릿을 -80°C에서 제거하고 약 10회 위아래로 피펫팅한 다음 간단히 볼텍싱하여 50μL의 MQ H2O를 각각 재현탁합니다. 나머지 단계를 수행하는 동안 샘플을 실온(RT)에 둡니다.
- negative plate control(조직 희석 용액 단독 및 uninfected brain homogenate) 및 positive plate control(감염된 brain homogenate)을 포함하여 지정된 plate control의 2μL를 로드합니다.
- 각 양성 및 음성 면봉 추출물 기술 복제를 최소 4개의 복제 RT-QuIC 플레이트 웰에 2μL를 로드합니다.
참고: 음성 면봉 대조군에서 양성 판정에 대한 실험실의 기준을 초과하는 RT-QuIC 파딩이 나타나는 경우, 이는 면봉, 추출 및 농축 과정에서 오염이 유입되었으며 면봉 실험을 다시 수행해야 함을 나타냅니다
6. RT-QuIC에 사용하기 위한 시료 준비
- 조직 희석 용액(N2-0.1%SDS/PBS)에 적절한 농도로 희석하여 적절한 음판 제어(예: 감염되지 않은 뇌 균질화, 감염되지 않은 림프절 등)를 준비합니다. 감염된 뇌 균질산물을 조직 희석 용액에서 10-3 의 희석으로 희석하여 양성 플레이트 대조군을 준비합니다.
- 이전에 보관된 면봉 추출물 펠릿을 -80°C에서 제거하고 20-50μL의 조직 희석 용액(의심되는 오염량에 따라 다름)으로 약 10회 위아래로 피펫팅한 다음 간단히 와류하여 재현탁합니다. 나머지 단계를 수행하는 동안 샘플이 RT에 놓이도록 합니다.
- 음성 플레이트 대조군(조직 희석 용액 단독 및 감염되지 않은 뇌 균질산염) 및 양성 평판 대조군(감염된 뇌 균질산염)을 포함하여 지정된 플레이트 제어 2μL를 RT-QuIC 플레이트 웰에 로드합니다.
- 각 면봉 추출물 2μL를 4개의 복제 웰에 로드합니다.
7. RT-QuIC 분석 및 결과
- 개별 실험실 프로토콜(옵션 프로토콜38,40)에 따라 RT-QuIC를 수행합니다.
- 샘플의 양성을 결정하는 데 필요한 매개변수를 정의합니다(대표 결과, 그림 5 참조).
참고: 이러한 매개변수는 각 랩에서 정의합니다. - 제공된 표에 결과를 기록하고 실험실 모범 사례에 따라 적절한 조치를 취합니다(표 1 및 보충 그림 2).
결과
양성 및 음성 결과에 대한 서면 설명(양성/음성 플레이트 및 면봉 대조군 포함)
음성 대조군 면봉은 면봉, 추출 및 농축 과정에서 유입될 수 있는 잠재적인 프리온 오염을 모니터링하기 위해 감시 면봉에 포함됩니다. 주어진 월간 감시를 위해 수행되는 첫 번째 RT-QuIC 플레이트에는 양성 및 음성 면봉 대조군이 포함되어야 합니다. 성공적인 음성 대조군은 양성 형광 임계값을 넘지 못합니다(그림 6A). 이 결과는 실험 절차 중에 오염이 발생하지 않았음을 나타냅니다. 성공적인 양성 대조군 면봉 추출물은 주어진 샘플에 대한 모든 복제 웰에서 양성 파종을 나타냅니다(양성 대조군 면봉은 햄스터 적응 전염성 밍크 뇌병증 균주 Hyper(HY TME) 뇌 균질산염으로 오염되었습니다. positive control dilution series를 포함하면 주어진 실험에 대한 프리온 검출의 민감도를 측정할 수 있습니다(그림 6A).
표면 면봉 추출물 샘플을 검사할 때 미리 결정된 양성 형광 임계값 이상으로 시딩을 보여주지 않는 표면은 프리온 음성으로 간주될 수 있습니다(그림 6B). 반대로, 프리온에 오염된 표면 면봉 추출물은 양성 형광 임계값 이상의 파종 능력을 보여주지만, 최대점 비율(MPR) 및 형광 시간은 포함된 양성 플레이트 대조군에 비해 다를 수 있습니다(그림 6B). 적절한 소독을 평가하는 방법의 능력은 표백제로 처리된 프리온 오염 표면에서 강조되며, 이 표면은 현재 RT-QuIC를 파종하지 못합니다(그림 6B).
중요한 것은 우리 실험실에서 양성 샘플을 복제 우물의 절반 이상에서 설정된 양성 형광 임계값을 통과하는 샘플로 정의하지만 각 실험실마다 자체 표준을 설정해야 한다는 것입니다. 아밀로이드 형성 속도(RAF)와 형광 시간도 양성에 대한 실험실별 임계값을 설정하는 데 사용할 수 있습니다.
우리는 양성 형광 임계값을 통과하지만 운동 곡선이 변경되고 양성 대조군 샘플에 비해 비정상적으로 오랜 시간 후에 형광이 나타나는 표면 아티팩트 결과를 관찰했습니다(그림 6C). 이러한 결과는 표면에 존재하는 먼지 또는 잔류 화학 물질의 존재로 인해 발생할 수 있으므로 신중하게 해석해야 합니다. 이러한 결과는 일반적인 실험실 청결의 필요성과 진양성(true positive)과 위양성(false positive) 파종을 구별하는 기준을 강조합니다.
고체 및 액체 생물학적 위험 폐기물의 처리는 해당 기관의 현재 생물학적 위험 처리 지침에 따라 수행되어야 합니다. 일반적인 프리온 소독 기술에는 수산화나트륨, 차아염소산나트륨(표백제) 또는 134°C에서 18분 동안 오토클레이빙 처리가 포함됩니다 43,44,45,46.
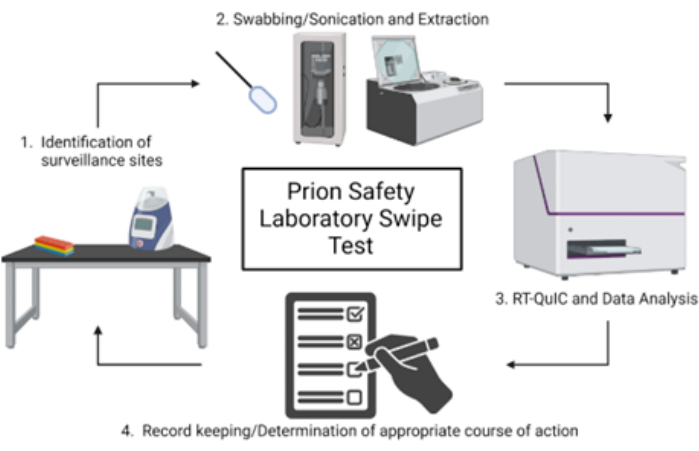
그림 1: 프리온 안전성 실험실 스와이프 테스트의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
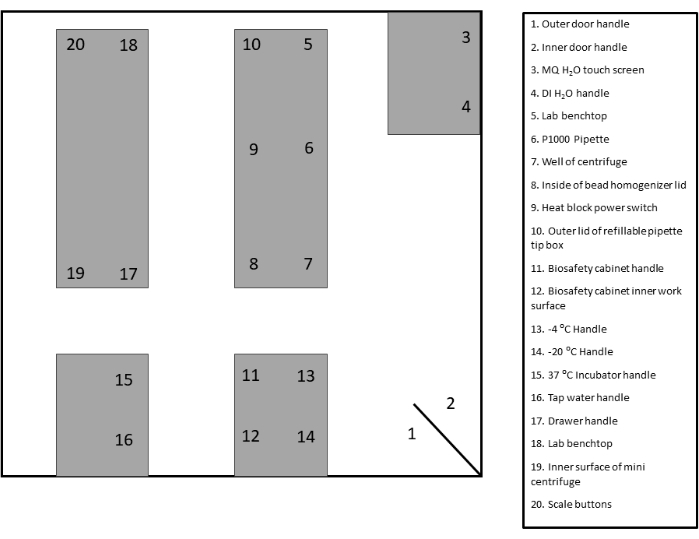
그림 2: 샘플 면봉 부위 레이아웃. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
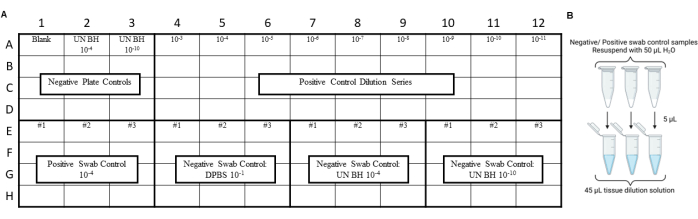
그림 3: 면봉 대조군을 위한 샘플 실험 설계에는 프리온 안전성 실험실 스와이프 테스트가 포함되었습니다. (A) 음성 및 양성 면봉 추출물 대조군을 위한 샘플 레이아웃. (B) 음성 및 양성 면봉 추출물 대조군은 50μL의H2O로 재현탁해야 합니다. 재현탁된 면봉 추출물을 조직 희석 용액으로 희석하여 10배 희석해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
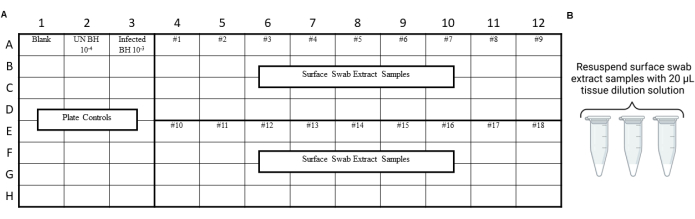
그림 4: 프리온 안전 실험실 스와이프 테스트에서 표면 면봉 추출물에 대한 샘플 실험 설계. (A) 표면 면봉 추출물에 대한 샘플 레이아웃. (B) 표면 면봉 추출물 샘플은 20μL의 조직 희석 용액으로 재현탁해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
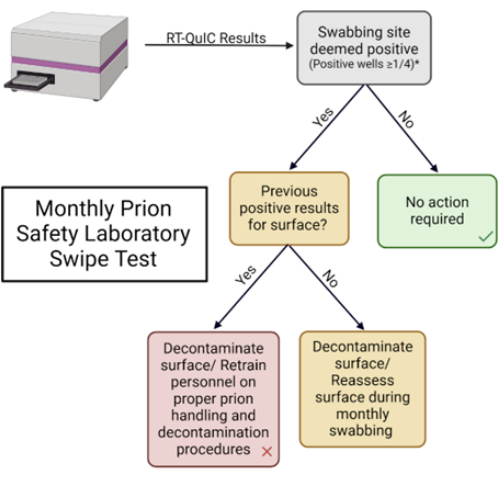
그림 5: 월간 프리온 안전 실험실 스와이프 테스트. 결과를 해석하고 적절한 응답을 결정하는 데 사용되는 순서도입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
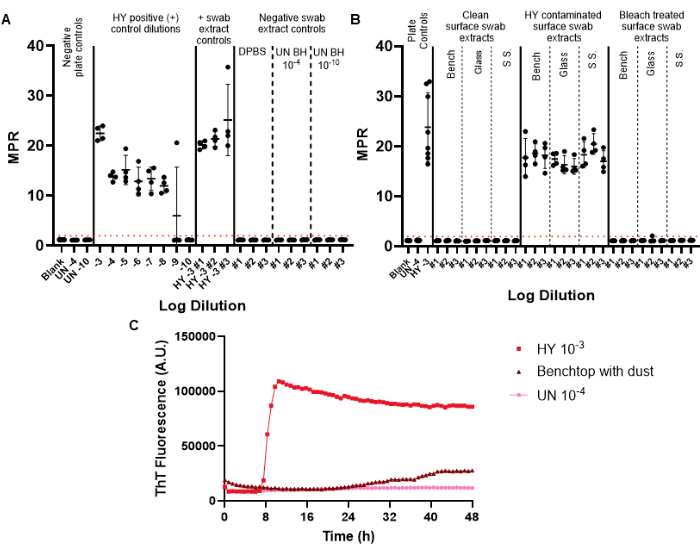
그림 6: 대표적인 표면 면봉 실험. (A) 음성 면봉 추출물 대조군을 삼중(DPBS, 감염되지 않은 햄스터 뇌 균질화 10-4 및 10-10) 및 양성 면봉 추출물 대조군을 삼중(HY 뇌 균질화 10-3)으로 포함하는 표면 면봉 조절판. (B) 오염 전, HY 10-3 오염 후, 오염된 표면의 표백제 처리 후 면봉으로 면봉 채취한 벤치탑, 유리 및 스테인리스강(SS) 표면에 대한 대표적인 면봉 추출물. (C) 감염되지 않은 뇌 균질산염 10-4, HY 뇌 균질액 10-3 및 미세한 먼지 필름으로 코팅된 탁상에서 추출한 면봉 추출물의 형광 추적 비교. 패널 A와 B에 대한 음극판 대조군에는 블랭크(조직 희석 용액)와 감염되지 않은 햄스터 뇌 균질화 10-4가 포함됩니다. 패널 B는 감염되지 않은 뇌 균질화 10-4의 첨가 및 HY 뇌 균질화 10-3의 양성 플레이트 제어를 포함합니다. 양성 형광 역치(빨간색 점선으로 표시)는 2로 결정되었습니다. 보고된 최대점 비율(MPR)은 최대 형광을 플레이트 리더에서 얻은 초기 형광 판독값으로 나눈 값입니다. 각 점은 주어진 표본 유형에 대한 하나의 기술 우물 반복을 나타냅니다. 평균과 표준 편차가 제시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 샘플 면봉 사이트 월간 문서 양식. 이 표를 다운로드하려면 여기를 클릭하십시오.
보충 그림 1: 스왑 사이트 레이아웃 템플릿. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 면봉 사이트 월간 문서 양식. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
설명된 프리온 안전 면봉 방법은 기존 프리온 안전 조치를 강화하는 데 사용할 수 있습니다. 이 방법은 프리온 실험실 공간 및 장비뿐만 아니라 공유 실험실 공간에서도 잠재적인 프리온 오염을 모니터링할 수 있습니다. 중요한 것은 이 방법을 적용하여 프리온으로 오염된 표면의 오염 제거를 확인하기 위해 실험실별 소독 기술을 테스트하는 데 적용할 수 있다는 것입니다. 다양한 프리온 균주가 소독 기술에 대해 서로 다른 민감도를 나타내기 때문에 이 방법은 이러한 기술이 수산화나트륨 또는 차아염소산나트륨(표백제) 43,44 처리와 같은 현재 실험실 실험에 효과적임을 확인할 수 있습니다.
이 방법론의 주요 단계에는 실험의 다운스트림 교차 오염과 관련될 수 있는 모니터링 영역뿐만 아니라 트래픽이 많은 영역의 샘플을 제공할 적절한 면봉 사이트를 식별하는 것이 포함됩니다. 또한 실험실은 해당 실험실이나 클리닉에서 일반적으로 사용되는 대조군을 밀접하게 반영하는 양성 및 음성 대조군을 활용해야 합니다. 예를 들어, 설치류 프리온으로 작업하는 경우 양성 및 음성 대조군은 해당 종과 일치해야 합니다. 마지막으로, 감시 데이터는 양성 추세를 쉽게 식별할 수 있도록 최신 상태로 유지되고 조직되어야 하며, 이를 통해 특정 영역에서 일관된 양성 결과가 나올 경우 실험실 직원의 완화 및 재교육을 가능하게 해야 합니다.
이 프로토콜의 한 가지 제한 사항은 잘못된 RT-QuIC 결과가 생성될 수 있다는 것입니다. RT-QuIC의 민감한 특성을 감안할 때 실험실 표면에 잔류 세제, 소금 및 기타 물질이 존재하면 반응 결과에 영향을 미칠 수 있습니다39. 전반적으로 이러한 관찰을 감안할 때 표면에 잔류 소금, 세제 및 먼지와 같이 RT-QuIC를 방해할 수 있는 물질이 없는 것이 유리합니다. RT-QuIC 방법론이 개선됨에 따라 현재 RT-QuIC의 한계 중 많은 부분이 해결될 것으로 예상됩니다. 따라서 당사는 최종 사용자가 RT-QuIC의 최신 개선 사항을 활용하기 위해 문헌을 계속 확인할 것을 권장합니다.
프리온을 연구하는 실험실에서 이 방법의 주요 이점은 민감한 증폭 분석 결과에 영향을 미칠 수 있는 오염을 최소화할 수 있다는 것입니다. 부검 도구는 일반적으로 향후 부검을 위해 재사용하기 전에 소독합니다. 설명된 면봉 방법은 다운스트림 결과에 영향을 미칠 수 있는 잔류 프리온 감염성에 대한 부검 도구를 평가하는 방법을 제공합니다. 이는 조직에서 프리온 검출이 부검 도구의 오염으로 인한 것이 아닐 가능성을 배제하기 위해 실험에 추가적인 수준의 엄격함을 제공할 수 있습니다.
공개
J.C.B.와 Q.Y.는 프리온 표면 면봉 기술과 관련된 특허 출원의 발명자입니다.
감사의 말
이 연구는 크로이츠펠트 야콥병 재단(Creutzfeldt Jacob Disease Foundation)의 보조금으로 지원되었습니다. 자금 제공자는 연구 설계, 데이터 수집 및 해석 또는 출판을 위해 연구를 제출하는 결정에 아무런 역할도 하지 않았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Fisherbrand PurSwab Foam Swabs | Fisher brand | Catalog #14-960-3E | |
| Milli-Q IQ 7005 Ultrapure Water System | MilliporeSigma | Q7005T0C | |
| Mini-centrifuge, 6000 rpm | Southern Labware | MLX-306 | |
| Omega plate reader | BMG Labtech | FLUOstar Omega plate reader | |
| Q700 sonicator | QSonica | Q700-110 | |
| Recombinant hamster prion protein | MNPRO | MNPROtein-Hamster | syrian hamster, amino acids 90-231 |
| Savant speedvac | Thermo Scientific | SPD1030-230 | |
| Silica nanospheres (50 nm) | nano Composix | SISN50-25M |
참고문헌
- Prusiner, S. B. Novel proteinaceous infectious particles cause scrapie. Science. 216 (4542), 136-144 (1982).
- Bolton, D. C., McKinley, M. P., Prusiner, S. B. Identification of a protein that purifies with the scrapie prion. Science. 218 (4579), 1309-1311 (1982).
- Oesch, B., et al. A cellular gene encodes scrapie PrP 27-30 protein. Cell. 40 (4), 735-746 (1985).
- Caughey, B., Raymond, G. The scrapie-associated form of PrP is made from a cell surface precursor that is both protease- and phospholipase-sensitive. J Biol Chem. 266 (27), 18217-18223 (1991).
- Deleault, N. R., Harris, B. T., Rees, J. R., Supattapone, S. Formation of native prions from minimal components in vitro. Proc Natl Acad Sci U S A. 104 (23), 9741-9746 (2007).
- Gajdusek, D. C., Zigas, V. Degenerative disease of the central nervous system in New Guinea: the endemic occurrence of "kuru" in the native population. N Engl J Med. 257, 974-978 (1957).
- Centers for Disease Control. Fatal degenerative neurologic disease in patients who received pituitary-derived human growth hormone. MMWR Morb Mortal Wkly Rep. 34, 359-361 (1985).
- Duffy, P., Wolf, J., Collins, G., DeVoe, A. G., Streeten, B., Cowen, D. Letter: possible person-to-person transmission of Creutzfeldt-Jakob disease. N Engl J Med. 290 (12), 692-693 (1974).
- Brown, P., et al. Iatrogenic Creutzfeldt-Jakob disease at the millennium. Neurology. 55 (8), 1075-1081 (2000).
- Huillard d'Aignaux, J., et al. Incubation period of Creutzfeldt-Jakob disease in human growth hormone recipients in France. Neurology. 53 (6), 1197-1201 (1999).
- Marzewski, D. J., Towfighi, J., Harrington, M. G., Merril, C. R., Brown, P. Creutzfeldt-Jakob disease following pituitary-derived human growth hormone therapy: a new American case. Neurology. 38, 1131-1133 (1988).
- Hannah, E. L., et al. Creutzfeldt-Jakob disease after receipt of a previously unimplicated brand of dura mater graft. Neurology. 56 (8), 1080-1083 (2001).
- Shimizu, S., et al. Creutzfeldt-Jakob disease with florid-type plaques after cadaveric dura mater grafting. Arch Neurol. 56 (3), 357-362 (1999).
- Antoine, J. C., et al. Creutzfeldt-Jakob disease after extracranial dura mater embolization for a nasopharyngeal angiofibroma. Neurology. 48 (5), 1451-1453 (1997).
- Esmonde, T., Lueck, C. J., Symon, L., Duchen, L. W., Will, R. G. Creutzfeldt-Jakob disease and lyophilised dura mater grafts: report of two cases. J Neurol Neurosurg Psychiatry. 56, 999-1000 (1993).
- Willison, H. J., Gale, A. N., McLaughlin, J. E. Creutzfeldt-Jakob disease following cadaveric dura mater graft. J Neurol Neurosurg Psychiatry. 54, 940(1991).
- Diringer, H., Braig, H. R. Infectivity of unconventional viruses in dura mater. Lancet. 334, 439-440 (1989).
- Peden, A. H., Head, M. W., Ritchie, D. L., Bell, J. E., Ironside, J. W. Preclinical vCJD after blood transfusion in a PRNP codon 129 heterozygous patient. Lancet. 364 (9433), 527-529 (2004).
- Will, R. G., Matthews, W. B. Evidence for case-to-case transmission of Creutzfeldt-Jakob disease. J Neurol Neurosurg Psychiatry. 45, 235-238 (1982).
- el Hachimi, K. H., Chaunu, M. P., Cervenakova, L., Brown, P., Foncin, J. F. Putative neurosurgical transmission of Creutzfeldt-Jakob disease with analysis of donor and recipient: agent strains. C R Acad Sci III. 320 (4), 319-328 (1997).
- Alper, T., et al. Does the agent of scrapie replicate without nucleic acid. Nature. 214, 764-766 (1967).
- Casassus, B. France halts prion research amid safety concerns. Science. 373 (6554), 475-476 (2021).
- Brandel, J. P., et al. Variant Creutzfeldt-Jakob disease diagnosed 7.5 years after occupational exposure. N Engl J Med. 383 (1), 83-85 (2020).
- Flechsig, E., Hegyi, I., Enari, M., Schwarz, P., Collinge, J., Weissmann, C. Transmission of scrapie by steel-surface-bound prions. Mol Med. 7 (10), 679-684 (2001).
- Zobeley, E., Flechsig, E., Cozzio, A., Enari, M., Weissmann, C. Infectivity of scrapie prions bound to a stainless steel surface. Mol Med. 5 (4), 240-243 (1999).
- Brown, P., Gajdusek, D. C. Survival of scrapie virus after 3 years' interment. Lancet. 337 (8736), 269-270 (1991).
- Seidel, B., et al. Scrapie agent (strain 263K) can transmit disease via the oral route after persistence in soil over years. PLoS One. 2 (5), e435(2007).
- Maddison, B. C., et al. Environmental sources of scrapie prions. J Virol. 84 (21), 11560-11562 (2010).
- Pritzkow, S., Morales, R., Lyon, A., Concha-Marambio, L., Urayama, A., Soto, C. Efficient prion disease transmission through common environmental materials. J Biol Chem. 293 (9), 3363-3373 (2018).
- Alper, T., Cramp, W., Haig, D., Clarke, M. Does the agent of scrapie replicate without nucleic acid. Nature. 214 (90), 764-766 (1967).
- Bernoulli, C., et al. Danger of accidental person-to-person transmission of Creutzfeldt-Jakob disease by surgery. Lancet. 309 (8009), 478-479 (1977).
- Brown, P., Rohwer, R. G., Green, E. M., Gajdusek, D. C. Effect of chemicals, heat, and histopathologic processing on high- infectivity hamster-adapted scrapie virus. J Infect Dis. 145 (5), 683-687 (1982).
- Brown, P., et al. Chemical disinfection of Creutzfeldt-Jakob disease virus. N Engl J Med. 306, 1279-1282 (1982).
- Dickinson, A. G., Taylor, D. M. Resistance of scrapie agent to decontamination. N Engl J Med. 299, 1413-1414 (1978).
- Hunter, G. D., Millson, G. C. Studies on the heat stability and chromatographic behavior of the scrapie agent. J Gen Microbiol. 37, 251-258 (1964).
- Pattison, I. H. Resistance of the scrapie agent to formalin. J Comp Pathol. 75, 159-164 (1965).
- Fraser, H., Farquhar, C., McConnell, I., Davies, D. The scrapie disease process is unaffected by ionising radiation. Prog Clin Biol Res. 317, 653-658 (1989).
- Yuan, Q., et al. Sensitive detection of chronic wasting disease prions recovered from environmentally relevant surfaces. Environ Int. 166, 107347(2022).
- Simmons, S. M., et al. Rapid and sensitive determination of residual prion infectivity from prion-decontaminated surfaces. mSphere. 9, e00504-e00524 (2024).
- Orru, C. D., et al. Sensitive detection of pathological seeds of alpha-synuclein, tau and prion protein on solid surfaces. PLoS Pathog. 20 (4), e1012175(2024).
- Wilham, J. M., et al. Rapid end-point quantitation of prion seeding activity with sensitivity comparable to bioassays. PLoS Pathog. 6 (12), e1001217(2010).
- Srivastava, A., et al. Enhanced quantitation of pathological alpha-synuclein in patient biospecimens by RT-QuIC seed amplification assays. PLoS Pathog. 20 (9), e1012554(2024).
- Hughson, A. G., et al. Inactivation of prions and amyloid seeds with hypochlorous acid. PLoS Pathog. 12 (9), e1005914(2016).
- Williams, K., Hughson, A. G., Chesebro, B., Race, B. Inactivation of chronic wasting disease prions using sodium hypochlorite. PLoS One. 14 (10), e0223659(2019).
- Taylor, D. M. Autoclaving standards for Creutzfeldt-Jakob disease agent [letter]. Ann Neurol. 22 (4), 557-558 (1987).
- Brown, P., Rohwer, R. G., Gajdusek, D. C. Newer data on the inactivation of scrapie virus or Creutzfeldt-Jakob disease virus in brain tissue. J Infect Dis. 153 (6), 1145-1148 (1986).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유