Method Article
Test di strisciamento del laboratorio di sicurezza dei prioni
In questo articolo
Riepilogo
Manca un metodo per valutare le aree comunemente utilizzate in laboratorio per la contaminazione da prioni e un'efficace decontaminazione. Il protocollo qui descritto fornisce i fondamenti chiave per l'implementazione di un test di sicurezza con strisciamento di prioni di laboratorio che può essere facilmente modificato per soddisfare le esigenze individuali di laboratori specifici.
Abstract
La trasmissione della malattia da prioni iatrogeni si è verificata da strumenti neurochirurgici contaminati, materiali da trapianto e esposizione professionale a strumenti di laboratorio contaminati da prioni. I prioni causano la malattia attraverso il ripiegamento errato della normale forma cellulare della proteina prionica, PrPC, nella forma mal ripiegata e patogena PrPSc e sono invariabilmente fatali. Ridurre la trasmissione iatrogena e professionale dei prioni è una sfida. Innanzitutto, i prioni possono legarsi e persistere sulle superfici per lunghi periodi di tempo. In secondo luogo, i prioni sono altamente resistenti all'inattivazione. Detto questo, le superfici possono mantenere l'infettività per lunghi periodi di tempo dopo una decontaminazione inefficace. Questo non solo può rappresentare un potenziale rischio professionale per i lavoratori del laboratorio di prioni, ma potrebbe potenzialmente contaminare gli esperimenti di laboratorio che utilizzano tecniche di amplificazione dei prioni sensibili. Il protocollo qui descritto per un test di scansione di laboratorio per la sicurezza dei prioni include passaggi per l'identificazione e la documentazione di aree di laboratorio ad alto traffico, controlli di tampone raccomandati per garantire la validità dei risultati, passaggi per identificare risposte adeguate a siti di tampone di superficie positivi, risultati rappresentativi del test di strisciamento dei prioni, nonché potenziali risultati artefatti. Nel complesso, il test di strisciamento del laboratorio di sicurezza dei prioni può essere implementato come parte di un più ampio programma di sicurezza dei prioni per valutare la decontaminazione delle superfici, monitorare gli spazi comuni per la contaminazione da prioni e implementare la documentazione dello stato di decontaminazione dei prioni.
Introduzione
Le malattie da prioni sono invariabilmente malattie neurodegenerative fatali senza alcun trattamento o cura nota. Le malattie da prioni sono causate da PrPSc, la forma mal ripiegata e patogena della normale forma cellulare della proteina prionica 1,2,3,4,5, PrP C. È noto che le malattie da prioni colpiscono l'uomo e molte altre specie animali. Una malattia da prioni umana, la malattia di Creutzfeldt-Jakob, CJD, ha tre eziologie note: sporadica, ereditaria e acquisita. La CJD acquisita può verificarsi a seguito di una trasmissione accidentale (iatrogena e professionale) e si ritiene che sia la causa del Kuru nel popolo Fore della Papua Nuova Guinea6.
La trasmissione di prioni è stata associata a dispositivi medici contaminati da prioni e materiali da trapianto 7,8,9,10,11,12,13,14,15,16,17. La trasmissione iatrogena della CJD può avvenire attraverso il sangue, i tessuti o da superfici contaminate da prioni 18,19,20. Ad esempio, la CJD iatrogena può svilupparsi in pazienti a seguito di un elettroencefalogramma con elettrodi precedentemente utilizzati su un individuo nella fase preclinica della CJD che poi ha ceduto alla CJD21. La trasmissione professionale di laboratorio più recente si è verificata anche quando un lavoratore di laboratorio ha contratto la malattia da prioni tramite una puntura cutanea con una pinza utilizzata per maneggiare fette di cervello di un animale infetto da BSE22,23 adattata alle pecore. Tali scenari di trasmissione potrebbero verificarsi all'interno di ambienti clinici, di laboratorio e di laboratorio diagnostici in cui vengono manipolati campioni di prioni.
I prioni resistono alle comuni tecniche di disinfezione e possono persistere e rimanere infettivi sulle superfici per lunghi periodi di tempo 24,25,26,27,28,29. Le comuni tecniche di disinfezione come l'uso di etanolo, detergenti fenolici, perossido di idrogeno, varie forme di radiazioni e formaldeide sono inadeguate per l'inattivazione dei prioni, consentendo alle superfici di mantenere l'infettività 30,31,32,33,34,35,36,37 . Queste caratteristiche contribuiscono alla trasmissione dei prioni durante l'esposizione iatrogena e professionale.
I metodi per il rilevamento dei prioni ambientali sono stati sviluppati solo di recente. Un metodo di tampone ambientale accoppiato con la conversione indotta dal terremoto in tempo reale (RT-QuIC) può valutare l'infettività residua dei prioni dalle superfici ambientali e dalle comuni superfici di laboratorio a seguito di una disinfezione inefficace 38,39,40,41,42. Qui, descriviamo come questa tecnica può essere incorporata in un più ampio programma di sicurezza contro i prioni. Nel complesso, questo metodo può consentire il monitoraggio dei protocolli di disinfezione dipendenti dal laboratorio, l'indagine e la documentazione adeguata dello stato di contaminazione, che può aiutare a garantire la validità degli esperimenti riducendo al minimo la contaminazione incrociata, la valutazione degli spazi di utilizzo condiviso per la contaminazione da prioni e consente la riqualificazione direzionale del personale in base alle aree comunemente contaminate.
Protocollo
Tutte le procedure che coinvolgono gli animali sono state approvate e conformi alla Guida per la cura e l'uso degli animali da laboratorio dal Comitato istituzionale per la cura e l'uso degli animali della Creighton University.
NOTA: Una panoramica schematica del test di strisciamento del laboratorio di sicurezza dei prioni è mostrata nella Figura 1.
1. Selezione dei siti di tamponamento e preparazione per il tampone di superficie
- Identificare ed etichettare le aree di sorveglianza appropriate per il tampone. Fare riferimento al modello fornito per la documentazione e il riferimento (Figura 2 e Figura supplementare 1).
- Preparare due provette per microcentrifuga da 1,5 ml per ciascuna delle aree identificate. Aggiungere 250 μl di soluzione salina tamponata con fosfato di Dulbecco al primo set di provette per microcentrifuga da utilizzare nella fase 3.2. Lasciare che il secondo set di provette per microcentrifuga rimanga vuoto per l'uso al punto 4.3.
- Recuperare i tamponi con punta in schiuma dallo stoccaggio in un'area priva di contaminazione da prioni.
- Preparare una bottiglia da spremere con acqua Milli-Q (MQ H2O) da utilizzare al punto 2.1.
2. Preparazione del tampone di controllo positivo e negativo
- Preparare le diluizioni per i controlli con tampone positivo e negativo utilizzando i tipi di controllo pertinenti. Esempio: per un controllo positivo, preparare una diluizione all'1% di omogenato cerebrale infetto da prioni nella soluzione salina tamponata con fosfato di Dulbecco (DPBS). Per il controllo negativo, preparare una diluizione allo 0,1% di omogenato cerebrale (BH) non infetto (UN) della stessa specie del controllo positivo in DPBS.
- Utilizzando guanti puliti, recuperare il numero appropriato di tamponi dalla confezione pulita e posizionare il manico con il lato rivolto verso il basso in un rack per provette, facendo attenzione a distanziare i tamponi di schiuma in modo che le punte non entrino in contatto con altri tamponi o superfici. Per ogni campione di controllo, preparare tre tamponi. Cambiare i guanti tra un campione e l'altro.
- Tenendo un tampone di schiuma pulito per l'impugnatura, applicare 50 μl dei rispettivi campioni di controllo positivi e negativi sulle punte dei tamponi di schiuma. Assicurati di applicare su entrambi i lati della punta del tampone per garantire il completo assorbimento.
NOTA: Cambiare sempre i guanti prima di rimuovere un tampone pulito dal rack per provette. - Usando le forbici, tagliare il manico in eccesso del tampone (circa 1/2 della lunghezza) e posizionare il tampone nella provetta da microcentrifuga precaricata con la parte della punta in schiuma rivolta verso il basso. Assicurarsi che la punta in schiuma sia immersa nel DPBS e che l'impugnatura sia tagliata in modo adeguato per chiudere completamente il coperchio della provetta per microcentrifuga.
- Continuare ad applicare i campioni di controllo dopo aver cambiato i guanti fino a quando tutti i campioni sono stati applicati.
3. Tampone superficiale
- Tenendo un tampone di schiuma pulito per l'impugnatura, prebagnare la punta di schiuma con MQ H2O e scrollarsi di dosso l'eccesso. Posizionare la punta in schiuma inumidita del tampone sull'area scelta per la sorveglianza e tamponare l'area avanti e indietro circa dieci volte ruotando contemporaneamente la punta del tampone sulla superficie.
- Usando le forbici, tagliare il manico in eccesso del tampone (circa 1/2 della lunghezza) e posizionare il tampone nella provetta da microcentrifuga precaricata con la parte della punta in schiuma rivolta verso il basso. Assicurarsi che la punta in schiuma sia immersa nel DPBS e che l'impugnatura sia tagliata in modo adeguato per chiudere completamente il coperchio della provetta per microcentrifuga.
- Gettare i guanti e metterne di nuovi prima di ogni rispettivo sito di tampone per ridurre al minimo la probabilità di contaminazione incrociata.
- Ripetere la procedura fino a quando tutte le aree scelte per la sorveglianza non sono state sottoposte a tampone.
4. Estrazione del tampone e concentrazione sottovuoto
NOTA: Accendere il concentratore sottovuoto 30 minuti prima dell'uso per consentire allo strumento di riscaldarsi.
- Posizionare le provette per microcentrifuga in un rack circolare per provette. Posizionare la rastrelliera per provette microfuge nel bagnomaria del sonicatore a tromba a tazza. Assicurarsi che i tamponi di schiuma nel DPBS all'interno delle provette per microcentrifuga siano sotto la superficie dell'acqua nel corno della tazza (la parte del manico non deve essere sommersa). Applicare le seguenti impostazioni: 15 s di autonomia totale (5 s on, 5 s off) a ~75-85 watt.
- Dopo la sonicazione, centrifugare le provette per circa 15 secondi per raccogliere il DPBS sul fondo della provetta prima del trasferimento.
- Utilizzando una pipetta P1000 impostata su 250 μl, raccogliere con cura tutto il liquido (estratto del tampone) dal fondo della provetta per microcentrifuga e trasferirlo nella provetta per microcentrifuga corrispondente dal secondo set premarcato vuoto. Utilizzare il puntale della pipetta per spremere il liquido in eccesso dal puntale in schiuma. Gettare le provette vuote contenenti tamponi.
- Impostare le seguenti impostazioni sul concentratore a vuoto: Temperatura: 45 °C, Tempo di riscaldamento: 15 min, Tempo di esecuzione: 2 h, Vuoto: 5,1.
- Posizionare le provette per microcentrifuga contenenti estratti di tampone nel concentratore a vuoto, assicurandosi che le provette siano bilanciate e che tutti i tappi delle provette siano aperti.
- Al termine del ciclo, assicurarsi che i campioni siano completamente concentrati (rimane solo il pellet). Conservare i pellet a -80 °C fino al momento dell'utilizzo per RT-QuIC.
NOTA: In alcuni casi, potrebbe essere necessario un tempo di concentrazione del vuoto aggiuntivo per garantire la concentrazione completa. Rimuovere tutti i campioni concentrati, lasciando solo le provette che contengono ancora liquido. Riequilibrare le provette rimanenti all'interno del concentratore ed eseguire con incrementi aggiuntivi di 1 ora fino a quando i campioni non sono completamente concentrati.
5. Preparazione dei controlli di tampone per l'uso in RT-QuIC
NOTA: I controlli RT-QuIC devono essere eseguiti prima del dosaggio degli estratti di tamponi ambientali per garantire che non si sia introdotta contaminazione durante le procedure di tamponamento, estrazione o concentrazione. Per esempi di layout, vedere la Figura 3 e la Figura 4.
- Preparare un appropriato controllo della piastra RT-QuIC negativo (ad es. omogeneizzato cerebrale non infetto [UN BH]) diluendo alla concentrazione appropriata nella soluzione di diluizione tissutale (N2-0,1%SDS/PBS). Preparare una diluizione positiva per il controllo della piastra diluendo l'omogenato cerebrale infetto da prioni a una diluizione di 10-3 in una soluzione di diluizione tissutale.
- Rimuovere i pellet di estratto dal tampone di controllo precedentemente conservati a -80 °C e risospendere ciascuno con 50 μL di MQ H2O pipettando su e giù circa 10 volte, quindi agitando brevemente con un vortice. Lasciare riposare i campioni a temperatura ambiente (RT) durante l'esecuzione dei passaggi rimanenti.
- Caricare 2 μl di controlli su piastra specificati, compresi i controlli su piastra negativi (soluzione di diluizione tissutale da sola e omogeneizzato cerebrale non infetto) e un controllo su piastra positivo (omogenato cerebrale infetto).
- Caricare 2 μL di ciascun tampone positivo e negativo estratto tecnico replicato in un minimo di quattro pozzetti di piastre RT-QuIC replicati.
NOTA: Se i controlli negativi del tampone mostrano una semina RT-QuIC superiore allo standard di un laboratorio per una determinazione positiva, ciò indicherebbe che la contaminazione è stata introdotta durante il processo di tampone, estrazione e concentrazione e che l'esperimento del tampone deve essere eseguito nuovamente
6. Preparazione dei campioni per l'uso in RT-QuIC
- Preparare un appropriato controllo negativo della piastra (ad es. omogeneizzato cerebrale non infetto, linfonodo non infetto, ecc.) diluendo alla concentrazione appropriata nella soluzione di diluizione tissutale (N2-0,1% SDS/PBS). Preparare controlli positivi su piastra diluendo l'omogenato cerebrale infetto a una diluizione di 10-3 in una soluzione di diluizione tissutale.
- Rimuovere i pellet di estratto del tampone precedentemente conservati a una temperatura di -80 °C e risospendere con 20-50 μl di soluzione di diluizione tissutale (a seconda della quantità sospetta di contaminazione) pipettando su e giù circa dieci volte, quindi agitando brevemente a vortici. Lasciare che i campioni rimangano a RT mentre si eseguono i passaggi rimanenti.
- Caricare 2 μL di controlli su piastra specificati, inclusi i controlli su piastra negativi (soluzione di diluizione tissutale da sola e omogenato cerebrale non infetto) e un controllo su piastra positivo (omogenato cerebrale infetto) nei pozzetti per piastre RT-QuIC.
- Caricare 2 μL di ciascun estratto di tampone in quattro pozzetti replicati.
7. Analisi e risultati RT-QuIC
- Eseguire RT-QuIC secondo i protocolli di laboratorio individuali (protocolli opzionali38,40).
- Definire i parametri necessari per determinare la positività di un campione (vedi risultati rappresentativi, Figura 5).
NOTA: Questi parametri sono definiti da ciascun laboratorio. - Registrare i risultati nella tabella fornita e intraprendere le azioni appropriate in base alle migliori pratiche di laboratorio (Tabella 1 e Figura 2 supplementare).
Risultati
Descrizione scritta dei risultati positivi e negativi (compresi i controlli positivi/negativi su piastra e tampone)
I tamponi di controllo negativi sono inclusi nel tampone di sorveglianza per monitorare la potenziale contaminazione da prioni che potrebbe essere introdotta durante il processo di tamponamento, estrazione e concentrazione. La prima piastra RT-QuIC eseguita per una determinata sorveglianza mensile dovrebbe includere i controlli positivi e negativi del tampone. I controlli negativi riusciti non superano la soglia di fluorescenza positiva (Figura 6A). Questo risultato indicherebbe che la contaminazione non è stata introdotta durante le procedure sperimentali. Gli estratti di tampone di controllo positivo riusciti mostrerebbero una semina positiva in tutti i pozzetti replicati per un dato campione (i tamponi di controllo positivi sono stati contaminati con l'omogenato cerebrale di encefalopatia di visone trasmissibile adattato al criceto criceto ceppo Hyper (HY TME). L'inclusione di una serie di diluizioni a controllo positivo consente di determinare la sensibilità della rivelazione dei prioni per un dato esperimento (Figura 6A).
Quando si esaminano campioni di estratti di tamponi superficiali, le superfici che non mostrano una semina al di sopra della soglia di fluorescenza positiva predeterminata possono essere considerate negative ai prioni (Figura 6B). Al contrario, gli estratti di tamponi superficiali contaminati da prioni mostreranno capacità di semina superiori alla soglia di fluorescenza positiva, sebbene il rapporto di punti massimi (MPR) e il tempo alla fluorescenza possano variare rispetto al controllo positivo su piastra incluso (Figura 6B). La capacità del metodo di valutare un'adeguata disinfezione è evidenziata dalle superfici contaminate da prioni trattate con candeggina, che ora non riescono a seminare RT-QuIC (Figura 6B).
È importante sottolineare che, mentre il nostro laboratorio definisce un campione positivo come un campione che supera la soglia di fluorescenza positiva impostata in almeno la metà dei pozzetti replicati, è necessario che ogni laboratorio stabilisca i propri standard. Il tasso di formazione dell'amiloide (RAF) e il tempo alla fluorescenza possono anche essere utilizzati per aiutare a stabilire soglie specifiche di laboratorio per la positività.
Abbiamo osservato risultati di artefatti superficiali che superano la soglia di fluorescenza positiva ma con curve cinetiche alterate e dopo un tempo anormalmente lungo alla fluorescenza rispetto ai campioni di controllo positivi (Figura 6C). Questi risultati devono essere interpretati con cautela in quanto possono essere causati dalla presenza di polvere o sostanze chimiche residue presenti su una superficie. Questi risultati evidenziano la necessità di una pulizia generale del laboratorio, nonché i criteri per distinguere tra seeding vero positivo e falso positivo.
Lo smaltimento dei rifiuti solidi e liquidi a rischio biologico deve essere effettuato seguendo le attuali linee guida per lo smaltimento dei rischi biologici di una determinata istituzione. Le tecniche comuni di disinfezione con prioni includono il trattamento con idrossido di sodio, ipoclorito di sodio (candeggina) o sterilizzazione in autoclave a 134 °C per 18 minuti 43,44,45,46.
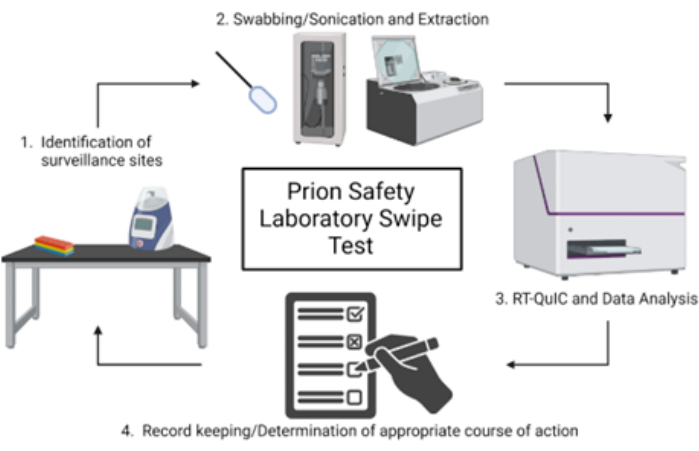
Figura 1: Panoramica schematica del test di strisciamento in laboratorio per la sicurezza dei prioni. Fare clic qui per visualizzare una versione più grande di questa figura.
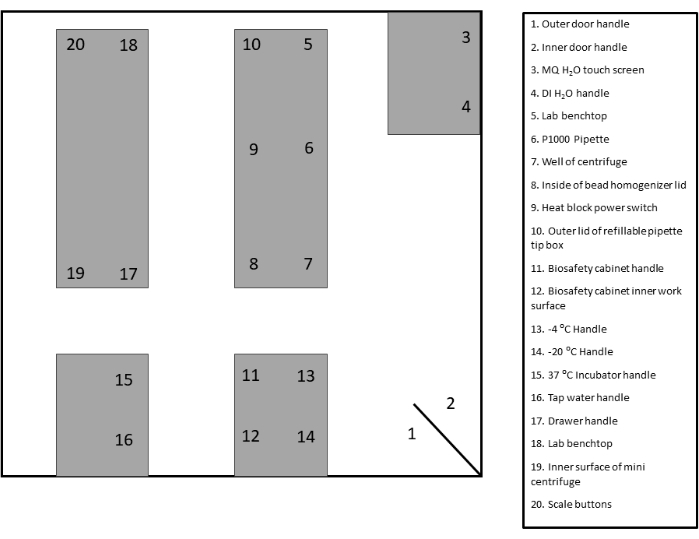
Figura 2: Esempio di layout del sito di tamponamento. Fare clic qui per visualizzare una versione più grande di questa figura.
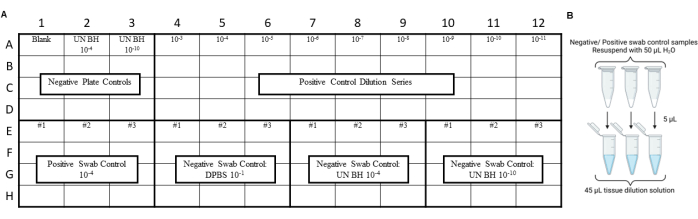
Figura 3: Disegno dell'esperimento di esempio per i controlli con tampone incluso il test di strisciamento in laboratorio per la sicurezza dei prioni. (A) Layout del campione per i controlli negativi e positivi dell'estratto del tampone. (B) I controlli negativi e positivi dell'estratto del tampone devono essere risospesi con 50 μl di H2O. Una diluizione di 10 volte dell'estratto del tampone risospeso deve essere generata diluindolo in una soluzione di diluizione tissutale. Clicca qui per visualizzare una versione più grande di questa figura.
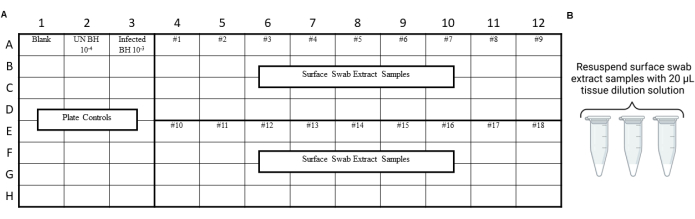
Figura 4: Esempio di disegno dell'esperimento per estratti di tampone di superficie dal test di scansione del laboratorio di sicurezza dei prioni. (A) Schema di esempio per estratti di tampone di superficie. (B) I campioni di estratto del tampone superficiale devono essere risospesi con 20 μl di soluzione di diluizione tissutale. Clicca qui per visualizzare una versione più grande di questa figura.
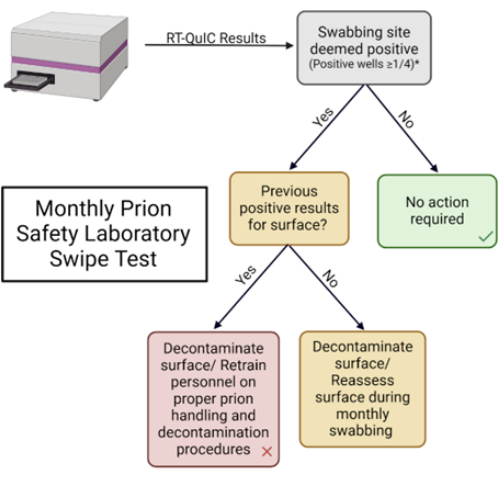
Figura 5: Test mensile di strisciamento del laboratorio per la sicurezza dei prioni. Diagramma di flusso utilizzato per interpretare i risultati e determinare la risposta appropriata. Clicca qui per visualizzare una versione più grande di questa figura.
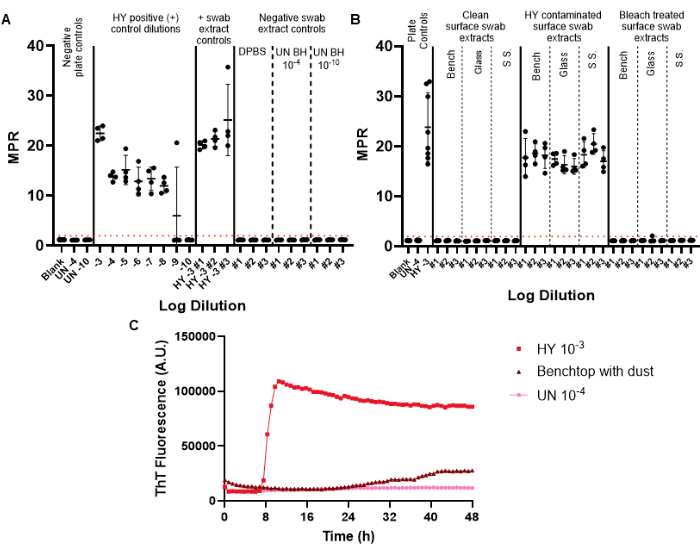
Figura 6: Esperimento rappresentativo di tampone di superficie. (A) Piastra di controllo del tampone di superficie contenente controlli negativi dell'estratto del tampone in triplicato (DPBS, omogeneizzato di cervello di criceto non infetto 10-4 e 10-10) e controlli positivi dell'estratto del tampone in triplicato (HY omogeneizzato cerebrale 10-3). (B) Estratti rappresentativi di tamponi per superfici da banco, vetro e acciaio inossidabile (SS) che sono stati tamponati prima della contaminazione, a seguito di contaminazione con HY 10-3 e dopo il trattamento con candeggina di superfici contaminate. (C) Confronto del tracciato di fluorescenza dell'omogenato cerebrale 10-4 non infetto, dell'omogenato cerebrale HY 10-3 e dell'estratto del tampone dal banco di lavoro rivestito con un sottile film di polvere. I controlli negativi su piastra per i pannelli A e B includono un bianco (soluzione di diluizione tissutale) e un omogeneizzato di cervello di criceto non infetto 10-4. Il pannello B include l'aggiunta dell'omogenato cerebrale 10-4 non infetto e il controllo positivo su piastra dell'omogenato cerebrale HY 10-3. Una soglia di fluorescenza positiva (illustrata da una linea tratteggiata rossa) è stata determinata a 2. Il rapporto di punti massimi (MPR) riportato è la fluorescenza massima divisa per la lettura iniziale della fluorescenza ottenuta dal lettore di piastre. Ogni punto rappresenta una replica tecnica del pozzo per un dato tipo di campione. Vengono presentate la media e la deviazione standard. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Esempio di modulo di documentazione mensile del sito di tampone. Clicca qui per scaricare questa tabella.
Figura supplementare 1: Modello di layout del sito di tampone. Clicca qui per scaricare questo file.
Figura supplementare 2: Modulo di documentazione mensile del sito di tampone. Clicca qui per scaricare questo file.
Discussione
Il metodo di tampone di sicurezza dei prioni descritto può essere utilizzato per migliorare le misure di sicurezza dei prioni esistenti. Questo metodo può monitorare gli spazi e le apparecchiature di laboratorio dei prioni, nonché gli spazi di laboratorio condivisi, per una potenziale contaminazione da prioni. È importante sottolineare che questo metodo può essere adattato per testare tecniche di disinfezione specifiche di laboratorio per verificare la decontaminazione delle superfici contaminate da prioni. Poiché vari ceppi di prioni mostrano diverse sensibilità alle tecniche di disinfezione, questo metodo può confermare che queste tecniche sono efficaci per gli attuali esperimenti di laboratorio, come il trattamento con idrossido di sodio o ipoclorito di sodio (candeggina)43,44.
I passaggi chiave per questa metodologia includono l'identificazione di siti di tampone appropriati che forniranno un campione sia di aree ad alto traffico che di aree da monitorare che potrebbero essere coinvolte nella contaminazione incrociata a valle degli esperimenti. Inoltre, i laboratori dovrebbero utilizzare controlli positivi e negativi che rispecchino da vicino quelli comunemente utilizzati in un determinato laboratorio o clinica. Ad esempio, se si lavora con prioni roditori, i controlli positivi e negativi dovrebbero corrispondere a quella specie. Infine, i dati di sorveglianza dovrebbero essere mantenuti aggiornati e organizzati in modo da poter identificare facilmente le tendenze di positività, consentendo così la mitigazione e la riqualificazione del personale di laboratorio in caso di risultati positivi costanti per una determinata area.
Una limitazione di questo protocollo è la potenziale generazione di risultati RT-QuIC errati. Data la natura sensibile di RT-QuIC, la presenza di residui di detergenti, sale e altre sostanze sulle superfici di laboratorio può influire sull'esito della reazione39. Nel complesso, data questa osservazione, è vantaggioso che le superfici rimangano prive di sostanze che possono interferire con RT-QuIC, come sale residuo, detergenti e polvere. Man mano che saranno disponibili miglioramenti alla metodologia RT-QuIC, prevediamo che molte delle attuali limitazioni di RT-QuIC saranno risolte. Pertanto, incoraggiamo l'utente finale a tenersi aggiornato sulla letteratura per trarre vantaggio dagli ultimi miglioramenti in RT-QuIC.
Un vantaggio chiave di questo metodo per i laboratori di ricerca sui prioni è la capacità di ridurre al minimo la contaminazione che può influire sui risultati dei saggi di amplificazione sensibili. Gli strumenti per necroscopia vengono comunemente disinfettati prima di essere riutilizzati per future necroscopie. Il metodo di tampone descritto fornisce un metodo per valutare gli strumenti di necroscopia per l'infettività residua dei prioni che può influenzare i risultati a valle. Ciò può fornire un ulteriore livello di rigore agli esperimenti per escludere la possibilità che la rilevazione di prioni nei tessuti non sia dovuta alla contaminazione degli strumenti di necroscopia.
Divulgazioni
J.C.B. e Q.Y. sono inventori di una domanda di brevetto relativa alla tecnologia di tampone di superficie con prioni.
Riconoscimenti
Il lavoro è stato sostenuto da una sovvenzione della Creutzfeldt Jacob Disease Foundation. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta e nell'interpretazione dei dati o nella decisione di presentare il lavoro per la pubblicazione.
Materiali
| Name | Company | Catalog Number | Comments |
| Fisherbrand PurSwab Foam Swabs | Fisher brand | Catalog #14-960-3E | |
| Milli-Q IQ 7005 Ultrapure Water System | MilliporeSigma | Q7005T0C | |
| Mini-centrifuge, 6000 rpm | Southern Labware | MLX-306 | |
| Omega plate reader | BMG Labtech | FLUOstar Omega plate reader | |
| Q700 sonicator | QSonica | Q700-110 | |
| Recombinant hamster prion protein | MNPRO | MNPROtein-Hamster | syrian hamster, amino acids 90-231 |
| Savant speedvac | Thermo Scientific | SPD1030-230 | |
| Silica nanospheres (50 nm) | nano Composix | SISN50-25M |
Riferimenti
- Prusiner, S. B. Novel proteinaceous infectious particles cause scrapie. Science. 216 (4542), 136-144 (1982).
- Bolton, D. C., McKinley, M. P., Prusiner, S. B. Identification of a protein that purifies with the scrapie prion. Science. 218 (4579), 1309-1311 (1982).
- Oesch, B., et al. A cellular gene encodes scrapie PrP 27-30 protein. Cell. 40 (4), 735-746 (1985).
- Caughey, B., Raymond, G. The scrapie-associated form of PrP is made from a cell surface precursor that is both protease- and phospholipase-sensitive. J Biol Chem. 266 (27), 18217-18223 (1991).
- Deleault, N. R., Harris, B. T., Rees, J. R., Supattapone, S. Formation of native prions from minimal components in vitro. Proc Natl Acad Sci U S A. 104 (23), 9741-9746 (2007).
- Gajdusek, D. C., Zigas, V. Degenerative disease of the central nervous system in New Guinea: the endemic occurrence of "kuru" in the native population. N Engl J Med. 257, 974-978 (1957).
- Centers for Disease Control. Fatal degenerative neurologic disease in patients who received pituitary-derived human growth hormone. MMWR Morb Mortal Wkly Rep. 34, 359-361 (1985).
- Duffy, P., Wolf, J., Collins, G., DeVoe, A. G., Streeten, B., Cowen, D. Letter: possible person-to-person transmission of Creutzfeldt-Jakob disease. N Engl J Med. 290 (12), 692-693 (1974).
- Brown, P., et al. Iatrogenic Creutzfeldt-Jakob disease at the millennium. Neurology. 55 (8), 1075-1081 (2000).
- Huillard d'Aignaux, J., et al. Incubation period of Creutzfeldt-Jakob disease in human growth hormone recipients in France. Neurology. 53 (6), 1197-1201 (1999).
- Marzewski, D. J., Towfighi, J., Harrington, M. G., Merril, C. R., Brown, P. Creutzfeldt-Jakob disease following pituitary-derived human growth hormone therapy: a new American case. Neurology. 38, 1131-1133 (1988).
- Hannah, E. L., et al. Creutzfeldt-Jakob disease after receipt of a previously unimplicated brand of dura mater graft. Neurology. 56 (8), 1080-1083 (2001).
- Shimizu, S., et al. Creutzfeldt-Jakob disease with florid-type plaques after cadaveric dura mater grafting. Arch Neurol. 56 (3), 357-362 (1999).
- Antoine, J. C., et al. Creutzfeldt-Jakob disease after extracranial dura mater embolization for a nasopharyngeal angiofibroma. Neurology. 48 (5), 1451-1453 (1997).
- Esmonde, T., Lueck, C. J., Symon, L., Duchen, L. W., Will, R. G. Creutzfeldt-Jakob disease and lyophilised dura mater grafts: report of two cases. J Neurol Neurosurg Psychiatry. 56, 999-1000 (1993).
- Willison, H. J., Gale, A. N., McLaughlin, J. E. Creutzfeldt-Jakob disease following cadaveric dura mater graft. J Neurol Neurosurg Psychiatry. 54, 940(1991).
- Diringer, H., Braig, H. R. Infectivity of unconventional viruses in dura mater. Lancet. 334, 439-440 (1989).
- Peden, A. H., Head, M. W., Ritchie, D. L., Bell, J. E., Ironside, J. W. Preclinical vCJD after blood transfusion in a PRNP codon 129 heterozygous patient. Lancet. 364 (9433), 527-529 (2004).
- Will, R. G., Matthews, W. B. Evidence for case-to-case transmission of Creutzfeldt-Jakob disease. J Neurol Neurosurg Psychiatry. 45, 235-238 (1982).
- el Hachimi, K. H., Chaunu, M. P., Cervenakova, L., Brown, P., Foncin, J. F. Putative neurosurgical transmission of Creutzfeldt-Jakob disease with analysis of donor and recipient: agent strains. C R Acad Sci III. 320 (4), 319-328 (1997).
- Alper, T., et al. Does the agent of scrapie replicate without nucleic acid. Nature. 214, 764-766 (1967).
- Casassus, B. France halts prion research amid safety concerns. Science. 373 (6554), 475-476 (2021).
- Brandel, J. P., et al. Variant Creutzfeldt-Jakob disease diagnosed 7.5 years after occupational exposure. N Engl J Med. 383 (1), 83-85 (2020).
- Flechsig, E., Hegyi, I., Enari, M., Schwarz, P., Collinge, J., Weissmann, C. Transmission of scrapie by steel-surface-bound prions. Mol Med. 7 (10), 679-684 (2001).
- Zobeley, E., Flechsig, E., Cozzio, A., Enari, M., Weissmann, C. Infectivity of scrapie prions bound to a stainless steel surface. Mol Med. 5 (4), 240-243 (1999).
- Brown, P., Gajdusek, D. C. Survival of scrapie virus after 3 years' interment. Lancet. 337 (8736), 269-270 (1991).
- Seidel, B., et al. Scrapie agent (strain 263K) can transmit disease via the oral route after persistence in soil over years. PLoS One. 2 (5), e435(2007).
- Maddison, B. C., et al. Environmental sources of scrapie prions. J Virol. 84 (21), 11560-11562 (2010).
- Pritzkow, S., Morales, R., Lyon, A., Concha-Marambio, L., Urayama, A., Soto, C. Efficient prion disease transmission through common environmental materials. J Biol Chem. 293 (9), 3363-3373 (2018).
- Alper, T., Cramp, W., Haig, D., Clarke, M. Does the agent of scrapie replicate without nucleic acid. Nature. 214 (90), 764-766 (1967).
- Bernoulli, C., et al. Danger of accidental person-to-person transmission of Creutzfeldt-Jakob disease by surgery. Lancet. 309 (8009), 478-479 (1977).
- Brown, P., Rohwer, R. G., Green, E. M., Gajdusek, D. C. Effect of chemicals, heat, and histopathologic processing on high- infectivity hamster-adapted scrapie virus. J Infect Dis. 145 (5), 683-687 (1982).
- Brown, P., et al. Chemical disinfection of Creutzfeldt-Jakob disease virus. N Engl J Med. 306, 1279-1282 (1982).
- Dickinson, A. G., Taylor, D. M. Resistance of scrapie agent to decontamination. N Engl J Med. 299, 1413-1414 (1978).
- Hunter, G. D., Millson, G. C. Studies on the heat stability and chromatographic behavior of the scrapie agent. J Gen Microbiol. 37, 251-258 (1964).
- Pattison, I. H. Resistance of the scrapie agent to formalin. J Comp Pathol. 75, 159-164 (1965).
- Fraser, H., Farquhar, C., McConnell, I., Davies, D. The scrapie disease process is unaffected by ionising radiation. Prog Clin Biol Res. 317, 653-658 (1989).
- Yuan, Q., et al. Sensitive detection of chronic wasting disease prions recovered from environmentally relevant surfaces. Environ Int. 166, 107347(2022).
- Simmons, S. M., et al. Rapid and sensitive determination of residual prion infectivity from prion-decontaminated surfaces. mSphere. 9, e00504-e00524 (2024).
- Orru, C. D., et al. Sensitive detection of pathological seeds of alpha-synuclein, tau and prion protein on solid surfaces. PLoS Pathog. 20 (4), e1012175(2024).
- Wilham, J. M., et al. Rapid end-point quantitation of prion seeding activity with sensitivity comparable to bioassays. PLoS Pathog. 6 (12), e1001217(2010).
- Srivastava, A., et al. Enhanced quantitation of pathological alpha-synuclein in patient biospecimens by RT-QuIC seed amplification assays. PLoS Pathog. 20 (9), e1012554(2024).
- Hughson, A. G., et al. Inactivation of prions and amyloid seeds with hypochlorous acid. PLoS Pathog. 12 (9), e1005914(2016).
- Williams, K., Hughson, A. G., Chesebro, B., Race, B. Inactivation of chronic wasting disease prions using sodium hypochlorite. PLoS One. 14 (10), e0223659(2019).
- Taylor, D. M. Autoclaving standards for Creutzfeldt-Jakob disease agent [letter]. Ann Neurol. 22 (4), 557-558 (1987).
- Brown, P., Rohwer, R. G., Gajdusek, D. C. Newer data on the inactivation of scrapie virus or Creutzfeldt-Jakob disease virus in brain tissue. J Infect Dis. 153 (6), 1145-1148 (1986).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon