Method Article
בדיקת החלקה של מעבדת בטיחות פריון
In This Article
Summary
חסרה שיטה להערכת אזורים נפוצים במעבדות לזיהום פריונים וטיהור יעיל. הפרוטוקול המתואר כאן מספק יסודות מרכזיים ליישום בדיקת בטיחות פריון מעבדה שניתן לשנות בקלות כדי לענות על הצרכים האישיים של מעבדות ספציפיות.
Abstract
העברת מחלת פריונים יאטרוגנית התרחשה מכלים נוירוכירורגיים מזוהמים, חומרי השתלה וחשיפה תעסוקתית לכלי מעבדה מזוהמים בפריונים. פריונים גורמים למחלות על ידי קיפול שגוי של הצורה התאית הרגילה של חלבון הפריון, PrPC, לצורה המקופלת והפתוגנית PrPSc והם תמיד קטלניים. הפחתת העברת פריונים יאטרוגניים ותעסוקתיים היא מאתגרת. ראשית, פריונים יכולים להיקשר למשטחים ולהתמיד בהם לפרקי זמן ארוכים. שנית, פריונים עמידים מאוד בפני אי-הפעלה. בהתחשב בכך, משטחים יכולים לשמור על הדבקה לפרקי זמן ארוכים לאחר טיהור לא יעיל. לא רק שזה יכול להוות סיכון תעסוקתי פוטנציאלי עבור עובדי מעבדת פריונים, אלא שזה עלול לזהם ניסויי מעבדה צולבים תוך שימוש בטכניקות הגברה רגישות של פריונים. הפרוטוקול המתואר כאן לבדיקת החלקה של מעבדת בטיחות פריונים כולל שלבים לזיהוי ותיעוד של אזורי מעבדה בעלי תנועה גבוהה, בקרות מטוש מומלצות כדי להבטיח את תקפות התוצאות, צעדים לזיהוי תגובות נאותות לאתרי מטוש משטח חיוביים, תוצאות מייצגות מבדיקת החלקה של פריונים, כמו גם תוצאות מלאכותיות פוטנציאליות. בסך הכל, ניתן ליישם את בדיקת ההחלקה של מעבדת בטיחות פריונים כחלק מתוכנית בטיחות פריונים רחבה יותר להערכת טיהור משטחים, ניטור חללים משותפים לזיהום פריונים ויישום תיעוד מצב טיהור פריונים.
Introduction
מחלות פריון הן תמיד מחלות נוירודגנרטיביות קטלניות ללא טיפול או תרופה ידועים. מחלות פריון נגרמות על ידי PrPSc, הצורה השגויה והפתוגנית של הצורה התאית הרגילה של חלבון הפריון 1,2,3,4,5, PrP C. מחלות פריון ידועות כמשפיעות על בני אדם ועל כמה מינים אחרים של בעלי חיים. למחלת פריונים אנושית אחת, מחלת קרויצפלד-יעקב, CJD, יש שלוש אטיולוגיות ידועות: ספורדיות, תורשתיות ונרכשות. CJD נרכש יכול להתרחש כתוצאה מהעברה מקרית (יאטרוגנית ותעסוקתית) ונחשב כגורם לקורו באנשי פור של פפואה גינאה החדשה6.
העברת פריון נקשרה למכשירים רפואיים מזוהמים בפריון ולחומרי השתלה 7,8,9,10,11,12,13,14,15,16,17. העברה יאטרוגנית של CJD יכולה להתרחש באמצעות דם, רקמות, או ממשטחים מזוהמים פריון 18,19,20. לדוגמה, CJD יאטרוגני יכול להתפתח בחולים בעקבות electroencephalogram עם אלקטרודות בשימוש בעבר על אדם בשלב הפרה-קליני של CJD אשר לאחר מכן נכנע ל- CJD21. שידור תעסוקתי מבוסס מעבדה עדכני יותר התרחש גם כאשר עובד מעבדה נדבק במחלת פריון באמצעות נקב עור עם מלקחיים המשמשים לטיפול בפרוסות מוח מחיה נגועה ב- BSE22,23 מותאם לכבשים. תרחישי העברה כאלה יכולים להתרחש בתוך הגדרות קליניות, מעבדתיות ומעבדות אבחון שבהן דגימות פריון מטופלות.
פריונים עמידים לטכניקות חיטוי נפוצות ויכולים להתמיד ולהישאר מדבקים על משטחים לפרקי זמן ממושכים 24,25,26,27,28,29. טכניקות חיטוי נפוצות כגון שימוש באתנול, חומרי ניקוי פנוליים, מי חמצן, צורות שונות של קרינה ופורמלדהיד אינן מספיקות לנטרול פריונים, ומאפשרות למשטחים לשמור על זיהומיות 30,31,32,33,34,35,36,37 . מאפיינים אלה תורמים להעברת פריונים במהלך חשיפה יאטרוגנית ותעסוקתית.
שיטות לזיהוי פריונים סביבתיים פותחו רק לאחרונה. שיטת ספוג סביבתי בשילוב עם המרה בזמן אמת הנגרמת על ידי רעידות אדמה (RT-QuIC) יכולה להעריך הדבקה שיורית של פריונים ממשטחים סביבתיים כמו גם ממשטחי מעבדה נפוצים לאחר חיטוי לא יעיל 38,39,40,41,42. כאן, אנו מתארים כיצד ניתן לשלב טכניקה זו בתוכנית בטיחות פריונים רחבה יותר. בסך הכל, שיטה זו יכולה לאפשר ניטור של פרוטוקולי חיטוי תלויי מעבדה, חקירה ותיעוד נאות של מצב הזיהום, מה שיכול לעזור להבטיח את תקפות הניסויים על ידי מזעור זיהום צולב, הערכה של מרחבי שימוש משותפים לזיהום פריונים ומאפשר הכשרה מחדש כיוונית של כוח אדם המבוסס על אזורים מזוהמים נפוצים.
Protocol
כל הנהלים המערבים בעלי חיים אושרו ובהתאם למדריך לטיפול ושימוש בחיות מעבדה על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת קרייטון.
הערה: סקירה סכמטית של בדיקת ההחלקה של מעבדת הבטיחות של פריון מוצגת באיור 1.
1. בחירת אתרי ספוגית והכנה למטוש פני השטח
- זהה ותייג אזורי מעקב מתאימים למטוש. עיין בתבנית שסופקה לתיעוד ולעיון (איור 2 ואיור משלים 1).
- הכינו שני צינורות מיקרוצנטריפוגות 1.5 מ"ל לכל אחד מהאזורים שזוהו. הוסף 250 μL של מלח חוצץ פוספט של Dulbecco לקבוצה הראשונה של צינורות microcentrifuge לשימוש בשלב 3.2. תן לקבוצה השנייה של צינורות מיקרוצנטריפוגות להישאר ריקה לשימוש בשלב 4.3.
- יש לאחזר מטושים מוקצפים מאחסון באזור נקי מזיהום פריונים.
- הכינו בקבוק לחיץ עם מי Milli-Q (MQ H2O) לשימוש בשלב 2.1.
2. הכנת מטוש בקרה חיובית ושלילית
- הכינו דילולים לבקרות מטוש חיוביות ושליליות באמצעות סוגי בקרה רלוונטיים. דוגמה: לבקרה חיובית, הכינו דילול של 1% של הומוגנט מוחי נגוע בפריונים במי מלח חוצצי פוספט (DPBS) של Dulbecco. לבקרה שלילית, הכינו דילול של 0.1% של הומוגנט מוחי לא נגוע (UN) (BH) מאותו מין כמו הבקרה החיובית ב-DPBS.
- בעזרת כפפות נקיות, שלפו את המספר המתאים של מטושים מהאריזה הנקייה והניחו את צד הידית כלפי מטה לתוך מתלה צינורות, תוך הקפדה על ריווח מקלוני קצף כך שהקצוות לא יבואו במגע עם מטושים או משטחים אחרים. עבור כל דגימת ביקורת, הכינו שלושה מטושים. החליפו כפפות בין כל דגימה.
- החזקת ספוגית קצף נקייה ליד הידית, יש למרוח 50 μL של דגימות בקרה חיוביות ושליליות בהתאמה על קצות ספוגית הקצף. יש להקפיד למרוח על שני צידי קצה המקלון כדי להבטיח ספיגה מלאה.
הערה: יש להחליף תמיד כפפות לפני הסרת מטוש נקי ממדף הצינורות. - בעזרת מספריים, חותכים את הידית העודפת של המקלון (כ-1/2 מהאורך) ומניחים את המקלון בתוך צינור המיקרוצנטריפוגה הטעון מראש כאשר חלק קצה הקצף מופנה כלפי מטה. ודא שקצה הקצף שקוע ב- DPBS ושהידית נחתכת כראוי כדי לסגור את מכסה צינור המיקרוצנטריפוגה לחלוטין.
- יש להמשיך למרוח דגימות בקרה לאחר החלפת הכפפות עד ליישום כל הדגימות.
3. משטח swabbing
- מחזיקים ספוגית קצף נקייה ליד הידית, מרטיבים מראש את קצה הקצף עם MQ H2O ומנערים את העודפים. הניחו את קצה הקצף הלח של המקלון על האזור שנבחר למעקב ובצעו ספוגית קדימה ואחורה כעשר פעמים תוך סיבוב בו זמנית של קצה המקלון על פני השטח.
- בעזרת מספריים, חותכים את הידית העודפת של המקלון (כ-1/2 מהאורך) ומניחים את המקלון בתוך צינור המיקרוצנטריפוגה הטעון מראש כאשר חלק קצה הקצף מופנה כלפי מטה. ודא שקצה הקצף שקוע ב- DPBS ושהידית נחתכת כראוי כדי לסגור את מכסה צינור המיקרוצנטריפוגה לחלוטין.
- יש להשליך את הכפפות ולהניח כפפות חדשות לפני כל אתר מטוש בהתאמה כדי למזער את ההסתברות לזיהום צולב.
- חזור על ההליך עד שכל האזורים שנבחרו למעקב יימטושו.
4. מיצוי מטושים וריכוז ואקום
הערה: הפעל את רכז הוואקום 30 דקות לפני השימוש כדי לאפשר למכשיר להתחמם.
- הכניסו את צינורות המיקרוצנטריפוגות למתלה צינורות עגול. הניחו את מתלה צינור המיקרופוגה באמבט המים של קרן הכוס. ודא שמקלוני הקצף ב- DPBS בתוך צינורות המיקרוצנטריפוגות נמצאים מתחת לפני המים בקרן הכוס (חלק הידית אינו חייב להיות שקוע). החל את ההגדרות הבאות: זמן פעולה כולל של 15 שניות (5 שניות מופעלות, 5 שניות כבויות) ב~75-85 וואט.
- לאחר הסוניקציה, צנטריפוגו את הצינורות במשך כ-15 שניות כדי לאסוף DPBS בתחתית הצינור לפני ההעברה.
- באמצעות פיפטה P1000 להגדיר 250 μL, בזהירות לאסוף את כל הנוזל (תמצית ספוגית) מתחתית צינור microcentrifuge ולהעביר לתוך צינור microcentrifuge המתאים מן השני, ריק מסומן מראש. השתמשו בקצה פיפטה כדי לסחוט נוזלים עודפים מקצה הקצף. יש להשליך צינורות ריקים המכילים מטושים.
- הגדר את ההגדרות הבאות על רכז הוואקום: טמפרטורה: 45 °C, זמן חום: 15 דקות, זמן הפעלה: 2 שעות, ואקום: 5.1.
- הכניסו את צינורות המיקרוצנטריפוגות המכילות תמציות מטוש לרכז הוואקום, וודאו שהצינורות מאוזנים וכל פקקי הצינוריות פתוחים.
- עם סיום המחזור, ודא כי הדגימות מרוכזות לחלוטין (רק הגלולה נשארת). אחסנו את הכדוריות בטמפרטורה של -80°C עד לשימוש עבור RT-Quic.
הערה: במקרים מסוימים, ייתכן שיידרש זמן ריכוז ואקום נוסף כדי להבטיח ריכוז מלא. הסר את כל הדגימות המרוכזות, והשאיר רק את הצינורות שעדיין מכילים נוזל. אזנו מחדש את הצינורות הנותרים בתוך הרכז והפעילו במרווחים נוספים של שעה עד שהדגימות מרוכזות לחלוטין.
5. הכנת בקרות מטוש לשימוש ב-RT-QuIC
הערה: יש לבצע את בקרות RT-QuIC לפני הבדיקה של תמציות מטוש סביבתיות כדי להבטיח שלא הוצג זיהום במהלך הליכי המטוש, המיצוי או הריכוז. לדוגמה, פריסות, ראו איור 3 ואיור 4.
- הכינו בקרת לוחית RT-QuIC שלילית מתאימה (למשל, הומוגנט מוחי לא נגוע [UN BH]) על ידי דילול לריכוז המתאים בתמיסת דילול רקמות (N2-0.1%SDS/PBS). הכינו דילול שליטה חיובי בצלחת על ידי דילול הומוגנט מוחי נגוע פריונים לדילול של 10-3 בתמיסת דילול רקמות.
- הסר כדורי תמצית ספוגית בקרה שאוחסנו בעבר מ -80 ° C והשהה מחדש כל אחד עם 50 μL של MQ H2O על ידי pipeting למעלה ולמטה בערך 10 פעמים, ולאחר מכן מערבול קצר. אפשר לדגימות לשבת בטמפרטורת החדר (RT) בעת ביצוע השלבים הנותרים.
- עומס 2 μL של פקדי לוחות מוגדרים, כולל בקרות לוחיות שליליות (תמיסת דילול רקמות בלבד והומוגנט מוחי לא נגוע) ובקרת צלחת חיובית (הומוגנט מוח נגוע).
- טען 2 μL מכל תמצית מטוש חיובית ושלילית משוכפלת טכנית למינימום של ארבע בארות צלחת RT-QuIC משוכפלות.
הערה: אם בקרות מטוש שליליות מציגות זריעה RT-QuIC מעל התקן של מעבדה לקביעה חיובית, הדבר מצביע על כך שהזיהום הוכנס במהלך תהליך המטוש, המיצוי והריכוז וכי יש לבצע שוב את ניסוי המטוש
6. הכנת דגימות לשימוש ב- RT-QuIC
- הכינו בקרת פלטה שלילית מתאימה (למשל, הומוגנט מוח לא נגוע, בלוטת לימפה לא נגועה וכו ') על ידי דילול לריכוז המתאים בתמיסת דילול רקמות (N2-0.1% SDS/PBS). הכן בקרות צלחת חיוביות על ידי דילול הומוגנט מוח נגוע לדילול של 10-3 בתמיסת דילול רקמות.
- הסר כדורי תמצית מטוש שאוחסנו בעבר מ -80 ° C והשהה מחדש עם 20-50 μL של תמיסת דילול רקמות (בהתאם לכמות החשודה של זיהום) על ידי pipeting למעלה ולמטה כעשר פעמים, ולאחר מכן מערבול קצר. אפשר לדגימות לשבת ב- RT בעת ביצוע השלבים הנותרים.
- עומס 2 μL של פקדי לוחות שצוינו, כולל בקרות לוחיות שליליות (תמיסת דילול רקמות בלבד והומוגנט מוחי לא נגוע) ובקרת צלחת חיובית (הומוגנט מוח נגוע) לתוך בארות הצלחת RT-QuIC.
- יש להעמיס 2 μL מכל תמצית מטוש לארבע בארות משוכפלות.
7. ניתוח RT-QuIC ותוצאות
- בצע RT-QuIC בהתאם לפרוטוקולי מעבדה נפרדים (פרוטוקולים אופציונליים38,40).
- הגדר את הפרמטרים הדרושים לקביעת החיוביות של מדגם (ראה תוצאות מייצגות, איור 5).
הערה: פרמטרים אלה מוגדרים על ידי כל מעבדה. - רשום תוצאות בטבלה שסופקה ונקוט פעולה מתאימה בהתבסס על שיטות עבודה מומלצות במעבדה (טבלה 1 ואיור משלים 2).
תוצאות
תיאור בכתב של תוצאות חיוביות ושליליות (כולל בקרות לוחית ומטוש חיוביות/שליליות)
מקלוני בקרה שליליים כלולים במקלוני המעקב כדי לפקח על זיהום פריונים פוטנציאלי שיכול להיות מוצג במהלך תהליך המטוש, המיצוי והריכוז. לוחית RT-QuIC הראשונה המבוצעת עבור מעקב חודשי נתון צריכה לכלול את בקרות המטוש החיוביות והשליליות. בקרות שליליות מוצלחות אינן מצליחות לחצות את סף הפלואורסצנטיות החיובית (איור 6A). תוצאה זו תצביע על כך שלא הוכנס זיהום במהלך הליכי הניסוי. תמציות מוצלחות של ספוגית בקרה חיובית יציגו זריעה חיובית בכל הבארות המשוכפלות עבור דגימה נתונה (מקלוני בקרה חיוביים זוהמו בזן אנצפלופתיה מינק המותאם לאוגר Hyper (HY TME) הומוגנט במוח. הכללת סדרת דילול בקרה חיובית מאפשרת לקבוע את הרגישות של זיהוי פריונים עבור ניסוי נתון (איור 6A).
כאשר בוחנים דגימות של תמצית מטוש פני שטח, משטחים שלא מראים זריעה מעל סף הפלואורסצנטיות החיובי שנקבע מראש יכולים להיחשב כשליליים לפריון (איור 6B). לעומת זאת, תמציות מטוש פני שטח מזוהמות בפריון יראו יכולות זריעה מעל סף הפלואורסצנטיות החיובית, אם כי יחס הנקודה המרבית (MPR) והזמן לפלואורסנציה יכולים להשתנות בהשוואה לבקרת הלוחות החיובית הכלולה (איור 6B). היכולת של השיטה להעריך חיטוי הולם מודגשת על-ידי המשטחים המזוהמים של פריונים שטופלו באקונומיקה, שכעת אינם מצליחים לזרוע RT-QuIC (איור 6B).
חשוב לציין, בעוד שהמעבדה שלנו מגדירה דגימה חיובית כדגימה שעוברת את סף הפלואורסצנטיות החיובית שנקבע לפחות במחצית מהבארות המשוכפלות, יש צורך שכל מעבדה תקבע סטנדרטים משלה. קצב היווצרות העמילואיד (RAF) והזמן עד לפלואורסצנטיות יכולים לשמש גם כדי לסייע בקביעת ערכי סף ספציפיים למעבדה לחיוביות.
ראינו תוצאות של ממצאים על פני השטח שעוברות את סף הפלואורסצנטיות החיובית, אבל עם עקומות קינטיות משתנות ולאחר זמן ארוך באופן חריג לפלואורסצנטיות בהשוואה לדגימות ביקורת חיוביות (איור 6C). תוצאות אלה יש לפרש בזהירות כפי שהם עלולים להיגרם על ידי נוכחות של אבק או כימיקלים שיורית נוכח על פני השטח. ממצאים אלה מדגישים את הצורך בניקיון מעבדה כללי, כמו גם קריטריונים להבחנה בין זריעה חיובית אמיתית לזריעה חיובית כוזבת.
סילוק פסולת מסוכנת ביולוגית מוצקה ונוזלית צריך להיעשות בהתאם להנחיות הנוכחיות לסילוק סיכונים ביולוגיים של מוסד נתון. טכניקות חיטוי פריונים נפוצות כוללות טיפול בנתרן הידרוקסידי, נתרן היפוכלוריט (אקונומיקה), או אוטוקלאבינג ב 134 ° C למשך 18 דקות 43,44,45,46.
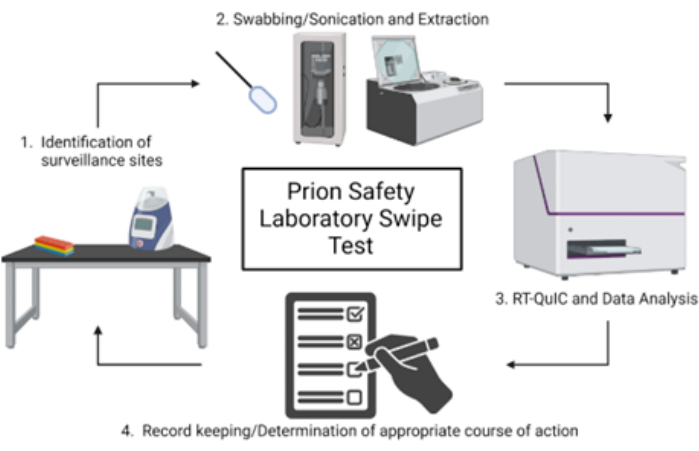
איור 1: סקירה סכמטית של בדיקת החלקה של מעבדת בטיחות פריונים. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
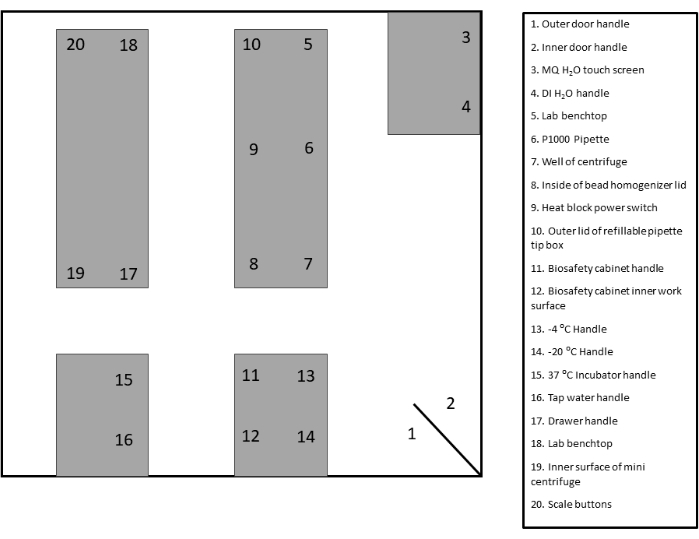
איור 2: פריסת אתר מטוש לדוגמה. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
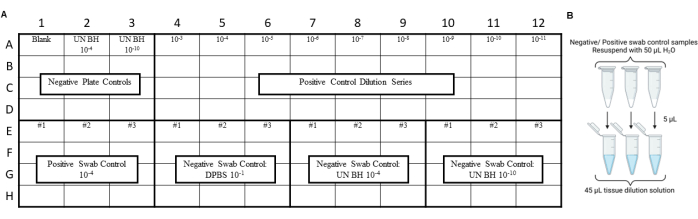
איור 3: תכנון ניסוי לדוגמה עבור בקרות מטוש כלל בדיקת החלקה של מעבדת בטיחות פריונים. (A) פריסת דגימה עבור בקרות תמצית מטוש שליליות וחיוביות. (B) בקרות תמצית מטוש שליליות וחיוביות צריכות להיות מושעות מחדש עם 50 μL של H2O. יש ליצור דילול של פי 10 של תמצית המקלון המרחף מחדש על ידי דילול לתמיסת דילול רקמות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
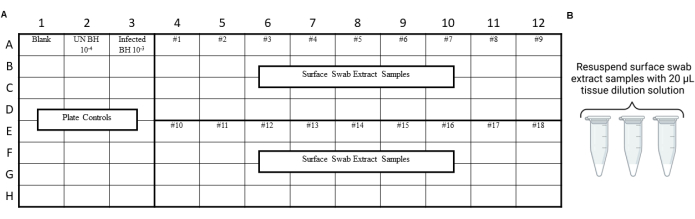
איור 4: תכנון ניסוי לדוגמה עבור תמציות מטוש משטח מבדיקת החלקה של מעבדת בטיחות פריונים. (A) פריסה לדוגמה עבור תמציות מטוש פני שטח. (B) דגימות תמצית מטוש פני השטח צריכות להיות מושעות מחדש עם 20 μL של תמיסת דילול רקמות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
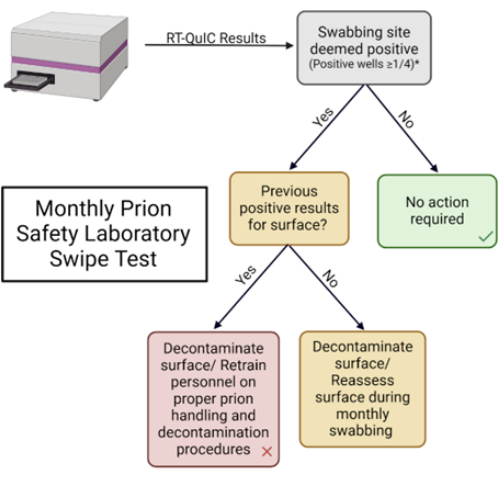
איור 5: בדיקת החלקה חודשית של מעבדת בטיחות פריונים. תרשים זרימה המשמש לפירוש תוצאות ולקביעת תגובה מתאימה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
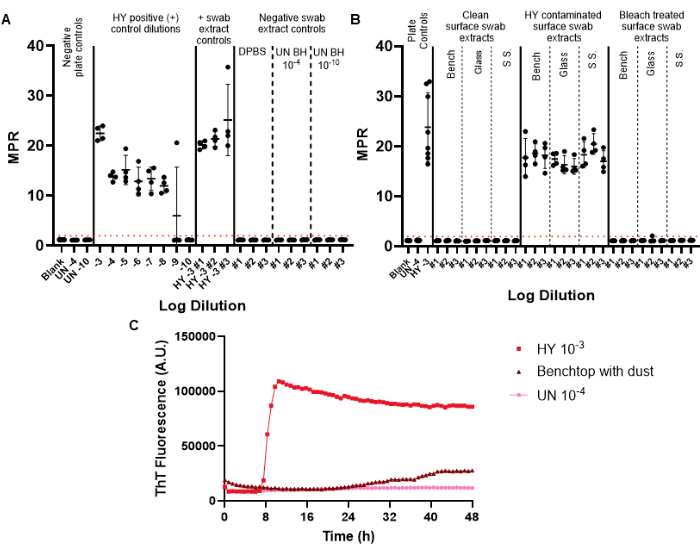
איור 6: ניסוי מייצג של מטוש פני שטח. (A) לוחית בקרה של מטוש פני השטח המכילה בקרות של תמצית מטוש שלילי בבקרה משולשת (DPBS, מוח אוגר לא נגוע הומוגנט 10-4 ו-10-10) ובקרות תמצית מטוש חיובית במשולש (HY הומוגנט מוח 10-3). (B) תמציות מטוש מייצגות למשטחי ספסל, זכוכית ונירוסטה (S.S.) שעברו ספוגית לפני הזיהום, בעקבות זיהום ב-HY 10-3 ולאחר טיפול באקונומיקה במשטחים מזוהמים. (C) השוואה של מעקב פלואורסצנטי בין הומוגנט מוח לא נגוע 10-4, הומוגנט מוח HY 10-3, ותמצית המקלון מהספסל המצופה בשכבת אבק עדינה. בקרות לוח שליליות עבור לוחות A ו- B כוללות ריק (תמיסת דילול רקמות) ומוח אוגר לא נגוע הומוגני 10-4. לוח B כולל תוספת של הומוגנט מוח לא נגוע 10-4 ואת בקרת הצלחת החיובית של הומוגנט מוח HY 10-3. סף פלואורסצנטיות חיובי (מודגם על ידי קו מקווקו אדום) נקבע להיות 2. יחס נקודת השיא (MPR) המדווח הוא הפלואורסצנטיות המרבית חלקי קריאת הפלואורסצנטיות הראשונית המתקבלת על ידי קורא הלוחות. כל נקודה מייצגת באר טכנית אחת המשוכפלת עבור סוג מדגם נתון. הממוצע וסטיית התקן מוצגים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: טופס תיעוד חודשי של אתר מטוש לדוגמה. אנא לחץ כאן כדי להוריד טבלה זו.
איור משלים 1: תבנית פריסת אתר Swabbing. אנא לחץ כאן כדי להוריד קובץ זה.
תרשים משלים 2: טופס תיעוד חודשי של אתר מטוש. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
ניתן להשתמש בשיטת ספוגית הבטיחות המתוארת של פריון כדי לשפר את אמצעי הבטיחות הקיימים של פריונים. שיטה זו יכולה לנטר חללים וציוד של מעבדת פריונים, כמו גם חללי מעבדה משותפים, לאיתור זיהום פוטנציאלי של פריונים. חשוב לציין כי ניתן להתאים שיטה זו לבדיקת טכניקות חיטוי ספציפיות למעבדה כדי לוודא טיהור של משטחים מזוהמים בפריון. מכיוון שזנים שונים של פריונים מציגים רגישויות שונות לטכניקות חיטוי, שיטה זו יכולה לאשר כי טכניקות אלה יעילות לניסויי מעבדה נוכחיים, כגון טיפול בנתרן הידרוקסידי או נתרן היפוכלוריט (אקונומיקה)43,44.
צעדים מרכזיים עבור מתודולוגיה זו כוללים זיהוי של אתרי מטוש מתאימים שיספקו מדגם של שני אזורים בעלי תנועה גבוהה, כמו גם אזורים לניטור שעשויים להיות מעורבים בזיהום צולב במורד הזרם של ניסויים. בנוסף, מעבדות צריכות להשתמש בבקרות חיוביות ושליליות הדומות באופן הדוק לאלה הנפוצות במעבדה או במרפאה נתונה. לדוגמה, אם עובדים עם פריונים של מכרסמים, הבקרות החיוביות והשליליות צריכות להתאים למין זה. לבסוף, נתוני המעקב צריכים להיות מעודכנים ומאורגנים כך שניתן יהיה לזהות בקלות מגמות חיוביות, ובכך לאפשר הפחתה והכשרה מחדש של צוות המעבדה במקרה של תוצאות חיוביות עקביות עבור אזור נתון.
מגבלה אחת של פרוטוקול זה היא יצירת פוטנציאל של תוצאות RT-QuIC שגויות. בהתחשב באופי הרגיש של RT-QuIC, נוכחות של שאריות דטרגנטים, מלח וחומרים אחרים על משטחי מעבדה יכולה להשפיע על התוצאה של התגובה39. בסך הכל, בהתחשב בתצפית זו, יש יתרון בכך שמשטחים נשארים נקיים מחומרים שיכולים להפריע ל-RT-QuIC, כגון שאריות מלח, חומרי ניקוי ואבק. ככל ששיפורים במתודולוגיית RT-QuIC יהיו זמינים, אנו צופים שרבות מהמגבלות הנוכחיות של RT-QuIC ייפתרו. לכן, אנו מעודדים את משתמש הקצה להתעדכן בספרות כדי לנצל את השיפורים האחרונים ב-RT-QuIC.
יתרון מרכזי של שיטה זו עבור מעבדות החוקרות פריונים הוא היכולת למזער זיהום שעלול להשפיע על התוצאות של בדיקות הגברה רגישות. כלי נקרופסי מחוטאים בדרך כלל לפני שנעשה בהם שימוש חוזר לנקרופסיות עתידיות. שיטת המטוש המתוארת מספקת שיטה להערכת כלי נקרופסי להדבקה שיורית של פריונים שעלולה להשפיע על התוצאות במורד הזרם. זה יכול לספק רמה נוספת של קפדנות לניסויים כדי לשלול את האפשרות כי זיהוי פריונים ברקמות לא היה בשל זיהום מן הכלים necropsy.
Disclosures
J.C.B. ו-Q.Y. הם ממציאים של בקשת פטנט הנוגעת לטכנולוגיית משטח פריון.
Acknowledgements
העבודה נתמכה על ידי מענק מהקרן למחלות קרויצפלדט יעקב. למממנים לא היה כל תפקיד בעיצוב המחקר, באיסוף הנתונים ובפרשנותם, או בהחלטה להגיש את העבודה לפרסום.
Materials
| Name | Company | Catalog Number | Comments |
| Fisherbrand PurSwab Foam Swabs | Fisher brand | Catalog #14-960-3E | |
| Milli-Q IQ 7005 Ultrapure Water System | MilliporeSigma | Q7005T0C | |
| Mini-centrifuge, 6000 rpm | Southern Labware | MLX-306 | |
| Omega plate reader | BMG Labtech | FLUOstar Omega plate reader | |
| Q700 sonicator | QSonica | Q700-110 | |
| Recombinant hamster prion protein | MNPRO | MNPROtein-Hamster | syrian hamster, amino acids 90-231 |
| Savant speedvac | Thermo Scientific | SPD1030-230 | |
| Silica nanospheres (50 nm) | nano Composix | SISN50-25M |
References
- Prusiner, S. B. Novel proteinaceous infectious particles cause scrapie. Science. 216 (4542), 136-144 (1982).
- Bolton, D. C., McKinley, M. P., Prusiner, S. B. Identification of a protein that purifies with the scrapie prion. Science. 218 (4579), 1309-1311 (1982).
- Oesch, B., et al. A cellular gene encodes scrapie PrP 27-30 protein. Cell. 40 (4), 735-746 (1985).
- Caughey, B., Raymond, G. The scrapie-associated form of PrP is made from a cell surface precursor that is both protease- and phospholipase-sensitive. J Biol Chem. 266 (27), 18217-18223 (1991).
- Deleault, N. R., Harris, B. T., Rees, J. R., Supattapone, S. Formation of native prions from minimal components in vitro. Proc Natl Acad Sci U S A. 104 (23), 9741-9746 (2007).
- Gajdusek, D. C., Zigas, V. Degenerative disease of the central nervous system in New Guinea: the endemic occurrence of "kuru" in the native population. N Engl J Med. 257, 974-978 (1957).
- Centers for Disease Control. Fatal degenerative neurologic disease in patients who received pituitary-derived human growth hormone. MMWR Morb Mortal Wkly Rep. 34, 359-361 (1985).
- Duffy, P., Wolf, J., Collins, G., DeVoe, A. G., Streeten, B., Cowen, D. Letter: possible person-to-person transmission of Creutzfeldt-Jakob disease. N Engl J Med. 290 (12), 692-693 (1974).
- Brown, P., et al. Iatrogenic Creutzfeldt-Jakob disease at the millennium. Neurology. 55 (8), 1075-1081 (2000).
- Huillard d'Aignaux, J., et al. Incubation period of Creutzfeldt-Jakob disease in human growth hormone recipients in France. Neurology. 53 (6), 1197-1201 (1999).
- Marzewski, D. J., Towfighi, J., Harrington, M. G., Merril, C. R., Brown, P. Creutzfeldt-Jakob disease following pituitary-derived human growth hormone therapy: a new American case. Neurology. 38, 1131-1133 (1988).
- Hannah, E. L., et al. Creutzfeldt-Jakob disease after receipt of a previously unimplicated brand of dura mater graft. Neurology. 56 (8), 1080-1083 (2001).
- Shimizu, S., et al. Creutzfeldt-Jakob disease with florid-type plaques after cadaveric dura mater grafting. Arch Neurol. 56 (3), 357-362 (1999).
- Antoine, J. C., et al. Creutzfeldt-Jakob disease after extracranial dura mater embolization for a nasopharyngeal angiofibroma. Neurology. 48 (5), 1451-1453 (1997).
- Esmonde, T., Lueck, C. J., Symon, L., Duchen, L. W., Will, R. G. Creutzfeldt-Jakob disease and lyophilised dura mater grafts: report of two cases. J Neurol Neurosurg Psychiatry. 56, 999-1000 (1993).
- Willison, H. J., Gale, A. N., McLaughlin, J. E. Creutzfeldt-Jakob disease following cadaveric dura mater graft. J Neurol Neurosurg Psychiatry. 54, 940(1991).
- Diringer, H., Braig, H. R. Infectivity of unconventional viruses in dura mater. Lancet. 334, 439-440 (1989).
- Peden, A. H., Head, M. W., Ritchie, D. L., Bell, J. E., Ironside, J. W. Preclinical vCJD after blood transfusion in a PRNP codon 129 heterozygous patient. Lancet. 364 (9433), 527-529 (2004).
- Will, R. G., Matthews, W. B. Evidence for case-to-case transmission of Creutzfeldt-Jakob disease. J Neurol Neurosurg Psychiatry. 45, 235-238 (1982).
- el Hachimi, K. H., Chaunu, M. P., Cervenakova, L., Brown, P., Foncin, J. F. Putative neurosurgical transmission of Creutzfeldt-Jakob disease with analysis of donor and recipient: agent strains. C R Acad Sci III. 320 (4), 319-328 (1997).
- Alper, T., et al. Does the agent of scrapie replicate without nucleic acid. Nature. 214, 764-766 (1967).
- Casassus, B. France halts prion research amid safety concerns. Science. 373 (6554), 475-476 (2021).
- Brandel, J. P., et al. Variant Creutzfeldt-Jakob disease diagnosed 7.5 years after occupational exposure. N Engl J Med. 383 (1), 83-85 (2020).
- Flechsig, E., Hegyi, I., Enari, M., Schwarz, P., Collinge, J., Weissmann, C. Transmission of scrapie by steel-surface-bound prions. Mol Med. 7 (10), 679-684 (2001).
- Zobeley, E., Flechsig, E., Cozzio, A., Enari, M., Weissmann, C. Infectivity of scrapie prions bound to a stainless steel surface. Mol Med. 5 (4), 240-243 (1999).
- Brown, P., Gajdusek, D. C. Survival of scrapie virus after 3 years' interment. Lancet. 337 (8736), 269-270 (1991).
- Seidel, B., et al. Scrapie agent (strain 263K) can transmit disease via the oral route after persistence in soil over years. PLoS One. 2 (5), e435(2007).
- Maddison, B. C., et al. Environmental sources of scrapie prions. J Virol. 84 (21), 11560-11562 (2010).
- Pritzkow, S., Morales, R., Lyon, A., Concha-Marambio, L., Urayama, A., Soto, C. Efficient prion disease transmission through common environmental materials. J Biol Chem. 293 (9), 3363-3373 (2018).
- Alper, T., Cramp, W., Haig, D., Clarke, M. Does the agent of scrapie replicate without nucleic acid. Nature. 214 (90), 764-766 (1967).
- Bernoulli, C., et al. Danger of accidental person-to-person transmission of Creutzfeldt-Jakob disease by surgery. Lancet. 309 (8009), 478-479 (1977).
- Brown, P., Rohwer, R. G., Green, E. M., Gajdusek, D. C. Effect of chemicals, heat, and histopathologic processing on high- infectivity hamster-adapted scrapie virus. J Infect Dis. 145 (5), 683-687 (1982).
- Brown, P., et al. Chemical disinfection of Creutzfeldt-Jakob disease virus. N Engl J Med. 306, 1279-1282 (1982).
- Dickinson, A. G., Taylor, D. M. Resistance of scrapie agent to decontamination. N Engl J Med. 299, 1413-1414 (1978).
- Hunter, G. D., Millson, G. C. Studies on the heat stability and chromatographic behavior of the scrapie agent. J Gen Microbiol. 37, 251-258 (1964).
- Pattison, I. H. Resistance of the scrapie agent to formalin. J Comp Pathol. 75, 159-164 (1965).
- Fraser, H., Farquhar, C., McConnell, I., Davies, D. The scrapie disease process is unaffected by ionising radiation. Prog Clin Biol Res. 317, 653-658 (1989).
- Yuan, Q., et al. Sensitive detection of chronic wasting disease prions recovered from environmentally relevant surfaces. Environ Int. 166, 107347(2022).
- Simmons, S. M., et al. Rapid and sensitive determination of residual prion infectivity from prion-decontaminated surfaces. mSphere. 9, e00504-e00524 (2024).
- Orru, C. D., et al. Sensitive detection of pathological seeds of alpha-synuclein, tau and prion protein on solid surfaces. PLoS Pathog. 20 (4), e1012175(2024).
- Wilham, J. M., et al. Rapid end-point quantitation of prion seeding activity with sensitivity comparable to bioassays. PLoS Pathog. 6 (12), e1001217(2010).
- Srivastava, A., et al. Enhanced quantitation of pathological alpha-synuclein in patient biospecimens by RT-QuIC seed amplification assays. PLoS Pathog. 20 (9), e1012554(2024).
- Hughson, A. G., et al. Inactivation of prions and amyloid seeds with hypochlorous acid. PLoS Pathog. 12 (9), e1005914(2016).
- Williams, K., Hughson, A. G., Chesebro, B., Race, B. Inactivation of chronic wasting disease prions using sodium hypochlorite. PLoS One. 14 (10), e0223659(2019).
- Taylor, D. M. Autoclaving standards for Creutzfeldt-Jakob disease agent [letter]. Ann Neurol. 22 (4), 557-558 (1987).
- Brown, P., Rohwer, R. G., Gajdusek, D. C. Newer data on the inactivation of scrapie virus or Creutzfeldt-Jakob disease virus in brain tissue. J Infect Dis. 153 (6), 1145-1148 (1986).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved