Method Article
朊病毒安全实验室滑动测试
摘要
缺乏评估实验室环境中常用区域的朊病毒污染和有效去污的方法。此处描述的方案为实施实验室朊病毒安全滑动检测提供了关键基础知识,可以轻松修改以满足特定实验室的个性化需求。
摘要
医源性朊病毒病的传播来自受污染的神经外科工具、移植材料和职业暴露于受朊病毒污染的实验室工具。朊病毒通过将朊病毒蛋白的正常细胞形式 PrPC 模板错误折叠成错误折叠的致病形式 PrPSc 而引起疾病,并且总是致命的。减少医源性和职业性朊病毒的传播具有挑战性。首先,朊病毒可以结合并长时间留在表面上。其次,朊病毒对灭活具有很强的抵抗力。鉴于此,表面在无效的净化后可以长时间保持传染性。这不仅会对朊病毒实验室工作人员构成潜在的职业风险,而且可能会交叉污染利用敏感朊病毒扩增技术的实验室实验。此处描述的朊病毒安全实验室擦拭测试方案包括识别和记录高流量实验室区域的步骤、推荐的拭子控制以确保结果的有效性、确定对阳性表面擦拭部位的正确反应的步骤、朊病毒擦拭测试的代表性结果,以及潜在的人为结果。总体而言,朊病毒安全实验室刷卡测试可以作为更广泛的朊病毒安全计划的一部分实施,以评估表面净化、监测公共空间的朊病毒污染,并实施朊病毒净化状态的记录。
引言
朊病毒病总是致命的神经退行性疾病,没有已知的治疗方法或治愈方法。朊病毒病是由 PrPSc 引起的,PrP Sc 是朊病毒蛋白 1,2,3,4,5,PrP C 的正常细胞形式的错误折叠和致病形式。已知朊病毒病会影响人类和其他几种动物物种。一种人类朊病毒病,即克雅氏病,CJD,有三种已知的病因:散发性、遗传性和获得性。获得性 CJD 可由意外传播(医源性和职业性)引起,被认为是巴布亚新几内亚福尔人 Kuru 的原因6。
朊病毒传播与朊病毒污染的医疗器械和移植材料有关7,8,9,10,11,12,13,14,15,16,17。CJD 的医源性传播可通过血液、组织或朊病毒污染的表面发生 18,19,20。例如,医源性 CJD 可在脑电图后发生,该电极先前用于 CJD 临床前阶段的个体,然后死于 CJD21。最近的实验室职业传播也发生了,一名实验室工作人员通过用镊子穿刺皮肤感染了朊病毒病,该镊子用于处理感染了绵羊适应的 BSE 的动物的脑切片22,23。这种传播情况可能发生在处理朊病毒样本的临床、实验室和诊断实验室环境中。
朊病毒抗拒常见的消毒技术,可以在表面上持续存在并长时间保持传染性 24,25,26,27,28,29。常见的消毒技术,如使用乙醇、酚类清洁剂、过氧化氢、各种形式的辐射和甲醛,不足以灭活朊病毒,使表面保持传染性 30,31,32,33,34,35,36,37.这些特性有助于朊病毒在医源性和职业暴露期间的传播。
检测环境朊病毒的方法直到最近才被开发出来。环境拭子法结合实时地震诱导转化 (RT-QuIC) 可以评估无效消毒后环境表面以及常见实验室表面的残留朊病毒感染性 38,39,40,41,42。在这里,我们描述了如何将这项技术纳入更广泛的朊病毒安全计划。总体而言,这种方法可以允许监测依赖于实验室的消毒方案、调查和正确记录污染状态,这可以通过最大限度地减少交叉污染来帮助确保实验的有效性,评估朊病毒污染的共享使用空间,并允许根据常见污染区域对人员进行定向再培训。
研究方案
所有涉及动物的程序均已获得克赖顿大学机构动物护理和使用委员会的批准并符合《实验动物护理和使用指南》。
注意: 图 1 显示了朊病毒安全实验室滑动测试的示意图概述。
1. 拭子部位的选择和表面拭子的准备
- 确定并标记适当的拭子监测区域。请参阅提供的模板以获取文档和参考(图 2 和 补充图 1)。
- 为每个已识别区域准备两个 1.5 mL 微量离心管。将 250 μL Dulbecco 磷酸盐缓冲盐水添加到第一组微量离心管中,用于步骤 3.2。让第二组微量离心管保持为空,以便在步骤 4.3 中使用。
- 从无朊病毒污染区域的储存中取出泡沫棉签。
- 准备一个装有 Milli-Q 水 (MQ H2O) 的挤压瓶,用于步骤 2.1。
2. 阳性和阴性对照拭子制备
- 使用相关对照类型为阳性和阴性拭子对照准备稀释液。示例:对于阳性对照,在 Dulbecco 磷酸盐缓冲盐水 (DPBS) 中制备 1% 稀释的朊病毒感染的脑匀浆。对于阴性对照,制备 0.1% 稀释的未感染 (UN) 脑匀浆 (BH),该稀释液来自 DPBS 中的阳性对照相同物种。
- 戴上干净的手套,从干净的包装中取出适当数量的拭子,然后将手柄面朝下放入试管架中,注意将泡沫拭子隔开,使吸头不会接触其他拭子或表面。对于每个对照样品,准备三个拭子。在每个样品之间更换手套。
- 握住干净的泡沫棉签,将 50 μL 相应的阳性和阴性对照样品涂抹在泡沫棉签尖端上。确保涂抹在拭子尖端的两侧,以确保完全吸收。
注意:从试管架中取出干净的棉签之前,请务必更换手套。 - 使用剪刀剪掉棉签的多余手柄(大约长度的 1/2),然后将棉签放入预装的微量离心管中,泡沫尖端部分朝下。确保泡沫吸头浸没在 DPBS 中,并且手柄被充分切割以完全关闭微量离心管的盖子。
- 更换手套后继续应用对照样品,直到所有样品都应用完毕。
3. 表面拭子
- 握住干净的泡沫尖端拭子的手柄,用 MQ H2O 预湿泡沫尖端并抖掉多余的泡沫。将棉签的湿泡沫尖端放在选择进行监测的区域上,来回擦拭该区域约 10 次,同时在表面上旋转棉签尖端。
- 使用剪刀剪掉棉签的多余手柄(大约长度的 1/2),然后将棉签放入预装的微量离心管中,泡沫尖端部分朝下。确保泡沫吸头浸没在 DPBS 中,并且手柄被充分切割以完全关闭微量离心管的盖子。
- 在每个拭子采集部位之前丢弃手套并戴上新手套,以尽量减少交叉污染的可能性。
- 重复该过程,直到所有选择进行监测的区域都已拭子。
4. 拭子提取和真空浓缩
注:使用前 30 分钟打开真空浓缩器,让仪器预热。
- 将微量离心管放入圆形管架中。将微量离心管架放入杯角超声仪水浴中。确保微量离心管内 DPBS 中的泡沫棉签低于杯角中的水面(手柄部分不必浸入水中)。应用以下设置:在 ~75-85 瓦时,总运行时间为 15 秒(5 秒开,5 秒关)。
- 超声处理后,将试管离心约 15 秒,以便在转移前将 DPBS 收集在试管底部。
- 使用设置为 250 μL 的 P1000 移液器,小心地从微量离心管底部收集所有液体(拭子提取物),并从第二个空的预标记套装转移到相应的微量离心管中。使用移液器吸头从泡沫吸头中挤出多余的液体。丢弃含有拭子的空管。
- 在真空浓缩器上设置以下设置:温度:45 °C,加热时间:15 分钟,运行时间:2 小时,真空度:5.1。
- 将含有拭子提取物的微量离心管放入真空浓缩器中,确保试管平衡且所有管盖都打开。
- 循环完成后,确保样品完全浓缩(仅剩下沉淀)。将沉淀储存在 -80 °C,直到用于 RT-QuIC。
注意:在某些情况下,可能需要额外的真空浓缩时间以确保完全浓缩。去除所有浓缩的样品,只留下仍含有液体的试管。重新平衡浓缩器内的剩余试管,并以额外的 1 小时增量运行,直到样品完全浓缩。
5. 制备用于 RT-QuIC 的拭子对照
注:应在分析环境拭子提取物之前进行 RT-QuIC 对照,以确保在拭子、提取或浓缩过程中没有引入污染。有关示例布局,请参阅 图 3 和 图 4。
- 通过在组织稀释溶液 (N2-0.1%SDS/PBS) 中稀释至适当浓度,制备适当的阴性 RT-QuIC 板对照(例如,未感染的脑匀浆 [UN BH])。通过在组织稀释溶液中将朊病毒感染的脑匀浆稀释至 10-3 的稀释液来制备阳性板对照稀释液。
- 从 -80 °C 中取出先前储存的对照拭子提取物沉淀,并通过上下吹打约 10 次,用 50 μL MQ H2O 重悬每个沉淀,然后短暂涡旋。在执行其余步骤时,让样品在室温 (RT) 下静置。
- 加载 2 μL 指定的板对照,包括阴性板对照(单独的组织稀释溶液和未感染的脑匀浆)和阳性板对照(感染的脑匀浆)。
- 将 2 μL 每个阳性和阴性拭子提取物技术副本加载到至少 4 个重复的 RT-QuIC 板孔中。
注:如果阴性拭子对照显示 RT-QuIC 种子高于实验室的阳性测定标准,则表明在拭子、提取和浓缩过程中引入了污染,应再次进行拭子实验
6. 用于 RT-QuIC 的样品制备
- 通过在组织稀释溶液 (N2-0.1%SDS/PBS) 中稀释至适当浓度,制备适当的阴性板对照(例如,未感染的脑匀浆、未感染的淋巴结等)。通过在组织稀释溶液中将感染的脑匀浆稀释至 10-3 的稀释液来制备阳性板对照。
- 从 -80 °C 中取出先前储存的拭子提取物沉淀,并用 20-50 μL 组织稀释溶液(取决于可疑的污染量)重悬,上下吹打约 10 次,然后短暂涡旋。在执行其余步骤时,让样品在 RT 中放置。
- 将 2 μL 指定的板对照,包括阴性板对照(单独的组织稀释溶液和未感染的脑匀浆)和阳性板对照(感染的脑匀浆)加载到 RT-QuIC 板孔中。
- 将 2 μL 每种拭子提取物加载到四个重复孔中。
7. RT-QuIC 分析和结果
- 根据各个实验室方案(可选方案38,40)进行 RT-QuIC。
- 定义确定样品阳性所需的参数(参见代表性结果, 图 5)。
注意:这些参数由每个实验定义。 - 将结果记录在提供的表格中,并根据实验室最佳实践采取适当的措施(表 1 和 补充图 2)。
结果
阳性和阴性结果的书面描述(包括阳性/阴性板和拭子对照)
阴性对照拭子包含在监测拭子中,以监测在拭子、提取和浓缩过程中可能引入的潜在朊病毒污染。为给定的月度监测进行的第一个 RT-QuIC 板应包括阳性和阴性拭子对照。成功的阴性对照未能超过阳性荧光阈值(图 6A)。这一结果表明,在实验过程中没有引入污染。成功的阳性对照拭子提取物将在给定样品的所有重复孔中表现出阳性接种(阳性对照拭子被仓鼠适应的传染性水貂脑病菌株 Hyper (HY TME) 脑匀浆污染。包含阳性对照稀释系列可以确定给定实验中朊病毒检测的灵敏度(图 6A)。
在检查表面拭子提取物样品时,未能显示高于预定阳性荧光阈值的种子的表面可被视为朊病毒阴性(图 6B)。相反,受朊病毒污染的表面拭子提取物将显示高于阳性荧光阈值的接种能力,尽管与包含的阳性板对照相比,最大点比率 (MPR) 和发荧光时间可能会有所不同(图 6B)。经过漂白剂处理的朊病毒污染表面突出了该方法评估充分消毒的能力,这些表面现在无法接种 RT-QuIC(图 6B)。
重要的是,虽然我们的实验室将阳性样品定义为在至少一半的重复孔中通过设定的阳性荧光阈值的样品,但每个实验室都需要设置自己的标准品。淀粉样蛋白形成速率 (RAF) 和发荧光时间也可用于帮助建立实验室特异性阳性阈值。
我们观察到表面伪影结果超过阳性荧光阈值,但动力学曲线发生了变化,并且与阳性对照样品相比,荧光时间异常长(图 6C)。应谨慎解释这些结果,因为它们可能是由表面上存在的灰尘或残留化学物质引起的。这些发现强调了一般实验室清洁度的必要性,以及区分真阳性和假阳性接种的标准。
固体和液体生物危害废物的处置应遵循特定机构当前的生物危害处理指南。常见的朊病毒消毒技术包括氢氧化钠、次氯酸钠(漂白剂)处理或在 134 °C 下高压灭菌 18 分钟 43,44,45,46。
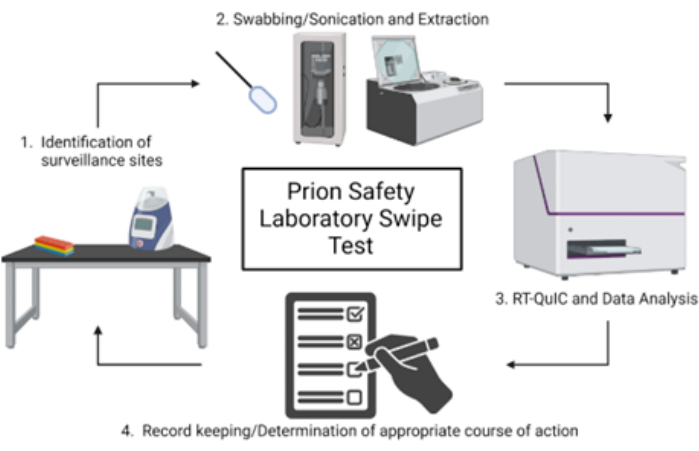
图 1:朊病毒安全实验室刷卡试验的示意图概述。请单击此处查看此图的较大版本。
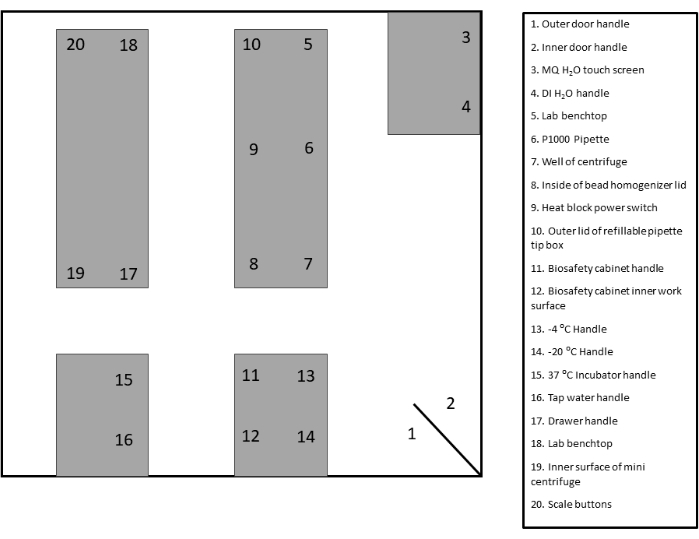
图 2:拭子样本站点布局。请单击此处查看此图的较大版本。
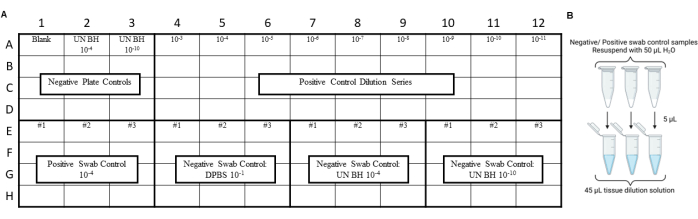
图 3:拭子对照的样本实验设计包括朊病毒安全实验室滑动测试。 (A) 阴性和阳性拭子提取物对照的样品布局。(B) 阴性和阳性拭子提取物对照应用 50 μL H2O 重悬。应通过将重悬的拭子提取物稀释到组织稀释溶液中来产生 10 倍稀释的拭子提取物。 请单击此处查看此图的较大版本。
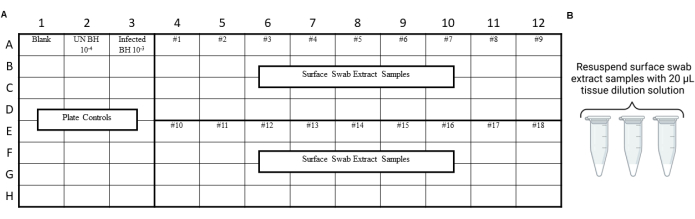
图 4:朊病毒安全实验室擦拭测试的表面拭子提取物的样品实验设计。 (A) 表面拭子提取物的样品布局。(B) 表面拭子提取物样品应使用 20 μL 组织稀释溶液重悬。 请单击此处查看此图的较大版本。
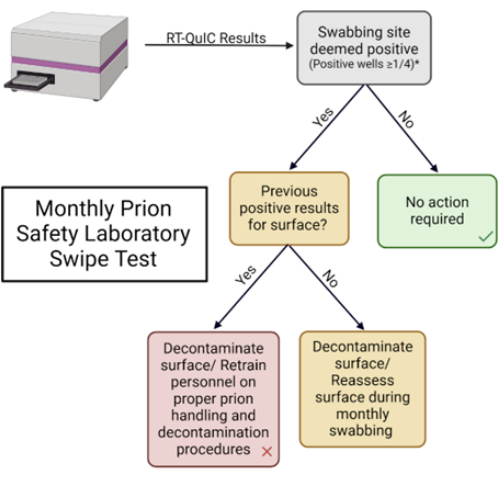
图 5:每月朊病毒安全实验室刷卡测试。 用于解释结果和确定适当响应的流程图。 请单击此处查看此图的较大版本。
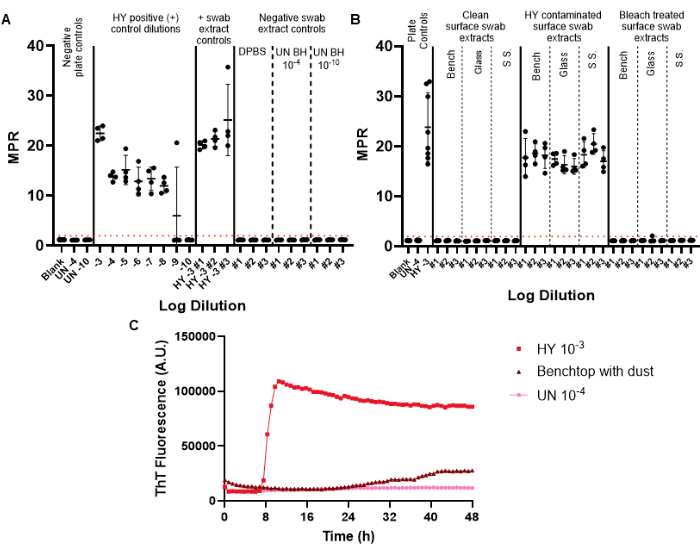
图 6:代表性的表面拭子检测实验。(A) 表面拭子对照板,包含一式三份的阴性拭子提取物对照(DPBS,未感染的仓鼠脑匀浆 10-4 和 10-10)和一式三份的阳性拭子提取物对照(HY 脑匀浆 10-3)。(B) 在污染前、HY 10-3 污染后以及对污染表面进行漂白剂处理后擦拭的台式、玻璃和不锈钢 (S.S.) 表面的代表性拭子提取物。(C) 未感染的脑匀浆 10-4、HY 脑匀浆 10-3 和来自工作台的拭子提取物涂有一层细尘膜的荧光示踪比较。图 A 和 B 的阴性板对照包括空白(组织稀释溶液)和未感染的仓鼠脑匀浆 10-4。图 B 包括添加未感染的脑匀浆 10-4 和 HY 脑匀浆 10-3 的阳性板对照。阳性荧光阈值(由红色虚线表示)确定为 2。报告的最大点比率 (MPR) 是最大荧光除以读板器获得的初始荧光读数。每个点代表给定样品类型的一个技术井重复。给出了平均值和标准差。请单击此处查看此图的较大版本。
表 1:样本拭子检测站点月度记录表。请点击此处下载此表格。
补充图 1:拭子站点布局模板。请点击此处下载此文件。
补充图 2:拭子网站月度文件表。请点击此处下载此文件。
讨论
所描述的朊病毒安全拭子方法可用于增强现有的朊病毒安全措施。这种方法可以监测朊病毒实验室空间和设备,以及共享实验室空间,以发现潜在的朊病毒污染。重要的是,这种方法可以适用于测试实验室特定的消毒技术,以验证朊病毒污染表面的净化。由于各种朊病毒菌株对消毒技术表现出不同的敏感性,因此该方法可以确认这些技术对当前的实验室实验有效,例如用氢氧化钠或次氯酸钠(漂白剂)处理43,44。
该方法的关键步骤包括确定适当的拭子采样位点,该位点将提供高流量区域以及可能涉及下游实验交叉污染的监测区域的样本。此外,实验室应使用与给定实验室或诊所中常用的对照密切相关的阳性和阴性对照。例如,如果与啮齿动物朊病毒合作,则阳性和阴性对照应与该物种相匹配。最后,监测数据应保持最新和组织,以便轻松识别阳性趋势,从而在给定地区出现持续阳性结果的情况下对实验室工作人员进行缓解和再培训。
该协议的一个限制是可能产生错误的 RT-QuIC 结果。鉴于 RT-QuIC 的敏感性,实验室表面残留的去污剂、盐和其他物质会影响反应结果39。总体而言,鉴于这一观察结果,表面保持无残留盐、清洁剂和灰尘等可能干扰 RT-QuIC 的物质是有利的。随着 RT-QuIC 方法的改进,我们预计 RT-QuIC 的许多当前限制将得到解决。因此,我们鼓励最终用户及时了解文献,以利用 RT-QuIC 的最新改进。
对于研究朊病毒的实验室来说,该方法的一个主要优点是能够最大限度地减少可能影响灵敏扩增分析结果的污染。尸检工具通常在重新用于将来的尸检之前进行消毒。所描述的拭子方法提供了一种评估可能影响下游结果的残留朊病毒感染性的尸检工具的方法。这可以为实验提供额外的严谨性,以排除组织中朊病毒检测不是由于尸检工具污染的可能性。
披露声明
J.C.B. 和 Q.Y. 是与朊病毒表面拭子技术有关的专利申请的发明人。
致谢
这项工作得到了克雅氏病基金会的资助。资助者在研究设计、数据收集和解释或提交工作发表的决定中没有作用。
材料
| Name | Company | Catalog Number | Comments |
| Fisherbrand PurSwab Foam Swabs | Fisher brand | Catalog #14-960-3E | |
| Milli-Q IQ 7005 Ultrapure Water System | MilliporeSigma | Q7005T0C | |
| Mini-centrifuge, 6000 rpm | Southern Labware | MLX-306 | |
| Omega plate reader | BMG Labtech | FLUOstar Omega plate reader | |
| Q700 sonicator | QSonica | Q700-110 | |
| Recombinant hamster prion protein | MNPRO | MNPROtein-Hamster | syrian hamster, amino acids 90-231 |
| Savant speedvac | Thermo Scientific | SPD1030-230 | |
| Silica nanospheres (50 nm) | nano Composix | SISN50-25M |
参考文献
- Prusiner, S. B. Novel proteinaceous infectious particles cause scrapie. Science. 216 (4542), 136-144 (1982).
- Bolton, D. C., McKinley, M. P., Prusiner, S. B. Identification of a protein that purifies with the scrapie prion. Science. 218 (4579), 1309-1311 (1982).
- Oesch, B., et al. A cellular gene encodes scrapie PrP 27-30 protein. Cell. 40 (4), 735-746 (1985).
- Caughey, B., Raymond, G. The scrapie-associated form of PrP is made from a cell surface precursor that is both protease- and phospholipase-sensitive. J Biol Chem. 266 (27), 18217-18223 (1991).
- Deleault, N. R., Harris, B. T., Rees, J. R., Supattapone, S. Formation of native prions from minimal components in vitro. Proc Natl Acad Sci U S A. 104 (23), 9741-9746 (2007).
- Gajdusek, D. C., Zigas, V. Degenerative disease of the central nervous system in New Guinea: the endemic occurrence of "kuru" in the native population. N Engl J Med. 257, 974-978 (1957).
- Centers for Disease Control. Fatal degenerative neurologic disease in patients who received pituitary-derived human growth hormone. MMWR Morb Mortal Wkly Rep. 34, 359-361 (1985).
- Duffy, P., Wolf, J., Collins, G., DeVoe, A. G., Streeten, B., Cowen, D. Letter: possible person-to-person transmission of Creutzfeldt-Jakob disease. N Engl J Med. 290 (12), 692-693 (1974).
- Brown, P., et al. Iatrogenic Creutzfeldt-Jakob disease at the millennium. Neurology. 55 (8), 1075-1081 (2000).
- Huillard d'Aignaux, J., et al. Incubation period of Creutzfeldt-Jakob disease in human growth hormone recipients in France. Neurology. 53 (6), 1197-1201 (1999).
- Marzewski, D. J., Towfighi, J., Harrington, M. G., Merril, C. R., Brown, P. Creutzfeldt-Jakob disease following pituitary-derived human growth hormone therapy: a new American case. Neurology. 38, 1131-1133 (1988).
- Hannah, E. L., et al. Creutzfeldt-Jakob disease after receipt of a previously unimplicated brand of dura mater graft. Neurology. 56 (8), 1080-1083 (2001).
- Shimizu, S., et al. Creutzfeldt-Jakob disease with florid-type plaques after cadaveric dura mater grafting. Arch Neurol. 56 (3), 357-362 (1999).
- Antoine, J. C., et al. Creutzfeldt-Jakob disease after extracranial dura mater embolization for a nasopharyngeal angiofibroma. Neurology. 48 (5), 1451-1453 (1997).
- Esmonde, T., Lueck, C. J., Symon, L., Duchen, L. W., Will, R. G. Creutzfeldt-Jakob disease and lyophilised dura mater grafts: report of two cases. J Neurol Neurosurg Psychiatry. 56, 999-1000 (1993).
- Willison, H. J., Gale, A. N., McLaughlin, J. E. Creutzfeldt-Jakob disease following cadaveric dura mater graft. J Neurol Neurosurg Psychiatry. 54, 940(1991).
- Diringer, H., Braig, H. R. Infectivity of unconventional viruses in dura mater. Lancet. 334, 439-440 (1989).
- Peden, A. H., Head, M. W., Ritchie, D. L., Bell, J. E., Ironside, J. W. Preclinical vCJD after blood transfusion in a PRNP codon 129 heterozygous patient. Lancet. 364 (9433), 527-529 (2004).
- Will, R. G., Matthews, W. B. Evidence for case-to-case transmission of Creutzfeldt-Jakob disease. J Neurol Neurosurg Psychiatry. 45, 235-238 (1982).
- el Hachimi, K. H., Chaunu, M. P., Cervenakova, L., Brown, P., Foncin, J. F. Putative neurosurgical transmission of Creutzfeldt-Jakob disease with analysis of donor and recipient: agent strains. C R Acad Sci III. 320 (4), 319-328 (1997).
- Alper, T., et al. Does the agent of scrapie replicate without nucleic acid. Nature. 214, 764-766 (1967).
- Casassus, B. France halts prion research amid safety concerns. Science. 373 (6554), 475-476 (2021).
- Brandel, J. P., et al. Variant Creutzfeldt-Jakob disease diagnosed 7.5 years after occupational exposure. N Engl J Med. 383 (1), 83-85 (2020).
- Flechsig, E., Hegyi, I., Enari, M., Schwarz, P., Collinge, J., Weissmann, C. Transmission of scrapie by steel-surface-bound prions. Mol Med. 7 (10), 679-684 (2001).
- Zobeley, E., Flechsig, E., Cozzio, A., Enari, M., Weissmann, C. Infectivity of scrapie prions bound to a stainless steel surface. Mol Med. 5 (4), 240-243 (1999).
- Brown, P., Gajdusek, D. C. Survival of scrapie virus after 3 years' interment. Lancet. 337 (8736), 269-270 (1991).
- Seidel, B., et al. Scrapie agent (strain 263K) can transmit disease via the oral route after persistence in soil over years. PLoS One. 2 (5), e435(2007).
- Maddison, B. C., et al. Environmental sources of scrapie prions. J Virol. 84 (21), 11560-11562 (2010).
- Pritzkow, S., Morales, R., Lyon, A., Concha-Marambio, L., Urayama, A., Soto, C. Efficient prion disease transmission through common environmental materials. J Biol Chem. 293 (9), 3363-3373 (2018).
- Alper, T., Cramp, W., Haig, D., Clarke, M. Does the agent of scrapie replicate without nucleic acid. Nature. 214 (90), 764-766 (1967).
- Bernoulli, C., et al. Danger of accidental person-to-person transmission of Creutzfeldt-Jakob disease by surgery. Lancet. 309 (8009), 478-479 (1977).
- Brown, P., Rohwer, R. G., Green, E. M., Gajdusek, D. C. Effect of chemicals, heat, and histopathologic processing on high- infectivity hamster-adapted scrapie virus. J Infect Dis. 145 (5), 683-687 (1982).
- Brown, P., et al. Chemical disinfection of Creutzfeldt-Jakob disease virus. N Engl J Med. 306, 1279-1282 (1982).
- Dickinson, A. G., Taylor, D. M. Resistance of scrapie agent to decontamination. N Engl J Med. 299, 1413-1414 (1978).
- Hunter, G. D., Millson, G. C. Studies on the heat stability and chromatographic behavior of the scrapie agent. J Gen Microbiol. 37, 251-258 (1964).
- Pattison, I. H. Resistance of the scrapie agent to formalin. J Comp Pathol. 75, 159-164 (1965).
- Fraser, H., Farquhar, C., McConnell, I., Davies, D. The scrapie disease process is unaffected by ionising radiation. Prog Clin Biol Res. 317, 653-658 (1989).
- Yuan, Q., et al. Sensitive detection of chronic wasting disease prions recovered from environmentally relevant surfaces. Environ Int. 166, 107347(2022).
- Simmons, S. M., et al. Rapid and sensitive determination of residual prion infectivity from prion-decontaminated surfaces. mSphere. 9, e00504-e00524 (2024).
- Orru, C. D., et al. Sensitive detection of pathological seeds of alpha-synuclein, tau and prion protein on solid surfaces. PLoS Pathog. 20 (4), e1012175(2024).
- Wilham, J. M., et al. Rapid end-point quantitation of prion seeding activity with sensitivity comparable to bioassays. PLoS Pathog. 6 (12), e1001217(2010).
- Srivastava, A., et al. Enhanced quantitation of pathological alpha-synuclein in patient biospecimens by RT-QuIC seed amplification assays. PLoS Pathog. 20 (9), e1012554(2024).
- Hughson, A. G., et al. Inactivation of prions and amyloid seeds with hypochlorous acid. PLoS Pathog. 12 (9), e1005914(2016).
- Williams, K., Hughson, A. G., Chesebro, B., Race, B. Inactivation of chronic wasting disease prions using sodium hypochlorite. PLoS One. 14 (10), e0223659(2019).
- Taylor, D. M. Autoclaving standards for Creutzfeldt-Jakob disease agent [letter]. Ann Neurol. 22 (4), 557-558 (1987).
- Brown, P., Rohwer, R. G., Gajdusek, D. C. Newer data on the inactivation of scrapie virus or Creutzfeldt-Jakob disease virus in brain tissue. J Infect Dis. 153 (6), 1145-1148 (1986).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。