Method Article
تصوير C. ايليجانس عالي الدقة عبر جميع مراحل اليرقات
In This Article
Summary
يصف هذا البروتوكول التصوير بفاصل زمني قائم على الموائع الدقيقة C. ايليجانس عبر تطور ما بعد الجنين بأكمله.
Abstract
أصبح Caenorhabditis elegans أحد أكثر النماذج الحيوانية دراسة والأكثر فهما في علم الأحياء. هناك ثلاث ميزات أساسية لنجاح C. ايليجانس ككائن حي نموذجي: سلالة الخلية الثابتة ، والشفافية ، وقابلية التتبع الجيني. هذه تجعله مثاليا لمجموعة متنوعة من الدراسات القائمة على الفحص المجهري مباشرة في الجسم الحي. غالبا ما تحتاج اليرقات واليرقات الحية C. ايليجانس والبالغين إلى تجميدها أثناء الحصول على الصورة. تؤثر طرق الشلل التقليدية سلبا على نمو ، خاصة في تطبيقات التصوير بفاصل زمني. هنا ، يتم تقديم بروتوكول إعداد وتشغيل مفصل لطريقة تصوير الموائع الدقيقة الجديدة ، والتي تعالج القيود المرتبطة بالشلل التقليدي القائم على وسادة أجار واستراتيجيات الموائع الدقيقة الأخرى. يتيح هذا النهج التصوير المباشر المتزامن عبر مراحل اليرقات المختلفة مع الحفاظ على اتجاه الدودة وهويتها بمرور الوقت. لتحقيق ذلك ، يتم استخدام مصفوفة قناة مصيدة الموائع الدقيقة ، مع هندستها المصممة بدقة للحفاظ على اتجاه دودة مستقر مع استيعاب النمو وطرح الريش. يتم تسهيل الشلل من خلال صمام هيدروليكي نشط يضغط لتثبيت الديدان على زجاج الغطاء فقط أثناء الحصول على الصورة. يسمح هذا التصميم بالتصوير عالي الدقة مع الحد الأدنى من التأثيرات على صلاحية الدودة أو توقيت النمو.
Introduction
C. ايليجانس يمكن إجراء التصوير بعدة طرق اعتمادا على التطبيق والإنتاجية المطلوبة والدقة. عند الحاجة إلى دقة عالية ، تستخدم الطريقة القياسية وسادات أجار1،2،3 ، وهي بنية بسيطة من الشريحة الزجاجية ، والأغاروز ، وزجاج الغطاء. يتم تجميد الموجودة على هذه الشرائح بسبب الضغط الذي يمارسه زجاج الغطاء. يمكن تحسين الشلل بشكل أكبر عن طريق إضافة عوامل التخدير ، على سبيل المثال ، الليفاميزول أو أزيد الصوديوم1،2 ، بحيث تكون الموجودة على وسادات أجار ثابتة تماما ويمكن تصويرها بدقة عالية ، بما في ذلك طرق الدقة الفائقةالمختلفة 2. لسوء الحظ ، من المعروف أن ضمادات الأجار تؤثر على تقدم النمو ، مع مزيج من الضغوط العالية المطبقة وعوامل التخدير التي تؤخر النمو أو تسبب توقف النموالكامل 4،5.
إلى جانب هذه الطرق القياسية ، ظهرت العديد من منهجيات الموائع الدقيقة في السنوات الأخيرة ، ولكل منها مزاياها وعيوبها أو حالات الاستخدام المتخصصة6،7،8،9،10،11،12،13،14،15،16،17،18 ،19. على سبيل المثال ، قدم Gritti et al.20 طريقة يتم فيها حصر الديدان داخل غرف كبيرة. تتطور الأجنة الموضوعة في هذه الغرف وتتحرك بحرية بينما تبقى داخل المنطقة المحددة محل الاهتمام على المجهر. على الرغم من فعاليته بشكل عام ، إلا أن هذا النهج يقتصر على استخدام علامات الفلورسنت الساطعة. في الآونة الأخيرة ، اقترح Keil et al.21 نسخة معدلة من هذه الطريقة ، تتضمن صماما هيدروليكيا على رقاقة لكبح جماح أثناء الحصول على الصور ، وبالتالي معالجة بعض قيود النهج الأصلي. ومع ذلك ، نظرا لأن كلتا الطريقتين تستخدمان غرفا أكبر من تلك المستخدمة للديدان المحاصرة ، تستمر في التحرك والدوران طوال التجربة. نتيجة لذلك ، يصبح تتبع العمليات التنموية أمرا صعبا ويتطلب معالجة لاحقة شاملة للصور لتصحيح حركة.
لمعالجة هذه القيود ، يتم تكييف النهج الذي قدمه Berger et al.18 (الشكل 1) ، حيث لا يتم الاحتفاظ بالحيوانات في غرفة كبيرة ولكن يتم وضعها في قناة مصيدة مصممة لتناسب ضمن نافذة نمو أقصر (حتى 2.5 مرحلة يرقة). على عكس طرق الموائع الدقيقة الحالية ، يحافظ هذا النهج على اتجاه وهويته طوال التجربة ويسمح بالحصول على صور عالية الدقة لديدان متعددة بالتوازي وعبر مراحل يرقات متعددة داخل جهاز واحد.
يتم محاصرة باستخدام هندسة قناة متخصصة حيث يكون ارتفاع القناة قريبا من سمك في بداية التجربة ، وبالتالي منع الدوران. يتم تحديد عرض وأطوال القناة بحيث يمكن للحيوانات أن تتحرك وتنمو بمرور الوقت ، مما يسهل طرح الريش والانتقال من مرحلة اليرقات إلى الأخرى. ثم يتم تحقيق التوازي ببساطة عن طريق وضع قنوات مصيدة متعددة بجانب بعضها البعض ، بحيث تكون متعددة مرئية في مجال رؤية واحد (مجال الرؤية ، الشكل 1 أ) ، ويمكن تصوير ما يصل إلى 41 في وحدة جهاز واحدة (الشكل 1 أ). يتم تزويد الموجودة على الرقاقة باستمرار بتعليق غذاء بكتيري عالي التركيز عبر قناة منخفضة الارتفاع ، مما يساعد في نفس الوقت على حصر في نهاية مصفوفة قناة المصيدة (خطوة الارتفاع ، الشكل 1 أ ، أحمر). على غرار النهج الذي اتبعه Keil et al.21 ، يتم تنفيذ صمام هيدروليكي كبير على الرقاقة ، والذي يمكن تضخيمه أثناء الحصول على الصورة ، والضغط على على الغطاء الزجاجي ، وبالتالي تحسين تجميد (الشكل 1 ب). يقلل الحد من تشغيل الصمام الهيدروليكي لفترة الحصول على الصورة فقط من أي تأثير سلبي على نمو ، مما يضمن تطورا موثوقا به عبر جميع مراحل اليرقات. على عكس الطرق التي وصفها Gritti et al.20 و Keil et al.21 ، لا يمكن تصوير عبر تطور ما بعد الجنين بأكمله داخل نفس الجهاز. بدلا من ذلك ، يتم تقديم خمسة أجهزة متميزة ، تسمى L1 و L1-4 و L2-A و L3-A و L4-A ، تغطي مرحلة L1 بأكملها ومرحلة L2 المبكرة ، ومرحلة L1 في منتصف أواخر المرحلة حتى منتصف L4 ، ومنتصف أواخر L2 حتى مرحلة البلوغ ، ومنتصف أواخر L3 حتى سن البلوغ ، وأواخر L4 حتى سن البلوغ ، على التوالي (الشكل 1C) ، مما يسمح بالتصوير المتواصل لأجزاء كبيرة من تطور ما بعد الجنين. يتم اتباع هذا النهج بسبب الزيادة الكبيرة في حجم من L1 إلى مرحلة البلوغ ، بحيث تكون القناة المناسبة لحيوانات L1 صغيرة جدا بالنسبة للبالغين ، مما يؤدي إلى توقف النمو ، وستكون القناة المناسبة للبالغين كبيرة جدا بالنسبة ل L1s ، مما يؤدي إلى الحركة المفرطة والدوران وهروب من قنوات المصائد.
باستخدام هذا النهج ، يتم تحقيق تقدم تنموي موثوق به لمجموعة متنوعة منالأنسجة 18 ، على سبيل المثال ، التطور ما بعد الجنين لتحت الجلد (المرحلة L1 إلى L4) ، وتحريض مصائر الخلايا الفرجية (المرحلة L2 و L3) ، وتشكل الفرج (L3 إلى مرحلةالبلوغ 19) وغزو الخلايا المرساة. منذ تقديمها ، تم استخدام أجهزة التصوير طويلة المدى هذه لدراسة مجموعة متنوعة من العمليات22،23 ، مع دمج النظام الأساسي مع تقنيات مثل الفحص المجهري فائق الدقة AiryScan24 ، مما يتيح العديد من الاكتشافات المستحيلة في السابق.
في ما يلي ، يتم تقديم جوانب التشغيل لأجهزة التصوير طويلة المدى هذه في بروتوكول خطوة بخطوة ، مما يسلط الضوء على النتائج المتوقعة وبعض التحديات المحتملة عند إعداد النظام.
Protocol
تفاصيل الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. تصنيع الجهاز
ملاحظة: تم تصنيع جميع الأجهزة باستخدام البروتوكول أدناه ، ومع ذلك ، فإن الأجهزة متاحة مباشرة من المؤلفين. يتم تصنيع رقاقة منفصلة لكل نوع من أنواع الأجهزة ، حيث يتم تصنيع كل رقاقة جهاز من طبقتين من SU8 بارتفاعات مختلفة (أي طبقة الطعام وطبقة المصيدة). يتم تصنيع رقاقة الصمام على رقاقة منفصلة ، بارتفاع واحد من SU-8 ، مع حذف الخطوات 1.3-1.6. السيلانات سامة وتطلق أبخرة أكالة. لذلك ، يجب تنفيذ هذه الخطوة في غطاء الدخان. للحصول على تفاصيل حول إجراء التصنيع ، راجع Berger et al.18.
- نظف الرقائق باستخدام بلازما الهواء.
- قم بتدوير طبقة SU8 الأولى ، ثم قم بإجراء خبز ناعم عند 95 درجة مئوية.
- اكشف الطبقة الأولى ، متبوعة بخبز ما بعد 95 درجة مئوية وتطويرها.
- قم بتنظيف البلازما مرة أخرى بعد تطوير الرقاقة وتجفيفها.
- قم بتدوير طبقة SU8 الثانية ، متبوعة بخبز طري عند 95 درجة مئوية (إذا لزم الأمر ، قم بإجراء خبز أولي عند 65 درجة مئوية).
- قم بمحاذاة القناع الثاني مع الميزات الموجودة باستخدام علامات المحاذاة على جانبي الرقاقة ، ثم قم بتعريض الطبقة الثانية.
- بعد الخبز وتطوير الرقاقة ، ثم قم بإجراء خبز صلب على حرارة 200 درجة مئوية.
- عالج الرقاقة بالكلوروتريميثيل سيلان لمدة 2 ساعة على الأقل.
- قم بإعداد دفعة من 20 جم من البوليمر المسبق PDMS (الجزء أ) واخلطها جيدا مع 1 جم من الرابط المتقاطع (النسبة 20: 1 ، الجزء ب) (انظر جدول المواد).
- ديغا لمدة 10 دقائق أو حتى تختفي جميع الفقاعات.
- قم بإزالة 2 مل من خليط PDMS واحتفظ به للخطوة 1.13.
- أضف 3 جم أخرى من الرابط المتقاطع إلى خليط PDMS المتبقي ، واخلطه جيدا (النسبة النهائية حوالي 5: 1).
- باستخدام دفعة 20: 1 PDMS ، قم بتدوير رقاقة الجهاز عند 750 دورة في الدقيقة لمدة 30 ثانية.
- ضع رقاقة الصمام في طبق من الألومنيوم وقم بإلقاء 5: 1 PDMS عليها. قم بإزالة رقاقة الجهاز لمدة 10 دقائق تقريبا. بعد التفريغ ، قم بإزالة أي فقاعات متبقية باستخدام ماصة.
- اخبز طبقات الصمام والجهاز عند 70 درجة مئوية لمدة 15/20 دقيقة تقريبا على التوالي.
- قم بتقييم معالجة طبقات الجهاز والصمام عن طريق فحصها برفق باستخدام طرف ماصة أو ملاقط. يجب أن تكون طبقة الصمام صلبة ، بينما يجب أن تظل طبقة الجهاز لزجة قليلا.
- افصل طبقة الصمام وقم بقصها إلى الحجم المطلوب باستخدام مشرط أو شفرة حلاقة.
- قم بعمل ثقب وصول في قناة الصمام (المقياس 20).
- ضع رقاقة الجهاز تحت مجهر مجسم مزود بإضاءة علوية.
- ضع قطعة PDMS التي تحتوي على طبقة الصمام بعناية على رقاقة الجهاز.
- قم بمحاذاة ميزات الصمام والجهاز بدقة ، مما يضمن إزالة كل الهواء المحبوس بين الطبقات.
- انقل الجهاز المجمع إلى فرن واخبزيه على حرارة 70 درجة مئوية طوال الليل.
- افصل الجهاز عن الرقاقة.
- قم بثقب جميع فتحات الوصول المتبقية (المقياس 20).
- اربط PDMS بغطاء زجاجي باستخدام بلازما الهواء ، ثم ضع الجهاز المرتبط في فرن على حرارة 70 درجة مئوية لبضع ساعات.
2. تحضير الدودة
ملاحظة: يصف هذا القسم تحضير الدودة عن طريق التبييض ، مما يسمح بتوليد أعداد كبيرة (مئات) من. طرق التزامن الأخرى ، مثل الانتقاء اليدوي ، ممكنة ولكنها عادة ما تستغرق وقتا طويلا وتتطلب عمالة كثيفة. يتم الحفاظ على جميع الديدان المستخدمة في البروتوكول وفقا للبروتوكولات القياسية عند 20 درجة مئوية وعلى ألواح NGM المصنفة ب E. coli OP50.
- بدءا من الأطباق التي تحتوي على العديد من الحاملة.
- اغسل من اللوحة باستخدام المخزن المؤقت M9.
- أضف 5٪ كلوريد الصوديوم و 5 أمتار من هيدروكسيد الصوديوم إلى معلق الدودة (200 ميكرولتر / 100 ميكرولتر لكل 1 مل معلق دودي).
- رج مزيج التبييض برفق حتى تبدأ في التفكك (~ 10 دقائق).
- مزيج التبييض بالطرد المركزي في درجة حرارة الغرفة ، 1300 × جم لمدة 1 دقيقة.
- قم بإزالة المادة الطافية باستخدام ماصة وأضف كمية متساوية من المخزن المؤقت M9 الطازج.
- مرة أخرى ، جهاز طرد مركزي في درجة حرارة الغرفة ، 1300 × جم لمدة 1 دقيقة.
- قم بإزالة المادة الطافية وانقل الديدان المحببة إلى أنبوب سعة 15 مل مع 5 مل من المخزن المؤقت M9 الطازج.
- يرج طوال الليل عند 20 درجة مئوية.
- مرر معلق الدودة من خلال مصفاة خلية 10 ميكرومتر.
- جهاز الطرد المركزي لتعليق الدودة عند 1300 × جم لمدة 1 دقيقة في درجة حرارة الغرفة.
- تخلص من المادة الطافية وأعد تعليق الديدان بحجم متساو من المخزن المؤقت M9.
- الطرد المركزي خليط الدودة مرة أخرى عند 1300 × جم لمدة 1 دقيقة في درجة حرارة الغرفة.
- قم بإزالة المادة الطافية وانقل الديدان إلى ألواح NGM. إذا كانت هناك حاجة إلى يرقات L1 ، فاستخدمها على الفور.
- بمجرد أن تصل الديدان إلى مرحلة النمو المرغوبة ، اغسلها من اللوحة باستخدام عازلة S-Basal جديدة تمت ترشيحها من خلال مرشح 0.2 ميكرومتر.
- اسمح للديدان بالترسيب عن طريق الجاذبية أو تكريبها عن طريق الطرد المركزي عند 750 × جم لمدة 1 دقيقة في درجة حرارة الغرفة.
- تخلص من المادة الطافية وأضف حجما متساويا من المخزن المؤقت S-Basal الطازج.
- كرر خطوات الترسيب أو الطرد المركزي (الخطوتان 2.16 و 2.17)
- قم بإزالة المادة الطافية وأضف كمية متساوية من المخزن المؤقت S-Basal الطازج.
- قم بتنفيذ خطوات الترسيب أو الطرد المركزي مرة أخيرة.
- قم بإزالة معظم المادة الطافية.
- احتفظ بالديدان في الأنبوب حتى تبدأ التجربة.
3. تحضير البكتيريا
ملاحظة: يمكن استخدام سلالات بكتيريا مختلفة (على سبيل المثال ، OP50 ، NA22 ، HT114 ، إلخ) على الشريحة. اضبط نسبة وسط تدرج الكثافة المضاف إلى مزيج الطعام للتعويض عن الاختلافات في الكثافة. يتم تمرير جميع المخازن المؤقتة من خلال مرشح 0.2 ميكرومتر لإزالة الجسيمات.
- قم بإعداد 40 مل من LBroth ، إما في 2 × 20 مل في أنابيب الطرد المركزي ، أو قوارير Erlenmeyer المعقمة ، إلخ.
- تلقيح LB بالبكتيريا المقطوفة من لوحة المخزون.
- تنمو البكتيريا أثناء الاهتزاز بين عشية وضحاها عند 37 درجة مئوية (~ 16 ساعة) (OD600 = 1.9).
- بكتيريا الطرد المركزي عند 3000 × جم لمدة 10 دقائق.
- قم بإزالة المادة الطافية وأضف 2 مل من محلول S-Basal الطازج إلى كل أنبوب. اجمع بين جميع الأنابيب.
- أعد تعليق البكتيريا ميكانيكيا باستخدام ماصة.
- الطرد المركزي للبكتيريا عند 3000 × جم لمدة 5 دقائق.
- قم بإزالة المادة الطافية وأضف 2 مل من محلول S-Basal الطازج مرة أخرى.
- أعد تعليق البكتيريا ميكانيكيا باستخدام ماصة.
- الطرد المركزي للبكتيريا عند 3000 × جم لمدة 5 دقائق.
- قم بإزالة أكبر قدر ممكن من المادة الطافية وأضف 1 مل من محلول S-Basal الطازج قبل تعليق جميع البكتيريا ميكانيكيا.
- اجمع بين 0.60 مل من وسط تدرج الكثافة ، و 0.38 مل من S-Basal + 1٪ بالوزن Pluronic F-127 (بوليمر ثلاثي الكتل غير أيوني ، ممثل هنا باسم PF) مع 1 مل من تعليق بكتيريا OP50 ، أو 0.65 مل من وسط تدرج الكثافة ، 0.33 مل من S-Basal + 1٪ بالوزن PF مع 1 مل من تعليق البكتيريا NA22 أو HT114.
- امزج تحضير الطعام جيدا باستخدام خلاط دوامة.
- قم بتصفية الطعام من خلال مصفاة خلوية 5 ميكرومتر أو 10 ميكرومتر. ينصح باستخدام مصفاة أصغر بشكل خاص عند استخدام أجهزة أصغر ، على سبيل المثال ، أجهزة L1.
ملاحظة: يمكن حفظ الطعام في درجة حرارة الغرفة لمدة تصل إلى يومين.
4. إعداد رقاقة
ملاحظة: راجع الشكل 2 للحصول على نظرة عامة تخطيطية على الجهاز والأنابيب والتوصيلات. يتم تمرير جميع المخازن المؤقتة من خلال مرشح 0.2 ميكرومتر لإزالة الغبار. يشير الدبوس الفولاذي المذكور في الخطوات التالية إلى أنبوب قصير مجوف يستخدم لربط أنبوب OD الأكبر (1/16 بوصة) بالثقوب ذات القطر الصغير المصنوع في جهاز PDMS. يتم إدخال هذه المسامير الفولاذية ببساطة في القطر الداخلي للأنبوب ثم دفعها إلى مادة PDMS ، مما يربط الاثنين بشكل فعال.
- ابدأ بملء حقنة بالماء منزوع الأيونات (DI).
- قم بتوصيل إبرة 23 جم وقطعة طويلة من الأنابيب مقاس 1/16 بوصة ، مع دبوس فولاذي مجوف (مثني بزاوية 90 درجة) في النهاية. يجب أن يكون الأنبوب طويلا بما يكفي ليمتد من الملف اللولبي إلى مرحلة المجهر.
- املأ الأنبوب بماء DI من المحقنة وقم بتوصيله بمدخل الصمام عن طريق إدخال الدبوس الفولاذي في الفتحة المثقوبة (الشكل 2 أ ، ي).
- قم بإزالة المحقنة والإبرة ، ثم قم بتوصيل الأنبوب بالملف اللولبي خارج الرقاقة (الشكل 2 أ ، ي).
- باستخدام برنامج التصوير، قم بتشغيل الملف اللولبي واضغط على الجهاز لعدة دقائق لطرد كل الهواء من الصمام. تحقق من الإكمال عن طريق التحقق بصريا من واجهة الهواء والماء على الشريحة ، والتي يجب أن تظهر مظلمة وتختفي في مادة PDMS (الشكل 2 ب).
- قم بإيقاف تشغيل الملف اللولبي (الشكل 2 ج).
- املأ حقنة سعة 1 مل بمحلول البكتيريا المفلترة (~ 0.5 مل من الطعام كافية).
- قم بتوصيل إبرة 30 جم وقطعة طويلة من الأنابيب 1/32 بوصة بالإبرة.
- اضغط على المكبس لملء كل من الإبرة والأنبوب المرفق ، مع ضمان عدم وجود هواء في المحقنة أو الأنبوب.
- أدخل الأنبوب مقاس 1/32 بوصة مباشرة في مدخل الطعام لجهاز الموائع الدقيقة ، باستخدام ملاقط لمنع تلف الأنبوب (يوصى باستخدام ملاقط SMD) (الشكل 2D ، K).
- ضع المحقنة على مضخة الحقنة (الشكل 2 د).
- اضغط على مكبس المحقنة باستخدام المسمار اللولبي في الخلف لملء الجهاز بالسائل. يجب أن تظهر قطرة من السائل عند كل اتصال مفتوح (الشكل 2D ، السهم).
- قم بسد كل من مدخل ومخرج الدودة بدبوس فولاذي محكم الغلق (دبوس فولاذي بقطعة قصيرة من الأنابيب مقاس 1/16 بوصة متصلة ومختومة بالاحتراق) (الشكل 2E ، L).
- قم بالضغط الإضافي باستخدام المسمار اللولبي لإزالة أي هواء متبقي في الجهاز (الشكل 2E ، السهم).
- قم بإزالة الدبوس المحظور عند المخرج وقم بتوصيل حاوية النفايات (المصنوعة من أنبوب الطرد المركزي المبرد أو المجهري ، مع دبابيس فولاذية عالقة من خلال الغطاء ومثبتة بالغراء). يتم توصيل حاوية النفايات باستخدام قطعة قصيرة من الأنابيب مقاس 1/16 بوصة ، مع توصيل أحد طرفيها بالحاوية والطرف الآخر متصل بدبوس فولاذي مجوف (مثني 90 درجة) (الشكل 2F ، G ، M).
- ادفع المحقنة للتأكد من توصيل حاوية النفايات بشكل صحيح وعدم وجود عوائق في النظام. لهذا الغرض ، ادفع كمية صغيرة من السائل عبر النظام (أدر المسمار اللولبي على مضخة الحقنة) حتى يتدفق السائل عبر أنبوب النفايات (الشكل 2G ، السهم).
- قم بإزالة الدبوس الفولاذي الثاني المسدود.
- ادفع المحقنة حتى تظهر قطرة صغيرة من السائل عند مدخل الدودة (الشكل 2H ، N).
- قم بتوصيل قطعة أطول من الأنابيب مقاس 1/16 بوصة (15-20 سم) بحقنة سعة 1 مل مملوءة بمخزن S-Basal ، باستخدام إبرة 23 جم (الشكل 2H ، N).
- قم بتوصيل دبوس فولاذي مستقيم 23 جم بالطرف الآخر من الأنبوب.
- املأ الإبرة والأنبوب بمخزن مؤقت من المحقنة ، مع ضمان عدم وجود هواء في المحقنة أو الأنبوب.
- أدخل الدبوس الفولاذي في نهاية الأنبوب في الأنبوب الذي يحتوي على الديدان.
- ادفع كمية صغيرة من السائل عبر الأنبوب ، مع ضمان عدم ترك الهواء.
- اسحب الديدان إلى الأنبوب ، لكن لا تسحبها إلى المحقنة.
- ادفع المحقنة المتصلة بالديدان حتى تظهر قطرة صغيرة من السائل على الدبوس الفولاذي (الشكل 2H).
- أدخل الدبوس الفولاذي في مدخل الدودة (الشكل 2I).
ملاحظة: يمكن إجراء تحضير الجهاز قبل التحضير النهائي للدودة وتركه على المجهر حتى تصبح الديدان جاهزة.
5. تحميل الدودة والتصوير
- ضع الجهاز على مجهر بتكبير منخفض (5x أو 10x) أو على مجهر تشريح.
- حدد وحدة الجهاز المستخدمة حاليا وابحث عن مدخل الفيروس المتنقل باستخدام إضاءة المجال الساطع.
- ضع الجهاز بحيث يكون المدخل مرئيا على جانب واحد من مجال الرؤية ويكون الجزء الخلفي من مدخل قناة التراكب اللوني مرئيا على الجانب الآخر.
- ادفع برفق على مكبس حقنة الدودة. سوف يتدفق السائل بشكل ملحوظ من المدخل عبر مجموعة القنوات باتجاه المخرج. إن وجود البكتيريا والاختلاف في معامل الانكسار بسبب إضافة وسط تدرج الكثافة يجعل تدفق السائل واضحا.
- تأكد من ظهور الفيروسات المتنقلة من المدخل وتتدفق باتجاه الجزء الخلفي من مصفوفة القنوات.
- ادفع برفق نحو مصفوفة القنوات. بمجرد أن يواجه القناة ، ادفعها إلى القناة ، وكرر ذلك مع إضافية.
ملاحظة: يجب توجيه برؤوسها نحو المخرج لسهولة الوصول إلى الطعام. يمكن توجيهها عن طريق دفع وسحب المكبس والسباحة. - بمجرد محاصرة عدد كاف من ، ضع المحقنة ، التي لا تزال متصلة بمدخل الدودة ، على مرحلة المجهر ، حيث ستبقى طوال التجربة. قد يكون من الضروري فصل الأنبوب الدودي لفترة وجيزة عن المحقنة لتحرير أي تراكم للضغط ، ثم إعادة توصيله بعناية بالإبرة الحادة.
- إذا تم إجراء التحميل على مجهر التشريح ، فقم بنقل الجهاز إلى مجهر التصوير. يمكن أن يظل الأنبوب متصلا بالشريحة ، ويتم توصيل المحقنة بالمضخة.
- قم بتشغيل مضخة الحقنة وقم بتشغيلها بمعدل محدد مسبقا يبلغ 1 ميكرولتر / ساعة لمدة 0.5 ميكرولتر ، وقم بزيادة المعدل بمقدار 100 ميكرولتر / ساعة لمدة 0.5 ميكرولتر ، وخفضها مرة أخرى إلى 1 ميكرولتر / ساعة. تتكرر هذه الدورة تلقائيا للتجربة بأكملها. للحصول على معلومات حول كيفية برمجة المضخة ، راجع دليل المستخدم الخاص بالجهاز.
- ضع الجهاز على مرحلة المجهر وتأكد من تثبيته بإحكام (يمكن العثور على اقتراحات لآليات التركيب في الشكل 3 أ).
- إذا لم يتم التحميل على مجهر التصوير، فحدد وحدة اهتمام الجهاز عند التكبير المنخفض.
- قم بالتبديل إلى تكبير التصوير المطلوب.
ملاحظة: الأجهزة متوافقة مع جميع أنواع الأهداف. - تحديد والمناطق ذات الأهمية داخل مصفوفة قناة المصيدة وإعداد ظروف التصوير المطلوبة.
- الصورة في ظروف التصوير المرغوبة ، مع الصمام الموجود على الرقاقة ، يتم تشغيله من خلال الملف اللولبي قبل 10 ثوان من الحصول على الصورة ، بحيث يتم تثبيت في مكانها.
ملاحظة: سيؤدي تشغيل الصمام الموجود على الرقاقة إلى إطالة وتسطيحها ، مما قد يتطلب تعديلات على منطقة التصوير ذات الاهتمام (ROI).
6. إعداد الإعداد
ملاحظة: يشير هذا القسم إلى الإعداد الأولي لآلية التحكم في الجهاز ولا يلزم تكراره قبل كل تجربة. راجع الشكل 3 ب ، ج. نظرا لأن العديد من الملفات اللولبية تتطلب جهدا أعلى ، فمن المرجح ألا يتم توصيل الملف اللولبي مباشرة بالمتحكم الدقيق ولكن عبر مرحل أو MOSFET (انظر الشكل 3C).
- حدد مصدر الهواء المضغوط (على سبيل المثال ، تركيب إمداد الجدار أو أسطوانة الغاز).
- قم بتوصيل مصدر الضغط بمنظم ضغط مناسب (نطاق ضغط 0-2 بار) باستخدام أنبوب 6 مم (مصدر الجدار) أو قم بتوصيل منظم مناسب مباشرة بأسطوانة الغاز.
- قم بتوصيل منظم الضغط بمدخل صمام الملف اللولبي (أنبوب 6 مم ، انظر الشكل 3 ب).
- ضع الملف اللولبي بالقرب من مرحلة المجهر قدر الإمكان (~ 0.5-1 متر من المرحلة يقترح ، على الرغم من إمكانية مسافات أطول إذا لزم الأمر).
- قم بتوصيل صمام الملف اللولبي إلكترونيا بوحدة التحكم المحددة. تتوفر خيارات مختلفة ، مثل التحكم فيها باستخدام لوحة تحكم منفصلة (على سبيل المثال ، Arduino) أو بطاقة DAq موجودة.
7. التنظيف والتخزين
- بمجرد اكتمال التجربة ، قم بإزالة الجهاز من المجهر.
- قم بإزالة سائل الغمر. يمكن إزالة زيت الغمر بالمذيبات العضوية (مثل الأسيتون والميثانول وما إلى ذلك).
- ضع الجهاز على سطح مستو وافصل جميع الأنابيب باستثناء أنبوب الصمام. لفصل كل أنبوب بأمان ، اضغط لأسفل على PDMS بالقرب منه واسحبه برفق. لا ترفع الجهاز وثنيه ، فقد يتسبب ذلك في كسر زجاج الغطاء.
- نظف سطح PDMS بنسبة 70٪ من الإيثانول.
- قم بتخزين الجهاز في درجة حرارة الغرفة مع توصيل أنبوب الصمام.
ملاحظة: يمكن إعادة استخدام الجهاز حتى يتم استخدام جميع الوحدات ، على الأرجح دون الحاجة إلى إعادة ملء أنبوب الصمام. ومع ذلك ، سوف يتبخر الماء الموجود في أنبوب الصمام على مدى فترة طويلة وقد يحتاج في النهاية إلى إعادة تعبئته.
النتائج
تصميم الجهاز وأبعاده
تم تصميم خمسة أجهزة متميزة لاستيعاب جميع مراحل اليرقات الأربع. تم تعيين هذه الأجهزة على النحو التالي: L1 ، لليرقات L1 التي يتم تحميلها مباشرة بعد الفقس وتصويرها حتى المرحلة L2 ؛ L1-L4 ، قادرة على حمل اليرقات من منتصف إلى أواخر المرحلة L1 من خلال أوائل إلى منتصف L4 ؛ L2-A ، مناسب للحيوانات من منتصف L2 تقريبا إلى مرحلة البلوغ ؛ L3-A ، للحيوانات من منتصف L3 تقريبا إلى مرحلة البلوغ الصغير ؛ و L4-A ، الذي يستوعب من مرحلة L4 المتأخرة تقريبا إلى مرحلة البلوغ الصغيرة.
تتبع جميع الأجهزة نفس التصميم الأساسي ، الذي يتكون من مدخل دودة ، و 1 (أو 2 في حالة تبادل الوسائط) ، ومخرج (مدخلات) طعام بكتيري ، ومخرج نفايات مشترك. بين جزء المدخل والمخرج ، يتم وضع مجموعة من 41 قناة مصيدة متوازية ، مع فصل جانب المدخل والمخرج بشكل فعال بواسطة قناة إمداد الطعام ذات الارتفاع المنخفض (الشكل 1 أ ، أ ′). تم اختيار أبعاد القناة لتكون أطول وأوسع بكثير من الديدان التي تم تحميلها في بداية التجربة ، بطول / عرض 400/15 ميكرومتر للأجهزة L1 ، و 575/22 ميكرومتر لأجهزة L1-L4 ، و 800/27 ميكرومتر لأجهزة L2-A ، و 900/30 ميكرومتر لأجهزة L3-A و 1000/65 ميكرومتر لأجهزة L4-A (الملف التكميلي 1 ، الملف التكميلي 2 ، الملف التكميلي 3 ، الملف التكميلي 4 ، والملف التكميلي 5).
تم اختيار طول القناة ليتناسب مع الحجم الذي وصلت إليه بنهاية التجربة ، بينما تم اختيار العرض بحيث تشغل الديدان في بداية التجربة ما يقرب من ثلثي عرض القناة. يسمح هذا التصميم بمساحة كافية للنمو والحركة أثناء طرح الريش مع منع الديدان من الدوران أو الدوران. على عكس العرض ، تم ضبط ارتفاع القناة بالقرب من سمك الديدان في بداية التجربة: 8 ميكرومتر ليرقات L1 المبكرة ، و 12 ميكرومتر ليرقات L1 المتوسطة / المتأخرة ، و 15 ميكرومتر لليرقات منتصف L2 ، و 17.5 ميكرومتر لليرقات منتصف L3 ، و 22.5 ميكرومتر لليرقات L4 المتأخرة ، المقابلة ل L1 ، L1-L4 ، L2-A ، L3-A ، وأجهزة L4-A ، على التوالي. يضمن ارتفاع القناة المنخفض ، جنبا إلى جنب مع العرض المحدد بعناية (الحفاظ على نسبة الارتفاع إلى العرض من 0.5-0.6) ، بقاء الديدان في اتجاه ثابت. والجدير بالذكر أنه مع ارتفاع قناة صغير بما فيه الكفاية ، يتم وضع جميع الديدان باستمرار في الاتجاه الجانبي المطلوب.
تم تصنيع قناة الإمداد الغذائي على ارتفاع 3 ميكرومتر ل L1 ، و 5 ميكرومتر لجميع الأجهزة الأخرى ، مما يضمن أن البكتيريا يمكن أن تصل بسهولة إلى دون هروب من قنوات المصائد. تستخدم جميع الأجهزة نفس طبقة إمداد الطعام (الملف التكميلي 6) ونفس طبقة الصمام (الملف التكميلي 7). لاحظ أن طبقة الصمام مصنعة على رقاقة منفصلة على ارتفاع 20 ميكرومتر وتوضع فقط على طبقة الجهاز أثناء تصنيع جهاز PDMS (الخطوة 1.21).
تتطلب هذه القيود الهندسية الخاصة بالمرحلة ، الضرورية لمنع الديدان من الدوران أو الانعكاس من الرأس إلى الذيل ، استخدام ثلاثة أنواع متميزة من الأجهزة لاستيعاب جميع مراحل اليرقات. إذا تم وضع يرقات L1 في قناة بحجم البالغة الصغيرة ، فلن تظل مستقرة وستخرج بسرعة من قناة المصاخة.
C. تحضير ايليجانس
ما لم ينص على خلاف ذلك ، تم الحفاظ على الديدان وفقا للبروتوكولات القياسية25 على ألواح NGM المصنفة ب E. coli OP50 عند 20 درجة مئوية. يصف قسم تحضير الدودة بوضوح تحضير مجموعة متزامنة من الديدان المستخدمة في تجربة التصوير. تم إجراء التزامن وفقا للبروتوكولات القياسية باستخدام مبيض هيبوكلوريت الصوديوم26 ، وتم تعديله بخطوة ترشيح إضافية لإزالة الحطام غير المفرغة بعد المجاعة طوال الليل. الهدف هو الحصول على العديد من يرقات L1 المتزامنة ، والتي يتم زرعها بعد ذلك على ألواح NGM أو تحميلها مباشرة في جهاز التصوير. طرق التزامن الأخرى ، مثل الانتقاء اليدوي أو وضع البيض المتحكم فيه ، مناسبة بنفس القدر. ومع ذلك ، فهي أكثر صعوبة في توليد كافية (يوصى ب 200 لكل شرط).
بمجرد وصول الديدان إلى المرحلة المرغوبة ، يمكن غسلها برفق من لوحة NGM باستخدام S-Basal نظيف (يتم ترشيحه بشكل مثالي من خلال مرشح 0.2 ميكرومتر). الهدف هو جمع أكبر عدد ممكن من دون جمع البكتيريا أو الحطام من اللوحة. يتم جمع في أنبوب طرد مركزي صغير وغسلها 2-3 مرات باستخدام عازلة S-Basal جديدة ، وأخيرا إزالة أكبر قدر ممكن من السوائل. ثم تؤخذ مباشرة من الحجم المركز. إذا كان تركيز منخفضا جدا ، فسيكون التحميل أبطأ ، مما يتطلب كمية أكبر من السائل لتدفق عبر الجهاز ويزيد من خطر سد قنوات المصيدة بالحطام.
تحضير الطعام البكتيري
يتم نمو البكتيريا باتباع البروتوكولات القياسية ، مع زيادة تركيز البكتيريا الأولي (OD600 = 1.9) بمقدار 40 ضعفا تقريبا في المخزن المؤقت S-Basal (الذي يتم ترشيحه من خلال مرشح 0.2 ميكرومتر) وخلطه مع وسط تدرج الكثافة والمخزن المؤقت S-Basal الذي يحتوي على PF (يتم ترشيحه من خلال مرشح 0.2 ميكرومتر). النتيجة المتوقعة من خطوة العملية هذه هي تحضير تعليق بكتيري كثيف للغاية ومنع ترسيب البكتيريا أثناء تجربة التصوير. الكثافة العالية ضرورية لإطعام على الرقاقة بمعدلات التدفق المنخفضة المستخدمة في توصيل الوسائط (1 ميكرولتر / ساعة). الغرض من وسط تدرج الكثافة هو منع ترسيب البكتيريا أثناء التجربة ، والغرض من PF هو منع البكتيريا من الالتصاق بجدران القناة. كل من وسط تدرج الكثافة و PF غير سامين ولا يؤثران على بقاء.
إذا تم استخدام نوع مختلف من البكتيريا في التجربة ، فيجب تحديد التركيز الضروري لوسط تدرج الكثافة. يمكن تحقيق ذلك عن طريق خلط تعليق البكتيريا بكميات متفاوتة من الوسط متبوعا بالطرد المركزي. إذا كان تركيز تدرج الكثافة منخفضا جدا ، فسوف ترسب البكتيريا. إذا كان التركيز مرتفعا جدا ، فسوف تطفو البكتيريا. بمجرد العثور على تركيز مناسب ، يوصى بالتحقق من صحة النتيجة عن طريق ترك خليط البكتيريا في درجة حرارة الغرفة لمدة 48 ساعة تقريبا للإشارة إلى كيفية تصرف الطعام طوال التجربة. بعد التجربة ، يوصى أيضا بفحص المحقنة التي يتم من خلالها تزويد البكتيريا والتأكد من عدم ترسيب البكتيريا أو طفوها. يمكن تعويض الفرق في الحجم الناتج عن إضافة كميات مختلفة من Optiprep عن طريق إضافة أكثر أو أقل من S-Basal + 1٪ حسب الوزن PF. وبالمثل ، يمكن إضافة وسائط أو مركبات إضافية (على سبيل المثال ، أوكسين) إلى التعليق ، ويتم طرح الحجم الإضافي من حجم S-Basal + 1٪ بالوزن PF.
التحضير للإعداد
قم بإعداد نظام إمداد الضغط في أقرب وقت ممكن من المجهر ، بحيث يمكن تشغيله بسهولة. يجب أن تظل جميع عمليات تشغيل الأنابيب ، وخاصة الأنابيب 1/16 بوصة المتصلة بالشريحة ، قصيرة (أقل من 0.5 متر لأنابيب OD 1/16 بوصة) (الشكل 2 والشكل 3 ب). كما هو موضح في القسم أعلاه ، يمكن تحقيق التحكم في الكمبيوتر في الصمام الموجود على الرقاقة بعدة طرق. يجب أن يكون ذلك ممكنا في أي برنامج مجهر (تم اختباره في Micro-Manager و Metamorph و NIS و ZenBlue) ، إما عن طريق توصيل لوحة تحكم مخصصة (على سبيل المثال ، Arduino) أو عن طريق توصيل النظام ببطاقة الحصول على البيانات الحالية (DAq) ، باستخدام مخرج رقمي. يجب بعد ذلك تكوين إخراج اللوحة المحدد كغالق ، والذي يتم تشغيله قبل 10 ثوان من الحصول على الصورة أو يتم تشغيله يدويا أثناء إعداد الجهاز. كما ذكرنا سابقا ، لا ينصح بتوصيل الملف اللولبي مباشرة بالمتحكم الدقيق ؛ بدلا من ذلك ، الاتصال عبر MOSFET أو مفتاح ترحيل بحيث يظل الملف اللولبي والمتحكم الدقيق معزولين إلكترونيا (الشكل 3C).
على غرار أنابيب إمداد الضغط ، حافظ على جميع الأنابيب الأخرى تعمل على الرقاقة (1/16 "OD و 1/32" OD) أقصر ما يمكن. حافظ على أنابيب الدودة والنفايات (1/16 بوصة OD) أقل من 2.5 سم و 20 سم على التوالي. يجب أن تكون أنابيب إمداد البكتيريا (1/32 بوصة OD) طويلة بما يكفي للاتصال من مضخة الحقنة بالجهاز بمجرد وضعها على مرحلة المجهر. ومع ذلك ، يوصى بشدة بتقصير هذا قدر الإمكان ووضع مضخة الحقنة بالقرب من مرحلة المجهر ، على سبيل المثال ، بجوار المسرح ، باستخدام رف أو فوق حاوية حاضنة. سيؤدي أي طول للأنابيب المضافة إلى النظام إلى زيادة الضغط الخلفي الذي يشعر به عند تحميل في الجهاز ويزيد الضغط الكلي على المحاصرة.
تشغيل الجهاز
يمكن تحضير جميع الأنابيب وتوصيلها بالإبرة الحادة والدبوس الفولاذي والحقنة في هذه المرحلة (بداية خطوة البروتوكول 4). كما ذكرنا أعلاه ، حافظ على طول الأنبوب قصيرا قدر الإمكان (الشكل 2J-N). الأهم من ذلك ، يجب توخي الحذر من عدم وجود فقاعات هواء في المحاقن أو الأنابيب ، لأنها ستتداخل مع تحميل وقد تؤدي إلى هروب من قناة المصيدة أثناء التجربة. يمكن إزالة فقاعات الهواء من المحقنة بعدة طرق مختلفة ، على سبيل المثال ، عن طريق ملء المحقنة ، وقلبها ، ورجها برفق بحيث ترتفع فقاعات الهواء إلى أعلى المحقنة (لا ينصح بنقر المحقنة ، حيث يمكن أن يؤدي ذلك إلى احتجاز فقاعات هواء إضافية). بدلا من ذلك ، يمكن ملء المحقنة عن طريق لصقها في المخزن المؤقت وتحريك المكبس بسرعة لأعلى ولأسفل لإزالة معظم الفقاعات بسرعة.
بمجرد ملء المحقنة وخالية من الفقاعات ، يتم توصيل الإبرة الحادة والأنبوب وتعبئتها بمخزن مؤقت. يجب أيضا توخي الحذر بشكل خاص عند ملء المحقنة ، حيث يمكن بسهولة احتجاز الهواء في الجزء البلاستيكي من الإبرة الحادة. إذا كان الهواء محاصرا ، فاستبدل الإبرة. بدلا من ذلك ، يمكن أن يؤدي الملء المسبق للإبرة بالسائل ، على سبيل المثال ، باستخدام ماصة ، إلى تخفيف المشكلة.
مع وجود جميع المكونات في مكانها ، يمكن توصيل الأنبوب بالجهاز ، بدءا من الأنبوب الذي يربط الملف اللولبي والصمام الموجود على الرقاقة (الشكل 2A-C ، J). يمتلئ هذا الأنبوب في البداية بالماء منزوع الأيونات ، ويتم ضغط النظام لإزالة كل الهواء من قناة الصمام المسدود. PDMS نفاذية للغاز. وبالتالي ، فإن الضغط المرتفع سيدفع كل الهواء من القناة إلى PDMS ، تاركا قناة الصمام مملوءة بالماء. يمكن اتباع هذه العملية على المجهر ، مما يضمن ملء قناة الصمام بأكملها. بعد ملء الصمام ، يمكن توصيل مصدر البكتيريا ، ويمكن ملء الجهاز وضغطه عن طريق سد جميع المداخل / المنافذ المفتوحة (الشكل 2D ، E ، K ، L). يتم إزاحة الهواء ، ويمكن مراقبة العملية على المجهر. بمجرد إزاحة كل الهواء ، يجب أن تملأ البكتيريا الجهاز بشكل موحد. تتم إزالة دبابيس الحظر ، ويتم توصيل أنبوب جمع النفايات (الشكل 2F ، G ، M). في هذه المرحلة ، يجب أن تتدفق كمية صغيرة من السائل عبر الجهاز إلى أنبوب جمع النفايات ، مما يضمن فتح جميع التوصيلات بالأنبوب. يمكن تأكيد ذلك بصريا قبل توصيل الأنبوب بأنبوب التجميع. إذا لم يتدفق أي سائل إلى أنبوب جمع النفايات ، فمن المحتمل أن يكون مسدودا. سيؤدي ذلك إلى تراكم الضغط على التجربة ، مما يؤثر سلبا على المحاصرة. إذا كان الأنبوب أو وصيلاته مسدودا ، فقم بإزالته وتنظيف جميع التوصيلات باستخدام إبرة أو اغسلها بحقنة مملوءة بالماء.
أخيرا ، يمكن توصيل أنبوب الدودة (الشكل 2H ، N). يتم التقاط الديدان من أنبوب الطرد المركزي ببساطة عن طريق امتصاصها في الأنبوب المتصل بالمحقنة المملوءة ب S-Basal. يجب سحب فقط إلى الأنبوب ، وليس المحقنة. يمكن بعد ذلك توصيل الأنبوب بالجهاز. قبل ذلك ، يتم دفع كمية صغيرة من السائل من الجهاز والأنبوب الدودي ، ويتم توصيل القطرتين بحيث لا يتم دفع الهواء إلى الجهاز أثناء التحميل.
تحميل الدودة
مع إجراء جميع التوصيلات ، يمكن تحميل عن طريق دفع وسحب مكبس حقنة الدودة. سيتم طرد من المدخل باتجاه مصفوفة قناة المصيدة ؛ ومع ذلك ، سوف يسبحون بشكل طبيعي ضد التدفق الذي يختبرونه. لذلك ، تحتاج إلى إعادة توجيهها بحيث تواجه رؤوسها قناة المصيدة. يتم تحقيق الاتجاه الصحيح للحيوان عن طريق دفع المكبس وسحبه وإعطاء الوقت للدوران في الاتجاه المطلوب. يمكن تحقيق ذلك تقريبا على أساس دودة واحدة ولكنه سيتطلب بعض الممارسة. بمجرد توجيه بشكل صحيح ، يمكن دفعها إلى قناة المصيدة والانزلاق إلى نهاية القناة ، حيث توقفها خطوة الارتفاع (الشكل 1 أ ، ب). إذا لم تتمكن من دخول القناة ، فهي كبيرة جدا بالنسبة للجهاز المحدد وتحتاج إلى تصويرها في جهاز أكبر. إذا كان بإمكان الدوران أو الالتفاف عند وضعها في قناة المصيدة ، فهي صغيرة جدا ، ويجب استخدام جهاز أصغر ، أو يجب ترك لتنمو لبضع ساعات أخرى.
الأهم من ذلك ، أن في القنوات المختلفة لن تؤثر على بعضها البعض. لذلك ، لن تؤثر المحملة بشكل غير صحيح على تلك التي تم تحميلها بشكل صحيح ، ومع ذلك ، لن يكون لديها وصول كاف إلى الطعام وبالتالي ستنمو بشكل أبطأ أو توقف التطور.
إذا تم تحميل في العمر المناسب ، فيجب أن تحدث الحد الأدنى من الحركة على طول محور القناة الطولية. ومع ذلك ، فإن حرة في التذبذب (الشكل 1 ب) وتبدأ في التغذية في غضون دقيقتين. إذا أظهرت حركة كبيرة على طول محور القناة الطولية ، فمن المحتمل أن يكون هذا ناتجا عن تراكم الضغط في الجهاز أو بسبب فقاعة هواء مستقرة في مكان ما في الأنبوب أو الإبرة الحادة أو المحقنة. يمكن تحرير تراكم الضغط داخل الجهاز عن طريق فصل الأنبوب الدودي برفق من الإبرة الحادة وإعادة توصيله برفق. إذا بقيت فقاعة هواء مستقرة داخل النظام على الرغم من الخطوات والاحتياطات المذكورة أعلاه ، فقد تحتاج إلى إزالة حقنة الدودة بأكملها واستبدالها بأخرى جديدة بدون فقاعات هواء. تعمل فقاعات الهواء في النظام كنوابض يتم ضغطها أثناء التحميل ويتم إطلاقها ببطء بعد تحميل. يمكن أن يؤدي التدفق الناتج عن تمدد فقاعات الهواء إلى عدم استقرار النظام ، مما يدفع إلى الخروج من قنوات المصيدة.
الحصول على الصور وتطويرها على الرقاقة
أخيرا ، بمجرد تحميل ، يمكن أن يبدأ الحصول على الصور. من حيث المبدأ ، تتوافق الأجهزة مع معظم طرق التصوير ، المجال الساطع ، التألقالإشعاعي 18،19،22،23 (الشكل 4) ، قرص الغزل متحدالبؤر 19 ، وحتى طرائق الدقة الفائقة (AiryScan24) ، حيث يتم إجراء جميع الصور من خلال زجاج غطاء بسمك 170 ميكرومتر. وبالتالي ، يظهر جهاز الموائع الدقيقة تأثيرا ضئيلا أو معدوما على جودة الصورة التي يمكن تحقيقها على الشريحة. ومع ذلك ، يجب اختيار ظروف التصوير المناسبة التي لا تؤثر على بقاء بغض النظر عن طريقة التصوير. ستؤدي شدة الإثارة العالية بسهولة إلى تبييض الفلوروفور وتوقف النمو بسبب الطاقة العالية والحرارة المنقولة على العينة. يوصى بأوقات التعرض القصيرة (~ 10 مللي ثانية) وشدة الإثارة المنخفضة (أقل من 10٪ من مصدر LED الفلوري النموذجي) ، مما ينتج عنه صورة قابلة للاستخدام عند إعداد تباين للحد الأدنى = 0 والحد الأقصى = 1000 (عند استخدام كاميرا 16 بت) (الشكل 4).
يتم عرض البيانات التمثيلية التي تم الحصول عليها باستخدام أجهزة L1 و L1-4 و L2-A في الشكل 4. إظهار تطور C . ايليجانس الخلايا الظهارية من الفقس / الجوع بين عشية وضحاها إلى مرحلة اليرقات في منتصف L2 (الشكل 4 أ ، الفيلم التكميلي 1) ، تحريض خلايا سلف الفرج المصير 1 درجة وانقسامها اللاحق من أواخر L1 إلى مرحلة اليرقات L4 المبكرة (الشكل 4 ب ، الفيلم التكميلي 2) وأخيرا تكوين C. ايليجانس الفرج من مرحلة اليرقات L3 المبكرة حتى الانعكاس عند الانتقال إلى مرحلة البلوغ (الشكل 4 ج، الفيلم التكميلي 3).
يرافق كل تطبيق تقدير كمي لمقاييس توقيت التطور المختلفة. يتم عرض الصور في الشكل 4 أ ، ب دون أي معالجة لاحقة مطبقة ، أي لم يتم تطبيق أي تفكيك أو تسجيل للصورة. من ناحية أخرى ، تم فك التركيب في الشكل 4C 27 وتسجيلها ، مما يسلط الضوء على التحسينات في جودة الصورة الممكنة عند استخدام أجهزة التصوير طويلة المدى.
أولا ، تحديد بداية كل انقسام لخلايا التماس للحيوانات الموضحة في الشكل 4 أ (انظر الفيلم التكميلي 1 للحصول على دورة بدوام كامل) ، مما يشير إلى التقسيم المتسق وفي الوقت المناسب لجميع الخلايا عبر 12 (الشكل 4 د). باستخدام خلايا التماس ، تم أيضا تقييم توقيت النمو العام عبر جميع مراحل اليرقات الأربع ، ووجد أن جميع انقسامات خلايا التماس قد اكتملت بعد 12.0 ساعة ± 1.7 ساعة (متوسط ± SD) في L1 (ن = 22) ، 10.2 ساعة ± 1.0 ساعة في L2 (ن = 27) ، 10.9 ساعة ± 1.4 ساعة في L3 (ن = 27) ، و 14.6 ساعة ± 2.2 ساعة في L4 (ن = 19). تتوافق هذه البيانات مع قيم الأدبيات2،28 بالإضافة إلى القيم المقاسة في المزروعة على الطبق ، وأسفرت عن متوسط أوقات النمو ل L1 15 ساعة (ن = 21) ، L2 10 ساعات (ن = 15) ، L3 12 ساعة (ن = 21) و L4 12.5 ساعة (ن = 61) (مقتبس من Berger et al.18). من المحتمل أن تكون التأخيرات الطفيفة التي لوحظت نتيجة لاكتساب الصور والسمية الضوئية الناتجة أو زيادة الحبس بمجرد نمو وستكون قناة فخ.
ثانيا ، تابعنا نمو عبر مرحلتي L2 و L3 ، وقمنا بتحديد طول الغدد التناسلية كمؤشر ممتاز للتقدم التنموي (الشكل 4E ، انظر الفيلم التكميلي 2 للحصول على دورة بدوام كامل). كما هو الحال مع انقسام خلايا التماس ، يمكن قياس طول الغدد التناسلية الدقيقة بفضل اتجاه المستقيم ، وتم العثور على نمو ثابت للغدد التناسلية عبر جميع المصورة (ن = 19). لوحظ أول قسم VPC في هذه التجارب بعد 14.26 ساعة ± 2.47 ساعة بعد بدء التجربة (~ 30 ساعة بعد البذر) ، والثانية حدثت بعد 1.46 ساعة ± 0.13 ساعة (ن = 19). تتفق هذه البيانات بشكل جيد مع قيم الأدبيات المحددة على لوحات NGM29،30. وجد يولينغ وأمبروس30 أن الانقسام الأول يحدث بعد حوالي 29 ساعة والثاني بعد حوالي 3 ساعات.
أخيرا ، تم تحديد الوقت الذي يتم فيه الوصول إلى مراحل محددة في تطور الفرج (الشكل 4F ، انظر الفيلم التكميلي 3 للدورة التدريبية بدوام كامل) ، وتحديدا تقييم الوقت اللازم للتقدم من الغزو (L4.0 ، t1) إلى منتصف المرحلة L4 (L4.5 ، t4) وفقا للمراحل الفرعية التي حددها Mok et al.31. كان متوسط وقت التقدم بين t1-t2 3.8 ساعة ± 1.2 ساعة ، وبين t2-t3 كان 3.5 ساعة ± 1.2 ساعة ، وبين t3-t4 كان 2.8 ساعة ± 1.6 ساعة (ن = 7) ، مما يشير إلى تقدم تنموي خطي تقريبا. على غرار مقايسة توقيت النمو ، تبدو هذه الأوقات ، وخاصة t1-t2 ، متأخرة قليلا مقارنة بقيم الأدبيات المبلغ عنها (t1-t2: 0.7 h ، t2-t3: 3 h ، t3-t4: 2.3 h31) ، ربما بسبب أبعاد الجهاز الضيقة التي تبطئ طرح الريش. ومع ذلك ، يظل توقيت النمو متسقا للغاية بين ، ويتقدم جميعهم بنجاح إلى مرحلة البلوغ.
تعويض حركة والانجراف المجهري
عادة ما تكون حركة في جميع أنحاء مكدس Z واحد ضئيلة عند تشغيل الصمام الموجود على الرقاقة. ومع ذلك ، لا يتوقع أن تظل ساكنة تماما. يمكن تعويض الارتعاش المتبقي الذي لوحظ في كومة واحدة عن طريق زيادة الضغط لتشغيل الصمام الموجود على الرقاقة ، أو تقليل وقت التعرض المستخدم ، أو زيادة الخطوة Z المحددة لتسريع اكتساب المكدس. يمكن تقليل وقت الحصول على المكدس باستخدام محرك أقراص بيزو Z ، مما يؤدي إلى حركة Z أسرع بكثير مقارنة بمحرك تركيز المجهر التقليدي ، أو من خلال استخدام مرشحات متعددة النطاقات (على سبيل المثال ، GFP / mCherry) بحيث يمكن الحصول على ألوان منفصلة دون الحاجة إلى تغييرات في المرشح تستغرق وقتا طويلا. كمرجع، في الأمثلة المقدمة (الشكل 4 والفيلم التكميلي 1، والفيلم التكميلي 2، والفيلم التكميلي 3)، كان وقت اكتساب المكدس عادة بين 3 و8 ثوان. يمكن أيضا إزالة الحركة المتبقية من خلال طرق تسجيل الصور المختلفة إذا لزم الأمر.
من المتوقع أن تنمو الموجودة على الرقاقة بشكل مطرد. وبالتالي ، فإن الميزات ذات الأهمية ستتغير حتما على طول محور القناة الطولية (الشكل 4 أ ، ب ، الفيلم التكميلي 1 والفيلم التكميلي 2). لذلك ، يوصى بتعيين مجال الرؤية للتصوير بحيث يمكن أن تنمو ميزة الاهتمام إلى مجال الرؤية ولا تضيع على مدار التجربة (الشكل 1 ب والشكل 4 أ ، ب). بدلا من ذلك ، يمكن تصوير في العديد من مجالات الرؤية المجاورة ، والتي تغطي جسم بالكامل. ومع ذلك ، قد يؤدي هذا إلى مزيد من السمية الضوئية والإجهاد. كما هو الحال مع Z-motion ، يمكن لإجراءات التسجيل المختلفة أن تعوض عن حركة في القناة بمرور الوقت. إذا أظهرت حركة غير منتظمة على طول المحور الطولي ، أكثر اتساعا مما يمكن أن يعزى إلى النمو ، فمن المحتمل أن يكون سبب ذلك فقاعة هواء.
يحتوي كل جهاز تصوير طويل المدى على ست وحدات تصوير فردية ، يمكن استخدام كل منها في تجربة منفصلة. يمكن أن تستوعب كل وحدة ما يصل إلى 41 ، ويتم تباعد قنوات المصيدة بحيث يمكن تصوير متعددة في مجال رؤية واحد. بالإضافة إلى ذلك ، يمكن تصوير العديد من مجالات الرؤية داخل وحدة أو جهاز واحد. كما هو الحال مع جميع عينات المجهر ، قد تؤدي الحركة عبر سطح العينة إلى انحراف التركيز بسبب فقدان وسائط الغمر. يمكن تعويض هذا الانجراف باستخدام زيت غمر منخفض اللزوجة أو من خلال طرق مختلفة للتركيز البؤري التلقائي. ومع ذلك ، قد لا تعمل بعض أنظمة التركيز البؤري التلقائي للأجهزة عند استخدامها مع جهاز الموائع الدقيقة PDMS ، حيث تستخدم الانتقال من الزجاج إلى وسط مائي كنقطة مرجعية (جانب العينة من زجاج الغطاء). يمتلئ جزء كبير من مجال الرؤية بالسيليكون داخل الجهاز ، والذي يحتوي على معامل انكسار أعلى من الماء. على الرغم من أن هذا لا يؤثر على جودة الصورة ، إلا أنه قد يؤثر سلبا على التركيز البؤري التلقائي. عند تصوير مجال رؤية واحد ، يكون انحراف التركيز البؤري الذي لوحظ داخل الجهاز ضئيلا (أقل من 2 ميكرومتر). إذا لوحظ انجراف تركيز مفرط ، فقد ينتج ذلك عن عدم الاستقرار الحراري لنظام المجهر أو البيئة ، أو حركة XY المفرطة التي تكتسب العديد من مجالات الرؤية ، أو التركيب غير الصحيح للجهاز على المجهر (انظر الشكل 3 أ للحصول على آليات التركيب المقترحة).
وبالمثل ، قد تؤدي حركة XY المفرطة والتركيب غير الصحيح أيضا إلى انجراف XY. نظرا لأن الجهاز وهدف المجهر متصلان عبر سائل الغمر ، فقد تتسبب الحركات السريعة في X أو Y أو Z في تطبيق القوى على الجهاز. إذا تم تركيب الأجهزة بشكل صحيح ولم تعمل عليها أي قوى خارجية ، فهي مستقرة بشكل استثنائي مع الحد الأدنى من انجراف التركيز وعدم وجود انجراف XY.
أخيرا ، إذا كانت معلمات النظام المحددة غير مناسبة ، فقد تؤثر أجهزة الموائع الدقيقة PDMS سلبا على نمو. تتأثر الجدوى بالضغط المفرط للصمام، أو السمية الضوئية العالية الناتجة عن شدة الإثارة العالية، أو أوقات التعرض الطويلة، أو الفترات الزمنية القصيرة بين عمليات الاستحواذ على المكدس. خاصة عند استخدام هذا النظام لأول مرة ، يوصى بشدة بتقييم صلاحية باستخدام علامة فلورية ساطعة أو تصوير المجال الساطع ، مما يضمن أن حالة التصوير لا تؤثر على نمو. بمجرد أن تتطور بشكل موثوق ، يمكن تغيير معلمات التصوير حسب الحاجة.
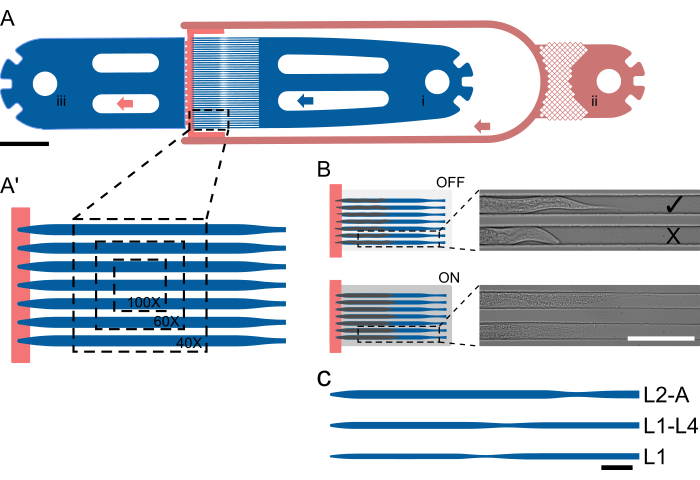
الشكل 1: تخطيط الجهاز والتشغيل التخطيطي. (أ) نظرة عامة على الجهاز توضح وحدة واحدة مع مدخل الدودة (i) ومدخل الطعام البكتيري (ii) والمخرج العام (iii). (أ) عرض مكبر لقناة المصيدة في جهاز L2-A ، مما يسلط الضوء على عدد الديدان المرئية في مجال رؤية واحد بتكبير مختلف (40x-100x). (ب) المبدأ الوظيفي للصمام الموجود على الرقاقة. عند إيقاف التشغيل ، يتم تحديد ارتفاع القناة بحيث يمكن للحيوانات أن تتناسب بشكل مريح مع قناة المصائد. عند التشغيل ، ينخفض ارتفاع القناة ، مما يضغط على على الغطاء الزجاجي ، وبالتالي يشل حركة المحاصرة بشكل عكسي. تظهر الصور حيوانين محاصرين على رقاقة تم الحصول عليهما باستخدام الصمام الموجود على الرقاقة OFF ومع تشغيل الصمام ، مع استقامة واستطالة بشكل واضح تحت الضغط. تم تحميل العلوي بشكل صحيح ويواجه مصدر الغذاء ( ) ، والجزء السفلي متجها بعيدا (X). (C-C") إعداد الجهاز التخطيطي. (ج) أحجام الأجهزة المتاحة. L1 مناسب للحيوانات من مرحلة L1 إلى منتصف L2 ، و L1-4 للحيوانات من منتصف L2 إلى منتصف L4 ، و L2-A للحيوانات من مرحلة اليرقات L2 المتوسطة إلى مرحلة البلوغ. أشرطة المقياس هي (A) 1000 ميكرومتر ، (B) 100 ميكرومتر ، و (C) 50 ميكرومتر. تم اقتباس الشكل جزئيا من Berger et al.18. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
) ، والجزء السفلي متجها بعيدا (X). (C-C") إعداد الجهاز التخطيطي. (ج) أحجام الأجهزة المتاحة. L1 مناسب للحيوانات من مرحلة L1 إلى منتصف L2 ، و L1-4 للحيوانات من منتصف L2 إلى منتصف L4 ، و L2-A للحيوانات من مرحلة اليرقات L2 المتوسطة إلى مرحلة البلوغ. أشرطة المقياس هي (A) 1000 ميكرومتر ، (B) 100 ميكرومتر ، و (C) 50 ميكرومتر. تم اقتباس الشكل جزئيا من Berger et al.18. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
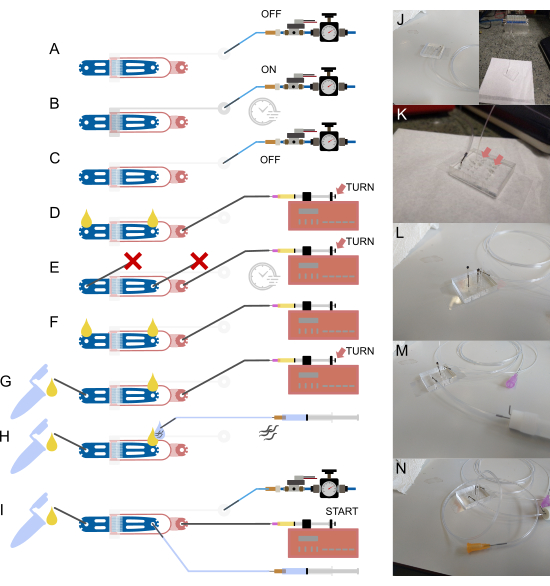
الشكل 2: إعداد الجهاز والتوصيلات. (أ-أ) نظرة عامة تخطيطية على عملية الإعداد. (أ) توصيل أنبوب مملوء بالماء مقاس 1/16 بوصة بمدخل الصمام باستخدام دبوس فولاذي مجوف (رمادي) ، مع توصيل الطرف الآخر بنظام إمداد الضغط. (ب) ملء الصمام الهيدروليكي الموجود على الرقاقة عبر الملف اللولبي خارج الرقاقة والضغط على الجهاز لبضع دقائق. (ج) إلغاء تنشيط الضغط قبل الانتقال إلى الخطوات التالية. (د) توصيل حقنة تحتوي على طعام بكتيري بمدخل الطعام باستخدام أنبوب 1/32 بوصة وإبرة حادة 30 جم ، متبوعا بملء الجهاز حتى يظهر السائل عند كلا الوصلتين المفتوحتين. (ه) إغلاق مدخل الدودة ومخرج النفايات بدبابيس فولاذية مسدودة بقطعة من الأنابيب مقاس 1/16 بوصة ( ) والضغط على الجهاز باستخدام حقنة الطعام والمضخة (عن طريق تعديل المسمار اللولبي) ، مع الحفاظ على الضغط لبضع دقائق. (و) إزالة المقابس من (E) ، وضمان تكوين قطرات سائلة عند كل وصلة مفتوحة. (ز) توصيل حاوية النفايات عبر قطعة قصيرة من الأنابيب 1/16 بوصة ودبوس فولاذي مجوف. (ح) تركيب حقنة مملوءة بالعازلة بالجهاز باستخدام دبوس فولاذي مجوف وإبرة غير حادة 23 جيجا. يتم سحب الديدان إلى الأنبوب قبل توصيله بالجهاز ، مما يضمن عدم إدخال الهواء عن طريق محاذاة قطرات السائل في المدخل ونهاية الأنبوب. (I) الإعداد النهائي مع إنشاء جميع اتصالات الجهاز. (ي) صورة للجهاز مع أنبوب صمام متصل بالمدخل والملف اللولبي (الخلفية) ، المقابلة ل (A-C). (ك) منظر مكبر للجهاز مع تركيب أنابيب إمدادات غذائية، تظهر قطرتين سائلتين (سهم) على مدخل الدودة ومخرج النفايات، المقابلة للعلامة (د). (L) منظر مكبر للجهاز مع تركيب أنبوب إمداد غذائي وانسداد مدخل الدودة ومخرج النفايات، المقابلة للرقم (E). (M) منظر مكبر للجهاز مع أنابيب النفايات والحاوية المرفقة، المقابلة للعلامة (G). (N) التجميع النهائي مع وجود جميع وصلات الأنابيب في مكانها ، المقابلة ل (I). مقتبس جزئيا من Berger et al.18. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
) والضغط على الجهاز باستخدام حقنة الطعام والمضخة (عن طريق تعديل المسمار اللولبي) ، مع الحفاظ على الضغط لبضع دقائق. (و) إزالة المقابس من (E) ، وضمان تكوين قطرات سائلة عند كل وصلة مفتوحة. (ز) توصيل حاوية النفايات عبر قطعة قصيرة من الأنابيب 1/16 بوصة ودبوس فولاذي مجوف. (ح) تركيب حقنة مملوءة بالعازلة بالجهاز باستخدام دبوس فولاذي مجوف وإبرة غير حادة 23 جيجا. يتم سحب الديدان إلى الأنبوب قبل توصيله بالجهاز ، مما يضمن عدم إدخال الهواء عن طريق محاذاة قطرات السائل في المدخل ونهاية الأنبوب. (I) الإعداد النهائي مع إنشاء جميع اتصالات الجهاز. (ي) صورة للجهاز مع أنبوب صمام متصل بالمدخل والملف اللولبي (الخلفية) ، المقابلة ل (A-C). (ك) منظر مكبر للجهاز مع تركيب أنابيب إمدادات غذائية، تظهر قطرتين سائلتين (سهم) على مدخل الدودة ومخرج النفايات، المقابلة للعلامة (د). (L) منظر مكبر للجهاز مع تركيب أنبوب إمداد غذائي وانسداد مدخل الدودة ومخرج النفايات، المقابلة للرقم (E). (M) منظر مكبر للجهاز مع أنابيب النفايات والحاوية المرفقة، المقابلة للعلامة (G). (N) التجميع النهائي مع وجود جميع وصلات الأنابيب في مكانها ، المقابلة ل (I). مقتبس جزئيا من Berger et al.18. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
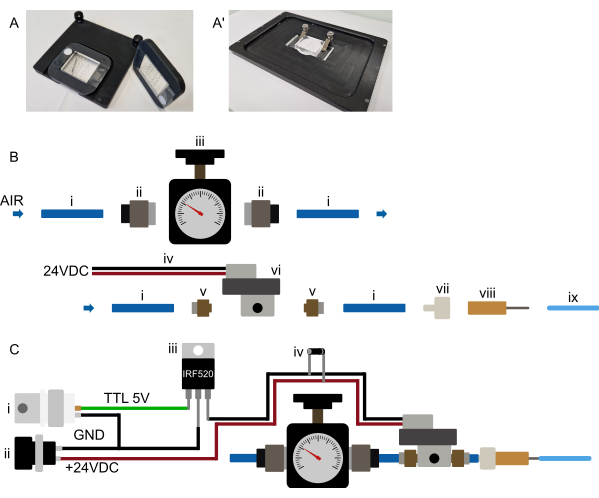
الشكل 3: إعداد الأجهزة. (أ-أ') اقترح تركيب الجهاز. (أ) إمكانية تركيب المجهر المستقيم. يتم توصيل الأجهزة بإطار مستطيل مطبوع ثلاثي الأبعاد مع فتحة مركزية كبيرة. يتم وضع شريطين صغيرين من الشريط على الوجهين في البداية على زجاج الغطاء، على جانبي جزء PDMS من الجهاز. ثم يتم وضع الإطار المطبوع ثلاثي الأبعاد فوق الجهاز ، بحيث يلتصق جزء PDMS من خلال الفتحة ويتم الضغط على الإطار بإحكام على الشريط على الوجهين ، مما يؤدي إلى ربط الجهاز بشكل دائم بالإطار لذلك ، فإن الإطار يحمل الجهاز بطريقة آمنة ويتم تثبيته على مسرح المجهر باستخدام مغناطيسات مدمجة في الإطار وإدراج المرحلة. هذا يضمن تركيبا مستقرا للجهاز ويمنع تصادم هدف المجهر مع أي جهاز تثبيت. يتم توجيه جميع الأنابيب إلى مقدمة الجهاز. (أ) تركيب ممكن لمجهر مقلوب. مجموعة من المشابك تمسك الجهاز بإحكام. التأكد من أن المشابك تضغط على الجهاز على إدراج المسرح لمنع أي حركة XY أثناء التشغيل. (ب) عرض أجزاء نظام الضغط. (ط) أنابيب البولي يوريثين OD 6 مم متصلة بمصدر ضغط. (ii) محول دفع G1 / 8 إلى 6 مم يربط الأنبوب (i) بمنظم الضغط (iii). ثم يتم توصيل الأنبوب بملف لولبي (vi) من خلال محول دفع M5 إلى 6 مم (v) ، وأخيرا ، يتم توصيل الأنبوب بموصل قفل لور إلى شوكة (vii) وإبرة حادة 23 G (viii) إلى أنبوب OD 1/16 "متصل بجهاز الموائع الدقيقة. (ج) نظرة عامة تخطيطية على التوصيلات الإلكترونية ونظام الضغط المجمع. (ط) مشغل TTL (+ 3.3-5 فولت) الذي تم إنشاؤه بواسطة Arduino أو بطاقة DAq أو أي متحكم دقيق آخر ، جنبا إلى جنب مع مصدر طاقة مناسب (ii ، 24 VDC) متصل ب MOSFET (iii) والتوصيلات الإلكترونية للملف اللولبي كما هو موضح في التخطيطي ، مع الصمام الثنائي للارتداد (iv) متصل عبر توصيلات طاقة الملفات اللولبية. بمجرد إرسال إشارة TTL من المتحكم الدقيق إلى بوابة MOSFET ، يتم تطبيق +24 VDC على الملف اللولبي المغلق عادة ، ويتم نفخ الصمام الهيدروليكي الموجود على الرقاقة. بمجرد إزالة إشارة TTL ، يتم تحرير الضغط ، ويتم تفريغ الصمام الهيدروليكي الموجود على الرقاقة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
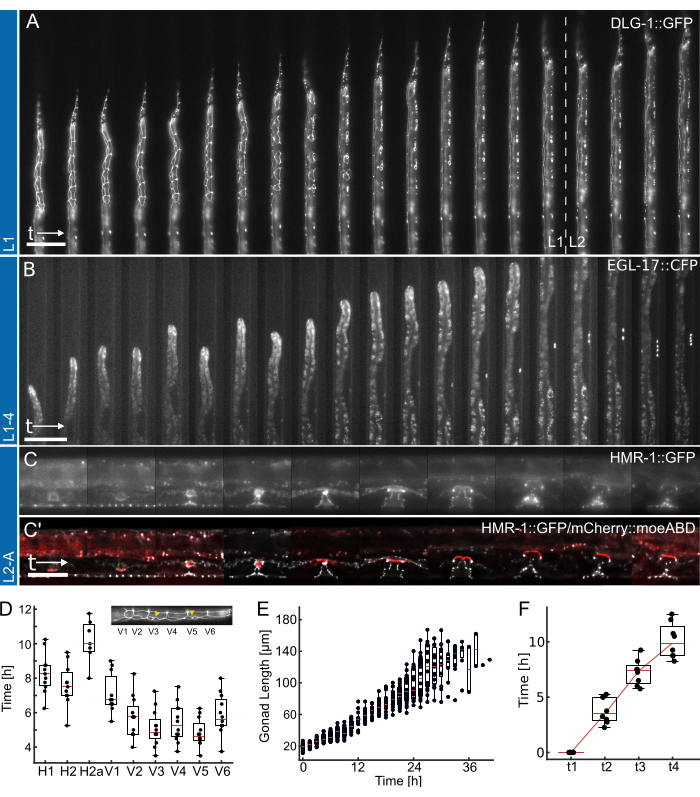
الشكل 4: النتائج التمثيلية. (أ) يظهر صانع الوصلات الظهارية (ML2615 ، dlg-1 (mc103 [dlg-1:: gfp])) ينمو من الجوع بين عشية وضحاها إلى مرحلة اليرقات المبكرة / المتوسطة L2 ، باستخدام جهاز L1. مرئية هي خلايا التماس المنقسمة ، وكذلك الخلايا P ، التي تهاجر وتنقسم نحو مرحلة اليرقات L1 المتأخرة. (ب) نمو من مرحلة اليرقات L1 المتأخرة حتى المرحلة المبكرة L4 ، باستخدام جهاز L1-4. مرئي هو علامة لخلية سلائف الفرج ذات المصير 1 درجة (VPC) (AH1187 ، arIs92 [egl-17:: cfp]) ، مع خلية واحدة مرئية في وقت مبكر من التجربة ، تليها جولتان من انقسامات الخلايا المرئية في مرحلة اليرقات L3. (ج) التي تنمو من مرحلة اليرقات L2 المتأخرة حتى مرحلة البلوغ المبكرة ، باستخدام جهاز L2-A. مرئي هو صانع الوصلات الظهارية (AH5786 ، hmr-1 (cp21 [hmr-1:: gfp + LoxP])) ، مما يسلط الضوء على الأنسجة الفرجية النامية التي تشكل هياكل حلقية مميزة ، وصورة مدمجة مع علامة لخلية مرساة الرحم (AC) (AH5786 ، qyIs50 [Pcdh-3>mCherry:: moeABD ، unc-119 (+)]) التي تغزو الأنسجة الفرجية في نهاية مرحلة اليرقات L3 ، وتربط الأنسجة. بالنسبة لجميع التجارب (A-C) ، يتم إعداد مجال الرؤية في البداية بحيث يكون جزء فقط من مرئيا. مع تقدم التجربة ، سيملأ المزيد من القناة بالميزات التي تتحول على طول محور القناة نتيجة لنمو. (د) الوقت الذي تبدأ فيه انقسامات خلايا التماس الفردية في الانقسام خلال مرحلة اليرقات L1 (ن = 12). يسلط إدراج الضوء على هويات خلايا التماس (H1-V6) على طول محور الجسم الأمامي الخلفي. (ه) يظهر نمو الغدد التناسلية مع مرور الوقت للحيوانات في الشكل 4 ب (ن = 19). (F) يوضح الوقت اللازم للوصول إلى 4 نقاط زمنية تنموية مميزة في تكوين الفرج (t1-t4) مما يشير إلى انتقال ثابت لجميع المصورة (ن = 7). قضبان المقياس هي (A ، B) 50 ميكرومتر و (C) 25 ميكرومتر. شاهد الفيلم التكميلي 1 والفيلم التكميلي 2 والفيلم التكميلي 3 للدورة التدريبية بدوام كامل. تظهر المخططات الصندوقية القيم المتوسطة (الخطوط الحمراء) مع الأرباع والأشرطة العلوية والسفلية التي تشير إلى أقصى درجات التوزيع ، باستثناء القيم المتطرفة. الشكل مقتبس من Berger et al.18. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الفيلم التكميلي 1: مفردة C. ايليجانس تتطور اليرقة من الجوع بين عشية وضحاها حتى المرحلة المبكرة L2. يتم عرض صور التألق العرضي ذات الكثافة القصوى (الارتفاع الإجمالي للإسقاط 1.5 ميكرومتر) ، بتنسيق غير معالج. مرئية هي جميع أحداث انقسام خلايا التماس والاندماج التي تحدث في المرحلة المحددة (أعلى). يتم تحديد الميزات باستخدام علامة DLG-1::GFP (الوصلة الظهارية) على فترات مدتها 15 دقيقة لمدة 25 ساعة. أعيد استخدام الفيلم من Berger et al.18. الرجاء النقر هنا لتنزيل هذا الفيلم.
الفيلم التكميلي 2: يرقة واحدة تتطور من مرحلة L1 المتأخرة حتى المرحلة المبكرة L4 ، معبرا عن علامة EGL-17:: CFP (خلية السلائف الفرجية ذات المصير 1 درجة (VPC)). في وقت مبكر من L2 (~ 400 دقيقة) ، يتجلى مضان EGL-17 :: CFP في P6.p ، ويزداد باستمرار في الشدة. خلال L3 ، يخضع P6.p لجولتين متتاليتين من الانقسام ، لتشكيل مراحل تطور الفرج المكونة من خلية واحدة و 2 خلية و 4 خلايا. يتم عرض الصور على فترات 30 دقيقة لمدة 34 ساعة. أعيد استخدام الفيلم من Berger et al.18. الرجاء النقر هنا لتنزيل هذا الفيلم.
الفيلم التكميلي 3: المنظر العلوي: إسقاط Z للفرج النامي من المرحلة L3 حتى الانتقال L4 / البالغين. المنظر السفلي: إسقاط X لنفس الفرج بمرور الوقت. تظهر كلتا الطريقتين التقسيم الأولي ل VPCs ، متبوعا بغزو الأحجار الكريمة وتشكيلها وتكبيرها ، متبوعا بالانهيار أثناء الانقلاب. يتم عرض صور التألق بعد الاقتصاص وتفكيك الالتفاف والتسجيل والإسقاط. يتم تحديد الميزات من خلال علامة HMR-1::GFP (تحت الجلد و VPCs) وعلامة mCherry:: moeABD (تحدد التيار المتردد). أعيد استخدام الفيلم من Berger et al.18. الرجاء النقر هنا لتنزيل هذا الفيلم.
الملف التكميلي 1: ملف CAD لجهاز L1. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 2: ملف CAD لجهاز L1-4. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 3: ملف CAD لجهاز L2-A. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 4: ملف CAD لجهاز L3-A. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 5: ملف CAD لجهاز L4-A. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 6: ملف CAD لهيكل توزيع الأغذية. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 7: ملف CAD لطبقة الصمام. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
وصفت هذه المقالة تشغيل منصة تصوير فريدة من نوعها طويلة الأجل للموائع الدقيقة ، وهي مناسبة للتصوير عالي الدقة وتتبع العمليات التنموية المختلفة في C. ايليجانس خلال جميع مراحل اليرقات الأربع حتى مرحلة البلوغالمبكرة 18. أصبحت القدرة على متابعة العمليات التنموية بمرور الوقت في الجسم الحي ، باستخدام طريقة التصوير هذه وغيرها ، لا غنى عنها في العديد من مجالات أبحاث C. ايليجانس وسمحت بالإجابة على الأسئلة التي كان يتعذر الوصول إليها سابقا23،24،29.
على عكس طرق التصوير التقليدية التي تستخدم منصات أجار واستراتيجيات التصوير طويلة المدى القائمة على الموائع الدقيقة المنشورة سابقا ، يحافظ هذا النهج على هوية الدودة واتجاهها طوال التجربة ، مما يتيح تتبع العمليات التنموية المعقدة بمرور الوقت. بغض النظر عن مرحلة النمو ، تقتصر على واحدة من 41 قناة مصيدة متوازية ، كل منها متصل بإمدادات غذائية على رقاقة ومغطاة بصمام هيدروليكي كبير. يحدث تثبيت جميع الديدان المحاصرة من خلال نفخ الصمام الهيدروليكي ، والضغط على الديدان على زجاج الغطاء فقط أثناء الحصول على الصورة. يمكن التصوير عالي الإنتاجية بسبب مصفوفة قناة المصيدة ذات التباعد الضيق ، مع ظهور متعددة في مجال رؤية واحد. تتوافق أجهزة التصوير طويلة المدى مع معظم إعدادات المجهر ، وتتطلب الحد الأدنى من الأجهزة الإضافية (أقل من 1000 دولار) وعدم إجراء تعديلات على الأجهزة الحالية. تشغيل الأجهزة بسيط عن قصد ، لذلك يجب أن يكون جميع المستخدمين قادرين على تعلمه بسرعة باتباع البروتوكول أعلاه والنتائج الموضحة.
باختصار ، يمكن تصوير على الرقاقة عبر ما يصل إلى 2.5 مرحلة يرقية (الشكل 1 ج). تتم مزامنة في البداية وإما تحميلها مباشرة على الرقاقة (جهاز L1) أو زرعها على لوحة NGM حتى مرحلة النمو المطلوبة (أجهزة L1-L4 و L2-A). يتم تغذية الموجودة على الرقاقة باستخدام تعليق بكتيري عالي التركيز وتثبيتها باستخدام صمام هيدروليكي على رقاقة يتم تشغيله بواسطة برنامج التصوير (الشكل 1 ب). يتم مناورة في قنوات المصيدة باستخدام حقنة ، وتوجيه بعناية برأسها نحو الإمدادات الغذائية وأخيرا محاصرة في نهاية قناة المصيدة (الشكل 1 أ والشكل 2). يجب توخي الحذر حتى لا يتم احتجاز الهواء في المحاقن والإبر الحادة والأنابيب ، لأن فقاعات الهواء ستزعج وضع بسهولة. تتوافق الأجهزة مع معظم طرق التصوير18،19،24 ، حيث أن مادة PDMS شفافة للغاية وغير فلورية ومحكمة الغلق على غطاء زجاجي رقيق (الشكل 4 ، الفيلم التكميلي 1 ، الفيلم التكميلي 2 ، والفيلم التكميلي 3). ومع ذلك ، يجب توخي الحذر عند اختيار ظروف التصوير ، حيث أن أوقات التعرض الطويلة وشدة الإثارة العالية ستؤثر بسهولة على بقاء وتؤدي إلى التبييض الضوئي.
بالإضافة إلى الإصدار المقدم من طريقة التصوير هذه ، هناك العديد من التعديلات على البروتوكول ممكنة ومتاحة بالفعل. التعديل الأكثر وضوحا هو استبدال سلالات البكتيريا القياسية ، على سبيل المثال ، بالبكتيريا التي تعبر عن الحمض النووي الريبي18 أو البكتيريا ذات القيم الغذائية المختلفة32. يمكن تبادل السلالات البكتيرية بسهولة عن طريق ضبط محتوى Optiprep لحساب الاختلافات في الكثافة. وبالمثل ، يمكن إضافة أي عدد من المركبات إلى الغذاء البكتيري ، على سبيل المثال ، الأوكسين أو المغذيات أو مركبات الدواء الجزيئية الصغيرة ، ويلاحظ تأثيرها مباشرة في الجسم الحي ، دون الحاجة إلى أي تغييرات في البروتوكول. على وجه الخصوص ، تم تطوير جهاز تبادل الوسائط لتحلل البروتين الناجم عن الأوكسين أو أي تطبيق يحتاج إلى تعرض موقوت أو قابل للعكس عن طريق إضافة مدخل طعام إلى تخطيط الجهاز دون تغيير الهندسة أو التشغيل. يسمح المدخل الإضافي بالتبديل البسيط بين حالتين مختلفتين ، على سبيل المثال ، أوكسين وعدم وجود أوكسين ، متصلة بالجهاز بنفس الطريقة الموضحة هنا لمصدر غذاء واحد ، ويتم ملاحظة التغييرات الناتجة مباشرة. تم تطوير متغيرات الجهاز أيضا حيث لا تتم مشاركة الصمام الهيدروليكي عبر جميع الوحدات الموجودة على الجهاز ولكن يتم فصله لكل وحدة ، بحيث يمكن تصوير ظروف متعددة داخل نفس الجهاز والتجربة بشكل فردي ، مما يقلل من الآثار الضارة المحتملة لتشغيل الصمام الطويل وأوقات الاستحواذ. أخيرا ، بالإضافة إلى متغيرات الجهاز الأصلية الموضحة في Berger et al.18 ، تم تطوير نوعين جديدين من الأجهزة ، L3-A و L4-A (تم تقديمه هنا) ، مما يسمح بالتصوير من منتصف L3 أو منتصف L4 حتى مرحلة البلوغ. الغرض من هذه التعديلات هو تأخير وقت بدء التجربة إلى مرحلة اليرقات اللاحقة ، بحيث يمكن تحميل الكبيرة في التطبيقات التي لا تكون فيها مراحل النمو السابقة ذات أهمية.
Disclosures
يعلن أصحاب البلاغ عدم وجود مصالح متنافسة أو مالية.
Acknowledgements
نود أن نشكر أعضاء مختبر هجنال على المناقشة النقدية والتعليقات على المخطوطة. نحن ممتنون أيضا لمركز C. elegans Genetics CGC ، الممول من مكتب المعاهد الوطنية للصحة لبرامج البنية التحتية للبحوث (P40 OD010440). علاوة على ذلك ، نود أن نتوجه بخالص الشكر إلى أعضاء مختبر غالي (معهد هوبريخت) ومختبر كونرادت (كلية لندن الجامعية) ومختبر فان دن هوفيل (جامعة أوتريخت) على مدخلات قيمة حول البروتوكول المقدم. تم دعم هذا العمل من خلال منح من المؤسسة الوطنية السويسرية للعلوم رقم 31003A-166580 إلى AH ، ورابطة السرطان السويسرية رقم 4377-02-2018 إلى AH ، وبتمويل من ETH Zürich إلى AdM.
Materials
| Name | Company | Catalog Number | Comments |
| 3/2 solenoid valve | Distrelec | 154-22-898 and 154-22-899 | Alternative to above. Solenoid valve connecting the pressure regulator to the on-chip valve. |
| Arduino | Distrelec | 301-01-956 | Optional microcontroller depending on the selected controller and interface. |
| Bacto-Tryptone | Thermo Fisher Scientific | 211705 | For L Broth production. |
| Bacto-Yeast | Thermo Fisher Scientific | 212750 | For L Broth production. |
| Blunt needle 23G | Gonano Dosiertechnik | GGA723050 | Blunt needle connecting the 1/16" tubing to a syringe. |
| Blunt needle 30G | Gonano Dosiertechnik | IG-TE730050 | Blunt needle connecting the 1/32" tubing to a syringe. |
| C. elegans Construct 1 | NA | NA | AH5786 LGI: hmr-1(cp21[hmr-1::gfp + LoxP]) Marston, D.J. et al. MRCK-1 drives apical constriction in C. elegans by linking developmental patterning to force generation. Curr. Biol. 26 (16), 2079-2089. 2016. |
| C. elegans Construct 2 | NA | NA | AH1187 LGII: arIs92[egl-17::cfp] Yoo, A.S., Bais, C., Greenwald, I. Crosstalk between the EGFR and LIN-12/Notch pathways in C. elegans vulval development. Science. 303 (5658), 663-666. 2004. |
| C. elegans Construct 3 | NA | NA | AH5786 LGV: qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)] Ziel, J.W., Hagedorn, E.J., Audhya, A., Sherwood, D.R. UNC-6 (netrin) orients the invasive membrane of the anchor cell in C. elegans. Nat. Cell Biol., 11 (2), 183-189. 2009. |
| C. elegans Construct 4 | NA | NA | ML2615 LGX: dlg-1(mc103[dlg-1::gfp]) Vuong-Brender, T.T.K., Suman, S.K., Labouesse, M. The apical ECM preserves embryonic integrity and distributes mechanical stress during morphogenesis. Development. 144 (23), 4336-4349. 2017. |
| Cable | Distrelec | 143-46-644 | Needed if selecting the solenoid from distrelec. Cable connecting the solenoid to the MOSFET. |
| Chlorotrimethyl silane | Sigma Aldrich | 386529-25ML | Silane for wafer passivation. |
| Cholesterol | Sigma Aldrich | C8667 | For S-Basal production. |
| Flyback Diode | Distrelec | 110-52-628 | Flyback diode protecting the microcontroller. |
| Hollow steel pin | Gonano Dosiertechnik | GGA7R23050 | 23G hollow steel pin connecting the 1/16" tubing to the device. |
| L Broth | NA | NA | Prepared in house following standard recipe. 10 g Bacto-tryptone, 5 g Bacto-yeast, 5 g NaCl, H2O to 1 litre, pH to 7.0 using 1 M NaOH |
| Long-term Imaging Device L1 | NA | NA | Long-term imaging device for L1 to early/mid L2 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L1-4 | NA | NA | Long-term imaging device for mid L1 to mid L4 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L2-A | NA | NA | Long-term imaging device for mid L2 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L3-A | NA | NA | Long-term imaging device for mid L3 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L4-A | NA | NA | Long-term imaging device for mid L4 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| M9 Buffer | NA | NA | Prepared in house following standard recipe. |
| MOSFET | Distrelec | 303-41-391 | Metal-oxide-semiconductor field-effect transistor, used to switch the 24VDC required for the solenoid. |
| NGM plates | NA | NA | Prepared in house following standard recipe. |
| Nylon Luer-Fitting | Fisher Scientific | 11776048 | Adapter from OD 6mm tubing to 23G blunt needle. |
| Optiprep | Sigma Aldrich | D1556 | Density matching liquid. |
| PDMS | Ameba | Elastosil RT601A/B | PDMS elastomer kit. |
| Pluronic F-127 | Sigma Aldrich | P2443 | Non-ionic surfactant. |
| Potassium dihydrogen phosphate | Sigma Aldrich | 1.37039 | For S-Basal production. |
| Potassium hydrogen phosphate | Sigma Aldrich | 1.05099 | For S-Basal production. |
| Power Supply 24VDC | Distrelec | 301-63-304 | 24VDC power supply. Select a power supply suitable for the solenoid selected. |
| Precision pressure regulator | Distrelec | 154-23-578 | Alternativ to above. Pressure regulator. |
| Pressure Gauge G1/8 | Distrelec | 154-23-643 | Pressure gauge attaches to the pressure regulator. |
| PU Tubing OD 6mm | Distrelec | 154-23-866 | Tubing connecting the pressure source and regulator, as well as regulator and solenoid valve. |
| Push-in fitting G1/8 to 6mm | Distrelec | 301-69-330 | Alternativ to above. 2x Push-in fitting attaches to the pressure regulator and connects to the 6mm tubing. |
| Push-in fitting M5 to 6 mm | Distrelec | 301-69-459 | 2x Push-in fitting attaches to the solenoid and the 6mm tubing. |
| S-Basal Buffer | NA | NA | Prepared in house following standard recipe. 5.85 g NaCl, 1 g K2HPO4, 6 g KH2PO4, 1 ml cholesterol (5 mg/ml in ethanol), H2O to 1 litre. Sterilize by autoclaving. |
| Sodium Chloride | Sigma Aldrich | S9625 | For L Broth and S-Basal production. |
| Sodium hydroxite (5M) | Sigma Aldrich | 567530 | Sodium hydroxide used when bleaching C. elegans (prepare solution at 5M concentration) |
| Sodium hypochlorite (5%) | Sigma Aldrich | 1.05614 | Sodium hypochlorite used when bleaching C. elegans (prepare solution at 5% concentration) |
| Strainer 10 µm | pluriSelect | 43-10010-40 | Alternative for bacteria food preparation, especially if smaller devices are used. |
| Strainer 5 µm | pluriSelect | 43-10005-40 | Strainer used to filter L1 larvae after overnight starvation and bacteria after completed food preparation. |
| SU-8 | Gersteltec | GM1050 | SU-8 for height from 1-10 µm. |
| SU-8 | Gersteltec | GM1060 | SU-8 for height from 5-30 µm. |
| SU-9 | Gersteltec | GM1070 | SU-8 for height from 15-200 µm. |
| Syringe 1 mL | Fisher Scientific | 11338763 | 1mL syringe. If using a different type ensure that the syringe body and plunger are stiff, such that they won't be deformed by the syringe pump. |
| Syringe Pump | WPI | Al1000-220 | Syringe pump (https://www.wpiinc.com/var-2300-aladdin-single-syringe-pump.html). |
| Tube 15 mL | Fisher Scientific | 50-809-220 | Tube used for worm bleaching and bacteria preparation. |
| Tube 2 mL | Fisher Scientific | NC1186931 | Tube used for worm preparation and bacteria preparation. |
| Tube 50 mL | Fisher Scientific | 50-465-232 | Tube used for bacteria preparation and growth. |
| Tweezer SMD | Brütsch Rüegg Werkzeuge | 448980 | Tweezers used to plug the 1/32" tubing into the device. |
| Tygon tubing 1/16" | Fisher Scientific | 642002 | Flexible 1/16" OD tubing connecting most components to the device. |
| Tygon tubing 1/32" | Fisher Scientific | 641900 | Flexible 1/32" OD tubing connecting the bacteria supply to the device. |
| UV KUB-3 | Kloe | NA | Mask aligner and UV exposure system. |
| Wafer | Siegert Wafer | 4P0/>1/525±25/SSP/TTV<10 | Silicon Wafer. |
| Waste Container | NA | NA | Prepared in house using a 2mL tube or a cryo vial and hollow steel pins. |
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved