Method Article
Imagens de C . elegans de alta resolução em todos os estágios larvais
Neste Artigo
Resumo
Este protocolo descreve imagens de lapso de tempo de C. elegans baseadas em microfluídica em todo o desenvolvimento pós-embrionário.
Resumo
Caenorhabditis elegans tornou-se um dos modelos animais mais amplamente estudados e mais bem compreendidos em biologia. Três características são fundamentais para o sucesso de C. elegans como organismo modelo: sua linhagem celular invariante, transparência e tratabilidade genética. Isso o torna ideal para uma ampla gama de estudos baseados em microscopia diretamente in vivo. Larvas e adultos vivos de C. elegans geralmente precisam ser imobilizados durante a aquisição da imagem. Os métodos tradicionais de imobilização afetam adversamente o desenvolvimento animal, especialmente em aplicações de imagem com lapso de tempo. Aqui, é introduzido um protocolo detalhado de configuração e operação para um novo método de imagem microfluídica, que aborda as limitações associadas à imobilização tradicional baseada em almofada de ágar e outras estratégias microfluídicas. Essa abordagem permite imagens simultâneas ao vivo em vários estágios larvais, preservando a orientação e a identidade do verme ao longo do tempo. Para conseguir isso, uma matriz de canais de armadilha microfluídica é empregada, com sua geometria projetada com precisão para manter uma orientação estável do verme enquanto acomoda o crescimento e a muda. A imobilização é facilitada por uma válvula hidráulica ativa que aplica pressão para proteger os sem-fins contra a lamínula apenas durante a aquisição da imagem. Esse design permite imagens de alta resolução com efeitos mínimos na viabilidade do verme ou no tempo de desenvolvimento.
Introdução
A imagem de C. elegans pode ser realizada de várias maneiras, dependendo da aplicação, rendimento desejado e resolução. Quando uma alta resolução é necessária, o método padrão utiliza almofadas de ágar 1,2,3, uma construção simples de lâmina de vidro, agarose e vidro de cobertura. Os animais nessas lâminas são imobilizados pela pressão exercida por uma lamínula. A imobilização pode ser melhorada ainda mais pela adição de agentes anestésicos, por exemplo, levamisol ou azida sódica 1,2, de modo que os animais em almofadas de ágar fiquem perfeitamente imóveis e possam ser visualizados em alta resolução, incluindo vários métodos de super-resolução2. Infelizmente, sabe-se que as almofadas de ágar afetam a progressão do desenvolvimento, com a combinação de altas pressões aplicadas e agentes anestesiantes retardando o desenvolvimento ou causando parada completa do desenvolvimento 4,5.
Além desses métodos padrão, várias metodologias microfluídicas surgiram nos últimos anos, cada uma com suas vantagens e desvantagens ou casos de uso especializados 6,7,8,9,10,11,12,13,14,15,16,17,18,19. Por exemplo, Gritti et al.20 introduziram um método no qual os vermes são confinados em grandes câmaras. Os embriões colocados nessas câmaras se desenvolvem e se movem livremente, permanecendo dentro da região de interesse designada em um microscópio. Embora geralmente eficaz, essa abordagem é limitada ao uso de marcadores fluorescentes brilhantes. Mais recentemente, Keil et al.21 propuseram uma versão modificada desse método, incorporando uma válvula hidráulica no chip para conter os animais durante a aquisição da imagem, abordando assim algumas limitações da abordagem original. No entanto, como ambos os métodos utilizam câmaras maiores do que as usadas para vermes presos, os animais continuam a se mover e girar ao longo do experimento. Como resultado, o rastreamento dos processos de desenvolvimento torna-se desafiador e requer um extenso pós-processamento de imagens para corrigir o movimento do animal.
Para lidar com essas limitações, a abordagem introduzida por Berger et al.18 (Figura 1), onde os animais não são mantidos em uma grande câmara, mas alojados em um canal de armadilha projetado para acomodar os animais em uma janela de desenvolvimento mais curta (até 2,5 estágios larvais) é adaptada. Ao contrário dos métodos microfluídicos existentes, essa abordagem preserva a orientação e a identidade do animal ao longo de um experimento e permite a aquisição de imagens de alta resolução de vários vermes em paralelo e em vários estágios larvais em um único dispositivo.
Os animais são capturados usando uma geometria de canal especializada, onde a altura do canal é próxima à espessura de um animal no início de um experimento, evitando assim a rotação. As larguras e comprimentos dos canais são selecionados para que os animais possam se mover e crescer ao longo do tempo, facilitando a muda e a transição de um estágio larval para o próximo. A paralelização é então alcançada simplesmente colocando vários canais de armadilha próximos uns dos outros, de modo que vários animais sejam visíveis em um único campo de visão (FOV, Figura 1A'), e até 41 animais possam ser fotografados em uma única unidade de dispositivo (Figura 1A). Os animais no chip recebem continuamente uma suspensão de alimento bacteriano altamente concentrada por meio de um canal de baixa altura, que ao mesmo tempo ajuda a confinar os animais no final da matriz do canal da armadilha (degrau de altura, Figura 1A, vermelho). Semelhante à abordagem adotada por Keil et al.21, é implementada uma grande válvula hidráulica on-chip, que pode ser inflada durante a aquisição da imagem, pressionando os animais contra a lamínula, melhorando assim a imobilização do animal (Figura 1B). Limitar a atuação da válvula hidráulica apenas ao período de aquisição da imagem minimiza qualquer efeito adverso no desenvolvimento animal, garantindo um desenvolvimento confiável em todos os estágios larvais. Ao contrário dos métodos descritos por Gritti et al.20 e Keil et al.21, os animais não podem ser visualizados em todo o desenvolvimento pós-embrionário dentro do mesmo dispositivo. Em vez disso, cinco dispositivos distintos são introduzidos, denominados L1, L1-4, L2-A, L3-A e L4-A, cobrindo todo o estágio L1 e o estágio L2 inicial, o estágio L1 médio-tardio até o estágio L4 médio, o L2 médio-tardio até a idade adulta jovem, o L3 médio-tardio até a idade adulta jovem e o L4 tardio até a idade adulta jovem, respectivamente (Figura 1C), que permitem imagens ininterruptas de grandes partes do desenvolvimento pós-embrionário. Essa abordagem é adotada devido ao grande aumento no tamanho do animal de L1 até a idade adulta, de modo que um canal adequado para animais L1 seria muito pequeno para adultos, resultando em parada do desenvolvimento, e um canal adequado para adultos seria muito grande para L1s, resultando em movimento excessivo, rotação e animais escapando dos canais de armadilha.
Usando essa abordagem, é alcançada uma progressão confiável do desenvolvimento para uma variedade de tecidos18, por exemplo, o desenvolvimento pós-embrionário da hipoderme (estágio L1 a L4), indução dos destinos das células vulvares (estágio L2 e L3), morfogênese vulvar (L3 à idade adulta19) e invasão de células âncora. Desde a sua introdução, esses dispositivos de imagem de longo prazo têm sido usados para estudar uma variedade de processos22 , 23 , com a plataforma sendo combinada com técnicas como a microscopia de super-resolução AiryScan24, permitindo inúmeras descobertas antes impossíveis.
A seguir, os aspectos de operação desses dispositivos de imagem de longo prazo são apresentados em um protocolo passo a passo, destacando os resultados esperados e alguns desafios potenciais ao configurar o sistema.
Protocolo
Os detalhes dos reagentes e dos equipamentos utilizados neste estudo estão listados na Tabela de Materiais.
1. Fabricação do dispositivo
NOTA: Todos os dispositivos foram fabricados usando o protocolo abaixo, no entanto, os dispositivos estão disponíveis diretamente com os autores. Um wafer separado é fabricado para cada tipo de dispositivo, com cada wafer de dispositivo fabricado a partir de duas camadas de SU8 de diferentes alturas (ou seja, camada de alimento e camada de armadilha). O wafer da válvula é fabricado em um wafer separado, com uma única altura de SU-8, omitindo as etapas 1.3-1.6. Os silanos são tóxicos e liberam vapores corrosivos. Esta etapa, portanto, precisa ser realizada em uma capela de exaustão. Para detalhes sobre o procedimento de fabricação, consulte Berger et al.18.
- Limpe os wafers usando plasma de ar.
- Gire a camada SU8 e, em seguida, execute um cozimento macio a 95 ° C.
- Expor a primeira camada, seguida de um pós-cozimento a 95 °C e desenvolvimento.
- Execute a limpeza de plasma novamente após o desenvolvimento e secagem do wafer.
- Gire a segunda camada de SU8, seguida de um cozimento macio a 95 ° C (se necessário, faça um cozimento inicial a 65 ° C).
- Alinhe a segunda máscara aos recursos existentes usando marcadores de alinhamento em ambos os lados do wafer e, em seguida, exponha a segunda camada.
- Pós-cozedura e revelação da bolacha e, em seguida, faça uma cozedura dura a 200 °C.
- Trate o wafer com clorotrimetilsilano por pelo menos 2 h.
- Prepare um lote de 20 g de pré-polímero PDMS (Parte A) e misture-o bem com 1 g do reticulador (proporção 20:1, Parte B) (consulte a Tabela de Materiais).
- Desgaseifique por 10 min ou até que todas as bolhas desapareçam.
- Remova 2 mL da mistura PDMS e reserve para a etapa 1.13.
- Adicione mais 3 g de reticulante à mistura PDMS restante e misture bem (proporção final de aprox. 5:1).
- Usando o lote de 20:1 PDMS, gire o wafer do dispositivo a 750 rpm por 30 s.
- Coloque o wafer da válvula em um prato de alumínio e lance o PDMS 5:1 nele. Desgaseifique o wafer do dispositivo por aproximadamente 10 min. Após a desgaseificação, remova as bolhas restantes usando uma pipeta.
- Asse as camadas da válvula e do dispositivo a 70 °C por aproximadamente 15/20 min, respectivamente.
- Avalie a cura do dispositivo e das camadas da válvula sondando-as suavemente com uma ponta de pipeta ou pinça. A camada da válvula deve ser sólida, enquanto a camada do dispositivo deve permanecer ligeiramente pegajosa.
- Retire a camada da válvula e corte-a no tamanho desejado usando um bisturi ou lâmina de barbear.
- Faça um orifício de acesso no canal da válvula (medidor 20).
- Posicione o wafer do dispositivo sob um estereomicroscópio equipado com iluminação superior.
- Coloque cuidadosamente a peça PDMS contendo a camada da válvula no wafer do dispositivo.
- Alinhe as características da válvula e do dispositivo com precisão, garantindo a remoção de todo o ar retido entre as camadas.
- Transfira o dispositivo montado para um forno e leve ao forno a 70 °C durante a noite.
- Retire o dispositivo do wafer.
- Perfure todos os orifícios de acesso restantes (medidor 20).
- Cole o PDMS a uma lamínula usando plasma de ar e, em seguida, coloque o dispositivo colado em um forno a 70 ° C por algumas horas.
2. Preparação de minhocas
NOTA: Esta seção descreve a preparação do verme por branqueamento, que permite a geração de um grande número (centenas) de animais. Outros métodos de sincronização, como separação manual, são possíveis, mas geralmente são mais demorados e trabalhosos. Todos os vermes usados no protocolo são mantidos de acordo com protocolos padrão a 20 ° C e em placas NGM semeadas com E. coli OP50.
- A partir de pratos com muitos animais grávidos.
- Lave os animais do prato usando tampão M9.
- Adicione 5% de NaClO e 5 M de NaOH à suspensão do sem-fim (200 μL/100 μL para cada 1 mL de suspensão do sem-fim).
- Agite suavemente a mistura de branqueamento até que os animais comecem a se desfazer (~10 min).
- Centrifugue a mistura de branqueamento à temperatura ambiente, 1300 x g por 1 min.
- Remova o sobrenadante usando uma pipeta e adicione uma quantidade igual de tampão M9 fresco.
- Novamente, centrifugue em temperatura ambiente, 1300 x g por 1 min.
- Remova o sobrenadante e transfira os vermes peletizados para um tubo de 15 mL com 5 mL de tampão M9 fresco.
- Agitar durante a noite a 20 °C.
- Passe a suspensão do sem-fim por um filtro de células de 10 μm.
- Centrifugue a suspensão sem-fim a 1300 × g por 1 min em temperatura ambiente.
- Rejeitar o sobrenadante e ressuspender os vermes num volume igual de tampão M9.
- Centrifugue a mistura de minhocas novamente a 1300 × g por 1 min em temperatura ambiente.
- Remova o sobrenadante e transfira os vermes para placas NGM. Se forem necessárias larvas L1, use-as imediatamente.
- Quando os vermes atingirem o estágio de desenvolvimento desejado, lave-os da placa usando um tampão S-Basal fresco filtrado por um filtro de 0,2 μm.
- Deixe os vermes sedimentarem por gravidade ou pelete-os por centrifugação a 750 × g por 1 min em temperatura ambiente.
- Rejeitar o sobrenadante e adicionar um volume igual de tampão S-basal fresco.
- Repita as etapas de sedimentação ou centrifugação (etapas 2.16 e 2.17)
- Remover o sobrenadante e adicionar um volume igual de tampão S-Basal fresco.
- Execute as etapas de sedimentação ou centrifugação uma última vez.
- Remova a maior parte do sobrenadante.
- Mantenha os vermes no tubo até o início do experimento.
3. Preparação de bactérias
NOTA: Diferentes cepas de bactérias (por exemplo, OP50, NA22, HT114, etc.) podem ser usadas no chip. Ajuste a proporção de meio de gradiente de densidade adicionado à mistura de alimentos para compensar as diferenças de densidade. Todos os tampões são passados através de um filtro de 0,2 μm para remover partículas.
- Prepare 40 mL de LBroth, em 2 x 20 mL em tubos de centrífuga, frascos Erlenmeyer estéreis, etc.
- Inocule LB com bactérias colhidas de um prato de estoque.
- Cultive as bactérias agitando durante a noite a 37 ° C (~ 16 h) (OD600 = 1,9).
- Centrifugue bactérias a 3000 x g por 10 min.
- Remova o sobrenadante e adicione 2 mL de tampão S-Basal fresco a cada tubo. Combine todos os tubos.
- Ressuspenda mecanicamente as bactérias usando uma pipeta.
- Centrifugue as bactérias a 3000 x g por 5 min.
- Remova o sobrenadante e adicione 2 mL de tampão S-Basal fresco novamente.
- Ressuspenda mecanicamente as bactérias usando uma pipeta.
- Centrifugue as bactérias a 3000 x g por 5 min.
- Remova o máximo possível do sobrenadante e adicione 1 mL de tampão S-Basal fresco antes de ressuspender mecanicamente todas as bactérias.
- Combine 0,60 mL de meio de gradiente de densidade, 0,38 mL de S-Basal + 1% em peso de Pluronic F-127 (um copolímero tribloco não iônico, representado aqui como PF) com 1 mL de suspensão de bactérias OP50 ou 0,65 mL de meio de gradiente de densidade, 0,33 mL de S-Basal + 1% em peso PF com 1 mL de suspensão de bactérias NA22 ou HT114.
- Misture bem a preparação de alimentos usando um misturador de vórtice.
- Filtre os alimentos através de um filtro de células de 5 μm ou 10 μm. Um filtro menor é especialmente recomendado ao usar dispositivos menores, por exemplo, dispositivos L1.
NOTA: Os alimentos podem ser mantidos em temperatura ambiente por até 2 dias.
4. Preparação de cavacos
NOTA: Consulte a Figura 2 para obter uma visão geral esquemática do dispositivo, tubulação e conexões. Todos os tampões são passados por um filtro de 0,2 μm para remover a poeira. O pino de aço mencionado nas etapas a seguir refere-se a um tubo curto e oco que é usado para fazer a interface do tubo OD maior (1/16") com os orifícios de pequeno diâmetro fabricados no dispositivo PDMS. Esses pinos de aço são simplesmente inseridos no diâmetro interno da tubulação e, em seguida, empurrados para o material PDMS, conectando efetivamente os dois.
- Comece enchendo uma seringa com água deionizada (DI).
- Conecte uma agulha de 23 G e um pedaço longo de tubo de 1/16", com um pino de aço oco (dobrado em um ângulo de 90°) na extremidade. A tubulação deve ser longa o suficiente para se estender do solenóide ao estágio do microscópio.
- Encha a tubulação com água DI da seringa e conecte-a à entrada da válvula inserindo o pino de aço no orifício perfurado (Figura 2A,J).
- Remova a seringa e a agulha e, em seguida, conecte o tubo ao solenóide fora do chip (Figura 2A,J).
- Usando o software de imagem, ligue o solenóide e pressurize o dispositivo por vários minutos para expelir todo o ar da válvula. Verifique a conclusão verificando visualmente a interface ar-água no chip, que deve parecer escura e desaparecer no material PDMS (Figura 2B).
- Desligue o solenóide (Figura 2C).
- Encha uma seringa de 1 mL com a solução de bactérias filtrada (~ 0,5 mL de alimento é suficiente).
- Conecte uma agulha de 30 G e um pedaço longo de tubo de 1/32" à agulha.
- Pressione o êmbolo para encher a agulha e o tubo conectado, garantindo que nenhum ar permaneça na seringa ou no tubo.
- Insira o tubo de 1/32" diretamente na entrada de alimentos do dispositivo microfluídico, usando uma pinça para evitar danos ao tubo (recomenda-se uma pinça SMD) (Figura 2D, K).
- Coloque a seringa na bomba da seringa (Figura 2D).
- Pressione o êmbolo da seringa usando o parafuso de aperto manual na parte traseira para encher o dispositivo com líquido. Uma gota de líquido deve aparecer em cada conexão aberta (Figura 2D, seta).
- Bloqueie a entrada e a saída do sem-fim com um pino de aço selado (um pino de aço com um pequeno pedaço de tubo de 1/16" preso e selado por queima) (Figura 2E, L).
- Aplique pressão adicional usando o parafuso de aperto manual para remover qualquer ar restante no dispositivo (Figura 2E, seta).
- Remova o pino bloqueado na saída e prenda o recipiente de resíduos (feito de um tubo criogênico ou microcentrífugo, com dois pinos de aço presos na tampa e presos com cola). O recipiente de resíduos é conectado usando um pequeno pedaço de tubo de 1/16", com uma extremidade presa ao recipiente e a outra extremidade conectada a um pino de aço oco (dobrado 90°) (Figura 2F,G,M).
- Empurre a seringa para garantir que o recipiente de resíduos esteja conectado corretamente e que não haja bloqueios no sistema. Para isso, empurre uma pequena quantidade de líquido através do sistema (gire o parafuso de aperto manual na bomba da seringa) até que o líquido flua através do tubo de resíduos (Figura 2G, seta).
- Remova o segundo pino de aço bloqueado.
- Empurre a seringa até que uma pequena gota de líquido apareça na entrada do verme (Figura 2H,N).
- Conecte um pedaço mais longo de tubo de 1/16" (15-20 cm) a uma seringa de 1 mL cheia de tampão S-Basal, usando uma agulha de 23 G (Figura 2H,N).
- Prenda um pino de aço reto de 23 G na outra extremidade da tubulação.
- Encha a agulha e o tubo com tampão da seringa, garantindo que não haja ar na seringa ou no tubo.
- Insira o pino de aço na extremidade do tubo no tubo que contém os sem-fim.
- Empurre uma pequena quantidade de líquido através da tubulação, garantindo que não haja mais ar.
- Puxe os vermes para dentro do tubo, mas não os puxe para dentro da seringa.
- Empurre a seringa conectada aos vermes até que uma pequena gota de líquido apareça no pino de aço (Figura 2H).
- Insira o pino de aço na entrada do sem-fim (Figura 2I).
NOTA: A preparação do dispositivo pode ser realizada antes da preparação final do verme e deixada no microscópio até que os vermes estejam prontos.
5. Carregamento e imagem latente do sem-fim
- Coloque o dispositivo em um microscópio com baixa ampliação (5x ou 10x) ou em um microscópio de dissecação.
- Identifique a unidade do dispositivo atualmente em uso e encontre a entrada do worm usando a iluminação de campo claro.
- Posicione o dispositivo de modo que a entrada seja visível em um lado do campo de view e a parte de trás da entrada do canal de armadilha seja visível do outro lado.
- Empurre suavemente o êmbolo da seringa sem-fim. O líquido fluirá visivelmente da entrada através da matriz de canais em direção à saída. A presença de bactérias e a diferença no índice de refração devido à adição do meio gradiente de densidade tornam o fluxo de líquido aparente.
- Certifique-se de que os worms apareçam da entrada e fluam em direção à parte de trás da matriz de canais.
- Empurre suavemente os animais em direção à matriz de canais. Quando um animal estiver de frente para o canal, empurre-o para dentro do canal e repita para outros animais.
NOTA: Os animais precisam ser orientados com a cabeça voltada para a saída para ter fácil acesso aos alimentos. Eles podem ser orientados empurrando e puxando o êmbolo e nadando. - Uma vez que animais suficientes tenham sido capturados, coloque a seringa, ainda presa à entrada do verme, no estágio do microscópio, onde permanecerá durante todo o experimento. Pode ser necessário retirar brevemente o tubo sem-fim da seringa para liberar qualquer acúmulo de pressão e, em seguida, recolocá-lo cuidadosamente na agulha romba.
- Se o carregamento foi realizado em um microscópio de dissecação, transfira o dispositivo para o microscópio de imagem. A tubulação pode permanecer presa ao chip e a seringa é conectada à bomba.
- Ligue a bomba de seringa e opere-a na taxa predefinida de 1 μL/h para 0,5 μL, aumente a taxa em 100 μL/h para 0,5 μL e reduza-a de volta para 1 μL/h. Este ciclo é repetido automaticamente durante todo o experimento. Para obter informações sobre como programar a bomba, consulte o manual do usuário do equipamento.
- Coloque o dispositivo no microscópio stage e certifique-se de que esteja firmemente preso (sugestões para mecanismos de montagem podem ser encontradas na Figura 3A).
- Se o carregamento não foi feito no microscópio de imagem, identifique a unidade do dispositivo de interesse em baixa ampliação.
- Mude para a ampliação de imagem desejada.
NOTA: Os dispositivos são compatíveis com todos os tipos de objetiva. - Identifique os animais e regiões de interesse dentro da matriz de canais de armadilha e configure as condições de imagem desejadas.
- Imagem nas condições de imagem desejadas, com a válvula no chip, acionada através do solenóide 10 s antes da aquisição da imagem, para que os animais sejam mantidos no lugar.
NOTA: O acionamento da válvula no chip alongará e achatará os animais, possivelmente exigindo ajustes na região de interesse (ROI) da imagem.
6. Preparação da configuração
NOTA: Esta seção refere-se à preparação inicial do mecanismo de controle do dispositivo e não precisa ser repetida antes de cada experimento. Consulte a Figura 3B,C. Como muitos solenóides requerem uma tensão mais alta, o solenóide provavelmente não será conectado diretamente ao microcontrolador, mas por meio de um relé ou MOSFET (consulte a Figura 3C).
- Identifique uma fonte de ar pressurizado (por exemplo, instalação de alimentação de parede ou cilindro de gás).
- Conecte a fonte de pressão a um regulador de pressão adequado (faixa de pressão de 0-2 bar) usando uma tubulação de 6 mm (fonte de parede) ou conecte diretamente um regulador adequado ao cilindro de gás.
- Conecte o regulador de pressão à entrada da válvula solenóide (tubulação de 6 mm, consulte a Figura 3B).
- Coloque o solenóide o mais próximo possível da platina do microscópio (sugere-se ~0,5-1 m da platina, embora distâncias maiores sejam possíveis, se necessário).
- Conecte a válvula solenóide eletronicamente ao controlador selecionado. Diferentes opções estão disponíveis, como controlá-lo usando uma placa microcontroladora separada (por exemplo, Arduino) ou uma placa DAq existente.
7. Limpeza e armazenamento
- Quando o experimento estiver concluído, remova o dispositivo do microscópio.
- Remova o líquido de imersão. O óleo de imersão pode ser removido com solventes orgânicos (por exemplo, acetona, metanol, etc.).
- Coloque o dispositivo em uma superfície plana e desconecte toda a tubulação, exceto a tubulação da válvula. Para desconectar cada tubulação com segurança, pressione o PDMS próximo a ela e puxe com cuidado. Não levante e dobre o dispositivo, pois isso pode causar a quebra da tampa do vidro.
- Limpe a superfície do PDMS com etanol a 70%.
- Armazene o dispositivo em temperatura ambiente com a tubulação da válvula conectada.
NOTA: O dispositivo pode ser reutilizado até que todas as unidades tenham sido usadas, provavelmente sem a necessidade de reabastecer a tubulação da válvula. No entanto, a água na tubulação da válvula evaporará por um longo período e pode eventualmente precisar ser reabastecida.
Resultados
Design e dimensões do dispositivo
Cinco dispositivos distintos foram projetados para acomodar todos os quatro estágios larvais. Esses dispositivos são designados da seguinte forma: L1, para larvas L1 carregadas imediatamente após a eclosão e fotografadas até o estágio L2; L1-L4, capaz de reter larvas do estágio L1 médio a tardio até o início e meio L4; L2-A, adequado para animais desde aproximadamente o estágio L2 até a idade adulta jovem; L3-A, para animais aproximadamente do estágio L3 até a idade adulta jovem; e L4-A, que acomoda animais desde aproximadamente o estágio L4 tardio até a idade adulta jovem.
Todos os dispositivos seguem o mesmo layout essencial, consistindo em uma entrada de minhoca, 1 (ou 2 em caso de troca de meios) entrada (s) de alimentos bacterianos e uma saída de lixo comum. Entre a parte de entrada e saída, uma matriz de 41 canais de armadilha paralelos é colocada, com o lado de entrada e saída efetivamente separados pelo canal de suprimento de alimentos de altura mais baixa (Figura 1A, A ′). As dimensões do canal foram escolhidas para serem significativamente mais longas e mais largas do que os worms carregados no início de um experimento, com um comprimento/largura de 400/15 μm para dispositivos L1, 575/22 μm para dispositivos L1-L4, 800/27 μm para dispositivos L2-A, 900/30 μm para dispositivos L3-A e 1000/65 μm para dispositivos L4-A (Arquivo Suplementar 1, Arquivo Suplementar 2, Arquivo Suplementar 3, Arquivo Suplementar 4 e Arquivo Suplementar 5).
O comprimento do canal foi selecionado para corresponder ao tamanho que os animais atingiram ao final do experimento, enquanto a largura foi escolhida de forma que os vermes no início do experimento ocupassem aproximadamente dois terços da largura do canal. Este design permite espaço suficiente para crescimento e movimento durante a muda, evitando que os vermes girem ou girem. Ao contrário da largura, a altura do canal foi ajustada próxima à espessura dos vermes no início do experimento: 8 μm para larvas L1 iniciais, 12 μm para larvas L1 médias/tardias, 15 μm para larvas L2 médias, 17,5 μm para larvas L3 médias e 22,5 μm para larvas L4 tardias, correspondendo às larvas L1, L1-L4, L2-A, L3-A, e dispositivos L4-A, respectivamente. A altura reduzida do canal, combinada com uma largura cuidadosamente selecionada (mantendo uma relação altura-largura de 0,5-0,6), garante que os sem-fins permaneçam em uma orientação fixa. Notavelmente, com uma altura de canal suficientemente pequena, todos os vermes são consistentemente posicionados na orientação lateral desejada.
O canal de abastecimento de alimentos foi fabricado a uma altura de 3 μm para L1 e 5 μm para todos os outros dispositivos, garantindo que as bactérias possam alcançar facilmente os animais sem que os animais escapem dos canais de armadilha. Todos os dispositivos usam a mesma camada de suprimento de alimentos (Arquivo Suplementar 6) e a mesma camada de válvula (Arquivo Suplementar 7). Observe que a camada da válvula é fabricada em um wafer separado a uma altura de 20 μm e colocada apenas na camada do dispositivo durante a fabricação do dispositivo PDMS (etapa 1.21).
Essas restrições geométricas específicas do estágio, essenciais para evitar que os vermes girem ou invertam a cabeça à cauda, exigem o uso de três tipos distintos de dispositivos para acomodar todos os estágios larvais. Se as larvas L1 fossem colocadas em um canal dimensionado para animais adultos jovens, elas não permaneceriam estáveis e sairiam rapidamente do canal da armadilha.
Preparação de C. elegans
Salvo indicação em contrário, os vermes foram mantidos de acordo com os protocolos padrão25 em placas NGM semeadas com E. coli OP50 a 20 °C. A seção de preparação de worms descreve explicitamente a preparação de uma população de worms sincronizada usada em um experimento de imagem. A sincronização foi realizada de acordo com protocolos padrão usando alvejante de hipoclorito de sódio26, modificado com uma etapa de filtração adicional para remover detritos e animais não eclodidos após a inanição durante a noite. O objetivo é obter muitas larvas L1 sincronizadas, que são então semeadas em placas NGM ou carregadas diretamente no dispositivo de imagem. Outros métodos de sincronização, como coleta manual ou postura controlada de ovos, são igualmente adequados. No entanto, eles são mais trabalhosos na geração de animais suficientes (recomenda-se 200 por condição).
Uma vez que os vermes tenham atingido o estágio desejado, eles podem ser lavados suavemente da placa NGM usando S-Basal limpo (idealmente filtrado através de um filtro de 0,2 μm). O objetivo é coletar o maior número possível de animais sem coletar bactérias ou detritos da placa. Os animais são coletados em um pequeno tubo de centrífuga e lavados 2-3 vezes com tampão S-Basal fresco, removendo finalmente o máximo de líquido possível. Os animais são então retirados diretamente do volume concentrado. Se a concentração de animais for muito baixa, o carregamento será mais lento, exigindo que um volume maior de líquido flua através do dispositivo e aumentando o risco de bloquear os canais de armadilha com detritos.
Preparação de alimentos bacterianos
O crescimento de bactérias é realizado seguindo protocolos padrão, com a concentração inicial de bactérias (OD600 = 1,9) aumentada aproximadamente 40 vezes em tampão S-Basal (filtrado através de um filtro de 0,2 μm) e misturado com o meio de gradiente de densidade e tampão S-Basal contendo PF (filtrado através de um filtro de 0,2 μm). O resultado esperado desta etapa do processo é a preparação de uma suspensão de bactérias muito densa e a prevenção da sedimentação de bactérias durante o experimento de imagem. A alta densidade é necessária para alimentar os animais no chip nas baixas taxas de fluxo empregadas na entrega de meios (1 μL / h). O objetivo do meio de gradiente de densidade é evitar a precipitação de bactérias durante o experimento, e o objetivo do PF é evitar que as bactérias grudem nas paredes do canal. Tanto o meio gradiente de densidade quanto o PF não são tóxicos e não afetam a viabilidade animal.
Se um tipo diferente de bactéria for usado em um experimento, a concentração necessária do meio gradiente de densidade precisará ser determinada. Isso pode ser conseguido misturando a suspensão de bactérias com quantidades variáveis do meio, seguida de centrifugação. Se a concentração do gradiente de densidade for muito baixa, as bactérias sedimentarão; Se a concentração for muito alta, as bactérias flutuarão. Uma vez encontrada uma concentração adequada, recomenda-se validar o resultado deixando a mistura de bactérias à temperatura ambiente por aproximadamente 48 h para indicar como o alimento se comportará durante todo o experimento. Após o experimento, também é recomendável verificar a seringa através da qual as bactérias são fornecidas e garantir que as bactérias não sedimentem ou flutuem. A diferença de volume resultante da adição de diferentes quantidades de Optiprep pode ser compensada pela adição de mais ou menos S-Basal + 1% em peso de PF. Da mesma forma, meios ou compostos adicionais (por exemplo, auxina) podem ser adicionados à suspensão, e o volume extra é subtraído do volume de S-Basal + 1% em peso PF.
Preparação da configuração
Configure o sistema de alimentação de pressão o mais próximo possível do microscópio, de modo que possa ser operado convenientemente. Todos os trechos de tubulação, especialmente o tubo de 1/16" conectado ao chip, devem permanecer curtos (menos de 0.5 m para o tubo de 1/16" OD) (Figura 2 e Figura 3B). Conforme indicado na seção acima, o controle por computador da válvula no chip pode ser obtido de várias maneiras. Deve ser possível em qualquer software de microscópio (testado em Micro-Manager, Metamorph, NIS e ZenBlue), conectando uma placa microcontroladora dedicada (por exemplo, Arduino) ou conectando o sistema a uma placa de aquisição de dados (DAq) existente, usando uma saída digital. A saída da placa selecionada deve então ser configurada como um obturador, que liga 10 s antes da aquisição da imagem ou é acionado manualmente durante a configuração do dispositivo. Como mencionado anteriormente, não é recomendável conectar o solenóide diretamente ao microcontrolador; em vez disso, conectando-se por meio de um MOSFET ou chave de relé para que o solenóide e o microcontrolador permaneçam isolados eletronicamente (Figura 3C).
Semelhante à tubulação de fornecimento de pressão, mantenha todas as outras tubulações até o cavaco (1/16" OD e 1/32" OD) o mais curto possível. Mantenha os tubos sem-fim e resíduos (1/16" OD) abaixo de 2.5 cm e 20 cm, respectivamente. A tubulação de alimentação de bactérias (1/32" OD) deve ser longa o suficiente para ser conectada da bomba de seringa ao dispositivo, uma vez colocada no microscópio stage. No entanto, encurtar isso o máximo possível e colocar a bomba de seringa perto do microscópio stage é altamente recomendado, por exemplo, próximo ao stage, usando uma prateleira ou em cima de um gabinete de incubadora. Qualquer comprimento de tubulação adicionado ao sistema aumentará a contrapressão sentida ao carregar animais no dispositivo e aumentará a pressão total sobre os animais presos.
Operação do dispositivo
Todos os tubos podem ser preparados e conectados à respectiva agulha romba, pino de aço e seringa nesta fase (início da etapa 4 do protocolo). Como mencionado acima, mantenha o comprimento da tubulação o mais curto possível (Figura 2J-N). É importante ressaltar que deve-se tomar cuidado para que não permaneçam bolhas de ar nas seringas ou tubos, pois elas interferirão no carregamento dos animais e poderão resultar na fuga dos animais do canal da armadilha durante o experimento. As bolhas de ar podem ser removidas da seringa de várias maneiras diferentes, por exemplo, enchendo a seringa, invertendo-a e agitando-a suavemente de modo que as bolhas de ar subam para o topo da seringa (sacudir a seringa não é recomendado, pois isso pode resultar em bolhas de ar adicionais sendo presas). Alternativamente, a seringa pode ser preenchida colocando-a no tampão e movendo rapidamente o êmbolo para cima e para baixo para remover a maioria das bolhas rapidamente.
Uma vez que a seringa esteja cheia e sem bolhas, a agulha romba e o tubo são conectados e preenchidos com tampão. Cuidado especial também deve ser tomado ao encher a seringa, pois o ar pode ficar facilmente preso na parte plástica da agulha romba. Se o ar estiver preso, substitua a agulha. Como alternativa, encher previamente a agulha com líquido, por exemplo, usando uma pipeta, pode aliviar o problema.
Com todos os componentes no lugar, a tubulação pode ser conectada ao dispositivo, começando com a tubulação que conecta o solenóide e a válvula no chip (Figura 2A-C,J). Esta tubulação é inicialmente preenchida com água deionizada e o sistema é pressurizado para remover todo o ar do canal da válvula sem saída. O PDMS é permeável ao gás; assim, a pressão elevada empurrará todo o ar do canal para o PDMS, deixando o canal da válvula cheio de água. Este processo pode ser seguido em um microscópio, garantindo que todo o canal da válvula seja preenchido. Depois de encher a válvula, o suprimento de bactérias pode ser conectado e o dispositivo pode ser preenchido e pressurizado bloqueando todas as entradas/saídas abertas (Figura 2D, E, K, L). O ar é deslocado e o processo pode ser monitorado em um microscópio. Uma vez que todo o ar é deslocado, as bactérias devem preencher o dispositivo uniformemente. Os pinos de bloqueio são removidos e o tubo de coleta de resíduos é conectado (Figura 2F, G, M). Neste ponto, uma pequena quantidade de líquido deve fluir através do dispositivo para o tubo de coleta de resíduos, garantindo que todas as conexões com o tubo estejam abertas. Isso pode ser confirmado visualmente antes de conectar a tubulação ao tubo de coleta. Se nenhum líquido fluir para o tubo de coleta de resíduos, é provável que ele esteja bloqueado. Isso resultaria em acúmulo de pressão sobre o experimento, afetando negativamente os animais presos. Se o tubo ou suas conexões estiverem bloqueados, remova-o e limpe todas as conexões usando uma agulha ou lave-as com uma seringa cheia de água.
Finalmente, o tubo sem-fim pode ser conectado (Figura 2H,N). Os vermes são retirados do tubo da centrífuga simplesmente sugando-os para o tubo conectado à seringa cheia de S-Basal. Os animais só devem ser puxados para dentro do tubo, não da seringa. A tubulação pode então ser conectada ao dispositivo. Antes disso, uma pequena quantidade de líquido é empurrada para fora do dispositivo e do tubo sem-fim, e as duas gotículas são conectadas de forma que nenhum ar seja empurrado para dentro do dispositivo durante o carregamento.
Carregamento de worm
Com todas as conexões feitas, os animais podem ser carregados empurrando e puxando o êmbolo da seringa sem-fim. Os animais serão liberados da entrada em direção à matriz do canal da armadilha; no entanto, eles naturalmente nadarão contra o fluxo que experimentam. Os animais, portanto, precisam ser reorientados com a cabeça voltada para o canal da armadilha. A orientação correta do animal é realizada empurrando e puxando o êmbolo e dando aos animais tempo para girar na orientação desejada. Isso quase pode ser alcançado em uma única base de vermes, mas exigirá alguma prática. Uma vez que os animais estejam corretamente orientados, eles podem ser empurrados para o canal da armadilha e deslizar até o final do canal, onde um degrau de altura os impede (Figura 1A, B). Se os animais não puderem entrar no canal, eles são muito grandes para o dispositivo selecionado e precisam ser fotografados em um dispositivo maior. Se os animais puderem girar ou se virar quando colocados no canal da armadilha, eles são muito jovens e um dispositivo menor precisa ser usado, ou os animais precisam ser deixados para crescer por mais algumas horas.
É importante ressaltar que animais em canais diferentes não afetarão uns aos outros. Portanto, os animais carregados incorretamente não afetarão os carregados corretamente, no entanto, eles não terão acesso suficiente aos alimentos e, portanto, crescerão mais lentamente ou interromperão o desenvolvimento.
Se os animais forem carregados na idade certa, deve ocorrer um movimento mínimo ao longo do eixo longitudinal do canal. No entanto, os animais são livres para se mexer (Figura 1B) e começar a se alimentar em alguns minutos. Se os animais mostrarem movimento significativo ao longo do eixo longitudinal do canal, isso provavelmente é causado pelo acúmulo de pressão no dispositivo ou por uma bolha de ar alojada em algum lugar no tubo, agulha romba ou seringa. O acúmulo de pressão dentro do dispositivo pode ser liberado destacando suavemente o tubo sem-fim da agulha cega e recolocando-o com cuidado. Se uma bolha de ar permanecer alojada no sistema, apesar das etapas e precauções mencionadas acima, toda a seringa sem-fim pode precisar ser removida e substituída por uma nova sem bolhas de ar. As bolhas de ar no sistema funcionam como molas que são comprimidas durante o carregamento e liberadas lentamente após o carregamento dos animais. O fluxo criado pela expansão das bolhas de ar pode resultar em instabilidades do sistema, empurrando os animais para fora dos canais da armadilha.
Aquisição e desenvolvimento de imagens no chip
Finalmente, uma vez que os animais são carregados, a aquisição da imagem pode começar. Em princípio, os dispositivos são compatíveis com a maioria dos métodos de imagem, campo claro, epifluorescência 18,19,22,23 (Figura 4), disco giratório confocal19 e até mesmo modalidades de super-resolução (AiryScan24), pois todas as imagens são realizadas através de uma lamínula de 170 μm de espessura. Consequentemente, o dispositivo microfluídico mostra pouco ou nenhum efeito na qualidade de imagem alcançável no chip. No entanto, as condições de imagem apropriadas que não afetam a viabilidade do animal devem ser selecionadas, independentemente da modalidade de imagem. Altas intensidades de excitação resultarão prontamente em branqueamento de fluoróforos e parada do desenvolvimento devido à alta energia e calor transmitidos à amostra. Tempos de exposição curtos (~ 10 ms) e baixas intensidades de excitação (menos de 10% de uma fonte de LED de fluorescência típica) são recomendados, produzindo uma imagem utilizável em uma configuração de contraste de min = 0 e max = 1000 (ao usar uma câmera de 16 bits) (Figura 4).
Os dados representativos obtidos usando os dispositivos L1, L1-4 e L2-A são mostrados na Figura 4. Mostrando o desenvolvimento das células epiteliais de C. elegans desde a eclosão / fome durante a noite até o estágio larval de L2 médio (Figura 4A, Filme Suplementar 1), indução das células precursoras da vulva 1 ° e suas divisões subsequentes do final de L1 ao início do estágio larval de L4 (Figura 4B, Filme Suplementar 2) e, finalmente, formação da vulva de C. elegans desde o estágio larval inicial de L3 até a eversão na transição para a idade adulta (Figura 4C, Filme Suplementar 3).
Cada aplicação é acompanhada por uma quantificação de diferentes métricas de tempo de desenvolvimento. As imagens na Figura 4A,B são mostradas sem nenhum pós-processamento aplicado, ou seja, nenhuma deconvolução ou registro de imagem foi aplicado. As imagens da Figura 4C, por outro lado, foram desconvolvidas27 e registradas, destacando as melhorias na qualidade da imagem possíveis ao usar dispositivos de imagem de longo prazo.
Primeiro, identificar o início de cada divisão celular da costura para animais mostrados na Figura 4A (ver Filme Suplementar 1 para um curso em tempo integral), indicando a divisão consistente e oportuna de todas as células em 12 animais (Figura 4D). Usando as células da costura, o tempo geral de desenvolvimento em todos os quatro estágios larvais também foi avaliado e descobriu que todas as divisões das células da costura foram concluídas após 12,0 h ± 1,7 h (média ± DP) em L1 (n = 22), 10,2 h ± 1,0 h em L2 (n = 27), 10,9 h ± 1,4 h em L3 (n = 27) e 14,6 h ± 2,2 h em animais L4 (n = 19). Esses dados são consistentes com os valores da literatura 2,28, bem como os valores medidos em animais criados em placa, produziram tempos medianos de desenvolvimento para L1 15 h (n = 21), L2 10 h (n = 15), L3 12 h (n = 21) e L4 12,5 h (n = 61) (Adaptado de Berger et al.18). Os pequenos atrasos observados são provavelmente uma consequência da aquisição de imagens e da fototoxicidade resultante ou do aumento do confinamento quando os animais crescem e se tornam um canal de armadilha.
Em segundo lugar, acompanhamos o crescimento animal nos estágios L2 e L3, quantificando o comprimento das gônadas como um excelente indicador de progressão do desenvolvimento (Figura 4E, consulte o Filme Suplementar 2 para um curso em tempo integral). Tal como acontece com a divisão celular da costura, o comprimento preciso da gônada pode ser medido graças à orientação reta do animal, e foi encontrado um crescimento consistente da gônada em todos os animais fotografados (n = 19). A primeira divisão do VPC nesses experimentos foi observada 14,26 h ± 2,47 h após o início do experimento (~ 30 h após a semeadura), com a segunda ocorrendo 1,46 h ± 0,13 h depois (n = 19). Esses dados estão em boa concordância com os valores da literatura estabelecidos em placas NGM29,30. Euling e Ambros30 encontraram a primeira divisão ocorrendo após aproximadamente 29 h e a segunda aproximadamente 3 h depois.
Finalmente, o tempo pelo qual os estágios específicos do desenvolvimento vulvar são alcançados foi quantificado (Figura 4F, ver Filme Suplementar 3 para o curso em tempo integral), avaliando especificamente o tempo necessário para progredir da invaginação (L4.0, t1) para o estágio médio de L4 (L4.5, t4) de acordo com os subestágios definidos por Mok et al.31. O tempo médio de progressão entre t1-t2 foi de 3,8 h ± 1,2 h, entre t2-t3 foi de 3,5 h ± 1,2 h e entre t3-t4 foi de 2,8 h ± 1,6 h (n = 7), indicando uma progressão aproximadamente linear do desenvolvimento. Semelhante ao ensaio de tempo de desenvolvimento, esses tempos, particularmente t1-t2, parecem ligeiramente atrasados em comparação com os valores relatados na literatura (t1-t2: 0,7 h, t2-t3: 3 h, t3-t4: 2,3 h31), possivelmente devido às dimensões estreitas do dispositivo retardando a muda. No entanto, o tempo de desenvolvimento permanece altamente consistente entre os animais, e todos progridem com sucesso até a idade adulta.
Compensando o movimento do animal e o desvio do microscópio
O movimento do animal em uma única pilha Z é normalmente mínimo quando a válvula no chip é acionada. No entanto, não se espera que os animais permaneçam completamente imóveis. O jitter residual observado em uma única pilha pode ser compensado aumentando a pressão para acionar a válvula no chip, diminuindo o tempo de exposição usado ou aumentando a etapa Z selecionada para acelerar a aquisição da pilha. O tempo de aquisição da pilha pode ser reduzido ainda mais usando um Z-drive piezo, resultando em um Z-motion significativamente mais rápido em comparação com um drive de foco de microscópio convencional, ou utilizando filtros multibanda (por exemplo, GFP/mCherry) de modo que cores separadas possam ser adquiridas sem a necessidade de trocas de filtro demoradas. Para referência, nos exemplos fornecidos (Figura 4 e Filme Suplementar 1, Filme Suplementar 2 e Filme Suplementar 3), o tempo de aquisição da pilha era normalmente entre 3 e 8 segundos. O movimento residual também pode ser removido por meio de vários métodos de registro de imagem, se necessário.
Espera-se que os animais no chip cresçam de forma constante. Assim, as características de interesse inevitavelmente se deslocarão ao longo do eixo longitudinal do canal (Figura 4A, B, Filme Suplementar 1 e Filme Suplementar 2). Portanto, recomenda-se definir o FOV de imagem de forma que a característica de interesse possa crescer no FOV e não seja perdida ao longo de um experimento (Figura 1B e Figura 4A, B). Alternativamente, os animais podem ser visualizados em vários FOVs adjacentes, cobrindo todo o corpo do animal. No entanto, isso pode transmitir fototoxicidade e estresse adicionais. Tal como acontece com o Z-motion, vários procedimentos de registro podem compensar o movimento do animal no canal ao longo do tempo. Se os animais apresentarem movimento errático ao longo do eixo longitudinal, mais extenso do que o que pode ser atribuído ao crescimento, é provável que isso seja causado por uma bolha de ar.
Cada dispositivo de imagem de longo prazo contém seis unidades de imagem individuais, cada uma das quais pode ser usada para um experimento separado. Cada unidade pode abrigar até 41 animais, e os canais de armadilha são espaçados de forma que vários animais possam ser visualizados em um único campo de visão. Além disso, vários FOVs podem ser visualizados em uma única unidade ou dispositivo. Como em todas as amostras de microscópio, o movimento na superfície da amostra pode introduzir desvio de foco devido à perda de meios de imersão. Esse desvio pode ser compensado usando um óleo de imersão de baixa viscosidade ou por meio de várias modalidades de foco automático. No entanto, alguns sistemas de foco automático de hardware podem não funcionar quando usados com um dispositivo microfluídico PDMS, pois usam a transição do vidro para um meio aquoso como ponto de referência (lado da amostra da lamínula). Grande parte do FOV é preenchido com silicone dentro do dispositivo, que tem um índice de refração mais alto do que a água; Embora isso não afete a qualidade da imagem, pode afetar negativamente o foco automático. Ao obter imagens de um único FOV, o desvio de foco observado dentro do dispositivo é mínimo (menos de 2 μm). Se for observado desvio excessivo de foco, isso pode resultar da instabilidade térmica do sistema ou ambiente do microscópio, movimento XY excessivo adquirindo vários FOVs ou montagem inadequada do dispositivo no microscópio (consulte a Figura 3A para obter os mecanismos de montagem sugeridos).
Da mesma forma, o movimento XY excessivo e a montagem inadequada também podem resultar em desvio XY. Como o dispositivo e a objetiva do microscópio são conectados por meio do líquido de imersão, movimentos rápidos em X, Y ou Z podem fazer com que forças sejam aplicadas ao dispositivo. Se os dispositivos estiverem montados corretamente e nenhuma força externa atuar sobre eles, eles serão excepcionalmente estáveis com desvio de foco mínimo e sem desvio XY.
Finalmente, se os parâmetros específicos do sistema forem inadequados, os dispositivos microfluídicos PDMS podem afetar adversamente o desenvolvimento animal. A viabilidade é afetada pela pressão excessiva da válvula, alta fototoxicidade resultante de altas intensidades de excitação, longos tempos de exposição ou curtos intervalos de tempo entre as aquisições da pilha. Especialmente ao usar este sistema pela primeira vez, é altamente recomendável avaliar a viabilidade do animal usando um marcador fluorescente brilhante ou imagem de campo claro, garantindo que a condição de imagem não afete o crescimento animal. Uma vez que os animais se desenvolvem de forma confiável, os parâmetros de imagem podem ser variados conforme necessário.
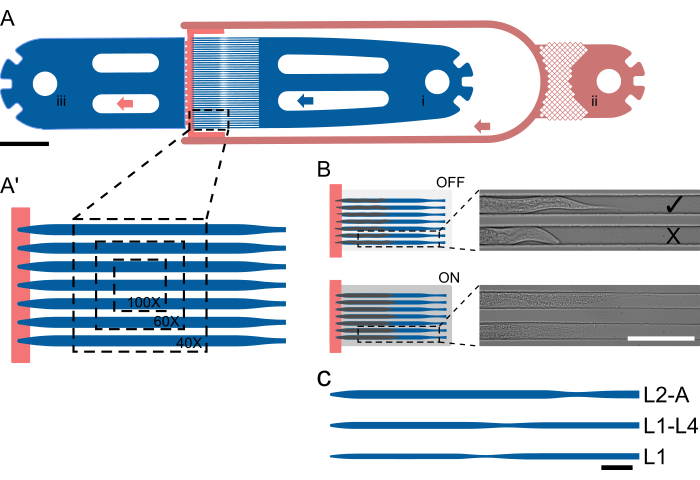
Figura 1: Layout do dispositivo e operação esquemática. (A) Visão geral do dispositivo mostrando uma única unidade com a entrada do sem-fim (i), a entrada de alimento bacteriano (ii) e a saída geral (iii). (A') Visão ampliada do canal de armadilha em um dispositivo L2-A, destacando o número de vermes visíveis em um único FOV em diferentes ampliações (40x-100x). (B) Princípio de funcionamento da válvula no chip. Quando DESLIGADO, a altura do canal é selecionada para que os animais possam caber confortavelmente no canal da armadilha. Quando ligado, a altura do canal diminui, pressionando o animal contra a lamínula, imobilizando reversivelmente os animais presos. As imagens mostram dois animais presos no chip com a válvula no chip DESLIGADA e com a válvula LIGADA, com os animais visivelmente se endireitando e alongando sob pressão. O animal superior carregou corretamente e voltado para a fonte de alimento ( ), e o inferior voltado para longe (X). (C-C") Configuração esquemática do dispositivo. (C) Tamanhos de dispositivos disponíveis. L1 é adequado para animais do estágio L1 a meio de L2, L1-4 para animais do estágio larval de meados de L2 a meados de L4 e L2-A para animais do estágio larval de meados de L2 até a idade adulta. As barras de escala são (A) 1000 μm, (B) 100 μm e (C) 50 μm. A figura é parcialmente adaptada de Berger et al.18. Clique aqui para ver uma versão maior desta figura.
), e o inferior voltado para longe (X). (C-C") Configuração esquemática do dispositivo. (C) Tamanhos de dispositivos disponíveis. L1 é adequado para animais do estágio L1 a meio de L2, L1-4 para animais do estágio larval de meados de L2 a meados de L4 e L2-A para animais do estágio larval de meados de L2 até a idade adulta. As barras de escala são (A) 1000 μm, (B) 100 μm e (C) 50 μm. A figura é parcialmente adaptada de Berger et al.18. Clique aqui para ver uma versão maior desta figura.
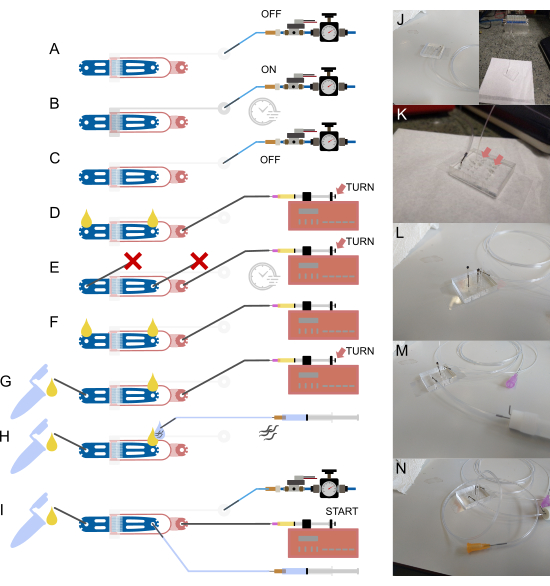
Figura 2: Configuração e conexões do dispositivo. (A-I) Visão geral esquemática do processo de configuração. (A) Conexão de tubulação cheia de água de 1/16" à entrada da válvula usando um pino de aço oco (cinza), com a outra extremidade conectada ao sistema de fornecimento de pressão. (B) Enchimento da válvula hidráulica no chip através do solenóide fora do chip e pressurização do dispositivo por alguns minutos. (C) Desativação da pressão antes de prosseguir para as próximas etapas. (D) Conexão de uma seringa contendo alimento bacteriano à entrada de alimentos usando tubo de 1/32" e uma agulha romba de 30 G, seguida de enchimento do dispositivo até que o líquido apareça em ambas as conexões abertas. (E) Vedação da entrada do sem-fim e saída de resíduos com pinos de aço bloqueados por um pedaço de tubo de 1/16" ( ) e pressurização do dispositivo usando a seringa de alimentos e a bomba (via ajuste do parafuso de aperto manual), mantendo a pressão por alguns minutos. (F) Remoção dos plugues de (E), garantindo a formação de gotículas de líquido em cada conexão aberta. (G) Conexão do recipiente de resíduos por meio de um pequeno pedaço de tubo de 1/16" e um pino de aço oco. (H) Fixação de uma seringa cheia de tampão ao dispositivo usando um pino de aço oco e uma agulha romba de 23 G. Os vermes são atraídos para dentro da tubulação antes de conectá-la ao dispositivo, garantindo que nenhum ar seja introduzido alinhando gotículas de líquido na entrada e na extremidade da tubulação. (I) Configuração final com todas as conexões de dispositivos estabelecidas. (J) Imagem do dispositivo com tubulação de válvula conectada à entrada e solenóide (fundo), correspondente a (A-C). (K) Vista ampliada do dispositivo com tubo de abastecimento de alimentos conectado, mostrando duas gotículas de líquido (setas) na entrada do sem-fim e na saída de resíduos, correspondendo a (D). (L) Visão ampliada do dispositivo com tubo de abastecimento de alimentos conectado e a entrada do sem-fim e a saída de resíduos bloqueadas, correspondendo a (E). (M) Vista ampliada do dispositivo com tubo de resíduos e recipiente conectados, correspondendo a (G). (N) Montagem final com todas as conexões de tubulação no lugar, correspondendo a (I). Parcialmente adaptado de Berger et al.18. Clique aqui para ver uma versão maior desta figura.
) e pressurização do dispositivo usando a seringa de alimentos e a bomba (via ajuste do parafuso de aperto manual), mantendo a pressão por alguns minutos. (F) Remoção dos plugues de (E), garantindo a formação de gotículas de líquido em cada conexão aberta. (G) Conexão do recipiente de resíduos por meio de um pequeno pedaço de tubo de 1/16" e um pino de aço oco. (H) Fixação de uma seringa cheia de tampão ao dispositivo usando um pino de aço oco e uma agulha romba de 23 G. Os vermes são atraídos para dentro da tubulação antes de conectá-la ao dispositivo, garantindo que nenhum ar seja introduzido alinhando gotículas de líquido na entrada e na extremidade da tubulação. (I) Configuração final com todas as conexões de dispositivos estabelecidas. (J) Imagem do dispositivo com tubulação de válvula conectada à entrada e solenóide (fundo), correspondente a (A-C). (K) Vista ampliada do dispositivo com tubo de abastecimento de alimentos conectado, mostrando duas gotículas de líquido (setas) na entrada do sem-fim e na saída de resíduos, correspondendo a (D). (L) Visão ampliada do dispositivo com tubo de abastecimento de alimentos conectado e a entrada do sem-fim e a saída de resíduos bloqueadas, correspondendo a (E). (M) Vista ampliada do dispositivo com tubo de resíduos e recipiente conectados, correspondendo a (G). (N) Montagem final com todas as conexões de tubulação no lugar, correspondendo a (I). Parcialmente adaptado de Berger et al.18. Clique aqui para ver uma versão maior desta figura.
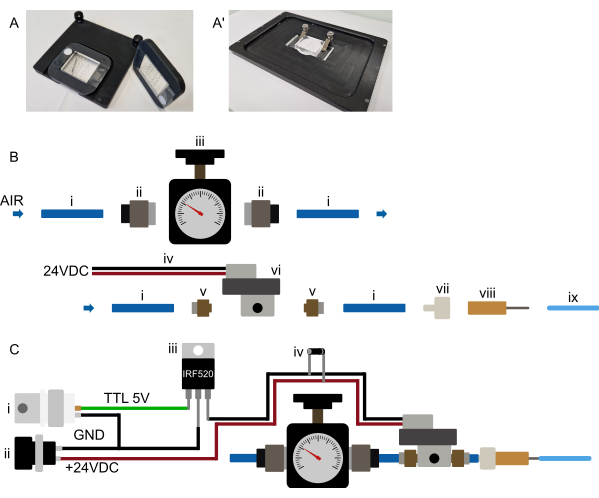
Figura 3: Configuração de hardware. (A-A') Sugestão de montagem do dispositivo. (A) Montagem possível para um microscópio vertical. Os dispositivos são fixados a uma moldura retangular impressa em 3D com um grande recorte central. Duas pequenas tiras de fita dupla-face são colocadas inicialmente na lamínula, em ambos os lados da parte PDMS do dispositivo. A moldura impressa em 3D é então colocada sobre o dispositivo, de modo que a parte PDMS passe pelo recorte e a moldura seja firmemente pressionada na fita dupla face, prendendo permanentemente o dispositivo à moldura. A estrutura, portanto, segura o dispositivo de maneira segura e é mantida na platina do microscópio usando ímãs embutidos na estrutura e na inserção da platina. Isso garante uma montagem estável do dispositivo e evita a colisão da objetiva do microscópio com qualquer hardware de montagem. Todos os tubos são roteados para a frente do dispositivo. (A') Possível montagem para um microscópio invertido. Um conjunto de grampos segura firmemente o dispositivo. Garantir que os clamps pressione o dispositivo no stage inserção para evitar qualquer movimento XY durante a operação. (B) Vista das peças do sistema de pressão. i) Tubo de poliuretano de 6 mm de diâmetro externo ligado a uma fonte de pressão. (ii) Adaptador push-in G1/8 a 6 mm conectando a tubulação (i) ao regulador de pressão (iii). A tubulação é então conectada a um solenóide (vi) por meio de um adaptador push-in de 5 para 6 mm (v) e, finalmente, a tubulação é conectada a um conector luer-lock-to-barb (vii) e uma agulha romba de 23 G (viii) à tubulação OD de 1/16" conectada ao dispositivo microfluídico. (C) Visão geral esquemática das conexões eletrônicas e do sistema de pressão montado. (i) O gatilho TTL (+3.3-5 V) gerado por um Arduino, um cartão DAq ou qualquer outro microcontrolador, juntamente com uma fonte de alimentação adequada (ii, 24 VCC) é conectado a um MOSFET (iii) e às conexões eletrônicas do solenóide conforme mostrado no esquema, com um diodo flyback (iv) conectado através das conexões de energia dos solenóides. Uma vez que um sinal TTL é enviado do microcontrolador para a porta do MOSFET, +24 VCC é aplicado ao solenóide normalmente fechado e a válvula hidráulica no chip é inflada. Uma vez que o sinal TTL é removido, a pressão é liberada e a válvula hidráulica no chip esvaziada. Clique aqui para ver uma versão maior desta figura.
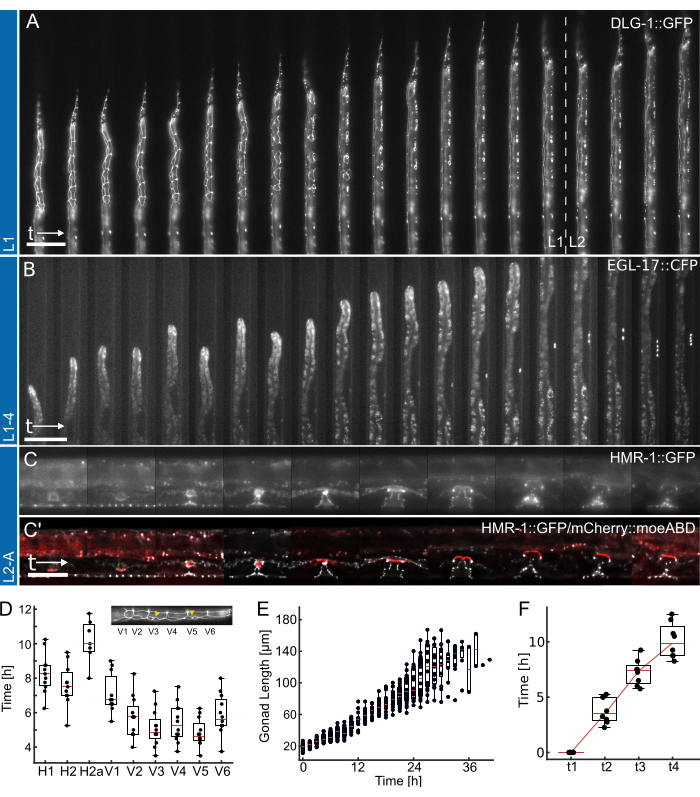
Figura 4: Resultados representativos. (A) Animal mostrando um criador de junções epiteliais (ML2615, dlg-1 (mc103 [dlg-1 :: gfp])) crescendo da fome durante a noite para o estágio larval L2 inicial / médio, usando o dispositivo L1. Visíveis são as células da costura em divisão, bem como as células P, que migram e se dividem em direção ao estágio larval L1 tardio. (B) Animal crescendo desde o estágio larval L1 tardio até o estágio L4 inicial, usando o dispositivo L1-4. Visível é um marcador para a célula precursora da vulva (VPC) de 1 ° (AH1187, arIs92 [egl-17 :: cfp]), com uma única célula visível no início do experimento, seguida por duas rodadas de divisões celulares visíveis no estágio larval L3. (C) Animais que crescem desde o final da fase larval de L2 até o início da idade adulta, usando o dispositivo L2-A. Visível é um criador de junção epitelial (AH5786, hmr-1 (cp21 [hmr-1 :: gfp + LoxP])), destacando o tecido vulvar em desenvolvimento formando estruturas toroidais distintas, e uma imagem combinada com um marcador para a célula âncora uterina (AC) (AH5786, qyIs50 [Pcdh-3 > mCherry :: moeABD, unc-119 (+)]) que invade o tecido vulvar no final do estágio larval L3, conectando os tecidos. Para todos os experimentos (A-C), o FOV é inicialmente configurado para que apenas parte dos animais seja visível. À medida que o experimento avança, o animal preencherá mais do canal com as características mudando ao longo do eixo do canal como consequência do crescimento animal. (D) Tempo em que as divisões celulares individuais começam a se dividir durante o estágio larval L1 (n = 12). A inserção destaca as identidades das células de costura (H1-V6) ao longo do eixo ântero-posterior do corpo. (E) Mostra o crescimento das gônadas com o tempo para os animais na Figura 4B (n = 19). (F) Mostra o tempo necessário para atingir 4 pontos de tempo de desenvolvimento distintos na morfogênese vulvar (t1-t4), indicando uma transição consistente para todos os animais fotografados (n = 7). As barras de escala são (A,B) 50 μm e (C) 25 μm. Veja Filme Suplementar 1, Filme Suplementar 2 e Filme Suplementar 3 para o curso de tempo integral. Os gráficos de caixa mostram os valores medianos (linhas vermelhas) com quartis superiores e inferiores e barras indicando os extremos da distribuição, excluindo outliers. A figura é adaptada de Berger et al.18. Clique aqui para ver uma versão maior desta figura.
Filme Suplementar 1: Larva única de C. elegans se desenvolvendo desde a fome durante a noite até o estágio inicial de L2. São exibidas imagens de epifluorescência projetadas de intensidade máxima (a altura total da projeção é de 1,5 μm), em formato não processado. Visíveis são todos os eventos de divisão e fusão de células de costura que ocorrem no estágio especificado (topo). As características são descritas usando o marcador DLG-1::GFP (junção epitelial) em intervalos de 15 minutos para um total de 25 h. O filme é reutilizado de Berger et al.18. Por favor, clique aqui para baixar este filme.
Filme Suplementar 2: Larva única desenvolvendo-se do estágio L1 tardio até o estágio L4 inicial, expressando um marcador EGL-17::CFP (célula precursora vulvar (VPC)). No início de L2 (~ 400 min), a fluorescência EGL-17::CFP se manifesta em P6.p, aumentando continuamente em intensidade. Durante L3, P6.p passa por duas rodadas consecutivas de divisão, formando os estágios de 1 célula, 2 células e 4 células do desenvolvimento da vulva. As imagens são mostradas em intervalos de 30 minutos para um total de 34 h. O filme é reutilizado de Berger et al.18. Por favor, clique aqui para baixar este filme.
Filme Suplementar 3: Vista superior: Projeção Z da vulva em desenvolvimento desde o estágio L3 até a transição L4/adulto. Vista inferior: projeção X da mesma vulva ao longo do tempo. Ambas as visões mostram a divisão inicial dos VPCs, seguida de invaginação, formação e alargamento dos toróides, seguido de colapso durante a eversão. As imagens de epifluorescência são exibidas após o corte, deconvolução, registro e projeção. As características são descritas através do marcador HMR-1::GFP (hipoderme e VPCs) e do marcador mCherry::moeABD (delineando o AC). O filme é reutilizado de Berger et al.18. Por favor, clique aqui para baixar este filme.
Arquivo Suplementar 1: Arquivo CAD para o dispositivo L1. Clique aqui para baixar este arquivo.
Arquivo suplementar 2: arquivo CAD para o dispositivo L1-4. Clique aqui para baixar este arquivo.
Arquivo Suplementar 3: Arquivo CAD para o dispositivo L2-A. Clique aqui para baixar este arquivo.
Arquivo Suplementar 4: Arquivo CAD para o dispositivo L3-A. Clique aqui para baixar este arquivo.
Arquivo Suplementar 5: Arquivo CAD para o dispositivo L4-A. Clique aqui para baixar este arquivo.
Arquivo Suplementar 6: arquivo CAD para a estrutura de distribuição de alimentos. Clique aqui para baixar este arquivo.
Arquivo Suplementar 7: Arquivo CAD para a camada de válvula. Clique aqui para baixar este arquivo.
Discussão
Este artigo descreveu a operação de uma plataforma única de imagem microfluídica de longo prazo, que é adequada para imagens de alta resolução e rastreamento de vários processos de desenvolvimento em C. elegans durante todos os quatro estágios larvais no início da idade adulta18. A capacidade de acompanhar os processos de desenvolvimento ao longo do tempo in vivo, usando este método de imagem e outros, tornou-se indispensável em muitos campos de pesquisa de C. elegans e permitiu que perguntas anteriormente inacessíveis fossem respondidas 23,24,29.
Em contraste com os métodos tradicionais de imagem que usam almofadas de ágar e estratégias de imagem de longo prazo baseadas em microfluídica publicadas anteriormente, essa abordagem preserva a identidade e a orientação do verme durante todo o experimento, permitindo o rastreamento de processos complexos de desenvolvimento ao longo do tempo. Independentemente do estágio de desenvolvimento, os animais estão confinados a um dos 41 canais de armadilha paralelos, cada um conectado a um suprimento de alimento no chip e coberto por uma grande válvula hidráulica. A imobilização de todos os vermes presos ocorre através da inflação da válvula hidráulica, pressionando os vermes na lamínula apenas durante a aquisição da imagem. A imagem de alto rendimento é possível devido à matriz de canais de armadilha estreitamente espaçada, com vários animais visíveis em um único campo de visão. Os dispositivos de imagem de longo prazo são compatíveis com a maioria das configurações de microscópio, exigindo hardware adicional mínimo (menos de US$ 1000) e nenhuma modificação no hardware existente. A operação dos dispositivos é intencionalmente simples, portanto, todos os usuários devem ser capazes de aprendê-la rapidamente seguindo o protocolo acima e os resultados descritos.
Resumidamente, os animais podem ser fotografados no chip em até 2,5 estágios larvais (Figura 1C). Os animais são inicialmente sincronizados e carregados diretamente no chip (dispositivo L1) ou semeados na placa NGM até o estágio de desenvolvimento desejado (dispositivos L1-L4 e L2-A). Os animais no chip são alimentados usando uma suspensão de bactérias altamente concentrada e imobilizados usando uma válvula hidráulica no chip acionada pelo software de imagem (Figura 1B). Os animais são manobrados para os canais da armadilha usando uma seringa, orientando cuidadosamente os animais com a cabeça em direção ao suprimento de alimento e, finalmente, prendendo os animais no final do canal da armadilha (Figura 1A e Figura 2). Deve-se tomar cuidado para que nenhum ar fique preso nas seringas, agulhas rombas e tubos, pois as bolhas de ar perturbarão prontamente a posição do animal. Os dispositivos são compatíveis com a maioria das modalidades de imagem 18,19,24, pois o material PDMS é altamente transparente, não fluorescente e vedado contra uma fina lamínula (Figura 4, Filme Suplementar 1, Filme Suplementar 2 e Filme Suplementar 3). No entanto, deve-se ter cuidado ao selecionar as condições de imagem, pois longos tempos de exposição e altas intensidades de excitação afetarão prontamente a viabilidade do animal e resultarão em fotobranqueamento.
Além da versão apresentada desse método de imagem, várias modificações no protocolo são possíveis e já estão disponíveis. A modificação mais direta é substituir as cepas de bactérias padrão, por exemplo, por bactérias que expressam RNAi18 ou bactérias com diferentes valores nutricionais32. As cepas bacterianas podem ser facilmente trocadas ajustando o conteúdo do Optiprep para levar em conta as diferenças de densidade. Da mesma forma, qualquer número de compostos pode ser adicionado ao alimento bacteriano, por exemplo, auxina, nutrientes ou compostos de drogas de moléculas pequenas, e seu efeito é observado diretamente in vivo, sem a necessidade de alterações no protocolo. Em particular, um dispositivo de troca de mídia foi desenvolvido para degradação de proteínas induzida por auxina ou qualquer aplicação que necessite de exposição cronometrada ou reversível, adicionando uma entrada de alimento ao layout do dispositivo sem alterar a geometria ou operação. A entrada adicional permite a comutação simples entre duas condições diferentes, por exemplo, auxina e sem auxina, conectadas ao dispositivo da mesma maneira mostrada aqui para uma única fonte de alimento, e as alterações resultantes são observadas diretamente. Variantes de dispositivos também foram desenvolvidas onde a válvula hidráulica não é compartilhada entre todas as unidades de um dispositivo, mas separada para cada unidade, de modo que várias condições possam ser visualizadas dentro do mesmo dispositivo e experimentadas individualmente, reduzindo os efeitos potencialmente prejudiciais de longos tempos de atuação e aquisição da válvula. Finalmente, além das variantes originais do dispositivo descritas em Berger et al.18, duas novas variantes do dispositivo foram desenvolvidas, L3-A e L4-A (apresentadas aqui), permitindo imagens do estágio médio de L3 ou meados de L4 até a idade adulta. O objetivo dessas modificações é atrasar o tempo de início de um experimento para um estágio larval posterior, de modo que animais maiores possam ser carregados em aplicações onde os estágios iniciais de desenvolvimento não são de interesse.
Divulgações
Os autores declaram não haver interesses concorrentes ou financeiros.
Agradecimentos
Gostaríamos de agradecer aos membros do laboratório Hajnal pela discussão crítica e comentários sobre o manuscrito. Também somos gratos ao C. elegans Genetics Center CGC, financiado pelo Escritório de Programas de Infraestrutura de Pesquisa do NIH (P40 OD010440). Além disso, gostaríamos de agradecer aos membros do laboratório Galli (Instituto Hubrecht), do laboratório Conradt (University College London) e do laboratório van den Heuvel (Universidade de Utrecht) pela valiosa contribuição sobre o protocolo apresentado. Este trabalho foi apoiado por doações da Swiss National Science Foundation nº 31003A-166580 para AH, da Swiss Cancer League nº 4377-02-2018 para AH e financiamento da ETH Zürich para AdM.
Materiais
| Name | Company | Catalog Number | Comments |
| 3/2 solenoid valve | Distrelec | 154-22-898 and 154-22-899 | Alternative to above. Solenoid valve connecting the pressure regulator to the on-chip valve. |
| Arduino | Distrelec | 301-01-956 | Optional microcontroller depending on the selected controller and interface. |
| Bacto-Tryptone | Thermo Fisher Scientific | 211705 | For L Broth production. |
| Bacto-Yeast | Thermo Fisher Scientific | 212750 | For L Broth production. |
| Blunt needle 23G | Gonano Dosiertechnik | GGA723050 | Blunt needle connecting the 1/16" tubing to a syringe. |
| Blunt needle 30G | Gonano Dosiertechnik | IG-TE730050 | Blunt needle connecting the 1/32" tubing to a syringe. |
| C. elegans Construct 1 | NA | NA | AH5786 LGI: hmr-1(cp21[hmr-1::gfp + LoxP]) Marston, D.J. et al. MRCK-1 drives apical constriction in C. elegans by linking developmental patterning to force generation. Curr. Biol. 26 (16), 2079-2089. 2016. |
| C. elegans Construct 2 | NA | NA | AH1187 LGII: arIs92[egl-17::cfp] Yoo, A.S., Bais, C., Greenwald, I. Crosstalk between the EGFR and LIN-12/Notch pathways in C. elegans vulval development. Science. 303 (5658), 663-666. 2004. |
| C. elegans Construct 3 | NA | NA | AH5786 LGV: qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)] Ziel, J.W., Hagedorn, E.J., Audhya, A., Sherwood, D.R. UNC-6 (netrin) orients the invasive membrane of the anchor cell in C. elegans. Nat. Cell Biol., 11 (2), 183-189. 2009. |
| C. elegans Construct 4 | NA | NA | ML2615 LGX: dlg-1(mc103[dlg-1::gfp]) Vuong-Brender, T.T.K., Suman, S.K., Labouesse, M. The apical ECM preserves embryonic integrity and distributes mechanical stress during morphogenesis. Development. 144 (23), 4336-4349. 2017. |
| Cable | Distrelec | 143-46-644 | Needed if selecting the solenoid from distrelec. Cable connecting the solenoid to the MOSFET. |
| Chlorotrimethyl silane | Sigma Aldrich | 386529-25ML | Silane for wafer passivation. |
| Cholesterol | Sigma Aldrich | C8667 | For S-Basal production. |
| Flyback Diode | Distrelec | 110-52-628 | Flyback diode protecting the microcontroller. |
| Hollow steel pin | Gonano Dosiertechnik | GGA7R23050 | 23G hollow steel pin connecting the 1/16" tubing to the device. |
| L Broth | NA | NA | Prepared in house following standard recipe. 10 g Bacto-tryptone, 5 g Bacto-yeast, 5 g NaCl, H2O to 1 litre, pH to 7.0 using 1 M NaOH |
| Long-term Imaging Device L1 | NA | NA | Long-term imaging device for L1 to early/mid L2 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L1-4 | NA | NA | Long-term imaging device for mid L1 to mid L4 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L2-A | NA | NA | Long-term imaging device for mid L2 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L3-A | NA | NA | Long-term imaging device for mid L3 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L4-A | NA | NA | Long-term imaging device for mid L4 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| M9 Buffer | NA | NA | Prepared in house following standard recipe. |
| MOSFET | Distrelec | 303-41-391 | Metal-oxide-semiconductor field-effect transistor, used to switch the 24VDC required for the solenoid. |
| NGM plates | NA | NA | Prepared in house following standard recipe. |
| Nylon Luer-Fitting | Fisher Scientific | 11776048 | Adapter from OD 6mm tubing to 23G blunt needle. |
| Optiprep | Sigma Aldrich | D1556 | Density matching liquid. |
| PDMS | Ameba | Elastosil RT601A/B | PDMS elastomer kit. |
| Pluronic F-127 | Sigma Aldrich | P2443 | Non-ionic surfactant. |
| Potassium dihydrogen phosphate | Sigma Aldrich | 1.37039 | For S-Basal production. |
| Potassium hydrogen phosphate | Sigma Aldrich | 1.05099 | For S-Basal production. |
| Power Supply 24VDC | Distrelec | 301-63-304 | 24VDC power supply. Select a power supply suitable for the solenoid selected. |
| Precision pressure regulator | Distrelec | 154-23-578 | Alternativ to above. Pressure regulator. |
| Pressure Gauge G1/8 | Distrelec | 154-23-643 | Pressure gauge attaches to the pressure regulator. |
| PU Tubing OD 6mm | Distrelec | 154-23-866 | Tubing connecting the pressure source and regulator, as well as regulator and solenoid valve. |
| Push-in fitting G1/8 to 6mm | Distrelec | 301-69-330 | Alternativ to above. 2x Push-in fitting attaches to the pressure regulator and connects to the 6mm tubing. |
| Push-in fitting M5 to 6 mm | Distrelec | 301-69-459 | 2x Push-in fitting attaches to the solenoid and the 6mm tubing. |
| S-Basal Buffer | NA | NA | Prepared in house following standard recipe. 5.85 g NaCl, 1 g K2HPO4, 6 g KH2PO4, 1 ml cholesterol (5 mg/ml in ethanol), H2O to 1 litre. Sterilize by autoclaving. |
| Sodium Chloride | Sigma Aldrich | S9625 | For L Broth and S-Basal production. |
| Sodium hydroxite (5M) | Sigma Aldrich | 567530 | Sodium hydroxide used when bleaching C. elegans (prepare solution at 5M concentration) |
| Sodium hypochlorite (5%) | Sigma Aldrich | 1.05614 | Sodium hypochlorite used when bleaching C. elegans (prepare solution at 5% concentration) |
| Strainer 10 µm | pluriSelect | 43-10010-40 | Alternative for bacteria food preparation, especially if smaller devices are used. |
| Strainer 5 µm | pluriSelect | 43-10005-40 | Strainer used to filter L1 larvae after overnight starvation and bacteria after completed food preparation. |
| SU-8 | Gersteltec | GM1050 | SU-8 for height from 1-10 µm. |
| SU-8 | Gersteltec | GM1060 | SU-8 for height from 5-30 µm. |
| SU-9 | Gersteltec | GM1070 | SU-8 for height from 15-200 µm. |
| Syringe 1 mL | Fisher Scientific | 11338763 | 1mL syringe. If using a different type ensure that the syringe body and plunger are stiff, such that they won't be deformed by the syringe pump. |
| Syringe Pump | WPI | Al1000-220 | Syringe pump (https://www.wpiinc.com/var-2300-aladdin-single-syringe-pump.html). |
| Tube 15 mL | Fisher Scientific | 50-809-220 | Tube used for worm bleaching and bacteria preparation. |
| Tube 2 mL | Fisher Scientific | NC1186931 | Tube used for worm preparation and bacteria preparation. |
| Tube 50 mL | Fisher Scientific | 50-465-232 | Tube used for bacteria preparation and growth. |
| Tweezer SMD | Brütsch Rüegg Werkzeuge | 448980 | Tweezers used to plug the 1/32" tubing into the device. |
| Tygon tubing 1/16" | Fisher Scientific | 642002 | Flexible 1/16" OD tubing connecting most components to the device. |
| Tygon tubing 1/32" | Fisher Scientific | 641900 | Flexible 1/32" OD tubing connecting the bacteria supply to the device. |
| UV KUB-3 | Kloe | NA | Mask aligner and UV exposure system. |
| Wafer | Siegert Wafer | 4P0/>1/525±25/SSP/TTV<10 | Silicon Wafer. |
| Waste Container | NA | NA | Prepared in house using a 2mL tube or a cryo vial and hollow steel pins. |
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados