Method Article
所有幼虫阶段的高分辨率 秀丽隐杆线 虫成像
摘要
该协议描述了整个胚胎后发育过程中基于微流体的 秀丽隐 杆线虫延时成像。
摘要
秀丽隐杆 线虫已成为生物学中研究最广泛和理解最广的动物模型之一。 秀丽隐杆线 虫作为模式生物成功的关键有三个:其不变的细胞谱系、透明度和遗传易处理性。这些使其成为直接 体内各种基于显微镜的研究的理想选择。在图像采集过程中,活的 秀丽隐杆线 虫幼虫和成虫通常需要固定。传统的固定化方法对动物发育有不利影响,尤其是在延时成像应用中。在这里,介绍了一种新型微流体成像方法的详细设置和作方案,该方法解决了与传统的基于琼脂垫的固定和其他微流体策略相关的局限性。这种方法可以在各个幼虫阶段同时进行实时成像,同时随着时间的推移保持蠕虫的方向和身份。为了实现这一目标,采用了微流体陷阱通道阵列,其几何形状经过精确设计,可在适应生长和蜕皮的同时保持稳定的蠕虫方向。主动液压阀有助于固定,该液压阀仅在图像采集期间施加压力以将蜗杆固定在盖玻片上。这种设计允许高分辨率成像,对蠕虫活力或发育时间的影响最小。
引言
秀丽隐杆线虫成像可以通过多种方式进行,具体取决于应用、所需的通量和分辨率。当需要高分辨率时,标准方法使用琼脂垫 1,2,3,这是一种由载玻片、琼脂糖和盖玻片组成的简单结构。这些载玻片上的动物被盖玻片施加的压力固定。通过添加麻醉剂(例如左旋咪唑或叠氮化钠 1,2),可以进一步改善固定化,这样琼脂垫上的动物就可以完全静止,并且可以以高分辨率成像,包括各种超分辨率方法2。不幸的是,已知琼脂垫会影响发育进展,高压和麻醉剂的组合会延缓发育或导致发育完全停滞 4,5。
除了这些标准方法外,近年来还出现了几种微流体方法,每种方法都有其优点和缺点或专门的用例6、7、8、9、10、11、12、13、14、15、16、17、18、19. 例如,Gritti 等人20 引入了一种将蠕虫限制在大腔室内的方法。放置在这些腔室中的胚胎可以自由发育和移动,同时保持在显微镜上的指定感兴趣区域内。虽然通常有效,但这种方法仅限于使用明亮的荧光标记物。最近,Keil 等人21 提出了这种方法的修改版本,在图像采集过程中加入了一个片上液压阀来约束动物,从而解决了原始方法的一些局限性。然而,由于这两种方法都使用比用于捕获蠕虫的腔室更大的腔室,因此动物在整个实验过程中继续移动和旋转。因此,跟踪发育过程变得具有挑战性,需要大量的图像后处理来校正动物的运动。
为了解决这些限制,Berger 等人18 (图 1)引入的方法,其中动物不被关在一个大房间里,而是被饲养在一个陷阱通道中,该通道旨在使动物适应较短的发育窗口(最多 2.5 个幼虫阶段)。与现有的微流控方法不同,这种方法在整个实验过程中保留了动物的方向和身份,并允许在单个设备中并行和跨多个幼虫阶段获取多个蠕虫的高分辨率图像。
使用专门的通道几何形状捕获动物,其中通道高度接近实验开始时动物的厚度,从而防止旋转。选择通道宽度和长度,以便动物可以随着时间的推移移动和生长,从而促进蜕皮和从一个幼虫阶段过渡到下一个阶段。然后只需将多个陷阱通道彼此相邻放置即可实现并行化,这样在单个视野中可以看到多只动物(FOV, 图 1A'),并且最多可以在单个设备单元中对 41 只动物进行成像(图 1A)。芯片上的动物 通过 低高度通道持续获得高浓度的细菌食物悬浮液,同时有助于将动物限制在陷阱通道阵列的末端(高度步长, 图 1A,红色)。与 Keil 等人 21 采用的方法类似,实现了一个大型液压片上阀,该阀可以在图像采集过程中充气,将动物压在盖玻片上,从而提高动物固定能力(图 1B)。将液压阀驱动限制在图像采集期间,可最大限度地减少对动物发育的任何不利影响,确保所有幼虫阶段的可靠发育。与 Gritti 等人 20 和 Keil 等人 21 描述的方法不同,不能在同一设备内对动物的整个胚胎后发育进行成像。相反,引入了五种不同的设备,分别称为 L1、L1-4、L2-A、L3-A 和 L4-A,分别涵盖整个 L1 阶段和 L2 早期、L1 中后期到 L4 中期、L2 中晚期到成年早期、L3 中晚期到青年期和 L4 晚期到青年期(图 1C), 这允许对胚胎后发育的大部分进行不间断成像。采用这种方法是因为从 L1 到成年,动物体型大幅增加,因此适合 L1 动物的通道对于成年来说太小了,导致发育停滞,而适合成体的通道对于 L1 来说太大了,导致过度运动、旋转和动物逃离陷阱通道。
使用这种方法,可以实现各种组织的可靠发育进程18,例如,皮下组织的胚胎后发育(L1 至 L4 阶段)、外阴细胞命运的诱导(L2 和 L3 阶段)、外阴形态发生(L3 至成年19)和锚定细胞侵袭。自推出以来,这些长时程成像设备已被用于研究各种过程22,23,该平台甚至与 AiryScan 超分辨率显微镜24 等技术相结合,实现了许多以前不可能的发现。
在下文中,这些长时程成像设备的作方面将以分步协议的形式介绍,重点介绍设置系统时的预期结果和一些潜在挑战。
研究方案
本研究中使用的试剂和设备的详细信息列在 材料表中。
1. 器件制造
注意:所有设备均使用以下协议制造,但是,设备可直接从作者处获得。为每种器件类型制造一个单独的晶圆,每个器件晶圆由两层不同高度的 SU8(即食品层和陷阱层)制成。阀晶片在单独的晶片上制造,单个高度为 SU-8,省略了步骤 1.3-1.6。硅烷有毒,放出腐蚀性蒸气。因此,此步骤需要在通风橱中执行。有关制造程序的详细信息,请参阅 Berger et al.18。
- 使用空气等离子体清洁晶圆。
- 旋涂第一层 SU8,然后在 95 °C 下进行软烘烤。
- 曝光第一层,然后在 95 °C 下进行后烘烤并显影。
- 在晶圆显影和干燥后再次进行等离子清洗。
- 旋涂第二层 SU8,然后在 95 °C 下进行软烘烤(如有必要,在 65 °C 下进行初始烘烤)。
- 使用晶圆两侧的对齐标记将第二个掩模与现有特征对齐,然后暴露第二层。
- 对晶圆进行后烘烤和显影,然后在 200 °C 下进行硬烘烤。
- 用氯三甲基硅烷处理晶片至少 2 小时。
- 准备一批 20 g PDMS 预聚物(A 部分),并将其与 1 g 交联剂(比例 20: 1,B 部分)充分混合(参见材料表)。
- 脱气 10 分钟或直到所有气泡消失。
- 取出 2 mL PDMS 混合物并保留用于步骤 1.13。
- 向剩余的 PDMS 混合物中再加入 3 g 交联剂,并充分混合(最终比例约为 5:1)。
- 使用该批次的 20:1 PDMS,以 750 rpm 的速度旋涂器件晶圆 30 秒。
- 将阀晶片放入铝盘中,然后将 5:1 PDMS 浇铸到其上。对器件晶圆脱气约 10 分钟。脱气后,使用移液器去除任何残留的气泡。
- 将阀层和设备层分别在 70 °C 下烘烤约 15/20 分钟。
- 用移液器吸头或镊子轻轻探查装置和瓣膜层的固化情况。阀层应该是实心的,而设备层应该保持轻微的粘性。
- 拆下瓣膜层,并使用手术刀或剃须刀片将其修剪成所需的尺寸。
- 在阀通道中打一个检修孔(规格 20)。
- 将器件晶圆放置在配备顶部照明的立体显微镜下。
- 小心地将包含阀层的 PDMS 片放在器件晶片上。
- 精确对齐阀门和设备功能,确保去除各层之间所有滞留的空气。
- 将组装好的装置转移到烤箱中,并在 70 °C 下烘烤过夜。
- 将器件从晶圆上拆下。
- 冲孔 (规格 20)。
- 使用空气等离子体将 PDMS 粘合到盖玻片上,然后将粘合的设备放入 70 °C 的烘箱中几个小时。
2. 蠕虫准备
注:本节介绍通过漂白制备蠕虫,漂白可以生成大量(数百)动物。其他同步方法(例如手动拣选)是可能的,但通常更耗时且更耗力。该方案中使用的所有蠕虫均根据标准方案在20°C下维持在用 大肠杆菌 OP50接种的NGM平板上。
- 从有许多怀孕动物的盘子开始。
- 使用 M9 缓冲液将动物从板中洗掉。
- 向蠕虫悬浮液中加入 5% NaClO 和 5 M NaOH(每 1 mL 蠕虫悬浮液 200 μL/100 μL)。
- 轻轻摇晃漂白混合物,直到动物开始破裂(~10 分钟)。
- 在室温下以 1300 x g 离心漂白混合物 1 分钟。
- 用移液管除去上清液,并加入等量的新鲜 M9 缓冲液。
- 再次在室温下以 1300 x g 离心 1 分钟。
- 去除上清液,将沉淀的蠕虫转移到装有 5 mL 新鲜 M9 缓冲液的 15 mL 试管中。
- 在 20 °C 下摇动过夜。
- 将蠕虫悬液通过 10 μm 细胞过滤器。
- 在室温下以 1300 × g 离心蠕虫悬浮液 1 分钟。
- 弃去上清液,将蠕虫重悬于等体积的 M9 缓冲液中。
- 在室温下以 1300 × g 再次离心蠕虫混合物 1 分钟。
- 去除上清液并将蠕虫转移到 NGM 板中。如果需要 L1 幼虫,请立即使用它们。
- 一旦蠕虫达到所需的发育阶段,使用通过 0.2 μm 过滤器过滤的新鲜 S-Basal 缓冲液将它们从板上洗掉。
- 让蠕虫在重力作用下沉淀或在室温下以 750 × g 离心 1 分钟沉淀。
- 弃去上清液,加入等体积的新鲜 S-Basal 缓冲液。
- 重复沉淀或离心步骤(步骤 2.16 和 2.17)
- 去除上清液,加入等体积的新鲜 S-Basal 缓冲液。
- 最后一次执行沉淀或离心步骤。
- 去除大部分上清液。
- 将蠕虫留在试管中,直到实验开始。
3. 细菌制备
注意:芯片上可以使用不同的细菌菌株(例如,OP50、NA22、HT114 等)。调整添加到食物混合物中的密度梯度介质的比例,以补偿密度差异。所有缓冲液均通过 0.2 μm 过滤器以去除颗粒。
- 在离心管、无菌锥形瓶等中制备 40 mL 的 LBroth,以 2 x 20 mL 的容量制备。
- 用从储备板中挑选的细菌接种 LB。
- 在 37 °C (~16 h) 下摇动过夜时培养细菌 (OD600 = 1.9)。
- 以 3000 x g 离心细菌 10 分钟。
- 去除上清液,向每个试管中加入 2 mL 新鲜的 S-Basal 缓冲液。合并所有管子。
- 使用移液管机械重悬细菌。
- 将细菌以 3000 x g 离心 5 分钟。
- 去除上清液,再次加入 2 mL 新鲜的 S-Basal 缓冲液。
- 使用移液管机械重悬细菌。
- 将细菌以 3000 x g 离心 5 分钟。
- 尽可能多地去除上清液并加入 1 mL 新鲜的 S-Basal 缓冲液,然后机械重悬所有细菌。
- 将 0.60 mL 密度梯度培养基、0.38 mL S-基础 + 1% 重量 Pluronic F-127(一种非离子三嵌段共聚物,此处表示为 PF)与 1 mL OP50 细菌悬浮液或 0.65 mL 密度梯度培养基、0.33 mL S-基础 + 1% 重量 PF 与 1 mL NA22 或 HT114 细菌悬浮液混合。
- 使用涡旋混合器充分混合食物制备。
- 通过 5 μm 或 10 μm 细胞过滤器过滤食物。使用较小的设备(例如 L1 设备)时,特别建议使用较小的过滤器。
注意:食物可以在室温下保存长达 2 天。
4. 芯片准备
注意:有关设备、管道和连接的示意图,请参阅 图 2 。所有缓冲液均通过 0.2 μm 过滤器以去除灰尘。以下步骤中提到的钢针是指一根短的空心管,用于将较大的外径管 (1/16“) 连接到 PDMS 器件中制造的小直径孔。这些钢针只需插入管子的内径,然后推入 PDMS 材料中,即可有效地将两者连接起来。
- 首先用去离子 (DI) 水填充注射器。
- 连接一根 23 G 针和一根 1/16 英寸的长管,末端有一个空心钢针(弯曲 90° 角)。管子应该足够长,以便从螺线管延伸到显微镜载物台。
- 用注射器中的去离子水填充管道,然后将钢针插入冲孔中,将其连接到阀门入口(图 2A、J)。
- 取出注射器和针头,然后将管道连接到片外螺线管(图 2A、J)。
- 使用成像软件,打开电磁阀并对设备加压几分钟,以排出阀门中的所有空气。通过目视检查芯片上的气-水界面来验证完成,该界面应该显得较暗并消失在 PDMS 材料中(图 2B)。
- 关闭螺线管(图 2C)。
- 用过滤后的细菌溶液填充 1 mL 注射器(~0.5 mL 食物就足够了)。
- 将一根 30 G 针和一根 1/32“ 长管连接到针上。
- 按下柱塞以填充针头和连接的管路,确保注射器或管路中没有空气残留。
- 将 1/32 英寸的管子直接插入微流体设备的食物入口,使用镊子防止损坏管子(建议使用 SMD 镊子)(图 2D,K)。
- 将注射器放在注射泵上(图 2D)。
- 使用背面的翼形螺钉按压注射器柱塞,使设备充满液体。每个打开的连接处都应出现一滴液体(图 2D,箭头)。
- 用密封的钢针(一个钢针,带有一小段 1/16 英寸管子连接并通过燃烧密封)堵塞蜗杆入口和出口(图 2E,L)。
- 使用翼形螺钉施加额外压力以去除设备中的任何剩余空气(图 2E,箭头)。
- 取下出口处堵塞的针脚,并连接废液容器(由冷冻管或微量离心管制成,两个钢针插在盖子上,并用胶水固定)。废液容器使用一小段 1/16 英寸管连接,一端连接到容器,另一端连接到空心钢针(弯曲 90°)(图 2F,G,M)。
- 推动注射器以确保废液容器正确连接并且系统中不存在堵塞。为此,将少量液体推入系统(转动注射泵上的指旋螺钉),直到液体流过废液管(图 2G,箭头)。
- 拆下第二个堵塞的钢销。
- 推动注射器,直到蠕虫入口处出现一小滴液体(图 2H,N)。
- 使用 15 G 针头将一根较长的 1/16 英寸管 (20-23 cm) 连接到装有 S-Basal 缓冲液的 23 mL 注射器上(图 2H,N)。
- 将 23 G 钢针直接连接到管路的另一端。
- 用注射器中的缓冲液填充针头和管路,确保注射器或管路中没有空气残留。
- 将管路末端的钢针插入包含蜗杆的管子中。
- 将少量液体推入管路,确保没有空气残留。
- 将蠕虫拉入管道,但不要将其拉入注射器。
- 推动连接到蠕虫的注射器,直到钢针上出现一小滴液体(图 2H)。
- 将钢销插入蜗杆入口(图 2I)。
注意:设备准备可以在最终蠕虫制备之前进行,并留在显微镜上,直到蠕虫准备好。
5. 蠕虫加载和成像
- 将设备以低倍率(5 倍或 10 倍)放在显微镜上或解剖显微镜上。
- 识别当前正在使用的设备单元,并使用明场照明找到蜗杆入口。
- 放置设备,使入口在视野的一侧可见,而捕集通道入口的背面在另一侧可见。
- 轻轻推动蠕虫注射器的柱塞。液体将明显地从入口通过通道阵列流向出口。细菌的存在和由于添加密度梯度介质而导致的折射率差异使液体流动明显。
- 确保蠕虫从入口出现并流向通道阵列的背面。
- 轻轻地将动物推向通道阵列。一旦动物面向通道,将其推入通道,然后对其他动物重复此作。
注意:动物需要将头朝向出口,以便于获取食物。它们可以通过推拉柱塞和游泳来定位。 - 一旦捕获了足够的动物,将仍然连接到蠕虫入口的注射器放在显微镜载物台上,它将在整个实验过程中保持在那里。可能需要从注射器上短暂地拆下蠕虫管以释放任何压力积聚,然后小心地将其重新连接到钝针上。
- 如果在解剖显微镜上进行加载,请将设备转移到成像显微镜上。管道可以保持连接到芯片上,注射器可以连接到泵。
- 打开注射泵,以 1 μL/h 的预设速率运行 0.5 μL,将速率增加 100 μL/h (0.5 μL),然后将其降低回 1 μL/h。整个实验会自动重复此循环。有关如何对泵进行编程的信息,请参阅设备的用户手册。
- 将设备放在显微镜载物台上并确保其牢固握住(有关安装机制的建议可在 图 3A 中找到)。
- 如果未在成像显微镜上进行加载,请在低放大倍率下确定感兴趣的设备单元。
- 切换到所需的成像放大倍率。
注意:这些设备与所有物镜类型兼容。 - 在陷阱通道阵列中识别动物和感兴趣的区域,并设置所需的成像条件。
- 在图像采集前 10 秒,使用片上阀通过螺线管启动,在所需成像条件下进行成像,因此动物被固定在原位。
注意:驱动片上阀会拉长和压平动物,可能需要调整感兴趣成像区域 (ROI)。
6. 设置准备
注意:本节是指设备控制机制的初始准备,不需要在每次实验前重复。参见 图 3B、C。由于许多螺线管需要更高的电压,因此螺线管很可能不会直接连接到微控制器,而是 通过 继电器或 MOSFET 连接(参见 图 3C)。
- 确定加压气源(例如,壁式供水装置或气瓶)。
- 使用 6 mm 管路(壁源)将压力源连接到合适的减压阀(0-2 bar 压力范围),或将合适的减压阀直接连接到气瓶上。
- 将压力调节器连接到电磁阀输入端(6 mm 管,参见 图 3B)。
- 将螺线管放置在尽可能靠近显微镜载物台的位置(建议距离载物台 ~0.5-1 m,但如果需要,可以保持更长的距离)。
- 以电子方式将电磁阀连接到选定的控制器。有不同的选项可供选择,例如使用单独的微控制器板(例如 Arduino)或现有的 DAq 卡进行控制。
7. 清理和储存
- 实验完成后,从显微镜中取出设备。
- 取出浸入的液体。浸泡油可以用有机溶剂(例如丙酮、甲醇等)去除。
- 将设备放在平坦的表面上,并断开除阀管以外的所有管路。要安全地断开每根管路的连接,请按下靠近其的 PDMS 并轻轻拉动。请勿抬起和弯曲设备,因为这可能会导致盖玻片破裂。
- 用 70% 乙醇清洁 PDMS 表面。
- 将设备存放在室温下,并连接阀管。
注意:该设备可以重复使用,直到所有装置都用完,可能不需要重新填充阀管。但是,阀管中的水会在很长一段时间内蒸发,最终可能需要重新填充。
结果
设备设计和尺寸
设计了五个不同的设备来容纳所有四个幼虫阶段。这些装置的指定如下:L1,用于孵化后立即加载 L1 幼虫并成像至 L2 阶段;L1-L4,能够容纳从 L1 中晚期到 L4 早期到中期的幼虫;L2-A,适用于大约从 L2 中期到成年早期的动物;L3-A,适用于大约从 L3 中期到成年早期的动物;和 L4-A,它可容纳从大约 L4 晚期到成年早期的动物。
所有设备都遵循相同的基本布局,包括一个蠕虫入口、1 个(或在介质交换的情况下为 2 个)细菌食物入口和一个公共废物出口。在入口和出口部分之间,放置了一个由 41 个平行陷阱通道组成的阵列,入口和出口侧被较低高度的食物供应通道有效隔开(图 1A,A′)。选择通道尺寸比实验开始时加载的螺杆长/宽明显更长、更宽,L1 器件的长度/宽度为 400/15 μm,L1-L4 器件的长度/宽度为 575/22 μm,L2-A 器件的长度/宽度为 800/27 μm,L3-A 器件的长度/宽度为 900/30 μm,L4-A 器件的长度/宽度为 1000/65 μm(补充文件 1、 补充文件 2、 补充文件 3、 补充文件 4 和补充 文件 5)。
选择通道长度以匹配动物在实验结束时达到的大小,而选择宽度以使实验开始时的蠕虫占据大约三分之二的通道宽度。这种设计为蜕皮期间的生长和移动提供了足够的空间,同时防止蠕虫转动或旋转。与宽度不同,通道高度设置在实验开始时接近蠕虫的厚度:早期 L1 幼虫为 8 μm,中/晚期 L1 幼虫为 12 μm,中期 L2 幼虫为 15 μm,中期 L3 幼虫为 17.5 μm,晚期 L4 幼虫为 22.5 μm,对应于 L1、L1-L4、L2-A、L3-A、 和 L4-A 设备。减小的通道高度,结合精心选择的宽度(保持 0.5-0.6 的高宽比),确保蜗杆保持固定方向。值得注意的是,在通道高度足够小的情况下,所有蜗杆都始终位于所需的横向方向。
L1 的食物供应通道高度为 3 μm,所有其他设备的高度为 5 μm,确保细菌可以轻松到达动物,而不会让动物从陷阱通道中逃脱。所有设备都使用相同的食品供应层(补充文件 6)和相同的阀门层(补充文件 7)。请注意,阀层是在高度为 20 μm 的单独晶圆上制造的,并且在 PDMS 器件制造期间仅放置在器件层上(步骤 1.21)。
这些特定于阶段的几何约束对于防止蠕虫从头到尾旋转或反转至关重要,因此需要使用三种不同的设备类型来适应所有幼虫阶段。如果将 L1 幼虫放置在适合年轻成年动物的通道中,它们将无法保持稳定,并且会迅速离开诱捕通道。
秀丽隐杆线虫 制备
除非另有说明,否则根据标准方案25 在 20 °C 下接种大 肠 杆菌 OP50 的 NGM 平板上维持蠕虫。 蠕虫制备部分明确描述了成像实验中使用的同步蠕虫种群的制备。根据标准方案使用次氯酸钠漂白剂26 进行同步,并通过额外的过滤步骤进行改性,以去除饥饿过夜后的碎屑和未孵化的动物。目的是获得许多同步的 L1 幼虫,然后将其接种在 NGM 平板上或直接加载到成像装置中。其他同步方法,例如手动采摘或受控产蛋,同样适用。然而,它们在产生足够的动物方面更加费力(建议每个条件 200 只)。
一旦蠕虫达到所需阶段,就可以使用干净的 S-Basal 轻轻地将它们从 NGM 板上洗掉(最好通过 0.2 μm 过滤器过滤)。目的是在不从板中收集细菌或碎屑的情况下收集尽可能多的动物。将动物收集在小离心管中,并用新鲜的 S-Basal 缓冲液洗涤 2-3 次,最后去除尽可能多的液体。然后直接从浓缩体积中取出动物。如果动物浓度过低,加载速度会变慢,需要更大体积的液体流过设备,并增加碎屑堵塞捕集通道的风险。
细菌食物制备
细菌生长按照标准方案进行,初始细菌浓度 (OD600 = 1.9) 在 S-Basal 缓冲液(通过 0.2 μm 过滤器过滤)中增加约 40 倍,并与密度梯度培养基和含有 PF 的 S-Basal 缓冲液混合(通过 0.2 μm 过滤器过滤)。该工艺步骤的预期结果是制备非常致密的细菌悬浮液并防止成像实验过程中的细菌沉淀。高密度对于以培养基输送中采用的低流速 (1 μL/h) 进行芯片上的动物饲喂是必需的。密度梯度介质的目的是防止实验过程中细菌沉淀,PF 的目的是防止细菌粘附在通道壁上。密度梯度培养基和 PF 均无毒,不会影响动物活力。
如果在实验中使用了不同的细菌类型,则需要确定密度梯度介质的必要浓度。这可以通过将细菌悬浮液与不同量的培养基混合,然后离心来实现。如果密度梯度浓度过低,细菌会沉淀;如果浓度过高,细菌会漂浮。一旦找到合适的浓度,建议通过将细菌混合物在室温下放置约 48 小时来验证结果,以表明食物在整个实验过程中的行为。实验结束后,同样建议检查用于供应细菌的注射器,并确保细菌不会沉淀或漂浮。添加不同量的 Optiprep 而导致的体积差异可以通过添加或多或少的 S-基础 + 1% 重量 PF 来补偿。同样,可以将额外的培养基或化合物(例如生长素)添加到悬浮液中,并从 S-基础 + 1% 重量 PF 的体积中减去额外的体积。
设置准备
将压力供应系统设置在尽可能靠近显微镜的位置,以便于作。所有管路,尤其是连接到芯片的 1/16“ 管路,应保持较短(1/16” OD 管路小于 0.5 m)(图 2 和 图 3B)。如上一节所示,可以通过多种方式实现片上阀的计算机控制。在任何显微镜软件中(在 Micro-Manager、Metamorph、NIS 和 ZenBlue 中测试),通过连接专用微控制器板(例如 Arduino)或使用数字输出将系统连接到现有的数据采集 (DAq) 卡,都应该是可能的。然后,应将选定的板输出配置为快门,该快门在图像采集前 10 秒打开或在设备设置期间手动启动。如前所述,不建议将螺线管直接连接到微控制器;相反, 通过 MOSFET 或继电器开关连接,以便螺线管和微控制器保持电子隔离(图 3C)。
与压力供应管路类似,使连接到芯片的所有其他管路(1/16“ OD 和 1/32” OD)尽可能短。将蠕虫管和废液管(外径 1/16 英寸)分别保持在 2.5 厘米和 20 厘米以下。细菌供应管(外径 1/32 英寸)必须足够长,以便在放置在显微镜载物台上后从注射泵连接到设备。尽管如此,强烈建议尽可能缩短时间并将注射泵放置在靠近显微镜载物台的位置,例如,靠近载物台、使用架子或培养箱外壳顶部。添加到系统中的任何长度的管道都会增加将动物装入装置时感受到的背压,并增加被困动物的总压力。
设备作
在此阶段(方案步骤 4 开始),可以准备所有管路并将其连接到相应的钝针、钢针和注射器。如上所述,保持管子长度尽可能短(图 2J-N)。重要的是,必须注意注射器或管道中不要残留气泡,因为它们会干扰动物负载,并可能导致动物在实验期间从陷阱通道中逃脱。可以通过多种不同的方式从注射器中去除气泡,例如,填充注射器,倒置注射器,然后轻轻摇晃,使气泡上升到注射器的顶部(不建议轻弹注射器,因为这会导致额外的气泡被捕获)。或者,可以通过将注射器插入缓冲液中并快速上下移动柱塞来填充注射器,以快速去除大部分气泡。
一旦注射器装满且无气泡,就会连接钝针和管路并填充缓冲液。填充注射器时还必须特别小心,因为空气很容易被困在钝针的塑料部分。如果空气滞留,请更换针头。或者,用液体预填充针头,例如使用移液器,可以缓解这个问题。
所有组件就位后,可以将管道连接到设备上,从连接电磁阀和片上阀的管道开始(图 2A-C,J)。该管路最初充满去离子水,然后对系统加压以去除死端阀通道中的所有空气。PDMS 是透气的;因此,升高的压力会将通道中的所有空气推入 PDMS,使阀通道充满水。可以在显微镜上跟踪此过程,确保整个瓣膜通道都充满。填充阀门后,可以连接细菌供应,并且可以通过阻塞所有打开的入口/出口来填充和加压设备(图 2D,E,K,L)。空气被置换,并且可以在显微镜上监测该过程。一旦所有空气都被排出,细菌应该均匀地充满设备。移除阻塞销,并连接废物收集管(图 2F,G,M)。此时,应有少量液体通过设备流入废液收集管,确保与管子的所有连接都打开。在将管路连接到收集管之前,可以目视确认这一点。如果没有液体流向废物收集管,则它可能被堵塞。这将导致实验压力积聚,对被困动物产生负面影响。如果管子或其连接被堵塞,请将其取出并使用针头清洁所有连接或用装满水的注射器冲洗。
最后,可以连接蜗杆管(图 2H,N)。只需将蠕虫吸入连接到 S 基础填充注射器的管道中,即可从离心管中吸出蠕虫。只能将动物拉入管道中,而不应拉入注射器中。然后可以将管道连接到设备。在此之前,从设备和蜗杆管中推出少量液体,并将两个液滴连接起来,以便在加载过程中不会将空气推入设备。
蜗杆装载
完成所有连接后,可以通过推拉蠕虫注射器的柱塞来装载动物。动物将从入口冲向诱捕通道阵列;然而,他们自然会逆流而上。因此,动物需要重新定位,使它们的头部面向陷阱通道。通过推拉柱塞并给动物时间旋转到所需的方向,可以完成正确的动物方向。这几乎可以在单个蠕虫的基础上实现,但需要一些练习。一旦动物方向正确,就可以将它们推入陷阱通道并滑到通道的末端,在那里高度台阶会阻止它们(图 1A、B)。如果动物无法进入通道,则它们对于所选设备来说太大,需要在更大的设备中成像。如果动物在放入诱捕通道时可以旋转或转身,则它们太小,需要使用较小的设备,或者需要让动物多生长几个小时。
重要的是,不同渠道的动物不会相互影响。因此,加载不正确的动物不会影响正确加载的动物,但是,它们将没有足够的食物,因此生长速度会变慢或发育缓慢。
如果动物在正确的年龄加载,则沿纵向通道轴的运动应最小。然而,动物可以自由摆动(图 1B)并在几分钟内开始进食。如果动物沿纵向通道轴线表现出明显的运动,这可能是由于设备中的压力积聚或管道、钝针或注射器中某处的气泡引起的。通过轻轻地将蜗杆管从钝针上拆下并轻轻重新安装,可以释放设备内积聚的压力。如果尽管采取了上述步骤和预防措施,系统内仍有气泡,则可能需要移除整个蠕虫注射器,并更换为没有气泡的新注射器。系统中的气泡起到弹簧的作用,在装载过程中被压缩,在装载动物后缓慢释放。气泡膨胀产生的流动会导致系统不稳定,将动物推出陷阱通道。
片上图像采集和开发
最后,一旦加载了动物,就可以开始图像采集。原则上,这些设备与大多数成像方法兼容,明场、落射荧光18、19、22、23 (图 4)、转盘共聚焦19, 甚至超分辨率模式(AiryScan24),因为所有成像都是通过 170 μm 厚的盖玻片进行的。因此,微流体器件对可实现的片上图像质量几乎没有影响。然而,无论成像方式如何,都必须选择不影响动物活力的适当成像条件。由于样品上施加的高能量和热量,高激发强度很容易导致荧光团漂白和发育停滞。建议使用较短的曝光时间(~10 ms)和低激发强度(小于典型荧光 LED 光源的 10%),从而在最小 = 0 和最大 = 1000 的对比度设置下产生可用图像(当使用 16 位相机时)(图 4)。
使用 L1、L1-4 和 L2-A 器件获得的代表性数据如图 4 所示。显示 秀丽隐杆线 虫上皮细胞从孵化/过夜饥饿发育到 L2 中期幼虫阶段(图 4A, 补充电影 1),诱导 1° 命运的外阴前体细胞及其随后从 L1 晚期分裂到 L4 早期幼虫阶段(图 4B, 补充电影 2),最后形成 秀丽隐杆线虫 外阴从 L3 早期幼虫阶段到过渡到成年时外翻(图 4C、 补充电影 3)。
每个应用程序都附有不同开发时间指标的量化。 图 4A、B 中的图像未应用任何后处理,即未应用反卷积或图像配准。另一方面, 图 4C 中的图像被反卷积27 并配准,突出了使用长期成像设备时图像质量的可能改进。
首先,确定图 4A 中所示动物每个接缝细胞分裂的开始(有关全日制课程,请参见补充电影 1),表明所有细胞在 12 只动物中一致和及时地分裂(图 4D)。使用接缝细胞,还评估了所有四个幼虫阶段的一般发育时间,发现所有接缝细胞分裂均在 L1 (n = 22) 的 12.0 小时± 1.7 小时(平均 ± SD)后完成,L2 ± 1.0 小时(n = 27),L3 ± 1.4 小时(n = 27),L4 动物 (n = 19) 的 14.6 小时± 2.2 小时。这些数据与文献值 2,28 以及在平板上生长的动物中测量的值一致,得出 L1 15 小时 (n = 21)、L2 10 小时 (n = 15)、L3 12 小时 (n = 21) 和 L4 12.5 小时 (n = 61) 的中位发育时间(改编自 Berger 等人 18)。观察到的轻微延迟可能是图像采集和产生的光毒性的结果,或者一旦动物长大并将成为陷阱通道,限制就会增加。
其次,我们跟踪了 L2 和 L3 阶段的动物生长,量化了性腺长度作为发育进展的极好指标(图 4E,全日制课程见补充电影 2)。与接缝细胞分裂一样,由于动物方向是直线的,因此可以测量精确的性腺长度,并且发现所有成像动物的性腺生长一致 (n = 19)。这些实验中的第一次 VPC 分裂在实验开始后 14.26 小时± 2.47 小时(接种后 ~30 小时)观察到,第二次发生在 1.46 小时± 0.13 小时后 (n = 19)。这些数据与 NGM 板29,30 上确定的文献值非常吻合。Euling 和 Ambros30 发现第一次分裂发生在大约 29 小时后,第二次发生在大约 3 小时后。
最后,量化了达到外阴发育特定阶段的时间(图 4F,全时课程见 补充电影 3 ),具体评估从内陷(L4.0,t1)进展到中 L4 阶段(L4.5,t4)所需的时间根据 Mok 等人定义的子阶段31。t1-t2 之间的平均进展时间为 3.8 h ± 1.2 h,t2-t3 之间的平均进展时间为 3.5 h ± 1.2 h,t3-t4 之间的平均进展时间为 2.8 h ± 1.6 h (n = 7),表明近似线性发育进展。与发育时间测定类似,这些时间,特别是 t1-t2,与报道的文献值 (t1-t2: 0.7 h, t2-t3: 3 h, t3-t4: 2.3 h31) 相比,似乎略有延迟,可能是由于狭窄的装置尺寸减慢了蜕皮。尽管如此,动物的发育时间保持高度一致,并且都成功地发展到成年。
补偿动物运动和显微镜漂移
当片上阀启动时,整个 Z 轴堆栈中的动物运动通常很小。然而,动物不会完全静止。通过增加压力以驱动片上阀、减少使用的曝光时间或增加选定的 Z 步长以加速堆栈采集,可以补偿在单个堆栈中观察到的残余抖动。与传统显微镜聚焦驱动器相比,使用压电 Z 驱动器可以进一步缩短堆栈采集时间,从而显着加快 Z 轴运动,或者通过使用多波段滤光片(例如 GFP/mCherry)来获取单独的颜色,而无需耗时地更换滤光片。作为参考,在提供的示例(图 4 和 补充电影 1、补充电影 2 和 补充电影 3)中,堆栈采集时间通常在 3 到 8 秒之间。如有必要,还可以通过各种图像配准方法去除残影运动。
预计芯片上的动物将稳步增长。因此,感兴趣的特征将不可避免地沿纵向通道轴移动(图 4A、B、补充电影 1 和补充电影 2)。因此,建议设置成像 FOV,以便感兴趣的特征可以生长到 FOV 中并且在实验过程中不会丢失(图 1B 和图 4A,B)。或者,可以在多个相邻的 FOV 中对动物进行成像,覆盖整个动物身体。然而,这可能会带来额外的光毒性和压力。与 Z 轴运动一样,各种配准程序可以随着时间的推移补偿通道中的动物运动。如果动物沿纵轴表现出不稳定的运动,比可归因于生长的运动更广泛,这可能是由气泡引起的。
每个长时成像设备都包含六个单独的成像单元,每个单元都可用于单独的实验。每个单元最多可容纳 41 只动物,并且陷阱通道的间隔使得可以在单个 FOV 中对多只动物进行成像。此外,可以在单个单元或设备中对多个 FOV 进行成像。与所有显微镜样品一样,由于浸没介质的损失,样品表面的移动可能会引入焦点漂移。这种漂移可以通过使用低粘度的浸油或通过各种自动对焦模式来补偿。但是,某些硬件自动对焦系统在与 PDMS 微流体设备一起使用时可能无法正常工作,因为它们使用从玻璃到水性介质的过渡作为参考点(盖玻片的样品侧)。设备内的大部分 FOV 都充满了硅,其折射率高于水;虽然这不会影响图像质量,但可能会对自动对焦产生负面影响。对单个 FOV 进行成像时,在设备内观察到的焦点漂移最小(小于 2 μm)。如果观察到过大的焦点漂移,这可能是由于显微镜系统或环境的热不稳定、过度的 XY 运动获得多个 FOV 或设备在显微镜上的安装不当造成的(参见 图 3A 了解建议的安装机制)。
同样,过度的 XY 移动和不正确的安装也可能导致 XY 漂移。由于设备和显微镜物镜 是通过 浸没液体连接的,因此 X、Y 或 Z 方向的快速移动可能会导致对设备施加力。如果设备安装正确且没有外力作用,它们将非常稳定,焦点漂移最小,无 XY 漂移。
最后,如果特定的系统参数不合适,PDMS 微流控装置可能会对动物发育产生不利影响。活力受阀门压力过大、高激发强度导致的高光毒性、长曝光时间或堆栈采集之间的短时间间隔的影响。特别是在首次使用该系统时,强烈建议使用明亮的荧光标记或明场成像来评估动物活力,以确保成像条件不会影响动物生长。一旦动物可靠地发育,就可以根据需要改变成像参数。
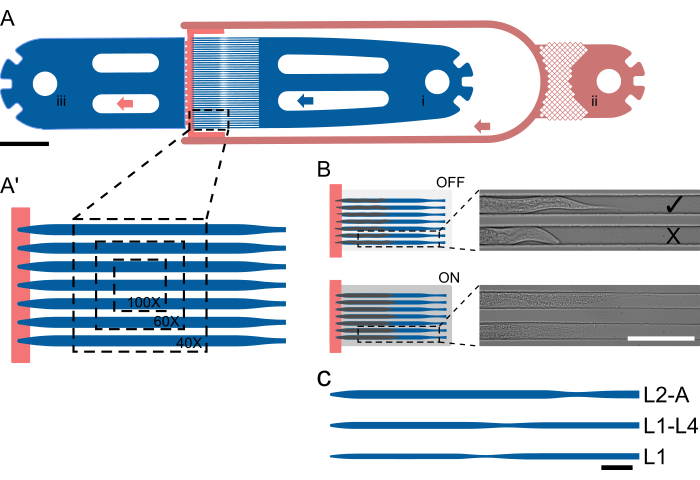
图 1:设备布局和示意图作。(A) 设备概述显示了带有蠕虫入口 (i)、细菌食物入口 (ii) 和总出口 (iii) 的单个单元。(一')L2-A 设备中陷阱通道的放大视图,突出显示了在不同放大倍率 (40x-100x) 下单个 FOV 中可见的蠕虫数量。(B) 片上阀的功能原理。关闭时,选择通道高度,以便动物可以舒适地适应陷阱通道。当 ON(打开)时,通道高度降低,将动物压在盖玻片上,从而可逆地固定被困动物。图像显示,在芯片上阀关闭和阀打开的情况下采集了两只被困的动物,动物在压力下明显伸直和伸长。上部动物正确加载并面向食物源 (), 下部动物背对着 (X)。(C-C”)原理图器件设置。(C) 可用的设备尺寸。L1 适用于 L1 至 L2 中期的动物,L1-4 适用于 L2 中期至 L4 中期的动物,L2-A 适用于 L2 中期幼虫至成年期的动物。比例尺为 (A) 1000 μm、(B) 100 μm 和 (C) 50 μm。该图部分改编自 Berger 等人 18。请单击此处查看此图的较大版本。
下部动物背对着 (X)。(C-C”)原理图器件设置。(C) 可用的设备尺寸。L1 适用于 L1 至 L2 中期的动物,L1-4 适用于 L2 中期至 L4 中期的动物,L2-A 适用于 L2 中期幼虫至成年期的动物。比例尺为 (A) 1000 μm、(B) 100 μm 和 (C) 50 μm。该图部分改编自 Berger 等人 18。请单击此处查看此图的较大版本。
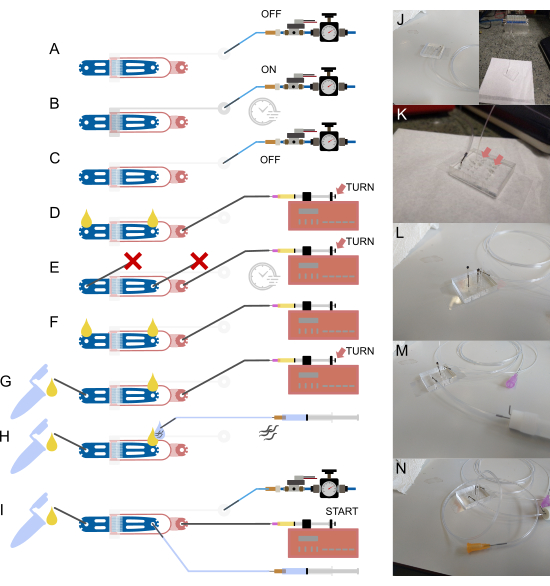
图 2:设备设置和连接。 (A-I)设置过程的示意图概述。(A) 使用空心钢销(灰色)将 1/16 英寸充水管连接到阀门入口,另一端连接到压力供应系统。(B) 通过片外电磁阀填充片上液压阀,并对装置加压几分钟。(C) 在进行下一步之前停用压力。(D) 使用 1/32 英寸管和 30 G 钝针将含有细菌食物的注射器连接到食物入口,然后填充装置,直到两个开放连接处出现液体。(E) 用一根 1/16 英寸的管子堵塞的钢销密封蜗杆入口和废物出口 ( ),并使用食品注射器和泵(通过指旋螺钉调节)对设备加压,保持压力几分钟。(F) 从 (E) 上取下塞子,确保在每个开放连接处形成液滴。(G) 通过一小段 1/16 英寸管和空心钢销连接废液容器。(H) 使用空心钢针和 23 G 钝针将填充缓冲液的注射器连接到装置上。在将管道连接到设备之前,将蠕虫吸入管道中,确保在入口和管道末端对齐液滴,不会引入空气。(I) 建立所有设备连接的最终设置。(J) 阀管连接到入口和电磁阀(背景)的装置图像,对应于 (A-C)。(K) 连接了食品供应管的设备的放大视图,显示蜗杆入口和废物出口上的两个液滴(箭头),对应于 (D)。(L) 连接了食品供应管且蜗杆入口和废物出口堵塞的设备的放大视图,对应于 (E)。(M) 连接了废液管和容器的设备的放大视图,对应于 (G)。(N) 所有管路连接就位的最终组件,对应于 (I)。部分改编自 Berger 等人18。请单击此处查看此图的较大版本。
),并使用食品注射器和泵(通过指旋螺钉调节)对设备加压,保持压力几分钟。(F) 从 (E) 上取下塞子,确保在每个开放连接处形成液滴。(G) 通过一小段 1/16 英寸管和空心钢销连接废液容器。(H) 使用空心钢针和 23 G 钝针将填充缓冲液的注射器连接到装置上。在将管道连接到设备之前,将蠕虫吸入管道中,确保在入口和管道末端对齐液滴,不会引入空气。(I) 建立所有设备连接的最终设置。(J) 阀管连接到入口和电磁阀(背景)的装置图像,对应于 (A-C)。(K) 连接了食品供应管的设备的放大视图,显示蜗杆入口和废物出口上的两个液滴(箭头),对应于 (D)。(L) 连接了食品供应管且蜗杆入口和废物出口堵塞的设备的放大视图,对应于 (E)。(M) 连接了废液管和容器的设备的放大视图,对应于 (G)。(N) 所有管路连接就位的最终组件,对应于 (I)。部分改编自 Berger 等人18。请单击此处查看此图的较大版本。
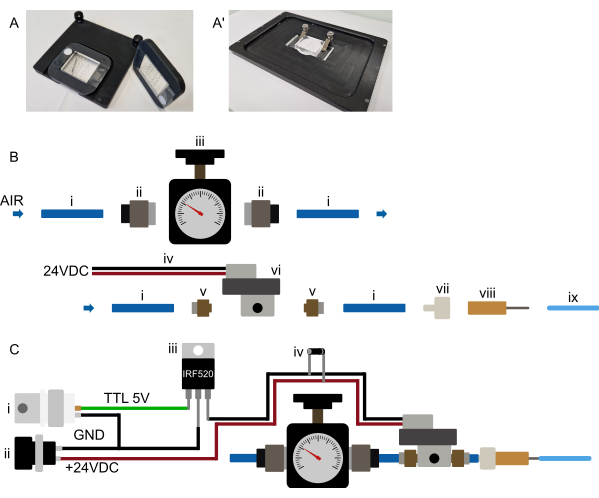
图 3:硬件设置。 (A-A')建议的设备安装。(A) 正置显微镜的可能安装座。设备连接到一个矩形的 3D 打印框架上,该框架有一个大型中央切口。最初将两小条双面胶带放在盖玻片上,位于器件 PDMS 部分的两侧。然后将 3D 打印的框架放在设备上,使 PDMS 部分穿过切口,并将框架牢牢地压在双面胶带上,将设备永久地连接到框架上。因此,框架以安全的方式固定设备,并且其本身使用嵌入框架和载物台插件中的磁铁固定在显微镜载物台上。这确保了稳定的设备安装,并防止显微镜物镜与任何安装硬件发生碰撞。所有管路都布线到设备的正面。(一')可安装倒置显微镜。一组夹子紧紧地固定设备。确保夹具将设备压在载物台插件上,以防止在运行过程中发生任何 XY 移动。(B) 压力系统部件视图。(i) 连接到压力源的 6 mm 外径聚氨酯管。(ii) G1/8 至 6 mm 快插式适配器,用于将管路 (i) 连接到减压阀 (iii)。然后,通过 M5 至 6 mm 推入式适配器 (v) 将管道连接到螺线管 (vi),最后,将管道连接到鲁尔锁到倒钩连接器 (vii) 和钝的 23 G 针 (viii) 连接到连接到微流体设备的 1/16“ OD 管。(C) 电子连接和组装压力系统的示意图概述。(i) 由 Arduino、DAq 卡或任何其他微控制器产生的 TTL 触发器 (+3.3-5 V) 以及合适的电源 (ii, 24 VDC) 连接到 MOSFET (iii) 和螺线管的电子连接,如图所示,反激二极管 (iv) 连接在螺线管电源连接上。一旦 TTL 信号从微控制器发送到 MOSFET 的栅极,+24 VDC 就会施加到常闭螺线管上,片上液压阀就会充气。一旦 TTL 信号被移除,压力就会释放,片上液压阀就会放气。请单击此处查看此图的较大版本。
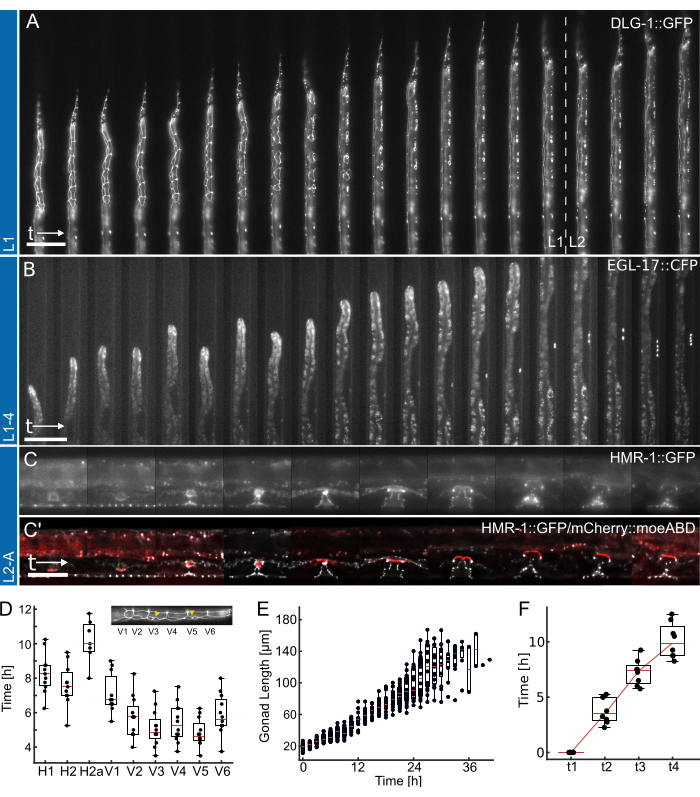
图 4:代表性结果。 (A) 使用 L1 装置显示上皮连接制造者 (ML2615, dlg-1(mc103[dlg-1::gfp])) 从夜间饥饿生长到 L2 幼虫早期/中期。可见的是分裂的接缝细胞以及 P 细胞,它们向 L1 幼虫晚期迁移和分裂。(B) 使用 L1-4 装置从 L1 幼虫晚期到 L4 早期生长的动物。可见是 1° 命运的外阴前体细胞 (VPC) (AH1187, arIs92[egl-17::cfp]) 的标志物,在实验早期可见单个细胞,随后在 L3 幼虫阶段进行两轮可见细胞分裂。(C) 使用 L2-A 装置从 L2 幼虫晚期生长到成年早期的动物。可见的是上皮连接制造器 (AH5786, hmr-1(cp21[hmr-1::gfp + LoxP])),突出了发育中的外阴组织形成不同的环形结构,以及带有子宫锚定细胞 (AC) 标记物的组合图像 (AH5786, qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)]),它在 L3 幼虫阶段结束时侵入外阴组织,连接组织。对于所有实验 (A-C),FOV 的初始设置使只有部分动物可见。随着实验的进行,由于动物的生长,动物将填充更多的通道,特征沿通道轴移动。(D) L1 幼虫阶段单个接缝细胞分裂开始分裂的时间 (n = 12)。Insert 沿前后体轴高亮显示接缝单元标识 (H1-V6)。(E) 在图 4B 中显示动物的性腺随时间生长 (n = 19)。(F) 显示外阴形态发生 (t1-t4) 达到 4 个不同发育时间点所需的时间,表明所有成像动物的过渡一致 (n = 7)。比例尺为 (A,B) 50 μm 和 (C) 25 μm。有关全日制课程,请参阅补充电影 1、补充电影 2 和补充电影 3。箱形图显示中位数(红线),其中上四分位数和下四分位数以及指示分布极值(不包括异常值)的条形。该图改编自 Berger 等人 18。请单击此处查看此图的较大版本。
补充影片 1:单个 秀丽隐杆线 虫幼虫从一夜饥饿发育到 L2 早期阶段。 显示的是最大强度投影落射荧光图像(投影的总高度为 1.5μm),采用其他未处理的格式。可以看到指定阶段(顶部)中发生的所有接缝单元分裂和熔合事件。使用 DLG-1::GFP (上皮交界处) 标记以 15 分钟的间隔概述特征,总共 25 小时。该电影被 Berger 等人重复使用 18。 请点击这里下载此电影。
补充影片 2:单只幼虫从 L1 晚期发育到 L4 早期,表达 EGL-17::CFP 标志物 (1° 宿缘外阴前体细胞 (VPC))。在 L2 早期(~400 分钟),EGL-17::CFP 荧光表现为 P6.p,强度持续增加。在 L3 期间,P6.p 经历两轮连续的分裂,形成外阴发育的 1 细胞、2 细胞和 4 细胞阶段。图像以 30 分钟的间隔显示,总共 34 小时。该电影被 Berger 等人重复使用 18。 请点击这里下载此电影。
补充电影 3:俯视图:发育中的外阴从 L3 阶段到 L4/成人过渡的 Z 投影。底视图:同一外阴随时间变化的 X 轴投影。两个视图都显示了 VPC 的初始分裂,然后是环形线圈的内陷、形成和扩大,然后是外翻过程中的坍缩。落射荧光图像在裁剪、反卷积、配准和投影后显示。通过 HMR-1::GFP 标记物(皮下组织和 VPCs)和 mCherry::moeABD 标记物(勾勒 AC)概述特征。该电影被 Berger 等人重复使用 18。 请点击这里下载此电影。
补充文件 1:L1 器件的 CAD 文件。 请点击此处下载此文件。
补充文件 2:L1-4 设备的 CAD 文件。 请点击此处下载此文件。
补充文件 3:L2-A 器件的 CAD 文件。 请点击此处下载此文件。
补充文件 4:L3-A 器件的 CAD 文件。 请点击此处下载此文件。
补充文件 5:L4-A 设备的 CAD 文件。 请点击此处下载此文件。
补充文件 6:食品分销结构的 CAD 文件。 请点击此处下载此文件。
补充文件 7:阀层的 CAD 文件。 请点击此处下载此文件。
讨论
本文描述了一种独特的微流控长期成像平台的作,该平台适用于秀丽隐杆线虫从所有四个幼虫阶段到成年早期的各种发育过程的高分辨率成像和跟踪18。使用这种成像方法和其他方法在体内随时间推移跟踪发育过程的能力在秀丽隐杆线虫研究的许多领域中已成为不可或缺的,并且允许回答以前无法获得的问题 23,24,29。
与使用琼脂垫的传统成像方法和以前发表的基于微流体的长期成像策略相比,这种方法在整个实验中保留了蠕虫的身份和方向,从而能够随着时间的推移跟踪复杂的发育过程。无论发育阶段如何,动物都被限制在 41 个平行的陷阱通道中的一个,每个通道都连接到芯片上的食品供应,并由一个大型液压阀覆盖。所有被困的蠕虫都通过液压阀的充气进行固定,仅在图像采集期间将蠕虫压在盖玻片上。由于捕获通道阵列间距窄,因此可以进行高通量成像,在单个视野内可以看到多个动物。长效成像设备与大多数显微镜设置兼容,需要最少的额外硬件(不到 1000 美元),并且无需修改现有硬件。设备的作故意简单,因此所有用户都应该能够按照上述协议和概述的结果快速学习它。
简而言之,可以在多达 2.5 个幼虫阶段对动物进行芯片成像(图 1C)。动物最初同步并直接加载到芯片上(L1 设备)或接种到 NGM 板上,直到所需的发育阶段(L1-L4 和 L2-A 设备)。使用高浓度细菌悬浮液喂养芯片上的动物,并使用由成像软件驱动的芯片上液压阀固定(图 1B)。使用注射器将动物纵到陷阱通道中,小心地将动物的头部朝向食物供应,最后在陷阱通道的末端诱捕动物(图 1A 和图 2)。必须小心,以免注射器、钝针和管道中残留空气,因为气泡很容易干扰动物的位置。设备与大多数成像模式 18,19,24 兼容,因为 PDMS 材料高度透明、无荧光,并且密封在薄盖玻璃上(图 4、补充电影 1、补充电影 2 和补充电影 3)。然而,在选择成像条件时必须小心,因为长曝光时间和高激发强度很容易影响动物的活力并导致光漂白。
除了这种成像方法的介绍版本外,对协议的几种修改是可能的并且已经可用。最直接的修改是替换标准细菌菌株,例如,用表达 RNAi 的细菌18 或具有不同营养价值的细菌32。通过调整 Optiprep 含量以解决密度差异,可以很容易地更换细菌菌株。同样,可以将任意数量的化合物添加到细菌食品中,例如生长素、营养物质或小分子药物化合物,并且它们的效果直接在 体内观察到,无需对方案进行任何更改。特别是,通过在设备布局中添加食物入口而不改变几何形状或作,为生长素诱导的蛋白质降解或任何需要定时或可逆曝光的应用开发了培养基交换装置。额外的入口允许在两种不同的条件之间进行简单切换,例如,生长素和无生长素,以与此处所示的单一食物来源相同的方式连接到设备上,并直接观察到由此产生的变化。还开发了设备变体,其中液压阀不是在设备上的所有单元之间共享的,而是为每个单元分开的,这样就可以在同一设备中对多个条件进行成像并单独进行实验,从而减少较长的阀门驱动和采集时间的潜在有害影响。最后,除了 Berger 等人 18 中描述的原始设备变体之外,还开发了两种新的设备变体,即 L3-A 和 L4-A(此处介绍),允许从 L3 中期或 L4 中期到成年期进行成像。这些修改的目的是将实验的开始时间推迟到较晚的幼虫阶段,以便可以将较大的动物加载到对早期发育阶段不感兴趣的应用中。
披露声明
作者声明没有竞争或经济利益。
致谢
我们要感谢 Hajnal 实验室的成员对手稿的批判性讨论和评论。我们还感谢由 NIH 研究基础设施计划办公室 (P40 OD010440) 资助的 秀丽隐杆线虫 遗传学中心 CGC。此外,我们要感谢 Galli 实验室(Hubrecht 研究所)、Conradt 实验室(伦敦大学学院)和 van den Heuvel 实验室(乌得勒支大学)的成员对所提出的方案的宝贵意见。这项工作得到了瑞士国家科学基金会(AH)编号 31003A-166580、瑞士癌症联盟(AH)编号 4377-02-2018 以及苏黎世联邦理工学院对 AdM 的资助。
材料
| Name | Company | Catalog Number | Comments |
| 3/2 solenoid valve | Distrelec | 154-22-898 and 154-22-899 | Alternative to above. Solenoid valve connecting the pressure regulator to the on-chip valve. |
| Arduino | Distrelec | 301-01-956 | Optional microcontroller depending on the selected controller and interface. |
| Bacto-Tryptone | Thermo Fisher Scientific | 211705 | For L Broth production. |
| Bacto-Yeast | Thermo Fisher Scientific | 212750 | For L Broth production. |
| Blunt needle 23G | Gonano Dosiertechnik | GGA723050 | Blunt needle connecting the 1/16" tubing to a syringe. |
| Blunt needle 30G | Gonano Dosiertechnik | IG-TE730050 | Blunt needle connecting the 1/32" tubing to a syringe. |
| C. elegans Construct 1 | NA | NA | AH5786 LGI: hmr-1(cp21[hmr-1::gfp + LoxP]) Marston, D.J. et al. MRCK-1 drives apical constriction in C. elegans by linking developmental patterning to force generation. Curr. Biol. 26 (16), 2079-2089. 2016. |
| C. elegans Construct 2 | NA | NA | AH1187 LGII: arIs92[egl-17::cfp] Yoo, A.S., Bais, C., Greenwald, I. Crosstalk between the EGFR and LIN-12/Notch pathways in C. elegans vulval development. Science. 303 (5658), 663-666. 2004. |
| C. elegans Construct 3 | NA | NA | AH5786 LGV: qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)] Ziel, J.W., Hagedorn, E.J., Audhya, A., Sherwood, D.R. UNC-6 (netrin) orients the invasive membrane of the anchor cell in C. elegans. Nat. Cell Biol., 11 (2), 183-189. 2009. |
| C. elegans Construct 4 | NA | NA | ML2615 LGX: dlg-1(mc103[dlg-1::gfp]) Vuong-Brender, T.T.K., Suman, S.K., Labouesse, M. The apical ECM preserves embryonic integrity and distributes mechanical stress during morphogenesis. Development. 144 (23), 4336-4349. 2017. |
| Cable | Distrelec | 143-46-644 | Needed if selecting the solenoid from distrelec. Cable connecting the solenoid to the MOSFET. |
| Chlorotrimethyl silane | Sigma Aldrich | 386529-25ML | Silane for wafer passivation. |
| Cholesterol | Sigma Aldrich | C8667 | For S-Basal production. |
| Flyback Diode | Distrelec | 110-52-628 | Flyback diode protecting the microcontroller. |
| Hollow steel pin | Gonano Dosiertechnik | GGA7R23050 | 23G hollow steel pin connecting the 1/16" tubing to the device. |
| L Broth | NA | NA | Prepared in house following standard recipe. 10 g Bacto-tryptone, 5 g Bacto-yeast, 5 g NaCl, H2O to 1 litre, pH to 7.0 using 1 M NaOH |
| Long-term Imaging Device L1 | NA | NA | Long-term imaging device for L1 to early/mid L2 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L1-4 | NA | NA | Long-term imaging device for mid L1 to mid L4 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L2-A | NA | NA | Long-term imaging device for mid L2 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L3-A | NA | NA | Long-term imaging device for mid L3 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L4-A | NA | NA | Long-term imaging device for mid L4 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| M9 Buffer | NA | NA | Prepared in house following standard recipe. |
| MOSFET | Distrelec | 303-41-391 | Metal-oxide-semiconductor field-effect transistor, used to switch the 24VDC required for the solenoid. |
| NGM plates | NA | NA | Prepared in house following standard recipe. |
| Nylon Luer-Fitting | Fisher Scientific | 11776048 | Adapter from OD 6mm tubing to 23G blunt needle. |
| Optiprep | Sigma Aldrich | D1556 | Density matching liquid. |
| PDMS | Ameba | Elastosil RT601A/B | PDMS elastomer kit. |
| Pluronic F-127 | Sigma Aldrich | P2443 | Non-ionic surfactant. |
| Potassium dihydrogen phosphate | Sigma Aldrich | 1.37039 | For S-Basal production. |
| Potassium hydrogen phosphate | Sigma Aldrich | 1.05099 | For S-Basal production. |
| Power Supply 24VDC | Distrelec | 301-63-304 | 24VDC power supply. Select a power supply suitable for the solenoid selected. |
| Precision pressure regulator | Distrelec | 154-23-578 | Alternativ to above. Pressure regulator. |
| Pressure Gauge G1/8 | Distrelec | 154-23-643 | Pressure gauge attaches to the pressure regulator. |
| PU Tubing OD 6mm | Distrelec | 154-23-866 | Tubing connecting the pressure source and regulator, as well as regulator and solenoid valve. |
| Push-in fitting G1/8 to 6mm | Distrelec | 301-69-330 | Alternativ to above. 2x Push-in fitting attaches to the pressure regulator and connects to the 6mm tubing. |
| Push-in fitting M5 to 6 mm | Distrelec | 301-69-459 | 2x Push-in fitting attaches to the solenoid and the 6mm tubing. |
| S-Basal Buffer | NA | NA | Prepared in house following standard recipe. 5.85 g NaCl, 1 g K2HPO4, 6 g KH2PO4, 1 ml cholesterol (5 mg/ml in ethanol), H2O to 1 litre. Sterilize by autoclaving. |
| Sodium Chloride | Sigma Aldrich | S9625 | For L Broth and S-Basal production. |
| Sodium hydroxite (5M) | Sigma Aldrich | 567530 | Sodium hydroxide used when bleaching C. elegans (prepare solution at 5M concentration) |
| Sodium hypochlorite (5%) | Sigma Aldrich | 1.05614 | Sodium hypochlorite used when bleaching C. elegans (prepare solution at 5% concentration) |
| Strainer 10 µm | pluriSelect | 43-10010-40 | Alternative for bacteria food preparation, especially if smaller devices are used. |
| Strainer 5 µm | pluriSelect | 43-10005-40 | Strainer used to filter L1 larvae after overnight starvation and bacteria after completed food preparation. |
| SU-8 | Gersteltec | GM1050 | SU-8 for height from 1-10 µm. |
| SU-8 | Gersteltec | GM1060 | SU-8 for height from 5-30 µm. |
| SU-9 | Gersteltec | GM1070 | SU-8 for height from 15-200 µm. |
| Syringe 1 mL | Fisher Scientific | 11338763 | 1mL syringe. If using a different type ensure that the syringe body and plunger are stiff, such that they won't be deformed by the syringe pump. |
| Syringe Pump | WPI | Al1000-220 | Syringe pump (https://www.wpiinc.com/var-2300-aladdin-single-syringe-pump.html). |
| Tube 15 mL | Fisher Scientific | 50-809-220 | Tube used for worm bleaching and bacteria preparation. |
| Tube 2 mL | Fisher Scientific | NC1186931 | Tube used for worm preparation and bacteria preparation. |
| Tube 50 mL | Fisher Scientific | 50-465-232 | Tube used for bacteria preparation and growth. |
| Tweezer SMD | Brütsch Rüegg Werkzeuge | 448980 | Tweezers used to plug the 1/32" tubing into the device. |
| Tygon tubing 1/16" | Fisher Scientific | 642002 | Flexible 1/16" OD tubing connecting most components to the device. |
| Tygon tubing 1/32" | Fisher Scientific | 641900 | Flexible 1/32" OD tubing connecting the bacteria supply to the device. |
| UV KUB-3 | Kloe | NA | Mask aligner and UV exposure system. |
| Wafer | Siegert Wafer | 4P0/>1/525±25/SSP/TTV<10 | Silicon Wafer. |
| Waste Container | NA | NA | Prepared in house using a 2mL tube or a cryo vial and hollow steel pins. |
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。