Method Article
Imagerie haute résolution de C. elegans à tous les stades larvaires
Dans cet article
Résumé
Ce protocole décrit l’imagerie microfluidique de C. elegans tout au long du développement post-embryonnaire.
Résumé
Caenorhabditis elegans est devenu l’un des modèles animaux les plus étudiés et les mieux compris en biologie. Trois caractéristiques sont essentielles au succès de C. elegans en tant qu’organisme modèle : sa lignée cellulaire invariante, sa transparence et sa traçabilité génétique. Cela le rend idéal pour une gamme variée d’études basées sur la microscopie directement in vivo. Les larves et les adultes vivants de C. elegans doivent souvent être immobilisés pendant l’acquisition de l’image. Les méthodes d’immobilisation traditionnelles nuisent au développement des animaux, en particulier dans les applications d’imagerie en accéléré. Ici, un protocole détaillé de configuration et d’utilisation d’une nouvelle méthode d’imagerie microfluidique est présenté, qui aborde les limites associées à l’immobilisation traditionnelle à base de tampon gélaire et à d’autres stratégies microfluidiques. Cette approche permet une imagerie simultanée en direct à différents stades larvaires tout en préservant l’orientation et l’identité du ver au fil du temps. Pour y parvenir, un réseau de canaux de piégeage microfluidique est utilisé, dont la géométrie est conçue avec précision pour maintenir une orientation stable vers vers tout en s’adaptant à la croissance et à la mue. L’immobilisation est facilitée par une soupape hydraulique active qui applique une pression pour fixer les vis sans fin contre le verre de protection uniquement pendant l’acquisition de l’image. Cette conception permet une imagerie à haute résolution avec des effets minimes sur la viabilité des vers ou le calendrier de développement.
Introduction
L’imagerie de C. elegans peut être réalisée de plusieurs manières en fonction de l’application, du débit souhaité et de la résolution. Lorsqu’une résolution élevée est nécessaire, la méthode standard utilise des tampons gélosés 1,2,3, une construction simple de lame de verre, d’agarose et de verre de couverture. Les animaux sur ces lames sont immobilisés par la pression exercée par une vitre de protection. L’immobilisation peut être encore améliorée par l’ajout d’agents anesthésiants, par exemple le lévamisole ou l’azoture de sodium 1,2, de sorte que les animaux sur des tampons gélosés sont parfaitement immobiles et peuvent être imagés à haute résolution, y compris diverses méthodes de super-résolution2. Malheureusement, les tampons gélosés sont connus pour affecter la progression du développement, la combinaison de pressions appliquées élevées et d’agents anesthésiques retardant le développement ou provoquant un arrêt complet du développement 4,5.
Outre ces méthodes standard, plusieurs méthodologies microfluidiques ont émergé ces dernières années, chacune avec ses avantages et ses inconvénients ou des cas d’utilisation spécialisés 6,7,8,9,10,11,12,13,14,15,16,17,18,19. Par exemple, Gritti et al.20 ont introduit une méthode dans laquelle les vers sont confinés dans de grandes chambres. Les embryons placés dans ces chambres se développent et se déplacent librement tout en restant dans la région d’intérêt désignée au microscope. Bien qu’elle soit généralement efficace, cette approche se limite à l’utilisation de marqueurs fluorescents brillants. Plus récemment, Keil et al.21 ont proposé une version modifiée de cette méthode, incorporant une valve hydraulique sur puce pour retenir les animaux pendant l’acquisition d’images, remédiant ainsi à certaines limites de l’approche originale. Cependant, comme les deux méthodes utilisent des chambres plus grandes que celles utilisées pour les vers piégés, les animaux continuent de bouger et de tourner tout au long de l’expérience. Par conséquent, le suivi des processus de développement devient difficile et nécessite un post-traitement d’image approfondi pour corriger le mouvement des animaux.
Pour remédier à ces limites, l’approche introduite par Berger et al.18 (figure 1), selon laquelle les animaux ne sont pas détenus dans une grande chambre, mais dans un canal de piégeage conçu pour s’adapter aux animaux dans une fenêtre de développement plus courte (jusqu’à 2,5 stades larvaires), est adaptée. Contrairement aux méthodes microfluidiques existantes, cette approche préserve l’orientation et l’identité animales tout au long d’une expérience et permet l’acquisition d’images haute résolution de plusieurs vers en parallèle et à travers plusieurs stades larvaires au sein d’un seul dispositif.
Les animaux sont piégés à l’aide d’une géométrie de canal spécialisée où la hauteur du canal est proche de l’épaisseur d’un animal au début d’une expérience, empêchant ainsi la rotation. Les largeurs et les longueurs des canaux sont sélectionnées de manière à ce que les animaux puissent se déplacer et grandir au fil du temps, facilitant ainsi la mue et la transition d’un stade larvaire à l’autre. La parallélisation est ensuite réalisée simplement en plaçant plusieurs canaux de piégeage les uns à côté des autres, de sorte que plusieurs animaux sont visibles dans un seul champ de vision (FOV, Figure 1A'), et jusqu’à 41 animaux peuvent être imagés dans une seule unité de dispositif (Figure 1A). Les animaux sur la puce reçoivent en permanence une suspension alimentaire bactérienne hautement concentrée via un canal de faible hauteur, ce qui permet en même temps de confiner les animaux à l’extrémité du réseau de canaux de piège (échelon de hauteur, figure 1A, rouge). Semblable à l’approche adoptée par Keil et al.21, une grande vanne hydraulique sur puce est mise en œuvre, qui peut être gonflée pendant l’acquisition de l’image, en pressant les animaux contre le verre de protection, améliorant ainsi l’immobilisation des animaux (Figure 1B). Limiter l’actionnement de la vanne hydraulique à la seule période d’acquisition de l’image minimise tout effet négatif sur le développement de l’animal, garantissant un développement fiable à tous les stades larvaires. Contrairement aux méthodes décrites par Gritti et al.20 et Keil et al.21, les animaux ne peuvent pas être imagés tout au long du développement post-embryonnaire au sein du même dispositif. Au lieu de cela, cinq dispositifs distincts sont introduits, appelés L1, L1-4, L2-A, L3-A et L4-A, couvrant l’ensemble du stade L1 et du stade L2 précoce, du stade L1 mi-tardif jusqu’au stade L4 moyen-tardif, le stade L2 mi-tardif jusqu’au jeune âge adulte, le L3 mi-fin jusqu’au jeune âge adulte et le stade L4 tardif jusqu’au jeune adulte, respectivement (Figure 1C), qui permettent une imagerie ininterrompue de grandes parties du développement post-embryonnaire. Cette approche est adoptée en raison de la forte augmentation de la taille des animaux de L1 à l’âge adulte, de sorte qu’un canal adapté aux animaux L1 serait beaucoup trop petit pour les adultes, entraînant un arrêt du développement, et un canal adapté aux adultes serait beaucoup trop grand pour les L1, ce qui entraînerait un mouvement excessif, une rotation et des animaux s’échappant des canaux de piège.
En utilisant cette approche, une progression fiable du développement d’une variété de tissus est obtenue18, par exemple, le développement post-embryonnaire de l’hypoderme (stade L1 à L4), l’induction du destin des cellules vulvaires (stades L2 et L3), la morphogenèse vulvaire (L3 à l’âge adulte19) et l’invasion des cellules d’ancrage. Depuis leur introduction, ces dispositifs d’imagerie à long terme ont été utilisés pour étudier une variété de processus22,23, la plate-forme étant même combinée à des techniques telles que la microscopie à super-résolution AiryScan24, permettant de nombreuses découvertes auparavant impossibles.
Dans ce qui suit, les aspects opérationnels de ces dispositifs d’imagerie à long terme sont présentés dans un protocole étape par étape, mettant en évidence les résultats attendus et certains défis potentiels lors de la mise en place du système.
Protocole
Les détails des réactifs et de l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Fabrication de l’appareil
REMARQUE : Tous les appareils ont été fabriqués à l’aide du protocole ci-dessous, cependant, les appareils sont directement disponibles auprès des auteurs. Une plaquette distincte est fabriquée pour chaque type de dispositif, chaque plaquette étant fabriquée à partir de deux couches de SU8 de hauteurs différentes (c’est-à-dire une couche alimentaire et une couche piège). La plaquette de valve est fabriquée sur une plaquette séparée, avec une seule hauteur de SU-8, en omettant les étapes 1.3-1.6. Les silanes sont toxiques et libèrent des vapeurs corrosives. Cette étape doit donc être effectuée dans une hotte. Pour plus de détails sur la procédure de fabrication, voir Berger et al.18.
- Nettoyez les plaquettes à l’aide d’un plasma d’air.
- Essorez l’enrobage de la première couche de SU8, puis effectuez une cuisson douce à 95 °C.
- Exposer la première couche, puis post-cuisson à 95 °C et développer.
- Effectuez à nouveau le nettoyage au plasma après le développement et le séchage de la plaquette.
- Essorez la deuxième couche de SU8, puis faites cuire doucement à 95 °C (si nécessaire, effectuez une première cuisson à 65 °C).
- Alignez le deuxième masque sur les entités existantes à l’aide de marqueurs d’alignement de chaque côté de la plaquette, puis exposez la deuxième couche.
- Post-cuisson et développez la gaufrette, puis effectuez une cuisson dure à 200 °C.
- Traitez la plaquette avec du chlorotriméthylsilane pendant au moins 2 h.
- Préparez un lot de 20 g de prépolymère PDMS (partie A) et mélangez-le soigneusement avec 1 g de réticulant (rapport 20:1, partie B) (voir tableau des matériaux).
- Dégazez pendant 10 minutes ou jusqu’à ce que toutes les bulles disparaissent.
- Retirer 2 ml du mélange PDMS et réserver pour l’étape 1.13.
- Ajoutez encore 3 g de réticulant au reste du mélange PDMS et mélangez soigneusement (rapport final d’environ 5:1).
- À l’aide du lot de PDMS 20:1, essorez la plaquette de l’appareil à 750 tr/min pendant 30 s.
- Placez la plaquette de valve dans un plat en aluminium et coulez-y le PDMS 5:1. Dégazez la plaquette de l’appareil pendant environ 10 min. Après le dégazage, retirez les bulles restantes à l’aide d’une pipette.
- Faites cuire les couches de la vanne et de l’appareil à 70 °C pendant environ 15/20 min respectivement.
- Évaluez le durcissement du dispositif et des couches de la valve en les sondant doucement à l’aide d’une pointe de pipette ou d’une pince à épiler. La couche de la valve doit être solide, tandis que la couche de l’appareil doit rester légèrement collante.
- Détachez la couche de valve et coupez-la à la taille requise à l’aide d’un scalpel ou d’une lame de rasoir.
- Percez un trou d’accès dans le canal de la vanne (jauge 20).
- Placez la plaquette de l’appareil sous un stéréomicroscope équipé d’un éclairage supérieur.
- Placez avec précaution la pièce PDMS contenant la couche de valve sur la plaquette de l’appareil.
- Alignez précisément la vanne et les caractéristiques de l’appareil, en assurant l’élimination de tout l’air emprisonné entre les couches.
- Transférez l’appareil assemblé dans un four et faites cuire à 70 °C pendant la nuit.
- Détachez l’appareil de la plaquette.
- Percez tous les trous d’accès restants (calibre 20).
- Collez le PDMS à un verre de protection à l’aide d’un plasma d’air, puis placez le dispositif collé dans un four à 70 °C pendant quelques heures.
2. Préparation des vers
REMARQUE : Cette section décrit la préparation des vers par blanchiment, ce qui permet de générer un grand nombre (des centaines) d’animaux. D’autres méthodes de synchronisation, telles que le prélèvement manuel, sont possibles, mais elles sont généralement plus longues et plus laborieuses. Tous les vers utilisés dans le protocole sont maintenus conformément aux protocoles standard à 20 °C et sur des plaques NGM ensemencées avec E. coli OP50.
- À partir de plaques avec de nombreux animaux gravides.
- Lavez les animaux de la plaque à l’aide d’un tampon M9.
- Ajouter 5 % de NaClO et 5 M de NaOH à la suspension de vis sans fin (200 μL/100 μL pour chaque 1 mL de suspension de vis sans fin).
- Agitez doucement le mélange de blanchiment jusqu’à ce que les animaux commencent à se désagréger (~10 min).
- Mélange de blanchiment centrifuge à température ambiante, 1300 x g pendant 1 min.
- Retirez le surnageant à l’aide d’une pipette et ajoutez une quantité égale de tampon M9 frais.
- Encore une fois, centrifuger à température ambiante, 1300 x g pendant 1 min.
- Retirer le surnageant et transférer les vers granulés dans un tube de 15 mL avec 5 mL de tampon M9 frais.
- Agiter toute la nuit à 20 °C.
- Passez la suspension de vis sans fin dans une crépine à cellules de 10 μm.
- Centrifuger la suspension de vis sans fin à 1300 × g pendant 1 min à température ambiante.
- Jetez le surnageant et remettez les vers en suspension dans un volume égal de tampon M9.
- Centrifugez à nouveau le mélange de vers de terre à 1300 × g pendant 1 min à température ambiante.
- Retirez le surnageant et transférez les vers sur des plaques NGM. Si des larves L1 sont nécessaires, utilisez-les immédiatement.
- Une fois que les vers ont atteint le stade de développement souhaité, lavez-les de la plaque à l’aide d’un tampon S-Basal frais filtré à travers un filtre de 0,2 μm.
- Laisser les vers sédimenter par gravité ou les granuler par centrifugation à 750 × g pendant 1 min à température ambiante.
- Jetez le surnageant et ajoutez un volume égal de tampon S-Basal frais.
- Répéter les étapes de sédimentation ou de centrifugation (étapes 2.16 et 2.17)
- Retirez le surnageant et ajoutez un volume égal de tampon S-Basal frais.
- Effectuez une dernière fois les étapes de sédimentation ou de centrifugation.
- Retirez la majeure partie du surnageant.
- Gardez les vers dans le tube jusqu’au début de l’expérience.
3. Préparation des bactéries
REMARQUE : Différentes souches de bactéries (par exemple, OP50, NA22, HT114, etc.) peuvent être utilisées sur la puce. Ajustez la proportion de milieu à gradient de densité ajoutée au mélange alimentaire pour compenser les différences de densité. Tous les tampons sont passés à travers un filtre de 0,2 μm pour éliminer les particules.
- Préparez 40 mL de LBroth, soit en 2 x 20 mL dans des tubes à centrifuger, des erlenmeyers stériles, etc.
- Inoculer LB avec des bactéries prélevées sur une plaque de stock.
- Cultivez les bactéries en agitant toute la nuit à 37 °C (~16 h) (DO600 = 1,9).
- Centrifuger les bactéries à 3000 x g pendant 10 min.
- Retirer le surnageant et ajouter 2 mL de tampon S-Basal frais dans chaque tube. Combinez tous les tubes.
- Remettre mécaniquement les bactéries en suspension à l’aide d’une pipette.
- Centrifuger les bactéries à 3000 x g pendant 5 min.
- Retirer le surnageant et ajouter à nouveau 2 mL de tampon S-Basal frais.
- Remettre mécaniquement les bactéries en suspension à l’aide d’une pipette.
- Centrifuger les bactéries à 3000 x g pendant 5 min.
- Retirer la plus grande quantité possible de surnageant et ajouter 1 mL de tampon S-Basal frais avant de remettre mécaniquement toutes les bactéries en suspension.
- Combinez 0,60 mL de milieu à gradient de densité, 0,38 mL de S-Basal + 1 % en poids de Pluronic F-127 (un copolymère tribloc non ionique, représenté ici par PF) avec 1 mL de suspension de bactéries OP50, ou 0,65 mL de milieu à gradient de densité, 0,33 mL de S-Basal + 1 % en poids de PF avec 1 mL de suspension de bactéries NA22 ou HT114.
- Mélangez soigneusement la préparation alimentaire à l’aide d’un mélangeur vortex.
- Filtrez les aliments à travers une passoire à cellules de 5 μm ou 10 μm. Une crépine plus petite est particulièrement conseillée lors de l’utilisation d’appareils plus petits, par exemple des appareils L1.
REMARQUE : Les aliments peuvent être conservés à température ambiante jusqu’à 2 jours.
4. Préparation des copeaux
REMARQUE : reportez-vous à la Figure 2 pour une vue d’ensemble schématique de l’appareil, de la tuyauterie et des connexions. Tous les tampons sont passés à travers un filtre de 0,2 μm pour éliminer la poussière. La goupille en acier mentionnée dans les étapes suivantes fait référence à un tube court et creux qui est utilisé pour interfacer le tube de plus grand diamètre extérieur (1/16") aux trous de petit diamètre fabriqués dans le dispositif PDMS. Ces goupilles en acier sont simplement insérées dans le diamètre intérieur du tube, puis poussées dans le matériau PDMS, reliant efficacement les deux.
- Commencez par remplir une seringue avec de l’eau déminéralisée (DI).
- Fixez une aiguille de 23 G et un long morceau de tube de 1/16", avec une goupille creuse en acier (pliée à un angle de 90°) à l’extrémité. Le tube doit être suffisamment long pour s’étendre du solénoïde à la platine du microscope.
- Remplissez le tube avec de l’eau DI de la seringue et connectez-le à l’entrée de la vanne en insérant la goupille en acier dans le trou perforé (Figure 2A,J).
- Retirez la seringue et l’aiguille, puis fixez la tubulure au solénoïde hors puce (Figure 2A,J).
- À l’aide du logiciel d’imagerie, allumez le solénoïde et mettez l’appareil sous pression pendant plusieurs minutes pour expulser tout l’air de la vanne. Vérifiez l’achèvement en vérifiant visuellement l’interface air-eau sur la puce, qui doit apparaître sombre et disparaître dans le matériau PDMS (Figure 2B).
- Mettez le solénoïde hors tension (Figure 2C).
- Remplissez une seringue de 1 mL avec la solution de bactéries filtrées (~0,5 mL de nourriture suffit).
- Fixez une aiguille de 30 g et un long morceau de tube de 1/32" à l’aiguille.
- Appuyez sur le piston pour remplir à la fois l’aiguille et le tube attaché, en vous assurant qu’il ne reste pas d’air dans la seringue ou le tube.
- Insérez le tube 1/32" directement dans l’entrée alimentaire du dispositif microfluidique, à l’aide d’une pince à épiler pour éviter d’endommager le tube (une pince CMS est recommandée) (Figure 2D,K).
- Placez la seringue sur le pousse-seringue (Figure 2D).
- Appuyez sur le piston de la seringue à l’aide de la vis à oreilles à l’arrière pour remplir l’appareil de liquide. Une goutte de liquide doit apparaître à chaque raccord ouvert (Figure 2D, flèche).
- Bloquez l’entrée et la sortie de la vis sans fin à l’aide d’une goupille en acier scellée (une goupille en acier avec un court morceau de tube de 1/16 po fixé et scellé par combustion) (Figure 2E,L).
- Appliquez une pression supplémentaire à l’aide de la vis moletée pour évacuer l’air restant dans l’appareil (Figure 2E, flèche).
- Retirez la goupille bloquée à la sortie et fixez le conteneur à déchets (fabriqué à partir d’un tube cryovial ou de microcentrifugeuse, avec deux goupilles en acier coincées à travers le couvercle et fixées avec de la colle). Le conteneur à déchets est relié à l’aide d’un petit morceau de tube de 1/16 po, avec une extrémité attachée au conteneur et l’autre extrémité reliée à une goupille creuse en acier (pliée à 90°) (Figure 2F, G, M).
- Poussez la seringue pour vous assurer que le conteneur à déchets est correctement connecté et qu’il n’y a pas de blocages dans le système. Pour cela, poussez une petite quantité de liquide dans le système (tournez la vis moletée sur le pousse-seringue) jusqu’à ce que le liquide s’écoule à travers la tubulure de vidange (Figure 2G, flèche).
- Retirez la deuxième goupille en acier bloquée.
- Poussez la seringue jusqu’à ce qu’une petite goutte de liquide apparaisse à l’entrée du ver (Figure 2H,N).
- Fixez un morceau plus long de tube de 1/16 po (15 à 20 cm) à une seringue de 1 mL remplie de tampon S-Basal, à l’aide d’une aiguille de 23 G (Figure 2H,N).
- Fixez une goupille droite en acier 23 G à l’autre extrémité du tube.
- Remplissez l’aiguille et le tube avec le tampon de la seringue, en vous assurant qu’il ne reste pas d’air dans la seringue ou le tube.
- Insérez la goupille en acier à l’extrémité du tube dans le tube contenant les vis sans fin.
- Poussez une petite quantité de liquide à travers le tube, en vous assurant qu’il ne reste pas d’air.
- Tirez les vers dans le tube, mais ne les tirez pas dans la seringue.
- Poussez la seringue reliée aux vers jusqu’à ce qu’une petite goutte de liquide apparaisse sur la goupille en acier (Figure 2H).
- Insérez la goupille en acier dans l’entrée de la vis sans fin (Figure 2I).
REMARQUE : La préparation de l’appareil peut être effectuée avant la préparation finale des vers et laissée sur le microscope jusqu’à ce que les vers soient prêts.
5. Chargement et imagerie des vers
- Placez l’appareil sur un microscope à faible grossissement (5x ou 10x) ou sur un microscope de dissection.
- Identifiez l’unité de l’appareil actuellement utilisée et trouvez l’entrée de la vis sans fin à l’aide de l’éclairage en fond clair.
- Positionnez l’appareil de manière à ce que l’entrée soit visible d’un côté du champ de vision et que l’arrière de l’entrée du canal de piège soit visible de l’autre côté.
- Poussez doucement sur le piston de la seringue à vis sans fin. Le liquide s’écoulera sensiblement de l’entrée à travers le réseau de canaux vers la sortie. La présence de bactéries et la différence d’indice de réfraction due à l’ajout du milieu à gradient de densité rendent l’écoulement du liquide apparent.
- Assurez-vous que les vers apparaissent à partir de l’entrée et s’écoulent vers l’arrière du réseau de canaux.
- Poussez doucement les animaux vers le réseau de canaux. Une fois qu’un animal fait face au canal, poussez-le dans le canal et répétez l’opération pour d’autres animaux.
REMARQUE : Les animaux doivent être orientés avec la tête vers la sortie pour avoir un accès facile à la nourriture. Ils peuvent être orientés en poussant et en tirant sur le piston et en nageant. - Une fois qu’un nombre suffisant d’animaux ont été piégés, placez la seringue, toujours attachée à l’entrée du ver, sur la platine du microscope, où elle restera tout au long de l’expérience. Il peut être nécessaire de détacher brièvement le tube à vis sans fin de la seringue pour libérer toute accumulation de pression, puis de le rattacher soigneusement à l’aiguille émoussée.
- Si le chargement a été effectué sur un microscope de dissection, transférez l’appareil sur le microscope imageur. Le tube peut rester attaché à la puce et la seringue est connectée à la pompe.
- Allumez le pousse-seringue et faites-le fonctionner au débit prédéfini de 1 μL/h pour 0,5 μL, augmentez le débit de 100 μL/h pour 0,5 μL et réduisez-le à 1 μL/h. Ce cycle est automatiquement répété pendant toute la durée de l’expérience. Pour plus d’informations sur la programmation de la pompe, consultez le manuel d’utilisation de l’équipement.
- Placez l’appareil sur la platine du microscope et assurez-vous qu’il est fermement maintenu (des suggestions de mécanismes de montage se trouvent à la figure 3A).
- Si le chargement n’a pas été effectué sur le microscope imageur, identifiez l’unité d’appareil d’intérêt à faible grossissement.
- Passez à l’agrandissement d’image souhaité.
REMARQUE : Les appareils sont compatibles avec tous les types d’objectifs. - Identifiez les animaux et les régions d’intérêt dans le réseau de canaux de piège et configurez les conditions d’imagerie souhaitées.
- Image dans les conditions d’imagerie souhaitées, avec la vanne sur puce, actionnée par le solénoïde 10 s avant l’acquisition de l’image, de sorte que les animaux sont maintenus en place.
REMARQUE : L’actionnement de la valve sur puce allongera et aplatira les animaux, nécessitant éventuellement des ajustements de la région d’intérêt (ROI) d’imagerie.
6. Préparation de la configuration
REMARQUE : Cette section fait référence à la préparation initiale du mécanisme de commande du dispositif et n’a pas besoin d’être répétée avant chaque expérience. Reportez-vous à la Figure 3B,C. Étant donné que de nombreux solénoïdes nécessitent une tension plus élevée, le solénoïde ne sera probablement pas connecté directement au microcontrôleur, mais via un relais ou un MOSFET (voir Figure 3C).
- Identifiez une source d’air sous pression (p. ex., installation murale ou bouteille de gaz).
- Raccordez la source de pression à un régulateur de pression approprié (plage de pression de 0 à 2 bars) à l’aide d’un tube de 6 mm (source murale) ou fixez directement un régulateur approprié à la bouteille de gaz.
- Connectez le régulateur de pression à l’entrée de l’électrovanne (tube de 6 mm, voir Figure 3B).
- Placez le solénoïde aussi près que possible de la platine du microscope (~0,5-1 m de la platine est suggéré, bien que des distances plus longues soient possibles si nécessaire).
- Connectez électroniquement l’électrovanne au contrôleur sélectionné. Différentes options sont disponibles, telles que le contrôle à l’aide d’une carte de microcontrôleur distincte (par exemple, Arduino) ou d’une carte DAq existante.
7. Nettoyage et entreposage
- Une fois l’expérience terminée, retirez l’appareil du microscope.
- Retirez le liquide d’immersion. L’huile d’immersion peut être éliminée à l’aide de solvants organiques (par exemple, acétone, méthanol, etc.).
- Placez l’appareil sur une surface plane et débranchez tous les tubes à l’exception du tube de la vanne. Pour déconnecter en toute sécurité chaque tube, appuyez sur le PDMS à proximité de celui-ci et tirez doucement. Ne soulevez pas et ne pliez pas l’appareil, car cela pourrait briser la vitre de protection.
- Nettoyez la surface du PDMS avec de l’éthanol à 70 %.
- Rangez l’appareil à température ambiante avec le tube de la vanne attaché.
REMARQUE : L’appareil peut être réutilisé jusqu’à ce que toutes les unités aient été utilisées, probablement sans avoir besoin de remplir le tube de la vanne. Cependant, l’eau dans le tube de la vanne s’évaporera sur une période prolongée et devra peut-être éventuellement être remplie.
Résultats
Conception et dimensions de l’appareil
Cinq dispositifs distincts ont été conçus pour s’adapter aux quatre stades larvaires. Ces dispositifs sont désignés comme suit : L1, pour les larves L1 chargées immédiatement après l’éclosion et imagées jusqu’au stade L2 ; L1-L4, capable de retenir les larves du milieu à la fin du stade L1 jusqu’au début ou au milieu de la L4 ; L2-A, adapté aux animaux du milieu du stade L2 jusqu’au jeune âge adulte ; L3-A, pour les animaux du milieu du stade L3 jusqu’au début de l’âge adulte ; et L4-A, qui accueille les animaux de la fin du stade L4 jusqu’au début de l’âge adulte.
Tous les appareils suivent la même disposition essentielle, composée d’une entrée de vers, d’une ou plusieurs entrées d’aliments bactériens (ou 2 en cas d’échange de fluide) et d’une sortie de déchets commune. Entre la partie d’entrée et de sortie, un ensemble de 41 canaux de piège parallèles est placé, les côtés d’entrée et de sortie étant effectivement séparés par le canal d’alimentation de faible hauteur (figures 1A, A). Les dimensions des canaux ont été choisies pour être significativement plus longues et plus larges que les vis sans fin chargées au début d’une expérience, avec une longueur/largeur de 400/15 μm pour les dispositifs L1, 575/22 μm pour les dispositifs L1-L4, 800/27 μm pour les dispositifs L2-A, 900/30 μm pour les dispositifs L3-A et 1000/65 μm pour les dispositifs L4-A (Fichier supplémentaire 1, Fichier supplémentaire 2, Dossier supplémentaire 3, Fichier supplémentaire 4 et Dossier supplémentaire 5).
La longueur du canal a été choisie pour correspondre à la taille que les animaux ont atteinte à la fin de l’expérience, tandis que la largeur a été choisie de manière à ce que les vers au début de l’expérience occupent environ les deux tiers de la largeur du canal. Cette conception laisse suffisamment d’espace pour la croissance et le mouvement pendant la mue tout en empêchant les vers de tourner ou de tourner. Contrairement à la largeur, la hauteur du canal a été fixée près de l’épaisseur des vers au début de l’expérience : 8 μm pour les larves L1 précoces, 12 μm pour les larves L1 moyennes/tardives, 15 μm pour les larves L2 moyennes, 17,5 μm pour les larves L3 moyennes et 22,5 μm pour les larves L4 tardives, correspondant aux larves L1, L1-L4, L2-A, L3-A, et les appareils L4-A, respectivement. La hauteur réduite du canal, combinée à une largeur soigneusement sélectionnée (en maintenant un rapport hauteur/largeur de 0,5-0,6), garantit que les vers restent dans une orientation fixe. Notamment, avec une hauteur de canal suffisamment petite, tous les vers sont positionnés de manière cohérente dans l’orientation latérale souhaitée.
Le canal d’approvisionnement alimentaire a été fabriqué à une hauteur de 3 μm pour L1 et de 5 μm pour tous les autres appareils, garantissant que les bactéries peuvent facilement atteindre les animaux sans que les animaux ne s’échappent des canaux de piégeage. Tous les dispositifs utilisent la même couche d’alimentation (Fichier supplémentaire 6) et la même couche de vanne (Fichier supplémentaire 7). Notez que la couche de valve est fabriquée sur une plaquette distincte à une hauteur de 20 μm et placée uniquement sur la couche de dispositif lors de la fabrication du dispositif PDMS (étape 1.21).
Ces contraintes géométriques spécifiques à chaque stade, essentielles pour empêcher les vers de tourner ou de s’inverser de la tête à la queue, nécessitent l’utilisation de trois types de dispositifs distincts pour s’adapter à tous les stades larvaires. Si les larves L1 étaient placées dans un canal de la taille d’un jeune adulte, elles ne resteraient pas stables et sortiraient rapidement du chenal du piège.
Préparation de C. elegans
Sauf indication contraire, les vers ont été maintenus selon les protocoles standard25 sur des plaques NGM ensemencées avec E. coli OP50 à 20 °C. La section sur la préparation des vers décrit explicitement la préparation d’une population de vers synchronisée utilisée dans une expérience d’imagerie. La synchronisation a été effectuée selon les protocoles standard à l’aide d’eau de Javel à l’hypochloritede sodium 26, modifiée par une étape de filtration supplémentaire pour éliminer les débris et les animaux non éclos après une nuit de famine. L’objectif est d’obtenir de nombreuses larves L1 synchronisées, qui sont ensuite ensemencées sur des plaques NGM ou chargées directement dans le dispositif d’imagerie. D’autres méthodes de synchronisation, telles que le prélèvement manuel ou la ponte contrôlée, sont tout aussi adaptées. Cependant, ils sont plus laborieux pour générer suffisamment d’animaux (200 par condition est recommandé).
Une fois que les vers ont atteint le stade souhaité, ils peuvent être lavés doucement de la plaque NGM à l’aide de S-Basal propre (idéalement filtré à travers un filtre de 0,2 μm). L’objectif est de collecter autant d’animaux que possible sans collecter de bactéries ou de débris dans la plaque. Les animaux sont rassemblés dans un petit tube à centrifuger et lavés 2 à 3 fois avec un tampon S-Basal frais, en éliminant finalement autant de liquide que possible. Les animaux sont ensuite directement prélevés dans le volume concentré. Si la concentration d’animaux est trop faible, le chargement sera plus lent, ce qui nécessitera l’écoulement d’un plus grand volume de liquide dans l’appareil et augmentera le risque de bloquer les canaux de piège avec des débris.
Préparation d’aliments à base de bactéries
La croissance des bactéries est effectuée selon les protocoles standard, la concentration initiale de bactéries (OD600 = 1,9) étant multipliée par environ 40 dans le tampon S-Basal (filtré à travers un filtre de 0,2 μm) et mélangé avec le milieu à gradient de densité et le tampon S-Basal contenant du PF (filtré à travers un filtre de 0,2 μm). Le résultat attendu de cette étape du processus est la préparation d’une suspension bactérienne très dense et la prévention de la sédimentation des bactéries pendant l’expérience d’imagerie. La haute densité est nécessaire pour nourrir les animaux sur puce aux faibles débits utilisés pour la distribution du milieu (1 μL/h). Le but du milieu à gradient de densité est d’empêcher la précipitation des bactéries pendant l’expérience, et le but du PF est d’empêcher les bactéries de coller aux parois du canal. Le milieu à gradient de densité et le PF sont non toxiques et n’affectent pas la viabilité des animaux.
Si un autre type de bactérie est utilisé dans une expérience, la concentration nécessaire du milieu à gradient de densité devra être déterminée. Cela peut être réalisé en mélangeant une suspension bactérienne avec des quantités variables du milieu, suivie d’une centrifugation. Si la concentration du gradient de densité est trop faible, les bactéries sédimenteront ; Si la concentration est trop élevée, les bactéries flotteront. Une fois qu’une concentration appropriée a été trouvée, il est recommandé de valider le résultat en laissant le mélange de bactéries à température ambiante pendant environ 48 h pour indiquer comment l’aliment se comportera tout au long de l’expérience. Après l’expérience, il est également recommandé de vérifier la seringue par laquelle les bactéries sont alimentées et de s’assurer que les bactéries ne sédimentent pas ou ne flottent pas. La différence de volume résultant de l’ajout de différentes quantités d’Optiprep peut être compensée par l’ajout de plus ou moins de S-Basal + 1 % en poids de PF. De même, des milieux ou des composés supplémentaires (par exemple, de l’auxine) peuvent être ajoutés à la suspension, et le volume supplémentaire est soustrait du volume de S-Basal + 1 % en poids de PF.
Préparation de la configuration
Installez le système d’alimentation en pression aussi près que possible du microscope, de manière à ce qu’il puisse être utilisé confortablement. Tous les passages de tubes, en particulier le tube de 1/16 » relié à la puce, doivent rester courts (moins de 0,5 m pour le tube de 1/16 » de diamètre extérieur) (Figure 2 et Figure 3B). Comme indiqué dans la section ci-dessus, le contrôle par ordinateur de la vanne sur puce peut être réalisé de différentes manières. Cela devrait être possible dans n’importe quel logiciel de microscope (testé dans Micro-Manager, Metamorph, NIS et ZenBlue), soit en connectant une carte de microcontrôleur dédiée (par exemple, Arduino), soit en connectant le système à une carte d’acquisition de données (DAq) existante, à l’aide d’une sortie numérique. La sortie de la carte sélectionnée doit ensuite être configurée comme un obturateur, qui s’allume 10 s avant l’acquisition de l’image ou est actionné manuellement lors de la configuration de l’appareil. Comme mentionné précédemment, il n’est pas recommandé de connecter le solénoïde directement au microcontrôleur ; au lieu de cela, en se connectant via un MOSFET ou un commutateur de relais de sorte que le solénoïde et le microcontrôleur restent isolés électroniquement (Figure 3C).
Semblable au tube d’alimentation en pression, veillez à ce que tous les autres passages de tube jusqu’à la puce (1/16 » OD et 1/32 » OD) soient aussi courts que possible. Gardez la vis sans fin et les tubes de vidange (1/16" OD) en dessous de 2,5 cm et 20 cm, respectivement. Le tube d’alimentation en bactéries (1/32" OD) doit être suffisamment long pour se connecter du pousse-seringue à l’appareil une fois placé sur la platine du microscope. Néanmoins, il est fortement recommandé de raccourcir autant que possible et de placer le pousse-seringue près de la platine du microscope, par exemple à côté de la platine, à l’aide d’une étagère ou sur le dessus d’une enceinte d’incubateur. Toute longueur de tube ajoutée au système augmentera la contre-pression ressentie lors du chargement des animaux dans l’appareil et augmentera la pression totale sur les animaux piégés.
Fonctionnement de l’appareil
À ce stade, tous les tubes peuvent être préparés et connectés à l’aiguille émoussée, à la goupille en acier et à la seringue respectives (début de l’étape 4 du protocole). Comme mentionné ci-dessus, gardez la longueur du tube aussi courte que possible (Figure 2J-N). Il est important de veiller à ce qu’il ne reste pas de bulles d’air dans les seringues ou les tubes, car elles interféreront avec le chargement des animaux et pourraient empêcher les animaux de s’échapper du canal du piège pendant l’expérience. Les bulles d’air peuvent être retirées de la seringue de plusieurs manières différentes, par exemple en remplissant la seringue, en la retournant et en la secouant doucement de sorte que les bulles d’air montent vers le haut de la seringue (il n’est pas recommandé de tapoter la seringue, car cela peut entraîner le piégeage de bulles d’air supplémentaires). Alternativement, la seringue peut être remplie en la collant dans le tampon et en déplaçant rapidement le piston de haut en bas pour éliminer rapidement la plupart des bulles.
Une fois que la seringue est remplie et exempte de bulles, l’aiguille et le tube émoussés sont attachés et remplis d’un tampon. Des précautions particulières doivent également être prises lors du remplissage de la seringue, car l’air peut facilement être emprisonné dans la partie en plastique de l’aiguille émoussée. Si de l’air est emprisonné, remplacez l’aiguille. Alternativement, pré-remplir l’aiguille avec du liquide, par exemple à l’aide d’une pipette, peut atténuer le problème.
Une fois tous les composants en place, le tube peut être fixé au dispositif, en commençant par le tube reliant le solénoïde et la vanne sur puce (Figure 2A-C,J). Ce tube est d’abord rempli d’eau déminéralisée et le système est pressurisé pour éliminer tout l’air du canal de la vanne sans issue. Le PDMS est perméable aux gaz ; ainsi, la pression élevée poussera tout l’air du canal dans le PDMS, laissant le canal de la vanne rempli d’eau. Ce processus peut être suivi au microscope, ce qui permet de s’assurer que tout le canal de la vanne est rempli. Après avoir rempli la vanne, l’alimentation en bactéries peut être connectée et l’appareil peut être rempli et pressurisé en bloquant toutes les entrées/sorties ouvertes (Figure 2D, E, K, L). L’air est déplacé et le processus peut être surveillé au microscope. Une fois que tout l’air est déplacé, les bactéries doivent remplir l’appareil uniformément. Les goupilles de blocage sont retirées et le tube de collecte des déchets est connecté (Figure 2F,G,M). À ce stade, une petite quantité de liquide doit s’écouler à travers l’appareil dans le tube de collecte des déchets, en veillant à ce que tous les raccords au tube soient ouverts. Cela peut être confirmé visuellement avant de connecter le tube au tube de collecte. Si aucun liquide ne s’écoule vers le tube de collecte des déchets, il est probablement bloqué. Cela entraînerait une accumulation de pression sur l’expérience, ce qui aurait un effet négatif sur les animaux piégés. Si le tube ou ses connexions sont bloqués, retirez-le et nettoyez toutes les connexions à l’aide d’une aiguille ou rincez-les avec une seringue remplie d’eau.
Enfin, le tube à vis sans fin peut être connecté (Figure 2H,N). Les vers sont ramassés dans le tube de centrifugation simplement en les aspirant dans le tube fixé à la seringue remplie de S-Basal. Les animaux ne doivent être tirés que dans le tube, pas dans la seringue. Le tube peut ensuite être connecté à l’appareil. Avant cela, une petite quantité de liquide est expulsée de l’appareil et du tube à vis sans fin, et les deux gouttelettes sont connectées de telle sorte qu’aucun air n’est poussé dans l’appareil pendant le chargement.
Chargement par vis sans fin
Une fois toutes les connexions effectuées, les animaux peuvent être chargés en poussant et en tirant sur le piston de la seringue à vis sans fin. Les animaux seront évacués de l’entrée vers le réseau de canaux de piégeage ; Cependant, ils nageront naturellement à contre-courant qu’ils subissent. Les animaux doivent donc être réorientés, la tête tournée vers le canal du piège. L’orientation correcte de l’animal est obtenue en poussant et en tirant sur le piston et en donnant aux animaux le temps de tourner dans l’orientation souhaitée. Cela peut presque être réalisé sur la base d’un seul ver, mais nécessitera un peu de pratique. Une fois que les animaux sont correctement orientés, ils peuvent être poussés dans le canal du piège et glisser jusqu’à l’extrémité du canal, où une marche en hauteur les arrête (figures 1A, B). Si les animaux ne peuvent pas entrer dans le canal, ils sont trop gros pour l’appareil sélectionné et doivent être imagés dans un appareil plus grand. Si les animaux peuvent pivoter ou se retourner lorsqu’ils sont placés dans le canal du piège, ils sont trop jeunes et un appareil plus petit doit être utilisé, ou les animaux doivent être laissés grandir pendant quelques heures de plus.
Il est important de noter que les animaux dans des canaux différents ne s’affecteront pas les uns les autres. Par conséquent, les animaux mal chargés n’affecteront pas ceux chargés correctement, cependant, ils n’auront pas un accès suffisant à la nourriture et auront donc une croissance plus lente ou arrêteront leur développement.
Si les animaux sont chargés au bon âge, il doit se produire un mouvement minimal le long de l’axe longitudinal du canal. Cependant, les animaux sont libres de se tortiller (figure 1B) et commencent à se nourrir en quelques minutes. Si les animaux montrent un mouvement significatif le long de l’axe du canal longitudinal, cela est probablement causé par une accumulation de pression dans l’appareil ou par une bulle d’air logée quelque part dans le tube, l’aiguille émoussée ou la seringue. L’accumulation de pression à l’intérieur de l’appareil peut être relâchée en détachant doucement le tube à vis sans fin de l’aiguille émoussée et en le refixant doucement. Si une bulle d’air est restée logée dans le système malgré les étapes et précautions mentionnées ci-dessus, il peut être nécessaire de retirer l’ensemble de la seringue à ver et de la remplacer par une nouvelle sans bulles d’air. Les bulles d’air dans le système fonctionnent comme des ressorts qui sont comprimés pendant le chargement et libérés lentement après le chargement des animaux. Le flux créé par l’expansion des bulles d’air peut entraîner des instabilités du système, poussant les animaux hors des canaux de piégeage.
Acquisition et développement d’images sur puce
Enfin, une fois les animaux chargés, l’acquisition d’images peut commencer. En principe, les appareils sont compatibles avec la plupart des méthodes d’imagerie, le fond clair, l’épifluorescence 18,19,22,23 (Figure 4), le disque rotatif confocal19 et même les modalités de super-résolution (AiryScan24), car toute l’imagerie est réalisée à travers un verre de couverture de 170 μm d’épaisseur. Par conséquent, le dispositif microfluidique montre peu ou pas d’effet sur la qualité d’image réalisable sur la puce. Cependant, des conditions d’imagerie appropriées qui n’affectent pas la viabilité des animaux doivent être sélectionnées, quelle que soit la modalité d’imagerie. Des intensités d’excitation élevées entraîneront facilement un blanchiment des fluorophores et un arrêt du développement en raison de l’énergie et de la chaleur élevées transmises à l’échantillon. Des temps d’exposition courts (~10 ms) et de faibles intensités d’excitation (moins de 10 % d’une source de LED de fluorescence typique) sont recommandés, ce qui permet d’obtenir une image utilisable avec un réglage de contraste min = 0 et max = 1000 (lors de l’utilisation d’une caméra 16 bits) (Figure 4).
La figure 4 présente des données représentatives obtenues à l’aide des dispositifs L1, L1-4 et L2-A. Montrant le développement des cellules épithéliales de C. elegans depuis l’éclosion/la famine nocturne jusqu’au stade larvaire moyen L2 (Figure 4A, vidéo supplémentaire 1), l’induction des cellules précurseurs de la vulve 1° et leurs divisions ultérieures de la fin de la phase L1 au stade larvaire L4 précoce (Figure 4B, vidéo supplémentaire 2) et enfin la formation de la vulve de C. elegans à partir du stade larvaire L3 précoce jusqu’à l’éversion lors de la transition vers l’âge adulte (Figure 4C, film supplémentaire 3).
Chaque application est accompagnée d’une quantification de différentes mesures de calendrier de développement. Les images des figures 4A et B sont affichées sans post-traitement appliqué, c’est-à-dire qu’aucune déconvolution ou recalage d’image n’a été appliqué. Les images de la figure 4C, en revanche, ont été déconvoluées27 et enregistrées, mettant en évidence les améliorations de la qualité d’image possibles lors de l’utilisation de dispositifs d’imagerie à long terme.
Tout d’abord, l’identification du début de la division cellulaire de chaque couture chez les animaux illustrés à la figure 4A (voir la vidéo supplémentaire 1 pour une évolution à temps plein), indiquant la division cohérente et opportune de toutes les cellules chez 12 animaux (figure 4D). À l’aide des cellules de la couture, le moment général du développement aux quatre stades larvaires a également été évalué, et on a constaté que toutes les divisions cellulaires de la couture étaient terminées après 12,0 h ± 1,7 h (moyenne ± écart-type) chez les animaux L1 (n = 22), 10,2 h ± 1,0 h dans L2 (n = 27), 10,9 h ± 1,4 h chez L3 (n = 27) et 14,6 h ± 2,2 h chez les animaux L4 (n = 19). Ces données sont cohérentes avec les valeurspubliées 2,28 ainsi qu’avec les valeurs mesurées chez les animaux élevés sur plaque, ont donné des temps de développement médians pour L1 15 h (n = 21), L2 10 h (n = 15), L3 12 h (n = 21) et L4 12,5 h (n = 61) (Adapté de Berger et al.18). Les légers retards observés sont probablement la conséquence de l’acquisition d’images et de la phototoxicité qui en résulte ou de l’augmentation du confinement une fois que les animaux ont grandi et qu’ils ont un canal de piégeage.
Deuxièmement, nous avons suivi la croissance animale à travers les stades L2 et L3, en quantifiant la longueur des gonades comme un excellent indicateur de la progression du développement (Figure 4E, voir la vidéo supplémentaire 2 pour un cours à temps plein). Comme pour la division cellulaire des coutures, la longueur précise des gonades a pu être mesurée grâce à l’orientation droite des animaux, et une croissance cohérente des gonades chez tous les animaux imagés a été trouvée (n = 19). La première division VPC dans ces expériences a été observée 14,26 h ± 2,47 h après le début de l’expérience (~30 h après l’ensemencement), la seconde se produisant 1,46 h ± 0,13 h plus tard (n = 19). Ces données sont en bon accord avec les valeurs publiées sur les planchesNGM 29,30. Euling et Ambros30 ont constaté que la première division se produisait après environ 29 heures et la seconde environ 3 heures plus tard.
Enfin, le temps pendant lequel des stades spécifiques du développement vulvaire sont atteints a été quantifié (Figure 4F, voir le film supplémentaire 3 pour le cours à temps plein), en évaluant spécifiquement le temps nécessaire pour passer de l’invagination (L4.0, t1) au stade moyen L4 (L4.5, t4) selon les sous-stades définis par Mok et al.31. Le temps moyen de progression entre t1-t2 était de 3,8 h ± 1,2 h, entre t2-t3 était de 3,5 h ± 1,2 h, et entre t3-t4 était de 2,8 h ± 1,6 h (n = 7), indiquant une progression développementale approximativement linéaire. À l’instar de l’essai sur le moment du développement, ces temps, en particulier t1-t2, semblent légèrement retardés par rapport aux valeurs publiées dans la littérature (t1-t2 : 0,7 h, t2-t3 : 3 h, t3-t4 : 2,3 h31), peut-être en raison des dimensions étroites du dispositif qui ralentissent la mue. Néanmoins, le calendrier de développement reste très constant chez les animaux, et tous progressent avec succès jusqu’à l’âge adulte.
Compensation du mouvement de l’animal et de la dérive du microscope
Le mouvement de l’animal dans une seule pile Z est généralement minime lorsque la valve sur puce est actionnée. Cependant, on ne s’attend pas à ce que les animaux restent complètement immobiles. La gigue résiduelle observée dans une seule pile peut être compensée en augmentant la pression pour actionner la vanne sur puce, en diminuant le temps d’exposition utilisé ou en augmentant le pas Z sélectionné pour accélérer l’acquisition de la pile. Le temps d’acquisition de la pile peut être encore réduit en utilisant un lecteur Z piézoélectrique, ce qui permet d’accélérer considérablement le mouvement Z par rapport à un moteur de mise au point de microscope conventionnel, ou en utilisant des filtres multibandes (par exemple, GFP/mCherry) de sorte que des couleurs distinctes peuvent être acquises sans avoir à changer de filtre fastidieux. À titre de référence, dans les exemples fournis (Figure 4 et Vidéo supplémentaire 1, Vidéo supplémentaire 2 et Vidéo supplémentaire 3), le temps d’acquisition de la pile était généralement compris entre 3 et 8 secondes. Le mouvement résiduel peut également être supprimé par diverses méthodes de recalage d’images si nécessaire.
On s’attend à ce que le nombre d’animaux sur puce augmente régulièrement. Ainsi, les caractéristiques d’intérêt se déplaceront inévitablement le long de l’axe du canal longitudinal (Figure 4A, B, Vidéo supplémentaire 1 et Vidéo supplémentaire 2). Par conséquent, il est recommandé de régler le champ de vision d’imagerie de manière à ce que la caractéristique d’intérêt puisse se développer dans le champ de vision et ne soit pas perdue au cours d’une expérience (Figure 1B et Figure 4A,B). Alternativement, les animaux peuvent être imagés dans plusieurs champs de vision adjacents, couvrant l’ensemble du corps de l’animal. Cependant, cela peut entraîner une phototoxicité et un stress supplémentaires. Comme pour le mouvement Z, diverses procédures d’enregistrement peuvent compenser le mouvement de l’animal dans le canal au fil du temps. Si les animaux présentent un mouvement erratique le long de l’axe longitudinal, plus étendu que ce qui peut être attribué à la croissance, cela est probablement causé par une bulle d’air.
Chaque appareil d’imagerie à long terme contient six unités d’imagerie individuelles, chacune pouvant être utilisée pour une expérience distincte. Chaque unité peut abriter jusqu’à 41 animaux, et les canaux de piégeage sont espacés de sorte que plusieurs animaux peuvent être imagés dans un seul FOV. De plus, plusieurs champs de vision peuvent être imagés au sein d’une seule unité ou d’un seul appareil. Comme pour tous les échantillons de microscope, le mouvement sur la surface de l’échantillon peut introduire une dérive de la mise au point en raison de la perte de support d’immersion. Cette dérive peut être compensée par l’utilisation d’une huile d’immersion à faible viscosité ou par diverses modalités de mise au point automatique. Cependant, certains systèmes de mise au point automatique matériels peuvent ne pas fonctionner lorsqu’ils sont utilisés avec un dispositif microfluidique PDMS, car ils utilisent la transition du verre à un milieu aqueux comme point de référence (côté échantillon du verre de couverture). Une grande partie du FOV est remplie de silicone à l’intérieur de l’appareil, qui a un indice de réfraction plus élevé que l’eau ; Bien que cela n’affecte pas la qualité de l’image, cela peut affecter négativement l’autofocus. Lors de l’imagerie d’un seul FOV, la dérive de mise au point observée à l’intérieur de l’appareil est minime (moins de 2 μm). Si une dérive excessive de la mise au point est observée, cela peut résulter de l’instabilité thermique du système ou de l’environnement du microscope, d’un mouvement XY excessif acquérant plusieurs champs de vision ou d’un mauvais montage de l’appareil sur le microscope (voir la figure 3A pour les mécanismes de montage suggérés).
De même, un mouvement XY excessif et un montage incorrect peuvent également entraîner une dérive XY. Étant donné que l’appareil et l’objectif du microscope sont reliés par le liquide d’immersion, des mouvements rapides en X, Y ou Z peuvent entraîner l’application de forces à l’appareil. Si les appareils sont correctement montés et qu’aucune force externe n’agit sur eux, ils sont exceptionnellement stables avec une dérive de mise au point minimale et aucune dérive XY.
Enfin, si des paramètres spécifiques du système ne sont pas appropriés, les dispositifs microfluidiques PDMS peuvent nuire au développement des animaux. La viabilité est affectée par une pression de soupape excessive, une phototoxicité élevée résultant d’intensités d’excitation élevées, de longs temps d’exposition ou de courts intervalles de temps entre les acquisitions de cheminée. En particulier lors de la première utilisation de ce système, il est fortement recommandé d’évaluer la viabilité des animaux à l’aide d’un marqueur fluorescent brillant ou d’une imagerie en fond clair, en veillant à ce que les conditions d’imagerie n’affectent pas la croissance de l’animal. Une fois que les animaux se développent de manière fiable, les paramètres d’imagerie peuvent être modifiés au besoin.
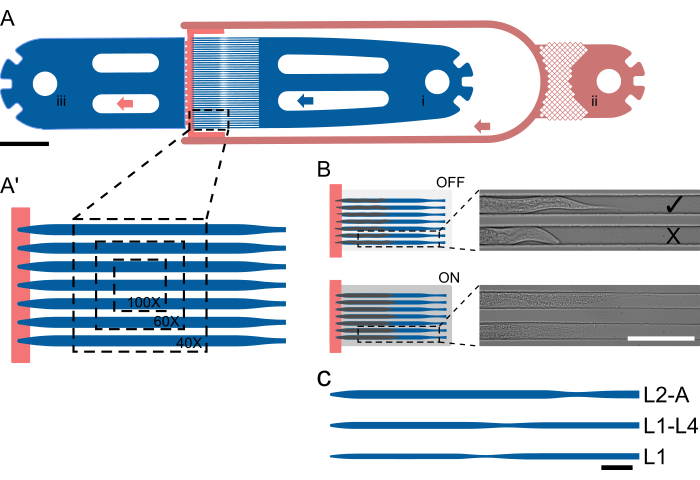
Figure 1 : Disposition de l’appareil et fonctionnement schématique. (A) Vue d’ensemble de l’appareil montrant une seule unité avec l’entrée de la vis sans fin (i), l’entrée d’aliments bactériens (ii) et la sortie générale (iii). (A') Vue agrandie du canal de piège dans un dispositif L2-A, mettant en évidence le nombre de vers visibles dans un seul champ de vision à différents grossissements (40x-100x). (B) Principe de fonctionnement de la vanne sur puce. Lorsqu’il est désactivé, la hauteur du canal est sélectionnée afin que les animaux puissent s’adapter confortablement dans le canal du piège. Lorsqu’il est allumé, la hauteur du canal diminue, ce qui presse l’animal sur le couvre-cœur, immobilisant ainsi de manière réversible les animaux piégés. Les images montrent deux animaux piégés sur la puce avec acquis avec la valve sur puce désactivée et avec la vanne activée, les animaux se redressant et s’allongeant visiblement sous la pression. L’animal supérieur chargé correctement et tourné vers la source de nourriture ( ), et l’animal inférieur tourné vers l’extérieur (X). (C-C") Configuration schématique de l’appareil. (C) Tailles d’appareils disponibles. L1 convient aux animaux du stade L1 au milieu du stade L2, L1-4 pour les animaux du stade larvaire du milieu de la L2 au stade larvaire du milieu de la L2 au milieu de la L4, et L2-A pour les animaux du stade larvaire du milieu de la L2 à l’âge adulte. Les barres d’échelle sont (A) 1000 μm, (B) 100 μm et (C) 50 μm. La figure est partiellement adaptée de Berger et al.18. Veuillez cliquer ici pour voir une version agrandie de cette figure.
), et l’animal inférieur tourné vers l’extérieur (X). (C-C") Configuration schématique de l’appareil. (C) Tailles d’appareils disponibles. L1 convient aux animaux du stade L1 au milieu du stade L2, L1-4 pour les animaux du stade larvaire du milieu de la L2 au stade larvaire du milieu de la L2 au milieu de la L4, et L2-A pour les animaux du stade larvaire du milieu de la L2 à l’âge adulte. Les barres d’échelle sont (A) 1000 μm, (B) 100 μm et (C) 50 μm. La figure est partiellement adaptée de Berger et al.18. Veuillez cliquer ici pour voir une version agrandie de cette figure.
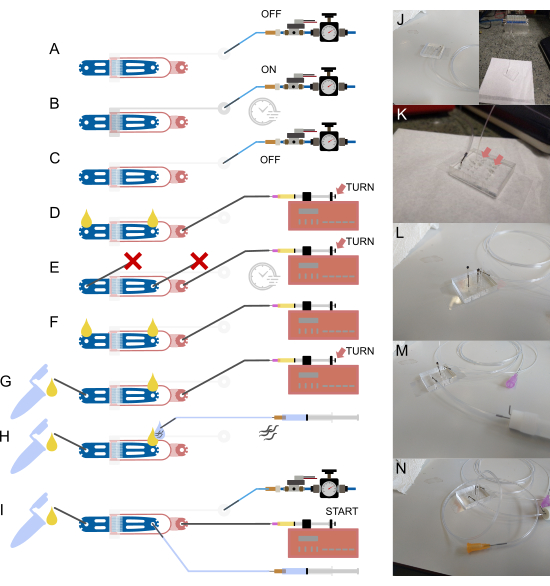
Figure 2 : configuration et connexions de l’appareil. (A-I) Vue d’ensemble schématique du processus de configuration. (A) Raccordement d’un tube rempli d’eau de 1/16" à l’entrée de la vanne à l’aide d’une goupille creuse en acier (grise), l’autre extrémité étant fixée au système d’alimentation sous pression. (B) Remplissage de la vanne hydraulique sur puce via le solénoïde hors puce et pressurisation de l’appareil pendant quelques minutes. (C) Désactivation de la pression avant de passer aux étapes suivantes. (D) Raccordement d’une seringue contenant des aliments bactériens à l’entrée des aliments à l’aide d’un tube de 1/32" et d’une aiguille émoussée de 30 G, suivi d’un remplissage du dispositif jusqu’à ce que du liquide apparaisse aux deux raccords ouverts. (E) Scellement de l’entrée de la vis sans fin et de la sortie des déchets à l’aide de goupilles en acier bloquées par un morceau de tube de 1/16" ( ) et pressurisation de l’appareil à l’aide de la seringue alimentaire et de la pompe (via le réglage par vis moletée), en maintenant la pression pendant quelques minutes. (F) Retrait des bouchons de (E), en s’assurant que des gouttelettes de liquide se forment à chaque connexion ouverte. (G) Raccordement du conteneur à déchets à l’aide d’un petit morceau de tube de 1/16" et d’une goupille creuse en acier. (H) Fixation d’une seringue remplie de tampon au dispositif à l’aide d’une goupille creuse en acier et d’une aiguille émoussée de 23 G. Des vis sans fin sont aspirées dans le tube avant de le connecter à l’appareil, ce qui permet de s’assurer qu’aucun air n’est introduit en alignant les gouttelettes de liquide à l’entrée et à l’extrémité du tube. (I) Configuration finale avec toutes les connexions de l’appareil établies. (J) Image du dispositif avec le tube de soupape connecté à l’entrée et le solénoïde (arrière-plan), correspondant à (A-C). (K) Vue agrandie de l’appareil avec la tubulure d’alimentation attachée, montrant deux gouttelettes de liquide (flèches) sur l’entrée de la vis sans fin et la sortie des déchets, correspondant à (D). (L) Vue agrandie de l’appareil avec la tubulure d’alimentation attachée et l’entrée de la vis sans fin et la sortie des déchets bloquées, correspondant à (E). (M) Vue agrandie de l’appareil avec le tube de déchets et le récipient fixés, correspondant à (G). (N) Assemblage final avec tous les raccords de tubes en place, correspondant à (I). Partiellement adapté de Berger et al.18. Veuillez cliquer ici pour voir une version agrandie de cette figure.
) et pressurisation de l’appareil à l’aide de la seringue alimentaire et de la pompe (via le réglage par vis moletée), en maintenant la pression pendant quelques minutes. (F) Retrait des bouchons de (E), en s’assurant que des gouttelettes de liquide se forment à chaque connexion ouverte. (G) Raccordement du conteneur à déchets à l’aide d’un petit morceau de tube de 1/16" et d’une goupille creuse en acier. (H) Fixation d’une seringue remplie de tampon au dispositif à l’aide d’une goupille creuse en acier et d’une aiguille émoussée de 23 G. Des vis sans fin sont aspirées dans le tube avant de le connecter à l’appareil, ce qui permet de s’assurer qu’aucun air n’est introduit en alignant les gouttelettes de liquide à l’entrée et à l’extrémité du tube. (I) Configuration finale avec toutes les connexions de l’appareil établies. (J) Image du dispositif avec le tube de soupape connecté à l’entrée et le solénoïde (arrière-plan), correspondant à (A-C). (K) Vue agrandie de l’appareil avec la tubulure d’alimentation attachée, montrant deux gouttelettes de liquide (flèches) sur l’entrée de la vis sans fin et la sortie des déchets, correspondant à (D). (L) Vue agrandie de l’appareil avec la tubulure d’alimentation attachée et l’entrée de la vis sans fin et la sortie des déchets bloquées, correspondant à (E). (M) Vue agrandie de l’appareil avec le tube de déchets et le récipient fixés, correspondant à (G). (N) Assemblage final avec tous les raccords de tubes en place, correspondant à (I). Partiellement adapté de Berger et al.18. Veuillez cliquer ici pour voir une version agrandie de cette figure.
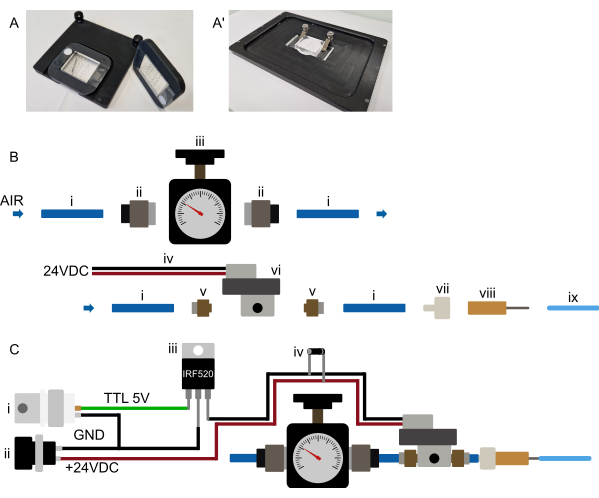
Figure 3 : configuration matérielle (A-A') Suggestion de montage de l’appareil. (A) Monture possible pour un microscope droit. Les appareils sont fixés à un cadre rectangulaire imprimé en 3D avec une grande découpe centrale. Deux petites bandes de ruban adhésif double face sont d’abord placées sur la vitre de protection, de chaque côté de la partie PDMS de l’appareil. Le cadre imprimé en 3D est ensuite placé sur l’appareil, de sorte que la partie PDMS passe à travers la découpe et que le cadre soit fermement pressé sur le ruban adhésif double face, fixant de manière permanente l’appareil au cadre. Le cadre maintient donc l’appareil de manière sûre et est lui-même maintenu sur la platine du microscope à l’aide d’aimants intégrés dans le cadre et l’insert de platine. Cela garantit un montage stable de l’appareil et empêche la collision de l’objectif du microscope avec tout matériel de montage. Tous les tubes sont acheminés vers l’avant de l’appareil. (A') Montage possible pour un microscope inversé. Un ensemble de pinces maintient fermement l’appareil. Assurez-vous que les pinces appuient l’appareil sur l’insert de platine pour éviter tout mouvement XY pendant le fonctionnement. (B) Vue des pièces du système de pression. (i) Tube en polyuréthane de 6 mm de diamètre extérieur relié à une source de pression. (ii) Adaptateur enfichable G1/8 à 6 mm reliant le tube (i) au régulateur de pression (iii). Le tube est ensuite connecté à un solénoïde (vi) par l’intermédiaire d’un adaptateur enfichable de M5 à 6 mm (v), et enfin, le tube est connecté à un connecteur luer-lock-à-barbe (vii) et à une aiguille émoussée de 23 G (viii) au tube de 1/16" de diamètre extérieur connecté au dispositif microfluidique. (C) Vue d’ensemble schématique des connexions électroniques et du système de pression assemblé. (i) Le déclencheur TTL (+3,3-5 V) généré par un Arduino, une carte DAq ou tout autre microcontrôleur, ainsi qu’une alimentation appropriée (ii, 24 VDC) sont connectés à un MOSFET (iii) et aux connexions électroniques du solénoïde comme indiqué sur le schéma, avec une diode flyback (iv) connectée à travers les connexions d’alimentation des solénoïdes. Une fois qu’un signal TTL est envoyé du microcontrôleur à la porte du MOSFET, +24 VDC est appliqué au solénoïde normalement fermé et la vanne hydraulique sur puce est gonflée. Une fois le signal TTL supprimé, la pression est relâchée et la vanne hydraulique sur puce dégonflée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
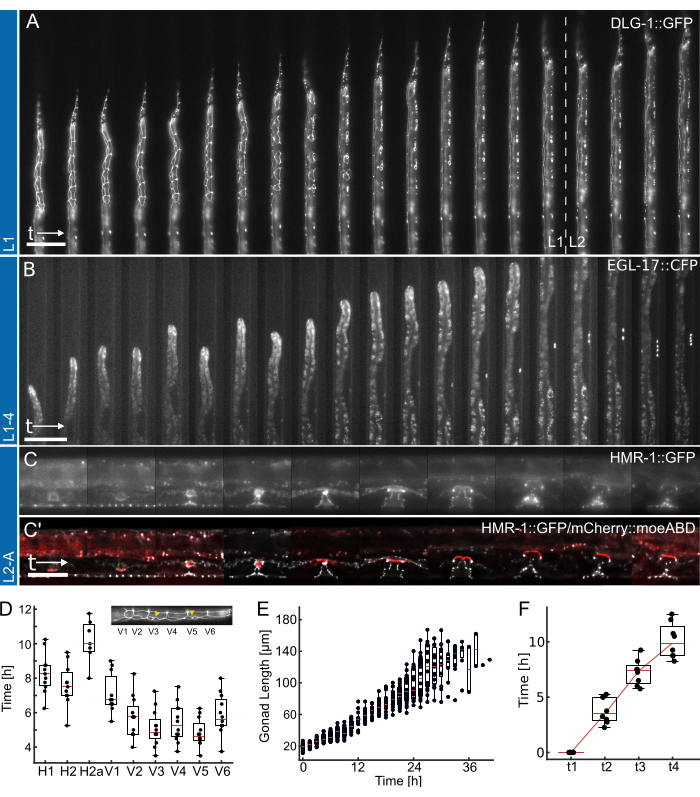
Figure 4 : Résultats représentatifs. (A) Animal montrant un fabricant de jonctions épithéliales (ML2615, dlg-1(mc103[dlg-1 ::gfp])) passant d’une famine nocturne à un stade larvaire précoce/moyen de L2, à l’aide du dispositif L1. Les cellules de la couture en division, ainsi que les cellules P, qui migrent et se divisent vers la fin du stade larvaire L1, sont visibles. (B) Croissance d’un animal à partir du stade larvaire L1 tardif jusqu’au stade L4 précoce, à l’aide du dispositif L1-4. Visible est un marqueur pour la cellule précurseur de la vulve (VPC) 1°-fatale (AH1187, arIs92[egl-17 ::cfp]), avec une seule cellule visible au début de l’expérience, suivie de deux cycles de divisions cellulaires visibles au stade larvaire L3. (C) Animaux en croissance à partir du stade larvaire L2 tardif jusqu’au début de l’âge adulte, à l’aide du dispositif L2-A. On peut voir un fabricant de jonctions épithéliales (AH5786, hmr-1(cp21[hmr-1 ::gfp + LoxP])), mettant en évidence le tissu vulvaire en développement formant des structures toroïdales distinctes, et une image combinée avec un marqueur pour la cellule d’ancrage utérine (AC) (AH5786, qyIs50[Pcdh-3>mCherry ::moeABD, unc-119(+)]) qui envahit le tissu vulvaire vers la fin du stade larvaire L3, reliant les tissus. Pour toutes les expériences (A-C), le FOV est initialement configuré de manière à ce que seule une partie des animaux soit visible. Au fur et à mesure que l’expérience progresse, l’animal remplira une plus grande partie du canal, les caractéristiques se déplaçant le long de l’axe du canal en raison de la croissance de l’animal. (D) Moment où les divisions cellulaires individuelles des coutures commencent à se diviser au stade larvaire L1 (n = 12). L’insert met en évidence les identités cellulaires des coutures (H1-V6) le long de l’axe antéro-postérieur du corps. (E) Montre la croissance des gonades avec le temps pour les animaux de la figure 4B (n = 19). (F) Montre le temps nécessaire pour atteindre 4 points distincts du développement dans la morphogenèse vulvaire (t1-t4), indiquant une transition cohérente pour tous les animaux imagés (n = 7). Les barres d’échelle sont (A,B) 50 μm et (C) 25 μm. Voir Film supplémentaire 1, Film supplémentaire 2 et Film supplémentaire 3 pour le cours à temps plein. Les boîtes à moustaches montrent les valeurs médianes (lignes rouges) avec les quartiles supérieur et inférieur et les barres indiquant les extrêmes de la distribution, à l’exclusion des valeurs aberrantes. La figure est adaptée de Berger et al.18. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Film supplémentaire 1 : Une seule larve de C. elegans se développe de la famine pendant la nuit jusqu’au stade L2 précoce. Des images d’épifluorescence projetées d’intensité maximale sont affichées (la hauteur totale de la projection est de 1,5 m), dans un format non traité. Tous les événements de division et de fusion des cellules de couture qui se produisent à l’étape spécifiée (en haut) sont visibles. Les caractéristiques sont décrites à l’aide du marqueur DLG-1 ::GFP (jonction épithéliale) à des intervalles de 15 minutes pour un total de 25 h. Le film est réutilisé à partir de Berger et al.18. Veuillez cliquer ici pour télécharger ce film.
Film supplémentaire 2 : Larve unique se développant de la fin du stade L1 jusqu’au début du stade L4, exprimant un marqueur EGL-17 ::CFP (cellule précurseur vulvaire (VPC))). Au début de L2 (~400 min), la fluorescence EGL-17 ::CFP se manifeste en P6.p, augmentant continuellement en intensité. Au cours de la L3, P6.p subit deux cycles consécutifs de division, formant les stades de développement de la vulve à 1 cellule, 2 cellules et 4 cellules. Les images sont affichées à des intervalles de 30 minutes pour un total de 34 h. Le film est réutilisé à partir de Berger et al.18. Veuillez cliquer ici pour télécharger ce film.
Vidéo supplémentaire 3 : Vue de dessus : Projection Z de la vulve en développement du stade L3 jusqu’à la transition L4/adulte. Vue de dessous : Projection X de la même vulve dans le temps. Les deux vues montrent la division initiale des VPC, suivie d’une invagination, de la formation et de l’élargissement des tores, suivie d’un effondrement lors de l’éversion. Les images d’épifluorescence sont affichées après le recadrage, la déconvolution, l’enregistrement et la projection. Les caractéristiques sont décrites par le marqueur HMR-1 ::GFP (hypoderme et VPC) et le marqueur mCherry ::moeABD (décrivant l’AC). Le film est réutilisé à partir de Berger et al.18. Veuillez cliquer ici pour télécharger ce film.
Fichier supplémentaire 1 : Fichier CAO pour l’appareil L1. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 2 : Fichier CAO pour l’appareil L1-4. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 3 : Fichier CAO pour l’appareil L2-A. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 4 : Fichier CAO pour l’appareil L3-A. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 5 : Fichier CAO pour l’appareil L4-A. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 6 : Fichier CAO pour la structure de distribution alimentaire. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 7 : Fichier CAO pour la couche de soupape. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Cet article a décrit le fonctionnement d’une plateforme unique d’imagerie microfluidique à long terme, qui convient à l’imagerie à haute résolution et au suivi de divers processus de développement chez C. elegans au cours des quatre stades larvaires jusqu’au début de l’âge adulte18. La capacité de suivre les processus de développement au fil du temps in vivo, en utilisant cette méthode d’imagerie et d’autres, est devenue indispensable dans de nombreux domaines de la recherche sur C. elegans et a permis de répondre à des questions jusqu’alors inaccessibles 23,24,29.
Contrairement aux méthodes d’imagerie traditionnelles utilisant des tampons gélosés et des stratégies d’imagerie à long terme basées sur la microfluidique précédemment publiées, cette approche préserve l’identité et l’orientation du ver tout au long de l’expérience, permettant de suivre des processus de développement complexes au fil du temps. Quel que soit le stade de développement, les animaux sont confinés à l’un des 41 canaux de piégeage parallèles, chacun relié à une alimentation sur puce et recouvert d’une grande vanne hydraulique. L’immobilisation de tous les vers piégés se produit par le gonflage de la vanne hydraulique, en appuyant les vers sur le verre de protection uniquement pendant l’acquisition de l’image. L’imagerie à haut débit est possible grâce au réseau de canaux de piège étroitement espacés, avec plusieurs animaux visibles dans un seul champ de vision. Les appareils d’imagerie à long terme sont compatibles avec la plupart des configurations de microscope, nécessitant un minimum de matériel supplémentaire (moins de 1000 $) et aucune modification du matériel existant. Le fonctionnement des appareils est intentionnellement simple, de sorte que tous les utilisateurs devraient être rapidement en mesure de l’apprendre en suivant le protocole ci-dessus et les résultats décrits.
En bref, les animaux peuvent être imagés sur puce sur un maximum de 2,5 stades larvaires (figure 1C). Les animaux sont d’abord synchronisés et soit directement chargés sur la puce (dispositif L1), soit ensemencés sur la plaque NGM jusqu’au stade de développement souhaité (dispositifs L1-L4 et L2-A). Les animaux sur puce sont nourris à l’aide d’une suspension bactérienne hautement concentrée et immobilisés à l’aide d’une vanne hydraulique sur puce actionnée par le logiciel d’imagerie (Figure 1B). Les animaux sont manœuvrés dans les canaux de piège à l’aide d’une seringue, en orientant soigneusement les animaux avec la tête vers l’approvisionnement en nourriture et enfin en piégeant les animaux à l’extrémité du canal de piège (figure 1A et figure 2). Des précautions doivent être prises pour qu’aucun air ne soit emprisonné dans les seringues, les aiguilles émoussées et les tubes, car les bulles d’air perturberont facilement la position de l’animal. Les dispositifs sont compatibles avec la plupart des modalités d’imagerie18,19,24, car le matériau PDMS est très transparent, non fluorescent et scellé contre un verre de protection mince (Figure 4, Vidéo supplémentaire 1, Vidéo supplémentaire 2 et Vidéo supplémentaire 3). Cependant, il faut faire attention lors du choix des conditions d’imagerie, car de longs temps d’exposition et des intensités d’excitation élevées affecteront facilement la viabilité des animaux et entraîneront un photoblanchiment.
En plus de la version présentée de cette méthode d’imagerie, plusieurs modifications du protocole sont possibles et déjà disponibles. La modification la plus simple consiste à remplacer les souches bactériennes standard, par exemple par des bactéries exprimant l’ARNi18 ou des bactéries ayant des valeurs nutritionnelles différentes32. Les souches bactériennes peuvent être facilement échangées en ajustant la teneur en Optiprep pour tenir compte des différences de densité. De même, n’importe quel nombre de composés peut être ajouté à la nourriture bactérienne, par exemple de l’auxine, des nutriments ou des composés médicamenteux à petites molécules, et leur effet est observé directement in vivo, sans qu’il soit nécessaire de modifier le protocole. En particulier, un dispositif d’échange de média a été développé pour la dégradation des protéines induite par l’auxine ou toute application nécessitant une exposition chronométrée ou réversible en ajoutant une entrée alimentaire à la disposition du dispositif sans modifier la géométrie ou le fonctionnement. L’entrée supplémentaire permet de basculer facilement entre deux conditions différentes, par exemple, l’auxine et l’absence d’auxine, attachées à l’appareil de la même manière que celle illustrée ici pour une seule source de nourriture, et les changements qui en résultent sont observés directement. Des variantes de dispositif ont également été développées où la vanne hydraulique n’est pas partagée entre toutes les unités d’un appareil, mais séparée pour chaque unité, de sorte que plusieurs conditions peuvent être imagées dans le même appareil et expérimentées individuellement, réduisant ainsi les effets potentiellement néfastes des longs temps d’actionnement et d’acquisition de la vanne. Enfin, au-delà des variantes originales du dispositif décrites dans Berger et al.18, deux nouvelles variantes de dispositif ont été développées, L3-A et L4-A (présentées ici), permettant l’imagerie du stade milieu L3 ou milieu L4 jusqu’à l’âge adulte. Le but de ces modifications est de retarder l’heure de début d’une expérience à un stade larvaire ultérieur, de sorte que des animaux plus grands puissent être chargés dans des applications où les premiers stades de développement ne sont pas intéressants.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent ou financier.
Remerciements
Nous tenons à remercier les membres du laboratoire Hajnal pour la discussion critique et les commentaires sur le manuscrit. Nous sommes également reconnaissants envers le Centre de génétique de C. elegans CGC, financé par le Bureau des programmes d’infrastructure de recherche des NIH (P40 OD010440). De plus, nous tenons à remercier les membres du laboratoire Galli (Institut Hubrecht), du laboratoire Conradt (University College London) et du laboratoire van den Heuvel (Université d’Utrecht) pour leur précieuse contribution au protocole présenté. Ces travaux ont été soutenus par des subventions du Fonds national suisse de la recherche scientifique n° 31003A-166580 à AH, de la Ligue suisse contre le cancer n° 4377-02-2018 à AH et d’un financement de l’ETH Zürich à AdM.
matériels
| Name | Company | Catalog Number | Comments |
| 3/2 solenoid valve | Distrelec | 154-22-898 and 154-22-899 | Alternative to above. Solenoid valve connecting the pressure regulator to the on-chip valve. |
| Arduino | Distrelec | 301-01-956 | Optional microcontroller depending on the selected controller and interface. |
| Bacto-Tryptone | Thermo Fisher Scientific | 211705 | For L Broth production. |
| Bacto-Yeast | Thermo Fisher Scientific | 212750 | For L Broth production. |
| Blunt needle 23G | Gonano Dosiertechnik | GGA723050 | Blunt needle connecting the 1/16" tubing to a syringe. |
| Blunt needle 30G | Gonano Dosiertechnik | IG-TE730050 | Blunt needle connecting the 1/32" tubing to a syringe. |
| C. elegans Construct 1 | NA | NA | AH5786 LGI: hmr-1(cp21[hmr-1::gfp + LoxP]) Marston, D.J. et al. MRCK-1 drives apical constriction in C. elegans by linking developmental patterning to force generation. Curr. Biol. 26 (16), 2079-2089. 2016. |
| C. elegans Construct 2 | NA | NA | AH1187 LGII: arIs92[egl-17::cfp] Yoo, A.S., Bais, C., Greenwald, I. Crosstalk between the EGFR and LIN-12/Notch pathways in C. elegans vulval development. Science. 303 (5658), 663-666. 2004. |
| C. elegans Construct 3 | NA | NA | AH5786 LGV: qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)] Ziel, J.W., Hagedorn, E.J., Audhya, A., Sherwood, D.R. UNC-6 (netrin) orients the invasive membrane of the anchor cell in C. elegans. Nat. Cell Biol., 11 (2), 183-189. 2009. |
| C. elegans Construct 4 | NA | NA | ML2615 LGX: dlg-1(mc103[dlg-1::gfp]) Vuong-Brender, T.T.K., Suman, S.K., Labouesse, M. The apical ECM preserves embryonic integrity and distributes mechanical stress during morphogenesis. Development. 144 (23), 4336-4349. 2017. |
| Cable | Distrelec | 143-46-644 | Needed if selecting the solenoid from distrelec. Cable connecting the solenoid to the MOSFET. |
| Chlorotrimethyl silane | Sigma Aldrich | 386529-25ML | Silane for wafer passivation. |
| Cholesterol | Sigma Aldrich | C8667 | For S-Basal production. |
| Flyback Diode | Distrelec | 110-52-628 | Flyback diode protecting the microcontroller. |
| Hollow steel pin | Gonano Dosiertechnik | GGA7R23050 | 23G hollow steel pin connecting the 1/16" tubing to the device. |
| L Broth | NA | NA | Prepared in house following standard recipe. 10 g Bacto-tryptone, 5 g Bacto-yeast, 5 g NaCl, H2O to 1 litre, pH to 7.0 using 1 M NaOH |
| Long-term Imaging Device L1 | NA | NA | Long-term imaging device for L1 to early/mid L2 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L1-4 | NA | NA | Long-term imaging device for mid L1 to mid L4 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L2-A | NA | NA | Long-term imaging device for mid L2 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L3-A | NA | NA | Long-term imaging device for mid L3 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L4-A | NA | NA | Long-term imaging device for mid L4 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| M9 Buffer | NA | NA | Prepared in house following standard recipe. |
| MOSFET | Distrelec | 303-41-391 | Metal-oxide-semiconductor field-effect transistor, used to switch the 24VDC required for the solenoid. |
| NGM plates | NA | NA | Prepared in house following standard recipe. |
| Nylon Luer-Fitting | Fisher Scientific | 11776048 | Adapter from OD 6mm tubing to 23G blunt needle. |
| Optiprep | Sigma Aldrich | D1556 | Density matching liquid. |
| PDMS | Ameba | Elastosil RT601A/B | PDMS elastomer kit. |
| Pluronic F-127 | Sigma Aldrich | P2443 | Non-ionic surfactant. |
| Potassium dihydrogen phosphate | Sigma Aldrich | 1.37039 | For S-Basal production. |
| Potassium hydrogen phosphate | Sigma Aldrich | 1.05099 | For S-Basal production. |
| Power Supply 24VDC | Distrelec | 301-63-304 | 24VDC power supply. Select a power supply suitable for the solenoid selected. |
| Precision pressure regulator | Distrelec | 154-23-578 | Alternativ to above. Pressure regulator. |
| Pressure Gauge G1/8 | Distrelec | 154-23-643 | Pressure gauge attaches to the pressure regulator. |
| PU Tubing OD 6mm | Distrelec | 154-23-866 | Tubing connecting the pressure source and regulator, as well as regulator and solenoid valve. |
| Push-in fitting G1/8 to 6mm | Distrelec | 301-69-330 | Alternativ to above. 2x Push-in fitting attaches to the pressure regulator and connects to the 6mm tubing. |
| Push-in fitting M5 to 6 mm | Distrelec | 301-69-459 | 2x Push-in fitting attaches to the solenoid and the 6mm tubing. |
| S-Basal Buffer | NA | NA | Prepared in house following standard recipe. 5.85 g NaCl, 1 g K2HPO4, 6 g KH2PO4, 1 ml cholesterol (5 mg/ml in ethanol), H2O to 1 litre. Sterilize by autoclaving. |
| Sodium Chloride | Sigma Aldrich | S9625 | For L Broth and S-Basal production. |
| Sodium hydroxite (5M) | Sigma Aldrich | 567530 | Sodium hydroxide used when bleaching C. elegans (prepare solution at 5M concentration) |
| Sodium hypochlorite (5%) | Sigma Aldrich | 1.05614 | Sodium hypochlorite used when bleaching C. elegans (prepare solution at 5% concentration) |
| Strainer 10 µm | pluriSelect | 43-10010-40 | Alternative for bacteria food preparation, especially if smaller devices are used. |
| Strainer 5 µm | pluriSelect | 43-10005-40 | Strainer used to filter L1 larvae after overnight starvation and bacteria after completed food preparation. |
| SU-8 | Gersteltec | GM1050 | SU-8 for height from 1-10 µm. |
| SU-8 | Gersteltec | GM1060 | SU-8 for height from 5-30 µm. |
| SU-9 | Gersteltec | GM1070 | SU-8 for height from 15-200 µm. |
| Syringe 1 mL | Fisher Scientific | 11338763 | 1mL syringe. If using a different type ensure that the syringe body and plunger are stiff, such that they won't be deformed by the syringe pump. |
| Syringe Pump | WPI | Al1000-220 | Syringe pump (https://www.wpiinc.com/var-2300-aladdin-single-syringe-pump.html). |
| Tube 15 mL | Fisher Scientific | 50-809-220 | Tube used for worm bleaching and bacteria preparation. |
| Tube 2 mL | Fisher Scientific | NC1186931 | Tube used for worm preparation and bacteria preparation. |
| Tube 50 mL | Fisher Scientific | 50-465-232 | Tube used for bacteria preparation and growth. |
| Tweezer SMD | Brütsch Rüegg Werkzeuge | 448980 | Tweezers used to plug the 1/32" tubing into the device. |
| Tygon tubing 1/16" | Fisher Scientific | 642002 | Flexible 1/16" OD tubing connecting most components to the device. |
| Tygon tubing 1/32" | Fisher Scientific | 641900 | Flexible 1/32" OD tubing connecting the bacteria supply to the device. |
| UV KUB-3 | Kloe | NA | Mask aligner and UV exposure system. |
| Wafer | Siegert Wafer | 4P0/>1/525±25/SSP/TTV<10 | Silicon Wafer. |
| Waste Container | NA | NA | Prepared in house using a 2mL tube or a cryo vial and hollow steel pins. |
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon