Method Article
すべての幼虫期にわたる高解像度 のC.エレガンス イメージング
要約
このプロトコルは、マイクロ流体ベースの C.エレガンス タイムラプスイメージングを、胚発生全体にわたって説明しています。
要約
線虫は 、生物学において最も広く研究され、最も理解されている動物モデルの1つとなっています。 C.エレガンス がモデル生物として成功するための鍵となるのは、その不変の細胞系譜、透明性、遺伝的扱いやすさの3つです。これらにより、 in vivoで直接顕微鏡を用いたさまざまな研究に理想的です。生きた C.エレガンスの 幼虫と成虫は、画像取得中にしばしば固定する必要があります。従来の固定化方法は、特にタイムラプスイメージングアプリケーションにおいて、動物の発生に悪影響を及ぼします。ここでは、従来の寒天パッドベースの固定化やその他のマイクロ流体戦略に関連する制限に対処する、新しいマイクロ流体イメージング法の詳細なセットアップと操作プロトコルを紹介します。このアプローチにより、さまざまな幼虫のステージ間で同時にライブイメージングを行いながら、線虫の向きと同一性を経時的に維持することができます。これを達成するために、マイクロ流体トラップチャネルアレイが採用されており、その形状は、成長と脱皮に対応しながら安定したワームの向きを維持するように正確に設計されています。固定化は、画像取得中のみカバーガラスに対してウォームを固定するために圧力をかけるアクティブ油圧バルブによって促進されます。この設計により、線虫の生存率や発生タイミングへの影響を最小限に抑えながら、高解像度のイメージングが可能になります。
概要
C.エレガンスのイメージングは、アプリケーション、所望のスループット、および分解能に応じて、いくつかの方法で実施できます。高い分解能が必要な場合、標準的な方法では、スライドガラス、アガロース、カバーガラスの単純な構造である寒天パッド1,2,3を利用します。これらのスライド上の動物は、カバーガラスによって加えられる圧力によって固定されます。固定化は、麻酔薬、例えば、レバミゾールまたはアジ化ナトリウム1,2の添加によってさらに改善することができ、その結果、寒天パッド上の動物は完全に静止し、種々の超解像方法2を含む高解像度で画像化することができる。残念ながら、寒天パッドは発達の進行に影響を与えることが知られており、高い圧力と麻酔薬の組み合わせが発達を遅らせたり、完全な発達停止を引き起こしたりします4,5。
これらの標準的な方法に加えて、近年、いくつかのマイクロ流体方法論が登場しており、それぞれに長所と短所または特殊なユースケースがあります6,7,8,9,10,11,12,13,14,15,16,17,18、19. 例えば、Gritti et al.20は、線虫を大きな部屋に閉じ込める方法を導入した。これらのチャンバーに保存された胚は、顕微鏡で指定された関心領域内に留まりながら、自由に発生および動きます。一般的には効果的ですが、このアプローチは明るい蛍光マーカーの使用に限定されています。最近では、Keilら21が、この方法の修正版を提案し、画像取得中に動物を拘束するためのオンチップ油圧バルブを組み込んで、元のアプローチのいくつかの限界に対処しました。しかし、どちらの方法も捕獲された線虫に使用されるものよりも大きなチャンバーを利用するため、動物は実験中ずっと動き続け、回転し続けます。その結果、発生過程の追跡が難しくなり、動物の動きを補正するために大量の画像後処理が必要になります。
これらの制限に対処するために、Berger et al.18 (図 1) によって導入されたアプローチ、つまり、動物は大きなチャンバーに収容されず、より短い発育期間 (最大 2.5 幼虫段階) 内に動物が収まるように設計されたトラップチャネルに収容されます。既存のマイクロ流体法とは異なり、このアプローチでは、実験全体を通じて動物の向きと同一性が維持され、1つのデバイス内で複数の幼虫のステージを並行して、複数の線虫の高解像度画像を取得することができます。
動物は、実験の開始時にチャネルの高さが動物の厚さに近い特殊なチャネル形状を使用してトラップされるため、回転が防止されます。チャネルの幅と長さは、動物が時間の経過とともに移動して成長できるように選択され、脱皮とある幼虫の段階から次の段階への移行を促進します。その後、複数のトラップチャネルを隣り合わせに配置するだけで並列化が実現され、1つの視野に複数の動物が見え(FOV、 図1A')、1つのデバイスユニットで最大41匹の動物を画像化できます(図1A)。チップ上の動物には、低高さのチャネル を介して 高濃度の細菌性食物懸濁液が継続的に供給され、同時にトラップチャネルアレイの端に動物を閉じ込めるのに役立ちます(高さステップ、 図1A、赤)。Keilらが採用したアプローチと同様に、21 には大型の油圧式オンチップバルブが実装されており、画像取得中に膨らませて動物をカバーガラスに押し付け、動物の固定化を改善します(図1B)。油圧バルブの作動を画像取得期間のみに制限することで、動物の発育への悪影響を最小限に抑え、すべての幼虫のステージで信頼性の高い発育を確保します。Gritti et al.20 およびKeil et al.21によって記述された方法とは異なり、動物は同じデバイス内で胚発生全体にわたって画像化することはできません。代わりに、L1、L1-4、L2-A、L3-A、およびL4-Aと呼ばれる5つの異なるデバイスが導入され、それぞれL1ステージ全体と初期L2ステージ、中期後期L1ステージから中期L4ステージまで、中期後期L2から若年成人期まで、中期後期L3から若年成人期まで、および後期L4から若年成人期までをカバーします(図1C)。 これにより、胚発生後の大部分を中断することなくイメージングできます。このアプローチは、L1から成体への動物のサイズの大幅な増加により、L1動物に適したチャネルが成体には小さすぎて発生停止を引き起こし、成体に適したチャネルがL1には大きすぎるため、過度の動き、回転、および動物がトラップチャネルから逃れるために取られます。
このアプローチを用いると、皮下組織の胚後発生(L1からL4の段階)、外陰細胞の運命の誘導(L2およびL3の段階)、外陰部の形態形成(L3から成体19)、およびアンカー細胞の浸潤など、さまざまな組織に対する信頼性の高い発生進行が達成される18。導入以来、これらの長期イメージングデバイスは、さまざまなプロセスの研究に使用されてきました22,23、さらにプラットフォームは、AiryScan超解像顕微鏡24などの技術と組み合わされ、以前は不可能だった多くの発見を可能にしました。
以下では、これらの長期イメージングデバイスの操作面を段階的なプロトコルで紹介し、システムのセットアップ時に期待される結果といくつかの潜在的な課題を強調します。
プロトコル
本試験で使用した試薬および装置の詳細は、 材料表に記載されています。
1. デバイス作製
注:すべてのデバイスは以下のプロトコルを使用して製造されていますが、デバイスは著者から直接入手できます。デバイスタイプごとに別々のウェーハが製造され、各デバイスウェーハは高さの異なるSU8の2つの層(つまり、食品層とトラップ層)から製造されます。バルブウェーハは、ステップ1.3-1.6を省略して、SU-8の単一高さの別のウェーハ上に製造されます。シランは有毒で、腐食性の蒸気を放出します。したがって、このステップはドラフトで実行する必要があります。作製手順の詳細については、Berger et al.18を参照してください。
- エアプラズマによるウェーハの洗浄
- 最初のSU8層をスピンコートし、次に95°Cでソフトベークを行います。
- 最初の層を露出させ、続いて95°Cでポストベークして現像します。
- ウェーハ現像・乾燥後、再度プラズマ洗浄を行ってください。
- 2番目のSU8層をスピンコートし、続いて95°Cでソフトベークします(必要に応じて、65°Cで最初のベークを行います)。
- ウェーハの両側にあるアライメントマーカーを使用して、2番目のマスクを既存の特徴に位置合わせし、2番目の層を露出させます。
- ウェーハをポストベークして現像し、200°Cでハードベークします。
- ウェーハをクロロトリメチルシランで少なくとも2時間処理します。
- 20 g の PDMS プレポリマー (パート A) のバッチを調製し、1 g の架橋剤 (比率 20:1、パート B) と十分に混合します ( 材料の表を参照)。
- 10分間、またはすべての気泡が消えるまでガスを抜きます。
- PDMS混合物2 mLを取り出し、ステップ1.13のために保存します。
- 残りのPDMS混合物にさらに3 gの架橋剤を加え、十分に混合します(最終比約5:1)。
- 20:1 PDMSのバッチを使用して、デバイスウェーハを750rpmで30秒間スピンコートします。
- バルブウェーハをアルミニウム皿に置き、5:1 PDMSをその上にキャストします。デバイスウェーハを約10分間脱気します。脱気後、ピペットを使用して残っている気泡を取り除きます。
- バルブ層とデバイス層の両方を70°Cでそれぞれ約15〜20分間ベークします。
- デバイスとバルブ層の硬化を評価するには、ピペットチップまたはピンセットで優しくプローブします。バルブ層は固体であるべきですが、デバイス層はわずかに粘着性を保つ必要があります。
- バルブ層を取り外し、メスまたはかみそりの刃を使用して必要なサイズにトリミングします。
- バルブチャネル(ゲージ20)にアクセス穴を開けます。
- デバイスウェーハをトップイルミネーションを備えた実体顕微鏡の下に置きます。
- バルブ層を含むPDMSピースをデバイスウェーハ上に慎重に配置します。
- バルブとデバイスの機能を正確に位置合わせし、層間に閉じ込められた空気をすべて確実に除去します。
- 組み立てた装置をオーブンに移し、70°Cで一晩焼きます。
- デバイスをウェーハから取り外します。
- 残りのすべてのアクセス穴を開けます(ゲージ20)。
- PDMSをエアプラズマでカバーガラスに接着し、接着したデバイスを70°Cのオーブンに数時間置きます。
2.ワームの準備
注:このセクションでは、大量(数百)の動物を生成できる漂白剤によるワームの準備について説明します。手動ピッキングなどの他の同期方法も可能ですが、通常は時間と労力がかかります。プロトコールで使用されるすべてのワームは、標準プロトコールに従って20°Cで、 大腸菌 OP50を播種したNGMプレート上に維持されます。
- 多くの妊娠した動物とのプレートから始めます。
- M9バッファーを使用して動物をプレートから洗い流します。
- 5% NaClOと5 MのNaOHをワーム懸濁液に添加します(1 mLのワーム懸濁液ごとに200 μL/100 μL)。
- 動物がバラバラになるまで、漂白剤を静かに振る(~10分)。
- 漂白混合物を室温で1300 x g で1分間遠心分離します。
- ピペットを使用して上清を取り除き、同量の新鮮なM9バッファーを追加します。
- 再度、室温で1300 x g を1分間遠心分離します。
- 上清を取り除き、ペレット状にした線虫を5 mLの新鮮なM9バッファーを入れた15 mLチューブに移します。
- 20°Cで一晩振とうします。
- ワーム懸濁液を10μmのセルストレーナーに通します。
- ウォーム懸濁液を1300 × g で室温で1分間遠心分離します。
- 上清を捨て、同量のM9バッファーにワームを再懸濁します。
- ワーム混合物を再び1300 × g で室温で1分間遠心分離します。
- 上清を取り除き、ワームをNGMプレートに移します。L1幼虫が必要な場合は、すぐに使用してください。
- 線虫が目的の発生段階に達したら、0.2 μmフィルターでろ過した新鮮なS-Basalバッファーを使用して、線虫をプレートから洗い流します。
- 線虫を重力で沈殿させるか、室温で750 × g で1分間遠心分離してペレット化します。
- 上清を捨て、等量の新鮮なS-Basal bufferを追加します。
- 沈降または遠心分離のステップを繰り返します(ステップ2.16および2.17)
- 上清を取り除き、等量の新鮮なS-Basalバッファーを追加します。
- 沈降または遠心分離のステップを最後にもう一度実行します。
- 上澄み液の大部分を取り除きます。
- 実験が始まるまで、ワームをチューブに入れておきます。
3.バクテリアの準備
注:チップ上では、さまざまな細菌株(OP50、NA22、HT114など)を使用できます。食品ミックスに添加する密度勾配培地の割合を調整して、密度の違いを補正します。すべてのバッファーは0.2μmフィルターを通過し、微粒子を除去します。
- 2 x 20 mLのLBrothを2 x 20 mLの遠心分離チューブ、滅菌三角フラスコなどで40 mL調製します。
- ストックプレートから採取した細菌をLBに接種します。
- 37°C(~16時間)で一晩振とうしながら細菌を増殖させます(OD600 = 1.9)。
- 細菌を3000 x g で10分間遠心分離します。
- 上清を取り除き、各チューブに2 mLの新鮮なS-Basal bufferを加えます。すべてのチューブを組み合わせます。
- ピペットを使用して細菌を機械的に再懸濁します。
- バクテリアを3000 x g で5分間遠心分離します。
- 上清を取り除き、2 mLの新鮮なS-Basal bufferを再度加えます。
- ピペットを使用して細菌を機械的に再懸濁します。
- バクテリアを3000 x g で5分間遠心分離します。
- 上清をできるだけ多く取り除き、新鮮なS-Basal bufferを1 mL加えてから、すべての細菌を機械的に再懸濁します。
- 0.60 mLの密度勾配培地、0.38 mLのS-Basal + 1重量%のPluronic F-127(非イオン性トリブロック共重合体、ここではPFと表記)を1 mLのOP50細菌懸濁液、または0.65 mLの密度勾配培地、0.33 mLのS-Basal + 1重量%PFを1 mLのNA22またはHT114細菌懸濁液と組み合わせます。
- ボルテックスミキサーを使用して食品の準備を完全に混合します。
- 5 μmまたは10 μmのセルストレーナーで食品をろ過します。L1デバイスなどの小型デバイスを使用する場合は、小型のストレーナを特にお勧めします。
注:食品は室温で最大2日間保存できます。
4. チップの準備
注意: 図 2 を参照してくださいview デバイス、チューブ、および接続の概略図。すべてのバッファーは0.2μmのフィルターを通過し、ほこりを除去します。次の手順で説明するスチールピンは、PDMSデバイスに製造された小径の穴に大きいODチューブ(1/16")を接続するために使用される短い中空チューブを指します。これらのスチールピンは、チューブの内径に挿入され、PDMS材料に押し込まれるだけで、2つを効果的に接続できます。
- まず、シリンジに脱イオン(DI)水を入れます。
- 23 Gの針と1/16インチの長いチューブを取り付け、端に中空のスチールピン(90°の角度で曲げたもの)を付けます。チューブは、ソレノイドから顕微鏡ステージまで伸びるのに十分な長さにする必要があります。
- シリンジからのDI水をチューブに充填し、スチールピンをパンチ穴に挿入してバルブインレットに接続します(図2A、J)。
- シリンジとニードルを取り外し、チューブをオフチップソレノイドに取り付けます(図2A、J)。
- イメージングソフトウェアを使用して、ソレノイドをオンにし、デバイスを数分間加圧して、バルブからすべての空気を排出します。チップ上の空気と水の界面を目視で確認して、完了を確認します。この界面は暗く見え、PDMS材料に消えているはずです(図2B)。
- ソレノイドをオフにします(図2C)。
- 1mLのシリンジにろ過したバクテリア溶液を入れます(~0.5mLの食品で十分です)。
- 30 Gの針と1/32インチの長いチューブを針に取り付けます。
- プランジャーを押して針と付属のチューブの両方に充填し、シリンジまたはチューブに空気が残らないようにします。
- チューブの損傷を防ぐためにピンセットを使用して、1/32インチチューブをマイクロ流体デバイスの食品入口に直接挿入します(SMDピンセットを推奨)(図2D、K)。
- シリンジをシリンジポンプに置きます(図2D)。
- 背面のつまみネジを使用してシリンジプランジャーを押し、デバイスに液体を充填します。開いている各接続部に液滴が現れるはずです(図2D、矢印)。
- ウォームの入口と出口の両方を密閉されたスチールピン(1/16インチチューブの短い部分が取り付けられ、燃焼によって密封されたスチールピン)で塞ぎます(図2E、L)。
- つまみネジを使用してさらに圧力をかけ、デバイス内に残っている空気をすべて取り除きます(図2E、矢印)。
- 出口で詰まったピンを取り外し、廃棄物容器(クライオバイアルまたは微量遠心チューブでできており、蓋に2本のスチールピンが突き刺さり、接着剤で固定されています)を取り付けます。廃棄物コンテナは、1/16インチの短いチューブを使用して接続され、一方の端がコンテナに取り付けられ、もう一方の端が中空鋼ピン(90°曲げ)に接続されています(図2F、G、M)。
- シリンジを押して、廃棄物容器が適切に接続され、システムに詰まりがないことを確認します。このためには、液体が廃液チューブを通って流れるまで、少量の液体をシステムに押し込みます(シリンジポンプのつまみネジを回します)(図2G、矢印)。
- 2 本目の詰まったスチールピンを取り外します。
- ミミズ入口に液体の小さな滴が現れるまでシリンジを押します(図2H、N)。
- 23 Gの針を使用して、S-Basal bufferで満たされた1 mLシリンジに1/16インチチューブ(15-20 cm)の長い部分を取り付けます(図2H、N)。
- チューブのもう一方の端にストレートの23Gスチールピンを取り付けます。
- 針とチューブにシリンジからのバッファーを充填し、シリンジまたはチューブに空気が残らないようにします。
- チューブの端にあるスチールピンを、ワームを含むチューブに挿入します。
- 少量の液体をチューブに押し込み、空気が残らないようにします。
- ワームをチューブに引き込みますが、シリンジには引っ張らないでください。
- ウォームに接続されたシリンジを、スチールピンに小さな液体が現れるまで押します(図2H)。
- スチールピンをウォームインレットに挿入します(図2I)。
注:デバイスの調製は、最終的なワーム調製の前に実行し、ワームの準備ができるまで顕微鏡に放置することができます。
5. ワームのローディングとイメージング
- デバイスを低倍率(5倍または10倍)の顕微鏡または解剖顕微鏡に置きます。
- 現在使用中のデバイスユニットを特定し、明視野照明を使用してワームインレットを見つけます。
- インレットが視野の片側に見え、トラップチャネルインレットの背面が反対側に見えるようにデバイスを配置します。
- ワームシリンジのプランジャーをそっと押します。液体は、入口からチャネルアレイを通って出口に向かって著しく流れます。バクテリアの存在と密度勾配媒体の添加による屈折率の違いにより、液体の流れが明らかになります。
- ワームがインレットから発生し、チャネルアレイの背面に向かって流れていることを確認します。
- 動物をチャネルアレイに向かってゆっくりと押します。動物がチャネルに面したら、チャネルに押し込み、追加の動物に対して繰り返します。
注:動物は、食べ物に簡単にアクセスできるように、頭を出口に向けて向ける必要があります。それらは、プランジャーを押したり引いたり、泳いだりすることで方向付けることができます。 - 十分な動物を捕獲したら、線虫の入口に取り付けたままのシリンジを顕微鏡ステージに置きます。圧力の蓄積を解放するために、シリンジからウォームチューブを短時間取り外す必要がある場合があります。その後、鈍い針に慎重に再取り付けします。
- 解剖顕微鏡でローディングを行った場合は、デバイスをイメージング顕微鏡に移します。チューブはチップに取り付けたままにすることができ、シリンジはポンプに接続されています。
- シリンジポンプのスイッチを入れ、0.5 μLの場合は1 μL/hのプリセットレートで運転し、0.5 μLの場合は100 μL/hずつレートを上げ、1 μL/hに戻します。このサイクルは、実験全体にわたって自動的に繰り返されます。ポンプのプログラム方法については、機器のユーザーマニュアルを参照してください。
- デバイスを顕微鏡ステージに置き、しっかりと保持されていることを確認します(取り付けメカニズムの提案は 図3Aにあります)。
- イメージング顕微鏡でローディングが行われなかった場合は、低倍率で目的のデバイスユニットを特定します。
- 希望の画像倍率に切り替えます。
注意: デバイスはすべての対物レンズタイプと互換性があります。 - トラップチャネルアレイ内の動物と関心領域を特定し、目的のイメージング条件を設定します。
- 画像取得前にオンチップバルブがソレノイド10秒を介して作動し、動物が所定の位置に保持されるように、目的のイメージング条件で画像を撮影します。
注:オンチップバルブを作動させると、動物が伸びて平らになり、イメージングの関心領域(ROI)の調整が必要になる可能性があります。
6. セットアップの準備
注:このセクションは、デバイス制御メカニズムの初期準備に関するものであり、各実験の前に繰り返す必要はありません。 図3B、Cを参照してください。多くのソレノイドはより高い電圧を必要とするため、ソレノイドはおそらくマイクロコントローラに直接接続されず、リレーまたはMOSFET を介して 接続されます ( 図3Cを参照)。
- 加圧された空気源(壁面供給設備やガスボンベなど)を特定します。
- 6 mmチューブ(壁源)を使用して圧力源を適切な圧力レギュレーター(0〜2 barの圧力範囲)に接続するか、適切なレギュレーターをガスボンベに直接取り付けます。
- 圧力レギュレーターをソレノイドバルブ入力(6 mmチューブ、 図3Bを参照)に接続します。
- ソレノイドを顕微鏡ステージのできるだけ近くに置きます(ステージから0.5~1 mが推奨されますが、必要に応じてより長い距離を置くことも可能です)。
- ソレノイドバルブを選択したコントローラーに電子的に接続します。別のマイクロコントローラボード(Arduinoなど)や既存のDAqカードを使用して制御するなど、さまざまなオプションが利用可能です。
7. クリーンアップと保管
- 実験が完了したら、デバイスを顕微鏡から取り外します。
- 浸漬液を取り除きます。浸漬油は、有機溶媒(アセトン、メタノールなど)で除去できます。
- デバイスを平らな面に置き、バルブチューブを除くすべてのチューブを外します。各チューブを安全に取り外すには、PDMSを近くに押し下げて、ゆっくりと引っ張ります。デバイスを持ち上げたり曲げたりすると、カバーガラスが破損する可能性があるため、曲げないでください。
- PDMS表面を70%エタノールで洗浄します。
- バルブチューブを取り付けた状態で、デバイスを室温で保管してください。
注意: このデバイスは、すべてのユニットが使用されるまで再利用でき、バルブチューブを補充する必要がない可能性があります。ただし、バルブチューブ内の水は長期間にわたって蒸発するため、最終的には補充が必要になる場合があります。
結果
デバイスの設計と寸法
5つの異なるデバイスは、4つの幼虫期すべてに対応するように設計されました。これらのデバイスは次のように指定されています:L1、孵化直後にロードされ、L2段階まで画像化されたL1幼虫用。L1-L4、L1中期から後期のL1段階から初期から中期のL4までの幼虫を保持することができます。L2-Aは、L2段階中期から若年成人期までの動物に適しています。L3-A、L3段階中期から若年成人期までの動物用。L4-Aは、L4期後期から若年成人期までの動物に対応します。
すべてのデバイスは、ワームインレット、1つ(またはメディア交換の場合は2つ)のバクテリアフードインレット、および一般的な廃棄物アウトレットで構成される同じ基本レイアウトに従います。入口部分と出口部分の間には、41の平行トラップチャネルの配列が配置され、入口側と出口側は高さの低い食品供給チャネルによって効果的に分離されています(図1A、A ')。チャネル寸法は、実験開始時にロードしたワームよりも大幅に長く、幅が広く、長さ/幅がL1デバイスの場合400/15μm、L1-L4デバイスの場合575/22μm、L2-Aデバイスの場合800/27μm、L3-Aデバイスの場合900/30μm、L4-Aデバイスの場合1000/65μm(補足ファイル1、 補足ファイル2、 補足ファイル3、 補足ファイル4、 および補足ファイル5)。
チャネルの長さは、実験の終了までに動物が到達したサイズと一致するように選択され、幅は、実験の開始時に線虫がチャネル幅の約3分の2を占めるように選択されました。この設計により、脱皮中の成長と移動に十分なスペースを確保しながら、ワームの回転や回転を防ぎます。幅とは異なり、チャネルの高さは実験開始時に線虫の厚さに近づけて設定しました:初期のL1幼虫は8μm、中期/後期L1幼虫は12μm、中期L2幼虫は15μm、中期L3幼虫は17.5μm、後期L4幼虫は22.5μmで、L1、L1-L4、L2-A、L3-Aに対応します。 およびL4-Aデバイス。チャネルの高さを低くし、慎重に選択した幅(高さと幅の比率を0.5〜0.6に維持)と組み合わせることで、ワームが一定の方向に留まるようにします。特に、チャネルの高さが十分に小さいと、すべての線虫が一貫して目的の横方向に配置されます。
餌供給チャネルは、L1では3μm、他のすべてのデバイスでは5μmの高さで製造されており、動物がトラップチャネルから逃げることなく、細菌が動物に容易に到達できるようになっています。すべてのデバイスは、同じ食品供給層(補足ファイル6)と同じバルブ層(補足ファイル7)を使用しています。バルブ層は、高さ20μmの別のウェーハ上に製造され、PDMSデバイス製造中にのみデバイス層に配置されることに注意してください(ステップ1.21)。
これらのステージ固有の幾何学的制約は、線虫が頭から尾へと回転または反転するのを防ぐために不可欠であり、すべての幼虫のステージに対応するために3つの異なるデバイスタイプを使用する必要があります。L1幼虫を若い成体動物用のサイズのチャネルに配置すると、L1幼虫は安定せず、すぐにトラップチャネルから出ます。
C.エレガンス の準備
特に明記されていない限り、線虫は、大腸菌OP50を播種したNGMプレート上の標準プロトコル25に従って、20°Cで維持しました。 線虫の調製セクションでは、イメージング実験で使用される同期線虫集団の調製について明示的に説明しています。同期は、次亜塩素酸ナトリウム漂白剤26を使用して標準的なプロトコルに従って実施され、一晩の飢餓後に破片や孵化していない動物を取り除くために追加のろ過ステップで変更されました。その目的は、同期したL1幼虫を多数採取し、それをNGMプレートに播種するか、イメージングデバイスに直接ロードすることです。手動摘み取りや制御された産卵などの他の同期方法も同様に適しています。しかし、十分な動物を生み出すのに手間がかかります(条件ごとに200匹が推奨されます)。
線虫が目的の段階に達したら、清潔なS-Basal(理想的には0.2 μmフィルターでろ過)を使用してNGMプレートから穏やかに洗い流すことができます。目的は、プレートからバクテリアや破片を集めることなく、できるだけ多くの動物を収集することです。動物は小さな遠心分離管に集められ、新鮮なS-Basal bufferで2〜3回洗浄され、最終的にできるだけ多くの液体が除去されます。その後、濃縮されたボリュームから動物を直接採取します。動物の濃度が低すぎると、負荷が遅くなり、装置内を流れるために大量の液体が必要になり、破片でトラップチャネルを塞ぐリスクが高まります。
細菌性食品調製
細菌の増殖は標準的なプロトコルに従って行われ、初期細菌濃度(OD600 = 1.9)をS-Basal buffer(0.2 μmフィルターでろ過)で約40倍に増やし、密度勾配培地およびPFを含むS-Basalバッファー(0.2 μmフィルターでろ過)と混合します。このプロセスステップの期待される結果は、イメージング実験中の非常に密度の高い細菌懸濁液の調製と細菌沈降の防止です。高密度は、培地送達に使用される低流量(1 μL/h)でオンチップで動物に給餌するために必要です。密度勾配培地の目的は実験中の細菌の沈殿を防ぐことであり、PFの目的は細菌がチャネル壁に付着するのを防ぐことです。密度勾配培地とPFはどちらも無毒であり、動物の生存率に影響を与えません。
実験で異なる種類の細菌を使用する場合は、密度勾配培地の必要な濃度を決定する必要があります。これは、細菌懸濁液をさまざまな量の培地と混合し、続いて遠心分離することで達成できます。密度勾配濃度が低すぎると、バクテリアが沈殿します。濃度が高すぎると、バクテリアが浮いてしまいます。適切な濃度が見つかったら、細菌混合物を室温で約48時間放置して結果を検証し、実験全体で食品がどのように振る舞うかを示すことをお勧めします。実験後は、細菌が供給される注射器を確認し、細菌が沈殿したり浮いたりしないことを確認することも同様に推奨されます。異なる量のOptiprepを添加することによる体積の差は、S-Basal + 1重量%PFを多かれ少なかれ添加することで補うことができます。同様に、追加の培地または化合物(例えば、オーキシン)を懸濁液に添加することができ、余分な容量はS-Basal + 1重量%PFの容量から差し引かれる。
セットアップの準備
圧力供給システムは、顕微鏡にできるだけ近づけて設置し、便利に操作できるようにしてください。すべてのチューブ配管、特にチップに接続する 1/16 インチ チューブは、短くする必要があります (外径 1/16 インチ チューブの場合は 0.5 m 未満) (図 2 および 図 3B)。上記のセクションで示したように、オンチップバルブのコンピュータ制御はさまざまな方法で実現できます。これは、専用のマイクロコントローラーボード(Arduinoなど)を接続するか、デジタル出力を使用してシステムを既存のデータ収集(DAq)カードに接続することにより、任意の顕微鏡ソフトウェア(Micro-Manager、Metamorph、NIS、およびZenBlueでテスト済み)で可能である必要があります。選択したボード出力は、画像取得の10秒前にオンになるか、デバイスのセットアップ中に手動で作動するシャッターとして構成する必要があります。前述のように、ソレノイドをマイクロコントローラに直接接続することはお勧めしません。代わりに、MOSFETまたはリレースイッチ を介して 接続し、ソレノイドとマイクロコントローラが電子的に絶縁されたままになります(図3C)。
圧力供給チューブと同様に、チップ(外径1/16インチおよび外径1/32インチ)までの他のすべてのチューブの配線をできるだけ短くします。ウォームチューブと廃チューブ(1/16インチ外径)をそれぞれ2.5cmと20cm未満に保ちます。バクテリア供給チューブ(外径1/32インチ)は、顕微鏡ステージに設置した後、シリンジポンプからデバイスに接続するのに十分な長さである必要があります。それにもかかわらず、これをできるだけ短くし、シリンジポンプを顕微鏡ステージの近くに配置することをお勧めします(ステージの横、棚の使用、またはインキュベーターエンクロージャーの上など)。システムにチューブを追加すると、動物を装置にロードするときに感じる背圧が増加し、閉じ込められた動物にかかる全圧力が増加します。
デバイスの操作
すべてのチューブは、この段階(プロトコルステップ4の開始)で、それぞれの鈍針、スチールピン、およびシリンジに準備して接続できます。前述のように、チューブの長さはできるだけ短くしてください(図2J-N)。重要なことは、シリンジやチューブに気泡が残らないように注意する必要があります。これは、動物のローディングを妨げ、実験中に動物がトラップチャネルから逃げる可能性があるためです。シリンジから気泡を取り除くには、シリンジに充填する、反転させる、シリンジの上部まで気泡が上がるように静かに振るなど、さまざまな方法でシリンジから気泡を取り除くことができます(シリンジをフリックすると、追加の気泡が閉じ込められる可能性があるため、シリンジをフリックすることはお勧めしません)。あるいは、シリンジをバッファーに突き刺し、プランジャーを上下に素早く動かして、ほとんどの気泡を迅速に除去することで、シリンジを充填することもできます。
シリンジが充填され、気泡がなくなったら、鈍い針とチューブを取り付けてバッファーを充填します。シリンジを充填する際には、鈍い針のプラスチック部分に空気が簡単に閉じ込められる可能性があるため、特別な注意を払う必要があります。空気が溜まっている場合は、針を交換してください。あるいは、ピペットを使用するなどして、針に液体を事前に充填することで、問題を軽減できます。
すべてのコンポーネントが所定の位置にあるので、ソレノイドとオンチップバルブを接続するチューブから始めて、チューブをデバイスに接続できます(図2A-C、J)。このチューブは最初に脱イオン水で満たされ、システムはデッドエンドバルブチャネルからすべての空気を除去するために加圧されます。PDMSはガス透過性です。したがって、圧力が上昇すると、チャネルからすべての空気がPDMSに押し出され、バルブチャネルは水で満たされたままになります。このプロセスは顕微鏡で追跡でき、バルブチャネル全体が満たされていることを確認できます。バルブを充填した後、バクテリアの供給を接続でき、すべての開いている入口/出口を塞ぐことでデバイスを充填および加圧できます(図2D、E、K、L)。空気が置換され、プロセスを顕微鏡で監視できます。すべての空気が置換されると、バクテリアはデバイスに均一に満たされるはずです。ブロッキングピンを取り外し、廃棄物収集チューブを接続します(図2F、G、M)。この時点で、少量の液体がデバイスを介して廃棄物収集チューブに流れ込み、チューブへのすべての接続が開いていることを確認します。これは、チューブを収集チューブに接続する前に視覚的に確認できます。廃棄物収集チューブに液体が流れない場合は、詰まっている可能性があります。これにより、実験中に圧力が蓄積し、閉じ込められた動物に悪影響を及ぼします。チューブまたはその接続部が詰まっている場合は、チューブを取り外し、針を使用してすべての接続部を清掃するか、水で満たされた注射器で洗い流します。
最後に、ウォームチューブを接続できます(図2H、N)。S-Basalを充填したシリンジに取り付けられたチューブにワームを吸い込むだけで、遠心分離管からワームを拾い上げます。動物は注射器ではなく、チューブに引き込む必要があります。その後、チューブをデバイスに接続できます。その前に、デバイスとウォームチューブから少量の液体が押し出され、ロード中にデバイスに空気が押し込まれないように2つの液滴が接続されます。
ウォームローディング
すべての接続が完了したら、ワームシリンジのプランジャーを押したり引いたりして動物を装填できます。動物は入口からトラップチャネルアレイに向かって洗い流されます。しかし、彼らは自然に彼らが経験する流れに逆らって泳ぎます。したがって、動物は頭をトラップチャネルに向けて向きを変える必要があります。正しい動物の向きは、プランジャーを押したり引いたりして、動物が目的の向きに回転する時間を与えることによって達成されます。これはほぼシングルワームベースで達成できますが、ある程度の練習が必要になります。動物が正しい向きになったら、トラップチャネルに押し込み、チャネルの端までスライドして、高さステップで動物を止めることができます(図1A、B)。動物がチャンネルに入らない場合は、選択したデバイスに対して大きすぎるため、より大きなデバイスでイメージングする必要があります。動物がトラップチャネルに入れられたときに回転したり回転したりできる場合、動物は若すぎるため、より小さなデバイスを使用するか、動物をさらに数時間成長させる必要があります。
重要なのは、異なるチャネルの動物が互いに影響を与えないということです。したがって、誤ってロードされた動物は、正しくロードされた動物に影響を与えませんが、食物への十分なアクセスがないため、成長が遅くなったり、発達が止まったりします。
動物が適切な年齢で負荷をかけられると、縦方向のチャネル軸に沿った動きは最小限に抑えられるはずです。しかし、動物は自由に小刻みに動き(図1B)、数分以内に餌を与え始めます。動物が縦方向のチャネル軸に沿って大きな動きを示す場合、これはデバイス内の圧力の蓄積、またはチューブ、鈍い針、または注射器のどこかに詰まった気泡によって引き起こされている可能性があります。デバイス内の圧力蓄積は、鈍い針からウォームチューブをそっと取り外し、そっと再度取り付けることで解放できます。上記の手順と予防措置にもかかわらず、気泡がシステム内に留まったままになっている場合は、ワームシリンジ全体を取り外して、気泡のない新しいシリンジと交換する必要があります。システム内の気泡は、負荷中に圧縮され、動物に負荷をかけた後にゆっくりと放出されるばねとして機能します。気泡が膨張することによって生じる流れは、システムを不安定にし、動物をトラップチャネルから押し出す可能性があります。
オンチップでの画像取得と現像
最後に、動物がロードされると、画像取得を開始できます。原則として、これらのデバイスは、明視野、落射蛍光18,19,22,23(図4)、スピニングディスク共焦点19、さらには超解像モダリティ(AiryScan24)など、ほとんどのイメージング方法に適合しており、すべてのイメージングは厚さ170μmのカバーガラスを介して行われます。その結果、マイクロ流体デバイスは、チップ上で達成可能な画質にほとんどまたはまったく影響を与えません。ただし、イメージングモダリティに関係なく、動物の生存率に影響を与えない適切なイメージング条件を選択する必要があります。高い励起強度は、サンプルに与えられる高エネルギーと熱により、蛍光色素の漂白と発生停止を容易に引き起こします。露光時間が短く(~10 ms)、励起強度が低い(一般的な蛍光LED光源の10%未満)ことが推奨され、コントラスト設定min=0、max=1000(16ビットカメラ使用時)で使用可能な画像が得られます(図4)。
L1、L1-4、L2-Aデバイスを使用して取得した代表的なデータを 図4に示します。 C.エレガンス の上皮細胞の孵化/夜間飢餓から中期L2幼虫期までの発達(図4A、 補足動画1)、1°運命の外陰部前駆細胞の誘導とその後のL1後期から初期L4幼虫期への分裂(図4B、 補足動画2)、そして最終的に C.エレガンス 外陰部の形成が初期L3幼虫期から成体への移行期の転回まで(図4C)、 補足ムービー3)。
各アプリケーションには、さまざまな開発タイミングメトリックの定量化が伴います。 図4A、B の画像は、後処理が適用されていない、つまり、デコンボリューションや画像レジストレーションが適用されていない状態で示されています。一方、 図4Cの画像は、デコンボリューション27 されて登録されており、長期イメージングデバイスを使用するときに可能な画質の改善を強調している。
まず、図4Aに示されている動物の各シーム細胞分裂の開始を同定し(フルタイムのコースについては補足動画1を参照)、12匹の動物にわたるすべての細胞の一貫した適時の分裂を示しています(図4D)。シーム細胞を用いて、4つの幼虫期すべてにわたる一般的な発生タイミングも評価し、L1(n = 22)では12.0時間±1.7時間(平均± SD)、L2では10.2時間±1.0時間後(n = 27)、L3では10.9±時間から1.4時間後(n = 27)、L4動物では14.6時間±2.2時間後に、すべてのシーム細胞分裂が完了したことを明らかにした。これらのデータは、文献値2,28、およびプレート上で成長した動物で測定された値と一致しており、L1 15 h(n = 21)、L2 10 h(n = 15)、L3 12 h(n = 21)、およびL4 12.5 h(n = 61)の発育時間の中央値が得られました(Berger et al.18から適応)。観察されるわずかな遅延は、画像の取得とそれに伴う光毒性の結果、または動物が成長してトラップチャネルになると閉じ込めが増加する結果である可能性があります。
次に、L2段階とL3段階にわたる動物の成長を追跡し、生殖腺の長さを発達進行の優れた指標として定量化しました(図4E、フルタイムのコースについては補足動画2を参照)。シーム細胞分裂と同様に、まっすぐな動物の向きのおかげで正確な生殖腺の長さを測定することができ、画像化されたすべての動物で一貫した生殖腺の成長が見つかりました(n = 19)。これらの実験の最初のVPC分裂は、実験開始から14.26時間±2.47時間後(播種後~30時間)に観測され、2回目の分裂は1.46時間±0.13時間後(n = 19)に発生しました。これらのデータは、NGMプレート29,30で確立された文献値とよく一致しています。ユーリングとアンブロス30は、最初の分裂が約29時間後に発生し、2回目の分裂が約3時間後に発生したことを発見した。
最後に、外陰部の発達の特定の段階に到達するまでの時間を定量化し(図4F、フルタイムコースについては補足動画3を参照)、特に、Mok et al.31によって定義されたサブステージに従って、陥入(L4.0、t1)から中期L4ステージ(L4.5、t4)に進むのに必要な時間を評価しました。t1-t2間の平均進行時間は3.8時間±1.2時間、t2-t3間は3.5時間±1.2時間、t3-t4間は2.8時間±1.6時間(n = 7)であり、ほぼ直線的な発達進行を示しています。発生タイミングアッセイと同様に、これらの時間、特にt1-t2は、報告された文献値(t1-t2:0.7時間、t2-t3:3時間、t3-t4:2.3時間31)と比較してわずかに遅れているように見えます。それにもかかわらず、発生のタイミングは動物間で非常に一貫しており、すべての動物が無事に成体化します。
動物の動きと顕微鏡のドリフトを補正
1つのZスタック全体での動物の動きは、通常、オンチップバルブが作動すると最小限に抑えられます。しかし、動物が完全に静止しているとは思われません。1つのスタックで観察される残留ジッターは、オンチップバルブを作動させる圧力を上げるか、使用露光時間を短縮するか、選択したZステップを増やしてスタック取得を加速することで補償できます。ピエゾZドライブを使用することで、従来の顕微鏡フォーカスドライブと比較してZモーションが大幅に高速化されたり、マルチバンドフィルター(GFP/mCherryなど)を使用して、時間のかかるフィルター交換を必要とせずに別々の色を取得したりすることで、スタック取得時間をさらに短縮できます。参考までに、提供された例(図4 および 補足動画1、補足動画2、 および 補足動画3)では、スタック取得時間は典型的には3〜8秒であった。残留運動は、必要に応じてさまざまな画像レジストレーション方法によって除去することもできます。
オンチップの動物は着実に成長することが期待されています。したがって、対象の特徴は、必然的に縦方向のチャネル軸に沿ってシフトする(図4A、B、 補足動画1 および 補足動画2)。したがって、対象の特徴がFOVに成長し、実験の過程で失われないようにイメージングFOVを設定することをお勧めします(図1B および 図4A、B)。あるいは、動物を複数の隣接するFOVで撮影し、動物の体全体を覆うこともできます。ただし、これにより追加の光毒性とストレスが発生する可能性があります。Z-motionと同様に、さまざまな登録手順により、チャネル内の動物の動きを時間の経過とともに補正できます。動物が縦軸に沿って不規則な動きを示し、成長に起因するものよりも広範囲にわたる場合、これは気泡によって引き起こされる可能性があります。
各長期イメージングデバイスには、6つの個別のイメージングユニットが含まれており、それぞれが個別の実験に使用できます。各ユニットには最大41匹の動物を収容でき、トラップチャンネルは1つのFOVで複数の動物を撮影できるように間隔が空いています。さらに、1つのユニットまたはデバイス内で複数のFOVを画像化できます。すべての顕微鏡サンプルと同様に、サンプル表面を横切る移動は、液浸媒体の損失により焦点ドリフトを引き起こす可能性があります。このドリフトは、低粘度の浸漬油を使用するか、さまざまなオートフォーカスモダリティを使用して補正できます。ただし、一部のハードウェアオートフォーカスシステムは、PDMSマイクロ流体デバイスと一緒に使用すると、ガラスから水性媒体への移行を基準点(カバーガラスのサンプル側)として使用するため、機能しない場合があります。FOVの多くは、デバイス内でシリコンで満たされており、水よりも高い屈折率を持っています。これは画質には影響しませんが、オートフォーカスに悪影響を与える可能性があります。単一のFOVをイメージングする場合、デバイス内で観察されるフォーカスドリフトは最小限(2μm未満)です。過度のフォーカスドリフトが観察される場合は、顕微鏡システムまたは環境の熱不安定性、複数のFOVを獲得する過度のXYモーション、または顕微鏡へのデバイスの不適切な取り付けが原因である可能性があります(推奨される取り付けメカニズムについては 、図3A を参照してください)。
同様に、XYの過度の移動や不適切な取り付けもXYドリフトを引き起こす可能性があります。デバイスと顕微鏡対物レンズは液浸液 を介して 接続されているため、X、Y、またはZの速い動きにより、デバイスに力が加えられる可能性があります。デバイスが正しく取り付けられ、外部力が作用しなければ、フォーカスドリフトが最小限に抑えられ、XYドリフトがなく、非常に安定しています。
最後に、特定のシステムパラメータが不適切な場合、PDMSマイクロ流体デバイスは動物の発生に悪影響を及ぼす可能性があります。生存率は、過剰なバルブ圧力、高い励起強度による高い光毒性、長い露光時間、またはスタック取得間の短い時間間隔によって影響を受けます。特に、このシステムを初めて使用するときは、イメージング条件が動物の成長に影響を与えないように、明るい蛍光マーカーまたは明視野イメージングを使用して動物の生存率を評価することを強くお勧めします。動物が確実に成長すると、イメージングパラメータは必要に応じて変化させることができます。
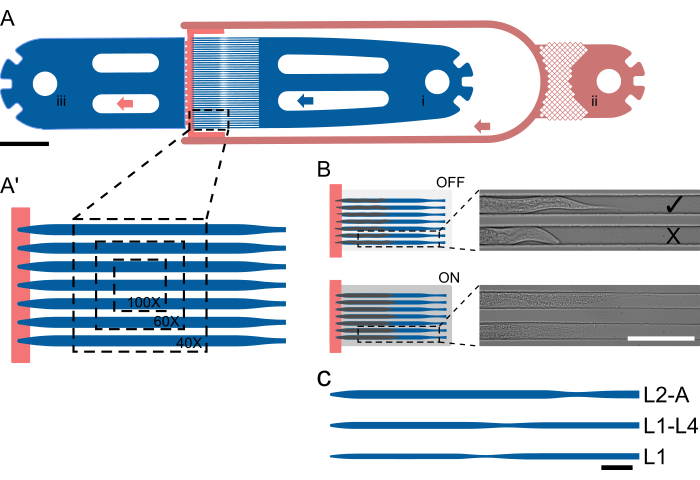
図1:デバイスのレイアウトと概略的な操作 (A)ワームインレット(i)、バクテリアフードインレット(ii)、および一般的なアウトレット(iii)を備えた単一のユニットを示すデバイスの概要。(A')L2-Aデバイスのトラップチャネルの拡大図で、1つのFOVで異なる倍率(40倍から100倍)で見えるワームの数を強調しています。(B)オンチップバルブの機能原理。OFFにすると、動物がトラップチャネルに快適に収まるようにチャネルの高さが選択されます。オンにすると、チャンネルの高さが下がり、動物がカバーガラスに押し付けられ、閉じ込められた動物が可逆的に動けなくなります。画像は、オンチップバルブをオフにし、バルブをオンにした状態で捕捉した2匹の罠にかかった動物を示しています。動物は圧力下で目に見えてまっすぐになり、伸びています。上の動物は正しく装填され、食料源の方を向いており( )、下は反対側を向いています(X)。(C-Cインチ)デバイスの概略設定。(C)利用可能なデバイスサイズ。L1はL1から中期L2期までの動物に、L1-4は中期L2から中期L4幼虫期までの動物に、L2-Aは中期L2幼虫期から成虫期までの動物に適しています。スケールバーは、(A)1000μm、(B)100μm、(C)50μmです。この図は、Berger et al.18から部分的に適応されています。この図の拡大版を表示するには、ここをクリックしてください。
)、下は反対側を向いています(X)。(C-Cインチ)デバイスの概略設定。(C)利用可能なデバイスサイズ。L1はL1から中期L2期までの動物に、L1-4は中期L2から中期L4幼虫期までの動物に、L2-Aは中期L2幼虫期から成虫期までの動物に適しています。スケールバーは、(A)1000μm、(B)100μm、(C)50μmです。この図は、Berger et al.18から部分的に適応されています。この図の拡大版を表示するには、ここをクリックしてください。
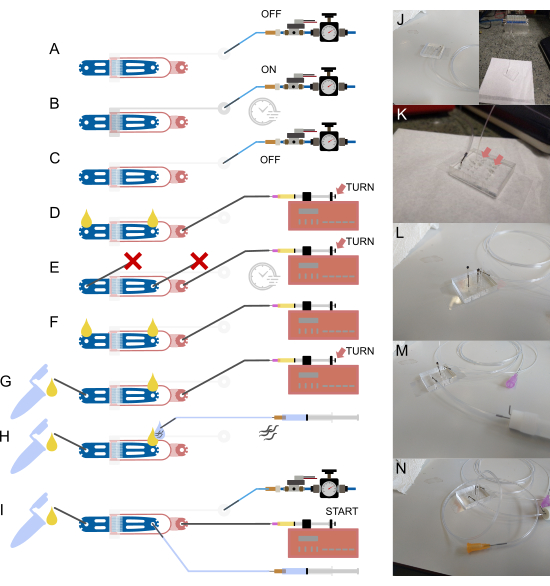
図2:デバイスのセットアップと接続。 (A-I)セットアップ プロセスの概略図の概要。(A)中空鋼ピン(灰色)を使用して1/16インチの水充填チューブをバルブインレットに接続し、もう一方の端を圧力供給システムに接続します。(B)オフチップソレノイドを介してオンチップ油圧バルブを充填し、デバイスを数分間加圧します。(C)次のステップに進む前に圧力を非アクティブ化します。(D)1/32インチのチューブと30Gの鈍い針を使用して細菌性食品を含む注射器を食品入口に接続し、続いて液体が両方の開いた接続部に現れるまでデバイスを充填します。(E)1/16インチのチューブ( )で塞がれたスチールピンでウォームの入口と廃棄物の出口を密閉し、食品シリンジとポンプを使用してデバイスを加圧します(つまみネジ調整を使用)、圧力を数分間維持します。(F)(E)からプラグを取り外し、開いている各接続部に液滴が形成されるようにします。(G)1/16インチの短いチューブと中空のスチールピンを介した廃棄物コンテナの接続。(H)中空鋼ピンと23Gの鈍針を使用して、緩衝液充填シリンジを装置に取り付けます。ワームは、デバイスを接続する前にチューブに引き込まれ、入口とチューブの端で液滴を位置合わせすることで空気が入らないようにします。(I)すべてのデバイス接続が確立された状態での最終セットアップ。(J)(A-C)に対応する、インレットとソレノイド(背景)にバルブチューブが接続されたデバイスの画像。(K)(D)に対応する、ワーム入口と廃棄物出口に2つの液滴(矢印)を示す、食品供給チューブが取り付けられたデバイスの拡大図。(L)(E)に対応する、食品供給チューブが取り付けられ、ワームの入口と廃棄物の出口が塞がれたデバイスの拡大図。(M)(G)に対応する、廃チューブと容器が取り付けられたデバイスの拡大図。(N)(I)に対応する、すべてのチューブ接続が所定の位置にあった最終アセンブリ。Berger et al.18から部分的に適応。この図の拡大版を表示するには、ここをクリックしてください。
)で塞がれたスチールピンでウォームの入口と廃棄物の出口を密閉し、食品シリンジとポンプを使用してデバイスを加圧します(つまみネジ調整を使用)、圧力を数分間維持します。(F)(E)からプラグを取り外し、開いている各接続部に液滴が形成されるようにします。(G)1/16インチの短いチューブと中空のスチールピンを介した廃棄物コンテナの接続。(H)中空鋼ピンと23Gの鈍針を使用して、緩衝液充填シリンジを装置に取り付けます。ワームは、デバイスを接続する前にチューブに引き込まれ、入口とチューブの端で液滴を位置合わせすることで空気が入らないようにします。(I)すべてのデバイス接続が確立された状態での最終セットアップ。(J)(A-C)に対応する、インレットとソレノイド(背景)にバルブチューブが接続されたデバイスの画像。(K)(D)に対応する、ワーム入口と廃棄物出口に2つの液滴(矢印)を示す、食品供給チューブが取り付けられたデバイスの拡大図。(L)(E)に対応する、食品供給チューブが取り付けられ、ワームの入口と廃棄物の出口が塞がれたデバイスの拡大図。(M)(G)に対応する、廃チューブと容器が取り付けられたデバイスの拡大図。(N)(I)に対応する、すべてのチューブ接続が所定の位置にあった最終アセンブリ。Berger et al.18から部分的に適応。この図の拡大版を表示するには、ここをクリックしてください。
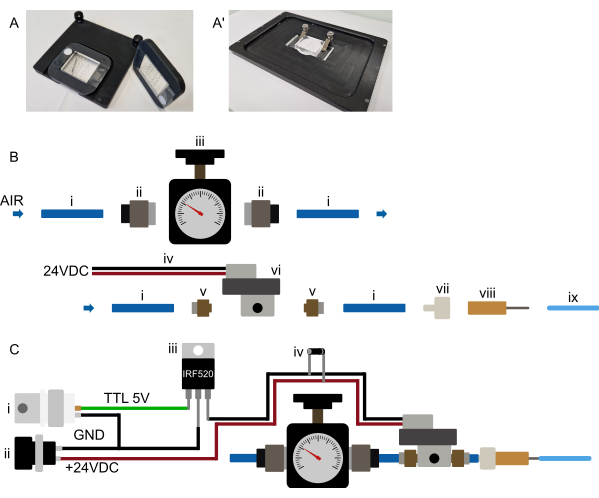
図3:ハードウェアのセットアップ。 (AA ')推奨されるデバイスの取り付け。(A)正立顕微鏡用のマウントが可能です。デバイスは、中央に大きな切り欠きがある長方形の3Dプリントフレームに取り付けられています。両面テープの2つの小さなストリップは、最初にデバイスのPDMS部分の両側のカバーガラス上に配置されます。次に、3Dプリントされたフレームをデバイスの上に配置して、PDMS部分が切り欠きを突き抜け、フレームが両面テープにしっかりと押し付けられ、デバイスがフレームに恒久的に取り付けられます。したがって、フレームはデバイスをしっかりと保持し、フレームとステージインサートに埋め込まれた磁石を使用してそれ自体が顕微鏡ステージ上に保持されます。これにより、安定したデバイスの取り付けが保証され、顕微鏡の対物レンズと取り付けハードウェアの衝突が防止されます。すべてのチューブはデバイスの前面に配線されています。(A')倒立顕微鏡への取り付けが可能。クランプのセットがデバイスをしっかりと保持します。クランプがデバイスをステージインサートに押し付けて、操作中のXYの動きを防ぎます。(B)圧力システム部品図。(i)圧力源に接続された外径6mmのポリウレタンチューブ。(ii)チューブ(i)を圧力レギュレータ(iii)に接続するG1/8-to-6 mmプッシュインアダプタ。次に、チューブはM5〜6mmのプッシュインアダプター(v)を介してソレノイド(vi)に接続され、最後に、チューブはルアーロックとバーブコネクタ(vii)に接続され、鈍い23Gニードル(viii)はマイクロ流体デバイスに接続された1/16インチODチューブに接続されます。(C)電子接続と組み立てられた圧力システムの概略図オーバーview。(i) Arduino、DAqカード、またはその他のマイクロコントローラによって生成されたTTLトリガ(+3.3-5 V)は、適切な電源(ii、24 VDC)とともに、MOSFET(iii)と回路図に示すようにソレノイドの電子接続に接続され、フライバックダイオード(iv)がソレノイド電源接続に接続された。TTL信号がマイクロコントローラからMOSFETのゲートに送信されると、+24VDCがノーマルクローズソレノイドに印加され、オンチップ油圧バルブが膨張します。TTL 信号が除去されると、圧力が解放され、オンチップ油圧バルブが収縮します。この図の拡大版を表示するには、ここをクリックしてください。
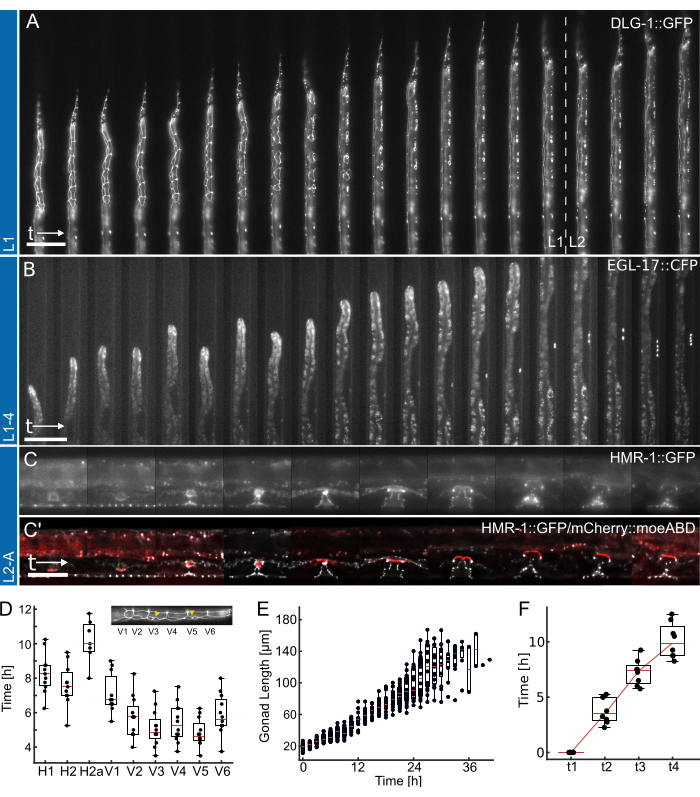
図4:代表的な結果。 (A)L1デバイスを使用して、一晩の飢餓から初期/中期のL2幼虫期に成長する上皮接合メーカー(ML2615、dlg-1(mc103[dlg-1::gfp]))を示す動物。目に見えるのは、分裂するシーム細胞と、L1幼虫後期に向かって移動および分裂するP細胞です。(B)L1-4装置を使用して、L1幼虫期後期からL4期初期まで成長する動物。目に見えるのは、1°運命の外陰前駆細胞(VPC)(AH1187、arIs92[egl-17::cfp])のマーカーであり、実験の初期に1つの細胞が見え、その後、L3幼虫期に2ラウンドの目に見える細胞分裂が続きます。(C)L2-Aデバイスを使用して、L2幼虫期後期から成体初期まで成長する動物。見えるのは、上皮接合器メーカー(AH5786, hmr-1(cp21[hmr-1::gfp + LoxP]))で、異なるトロイダル構造を形成する外陰部組織の発達を強調し、子宮アンカー細胞(AC)のマーカーと結合した画像(AH5786, qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)])は、L3幼虫期の終わりに向かって外陰部組織に侵入し、組織をつないでいます。すべての実験(A-C)では、FOVは動物の一部のみが見えるように初期設定されています。実験が進むにつれて、動物は、動物の成長の結果としてチャネル軸に沿って移動する特徴でチャネルをより多く埋めます。(D)L1幼虫期に個々のシーム細胞分裂が始まる時間(n = 12)。挿入は、前後の身体軸に沿ってシーム細胞のアイデンティティ(H1-V6)を強調表示します。(E)図4B(n = 19)の動物の生殖腺の成長を経時的に示します。(F)外陰部の形態形成における4つの異なる発生時点(t1-t4)に到達するのに必要な時間を示しており、画像化されたすべての動物(n = 7)の一貫した移行を示しています。スケールバーは、(A,B)50μm、(C)25μmです。フルタイムコースについては、Supplementary Movie 1、Supplementary Movie 2、Supplementary Movie 3をご覧ください。箱ひげ図には、中央値 (赤い線) と、上位四分位数と下位四分位数、および外れ値を除いた分布の極端を示す棒グラフが表示されます。この図は、Berger et al.18から引用されています。この図の拡大版を表示するには、ここをクリックしてください。
補足動画1:一晩の飢餓から初期のL2段階まで成長する単一の C.エレガンスの 幼虫。 最大強度の投影落射蛍光画像(投影の全高は1.5μm)が、それ以外は未処理の形式で表示されます。指定したステージで発生するすべてのシーム細胞分裂および融合イベントが表示されます(上)。特徴は、DLG-1::GFP(上皮接合部)マーカーを使用して、15分間隔で合計25時間にわたって概説されます。この映画は、Berger et al.18から再利用されています。 この映画をダウンロードするには、ここをクリックしてください。
補足動画2:L1後期からL4期初期にかけて発育する一匹の幼虫で、EGL-17::CFPマーカー(1°-fated vulval precursor cell (VPC))を発現している。初期のL2(~400分)では、EGL-17::CFP蛍光がP6.pに現れ、強度が継続的に増加します。L3では、P6.pは2回連続して分裂し、外陰部の1細胞、2細胞、および4細胞の段階を形成します。画像は 30 分間隔で、合計 34 時間表示されます。この映画は、Berger et al.18から再利用されています。 この映画をダウンロードするには、ここをクリックしてください。
補足動画3:上面図:L3段階からL4/成体移行期までの発達中の外陰部のZ投影。下面図:同じ外陰部の経時的なX投影。どちらの図も、VPCの最初の分裂、続いてトロイドの陥入、形成、拡大、そして反転中の崩壊を示しています。落射蛍光画像は、クロッピング、デコンボリューション、レジストレーション、および投影後に表示されます。特徴は、HMR-1::GFPマーカー(皮下組織およびVPC)およびmCherry::moeABDマーカー(ACの輪郭)によって概説されます。この映画は、Berger et al.18から再利用されています。 この映画をダウンロードするには、ここをクリックしてください。
補足ファイル1:L1デバイスのCADファイル。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:L1-4デバイスのCADファイル。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル3:L2-AデバイスのCADファイル。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル4:L3-AデバイスのCADファイル。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル5:L4-AデバイスのCADファイル。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル6:食品流通構造のCADファイル。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル7:バルブレイヤーのCADファイル。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この記事では、C.エレガンスの4つの幼虫期から成体初期までのさまざまな発生過程の高解像度イメージングと追跡に適した、独自のマイクロ流体長期イメージングプラットフォームの操作について説明しました18。このイメージング法などを用いて、in vivoで発生過程を経時的に追跡する能力は、C.エレガンス研究の多くの分野で不可欠となり、これまでアクセスできなかった疑問に答えることを可能にした23,24,29。
寒天パッドを使用した従来のイメージング方法や、以前に発表されたマイクロ流体ベースの長期イメージング戦略とは対照的に、このアプローチでは、実験全体を通じて線虫の同一性と向きが保持されるため、複雑な発生プロセスを経時的に追跡することができます。発達段階に関係なく、動物は41の平行トラップチャネルの1つに限定され、それぞれがオンチップの食物供給に接続され、大きな油圧バルブで覆われています。閉じ込められたすべてのワームの固定化は、油圧バルブの膨張によって行われ、画像取得中にのみワームがカバーガラスに押し付けられます。狭い間隔のトラップチャネルアレイにより、ハイスループットイメージングが可能になり、1つの視野内で複数の動物を見ることができます。長期イメージングデバイスは、ほとんどの顕微鏡セットアップと互換性があり、最小限の追加ハードウェア(1000ドル未満)で、既存のハードウェアに変更を加える必要はありません。デバイスの操作は意図的にシンプルであるため、すべてのユーザーは上記のプロトコルと概説された結果に従ってすぐに学習できるはずです。
簡単に言うと、動物は最大2.5の幼虫期にわたってオンチップでイメージングできます(図1C)。動物は最初に同期され、オンチップに直接ロードされるか(L1デバイス)、または目的の発生段階までNGMプレートに播種されます(L1-L4およびL2-Aデバイス)。オンチップの動物は、高濃度のバクテリア懸濁液を使用して給餌され、イメージングソフトウェアによって作動するオンチップ油圧バルブを使用して固定化されます(図1B)。動物は注射器を使用してトラップチャネルに操作され、頭を食物供給に向けて慎重に動物を向け、最後にトラップチャネルの端で動物をトラップします(図1A および 図2)。注射器、鈍器、チューブに空気が閉じ込められないように注意する必要があります。気泡は動物の位置を乱しやすくなります。PDMS材料は、透明性が高く、非蛍光性であり、薄いカバーガラスに対して密封されているため、デバイスはほとんどのイメージングモダリティ18、19、24と互換性がある(図4、 補足動画1、補足動画2、 および 補足動画3)。ただし、長時間の露光や高い励起強度は動物の生存率に容易に影響し、光退色を引き起こすため、イメージング条件を選択する際には注意が必要です。
このイメージング方法の提示されたバージョンに加えて、プロトコルに対するいくつかの変更が可能であり、すでに利用可能です。最も直接的な修正は、標準的な細菌株、例えば、RNAi発現細菌18 または異なる栄養価を持つ細菌32に置き換えることである。細菌株は、密度の違いを考慮してOptiprep含有量を調整することで容易に交換できます。同様に、任意の数の化合物、例えば、オーキシン、栄養素、または低分子薬物化合物を細菌性食品に添加することができ、それらの効果は、プロトコールにいかなる変更も必要なく、 生体内で直接観察される。特に、オーキシン誘導性タンパク質分解や、時限的または可逆的な曝露が必要なアプリケーションのために、形状や操作を変更せずにデバイスのレイアウトに食品入口を追加することで、培地交換デバイスが開発されました。追加のインレットにより、1つの食品源についてここに示されているのと同じ方法で、デバイスに取り付けられた2つの異なる条件(例えば、オーキシンとオーキシンなし)を簡単に切り替えることができます。その結果、変化が直接観察されます。また、油圧バルブがデバイス上のすべてのユニットで共有されるのではなく、ユニットごとに分離されているデバイスのバリエーションも開発され、同じデバイス内で複数の条件を画像化して個別に実験できるため、バルブの作動と取得時間が長いことによる潜在的な悪影響が軽減されます。最後に、Berger et al.18に記載されている元のデバイスバリアントを超えて、L3-AおよびL4-A(ここで紹介)の2つの新しいデバイスバリアントが開発され、L3中期またはL4中期の段階から成人期までのイメージングが可能になりました。これらの変更の目的は、実験の開始時間を後の幼虫期に遅らせることであり、これにより、初期の発生段階が関心がないアプリケーションにより大きな動物をロードできるようにすることです。
開示事項
著者は、競合する利益や金銭的な利益を宣言しません。
謝辞
Hajnal研究室の皆さんには、この原稿に対する批判的な議論とコメントをいただき、感謝いたします。また、NIH研究インフラストラクチャープログラム局(P40 OD010440)が資金提供する C.エレガンス 遺伝学センターCGCにも感謝しています。さらに、Galli研究室(Hubrecht Institute)、Conradt研究室(University College London)、van den Heuvel研究室(ユトレヒト大学)のメンバーには、提示されたプロトコルに関する貴重なご意見をいただき、感謝の意を表したいと思います。この研究は、スイス国立科学財団(Swiss National Science Foundation)の31003A-166580号からAHへの助成金、スイスがん連盟(Swiss Cancer League)の4377-02-2018号からのAHへの助成金、ETHチューリッヒのAdMへの資金提供によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 3/2 solenoid valve | Distrelec | 154-22-898 and 154-22-899 | Alternative to above. Solenoid valve connecting the pressure regulator to the on-chip valve. |
| Arduino | Distrelec | 301-01-956 | Optional microcontroller depending on the selected controller and interface. |
| Bacto-Tryptone | Thermo Fisher Scientific | 211705 | For L Broth production. |
| Bacto-Yeast | Thermo Fisher Scientific | 212750 | For L Broth production. |
| Blunt needle 23G | Gonano Dosiertechnik | GGA723050 | Blunt needle connecting the 1/16" tubing to a syringe. |
| Blunt needle 30G | Gonano Dosiertechnik | IG-TE730050 | Blunt needle connecting the 1/32" tubing to a syringe. |
| C. elegans Construct 1 | NA | NA | AH5786 LGI: hmr-1(cp21[hmr-1::gfp + LoxP]) Marston, D.J. et al. MRCK-1 drives apical constriction in C. elegans by linking developmental patterning to force generation. Curr. Biol. 26 (16), 2079-2089. 2016. |
| C. elegans Construct 2 | NA | NA | AH1187 LGII: arIs92[egl-17::cfp] Yoo, A.S., Bais, C., Greenwald, I. Crosstalk between the EGFR and LIN-12/Notch pathways in C. elegans vulval development. Science. 303 (5658), 663-666. 2004. |
| C. elegans Construct 3 | NA | NA | AH5786 LGV: qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)] Ziel, J.W., Hagedorn, E.J., Audhya, A., Sherwood, D.R. UNC-6 (netrin) orients the invasive membrane of the anchor cell in C. elegans. Nat. Cell Biol., 11 (2), 183-189. 2009. |
| C. elegans Construct 4 | NA | NA | ML2615 LGX: dlg-1(mc103[dlg-1::gfp]) Vuong-Brender, T.T.K., Suman, S.K., Labouesse, M. The apical ECM preserves embryonic integrity and distributes mechanical stress during morphogenesis. Development. 144 (23), 4336-4349. 2017. |
| Cable | Distrelec | 143-46-644 | Needed if selecting the solenoid from distrelec. Cable connecting the solenoid to the MOSFET. |
| Chlorotrimethyl silane | Sigma Aldrich | 386529-25ML | Silane for wafer passivation. |
| Cholesterol | Sigma Aldrich | C8667 | For S-Basal production. |
| Flyback Diode | Distrelec | 110-52-628 | Flyback diode protecting the microcontroller. |
| Hollow steel pin | Gonano Dosiertechnik | GGA7R23050 | 23G hollow steel pin connecting the 1/16" tubing to the device. |
| L Broth | NA | NA | Prepared in house following standard recipe. 10 g Bacto-tryptone, 5 g Bacto-yeast, 5 g NaCl, H2O to 1 litre, pH to 7.0 using 1 M NaOH |
| Long-term Imaging Device L1 | NA | NA | Long-term imaging device for L1 to early/mid L2 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L1-4 | NA | NA | Long-term imaging device for mid L1 to mid L4 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L2-A | NA | NA | Long-term imaging device for mid L2 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L3-A | NA | NA | Long-term imaging device for mid L3 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L4-A | NA | NA | Long-term imaging device for mid L4 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| M9 Buffer | NA | NA | Prepared in house following standard recipe. |
| MOSFET | Distrelec | 303-41-391 | Metal-oxide-semiconductor field-effect transistor, used to switch the 24VDC required for the solenoid. |
| NGM plates | NA | NA | Prepared in house following standard recipe. |
| Nylon Luer-Fitting | Fisher Scientific | 11776048 | Adapter from OD 6mm tubing to 23G blunt needle. |
| Optiprep | Sigma Aldrich | D1556 | Density matching liquid. |
| PDMS | Ameba | Elastosil RT601A/B | PDMS elastomer kit. |
| Pluronic F-127 | Sigma Aldrich | P2443 | Non-ionic surfactant. |
| Potassium dihydrogen phosphate | Sigma Aldrich | 1.37039 | For S-Basal production. |
| Potassium hydrogen phosphate | Sigma Aldrich | 1.05099 | For S-Basal production. |
| Power Supply 24VDC | Distrelec | 301-63-304 | 24VDC power supply. Select a power supply suitable for the solenoid selected. |
| Precision pressure regulator | Distrelec | 154-23-578 | Alternativ to above. Pressure regulator. |
| Pressure Gauge G1/8 | Distrelec | 154-23-643 | Pressure gauge attaches to the pressure regulator. |
| PU Tubing OD 6mm | Distrelec | 154-23-866 | Tubing connecting the pressure source and regulator, as well as regulator and solenoid valve. |
| Push-in fitting G1/8 to 6mm | Distrelec | 301-69-330 | Alternativ to above. 2x Push-in fitting attaches to the pressure regulator and connects to the 6mm tubing. |
| Push-in fitting M5 to 6 mm | Distrelec | 301-69-459 | 2x Push-in fitting attaches to the solenoid and the 6mm tubing. |
| S-Basal Buffer | NA | NA | Prepared in house following standard recipe. 5.85 g NaCl, 1 g K2HPO4, 6 g KH2PO4, 1 ml cholesterol (5 mg/ml in ethanol), H2O to 1 litre. Sterilize by autoclaving. |
| Sodium Chloride | Sigma Aldrich | S9625 | For L Broth and S-Basal production. |
| Sodium hydroxite (5M) | Sigma Aldrich | 567530 | Sodium hydroxide used when bleaching C. elegans (prepare solution at 5M concentration) |
| Sodium hypochlorite (5%) | Sigma Aldrich | 1.05614 | Sodium hypochlorite used when bleaching C. elegans (prepare solution at 5% concentration) |
| Strainer 10 µm | pluriSelect | 43-10010-40 | Alternative for bacteria food preparation, especially if smaller devices are used. |
| Strainer 5 µm | pluriSelect | 43-10005-40 | Strainer used to filter L1 larvae after overnight starvation and bacteria after completed food preparation. |
| SU-8 | Gersteltec | GM1050 | SU-8 for height from 1-10 µm. |
| SU-8 | Gersteltec | GM1060 | SU-8 for height from 5-30 µm. |
| SU-9 | Gersteltec | GM1070 | SU-8 for height from 15-200 µm. |
| Syringe 1 mL | Fisher Scientific | 11338763 | 1mL syringe. If using a different type ensure that the syringe body and plunger are stiff, such that they won't be deformed by the syringe pump. |
| Syringe Pump | WPI | Al1000-220 | Syringe pump (https://www.wpiinc.com/var-2300-aladdin-single-syringe-pump.html). |
| Tube 15 mL | Fisher Scientific | 50-809-220 | Tube used for worm bleaching and bacteria preparation. |
| Tube 2 mL | Fisher Scientific | NC1186931 | Tube used for worm preparation and bacteria preparation. |
| Tube 50 mL | Fisher Scientific | 50-465-232 | Tube used for bacteria preparation and growth. |
| Tweezer SMD | Brütsch Rüegg Werkzeuge | 448980 | Tweezers used to plug the 1/32" tubing into the device. |
| Tygon tubing 1/16" | Fisher Scientific | 642002 | Flexible 1/16" OD tubing connecting most components to the device. |
| Tygon tubing 1/32" | Fisher Scientific | 641900 | Flexible 1/32" OD tubing connecting the bacteria supply to the device. |
| UV KUB-3 | Kloe | NA | Mask aligner and UV exposure system. |
| Wafer | Siegert Wafer | 4P0/>1/525±25/SSP/TTV<10 | Silicon Wafer. |
| Waste Container | NA | NA | Prepared in house using a 2mL tube or a cryo vial and hollow steel pins. |
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved