Method Article
모든 유충 단계에서 이미징하는 고해상도 C. elegans
요약
이 프로토콜은 배아 후 발달 전반에 걸친 미세유체 기반 예쁜꼬마선충(C. elegans ) 타임랩스 이미징을 설명합니다.
초록
Caenorhabditis elegans 는 생물학에서 가장 널리 연구되고 가장 잘 이해되는 동물 모델 중 하나가 되었습니다. 예쁜꼬마선충 이 모델 유기체로서 성공할 수 있었던 열쇠는 불변 세포 계통, 투명성, 유전적 다루기 쉬운 세 가지 특징입니다. 이를 통해 생체 내에서 직접 다양한 현미경 기반 연구에 이상적입니다. 살아있는 예쁜꼬마선충, 유충 및 성충은 종종 이미지 획득 중에 움직이지 않아야 합니다. 기존의 고정화 방법은 특히 타임랩스 이미징 응용 분야에서 동물 발달에 부정적인 영향을 미칩니다. 여기에서는 새로운 미세유체 이미징 방법에 대한 자세한 설정 및 작동 프로토콜이 소개되며, 이는 전통적인 한천 기반 고정화 및 기타 미세유체 전략과 관련된 제한 사항을 해결합니다. 이 접근 방식을 사용하면 다양한 유충 단계에서 동시 실시간 이미징을 가능하게 하는 동시에 시간이 지남에 따라 벌레의 방향과 정체성을 보존할 수 있습니다. 이를 달성하기 위해 미세유체 트랩 채널 어레이가 사용되며, 성장과 탈피를 수용하면서 안정적인 웜 방향을 유지하도록 정밀하게 설계된 기하학적 구조가 있습니다. 고정은 활성 유압 밸브에 의해 촉진되며, 이 밸브는 이미지를 획득하는 동안에만 커버 유리에 웜을 고정하기 위해 압력을 가합니다. 이 설계는 웜 생존 능력이나 발달 타이밍에 미치는 영향을 최소화하면서 고해상도 이미징을 가능하게 합니다.
서문
C. elegans 이미징은 응용 프로그램, 원하는 처리량 및 해상도에 따라 여러 가지 방법으로 수행할 수 있습니다. 고해상도가 필요한 경우 표준 방법은 유리 슬라이드, 아가로스 및 커버 유리의 간단한 구조인 한천 패드 1,2,3을 사용합니다. 이 슬라이드에 있는 동물들은 커버 유리가 가하는 압력에 의해 움직이지 못합니다. 마취제, 예를 들어 레바미솔 또는 아지드화나트륨 1,2을 첨가하여 고정성을 더욱 개선할 수 있으며, 이를 통해 한천 패드에 있는 동물이 완벽하게 정지하고 다양한 초해상도 방법2을 포함하여 고해상도로 이미지화할 수 있습니다. 불행히도, 한천 패드는 높은 압력과 마취제의 조합으로 발달 진행에 영향을 미치는 것으로 알려져 있으며, 발달을 지연시키거나 완전한 발달 정지를 유발합니다 4,5.
이러한 표준 방법 외에도 최근 몇 년 동안 여러 미세 유체 방법론이 등장했으며, 각 방법론은 장점과 단점 또는 특수 사용 사례 6,7,8,9,10,11,12,13,14,15,16,17,18,19. 예를 들어, Gritti 등[20]은 지렁이를 큰 방 안에 가두는 방법을 소개했다. 이 챔버에 배치된 배아는 현미경의 지정된 관심 영역 내에 머무르면서 자유롭게 발달하고 움직입니다. 일반적으로 효과적이기는 하지만, 이 접근법은 밝은 형광 마커의 사용으로 제한됩니다. 보다 최근에 Keil et al.21은 이미지 획득 중에 동물을 구속하기 위해 온칩 유압 밸브를 통합하여 원래 접근 방식의 일부 제한 사항을 해결하는 이 방법의 수정된 버전을 제안했습니다. 그러나 두 방법 모두 갇힌 벌레에 사용되는 것보다 더 큰 챔버를 사용하기 때문에 동물은 실험 내내 계속 움직이고 회전합니다. 결과적으로 발달 과정을 추적하는 것이 어려워지고 동물의 움직임을 보정하기 위해 광범위한 이미지 후처리가 필요합니다.
이러한 한계를 해결하기 위해 Berger et al.18 (그림 1)이 도입한 접근 방식, 즉 동물을 큰 방에 가두는 것이 아니라 더 짧은 발달 창(최대 2.5개의 유충 단계) 내에 동물을 수용하도록 설계된 트랩 채널에 수용하는 접근 방식이 적용되었습니다. 기존의 미세유체 방법과 달리 이 접근 방식은 실험 전반에 걸쳐 동물의 방향과 정체성을 보존하고 단일 장치 내에서 여러 유충 단계에 걸쳐 병렬로 여러 벌레의 고해상도 이미지를 획득할 수 있습니다.
동물은 실험 시작 시 채널 높이가 동물의 두께에 가까운 특수 채널 형상을 사용하여 갇혀 회전을 방지합니다. 채널 너비와 길이는 동물이 시간이 지남에 따라 이동하고 성장할 수 있도록 선택되어 털갈이와 한 유충 단계에서 다음 유충 단계로의 전환을 용이하게 합니다. 그런 다음 여러 트랩 채널을 나란히 배치하여 병렬화를 달성하여 단일 시야(FOV, 그림 1A')에서 여러 동물을 볼 수 있고 단일 장치 장치에서 최대 41마리의 동물을 이미지화할 수 있습니다(그림 1A). 칩에 있는 동물은 높이가 낮은 채널을 통해 고농축 박테리아 먹이 현탁액을 지속적으로 공급받으며, 동시에 트랩 채널 어레이의 끝에 동물을 가두는 데 도움이 됩니다(높이 단계, 그림 1A, 빨간색). Keil et al.21이 취한 접근 방식과 유사하게, 대형 유압식 온칩 밸브가 구현되어 이미지 획득 중에 팽창되어 동물을 커버 유리에 밀어 넣어 동물 고정을 개선할 수 있습니다(그림 1B). 유압 밸브 작동을 이미지 획득 기간으로만 제한하면 동물 발달에 대한 부정적인 영향을 최소화하여 모든 유충 단계에서 안정적인 발달을 보장합니다. Gritti et al.20 및 Keil et al.21에 의해 기술된 방법과 달리, 동물은 동일한 장치 내에서 배아 후 발달 전반에 걸쳐 이미지화할 수 없습니다. 대신, L1, L1-4, L2-A, L3-A 및 L4-A라고 하는 5개의 별개의 장치가 도입되어 전체 L1 단계와 초기 L2 단계, 중후반 L1 단계부터 중반 L4 단계부터 중반 L4 단계부터 청년기까지를 각각 포괄합니다(그림 1C). 이를 통해 배아 후 발달의 많은 부분을 중단 없이 이미징할 수 있습니다. 이 접근법은 L1에서 성체로 동물의 크기가 크게 증가하기 때문에 L1 동물에게 적합한 채널이 성체에게는 너무 작아 발달 정지를 초래하고, 성체에 적합한 채널은 L1에 비해 너무 커서 과도한 이동, 회전 및 동물이 트랩 채널을 탈출하기 때문에 취해집니다.
이 접근법을 사용하면 다양한 조직에 대한 신뢰할 수 있는 발달 진행이 이루어집니다18, 예를 들어 하피의 배아 후 발달(L1에서 L4 단계), 외음부 세포 운명의 유도(L2 및 L3 단계), 외음부 형태 형성(L3에서 성인기19) 및 앵커 세포 침입. 도입 이후 이러한 장기 이미징 장치는 다양한 프로세스를 연구하는 데 사용되었으며22,23 이 플랫폼은 AiryScan 초고해상도 현미경24과 같은 기술과 결합되어 이전에는 불가능했던 수많은 발견을 가능하게 했습니다.
다음에서는 이러한 장기 이미징 장치의 작동 측면을 단계별 프로토콜로 소개하여 시스템 설정 시 예상되는 결과와 몇 가지 잠재적인 문제를 강조합니다.
프로토콜
이 연구에 사용된 시약 및 장비의 세부 사항은 재료 표에 나열되어 있습니다.
1. 장치 제작
참고: 모든 장치는 아래 프로토콜을 사용하여 제작되었지만, 장치는 작성자가 직접 사용할 수 있습니다. 각 장치 유형에 대해 별도의 웨이퍼가 제작되며, 각 장치 웨이퍼는 높이가 다른 SU8의 두 층(즉, 식품 층 및 트랩 층)으로 제작됩니다. 밸브 웨이퍼는 1.3-1.6 단계를 생략하고 단일 높이가 SU-8인 별도의 웨이퍼에 제작됩니다. 실란은 독성이 있으며 부식성 증기를 방출합니다. 따라서 이 단계는 흄 후드에서 수행해야 합니다. 제작 절차에 대한 자세한 내용은 Berger et al.18을 참조하십시오.
- 공기 플라즈마를 사용하여 웨이퍼를 청소합니다.
- 첫 번째 SU8 레이어를 스핀 코팅한 다음 95°C에서 소프트 베이크를 수행합니다.
- 첫 번째 레이어를 노출시킨 다음 95°C에서 포스트 베이킹하고 현상합니다.
- 웨이퍼 개발 및 건조 후 플라즈마 세척을 다시 수행합니다.
- 두 번째 SU8 레이어를 스핀 코팅한 다음 95°C에서 소프트 베이크합니다(필요한 경우 65°C에서 초기 베이크 수행).
- 웨이퍼의 양쪽에 있는 정렬 마커를 사용하여 두 번째 마스크를 기존 특징에 정렬한 다음 두 번째 레이어를 노출시킵니다.
- 웨이퍼를 포스트 베이킹 및 현상한 다음 200°C에서 하드 베이크를 수행합니다.
- 웨이퍼를 클로로트리메틸 실란으로 최소 2시간 동안 처리합니다.
- 20g의 PDMS 프리폴리머(파트 A) 배치를 준비하고 1g의 가교제(비율 20:1, 파트 B)와 완전히 혼합합니다( 재료 표 참조).
- 10분 동안 또는 모든 거품이 사라질 때까지 가스를 제거하십시오.
- PDMS 혼합물 2mL를 제거하고 1.13단계를 위해 예약합니다.
- 나머지 PDMS 혼합물에 3g의 가교제를 더 첨가하고 완전히 혼합합니다(최종 비율 약 5:1).
- 20:1 PDMS 배치를 사용하여 장치 웨이퍼를 750rpm에서 30초 동안 스핀 코팅합니다.
- 밸브 웨이퍼를 알루미늄 접시에 넣고 그 위에 5:1 PDMS를 주조합니다. 약 10분 동안 장치 웨이퍼의 가스를 제거합니다. 가스를 제거한 후 피펫을 사용하여 남아 있는 기포를 제거합니다.
- 밸브와 장치 층을 모두 70°C에서 각각 약 15/20분 동안 굽습니다.
- 장치 및 밸브 층의 경화를 피펫 팁 또는 핀셋으로 부드럽게 프로빙하여 평가합니다. 밸브 층은 단단해야 하고 장치 층은 약간 끈적해야 합니다.
- 밸브 층을 분리하고 메스나 면도날을 사용하여 필요한 크기로 다듬습니다.
- 밸브 채널에 액세스 구멍을 뚫습니다(게이지 20).
- 장치 웨이퍼를 상단 조명이 장착된 실체 현미경 아래에 놓습니다.
- 밸브 층이 포함된 PDMS 조각을 장치 웨이퍼에 조심스럽게 놓습니다.
- 밸브와 장치 기능을 정확하게 정렬하여 레이어 사이에 갇힌 모든 공기를 제거합니다.
- 조립된 장치를 오븐에 옮기고 70°C에서 밤새 굽습니다.
- 웨이퍼에서 장치를 분리합니다.
- 남아 있는 모든 접근 구멍(게이지 20)을 펀칭합니다.
- 공기 플라즈마를 사용하여 PDMS를 커버 유리에 접착한 다음 접착된 장치를 70°C의 오븐에 몇 시간 동안 놓습니다.
2. 지렁이 준비
참고: 이 섹션에서는 많은 수(수백 마리)의 동물을 생성할 수 있는 표백을 통한 벌레 준비에 대해 설명합니다. 수동 피킹과 같은 다른 동기화 방법도 가능하지만 일반적으로 시간이 많이 걸리고 노동 집약적입니다. 프로토콜에 사용되는 모든 웜은 20°C에서 표준 프로토콜에 따라 유지되며 E. coli OP50이 파종된 NGM 플레이트에서 유지됩니다.
- 많은 육식 동물이 있는 접시에서 시작합니다.
- M9 버퍼를 사용하여 접시에서 동물을 씻어냅니다.
- 웜 현탁액에 5% NaClO와 5M의 NaOH를 추가합니다(1mL 웜 현탁액마다 200μL/100μL).
- 동물이 분해되기 시작할 때까지 표백 혼합물을 부드럽게 흔듭니다(~10분).
- 원심분리기 표백 혼합물을 실온에서 1300 x g 에서 1분 동안 사용합니다.
- 피펫을 사용하여 상등액을 제거하고 동일한 양의 신선한 M9 버퍼를 추가합니다.
- 다시 말하지만, 실온에서 1300 x g 에서 1분 동안 원심분리합니다.
- 상층액을 제거하고 펠릿화된 웜을 5mL의 새로운 M9 완충액이 있는 15mL 튜브로 옮깁니다.
- 20°C에서 밤새 흔듭니다.
- 웜 현탁액을 10μm 세포 여과기에 통과시킵니다.
- 실온에서 1300 × g 의 웜 현탁액을 1분 동안 원심분리합니다.
- 상등액을 버리고 동일한 부피의 M9 완충액에 웜을 다시 현탁시킵니다.
- 웜 혼합물을 실온에서 1분 동안 1300 × g 으로 다시 원심분리합니다.
- 상층액을 제거하고 웜을 NGM 플레이트로 옮깁니다. L1 유충이 필요한 경우 즉시 사용하십시오.
- 벌레가 원하는 발달 단계에 도달하면 0.2μm 필터를 통해 여과된 새로운 S-Basal 완충액을 사용하여 플레이트에서 벌레를 씻어냅니다.
- 벌레가 중력에 의해 침전되도록 하거나 실온에서 750 × g 에서 1분 동안 원심분리하여 펠릿으로 만듭니다.
- 상층액을 버리고 동일한 부피의 새로운 S-Basal 완충액을 추가합니다.
- 침전 또는 원심분리 단계를 반복합니다(단계 2.16 및 2.17).
- 상층액을 제거하고 동일한 부피의 신선한 S-Basal 완충액을 추가합니다.
- 침전 또는 원심분리 단계를 마지막으로 한 번 수행합니다.
- 대부분의 상층액을 제거합니다.
- 실험이 시작될 때까지 벌레를 튜브에 보관하십시오.
3. 박테리아 준비
알림: 다양한 박테리아 균주(예: OP50, NA22, HT114 등)를 칩에 사용할 수 있습니다. 밀도 차이를 보상하기 위해 식품 믹스에 추가된 밀도 구배 매체의 비율을 조정합니다. 모든 버퍼는 0.2μm 필터를 통과하여 미립자를 제거합니다.
- 원심분리 튜브, 멸균 삼각 플라스크 등의 2 x 20mL에 LBroth 40mL를 준비합니다.
- 스톡 플레이트에서 채취한 박테리아로 LB를 접종합니다.
- 37°C(~16시간)에서 밤새 흔들면서 박테리아를 성장시킵니다(OD600 = 1.9).
- 박테리아를 3000 x g 에서 10분 동안 원심분리기합니다.
- 상층액을 제거하고 각 튜브에 2mL의 새 S-Basal 완충액을 추가합니다. 모든 튜브를 결합합니다.
- 피펫을 사용하여 박테리아를 기계적으로 재현탁시킵니다.
- 박테리아를 3000 x g 에서 5분 동안 원심분리합니다.
- 상층액을 제거하고 새로운 S-Basal 완충액 2mL를 다시 추가합니다.
- 피펫을 사용하여 박테리아를 기계적으로 재현탁시킵니다.
- 박테리아를 3000 x g 에서 5분 동안 원심분리합니다.
- 가능한 한 많은 상층액을 제거하고 모든 박테리아를 기계적으로 재현탁시키기 전에 1mL의 신선한 S-Basal 완충액을 추가합니다.
- 0.60mL의 밀도 구배 배지, 0.38mL의 S-Basal + 1중량%의 Pluronic F-127(비이온 삼중 블록 공중합체, 여기서는 PF로 표시)을 OP50 박테리아 현탁액 1mL와 결합하거나 0.65mL의 밀도 구배 배지, 0.33mL의 S-Basal + 1중량% PF를 1mL의 NA22 또는 HT114 박테리아 현탁액과 결합합니다.
- 와류 믹서를 사용하여 음식 준비를 철저히 혼합하십시오.
- 5μm 또는 10μm 세포 여과기를 통해 식품을 여과합니다. 더 작은 장치, 예를 들어 L1 장치를 사용할 때 더 작은 스트레이너가 특히 권장됩니다.
알림: 식품은 최대 2일 동안 실온에서 보관할 수 있습니다.
4. 칩 준비
알림: 그림 2 참조view 장치, 튜브 및 연결의. 모든 버퍼는 0.2μm 필터를 통과하여 먼지를 제거합니다. 다음 단계에서 언급된 강철 핀은 더 큰 OD 튜브(1/16")를 PDMS 장치에서 제작된 작은 직경의 구멍에 연결하는 데 사용되는 짧고 속이 빈 튜브를 나타냅니다. 이 강철 핀은 튜브의 내경에 간단히 삽입된 다음 PDMS 재료에 밀어 넣어 둘을 효과적으로 연결합니다.
- 먼저 주사기에 탈이온수(DI)를 채웁니다.
- 23G 바늘과 끝에 속이 빈 강철 핀(90° 각도로 구부러짐)이 있는 긴 1/16" 튜브 조각을 부착합니다. 튜브는 솔레노이드에서 현미경 스테이지까지 확장될 수 있을 만큼 충분히 길어야 합니다.
- 주사기의 DI water를 튜브에 채우고 강철 핀을 펀칭된 구멍에 삽입하여 밸브 입구에 연결합니다(그림 2A, J).
- 주사기와 바늘을 제거한 다음 튜브를 오프칩 솔레노이드에 부착합니다(그림 2A, J).
- 이미징 소프트웨어를 사용하여 솔레노이드를 켜고 몇 분 동안 장치에 압력을 가하여 밸브에서 모든 공기를 배출합니다. 어둡게 나타나고 PDMS 재료 속으로 사라져야 하는 칩의 공기-물 인터페이스를 육안으로 확인하여 완료를 확인합니다(그림 2B).
- 솔레노이드를 끕니다(그림 2C).
- 1mL 주사기에 여과된 박테리아 용액을 채웁니다(~0.5mL의 음식으로 충분).
- 30G 바늘과 1/32인치 튜브의 긴 조각을 바늘에 부착합니다.
- 플런저를 눌러 바늘과 부착된 튜브를 모두 채우고 주사기나 튜브에 공기가 남아 있지 않도록 합니다.
- 튜브의 손상을 방지하기 위해 핀셋을 사용하여 1/32" 튜브를 미세유체 장치의 식품 주입구에 직접 삽입합니다(SMD 핀셋 권장)(그림 2D,K).
- 주사기를 주사기 펌프에 놓습니다(그림 2D).
- 뒷면의 나비 나사를 사용하여 주사기 플런저를 눌러 장치에 액체를 채웁니다. 열린 각 연결부에 액체 한 방울이 나타나야 합니다(그림 2D, 화살표).
- 밀봉된 강철 핀(1/16" 튜브의 짧은 조각이 부착되고 연소되어 밀봉된 강철 핀)으로 웜 입구와 배출구를 모두 막습니다(그림 2E, L).
- 나비 나사를 사용하여 추가 압력을 가하여 장치에 남아 있는 공기를 제거합니다(그림 2E, 화살표).
- 배출구에서 막힌 핀을 제거하고 폐기물 용기를 부착합니다(냉동 또는 마이크로 원심분리기 튜브로 제작, 뚜껑에 두 개의 강철 핀이 끼워져 접착제로 고정됨). 폐기물 용기는 1/16" 튜브의 짧은 조각을 사용하여 연결되며 한쪽 끝은 용기에 부착되고 다른 쪽 끝은 속이 빈 강철 핀(90° 구부러짐)에 연결됩니다(그림 2F, G, M).
- 주사기를 밀어 폐기물 용기가 제대로 연결되어 있고 시스템에 막힌 부분이 없는지 확인하십시오. 이를 위해 액체가 폐기물 튜브를 통해 흐를 때까지 시스템을 통해 소량의 액체를 밀어 넣습니다(주사기 펌프의 나비 나사 돌림).
- 두 번째로 막힌 강철 핀을 제거합니다.
- 웜 주입구에 작은 액체 방울이 나타날 때까지 주사기를 밉니다(그림 2H,N).
- 23G 바늘을 사용하여 S-Basal 버퍼로 채워진 1mL 주사기에 더 긴 1/16" 튜브(15-20cm) 조각을 부착합니다(그림 2H,N).
- 튜브의 다른 쪽 끝에 직선 23G 강철 핀을 부착합니다.
- 바늘과 튜브에 주사기의 완충액을 채워 주사기나 튜브에 공기가 남아 있지 않도록 합니다.
- 튜브 끝에 있는 강철 핀을 웜이 들어 있는 튜브에 삽입합니다.
- 튜브를 통해 소량의 액체를 밀어 넣어 공기가 남지 않도록 합니다.
- 웜을 튜브 안으로 당기되 주사기 안으로 당기지 마십시오.
- 강철 핀에 작은 액체 방울이 나타날 때까지 웜에 연결된 주사기를 밉니다(그림 2H).
- 강철 핀을 웜 흡입구에 삽입합니다(그림 2I).
알림: 장치 준비는 최종 웜 준비 전에 수행할 수 있으며 웜이 준비될 때까지 현미경에 그대로 둘 수 있습니다.
5. 웜 로딩 및 이미징
- 장치를 저배율(5x 또는 10x)의 현미경 또는 해부 현미경에 놓습니다.
- 현재 사용 중인 장치 장치를 식별하고 명시야 조명을 사용하여 웜 주입구를 찾습니다.
- 흡입구가 시야의 한쪽에서 보이고 트랩 채널 흡입구의 뒷면이 다른 쪽에서 보이도록 장치를 배치합니다.
- 웜 주사기의 플런저를 부드럽게 누릅니다. 액체는 입구에서 채널 어레이를 통해 출구로 눈에 띄게 흐를 것입니다. 박테리아의 존재와 밀도 구배 매체의 추가로 인한 굴절률의 차이는 액체 흐름을 분명하게 만듭니다.
- 웜이 입구에서 나타나고 채널 어레이의 뒤쪽으로 흐르는지 확인합니다.
- 동물을 채널 어레이 쪽으로 부드럽게 밀어 넣습니다. 동물이 채널을 향하면 채널로 밀어 넣고 다른 동물에 대해 반복합니다.
알림: 동물은 음식에 쉽게 접근할 수 있도록 머리가 배출구를 향하도록 해야 합니다. 그들은 플런저를 밀고 당기고 수영하여 방향을 잡을 수 있습니다. - 충분한 동물이 갇히면 벌레 흡입구에 여전히 부착되어 있는 주사기를 현미경 스테이지에 놓고 실험 내내 그곳에 남아 있습니다. 주사기에서 웜 튜브를 잠시 분리하여 축적된 압력을 해제한 다음 뭉툭한 바늘에 조심스럽게 다시 부착해야 할 수 있습니다.
- 해부 현미경에 하중을 가한 경우 장치를 이미징 현미경으로 옮기십시오. 튜브는 칩에 부착된 상태로 유지될 수 있으며 주사기는 펌프에 연결됩니다.
- 주사기 펌프를 켜고 0.5μL의 경우 1μL/h의 사전 설정된 속도로 실행하고, 0.5μL의 경우 100μL/h만큼 속도를 높인 다음 다시 1μL/h로 줄입니다. 이 주기는 전체 실험에 대해 자동으로 반복됩니다. 펌프를 프로그래밍하는 방법에 대한 정보는 장비의 사용 설명서를 참조하십시오.
- 장치를 현미경 s에 놓습니다.tage 단단히 고정되었는지 확인합니다(장착 메커니즘에 대한 제안은 그림 3A에서 찾을 수 있음).
- 이미징 현미경에 로딩이 수행되지 않은 경우 저배율에서 관심 장치 단위를 식별합니다.
- 원하는 이미징 배율로 전환합니다.
참고: 장치는 모든 대물렌즈 유형과 호환됩니다. - 트랩 채널 어레이 내에서 관심 동물과 관심 영역을 식별하고 원하는 이미징 조건을 설정합니다.
- 온칩 밸브를 사용하여 원하는 이미징 조건에서 이미지를 촬영하고 이미지 획득 10초 전에 솔레노이드를 통해 작동하므로 동물이 제자리에 고정됩니다.
알림: 온칩 밸브를 작동하면 동물이 길어지고 평평해지며, 이미징 관심 영역(ROI)을 조정해야 할 수 있습니다.
6. 설치 준비
참고: 이 섹션은 장치 제어 메커니즘의 초기 준비를 참조하며 각 실험 전에 반복할 필요가 없습니다. 그림 3B,C를 참조하십시오. 많은 솔레노이드는 더 높은 전압을 필요로 하기 때문에 솔레노이드는 마이크로 컨트롤러에 직접 연결되지 않고 릴레이 또는 MOSFET을 통해 연결될 가능성이 높습니다(그림 3C 참조).
- 가압된 공기 공급원(예: 벽 공급 설비 또는 가스 실린더)을 식별합니다.
- 0mm 튜브(벽 소스)를 사용하여 압력 소스를 적절한 압력 조절기(2-6bar 압력 범위)에 연결하거나 적절한 조절기를 가스 실린더에 직접 부착합니다.
- 압력 조절기를 솔레노이드 밸브 입력(6mm 튜브, 그림 3B 참조)에 연결합니다.
- 솔레노이드를 현미경에 최대한 가깝게 배치하십시오.tage(s에서 ~0.5-1m를 두십시오.tage가 제안되지만 필요한 경우 더 먼 거리도 가능함).
- 솔레노이드 밸브를 선택한 컨트롤러에 전자적으로 연결합니다. 별도의 마이크로 컨트롤러 보드(예: Arduino) 또는 기존 DAq 카드를 사용하여 제어하는 것과 같은 다양한 옵션을 사용할 수 있습니다.
7. 정리 및 보관
- 실험이 완료되면 현미경에서 장치를 제거합니다.
- 침지 액체를 제거합니다. 이멀젼 오일은 유기 용제(예: 아세톤, 메탄올 등)로 제거할 수 있습니다.
- 장치를 평평한 표면에 놓고 밸브 튜브를 제외한 모든 튜브를 분리합니다. 각 튜브를 안전하게 분리하려면 PDMS에 가까운 PDMS를 누르고 부드럽게 당깁니다. 덮개 유리가 깨질 수 있으므로 장치를 들어 올리거나 구부리지 마십시오.
- PDMS 표면을 70% 에탄올로 세척합니다.
- 밸브 튜브가 부착된 상태로 장치를 실온에 보관하십시오.
알림: 밸브 튜브를 다시 채울 필요 없이 모든 장치가 사용될 때까지 장치를 재사용할 수 있습니다. 그러나 밸브 튜브의 물은 장기간에 걸쳐 증발하여 결국 다시 채워야 할 수도 있습니다.
결과
장치 설계 및 치수
4개의 유충 단계를 모두 수용할 수 있도록 5개의 고유한 장치가 설계되었습니다. 이러한 장치는 다음과 같이 지정됩니다 : L1, 부화 직후에 적재되고 L2 단계까지 이미징 된 L1 유충; L1-L4, L1 중후반부터 L4 초중반까지 유충을 보유할 수 있음; L2-A, 대략 L2 중반 단계부터 젊은 성인기까지의 동물에게 적합합니다. L3-A, 대략 L3 중반 단계부터 젊은 성인기까지의 동물; L4-A는 대략 L4 후반기부터 청년기까지의 동물을 수용합니다.
모든 장치는 웜 주입구, 1개(또는 미디어 교환의 경우 2개) 박테리아 음식 주입구 및 일반 폐기물 배출구로 구성된 동일한 필수 레이아웃을 따릅니다. 입구와 출구 부분 사이에는 41개의 병렬 트랩 채널 어레이가 배치되며, 입구 및 출구 측은 낮은 높이의 식품 공급 채널에 의해 효과적으로 분리됩니다(그림 1A, A'). 채널 치수는 L1 장치의 경우 400/15μm, L1-L4 장치의 경우 575/22μm, L2-A 장치의 경우 800/27μm, L3-A 장치의 경우 900/30μm, L4-A 장치의 경우 1000/65μm로 실험 시작 시 로드된 웜보다 훨씬 더 길고 넓도록 선택되었습니다(보충 파일 1, 보충 파일 2, 보충 파일 3, 보충 파일 4 및 보충 파일 5).
채널 길이는 실험이 끝날 때까지 동물이 도달한 크기와 일치하도록 선택되었으며, 너비는 실험 시작 시 지렁이가 채널 너비의 약 2/3를 차지하도록 선택되었습니다. 이 디자인은 털갈이 중에 성장과 움직임을 위한 충분한 공간을 허용하면서 벌레가 회전하거나 회전하는 것을 방지합니다. 너비와 달리 채널 높이는 실험 시작 시 벌레의 두께에 가깝게 설정되었습니다: 초기 L1 유충의 경우 8μm, 중/후기 L1 유충의 경우 12μm, 중-L2 유충의 경우 15μm, 중-L3 유충의 경우 17.5μm, L1, L1-L4, L2-A, L3-A에 해당하는 후기 L4 유충의 경우 22.5μm, 및 L4-A 장치. 감소된 채널 높이와 신중하게 선택된 너비(0.5-0.6의 높이 대 너비 비율 유지)가 결합되어 웜이 고정된 방향으로 유지되도록 합니다. 특히, 채널 높이가 충분히 작으면 모든 웜이 원하는 측면 방향으로 일관되게 배치됩니다.
식품 공급 채널은 L1의 경우 3μm, 다른 모든 장치의 경우 5μm 높이로 제작되어 동물이 트랩 채널에서 탈출하지 않고도 박테리아가 동물에게 쉽게 도달할 수 있도록 했습니다. 모든 장치는 동일한 식품 공급 층(보충 파일 6)과 동일한 밸브 층(보충 파일 7)을 사용합니다. 밸브 층은 20μm 높이의 별도의 웨이퍼에 제작되며 PDMS 장치 제작 중에만 장치 계층에 배치됩니다(단계 1.21).
지렁이가 머리에서 꼬리로 회전하거나 역전하는 것을 방지하는 데 필수적인 이러한 단계별 기하학적 제약 조건으로 인해 모든 유충 단계를 수용하기 위해 세 가지 고유한 장치 유형을 사용해야 합니다. L1 유충을 어린 성인 동물을 위한 크기의 수로에 배치하면 안정적으로 유지되지 않고 빠르게 트랩 수로를 빠져나갈 것입니다.
C. 예쁜꼬마선충 준비
달리 명시되지 않는 한, 웜은 20°C에서 E. coli OP50이 파종된 NGM 플레이트에서 표준 프로토콜25에 따라 유지되었습니다. 웜 준비 섹션에서는 이미징 실험에 사용되는 동기화된 웜 개체군의 준비를 명시적으로 설명합니다. 동기화는 차아염소산나트륨 표백제26을 사용하여 표준 프로토콜에 따라 수행되었으며, 하룻밤 동안 굶주린 후 파편과 부화하지 않은 동물을 제거하기 위해 추가 여과 단계로 수정되었습니다. 목표는 동기화된 많은 L1 유충을 얻은 다음 NGM 플레이트에 파종하거나 이미징 장치에 직접 로드하는 것입니다. 수동 채취 또는 제어된 알을 낳는 것과 같은 다른 동기화 방법도 똑같이 적합합니다. 그러나 충분한 동물을 생산하는 데 더 많은 노력이 듭니다(조건당 200마리 권장).
기생충이 원하는 단계에 도달하면 깨끗한 S-Basal(이상적으로는 0.2μm 필터를 통해 여과)을 사용하여 NGM 플레이트에서 부드럽게 씻어낼 수 있습니다. 목표는 플레이트에서 박테리아나 파편을 모으지 않고 가능한 한 많은 동물을 수집하는 것입니다. 동물을 작은 원심분리기 튜브에 넣고 신선한 S-Basal 완충액으로 2-3회 세척한 후 최종적으로 가능한 한 많은 액체를 제거합니다. 그런 다음 농축된 부피에서 동물을 직접 채취합니다. 동물의 농도가 너무 낮으면 로딩 속도가 느려져 장치를 통해 더 많은 양의 액체가 흘러야 하고 파편으로 트랩 채널이 막힐 위험이 높아집니다.
박테리아 식품 준비
박테리아 성장은 표준 프로토콜에 따라 수행되며, 초기 박테리아 농도(OD600 = 1.9)는 S-Basal 완충액(0.2μm 필터를 통해 여과됨)에서 약 40배 증가하고, PF(0.2μm 필터를 통해 여과됨)를 포함하는 밀도 구배 배지 및 S-Basal 완충액과 혼합됩니다. 이 프로세스 단계의 예상 결과는 이미징 실험 중에 매우 조밀한 박테리아 현탁액을 준비하고 박테리아 침강을 방지하는 것입니다. 매체 전달에 사용되는 낮은 유속(1μL/h)으로 동물을 온칩으로 먹이려면 고밀도가 필요합니다. 밀도 구배 매체의 목적은 실험 중 박테리아 침전을 방지하는 것이고 PF의 목적은 박테리아가 채널 벽에 달라붙는 것을 방지하는 것입니다. 밀도 구배 배지와 PF는 모두 무독성이며 동물 생존력에 영향을 미치지 않습니다.
실험에 다른 유형의 박테리아를 사용하는 경우 밀도 구배 매질의 필요한 농도를 결정해야 합니다. 이는 박테리아 현탁액을 다양한 양의 배지와 혼합한 후 원심분리를 통해 달성할 수 있습니다. 밀도 구배 농도가 너무 낮으면 박테리아가 침전됩니다. 농도가 너무 높으면 박테리아가 떠 다니게 됩니다. 적절한 농도가 발견되면 박테리아 혼합물을 약 48시간 동안 실온에 두어 결과를 검증하여 실험 전반에 걸쳐 식품이 어떻게 작용하는지 표시하는 것이 좋습니다. 실험이 끝나면 박테리아가 공급되는 주사기를 확인하고 박테리아가 침전되거나 떠다니지 않는지 확인하는 것도 권장됩니다. 다른 양의 Optiprep을 첨가하여 발생하는 부피 차이는 S-Basal + 1중량% PF를 더 많거나 적게 첨가하여 보상할 수 있습니다. 유사하게, 추가 매체 또는 화합물(예: 옥신)을 현탁액에 추가할 수 있으며, 추가 부피는 S-Basal + 1 중량% PF의 부피에서 뺍니다.
설정 준비
압력 공급 시스템을 현미경에 최대한 가깝게 설정하여 편리하게 작동할 수 있도록 합니다. 모든 튜빙 런, 특히 칩에 연결되는 1/16" 튜빙은 짧아야 합니다(0.5/16" OD 튜빙의 경우 1m 미만)(그림 2 및 그림 3B). 위 섹션에서 설명한 것처럼 온칩 밸브의 컴퓨터 제어는 다양한 방법으로 달성할 수 있습니다. 전용 마이크로 컨트롤러 보드(예: Arduino)를 연결하거나 디지털 출력을 사용하여 시스템을 기존 데이터 수집(DAq) 카드에 연결하여 모든 현미경 소프트웨어(Micro-Manager, Metamorph, NIS 및 ZenBlue에서 테스트됨)에서 가능해야 합니다. 그런 다음 선택한 보드 출력을 셔터로 구성해야 하며, 이 셔터는 이미지 획득 10초 전에 켜지거나 장치 설정 중에 수동으로 작동됩니다. 앞서 언급했듯이 솔레노이드를 마이크로 컨트롤러에 직접 연결하는 것은 권장되지 않습니다. 대신, MOSFET 또는 릴레이 스위치를 통해 연결하여 솔레노이드와 마이크로 컨트롤러가 전자적으로 절연된 상태를 유지하도록 합니다(그림 3C).
압력 공급 튜브와 유사하게 칩(1/16" OD 및 1/32" OD)에 대한 다른 모든 튜브 실행을 가능한 한 짧게 유지하십시오. 웜 튜브와 폐기물 튜브(1/16" OD)를 각각 2.5cm 및 20cm 미만으로 유지하십시오. 박테리아 공급 튜브(1/32" OD)는 현미경 스테이지에 배치된 후 주사기 펌프에서 장치까지 연결할 수 있을 만큼 충분히 길어야 합니다. 그럼에도 불구하고 이를 최대한 줄이고 주사기 펌프를 현미경 스테이지 가까이에 배치하는 것이 좋습니다(예: 스테이지 옆, 선반 사용 또는 인큐베이터 인클로저 상단). 시스템에 튜브를 추가하면 동물을 장치에 넣을 때 느끼는 배압이 증가하고 갇힌 동물에 대한 총 압력이 증가합니다.
장치 작동
모든 튜빙은 이 단계에서 각각의 무딘 바늘, 강철 핀 및 주사기에 준비하고 연결할 수 있습니다(프로토콜 단계 4의 시작). 위에서 언급했듯이 튜빙 길이를 가능한 한 짧게 유지하십시오(그림 2J-N). 중요한 것은 주사기나 튜브에 기포가 남아 있지 않도록 주의해야 하며, 이는 동물의 적재를 방해하고 실험 중에 동물이 트랩 채널에서 탈출하는 결과를 초래할 수 있으므로 주의해야 합니다. 기포는 여러 가지 방법으로 주사기에서 제거할 수 있는데, 예를 들어 주사기를 채우거나, 거꾸로 하거나, 기포가 주사기 상단으로 올라오도록 부드럽게 흔듭니다(주사기를 튕기는 것은 추가 기포가 갇힐 수 있으므로 권장하지 않습니다). 또는 주사기를 버퍼에 붙이고 플런저를 위아래로 빠르게 움직여 대부분의 기포를 빠르게 제거하여 주사기를 채울 수 있습니다.
주사기가 채워지고 기포가 제거되면 뭉툭한 바늘과 튜브가 부착되고 완충액으로 채워집니다. 뭉툭한 바늘의 플라스틱 부분에 공기가 쉽게 갇힐 수 있으므로 주사기를 채울 때도 특별한 주의를 기울여야 합니다. 공기가 갇히면 바늘을 교체하십시오. 또는 피펫을 사용하여 바늘에 액체를 미리 주입하면 문제를 완화할 수 있습니다.
모든 구성 요소가 제자리에 있으면 솔레노이드와 온칩 밸브를 연결하는 튜브부터 시작하여 튜브를 장치에 부착할 수 있습니다(그림 2A-C,J). 이 튜브는 처음에 탈이온수로 채워지며 시스템은 데드 엔드 밸브 채널에서 모든 공기를 제거하기 위해 가압됩니다. PDMS는 가스 투과성입니다. 따라서 상승된 압력은 채널의 모든 공기를 PDMS로 밀어 넣어 밸브 채널에 물을 채웁니다. 이 과정을 현미경으로 수행하여 전체 밸브 채널이 채워졌는지 확인할 수 있습니다. 밸브를 채운 후 박테리아 공급을 연결할 수 있으며 열려 있는 모든 입구/출구를 차단하여 장치를 채우고 가압할 수 있습니다(그림 2D,E,K,L). 공기가 빠져나가면 현미경으로 과정을 모니터링할 수 있습니다. 모든 공기가 제거되면 박테리아가 장치를 균일하게 채워야 합니다. 차단 핀이 제거되고 폐기물 수집 튜브가 연결됩니다(그림 2F, G, M). 이 시점에서 소량의 액체가 장치를 통해 폐기물 수집 튜브로 흘러 튜브에 대한 모든 연결이 열려 있는지 확인해야 합니다. 이는 튜브를 수집 튜브에 연결하기 전에 육안으로 확인할 수 있습니다. 폐기물 수거 튜브로 액체가 흐르지 않으면 막혔을 가능성이 있습니다. 이로 인해 실험에 압력이 증가하여 갇힌 동물에게 부정적인 영향을 미칠 수 있습니다. 튜브 또는 연결부가 막힌 경우 튜브를 제거하고 바늘을 사용하여 모든 연결부를 청소하거나 물을 채운 주사기로 세척하십시오.
마지막으로 웜 튜빙을 연결할 수 있습니다(그림 2H, N). 원심분리기 튜브에서 벌레를 S-Basal 충전 주사기에 부착된 튜브로 빨아들이기만 하면 벌레를 집어낼 수 있습니다. 동물은 주사기가 아닌 튜브 안으로 끌어당겨야 합니다. 그런 다음 튜브를 장치에 연결할 수 있습니다. 그 전에 장치와 웜 튜브에서 소량의 액체가 밀려 나오고 두 방울이 연결되어 로딩하는 동안 장치로 공기가 밀려나지 않습니다.
웜 로딩
모든 연결이 완료되면 웜 주사기의 플런저를 밀고 당겨 동물을 적재할 수 있습니다. 동물은 입구에서 트랩 채널 어레이로 흘러 나옵니다. 그러나 그들은 자연스럽게 그들이 경험하는 흐름을 거슬러 수영할 것입니다. 따라서 동물은 머리가 트랩 채널을 향하도록 방향을 바꿔야 합니다. 올바른 동물 방향은 플런저를 밀고 당기고 동물이 원하는 방향으로 회전할 시간을 줌으로써 이루어집니다. 이것은 거의 단일 웜 기반으로 달성할 수 있지만 약간의 연습이 필요합니다. 동물이 올바른 방향을 잡으면 트랩 채널로 밀어 넣고 높이 단계로 멈추는 채널 끝으로 미끄러져 들어갈 수 있습니다(그림 1A, B). 동물이 채널에 들어갈 수 없는 경우 선택한 장치에 비해 너무 커서 더 큰 장치에서 이미지를 촬영해야 합니다. 동물이 덫 채널에 놓였을 때 회전하거나 돌아설 수 있다면 너무 어리기 때문에 더 작은 장치를 사용하거나 동물이 몇 시간 더 자랄 수 있도록 두어야 합니다.
중요한 것은 서로 다른 경로에 있는 동물들이 서로 영향을 미치지 않는다는 것입니다. 따라서 잘못 적재된 동물은 올바르게 적재된 동물에게 영향을 미치지 않지만 음식에 대한 접근이 충분하지 않으므로 성장 속도가 느려지거나 발달을 방해합니다.
동물이 적절한 나이에 적재되면 세로 채널 축을 따라 최소한의 움직임이 발생해야 합니다. 그러나 동물은 자유롭게 몸을 움직일 수 있으며(그림 1B) 몇 분 이내에 먹이를 먹기 시작합니다. 동물이 세로 채널 축을 따라 상당한 움직임을 보이는 경우 이는 장치의 압력 상승 또는 튜브, 뭉툭한 바늘 또는 주사기 어딘가에 박힌 기포가 원인일 수 있습니다. 뭉툭한 바늘에서 웜 튜브를 부드럽게 분리하고 부드럽게 다시 부착하면 장치 내부에 축적된 압력을 해제할 수 있습니다. 위에서 언급한 단계와 예방 조치에도 불구하고 기포가 시스템 내에 남아 있는 경우 전체 웜 주사기를 제거하고 기포가 없는 새 것으로 교체해야 할 수 있습니다. 시스템의 기포는 하중 중에 압축되고 동물을 적재한 후 천천히 방출되는 스프링으로 기능합니다. 기포가 팽창하여 생성된 흐름은 시스템을 불안정하게 만들어 동물을 트랩 채널 밖으로 밀어낼 수 있습니다.
온칩(on-chip)의 이미지 획득 및 개발
마지막으로, 동물이 로드되면 이미지 획득을 시작할 수 있습니다. 원칙적으로 이 장치는 모든 이미징이 170μm 두께의 커버 유리를 통해 수행되기 때문에 대부분의 이미징 방법, 명시야, 에피 형광18,19,22,23(그림 4), 회전 디스크 공초점19 및 초고해상도 양식(AiryScan24)과 호환됩니다. 결과적으로, 미세유체 장치는 달성 가능한 이미지 품질 온칩에 거의 또는 전혀 영향을 미치지 않습니다. 그러나 이미징 방식에 관계없이 동물 생존력에 영향을 미치지 않는 적절한 이미징 조건을 선택해야 합니다. 높은 여기 강도는 샘플에 전달되는 높은 에너지와 열로 인해 형광단 표백 및 발달 정지를 쉽게 초래할 수 있습니다. 짧은 노출 시간(~10ms)과 낮은 여기 강도(일반적인 형광 LED 소스의 10% 미만)가 권장되며, 최소 = 0 및 최대 = 1000(16비트 카메라 사용 시)의 대비 설정에서 사용 가능한 이미지를 얻을 수 있습니다(그림 4).
L1, L1-4 및 L2-A 장치를 사용하여 얻은 대표 데이터는 그림 4에 나와 있습니다. 예쁜꼬마선충 상피세포의 부화/하룻밤 굶주림부터 L2 유충 중반 단계까지의 발달을 보여주며(그림 4A, 보충 동영상 1), 1°-fated 외음부 전구세포의 유도 및 L1 후기부터 L4 유충 초기 단계로의 후속 분열(그림 4B, 보충 동영상 2), 그리고 마지막으로 초기 L3 유충 단계부터 성체로 전환되는 역전까지의 C. elegans vulva의 형성을 보여줍니다(그림 4C, 보충 영화 3).
각 애플리케이션에는 서로 다른 개발 타이밍 메트릭의 정량화가 수반됩니다. 그림 4A,B의 이미지는 후처리가 적용되지 않은 상태, 즉 디콘볼루션 또는 이미지 정합이 적용되지 않은 상태로 표시됩니다. 반면, 그림 4C의 이미지는 디컨볼루션(deconvolved)되어 27 정합되었으며, 이는 장기 이미징 장치를 사용할 때 가능한 이미지 품질의 개선을 강조합니다.
첫째, 그림 4A에 나타난 동물에 대한 각 이음새 세포 분열의 시작을 식별하여(풀타임 과정은 보충 동영상 1 참조), 이는 12마리의 동물에 걸쳐 모든 세포의 일관되고 시기적절한 분열을 나타냅니다(그림 4D). 솔기 세포를 사용하여 4개의 유충 단계 모두에 걸친 일반적인 발달 시기도 평가했으며, 모든 솔기 세포 분열이 L1(n = 22)에서 12.0시간 ± 1.7시간(평균 ± SD), L2(n = 27)에서 10.2시간 ± 1.0시간, L3(n = 27)에서 10.9시간 ± 1.4시간, L4 동물(n = 19)에서 14.6시간 ± 2.2시간 후에 모든 이음새 세포 분열이 완료되었음을 발견했습니다. 이러한 데이터는 문헌 값 2,28 및 판에서 자란 동물에서 측정한 값, L1 15시간(n = 21), L2 10시간(n = 15), L3 12시간(n = 21) 및 L4 12.5시간(n = 61)에 대한 중간 발달 시간 결과와 일치합니다(Berger et al.18에서 발췌). 관찰된 약간의 지연은 이미지 획득 및 그에 따른 광독성의 결과일 가능성이 높거나 동물이 성장하여 트랩 채널이 되면 감금이 증가한 결과일 수 있습니다.
둘째, L2 및 L3 단계에 걸쳐 동물의 성장을 추적하여 생식선 길이를 발달 진행의 훌륭한 지표로 정량화했습니다(그림 4E, 풀타임 과정은 보충 동영상 2 참조). 이음새 세포 분열과 마찬가지로, 직선 동물 방향 덕분에 정확한 생식선 길이를 측정할 수 있었고, 이미징된 모든 동물에서 일관된 생식선 성장이 발견되었습니다(n = 19). 이 실험에서 첫 번째 VPC 분열은 실험이 시작된 후 14.26시간 ± 2.47시간(파종 후 ~30시간)에 관찰되었으며, 두 번째 분열은 1.46시간 ± 0.13시간 후(n = 19)에 발생했습니다. 이러한 데이터는 NGM 플레이트29,30에 설정된 문헌 값과 잘 일치합니다. Euling과 Ambros[30]는 첫 번째 분열이 약 29시간 후에 발생하고 두 번째 분열은 약 3시간 후에 발생한다는 것을 발견했습니다.
마지막으로, 외음부 발달의 특정 단계에 도달하는 시간을 정량화하여(그림 4F, 풀타임 과정에 대한 보충 동영상 3 참조), 특히 Mok et al.31에 의해 정의된 하위 단계에 따라 침습(L4.0, t1)에서 L4 중반 단계(L4.5, t4)로 진행하는 데 필요한 시간을 평가했습니다. T1-T2 사이의 평균 진행 시간은 3.8시간 ± 1.2시간, T2-T3 사이의 평균 진행 시간은 3.5시간 ± 1.2시간, T3-T4 사이의 평균 진행 시간은 2.8시간 ± 1.6시간(n = 7)으로 대략 선형적인 발달 진행을 나타냅니다. 발달 타이밍 분석과 유사하게, 이러한 시간, 특히 T1-T2는 보고된 문헌 값(T1-T2: 0.7시간, T2-T3: 3시간, T3-T4: 2.3시간31)에 비해 약간 지연된 것으로 보이며, 이는 탈피를 늦추는 좁은 장치 치수로 인해 발생할 수 있습니다. 그럼에도 불구하고, 발달 시기는 동물들 사이에서 매우 일관되게 유지되며, 모두 성공적으로 성체로 진행된다.
동물의 움직임과 현미경 드리프트 보정
단일 Z-스택 전반에 걸친 동물의 움직임은 일반적으로 온칩 밸브가 작동될 때 최소화됩니다. 그러나 동물들은 완전히 가만히 있지 않을 것으로 예상됩니다. 단일 스택에서 관찰된 잔류 지터는 온칩 밸브를 작동시키기 위한 압력을 증가시키거나, 사용된 노출 시간을 줄이거나, 스택 획득을 가속화하기 위해 선택한 Z-단계를 증가시켜 보상할 수 있습니다. 피에조 Z-드라이브를 사용하여 기존 현미경 초점 드라이브에 비해 훨씬 더 빠른 Z-모션을 얻거나 다중 대역 필터(예: GFP/mCherry)를 사용하여 시간이 많이 걸리는 필터를 변경할 필요 없이 별도의 색상을 획득할 수 있으므로 스택 획득 시간을 더욱 단축할 수 있습니다. 참고로, 제공된 예제(그림 4 및 Supplementary Movie 1, Supplementary Movie 2 및 Supplementary Movie 3)에서 스택 획득 시간은 일반적으로 3초에서 8초 사이였습니다. 잔류 모션은 필요한 경우 다양한 이미지 등록 방법을 통해 제거할 수도 있습니다.
온칩(on-chip) 동물은 꾸준히 성장할 것으로 예상됩니다. 따라서, 관심 피쳐는 필연적으로 세로 채널 축을 따라 이동하게 될 것이다(그림 4A, B, 보충 동영상 1 및 보충 동영상 2). 따라서 관심 피처가 FOV로 성장할 수 있고 실험 과정에서 손실되지 않도록 이미징 FOV를 설정하는 것이 좋습니다(그림 1B 및 그림 4A, B). 또는 전체 동물의 몸을 커버하는 여러 개의 인접한 FOV에서 동물을 이미지화할 수 있습니다. 그러나 이는 추가적인 광독성과 스트레스를 유발할 수 있습니다. Z-motion과 마찬가지로 다양한 등록 절차를 통해 시간 경과에 따른 채널 내 동물 움직임을 보정할 수 있습니다. 동물이 세로 축을 따라 불규칙한 움직임을 보이면 성장에 기인할 수 있는 것보다 더 광범위하게 기포가 원인일 가능성이 높습니다.
각 장기 이미징 장치에는 6개의 개별 이미징 장치가 포함되어 있으며, 각 이미징 장치는 별도의 실험에 사용할 수 있습니다. 각 유닛은 최대 41마리의 동물을 수용할 수 있으며, 트랩 채널은 단일 FOV에서 여러 동물을 이미지화할 수 있도록 간격을 두고 있습니다. 또한 단일 장치 또는 장치 내에서 여러 FOV를 이미지화할 수 있습니다. 모든 현미경 샘플과 마찬가지로 샘플 표면을 가로지르는 움직임은 침지 매체의 손실로 인해 초점 드리프트를 유발할 수 있습니다. 이러한 드리프트는 저점도 이멀젼 오일을 사용하거나 다양한 자동 초점 방식을 통해 보상할 수 있습니다. 그러나 일부 하드웨어 자동 초점 시스템은 유리에서 수성 매체로의 전이를 기준점(커버 유리의 샘플 면)으로 사용하기 때문에 PDMS 미세유체 장치와 함께 사용할 때 작동하지 않을 수 있습니다. FOV의 대부분은 물보다 굴절률이 높은 장치 내부의 실리콘으로 채워져 있습니다. 이는 이미지 품질에는 영향을 미치지 않지만 자동 초점에 부정적인 영향을 미칠 수 있습니다. 단일 FOV를 이미징할 때 장치 내에서 관찰되는 초점 드리프트는 최소(2μm 미만)입니다. 과도한 초점 드리프트가 관찰되는 경우 이는 현미경 시스템 또는 환경의 열적 불안정성, 여러 FOV를 획득하는 과도한 XY 모션 또는 현미경에 장치를 잘못 장착하는 원인일 수 있습니다(제안된 장착 메커니즘은 그림 3A 참조).
마찬가지로, 과도한 XY 이동과 부적절한 장착으로 인해 XY 드리프트가 발생할 수도 있습니다. 장치와 현미경 대물렌즈는 침지 액체를 통해 연결되기 때문에 X, Y 또는 Z의 빠른 움직임으로 인해 장치에 힘이 가해질 수 있습니다. 장치가 올바르게 장착되고 외부 힘이 작용하지 않으면 초점 드리프트가 최소화되고 XY 드리프트가 없어 매우 안정적입니다.
마지막으로, 특정 시스템 매개변수가 부적절하면 PDMS 미세유체 장치가 동물 발달에 부정적인 영향을 미칠 수 있습니다. 생존력은 과도한 밸브 압력, 높은 여기 강도로 인한 높은 광독성, 긴 노출 시간 또는 스택 획득 사이의 짧은 시간 간격에 의해 영향을 받습니다. 특히 이 시스템을 처음 사용할 때는 이미징 상태가 동물 성장에 영향을 미치지 않도록 밝은 형광 마커 또는 명시야 이미징을 사용하여 동물의 생존력을 평가하는 것이 좋습니다. 동물이 안정적으로 발달하면 필요에 따라 이미징 매개변수를 변경할 수 있습니다.
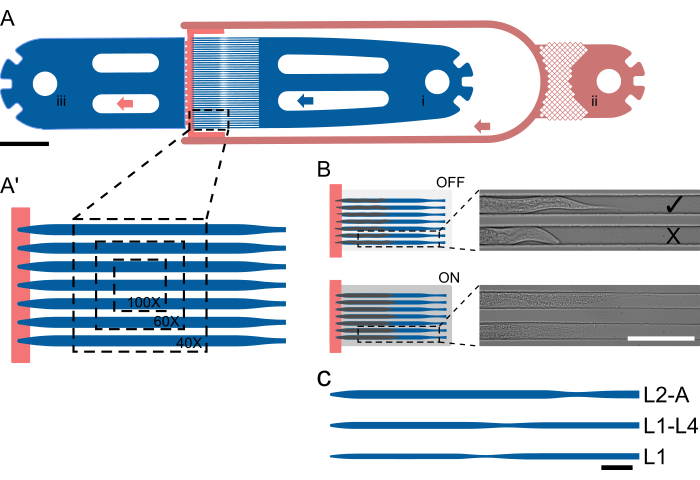
그림 1: 장치 레이아웃 및 회로도 작동.(A) 장치 개요는 웜 주입구(i), 박테리아 먹이 주입구(ii) 및 일반 배출구(iii)가 있는 단일 장치를 보여줍니다. (ᅡ') L2-A 장치의 트랩 채널 확대 보기, 다양한 배율(40x-100x)에서 단일 FOV에서 볼 수 있는 웜 수를 강조 표시합니다. (B) 온칩 밸브의 기능 원리. OFF일 때는, 동물들이 트랩 채널에 편안하게 들어갈 수 있도록 채널 높이가 선택됩니다. ON으로 설정하면 채널 높이가 감소하여 동물을 덮개 유리 위로 눌러 갇힌 동물을 가역적으로 움직이지 못하게 합니다. 이미지는 온칩 밸브 OFF와 밸브 ON 상태로 획득한 온칩에 갇힌 두 마리의 동물을 보여주며, 동물은 압력을 받아 눈에 띄게 곧게 펴지고 늘어납니다. 위쪽 동물은 올바르게 적재되어 먹이 공급원( )을 향하고 아래쪽 동물은 반대쪽을 향합니다(X). (C-C") 회로도 장치 설정. (C) 사용 가능한 장치 크기. L1은 L1에서 L2 중반까지의 동물에게, L1-4는 L2 중반에서 L4 중반까지의 동물에게, L2-A는 L2 중반에서 L4 중반까지의 동물에게 적합하며, L2-A는 L2 중반 유충 단계에서 성체까지의 동물에 적합합니다. 눈금 막대는 (A) 1000μm, (B) 100μm 및 (C) 50μm입니다. 이 그림은 Berger et al.18에서 부분적으로 각색한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
)을 향하고 아래쪽 동물은 반대쪽을 향합니다(X). (C-C") 회로도 장치 설정. (C) 사용 가능한 장치 크기. L1은 L1에서 L2 중반까지의 동물에게, L1-4는 L2 중반에서 L4 중반까지의 동물에게, L2-A는 L2 중반에서 L4 중반까지의 동물에게 적합하며, L2-A는 L2 중반 유충 단계에서 성체까지의 동물에 적합합니다. 눈금 막대는 (A) 1000μm, (B) 100μm 및 (C) 50μm입니다. 이 그림은 Berger et al.18에서 부분적으로 각색한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
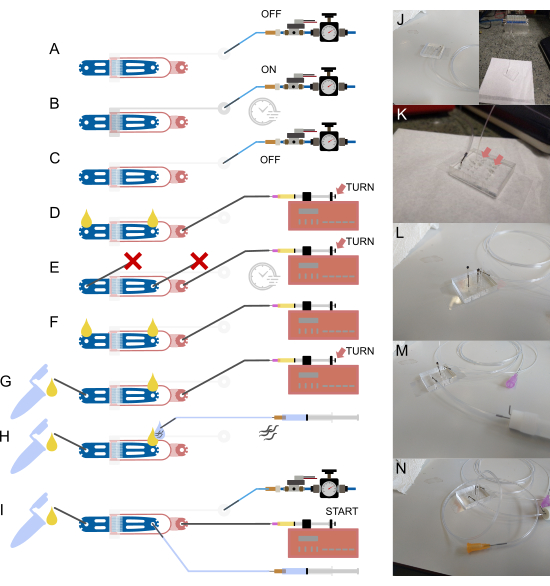
그림 2: 장치 설정 및 연결. (인공지능) 설정 프로세스의 개략적 개요. (A) 속이 빈 강철 핀(회색)을 사용하여 1/16" 물로 채워진 튜브를 밸브 입구에 연결하고 다른 쪽 끝은 압력 공급 시스템에 부착합니다. (B) 오프칩 솔레노이드를 통해 온칩 유압 밸브를 채우고 몇 분 동안 장치에 압력을 가합니다. (C) 다음 단계로 진행하기 전에 압력을 비활성화합니다. (D) 1/32" 튜브와 30G 뭉툭한 바늘을 사용하여 박테리아 음식이 들어 있는 주사기를 음식 주입구에 연결한 다음 열린 두 연결부에 액체가 나타날 때까지 장치를 채웁니다. (E) 1/16" 튜브( ) 조각으로 막힌 강철 핀으로 웜 입구와 폐기물 배출구를 밀봉하고 식품 주사기와 펌프를 사용하여 장치에 압력을 가하여(나비 나사 조정을 통해) 몇 분 동안 압력을 유지합니다. (F) (E)에서 플러그를 제거하여 열린 각 연결부에서 액체 방울이 형성되도록 합니다. (G) 1/16" 튜브의 짧은 조각과 속이 빈 강철 핀을 통해 폐기물 용기를 연결합니다. (H) 속이 빈 강철 핀과 23G의 뭉툭한 바늘을 사용하여 완충 주사기를 장치에 부착하는 단계. 웜은 장치에 연결하기 전에 튜브로 유입되어 입구와 튜브 끝단에 액체 방울을 정렬하여 공기가 유입되지 않도록 합니다. (I) 모든 장치 연결이 설정된 상태에서 최종 설정. (J) (A-C)에 해당하는 입구와 솔레노이드(배경)에 연결된 밸브 튜브가 있는 장치의 이미지. (K) 확대 view (D)에 해당하는 웜 주입구와 배설물 배출구에 두 개의 액체 방울(화살표)이 부착된 식품 공급 튜브가 부착된 장치. (L) 확대 view (E)에 해당하는 식품 공급 튜브가 부착되어 있고 웜 입구와 폐기물 배출구가 막힌 장치. (M) (G)에 해당하는 폐기물 튜브와 용기가 부착된 장치의 확대 보기. (N) (I)에 해당하는 모든 튜빙 연결부가 제자리에 있는 최종 조립품. Berger et al.18에서 부분적으로 각색. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
) 조각으로 막힌 강철 핀으로 웜 입구와 폐기물 배출구를 밀봉하고 식품 주사기와 펌프를 사용하여 장치에 압력을 가하여(나비 나사 조정을 통해) 몇 분 동안 압력을 유지합니다. (F) (E)에서 플러그를 제거하여 열린 각 연결부에서 액체 방울이 형성되도록 합니다. (G) 1/16" 튜브의 짧은 조각과 속이 빈 강철 핀을 통해 폐기물 용기를 연결합니다. (H) 속이 빈 강철 핀과 23G의 뭉툭한 바늘을 사용하여 완충 주사기를 장치에 부착하는 단계. 웜은 장치에 연결하기 전에 튜브로 유입되어 입구와 튜브 끝단에 액체 방울을 정렬하여 공기가 유입되지 않도록 합니다. (I) 모든 장치 연결이 설정된 상태에서 최종 설정. (J) (A-C)에 해당하는 입구와 솔레노이드(배경)에 연결된 밸브 튜브가 있는 장치의 이미지. (K) 확대 view (D)에 해당하는 웜 주입구와 배설물 배출구에 두 개의 액체 방울(화살표)이 부착된 식품 공급 튜브가 부착된 장치. (L) 확대 view (E)에 해당하는 식품 공급 튜브가 부착되어 있고 웜 입구와 폐기물 배출구가 막힌 장치. (M) (G)에 해당하는 폐기물 튜브와 용기가 부착된 장치의 확대 보기. (N) (I)에 해당하는 모든 튜빙 연결부가 제자리에 있는 최종 조립품. Berger et al.18에서 부분적으로 각색. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
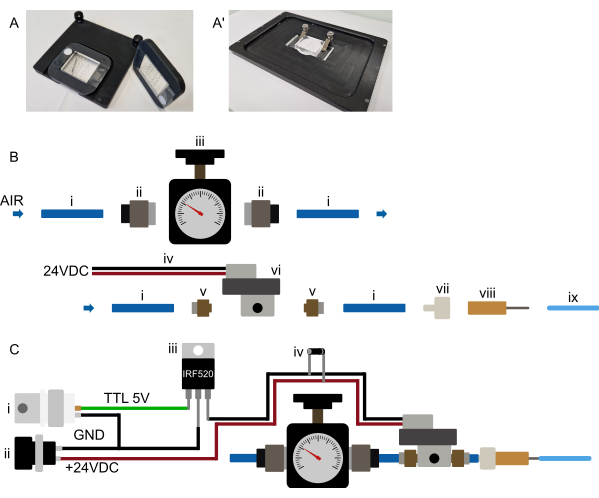
그림 3: 하드웨어 설정 (아-아') 제안된 장치 장착. (A) 정립 현미경을 장착할 수 있습니다. 장치는 큰 중앙 컷아웃이 있는 직사각형 3D 프린팅 프레임에 부착됩니다. 양면 테이프의 두 개의 작은 스트립은 처음에 장치의 PDMS 부분 양쪽에 있는 커버 유리에 배치됩니다. 그런 다음 3D 프린팅 프레임을 장치 위에 놓고 PDMS 부분이 컷아웃을 통해 달라붙고 프레임이 양면 테이프에 단단히 눌러져 장치를 프레임에 영구적으로 부착합니다. 따라서 프레임은 장치를 안전하게 고정하고 프레임과 스테이지 인서트에 내장된 자석을 사용하여 현미경 스테이지에 고정됩니다. 이를 통해 안정적인 장치 장착을 보장하고 현미경 대물렌즈와 장착 하드웨어의 충돌을 방지할 수 있습니다. 모든 튜브는 장치 전면으로 라우팅됩니다. (ᅡ') 도립 현미경에 장착할 수 있습니다. 클램프 세트는 장치를 단단히 고정합니다. 클램프가 작동 중 XY 움직임을 방지하기 위해 장치를 스테이지 인서트에 밀어 넣습니다. (B) 압력 시스템 부품 보기. (i) 압력 소스에 연결된 6mm OD 폴리우레탄 튜브. (ii) 튜브(i)를 압력 조절기(iii)에 연결하는 G1/8-6mm 푸쉬-인 어댑터. 튜빙은 M5-6mm 푸쉬-인 어댑터(v)를 통해 솔레노이드(vi)에 연결되고, 마지막으로 튜빙은 루어-록-미늘 커넥터(vii)와 무뚝뚝한 23G 바늘(viii)에 미세유체 장치에 연결된 1/16" OD 튜빙에 연결됩니다. (C) 전자 연결 및 조립된 압력 시스템의 개략도. (i) Arduino, DAq 카드 또는 기타 마이크로 컨트롤러에 의해 생성된 TTL 트리거(+3.3-5V)는 적절한 전원 공급 장치(ii, 24VDC)와 함께 MOSFET(iii) 및 솔레노이드의 전자 연결에 연결되며, 회로도에 표시된 대로 플라이백 다이오드(iv)는 솔레노이드 전원 연결을 가로질러 연결됩니다. TTL 신호가 마이크로 컨트롤러에서 MOSFET의 게이트로 전송되면 +24VDC가 상시 폐쇄 솔레노이드에 적용되고 온칩 유압 밸브가 팽창됩니다. TTL 신호가 제거되면 압력이 해제되고 온칩 유압 밸브가 수축됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
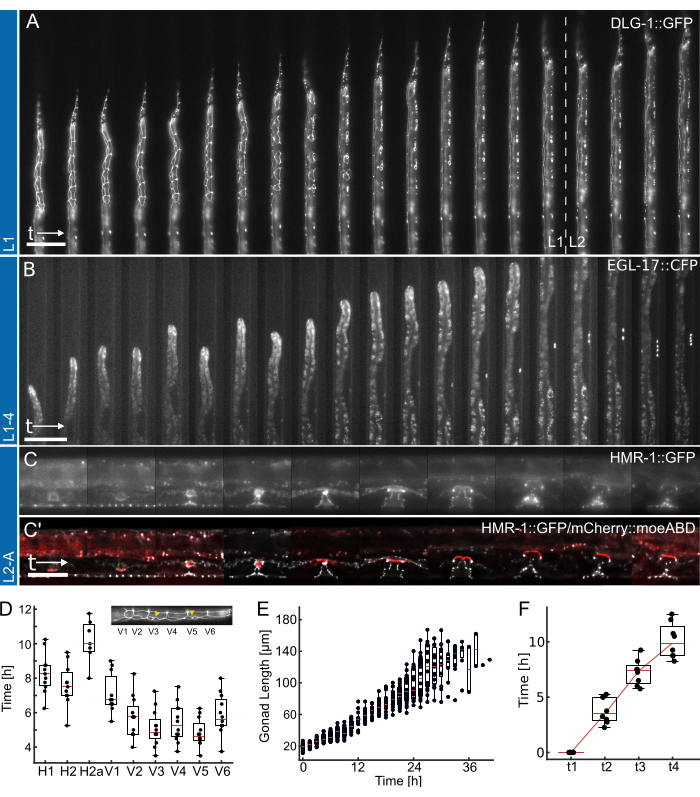
그림 4: 대표적인 결과. (A) L1 장치를 사용하여 하룻밤 동안의 굶주림에서 L2 유충 초기/중기 단계까지 성장하는 상피 접합 제작자(ML2615, dlg-1(mc103[dlg-1::gfp]))를 보여주는 동물. 분열하는 이음새 세포와 P 세포가 보이며, 이들은 L1 유충 말기로 이동하여 분열합니다. (B) L1-4 장치를 사용하여 후기 L1 유충 단계에서 초기 L4 단계까지 성장하는 동물. Visible은 1°-fated vulva precursor cell (VPC) (AH1187, arIs92[egl-17::cfp])에 대한 마커로, 실험 초기에 단일 세포가 보이고 L3 유충 단계에서 두 차례의 가시적 세포 분열이 있습니다. (C) L2-A 장치를 사용하여 후기 L2 유충 단계부터 초기 성체기까지 성장하는 동물. 보이는 것은 발달 중인 외음부 조직이 뚜렷한 토로이달 구조를 형성하는 것을 강조하는 상피 접합 메이커(AH5786, hmr-1(cp21[hmr-1::gfp + LoxP]))와 L3 유충 단계가 끝날 무렵 외음부 조직을 침범하여 조직을 연결하는 자궁 앵커 세포(AC)(AH5786, qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)])에 대한 마커가 있는 결합 이미지입니다. 모든 실험(A-C)에서 FOV는 동물의 일부만 보이도록 초기에 설정됩니다. 실험이 진행됨에 따라 동물은 동물 성장의 결과로 채널 축을 따라 이동하는 특징으로 채널의 더 많은 부분을 채울 것입니다. (D) L1 유충 단계에서 개별 이음새 세포 분열이 분열을 시작하는 시간(n = 12). 삽입은 전방-후방 몸체 축을 따라 이음새 세포 정체성(H1-V6)을 강조 표시합니다. (E) 그림 4B에서 동물의 시간에 따른 생식선 성장을 보여줍니다(n = 19). (F) 외음부 형태 형성(t1-t4)에서 4개의 뚜렷한 발달 시점에 도달하는 데 필요한 시간을 보여주며, 이는 이미지화된 모든 동물에 대해 일관된 전이를 나타냅니다(n = 7). 눈금 막대는 (A, B) 50 μm 및 (C) 25 μm입니다. 풀타임 과정에 대해서는 Supplementary Movie 1, Supplementary Movie 2, Supplementary Movie 3을 참조하십시오. 상자 그림은 중앙값(빨간색 선)을 보여주며, 상한 및 하위 사분위수와 막대는 특이치를 제외한 분포의 극단을 나타냅니다. 이 그림은 Berger et al.18에서 각색한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 영화 1: 단일 예쁜꼬마선충 유충이 하룻밤 사이에 굶주림에서 초기 L2 단계까지 발달합니다. 최대 강도 투사된 에피형광 이미지(투사의 총 높이는 1.5μm)가 표시되며, 그렇지 않으면 처리되지 않은 형식으로 표시됩니다. 보이는 것은 지정된 단계(상단)에서 발생하는 모든 이음새 세포 분열 및 융합 이벤트입니다. 기능은 DLG-1::GFP(상피 접합부) 마커를 사용하여 15분 간격으로 총 25시간 동안 설명됩니다. 이 영화는 Berger et al.18에서 재사용되었습니다. 이 영화를 다운로드하려면 여기를 클릭하십시오.
보충 동영상 2: 후기 L1 단계에서 초기 L4 단계까지 발달하는 단일 유충, EGL-17::CFP 마커(1°-fated vulval precursor cell (VPC))를 발현합니다. 초기 L2(~400분)에는 EGL-17::CFP 형광이 P6.p에서 나타나며 지속적으로 강도가 증가합니다. L3 동안 P6.p는 2회 연속 분열을 거쳐 외음부 발달의 1세포, 2세포 및 4세포 단계를 형성합니다. 이미지는 30분 간격으로 총 34시간 동안 표시됩니다. 이 영화는 Berger et al.18에서 재사용되었습니다. 이 영화를 다운로드하려면 여기를 클릭하십시오.
보충 동영상 3: 상단 보기: L3 단계에서 L4/성인 전환까지 발달 중인 외음부의 Z-투영. 하단 view: 시간이 지남에 따라 동일한 외음부의 X-투영. 두 견해 모두 VPC의 초기 분열, 그 다음에는 토로이드의 침습, 형성 및 확대, 그리고 역전 중 붕괴를 보여줍니다. Epifluorescence 이미지는 cropping, deconvolution, registration 및 projection 후에 표시됩니다. 기능은 HMR-1::GFP 마커(피하 및 VPC) 및 mCherry::moeABD 마커(AC 개요)를 통해 요약됩니다. 이 영화는 Berger et al.18에서 재사용되었습니다. 이 영화를 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: L1 장치용 CAD 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: L1-4 장치용 CAD 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 3: L2-A 장치용 CAD 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 4: L3-A 장치용 CAD 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 5: L4-A 장치용 CAD 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 6: 식품 유통 구조를 위한 CAD 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 7: 밸브 레이어에 대한 CAD 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 논문은 고유한 미세유체 장기 이미징 플랫폼의 작동에 대해 설명했는데, 이는 초기 성체까지의 4가지 유충 단계 모두에서 예쁜꼬마선충의 다양한 발달 과정에 대한 고해상도 이미징 및 추적에 적합합니다18. 이 이미징 방법 및 기타 방법을 사용하여 생체 내에서 시간이 지남에 따라 발달 과정을 추적하는 능력은 예쁜꼬마선충 연구의 많은 분야에서 없어서는 안 될 필수 요소가 되었으며 이전에는 접근할 수 없었던 질문에 답할 수 있게 되었습니다 23,24,29.
한천 패드 및 이전에 발표된 미세유체 기반 장기 이미징 전략을 사용하는 기존 이미징 방법과 달리 이 접근 방식은 실험 전반에 걸쳐 벌레의 정체성과 방향을 보존하여 시간이 지남에 따라 복잡한 발달 과정을 추적할 수 있습니다. 발달 단계에 관계없이 동물들은 41개의 평행 트랩 채널 중 하나에 갇혀 있으며, 각 채널은 온칩 식품 공급 장치에 연결되고 대형 유압 밸브로 덮여 있습니다. 갇힌 모든 웜의 고정은 유압 밸브의 팽창을 통해 발생하며, 이미지 획득 중에만 웜을 커버 유리에 누릅니다. 좁은 간격의 트랩 채널 어레이로 인해 고처리량 이미징이 가능하며 단일 시야 내에서 여러 동물을 볼 수 있습니다. 장기 이미징 장치는 대부분의 현미경 설정과 호환되며 최소한의 추가 하드웨어($1000 미만)가 필요하고 기존 하드웨어를 수정할 필요가 없습니다. 장치의 작동은 의도적으로 간단하므로 모든 사용자는 위의 프로토콜과 요약된 결과에 따라 빠르게 배울 수 있어야 합니다.
간단히 말해서, 동물은 최대 2.5개의 유충 단계에 걸쳐 온칩으로 이미지화할 수 있습니다(그림 1C). 동물은 초기에 동기화되고 원하는 발달 단계(L1-L4 및 L2-A 장치)까지 온칩(L1 장치)에 직접 로드되거나 NGM 플레이트에 파종됩니다. 온칩으로 탑재된 동물은 고농축 박테리아 현탁액을 사용하여 먹이를 공급받고 이미징 소프트웨어에 의해 작동되는 온칩 유압 밸브를 사용하여 고정됩니다(그림 1B). 동물은 주사기를 사용하여 덫 채널로 이동하고, 머리를 먹이 공급원 쪽으로 향하게 하여 동물을 조심스럽게 향하게 한 다음 마지막으로 덫 채널 끝에서 동물을 덫에 가둡니다(그림 1A 및 그림 2). 주사기, 뭉툭한 바늘 및 튜브에 공기가 갇히지 않도록 주의해야 하며, 기포는 동물의 위치를 쉽게 방해할 수 있습니다. PDMS 물질은 투명도가 높고, 형광성이 없으며, 얇은 커버 유리에 밀봉되어 있기 때문에, 장치는 대부분의 이미징 양식 18,19,24과 호환됩니다(그림 4, 보충 동영상 1, 보충 동영상 2 및 보충 동영상 3). 그러나 긴 노출 시간과 높은 여기 강도는 동물의 생존력에 쉽게 영향을 미치고 광표백을 초래할 수 있으므로 이미징 조건을 선택할 때 주의해야 합니다.
이러한 이미징 방법의 제시된 버전에 더하여, 프로토콜에 대한 몇 가지 수정이 가능하며 이미 이용 가능하다. 가장 간단한 수정은 표준 박테리아 균주를 예를 들어, RNAi 발현 박테리아18 또는 영양가가 다른 박테리아32 로 대체하는 것입니다. 박테리아 균주는 밀도 차이를 고려하여 Optiprep 함량을 조정하여 쉽게 교환할 수 있습니다. 유사하게, 박테리아 식품에 여러 화합물, 예를 들어 옥신, 영양소 또는 저분자 약물 화합물을 첨가할 수 있으며, 그 효과는 프로토콜에 대한 변경 없이 생체 내에서 직접 관찰됩니다. 특히, 매체 교환 장치는 옥신에 의한 단백질 분해 또는 형상이나 작동을 변경하지 않고 장치 레이아웃에 식품 주입구를 추가하여 시간 제한 또는 가역적 노출이 필요한 모든 응용 분야를 위해 개발되었습니다. 추가 주입구를 사용하면 단일 식품 공급원에 대해 여기에 표시된 것과 동일한 방식으로 장치에 부착된 두 가지 다른 조건(예: 옥신 및 옥신 없음) 사이를 간단하게 전환할 수 있으며 결과 변경 사항은 직접 관찰됩니다. 유압 밸브가 장치의 모든 장치에서 공유되지 않고 각 장치에 대해 분리되는 장치 변형도 개발되어 동일한 장치 내에서 여러 조건을 이미지화하고 개별적으로 실험할 수 있으므로 긴 밸브 작동 및 획득 시간으로 인한 잠재적으로 유해한 영향을 줄일 수 있습니다. 마지막으로, Berger et al.18에 기술된 원래의 장치 변형을 넘어서, 두 개의 새로운 장치 변형인 L3-A 및 L4-A(여기에 소개됨)가 개발되어 L3 중반 또는 L4 중반 단계에서 성인이 될 때까지 이미징할 수 있습니다. 이러한 수정의 목적은 실험 시작 시간을 후기 유충 단계로 지연시켜 초기 발달 단계가 관심 없는 응용 프로그램에 더 큰 동물을 적재할 수 있도록 하는 것입니다.
공개
저자는 경쟁 또는 재정적 이해관계가 없음을 선언합니다.
감사의 말
원고에 대한 비판적 토론과 논평을 해주신 Hajnal 연구실 구성원들에게 감사의 말씀을 전합니다. 우리는 또한 NIH Office of Research Infrastructure Programs(P40 OD010440)에서 자금을 지원하는 C. elegans Genetics Center CGC에도 감사드립니다. 또한, 제시된 프로토콜에 대한 귀중한 의견을 제시해 주신 Galli 연구소(Hubrecht Institute), Conradt 연구소(University College London) 및 van den Heuvel 연구소(위트레흐트 대학교)의 구성원들께 감사드립니다. 이 연구는 스위스 국립과학재단(Swiss National Science Foundation)의 보조금(번호 31003A-166580)이 AH에, 스위스 암 연맹(Swiss Cancer League)의 보조금(번호 4377-02-2018)이 AH에 지원했으며, ETH Zürich(ETH 취리히)가 AdM에 기부했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 3/2 solenoid valve | Distrelec | 154-22-898 and 154-22-899 | Alternative to above. Solenoid valve connecting the pressure regulator to the on-chip valve. |
| Arduino | Distrelec | 301-01-956 | Optional microcontroller depending on the selected controller and interface. |
| Bacto-Tryptone | Thermo Fisher Scientific | 211705 | For L Broth production. |
| Bacto-Yeast | Thermo Fisher Scientific | 212750 | For L Broth production. |
| Blunt needle 23G | Gonano Dosiertechnik | GGA723050 | Blunt needle connecting the 1/16" tubing to a syringe. |
| Blunt needle 30G | Gonano Dosiertechnik | IG-TE730050 | Blunt needle connecting the 1/32" tubing to a syringe. |
| C. elegans Construct 1 | NA | NA | AH5786 LGI: hmr-1(cp21[hmr-1::gfp + LoxP]) Marston, D.J. et al. MRCK-1 drives apical constriction in C. elegans by linking developmental patterning to force generation. Curr. Biol. 26 (16), 2079-2089. 2016. |
| C. elegans Construct 2 | NA | NA | AH1187 LGII: arIs92[egl-17::cfp] Yoo, A.S., Bais, C., Greenwald, I. Crosstalk between the EGFR and LIN-12/Notch pathways in C. elegans vulval development. Science. 303 (5658), 663-666. 2004. |
| C. elegans Construct 3 | NA | NA | AH5786 LGV: qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)] Ziel, J.W., Hagedorn, E.J., Audhya, A., Sherwood, D.R. UNC-6 (netrin) orients the invasive membrane of the anchor cell in C. elegans. Nat. Cell Biol., 11 (2), 183-189. 2009. |
| C. elegans Construct 4 | NA | NA | ML2615 LGX: dlg-1(mc103[dlg-1::gfp]) Vuong-Brender, T.T.K., Suman, S.K., Labouesse, M. The apical ECM preserves embryonic integrity and distributes mechanical stress during morphogenesis. Development. 144 (23), 4336-4349. 2017. |
| Cable | Distrelec | 143-46-644 | Needed if selecting the solenoid from distrelec. Cable connecting the solenoid to the MOSFET. |
| Chlorotrimethyl silane | Sigma Aldrich | 386529-25ML | Silane for wafer passivation. |
| Cholesterol | Sigma Aldrich | C8667 | For S-Basal production. |
| Flyback Diode | Distrelec | 110-52-628 | Flyback diode protecting the microcontroller. |
| Hollow steel pin | Gonano Dosiertechnik | GGA7R23050 | 23G hollow steel pin connecting the 1/16" tubing to the device. |
| L Broth | NA | NA | Prepared in house following standard recipe. 10 g Bacto-tryptone, 5 g Bacto-yeast, 5 g NaCl, H2O to 1 litre, pH to 7.0 using 1 M NaOH |
| Long-term Imaging Device L1 | NA | NA | Long-term imaging device for L1 to early/mid L2 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L1-4 | NA | NA | Long-term imaging device for mid L1 to mid L4 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L2-A | NA | NA | Long-term imaging device for mid L2 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L3-A | NA | NA | Long-term imaging device for mid L3 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L4-A | NA | NA | Long-term imaging device for mid L4 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| M9 Buffer | NA | NA | Prepared in house following standard recipe. |
| MOSFET | Distrelec | 303-41-391 | Metal-oxide-semiconductor field-effect transistor, used to switch the 24VDC required for the solenoid. |
| NGM plates | NA | NA | Prepared in house following standard recipe. |
| Nylon Luer-Fitting | Fisher Scientific | 11776048 | Adapter from OD 6mm tubing to 23G blunt needle. |
| Optiprep | Sigma Aldrich | D1556 | Density matching liquid. |
| PDMS | Ameba | Elastosil RT601A/B | PDMS elastomer kit. |
| Pluronic F-127 | Sigma Aldrich | P2443 | Non-ionic surfactant. |
| Potassium dihydrogen phosphate | Sigma Aldrich | 1.37039 | For S-Basal production. |
| Potassium hydrogen phosphate | Sigma Aldrich | 1.05099 | For S-Basal production. |
| Power Supply 24VDC | Distrelec | 301-63-304 | 24VDC power supply. Select a power supply suitable for the solenoid selected. |
| Precision pressure regulator | Distrelec | 154-23-578 | Alternativ to above. Pressure regulator. |
| Pressure Gauge G1/8 | Distrelec | 154-23-643 | Pressure gauge attaches to the pressure regulator. |
| PU Tubing OD 6mm | Distrelec | 154-23-866 | Tubing connecting the pressure source and regulator, as well as regulator and solenoid valve. |
| Push-in fitting G1/8 to 6mm | Distrelec | 301-69-330 | Alternativ to above. 2x Push-in fitting attaches to the pressure regulator and connects to the 6mm tubing. |
| Push-in fitting M5 to 6 mm | Distrelec | 301-69-459 | 2x Push-in fitting attaches to the solenoid and the 6mm tubing. |
| S-Basal Buffer | NA | NA | Prepared in house following standard recipe. 5.85 g NaCl, 1 g K2HPO4, 6 g KH2PO4, 1 ml cholesterol (5 mg/ml in ethanol), H2O to 1 litre. Sterilize by autoclaving. |
| Sodium Chloride | Sigma Aldrich | S9625 | For L Broth and S-Basal production. |
| Sodium hydroxite (5M) | Sigma Aldrich | 567530 | Sodium hydroxide used when bleaching C. elegans (prepare solution at 5M concentration) |
| Sodium hypochlorite (5%) | Sigma Aldrich | 1.05614 | Sodium hypochlorite used when bleaching C. elegans (prepare solution at 5% concentration) |
| Strainer 10 µm | pluriSelect | 43-10010-40 | Alternative for bacteria food preparation, especially if smaller devices are used. |
| Strainer 5 µm | pluriSelect | 43-10005-40 | Strainer used to filter L1 larvae after overnight starvation and bacteria after completed food preparation. |
| SU-8 | Gersteltec | GM1050 | SU-8 for height from 1-10 µm. |
| SU-8 | Gersteltec | GM1060 | SU-8 for height from 5-30 µm. |
| SU-9 | Gersteltec | GM1070 | SU-8 for height from 15-200 µm. |
| Syringe 1 mL | Fisher Scientific | 11338763 | 1mL syringe. If using a different type ensure that the syringe body and plunger are stiff, such that they won't be deformed by the syringe pump. |
| Syringe Pump | WPI | Al1000-220 | Syringe pump (https://www.wpiinc.com/var-2300-aladdin-single-syringe-pump.html). |
| Tube 15 mL | Fisher Scientific | 50-809-220 | Tube used for worm bleaching and bacteria preparation. |
| Tube 2 mL | Fisher Scientific | NC1186931 | Tube used for worm preparation and bacteria preparation. |
| Tube 50 mL | Fisher Scientific | 50-465-232 | Tube used for bacteria preparation and growth. |
| Tweezer SMD | Brütsch Rüegg Werkzeuge | 448980 | Tweezers used to plug the 1/32" tubing into the device. |
| Tygon tubing 1/16" | Fisher Scientific | 642002 | Flexible 1/16" OD tubing connecting most components to the device. |
| Tygon tubing 1/32" | Fisher Scientific | 641900 | Flexible 1/32" OD tubing connecting the bacteria supply to the device. |
| UV KUB-3 | Kloe | NA | Mask aligner and UV exposure system. |
| Wafer | Siegert Wafer | 4P0/>1/525±25/SSP/TTV<10 | Silicon Wafer. |
| Waste Container | NA | NA | Prepared in house using a 2mL tube or a cryo vial and hollow steel pins. |
참고문헌
- Sulston, J. E., Horvitz, H. R. Post-embryonic cell lineages of the nematode, Caenorhabditis elegans. Dev Biol. 56 (1), 110-156 (1977).
- Lin, R., Kipreos, E. T., Zhu, J., Khang, C. H., Kner, P. Subcellular three-dimensional imaging deep through multicellular thick samples by structured illumination microscopy and adaptive optics. Nat Commun. 12 (1), 3148(2021).
- Sulston, J. E., Schierenberg, E., White, J. G., Thomson, J. N. The embryonic cell lineage of the nematode Caenorhabditis elegans. Dev Biol. 100 (1), 64-119 (1983).
- Luke, C. J., Niehaus, J. Z., O'Reilly, L. P., Watkins, S. C. Non-microfluidic methods for imaging live C. elegans. Methods. 68 (3), 542-547 (2014).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods Cell Biol. 107, 177-206 (2012).
- Wolke, U., Jezuit, E. A., Priess, J. R. Actin-dependent cytoplasmic streaming in C. elegans oogenesis. Development. 134 (12), 2227-2236 (2007).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat Methods. 4 (9), 727-731 (2007).
- Hulme, S. E., Shevkoplyas, S. S., Apfeld, J., Fontana, W., Whitesides, G. M. A microfabricated array of clamps for immobilizing and imaging C. elegans. Lab Chip. 7 (11), 1515-1523 (2007).
- Rohde, C. B., Zeng, F., Gonzalez-Rubio, R., Angel, M., Yanik, M. F. Microfluidic system for on-chip high-throughput whole-animal sorting and screening at subcellular resolution. Proc Natl Acad Sci U S A. 104 (35), 13891-13895 (2007).
- Chung, K., Crane, M. M., Lu, H. Automated on-chip rapid microscopy, phenotyping and sorting of C. elegans. Nat Methods. 5 (7), 637-643 (2008).
- Krajniak, J., Lu, H. Long-term high-resolution imaging and culture of C. elegans in chip-gel hybrid microfluidic device for developmental studies. Lab Chip. 10 (14), 1862-1868 (2010).
- Samara, C., et al. Large-scale in vivo femtosecond laser neurosurgery screen reveals small-molecule enhancer of regeneration. Proc Natl Acad Sci U S A. 107 (43), 18342-18347 (2010).
- Stirman, J. N., Brauner, M., Gottschalk, A., Lu, H. High-throughput study of synaptic transmission at the neuromuscular junction enabled by optogenetics and microfluidics. J Neurosci Methods. 191 (1), 90-93 (2010).
- San-Miguel, A., Lu, H. Microfluidics as a tool for. WormBook: The Online Review of C. elegans Biology. , (2013).
- Lee, H., et al. A multi-channel device for high-density target-selective stimulation and long-term monitoring of cells and subcellular features in C. elegans. Lab Chip. 14 (23), 4513-4522 (2014).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nat Commun. 7 (1), 13023(2016).
- Berger, S., et al. Long-term C. elegans immobilization enables high-resolution developmental studies in vivo. Lab Chip. 18 (9), 1359-1368 (2018).
- Berger, S., Spiri, S., DeMello, A., Hajnal, A. Microfluidic-based imaging of complete Caenorhabditis elegans larval development. Development. 148 (18), dev199674(2021).
- Spiri, S., Berger, S., Mereu, L., DeMello, A., Hajnal, A. Reciprocal EGFR signaling in the anchor cell ensures precise inter-organ connection during Caenorhabditis elegans vulval morphogenesis. Development. 149 (1), dev199900(2022).
- Gritti, N., Kienle, S., Filina, O., Van Zon, J. S. Long-term time-lapse microscopy of C. elegans post-embryonic development. Nat Commun. 7 (1), 12500(2016).
- Keil, W., Kutscher, L. M., Shaham, S., Siggia, E. D. Long-term high-resolution imaging of developing C. elegans larvae with microfluidics. Dev Cell. 40 (2), 202-214 (2017).
- Heinze, S. D., Berger, S., Engleitner, S., Daube, M., Hajnal, A. Prolonging somatic cell proliferation through constitutive hox gene expression in C. elegans. Nat Commun. 14 (1), 6850(2023).
- Agarwal, P., Berger, S., Shemesh, T., Zaidel-Bar, R. Active nuclear positioning and actomyosin contractility maintain leader cell integrity during gonadogenesis. Curr Biol. 34 (11), 2373-2386 (2024).
- Segos, I., et al. Non-random segregation of mitochondria during asymmetric cell division contributes to cell fate divergence in daughter cells. bioRxiv. , 2024-2109 (2024).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. elegans Biology. , (2006).
- Pepin, B. GPU Deconvolution Library with C and Matlab API for Nvidia GPUs. , https://github.com/bobpepin/YacuDecu (2025).
- Podbilewicz, B., White, J. G. Cell fusions in the developing epithelia of C. elegans. Dev Biol. 161 (2), 408-424 (1994).
- Nusser-Stein, S., et al. Cell-cycle regulation of NOTCH signaling during C. elegans vulval development. Mol Syst Biol. 8 (1), 618(2012).
- Euling, S., Ambros, V. Heterochronic genes control cell cycle progress and developmental competence of C. elegans vulva precursor cells. Cell. 84 (5), 667-676 (1996).
- Mok, D. Z., Sternberg, P. W., Inoue, T. Morphologically defined sub-stages of C. elegans vulval development in the fourth larval stage. BMC Dev Biol. 15, 1-8 (2015).
- Laranjeira, A. C., Berger, S., Kohlbrenner, T., Greter, N. R., Hajnal, A. Nutritional vitamin B12 regulates RAS/MAPK-mediated cell fate decisions through one-carbon metabolism. Nat Commun. 15 (1), 8178(2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유