Method Article
הדמיה ברזולוציה גבוהה של C. elegans בכל שלבי הזחל
In This Article
Summary
פרוטוקול זה מתאר הדמיית דולג זמן מבוססת מיקרופלואידית על פני כל ההתפתחות הפוסט-עוברית.
Abstract
Caenorhabditis elegans הפך לאחד המודלים של בעלי החיים הנחקרים והמובנים ביותר בביולוגיה. שלושה מאפיינים הם המפתח להצלחתו של C. elegans כאורגניזם מודל: שושלת התאים הקבועה שלו, השקיפות והיכולת הגנטית שלו. אלה הופכים אותו לאידיאלי עבור מגוון רחב של מחקרים מבוססי מיקרוסקופיה ישירות in vivo. זחלים חיים של C. elegans ומבוגרים צריכים לעתים קרובות להיות משותקים במהלך רכישת תמונה. שיטות קיבוע מסורתיות משפיעות לרעה על התפתחות בעלי חיים, במיוחד ביישומי הדמיה בזמן-lapse. כאן, מוצג פרוטוקול התקנה ותפעול מפורט לשיטת הדמיה מיקרופלואידית חדשה, המתייחסת למגבלות הקשורות לאימוביליזציה מסורתית מבוססת אגר-פד ואסטרטגיות מיקרופלואידיות אחרות. גישה זו מאפשרת הדמיה חיה בו זמנית על פני שלבי הזחל השונים תוך שמירה על התמצאות וזהות התולעת לאורך זמן. כדי להשיג זאת, נעשה שימוש במערך תעלות מלכודת מיקרופלואידי, כאשר הגיאומטריה שלו תוכננה במדויק כדי לשמור על כיוון תולעת יציב תוך התאמה לצמיחה והתכה. אימוביליזציה מתאפשרת על ידי שסתום הידראולי פעיל המפעיל לחץ כדי לאבטח תולעים כנגד זכוכית הכיסוי אך ורק במהלך רכישת התמונה. עיצוב זה מאפשר הדמיה ברזולוציה גבוהה עם השפעות מינימליות על כדאיות התולעת או תזמון ההתפתחות.
Introduction
הדמיית C. elegans יכולה להתבצע במספר דרכים בהתאם ליישום, לתפוקה הרצויה ולרזולוציה. כאשר יש צורך ברזולוציה גבוהה, השיטה הסטנדרטית משתמשת ברפידות אגר 1,2,3, בנייה פשוטה של מגלשת זכוכית, אגרוז וזכוכית כיסוי. בעלי חיים במגלשות אלה משותקים על ידי הלחץ שמפעילה זכוכית כיסוי. ניתן לשפר עוד יותר את הקיבוע על ידי הוספת חומרי הרדמה, למשל, levamisole או נתרן אזיד 1,2, כך שבעלי חיים על רפידות אגר דוממים לחלוטין וניתן לצלם אותם ברזולוציה גבוהה, כולל שיטות שונות ברזולוציה גבוהה2. למרבה הצער, ידוע כי רפידות אגר משפיעות על התקדמות התפתחותית, כאשר השילוב של לחצים גבוהים וחומרי הרדמה מעכבים את ההתפתחות או גורמים לעצירת התפתחות מוחלטת 4,5.
מלבד שיטות סטנדרטיות אלו, צצו בשנים האחרונות מספר מתודולוגיות מיקרופלואידיות, כל אחת עם היתרונות והחסרונות שלה או מקרי שימוש מיוחדים 6,7,8,9,10,11,12,13,14,15,16,17,18,19. לדוגמה, Gritti et al.20 הציגו שיטה שבה תולעים מוגבלות בתוך תאים גדולים. עוברים המונחים בתאים אלה מתפתחים ונעים בחופשיות תוך שהם נשארים באזור העניין המיועד במיקרוסקופ. למרות שגישה זו יעילה בדרך כלל, היא מוגבלת לשימוש בסמנים פלואורסצנטיים בהירים. לאחרונה, Keil et al.21 הציעו גרסה שונה של שיטה זו, המשלבת שסתום הידראולי על השבב כדי לרסן בעלי חיים במהלך רכישת תמונה, ובכך לטפל בכמה מגבלות של הגישה המקורית. עם זאת, מכיוון ששתי השיטות משתמשות בתאים גדולים יותר מאלה המשמשים לתולעים לכודות, החיות ממשיכות לנוע ולהסתובב לאורך כל הניסוי. כתוצאה מכך, מעקב אחר תהליכי התפתחות הופך למאתגר ודורש עיבוד תמונה נרחב כדי לתקן את תנועת בעלי החיים.
כדי להתמודד עם המגבלות הללו, מותאמת הגישה שהוצגה על ידי ברגר ועמיתיו 18 (איור 1), שבה חיות אינן מוחזקות בתא גדול אלא שוכנים בתעלת מלכודת שנועדה להתאים חיות בחלון התפתחותי קצר יותר (עד 2.5 שלבי זחל). בניגוד לשיטות מיקרופלואידיות קיימות, גישה זו שומרת על התמצאות וזהות בעלי חיים לאורך כל הניסוי ומאפשרת רכישת תמונות ברזולוציה גבוהה של תולעים מרובות במקביל ועל פני שלבי זחל מרובים בתוך מכשיר אחד.
בעלי החיים נלכדים באמצעות גיאומטריית תעלה מיוחדת שבה גובה התעלה קרוב לעובי של בעל חיים בתחילת הניסוי, ובכך מונע סיבוב. רוחבי ואורכי התעלות נבחרים כך שבעלי חיים יוכלו לנוע ולגדול לאורך זמן, מה שמקל על ההיתוך והמעבר משלב זחל אחד למשנהו. לאחר מכן ההקבלה מושגת פשוט על ידי הצבת תעלות מלכודת מרובות אחת ליד השנייה, כך שחיות מרובות נראות בשדה ראייה יחיד (FOV, איור 1A'), וניתן לדמות עד 41 חיות ביחידת התקן אחת (איור 1A). חיות על השבב מקבלות באופן רציף תרחיף מזון חיידקי מרוכז מאוד דרך תעלה בגובה נמוך, אשר באותו זמן מסייעת לכלוא חיות בקצה מערך תעלות המלכודת (שלב גובה, איור 1A, אדום). בדומה לגישה שננקטה על ידי Keil et al.21, מיושם שסתום הידראולי גדול על השבב, שניתן לנפח במהלך רכישת התמונה, ללחוץ את החיות על זכוכית הכיסוי, ובכך לשפר את הקיבוע של בעלי החיים (איור 1B). הגבלת הפעלת השסתום ההידראולי רק לתקופת רכישת התמונה ממזערת כל השפעה שלילית על התפתחות בעלי החיים, ומבטיחה התפתחות אמינה בכל שלבי הזחל. בניגוד לשיטות שתוארו על ידי Gritti et al.20 ו-Keil et al.21, לא ניתן לדמות בעלי חיים לאורך כל ההתפתחות הפוסט-עוברית באותו מכשיר. במקום זאת, מוצגים חמישה מכשירים נפרדים, הנקראים L1, L1-4, L2-A, L3-A ו-L4-A, המכסים את כל שלב L1 ושלב L2 המוקדם, שלב L1 אמצעי-מאוחר עד אמצע שלב L4, אמצע-מאוחר L2 עד לבגרות צעירה, L3 אמצעי-מאוחר עד לבגרות צעירה, ו-L4 המאוחר עד לבגרות צעירה, בהתאמה (איור 1C), המאפשרים הדמיה ללא הפרעה של חלקים גדולים מההתפתחות הפוסט-עוברית. גישה זו ננקטת בשל הגידול הגדול בגודל בעלי החיים מ-L1 לבגרות, כך שתעלה המתאימה לחיות L1 תהיה קטנה מדי עבור בוגרים, וכתוצאה מכך עצירה התפתחותית, ותעלה המתאימה לבוגרים תהיה גדולה מדי עבור L1, וכתוצאה מכך תנועה מוגזמת, סיבוב ובעלי חיים בורחים מתעלות המלכודת.
באמצעות גישה זו, מושגת התקדמות התפתחותית אמינה למגוון רקמות18, למשל, התפתחות פוסט-עוברית של ההיפודרמיס (שלב L1 עד L4), אינדוקציה של גורל תאי הפות (שלב L2 ו-L3), מורפוגנזה של הפות (L3 עד בגרות19) ופלישת תאי עוגן. מאז הצגתם, מכשירי הדמיה ארוכי טווח אלה שימשו לחקר מגוון תהליכים22,23, כאשר הפלטפורמה אף שולבה עם טכניקות כמו מיקרוסקופיה ברזולוציה גבוהה של AiryScan24, מה שמאפשר תגליות רבות שלא היו אפשריות בעבר.
בהמשך, היבטי הפעולה של מכשירי הדמיה ארוכי טווח אלה מוצגים בפרוטוקול שלב אחר שלב, המדגיש את התוצאות הצפויות וכמה אתגרים פוטנציאליים בעת הגדרת המערכת.
Protocol
פרטי הריאגנטים והציוד המשמש במחקר זה מפורטים בטבלת החומרים.
1. ייצור מכשירים
הערה: כל המכשירים יוצרו באמצעות הפרוטוקול שלהלן, עם זאת, המכשירים זמינים ישירות מהמחברים. פרוסה נפרדת מיוצרת עבור כל סוג מכשיר, כאשר כל פרוסת מכשיר מיוצרת משתי שכבות של SU8 בגבהים שונים (כלומר, שכבת מזון ושכבת מלכודת). פרוסת השסתום מיוצרת על רקיק נפרד, עם גובה יחיד של SU-8, תוך השמטת שלבים 1.3-1.6. הסילנים רעילים ומשחררים אדים קורוזיביים. שלב זה, אם כן, צריך להתבצע במכסה אדים. לפרטים על הליך הייצור, עיין ב-Berger et al.18.
- נקה ופלים באמצעות פלזמת אוויר.
- סובבו את שכבת ה-SU8 הראשונה, ולאחר מכן בצעו אפייה רכה ב-95 מעלות צלזיוס.
- חושפים את השכבה הראשונה, ואחריה לאחר אפייה ב-95 מעלות והתפתחות.
- בצע שוב ניקוי פלזמה לאחר פיתוח וייבוש פרוסות.
- מסתובבים את שכבת ה-SU8 השנייה, ולאחריה אפייה רכה בחום של 95 מעלות צלזיוס (במידת הצורך מבצעים אפייה ראשונית ב-65 מעלות).
- יישר את המסיכה השנייה לתכונות הקיימות באמצעות סמני יישור משני צידי הוופל, ולאחר מכן חשוף את השכבה השנייה.
- לאחר האפייה ומפתחים את הוופל, ואז מבצעים אפייה קשה בחום של 200 מעלות צלזיוס.
- טפלו בוופל עם כלורוטרימתיל סילאן למשך שעתיים לפחות.
- הכן אצווה של 20 גרם PDMS קדם-פולימר (חלק א') וערבב אותה היטב עם 1 גרם של המקשר הצולב (יחס 20:1, חלק ב') (ראה טבלת חומרים).
- יש להוציא את הגז למשך 10 דקות או עד שכל הבועות נעלמות.
- הסר 2 מ"ל מתערובת ה-PDMS ושמור לשלב 1.13.
- הוסף עוד 3 גרם של קישור צולב לתערובת ה-PDMS הנותרת, וערבב היטב (יחס סופי כ-5:1).
- בעזרת אצווה של 20:1 PDMS, סובב את פרוסת המכשיר ב-750 סל"ד למשך 30 שניות.
- הנח את פרוסת השסתום בכלי אלומיניום ויצוק עליו את ה-PDMS 5:1. הסר את פרוסת המכשיר למשך כ-10 דקות. לאחר הסרת הגז, הסר את כל הבועות שנותרו באמצעות פיפטה.
- אופים גם את שכבות השסתום וגם את שכבות המכשיר ב-70 מעלות צלזיוס למשך כ-15/20 דקות בהתאמה.
- העריכו את ריפוי המכשיר ושכבות השסתום על ידי בדיקה עדינה בעזרת קצה פיפטה או פינצטה. שכבת השסתום צריכה להיות מוצקה, ואילו שכבת המכשיר צריכה להישאר מעט דביקה.
- נתק את שכבת השסתום וחתוך אותה לגודל הנדרש באמצעות אזמל או סכין גילוח.
- אגרוף חור גישה לתעלת השסתום (מד 20).
- מקם את פרוסת המכשיר מתחת לסטריאומיקרוסקופ המצויד בתאורה עליונה.
- הנח בזהירות את חתיכת ה-PDMS המכילה את שכבת השסתום על פרוסת המכשיר.
- יישר את תכונות השסתום והמכשיר במדויק, והבטיח את הסרת כל האוויר הכלוא בין השכבות.
- מעבירים את המכשיר המורכב לתנור ואופים בחום של 70 מעלות למשך הלילה.
- נתק את המכשיר מהרקיק.
- אגרוף את כל חורי הגישה הנותרים (מד 20).
- הצמידו את ה-PDMS לזכוכית כיסוי באמצעות פלזמת אוויר, ולאחר מכן הכניסו את המכשיר המודבק לתנור בטמפרטורה של 70 מעלות צלזיוס למשך מספר שעות.
2. הכנת תולעים
הערה: סעיף זה מתאר הכנת תולעים על ידי הלבנה, המאפשרת יצירת מספר גדול (מאות) של בעלי חיים. שיטות סינכרון אחרות, כגון קטיף ידני, אפשריות אך בדרך כלל גוזלות זמן רב יותר ודורשות עבודה רבה. כל התולעים המשמשות בפרוטוקול נשמרות על פי פרוטוקולים סטנדרטיים בטמפרטורה של 20 מעלות צלזיוס ועל צלחות NGM עם זרעי E. coli OP50.
- החל מצלחות עם בעלי חיים גרבידיים רבים.
- שטפו בעלי חיים מהצלחת באמצעות מאגר M9.
- הוסף 5% NaClO ו-5 M של NaOH לתרחיף התולעת (200 μL/100 μL לכל תרחיף תולעת של 1 מ"ל).
- יש לנער בעדינות את תערובת ההלבנה עד שבעלי החיים מתחילים להתפרק (~10 דקות).
- תערובת הלבנת צנטריפוגה בטמפרטורת החדר, 1300 x גרם למשך דקה.
- הסר את הסופרנטנט באמצעות פיפטה והוסף כמות שווה של מאגר M9 טרי.
- שוב, צנטריפוגה בטמפרטורת החדר, 1300 x גרם למשך דקה.
- הסר את הסופרנטנט והעביר את התולעים הגלוליות לצינור של 15 מ"ל עם 5 מ"ל של מאגר M9 טרי.
- יש לנער למשך הלילה בטמפרטורה של 20 מעלות צלזיוס.
- העבירו את תרחיף התולעת דרך מסננת תאים של 10 מיקרומטר.
- צנטריפוגה את תרחיף התולעת בטמפרטורה של 1300 × גרם למשך דקה אחת בטמפרטורת החדר.
- השליכו את הסופרנטנט והשעו מחדש את התולעים בנפח שווה של מאגר M9.
- צנטריפוגה את תערובת התולעים שוב בחום של 1300 × גרם למשך דקה בטמפרטורת החדר.
- הסר את הסופרנטנט והעביר את התולעים לצלחות NGM. אם יש צורך בזחלי L1, השתמש בהם מיד.
- לאחר שהתולעים מגיעות לשלב ההתפתחותי הרצוי, יש לשטוף אותן מהצלחת באמצעות בופר S-Basal טרי המסונן דרך מסנן של 0.2 מיקרומטר.
- אפשר לתולעים לשקוע על ידי כוח הכבידה או גלול אותן על ידי צנטריפוגה ב-750 × גרם למשך דקה אחת בטמפרטורת החדר.
- השליכו את הסופרנטנט והוסיפו נפח שווה של חוצץ S-Basal טרי.
- חזור על שלבי השיקוע או הצנטריפוגה (שלבים 2.16 ו-2.17)
- הסר את הסופרנטנט והוסף נפח שווה של חוצץ S-Basal טרי.
- בצע את שלבי השיקוע או הצנטריפוגה בפעם האחרונה.
- הסר את רוב הסופרנטנט.
- שמור את התולעים בצינור עד לתחילת הניסוי.
3. הכנת חיידקים
הערה: ניתן להשתמש בזני חיידקים שונים (למשל, OP50, NA22, HT114 וכו') על השבב. התאם את היחס של מדיום שיפוע הצפיפות שנוסף לתערובת המזון כדי לפצות על הבדלים בצפיפות. כל המאגרים מועברים דרך מסנן של 0.2 מיקרומטר להסרת חלקיקים.
- הכן 40 מ"ל של LBroth, או ב -2 x 20 מ"ל בצינורות צנטריפוגה, צלוחיות ארלנמאייר סטריליות וכו '.
- חסנו את LB בחיידקים שנקטפו מצלחת מלאי.
- גדל את החיידקים תוך כדי ניעור למשך הלילה בטמפרטורה של 37 מעלות צלזיוס (~16 שעות) (OD600 = 1.9).
- חיידקי צנטריפוגה ב 3000 x גרם למשך 10 דקות.
- הסר את הסופרנטנט והוסף 2 מ"ל של מאגר S-Basal טרי לכל צינור. שלב את כל הצינורות.
- השעו מכנית את החיידקים באמצעות פיפטה.
- צנטריפוגה את החיידקים ב -3000 x גרם למשך 5 דקות.
- הסר את הסופרנטנט והוסף שוב 2 מ"ל של מאגר S-Basal טרי.
- השעו מכנית את החיידקים באמצעות פיפטה.
- צנטריפוגה את החיידקים ב -3000 x גרם למשך 5 דקות.
- הסר כמה שיותר מהסופרנטנט והוסף 1 מ"ל של מאגר S-Basal טרי לפני השעיה מכנית של כל החיידקים.
- שלב 0.60 מ"ל של מדיום שיפוע צפיפות, 0.38 מ"ל של S-Basal + 1% לפי משקל Pluronic F-127 (קופולימר טריבלוק לא יוני, המיוצג כאן כ-PF) עם 1 מ"ל של תרחיף חיידקים OP50, או 0.65 מ"ל של מדיום שיפוע צפיפות, 0.33 מ"ל של S-Basal + 1% לפי משקל PF עם 1 מ"ל של תרחיף חיידקים NA22 או HT114.
- מערבבים היטב את הכנת המזון בעזרת מערבל מערבולת.
- מסננים את המזון דרך מסננת תאים של 5 מיקרומטר או 10 מיקרומטר. מסננת קטנה יותר מומלצת במיוחד בעת שימוש במכשירים קטנים יותר, למשל מכשירי L1.
הערה: ניתן לשמור מזון בטמפרטורת החדר עד יומיים.
4. הכנת שבבים
הערה: עיין באיור 2 לסקירה סכמטית של המכשיר, הצינורות והחיבורים. כל המאגרים מועברים דרך מסנן של 0.2 מיקרומטר להסרת אבק. סיכת הפלדה המוזכרת בשלבים הבאים מתייחסת לצינור קצר וחלול המשמש לממשק צינורות ה-OD הגדולים יותר (1/16 אינץ') לחורים בקוטר הקטן המיוצרים במכשיר ה-PDMS. סיכות פלדה אלו פשוט מוכנסות לקוטר הפנימי של הצינור ולאחר מכן נדחפות לתוך חומר ה-PDMS, ומחברות ביעילות בין השניים.
- התחל במילוי מזרק במים נטולי יונים (DI).
- חבר מחט 23 גרם וחתיכה ארוכה של צינור 1/16 אינץ', עם סיכת פלדה חלולה (כפופה בזווית של 90 מעלות) בקצה. הצינור צריך להיות ארוך מספיק כדי להתרחב משלב הסולנואיד למיקרוסקופ.
- מלאו את הצינור במי DI מהמזרק וחברו אותו לכניסת השסתום על ידי הכנסת סיכת הפלדה לתוך החור המנוקב (איור 2A,J).
- הסר את המזרק והמחט, ולאחר מכן חבר את הצינור לסולנואיד מחוץ לשבב (איור 2A,J).
- באמצעות תוכנת ההדמיה, הפעל את הסולנואיד ולחץ על המכשיר למשך מספר דקות כדי להוציא את כל האוויר מהשסתום. ודא את ההשלמה על ידי בדיקה ויזואלית של ממשק האוויר-מים על השבב, שאמור להיראות כהה ולהיעלם לתוך חומר ה-PDMS (איור 2B).
- כבה את הסולנואיד (איור 2C).
- מלאו מזרק של 1 מ"ל בתמיסת החיידקים המסוננים (מספיק ~0.5 מ"ל מזון).
- חבר למחט מחט של 30 גרם וחתיכה ארוכה של צינור בגודל 1/32 אינץ'.
- לחץ על הבוכנה כדי למלא גם את המחט וגם את הצינור המחובר, וודא שלא יישאר אוויר במזרק או בצינור.
- הכנס את הצינור בגודל 1/32 אינץ' ישירות לכניסת המזון של המכשיר המיקרופלואידי, באמצעות פינצטה כדי למנוע נזק לצינור (מומלץ להשתמש בפינצטה SMD) (איור 2D,K).
- הנח את המזרק על משאבת המזרק (איור 2D).
- לחץ על בוכנת המזרק באמצעות בורג האגודל מאחור כדי למלא את המכשיר בנוזל. טיפת נוזל אמורה להופיע בכל חיבור פתוח (איור 2D, חץ).
- חסום גם את כניסת התולעת וגם את יציאת התולעת עם סיכת פלדה אטומה (סיכת פלדה עם חתיכה קצרה של צינור 1/16 אינץ' מחוברת ואטומה על ידי צריבה) (איור 2E,L).
- הפעל לחץ נוסף באמצעות בורג האגודל כדי להסיר את כל האוויר שנותר במכשיר (איור 2E, חץ).
- הסר את הסיכה החסומה בשקע והצמד את מיכל הפסולת (עשוי מצינור קריוביאלי או מיקרוצנטריפוגה, עם שני סיכות פלדה תקועות דרך המכסה ומאובטחות בדבק). מיכל הפסולת מחובר באמצעות חתיכה קצרה של צינור בגודל 1/16 אינץ', כאשר קצה אחד מחובר למיכל והקצה השני מחובר לסיכת פלדה חלולה (כפופה ב-90°) (איור 2F,G,M).
- דחוף את המזרק כדי לוודא שמיכל הפסולת מחובר כהלכה ושאין סתימות במערכת. לשם כך, דחפו כמות קטנה של נוזל דרך המערכת (סובבו את בורג האגודל על משאבת המזרק) עד שהנוזל יזרום דרך צינורות הפסולת (איור 2G, חץ).
- הסר את סיכת הפלדה החסומה השנייה.
- דחפו את המזרק עד שתופיע טיפה קטנה של נוזל בכניסת התולעת (איור 2H,N).
- חבר חתיכה ארוכה יותר של צינור 1/16 אינץ' (15-20 ס"מ) למזרק של 1 מ"ל מלא במאגר S-Basal, באמצעות מחט 23 G (איור 2H,N).
- חבר סיכת פלדה ישרה 23 גרם לקצה השני של הצינור.
- מלאו את המחט והצינור בחיץ מהמזרק, וודאו שלא יישאר אוויר במזרק או בצינור.
- הכנס את סיכת הפלדה בקצה הצינור לתוך הצינור המכיל את התולעים.
- דחוף כמות קטנה של נוזל דרך הצינור, וודא שלא נשאר אוויר.
- משוך את התולעים לתוך הצינור, אך אל תמשוך אותן למזרק.
- דחפו את המזרק שמחובר לתולעים עד שתופיע טיפה קטנה של נוזל על סיכת הפלדה (איור 2H).
- הכנס את סיכת הפלדה לכניסת התולעת (איור 2I).
הערה: ניתן לבצע את הכנת המכשיר לפני הכנת התולעת הסופית ולהשאיר אותה על המיקרוסקופ עד שהתולעים מוכנות.
5. טעינת תולעת והדמיה
- הנח את המכשיר על מיקרוסקופ בהגדלה נמוכה (פי 5 או פי 10) או על מיקרוסקופ דיסקציה.
- זהה את יחידת ההתקן הנמצאת כעת בשימוש ומצא את כניסת התולעת באמצעות תאורת שדה בהיר.
- מקם את ההתקן כך שהכניסה נראית בצד אחד של שדה הראייה והחלק האחורי של כניסת תעלת המלכודת נראה בצד השני.
- לחץ בעדינות על הבוכנה של מזרק התולעת. הנוזל יזרום באופן ניכר מהכניסה דרך מערך התעלות לכיוון היציאה. נוכחותם של חיידקים וההבדל במקדם השבירה עקב תוספת מדיום שיפוע הצפיפות הופכים את זרימת הנוזל לברורה.
- ודא שהתולעים מופיעות מהכניסה וזורמות לכיוון החלק האחורי של מערך התעלות.
- דחף בעדינות את בעלי החיים לכיוון מערך הערוצים. ברגע שבעל חיים פונה לערוץ, דחף אותו לתוך התעלה, וחזור על הפעולה עבור בעלי חיים נוספים.
הערה: בעלי חיים צריכים להיות מכוונים עם ראשיהם לכיוון השקע כדי שתהיה להם גישה נוחה למזון. ניתן לכוון אותם על ידי דחיפה ומשיכה על הבוכנה ועל ידי השחייה שלהם. - לאחר שמספיק בעלי חיים נלכדו, הניחו את המזרק, שעדיין מחובר לכניסת התולעת, על שלב המיקרוסקופ, שם הוא יישאר לאורך כל הניסוי. ייתכן שיהיה צורך בניתוק קצר של צינור התולעת מהמזרק כדי לשחרר כל הצטברות לחץ, ולאחר מכן לחבר אותו בזהירות למחט הקהה.
- אם בוצעה טעינה במיקרוסקופ דיסקציה, העבר את המכשיר למיקרוסקופ ההדמיה. הצינור יכול להישאר מחובר לשבב, והמזרק מחובר למשאבה.
- הפעל את משאבת המזרק והפעל אותה בקצב מוגדר מראש של 1 μL/h עבור 0.5 μL, הגדל את הקצב ב-100 μL/h עבור 0.5 μL, והפחית אותו בחזרה ל-1 μL/h. מחזור זה חוזר על עצמו באופן אוטומטי במשך כל הניסוי. למידע על אופן תכנות המשאבה, עיין במדריך למשתמש של הציוד.
- הנח את המכשיר על המיקרוסקופtagה וודא שהוא מוחזק היטב (הצעות למנגנוני הרכבה ניתן למצוא באיור 3A).
- אם לא בוצעה טעינה במיקרוסקופ ההדמיה, זהה את יחידת המכשיר המעניינת בהגדלה נמוכה.
- עבור להגדלת ההדמיה הרצויה.
הערה: ההתקנים תואמים לכל סוגי המטרות. - זהה את בעלי החיים ואזורי העניין במערך ערוצי הלכידה והגדר את תנאי ההדמיה הרצויים.
- תמונה בתנאי ההדמיה הרצויים, כאשר השסתום על השבב, מופעל דרך הסולנואיד 10 שניות לפני רכישת התמונה, כך שבעלי החיים מוחזקים במקומם.
הערה: הפעלת השסתום על השבב תאריך ותשטח את בעלי החיים, ואולי תדרוש התאמות לאזור ההדמיה המעניין (ROI).
6. הכנת התקנה
הערה: סעיף זה מתייחס להכנה הראשונית של מנגנון הבקרה של המכשיר ואין צורך לחזור עליו לפני כל ניסוי. עיין באיור 3B,C. מכיוון שסולנואידים רבים דורשים מתח גבוה יותר, סביר להניח שהסולנואיד לא יחובר ישירות למיקרו-בקר אלא באמצעות ממסר או MOSFET (ראה איור 3C).
- זהה מקור אוויר בלחץ (למשל, התקנת אספקת קיר או בלון גז).
- חבר את מקור הלחץ לווסת לחץ מתאים (טווח לחץ של 0-2 בר) באמצעות צינורות 6 מ"מ (מקור קיר) או חבר ישירות ווסת מתאים לבלון הגז.
- חבר את ווסת הלחץ לכניסת שסתום הסולנואיד (צינור 6 מ"מ, ראה איור 3B).
- מקם את הסולנואיד קרוב ככל האפשר לשלב המיקרוסקופ (מוצע ~0.5-1 מ' מהבמה, אם כי מרחקים ארוכים יותר אפשריים במידת הצורך).
- חבר את שסתום הסולנואיד באופן אלקטרוני לבקר שנבחר. קיימות אפשרויות שונות, כגון שליטה בו באמצעות לוח מיקרו-בקר נפרד (למשל, Arduino) או כרטיס DAq קיים.
7. ניקוי ואחסון
- לאחר השלמת הניסוי, הסר את המכשיר מהמיקרוסקופ.
- הסר את נוזל הטבילה. ניתן להסיר שמן טבילה עם ממיסים אורגניים (למשל, אצטון, מתנול וכו').
- הנח את המכשיר על משטח ישר ונתק את כל הצינורות למעט צינורות השסתום. כדי לנתק בבטחה כל צינור, לחץ כלפי מטה על ה-PDMS קרוב אליו ומשוך בעדינות. אין להרים ולכופף את המכשיר, מכיוון שהדבר עלול לגרום לשבירת זכוכית הכיסוי.
- נקה את משטח ה-PDMS עם 70% אתנול.
- אחסן את המכשיר בטמפרטורת החדר כשצינור השסתום מחובר.
הערה: ניתן לעשות שימוש חוזר במכשיר עד לשימוש בכל היחידות, ככל הנראה ללא צורך במילוי מחדש של צינור השסתום. עם זאת, המים בצינורות השסתום יתאדו לאורך תקופה ממושכת וייתכן שיהיה צורך למלא אותם מחדש.
תוצאות
עיצוב ומידות המכשיר
חמישה מכשירים נפרדים תוכננו כדי להכיל את כל ארבעת שלבי הזחל. מכשירים אלה מיועדים כדלקמן: L1, עבור זחלי L1 שנטענו מיד לאחר הבקיעה וצולמו עד לשלב L2; L1-L4, המסוגל להחזיק זחלים משלב L1 האמצעי עד המאוחר עד תחילת L4; L2-A, מתאים לבעלי חיים בערך מאמצע שלב L2 ועד לבגרות צעירה; L3-A, לבעלי חיים בערך מאמצע שלב L3 ועד לבגרות צעירה; ו-L4-A, המכיל בעלי חיים בערך משלב L4 המאוחר ועד לבגרות צעירה.
כל המכשירים עוקבים אחר אותה פריסה חיונית, המורכבת מכניסת תולעת, כניסת מזון חיידקית אחת (או 2 במקרה של החלפת מדיה) ויציאת פסולת משותפת. בין חלק הכניסה והיציאה, ממוקם מערך של 41 תעלות מלכודת מקבילות, כאשר צד הכניסה והיציאה מופרד ביעילות על ידי תעלת אספקת המזון בגובה נמוך יותר (איור 1A, A′). מידות הערוצים נבחרו להיות ארוכות ורחבות משמעותית מהתולעים שנטענו בתחילת הניסוי, עם אורך/רוחב של 400/15 מיקרומטר עבור התקני L1, 575/22 מיקרומטר עבור התקני L1-L4, 800/27 מיקרומטר עבור התקני L2-A, 900/30 מיקרומטר עבור התקני L3-A ו-1000/65 מיקרומטר עבור התקני L4-A (קובץ משלים 1, קובץ משלים 2, תיק משלים 3, תיק משלים 4, ותיק משלים 5).
אורך התעלה נבחר כך שיתאים לגודל אליו הגיעו בעלי החיים בסוף הניסוי, בעוד שהרוחב נבחר כך שתולעים בתחילת הניסוי תפסו כשני שלישים מרוחב התעלה. עיצוב זה מאפשר מספיק מקום לצמיחה ותנועה במהלך ההיתוך תוך מניעת תולעים להסתובב או להסתובב. בניגוד לרוחב, גובה התעלה נקבע קרוב לעובי התולעים בתחילת הניסוי: 8 מיקרומטר לזחלי L1 מוקדמים, 12 מיקרומטר לזחלי L1 אמצעי/מאוחר, 15 מיקרומטר לזחלי אמצע L2, 17.5 מיקרומטר לזחלי אמצע L3 ו-22.5 מיקרומטר לזחלי L4 מאוחרים, המקבילים לזחלי L1, L1-L4, L2-A, L3-A. ומכשירי L4-A, בהתאמה. גובה הערוץ המופחת, בשילוב עם רוחב שנבחר בקפידה (שמירה על יחס גובה לרוחב של 0.5-0.6), מבטיח שהתולעים יישארו בכיוון קבוע. יש לציין כי עם גובה תעלה קטן מספיק, כל התולעים ממוקמות באופן עקבי בכיוון הצדדי הרצוי.
תעלת אספקת המזון יוצרה בגובה של 3 מיקרומטר עבור L1, ו-5 מיקרומטר עבור כל המכשירים האחרים, מה שמבטיח שחיידקים יוכלו להגיע בקלות לבעלי החיים מבלי שבעלי החיים יברחו מתעלות המלכודת. כל המכשירים משתמשים באותה שכבת אספקת מזון (קובץ משלים 6) ובאותה שכבת שסתום (קובץ משלים 7). שימו לב ששכבת השסתום מיוצרת על פרוסה נפרדת בגובה 20 מיקרומטר ומונחת רק על שכבת המכשיר במהלך ייצור מכשיר ה-PDMS (שלב 1.21).
אילוצים גיאומטריים ספציפיים לשלב, החיוניים למניעת תולעים להסתובב או להתהפך מכף רגל ועד ראש, מחייבים שימוש בשלושה סוגי מכשירים נפרדים כדי להתאים לכל שלבי הזחל. אם זחלי L1 היו ממוקמים בתעלה בגודל של חיות בוגרות צעירות, הם לא היו נשארים יציבים והיו יוצאים במהירות מתעלת המלכודת.
הכנת C. elegans
אלא אם צוין אחרת, תולעים נשמרו על פי פרוטוקולים סטנדרטיים25 על לוחות NGM שנזרעו עם E. coli OP50 ב-20 מעלות צלזיוס. סעיף הכנת התולעת מתאר במפורש את הכנת אוכלוסיית התולעים המסונכרנת המשמשת בניסוי הדמיה. הסנכרון בוצע על פי פרוטוקולים סטנדרטיים באמצעות אקונומיקה נתרן היפוכלוריט26, ששונה עם שלב סינון נוסף להסרת פסולת ובעלי חיים שלא בקעו לאחר רעב בלילה. המטרה היא להשיג זחלי L1 מסונכרנים רבים, אשר לאחר מכן נזרעים על לוחות NGM או נטענים ישירות לתוך מכשיר ההדמיה. שיטות סנכרון אחרות, כגון קטיף ידני או הטלת ביצים מבוקרת, מתאימות באותה מידה. עם זאת, הם עמלים יותר ביצירת מספיק בעלי חיים (מומלץ 200 לכל מצב).
לאחר שהתולעים הגיעו לשלב הרצוי, ניתן לשטוף אותן בעדינות מלוח ה-NGM באמצעות S-Basal נקי (באופן אידיאלי מסונן דרך מסנן של 0.2 מיקרומטר). המטרה היא לאסוף כמה שיותר בעלי חיים מבלי לאסוף חיידקים או פסולת מהצלחת. בעלי חיים נאספים בצינור צנטריפוגה קטן ונשטפים 2-3 פעמים עם מאגר S-Basal טרי, ולבסוף מסירים כמה שיותר נוזלים. לאחר מכן נלקחים בעלי חיים ישירות מהנפח המרוכז. אם ריכוז בעלי החיים נמוך מדי, הטעינה תהיה איטית יותר, תדרוש נפח גדול יותר של נוזל לזרום דרך המכשיר ותגדיל את הסיכון לחסימת תעלות מלכודת עם פסולת.
הכנת מזון חיידקי
גידול החיידקים מתבצע על פי פרוטוקולים סטנדרטיים, כאשר ריכוז החיידקים הראשוני (OD600 = 1.9) גדל בערך פי 40 במאגר S-Basal (מסונן דרך מסנן 0.2 מיקרומטר) ומעורבב עם מדיום שיפוע הצפיפות ומאגר S-Basal המכיל PF (מסונן דרך מסנן 0.2 מיקרומטר). התוצאה הצפויה של שלב תהליך זה היא הכנת תרחיף חיידקים צפוף מאוד ומניעת שקיעת חיידקים במהלך ניסוי ההדמיה. הצפיפות הגבוהה נחוצה כדי להאכיל את בעלי החיים על השבב בקצבי הזרימה הנמוכים המשמשים באספקת מדיה (1 μL/h). מטרת מדיום שיפוע הצפיפות היא למנוע משקעים של חיידקים במהלך הניסוי, ומטרת ה-PF היא למנוע מחיידקים להיצמד לדפנות התעלה. גם מדיום שיפוע הצפיפות וגם ה-PF אינם רעילים ואינם משפיעים על כדאיות בעלי החיים.
אם נעשה שימוש בסוג חיידק אחר בניסוי, יהיה צורך לקבוע את הריכוז הדרוש של מדיום שיפוע הצפיפות. ניתן להשיג זאת על ידי ערבוב תרחיף חיידקים עם כמויות משתנות של המדיום ואחריו צנטריפוגה. אם ריכוז שיפוע הצפיפות נמוך מדי, חיידקים ישקעו; אם הריכוז גבוה מדי, חיידקים יצופו. לאחר שנמצא ריכוז מתאים, מומלץ לאמת את התוצאה על ידי השארת תערובת החיידקים בטמפרטורת החדר למשך כ-48 שעות כדי לציין כיצד המזון יתנהג במהלך הניסוי. לאחר הניסוי, מומלץ גם לבדוק את המזרק שדרכו מסופקים החיידקים ולוודא שהחיידקים אינם שוקעים או צפים. ניתן לפצות על ההבדל בנפח הנובע מהוספת כמויות שונות של Optiprep על ידי הוספת פחות או יותר S-Basal + 1% לפי משקל PF. באופן דומה, ניתן להוסיף מדיה או תרכובות נוספות (למשל, אוקסין) למתלה, והנפח הנוסף מופחת מנפח ה-S-Basal + 1% לפי משקל PF.
הכנת התקנה
הגדר את מערכת אספקת הלחץ קרוב ככל האפשר למיקרוסקופ, כך שניתן יהיה להפעיל אותה בנוחות. כל ריצות הצינורות, במיוחד צינורות 1/16 אינץ' המתחברים לשבב, צריכים להישאר קצרים (פחות מ-0.5 מ' עבור צינורות OD בגודל 1/16 אינץ') (איור 2 ואיור 3B). כפי שצוין בסעיף לעיל, ניתן להשיג שליטה ממוחשבת על שסתום השבב במגוון דרכים. זה אמור להיות אפשרי בכל תוכנת מיקרוסקופ (שנבדקה ב-Micro-Manager, Metamorph, NIS ו-ZenBlue), או על ידי חיבור לוח מיקרו-בקר ייעודי (למשל, Arduino) או על ידי חיבור המערכת לכרטיס קליטת נתונים (DAq) קיים, באמצעות פלט דיגיטלי. לאחר מכן יש להגדיר את פלט הלוח שנבחר כתריס, שנדלק 10 שניות לפני רכישת התמונה או מופעל באופן ידני במהלך הגדרת המכשיר. כאמור, חיבור הסולנואיד ישירות למיקרו-בקר אינו מומלץ; במקום זאת, חיבור באמצעות MOSFET או מתג ממסר כך שהסולנואיד והמיקרו-בקר יישארו מבודדים אלקטרונית (איור 3C).
בדומה לצינורות אספקת הלחץ, שמור על כל שאר ריצות הצינורות לשבב (1/16 אינץ' OD ו-1/32 אינץ' OD) קצרות ככל האפשר. שמור את צינורות התולעת והפסולת (1/16 אינץ' OD) מתחת ל-2.5 ס"מ ו-20 ס"מ, בהתאמה. צינור אספקת החיידקים (1/32 אינץ' OD) חייב להיות ארוך מספיק כדי להתחבר ממשאבת המזרק למכשיר לאחר הנחתו על המיקרוסקופtagה. עם זאת, מומלץ מאוד לקצר זאת ככל האפשר ולמקם את משאבת המזרק קרוב לשלב המיקרוסקופ, למשל ליד הבמה, באמצעות מדף או על גבי מארז אינקובטור. כל אורך צינור שנוסף למערכת יגביר את הלחץ האחורי המורגש בעת העמסת בעלי חיים למכשיר ויגביר את הלחץ הכולל על בעלי חיים לכודים.
הפעלת המכשיר
ניתן להכין ולחבר את כל הצינורות למחט הקהה, סיכת הפלדה והמזרק המתאימים בשלב זה (תחילת שלב 4 של פרוטוקול). כפי שצוין לעיל, שמור על אורך הצינור קצר ככל האפשר (איור 2J-N). חשוב לציין, יש להקפיד שלא יישארו בועות אוויר במזרקים או בצינורות, שכן אלה יפריעו להעמסת בעלי חיים ועלולים לגרום לבעלי חיים לברוח מתעלת המלכודת במהלך הניסוי. ניתן להסיר בועות אוויר מהמזרק במספר דרכים שונות, למשל על ידי מילוי המזרק, היפוכו וניעורו בעדינות כך שבועות האוויר יעלו לראש המזרק (לא מומלץ להניף את המזרק, מכיוון שהדבר עלול לגרום ללכידת בועות אוויר נוספות). לחלופין, ניתן למלא את המזרק על ידי הדבקתו במאגר והזזת הבוכנה במהירות למעלה ולמטה כדי להסיר את רוב הבועות במהירות.
לאחר מילוי המזרק וללא בועות, המחט הבוטה והצינור מחוברים וממלאים במאגר. יש לנקוט בזהירות מיוחדת גם בעת מילוי המזרק, שכן אוויר יכול להילכד בקלות בחלק הפלסטי של המחט הבוטה. אם אוויר כלוא, החלף את המחט. לחלופין, מילוי מוקדם של המחט בנוזל, למשל, באמצעות פיפטה, יכול להקל על הבעיה.
כאשר כל הרכיבים במקומם, ניתן לחבר את הצינור למכשיר, החל מהצינור המחבר את הסולנואיד ואת שסתום השבב (איור 2A-C,J). צינור זה מלא בתחילה במים נטולי יונים, והמערכת מופעלת בלחץ כדי להסיר את כל האוויר מתעלת השסתום ללא מוצא. PDMS חדיר לגז; לפיכך, הלחץ המוגבר ידחוף את כל האוויר מהתעלה לתוך ה-PDMS, וישאיר את תעלת השסתום מלאה במים. ניתן לעקוב אחר תהליך זה במיקרוסקופ, ולהבטיח שכל תעלת השסתום מלאה. לאחר מילוי השסתום, ניתן לחבר את אספקת החיידקים, וניתן למלא את המכשיר וללחוץ עליו על ידי חסימת כל הכניסות/יציאות הפתוחות (איור 2D,E,K,L). האוויר נעקר, וניתן לעקוב אחר התהליך במיקרוסקופ. לאחר שכל האוויר נעקר, החיידקים צריכים למלא את המכשיר באופן אחיד. הפינים החוסמים מוסרים, וצינור איסוף הפסולת מחובר (איור 2F,G,M). בשלב זה, כמות קטנה של נוזל צריכה לזרום דרך המכשיר לצינור איסוף הפסולת, ולהבטיח שכל החיבורים לצינור פתוחים. ניתן לאשר זאת חזותית לפני חיבור הצינור לצינור האיסוף. אם לא זורם נוזל לצינור איסוף הפסולת, סביר להניח שהוא חסום. זה יגרום להצטברות לחץ במהלך הניסוי, מה שישפיע לרעה על בעלי החיים הלכודים. אם הצינור או חיבוריו חסומים, הסר אותו ונקה את כל החיבורים באמצעות מחט או שטוף אותם עם מזרק מלא במים.
לבסוף, צינורות התולעת יכולים להיות מחוברים (איור 2H,N). תולעים נאספות מצינור הצנטריפוגה פשוט על ידי יניקתן לתוך הצינור המחובר למזרק המלא ב-S-Basal. יש למשוך את בעלי החיים רק לתוך הצינור, ולא למזרק. לאחר מכן ניתן לחבר את הצינור למכשיר. לפני כן, כמות קטנה של נוזל נדחפת החוצה מהמכשיר ומצינור התולעת, ושתי הטיפות מחוברות כך שלא נדחף אוויר למכשיר במהלך הטעינה.
טעינת תולעת
עם כל החיבורים שנוצרו, ניתן להעמיס בעלי חיים על ידי דחיפה ומשיכה של הבוכנה של מזרק התולעת. בעלי חיים יישטפו מהכניסה לכיוון מערך תעלות המלכודת; עם זאת, הם ישחו באופן טבעי נגד הזרם שהם חווים. בעלי חיים, אם כן, צריכים להיות מכוונים מחדש כשראשם פונה לתעלת המלכודת. התמצאות נכונה של בעלי החיים מושגת על ידי דחיפה ומשיכה של הבוכנה ומתן זמן לבעלי החיים להסתובב לכיוון הרצוי. ניתן להשיג זאת כמעט על בסיס תולעת בודדת אך ידרוש תרגול מסוים. ברגע שחיות מכוונות נכון, הן יכולות להידחף לתוך תעלת המלכודת ולהחליק לקצה התעלה, שם מדרגת גובה עוצרת אותן (איור 1A,B). אם בעלי חיים אינם יכולים להיכנס לערוץ, הם גדולים מדי עבור המכשיר שנבחר ויש לצלם אותם במכשיר גדול יותר. אם בעלי חיים יכולים להסתובב או להסתובב כאשר הם מונחים בתעלת המלכודת, הם צעירים מדי, ויש צורך להשתמש במכשיר קטן יותר, או להשאיר את החיות לגדול עוד כמה שעות.
חשוב לציין, בעלי חיים בערוצים שונים לא ישפיעו זה על זה. לכן, בעלי חיים שנטענו בצורה לא נכונה לא ישפיעו על אלה שנטענו כהלכה, אולם לא תהיה להם גישה מספקת למזון ולכן יגדלו לאט יותר או יעצרו את ההתפתחות.
אם בעלי חיים נטענים בגיל המתאים, צריכה להתרחש תנועה מינימלית לאורך ציר התעלה האורכית. אולם חיות חופשיות להתנועע (איור 1B) ולהתחיל לאכול תוך כמה דקות. אם בעלי חיים מראים תנועה משמעותית לאורך ציר התעלה האורכית, סביר להניח שהדבר נגרם על ידי הצטברות לחץ במכשיר או על ידי בועת אוויר שנתקעה איפשהו בצינור, מחט קהה או מזרק. ניתן לשחרר הצטברות לחץ בתוך המכשיר על ידי ניתוק עדין של צינור התולעת מהמחט הקהה וחיבורו מחדש בעדינות. אם בועת אוויר נשארה תקועה בתוך המערכת למרות השלבים ואמצעי הזהירות שהוזכרו לעיל, ייתכן שיהיה צורך להסיר את מזרק התולעת כולו ולהחליף אותו בחדש ללא בועות אוויר. בועות אוויר במערכת מתפקדות כקפיצים הנדחסים במהלך הטעינה ומשתחררים לאט לאחר העמסת בעלי חיים. הזרימה שנוצרת על ידי התרחבות בועות האוויר עלולה לגרום לחוסר יציבות במערכת, ולדחוף את בעלי החיים אל מחוץ לתעלות המלכודת.
קליטה ופיתוח של תמונות על-השבב
לבסוף, ברגע שבעלי חיים נטענים, רכישת תמונות יכולה להתחיל. באופן עקרוני, המכשירים תואמים לרוב שיטות ההדמיה, שדה בהיר, אפיפלואורסצנציה 18,19,22,23 (איור 4), דיסק מסתובב קונפוקלי19, ואפילו שיטות ברזולוציה גבוהה (AiryScan24), שכן כל ההדמיה מתבצעת דרך זכוכית כיסוי בעובי 170 מיקרומטר. כתוצאה מכך, המכשיר המיקרופלואידי מראה השפעה מועטה עד אפסית על איכות התמונה הניתנת להשגה על השבב. עם זאת, יש לבחור תנאי הדמיה מתאימים שאינם משפיעים על כדאיות בעלי החיים ללא קשר לשיטת ההדמיה. עוצמות עירור גבוהות יביאו בקלות להלבנת פלואורופור ולעצירה התפתחותית עקב האנרגיה והחום הגבוהים המוענקים לדגימה. מומלץ זמני חשיפה קצרים (~10 ms) ועוצמות עירור נמוכות (פחות מ-10% ממקור LED פלואורסצנטי טיפוסי), המניבים תמונה שמישה בהגדרת ניגודיות של min = 0 ו- max = 1000 (בעת שימוש במצלמת 16 סיביות) (איור 4).
נתונים מייצגים המתקבלים באמצעות התקני L1, L1-4 ו-L2-A מוצגים באיור 4. מראה את התפתחות תאי האפיתל של C. elegans מבקיעה/רעב לילי לשלב הזחל האמצעי של L2 (איור 4A, סרטון משלים 1), אינדוקציה של תאי מבשר הפות בעלי גורל של 1 מעלות וחלוקתם לאחר מכן מסוף L1 לשלב הזחל המוקדם של L4 (איור 4B, סרטון משלים 2) ולבסוף היווצרות הפות של C. elegans משלב הזחל המוקדם של L3 ועד להיפוך במעבר לבגרות (איור 4Cסרט משלים 3).,
כל יישום מלווה בכימות של מדדי תזמון התפתחותיים שונים. התמונות באיור 4A,B מוצגות ללא כל עיבוד לאחר החלה, כלומר לא הוחל דה-קונבולוציה או רישום תמונה. התמונות באיור 4C, לעומת זאת, הופרדו27 ונרשמו, מה שמדגיש את השיפורים באיכות התמונה האפשריים בעת שימוש במכשירי הדמיה לטווח ארוך.
ראשית, זיהוי ההתחלה של כל חלוקת תאי תפר עבור חיות שמוצג באיור 4A (ראו סרטון משלים 1 לקורס במשרה מלאה), מה שמצביע על חלוקה עקבית ובזמן של כל התאים על פני 12 חיות (איור 4D). באמצעות תאי התפר, הוערך גם התזמון ההתפתחותי הכללי בכל ארבעת שלבי הזחל, ונמצא כי כל חלוקות תאי התפר הושלמו לאחר 12.0 שעות ±-1.7 שעות (ממוצע ± SD) ב-L1 (n = 22), 10.2 שעות ±-1.0 שעות ב-L2 (n = 27), 10.9 שעות ±-1.4 שעות ב-L3 (n = 27) ו-14.6 שעות ±-2.2 שעות בחיות L4 (n = 19). נתונים אלה עולים בקנה אחד עם ערכי הספרות 2,28 כמו גם ערכים שנמדדו בבעלי חיים שגדלו בצלחת, הניבו זמני התפתחות חציוניים עבור L1 15 שעות (n = 21), L2 10 שעות (n = 15), L3 12 שעות (n = 21) ו-L4 12.5 שעות (n = 61) (אומץ מברגר ואחרים 18). העיכובים הקלים שנצפו הם ככל הנראה תוצאה של רכישת תמונה וכתוצאה מכך פוטוטוקסיות או הכליאה המוגברת ברגע שבעלי החיים גדלו ויהיו ערוץ מלכודת.
שנית, עקבנו אחר גדילת בעלי חיים לאורך שלבי L2 ו-L3, וכימתנו את אורך בלוטת המין כאינדיקטור מצוין להתקדמות התפתחותית (איור 4E, ראו סרט משלים 2 לקורס במשרה מלאה). בדומה לחלוקת תאי התפר, ניתן היה למדוד את אורך בלוטת המין המדויק הודות לכיוון החיה הישר, ונמצאה צמיחה עקבית של בלוטת המין בכל בעלי החיים שצולמו (n = 19). חלוקת ה-VPC הראשונה בניסויים אלה נצפתה 14.26 שעות ±-2.47 שעות לאחר תחילת הניסוי (~30 שעות לאחר הזריעה), כאשר השנייה התרחשה 1.46 שעות ±-0.13 שעות לאחר מכן (n = 19). נתונים אלה תואמים היטב את ערכי הספרות שנקבעו על לוחות NGM29,30. אוילינג ואמברוס30 מצאו שהחלוקה הראשונה מתרחשת לאחר כ-29 שעות והשנייה כ-3 שעות לאחר מכן.
לבסוף, הזמן שבו מגיעים לשלבים ספציפיים בהתפתחות הפות כומת (איור 4F, ראה סרט משלים 3 לקורס במשרה מלאה), והעריך באופן ספציפי את הזמן הדרוש להתקדמות מהתפשטות (L4.0, t1) לשלב האמצע של L4 (L4.5, t4) בהתאם לתת-השלבים שהוגדרו על ידי Mok et al.31. זמן ההתקדמות הממוצע בין t1-t2 היה 3.8 שעות ±-1.2 שעות, בין t2-t3 היה 3.5 שעות ±-1.2 שעות, ובין t3-t4 היה 2.8 שעות ±-1.6 שעות (n = 7), מה שמצביע על התקדמות התפתחותית ליניארית בקירוב. בדומה לבדיקת התזמון ההתפתחותית, זמנים אלה, במיוחד t1-t2, נראים מעט מאוחרים בהשוואה לערכי הספרות המדווחים (t1-t2: 0.7 שעות, t2-t3: 3 שעות, t3-t4: 2.3 שעות31), אולי בגלל מידות המכשיר הצרות שמאטות את ההיתוך. עם זאת, תזמון ההתפתחות נשאר עקבי מאוד בקרב בעלי חיים, וכולם מתקדמים בהצלחה לבגרות.
פיצוי על תנועת בעלי חיים וסחיפה במיקרוסקופ
תנועת בעלי חיים לאורך מחסנית Z בודדת היא בדרך כלל מינימלית כאשר שסתום על-השבב מופעל. עם זאת, בעלי חיים לא צפויים להישאר דוממים לחלוטין. ניתן לפצות על הריצוד השיורי שנצפה בערימה בודדת על ידי הגדלת הלחץ להפעלת השסתום על-השבב, הפחתת זמן החשיפה המשומש או הגדלת צעד-ה-Z שנבחר כדי להאיץ את רכישת המחסנית. ניתן להפחית עוד יותר את זמן רכישת המחסנית על ידי שימוש בדוחף Z פייזו, וכתוצאה מכך תנועת Z מהירה משמעותית בהשוואה לדוחף מיקוד מיקרוסקופ קונבנציונלי, או על ידי שימוש במסננים מרובי-פסים (למשל, GFP/mCherry) כך שניתן לרכוש צבעים נפרדים ללא צורך בהחלפת מסננים גוזלת זמן. לעיון, בדוגמאות שסופקו (איור 4 וסרט משלים 1, סרט משלים 2 וסרט משלים 3), זמן רכישת המחסנית היה בדרך כלל בין 3 ל-8 שניות. ניתן להסיר תנועה שיורית גם באמצעות שיטות רישום תמונות שונות במידת הצורך.
בעלי חיים על שבב צפויים לגדול בהתמדה. לפיכך, תכונות מעניינות ישתנו באופן בלתי נמנע לאורך ציר הערוץ האורכי (איור 4A,B, סרט משלים 1 וסרט משלים 2). לכן, מומלץ להגדיר את ה-FOV של ההדמיה כך שהתכונה המעניינת יכולה לגדול ל-FOV ולא ללכת לאיבוד במהלך הניסוי (איור 1B ואיור 4A,B). לחלופין, ניתן לדמות בעלי חיים במספר FOVs סמוכים, המכסים את כל גוף החיה. עם זאת, זה עלול להקנות פוטוטוקסיות ומתח נוספים. בדומה לתנועת Z, הליכי רישום שונים יכולים לפצות על תנועת בעלי חיים בערוץ לאורך זמן. אם בעלי חיים מראים תנועה לא יציבה לאורך ציר האורך, נרחבת יותר ממה שניתן לייחס לגדילה, סביר להניח שהדבר נגרם על ידי בועת אוויר.
כל מכשיר הדמיה לטווח ארוך מכיל שש יחידות הדמיה נפרדות, שכל אחת מהן יכולה לשמש לניסוי נפרד. כל יחידה יכולה להכיל עד 41 בעלי חיים, ותעלות המלכודת מרווחות כך שניתן לדמות מספר בעלי חיים ב-FOV אחד. בנוסף, ניתן לצלם מספר FOVs בתוך יחידה או מכשיר אחד. כמו בכל דגימות המיקרוסקופ, תנועה על פני משטח הדגימה עלולה להכניס סחיפה של מיקוד עקב אובדן אמצעי טבילה. ניתן לפצות על סחיפה זו על ידי שימוש בשמן טבילה בעל צמיגות נמוכה יותר או באמצעות אופני מיקוד אוטומטי שונים. עם זאת, ייתכן שמערכות מיקוד אוטומטי מסוימות של חומרה לא יפעלו בשימוש עם התקן מיקרו-נוזלי PDMS, מכיוון שהן משתמשות במעבר מזכוכית למדיום מימי כנקודת ייחוס (צד מדגם של זכוכית הכיסוי). חלק ניכר מה-FOV מלא בסיליקון בתוך המכשיר, בעל מקדם שבירה גבוה יותר ממים; אמנם זה לא משפיע על איכות התמונה, אבל זה עלול להשפיע לרעה על המיקוד האוטומטי. בעת הדמיית FOV יחיד, סחיפת המיקוד שנצפתה בתוך המכשיר היא מינימלית (פחות מ-2 מיקרומטר). אם נצפתה סחיפה מוגזמת של מיקוד, הדבר עלול לנבוע מחוסר יציבות תרמית של מערכת המיקרוסקופ או הסביבה, תנועת XY מוגזמת הרוכשת מספר FOVs, או הרכבה לא נכונה של המכשיר על המיקרוסקופ (ראה איור 3A למנגנוני הרכבה מוצעים).
באופן דומה, תנועת XY מוגזמת והרכבה לא נכונה עלולים גם לגרום לסחף XY. מכיוון שהמכשיר ומטרת המיקרוסקופ מחוברים באמצעות נוזל הטבילה, תנועות מהירות ב-X, Y או Z עלולות לגרום להפעלת כוחות על המכשיר. אם המכשירים מותקנים כהלכה ולא פועלים עליהם כוחות חיצוניים, הם יציבים במיוחד עם סחיפה מינימלית של מיקוד וללא סחיפה XY.
לבסוף, אם פרמטרים ספציפיים של המערכת אינם מתאימים, המכשירים המיקרופלואידיים של PDMS עלולים להשפיע לרעה על התפתחות בעלי החיים. הכדאיות מושפעת מלחץ שסתום מוגזם, פוטוטוקסיות גבוהה הנובעת מעוצמות עירור גבוהות, זמני חשיפה ארוכים או מרווחי זמן קצרים בין רכישות מחסנית. במיוחד בעת שימוש ראשון במערכת זו, מומלץ מאוד להעריך את כדאיות בעלי החיים באמצעות סמן פלואורסצנטי בהיר או הדמיית שדה בהיר, כדי להבטיח שמצב ההדמיה אינו משפיע על צמיחת בעלי החיים. ברגע שבעלי חיים מתפתחים בצורה מהימנה, ניתן לשנות את פרמטרי ההדמיה לפי הצורך.
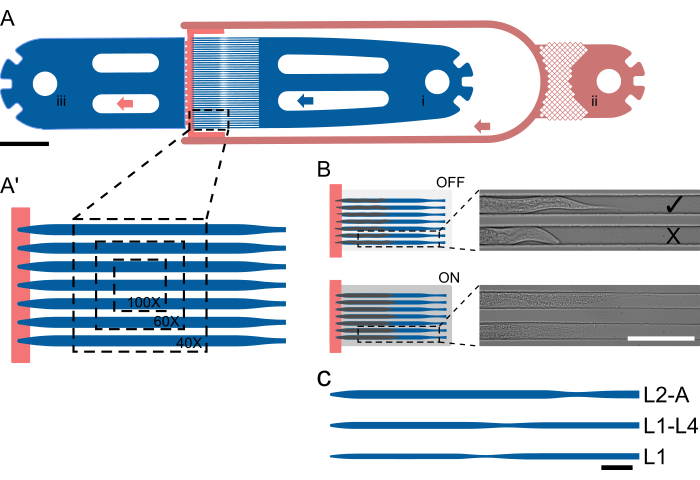
איור 1: פריסת ההתקן ופעולה סכמטית. (A) סקירת התקן המציגה יחידה יחידה עם כניסת התולעת (i), כניסת המזון החיידקי (ii) והיציאה הכללית (iii). (א') תצוגה מוגדלת של תעלת המלכודת במכשיר L2-A, המדגישה את מספר התולעים הנראות ב-FOV יחיד בהגדלות שונות (40x-100x). (ב) העיקרון הפונקציונלי של שסתום השבב. במצב כבוי, גובה הערוץ נבחר כך שבעלי חיים יוכלו להיכנס בנוחות לתעלת ההלכדה. כאשר מופעל, גובה התעלה יורד, לוחץ את החיה על זכוכית הכיסוי, ובכך משתק את החיות הלכודות באופן הפיך. התמונות מראות שני בעלי חיים לכודים על השבב עם שסתום על השבב כבוי ועם השסתום מופעל, כאשר בעלי החיים מתיישרים ומתארכים בלחץ. החיה העליונה נטענה כהלכה ופונה לכיוון מקור המזון ( ), והתחתונה פונה הצידה (X). (ג-ג") הגדרת מכשיר סכמטי. (ג) גדלי מכשירים זמינים. L1 מתאים לבעלי חיים משלב L1 עד אמצע L2, L1-4 לבעלי חיים מאמצע L2 עד אמצע שלב הזחל L4, ו-L2-A לבעלי חיים מאמצע שלב הזחל L2 ועד לבגרות. פסי קנה המידה הם (A) 1000 מיקרומטר, (B) 100 מיקרומטר ו-(C) 50 מיקרומטר. האיור נלקח בחלקו מ-Berger et al.18. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
), והתחתונה פונה הצידה (X). (ג-ג") הגדרת מכשיר סכמטי. (ג) גדלי מכשירים זמינים. L1 מתאים לבעלי חיים משלב L1 עד אמצע L2, L1-4 לבעלי חיים מאמצע L2 עד אמצע שלב הזחל L4, ו-L2-A לבעלי חיים מאמצע שלב הזחל L2 ועד לבגרות. פסי קנה המידה הם (A) 1000 מיקרומטר, (B) 100 מיקרומטר ו-(C) 50 מיקרומטר. האיור נלקח בחלקו מ-Berger et al.18. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
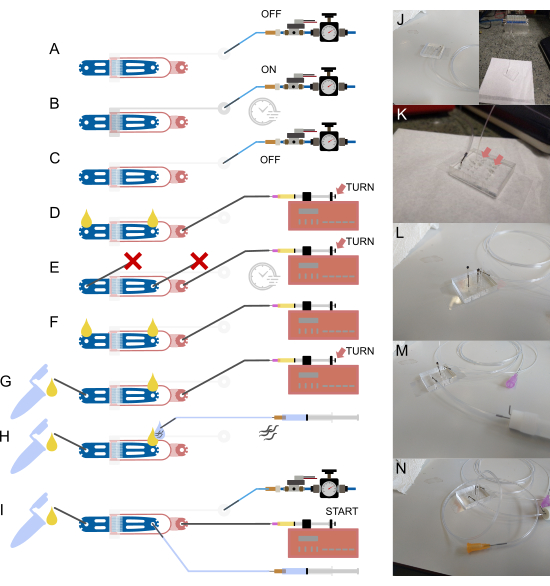
איור 2: הגדרת התקנים וחיבורים. (א-י) סקירה סכמטית של תהליך ההגדרה. (א) חיבור צינורות מלאים במים בגודל 1/16 אינץ' לכניסת השסתום באמצעות סיכת פלדה חלולה (אפור), כאשר הקצה השני מחובר למערכת אספקת הלחץ. (ב) מילוי השסתום ההידראולי על השבב דרך הסולנואיד מחוץ לשבב והפעלת לחץ על המכשיר למשך מספר דקות. (ג) השבתת הלחץ לפני שתמשיך לשלבים הבאים. (ד) חיבור מזרק המכיל מזון חיידקי לכניסת המזון באמצעות צינורות בגודל 1/32 אינץ' ומחט קהה של 30 גרם, ולאחר מכן מילוי המכשיר עד להופעת נוזל בשני החיבורים הפתוחים. (ה) איטום כניסת התולעת ויציאת הפסולת עם סיכות פלדה חסומות על ידי חתיכת צינור בגודל 1/16 אינץ' ( ) ולחץ על המכשיר באמצעות מזרק המזון והמשאבה (באמצעות כוונון בורג אגודל), תוך שמירה על לחץ למשך מספר דקות. (F) הסרת תקעים מ-(E), הבטחת היווצרות טיפות נוזל בכל חיבור פתוח. (ז) חיבור מיכל הפסולת באמצעות חתיכה קצרה של צינור 1/16 אינץ' וסיכת פלדה חלולה. (ח) חיבור מזרק מלא חוצץ למכשיר באמצעות סיכת פלדה חלולה ומחט קהה 23 גרם. תולעים נשאבות לתוך הצינור לפני חיבורו למכשיר, ומבטיחות שלא יוכנס אוויר על ידי יישור טיפות נוזל בקצה הכניסה והצינורות. (I) התקנה סופית עם כל חיבורי ההתקנים שהוקמו. (J) תמונה של המכשיר עם צינורות שסתום המחוברים לכניסה ולסולנואיד (רקע), המתאים ל-(A-C). (K) תצוגה מוגדלת של המכשיר עם צינור אספקת מזון מחובר, המראה שתי טיפות נוזל (חצים) על כניסת התולעת ויציאת הפסולת, המתאימה ל-(D). (L) תצוגה מוגדלת של המכשיר עם צינור אספקת מזון מחובר וכניסת התולעת ויציאת הפסולת חסומה, המתאימה ל-(E). (M) תצוגה מוגדלת של המכשיר עם צינורות פסולת ומיכל מחוברים, המתאימים ל-(G). (N) הרכבה סופית עם כל חיבורי הצינורות במקומם, המתאים ל-(I). מותאם חלקית מ-Berger et al.18. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
) ולחץ על המכשיר באמצעות מזרק המזון והמשאבה (באמצעות כוונון בורג אגודל), תוך שמירה על לחץ למשך מספר דקות. (F) הסרת תקעים מ-(E), הבטחת היווצרות טיפות נוזל בכל חיבור פתוח. (ז) חיבור מיכל הפסולת באמצעות חתיכה קצרה של צינור 1/16 אינץ' וסיכת פלדה חלולה. (ח) חיבור מזרק מלא חוצץ למכשיר באמצעות סיכת פלדה חלולה ומחט קהה 23 גרם. תולעים נשאבות לתוך הצינור לפני חיבורו למכשיר, ומבטיחות שלא יוכנס אוויר על ידי יישור טיפות נוזל בקצה הכניסה והצינורות. (I) התקנה סופית עם כל חיבורי ההתקנים שהוקמו. (J) תמונה של המכשיר עם צינורות שסתום המחוברים לכניסה ולסולנואיד (רקע), המתאים ל-(A-C). (K) תצוגה מוגדלת של המכשיר עם צינור אספקת מזון מחובר, המראה שתי טיפות נוזל (חצים) על כניסת התולעת ויציאת הפסולת, המתאימה ל-(D). (L) תצוגה מוגדלת של המכשיר עם צינור אספקת מזון מחובר וכניסת התולעת ויציאת הפסולת חסומה, המתאימה ל-(E). (M) תצוגה מוגדלת של המכשיר עם צינורות פסולת ומיכל מחוברים, המתאימים ל-(G). (N) הרכבה סופית עם כל חיבורי הצינורות במקומם, המתאים ל-(I). מותאם חלקית מ-Berger et al.18. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
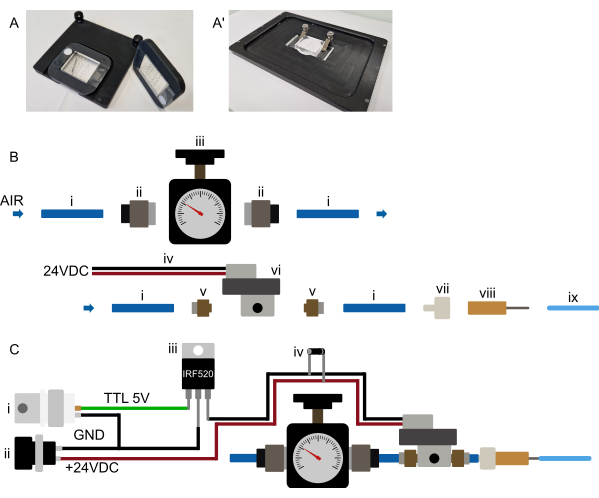
איור 3: הגדרת חומרה. (א-א') הצעה להרכבת מכשיר. (A) תושבת אפשרית למיקרוסקופ זקוף. המכשירים מחוברים למסגרת מלבנית מודפסת בתלת מימד עם גזרה מרכזית גדולה. שתי רצועות קטנות של סרט דו צדדי מונחות בתחילה על זכוכית הכיסוי, משני צידי חלק ה- PDMS של המכשיר. לאחר מכן מניחים את המסגרת המודפסת בתלת מימד מעל המכשיר, כך שחלק ה-PDMS נדבק דרך הגזרה והמסגרת נלחצת בחוזקה על הסרט הדו-צדדי, ומחברת את המכשיר לצמיתות למסגרת. המסגרת, אם כן, מחזיקה את המכשיר בצורה מאובטחת ומוחזקת בעצמה על במת המיקרוסקופ באמצעות מגנטים המוטבעים במסגרת ובתוספת הבמה. זה מבטיח הרכבה יציבה של המכשיר ומונע התנגשות של מטרת המיקרוסקופ עם כל חומרת הרכבה. כל הצינורות מנותבים לקדמת המכשיר. (א') הרכבה אפשרית למיקרוסקופ הפוך. סט מהדקים מחזיק היטב את המכשיר. ודא שהמהדקים לוחצים את המכשיר על ה-stagתוספת כדי למנוע כל תנועת XY במהלך הפעולה. (ב) תצוגת חלקי מערכת לחץ. (i) צינורות פוליאוריטן OD 6 מ"מ המחוברים למקור לחץ. (ii) מתאם דחיפה G1/8 עד 6 מ"מ המחבר את הצינור (i) לווסת הלחץ (iii). לאחר מכן הצינור מחובר לסולנואיד (vi) דרך מתאם דחיפה M5 עד 6 מ"מ (v), ולבסוף, הצינור מחובר למחבר luer-lock-to-barb (vii) ומחט קהה של 23 G (viii) לצינור OD בגודל 1/16 אינץ' המחובר למכשיר המיקרופלואידי. (ג) סקירה סכמטית של החיבורים האלקטרוניים ומערכת הלחץ המורכבת. (i) הדק ה-TTL (+3.3-5 V) שנוצר על ידי Arduino, כרטיס DAq או כל מיקרו-בקר אחר, יחד עם ספק כוח מתאים (ii, 24 VDC) מחובר ל-MOSFET (iii) ולחיבורים האלקטרוניים של הסולנואיד כפי שמוצג בסכמה, עם דיודת Flyback (iv) המחוברת על פני חיבורי החשמל של הסולנואידים. ברגע שאות TTL נשלח מהמיקרו-בקר לשער ה-MOSFET, +24 VDC מוחל על הסולנואיד הסגור בדרך כלל, והמגוף ההידראולי על השבב מנופח. לאחר הסרת אות ה-TTL, הלחץ משתחרר והמגוף ההידראולי על השבב מתרוקן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
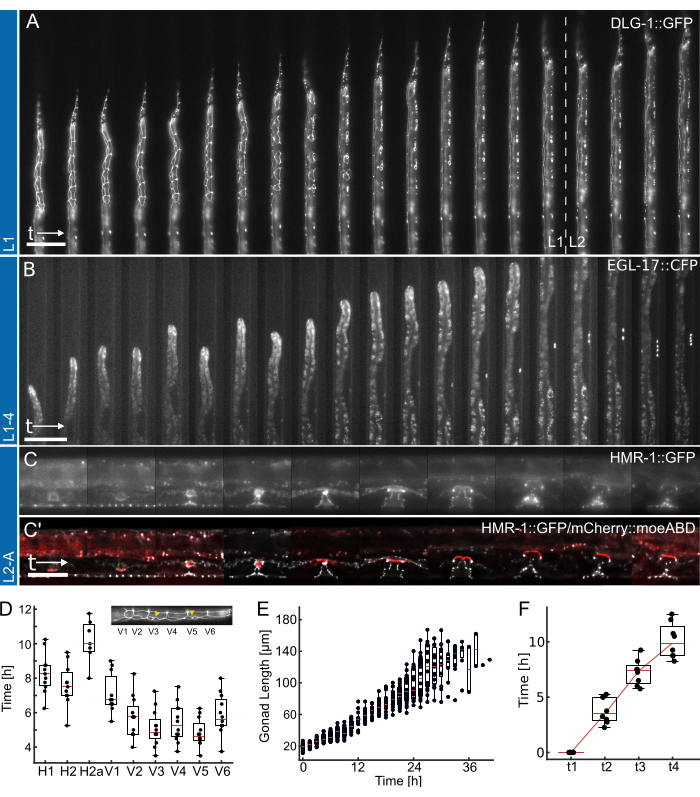
איור 4: תוצאות מייצגות. (A) בעל חיים שמראה יוצר צומת אפיתל (ML2615, dlg-1(mc103[dlg-1::gfp])) גדל מרעב לילי לשלב הזחל המוקדם/אמצע L2, באמצעות מכשיר L1. נראים תאי התפר המתחלקים, כמו גם תאי ה-P, הנודדים ומתחלקים לקראת שלב הזחל המאוחר של L1. (B) חיה שגדלה משלב הזחל המאוחר של L1 ועד לשלב המוקדם של L4, באמצעות מכשיר L1-4. נראה סמן לתא מבשר הפות (VPC) בעל גורל 1 מעלות (AH1187, arIs92[egl-17::cfp]), עם תא בודד הנראה מוקדם במהלך הניסוי, ואחריו שני סבבים של חלוקות תאים גלויות בשלב הזחל L3. (C) חיות שגדלות משלב הזחל המאוחר של L2 ועד לבגרות המוקדמת, באמצעות מכשיר L2-A. נראה יצרן צומת אפיתל (AH5786, hmr-1(cp21[hmr-1::gfp + LoxP])), המדגיש את רקמת הפות המתפתחת היוצרת מבנים טורואידיים מובחנים, ותמונה משולבת עם סמן לתא העוגן של הרחם (AC) (AH5786, qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)]) הפולש לרקמת הפות לקראת סוף שלב הזחל L3, ומחבר את הרקמות. עבור כל הניסויים (A-C), ה-FOV מוגדר בתחילה כך שרק חלק מבעלי החיים נראים לעין. ככל שהניסוי מתקדם, החיה תמלא יותר מהתעלה בתכונות המשתנות לאורך ציר הערוץ כתוצאה מגדילת החיה. (D) הזמן שבו חלוקות תאי תפר בודדות מתחילות להתחלק במהלך שלב הזחל L1 (n = 12). התוספת מדגישה את זהויות תאי התפר (H1-V6) לאורך ציר הגוף הקדמי-אחורי. (E) מראה גדילה של בלוטות המין עם הזמן עבור חיות באיור 4B (n = 19). (F) מראה את הזמן הנדרש כדי להגיע ל-4 נקודות זמן התפתחותיות שונות במורפוגנזה של הפות (t1-t4), מה שמצביע על מעבר עקבי עבור כל החיות שצולמו (n = 7). פסי קנה המידה הם (A,B) 50 מיקרומטר ו-(C) 25 מיקרומטר. ראה סרט משלים 1, סרט משלים 2 וסרט משלים 3 לקורס במשרה מלאה. תרשימי התיבה מציגים את ערכי החציון (קווים אדומים) עם רביעונים עליונים ותחתונים ועמודות המציינים את קיצוניות ההתפלגות, למעט חריגים. האיור נלקח מ-Berger et al.18. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
סרט משלים 1: זחל C . elegans יחיד מתפתח מרעב בן לילה עד לשלב L2 המוקדם. מוצגות תמונות אפיפלואורסצנטיות מוקרנות בעוצמה מקסימלית (הגובה הכולל של ההקרנה הוא 1.5 מיקרומטר), בפורמט שאחרת לא מעובד. נראים כל אירועי חלוקת תאי התפר והאיחוי המתרחשים בשלב שצוין (למעלה). התכונות מתוארות באמצעות סמן DLG-1::GFP (צומת אפיתל) במרווחים של 15 דקות למשך 25 שעות בסך הכל. הסרט נעשה בשימוש חוזר מברגר ואחרים.18. אנא לחץ כאן כדי להוריד את הסרט הזה.
סרטון משלים 2: זחל בודד מתפתח משלב L1 המאוחר עד לשלב L4 המוקדם, המבטא סמן EGL-17::CFP (תא מבשר פות (VPC)). בתחילת L2 (~400 דקות), הקרינה EGL-17::CFP מתבטאת ב-P6.p, ועולה בהתמדה בעוצמתה. במהלך L3, P6.p עובר שני סבבי חלוקה רצופים, ויוצר את שלבי התפתחות הפות של תא אחד, 2 תאים ו-4 תאים. התמונות מוצגות במרווחים של 30 דקות למשך 34 שעות בסך הכל. הסרט נעשה בשימוש חוזר מברגר ואחרים.18. אנא לחץ כאן כדי להוריד את הסרט הזה.
סרט משלים 3: מבט למעלה: הקרנת Z של הפות המתפתחת משלב L3 ועד למעבר L4/בוגר. מבט תחתון: הקרנת X של אותו פות לאורך זמן. שתי התצוגות מראות את החלוקה הראשונית של ה-VPC, ואחריה פלישה, היווצרות והגדלה של הטורואידים, ואחריה קריסה במהלך היפוך. תמונות אפיפלואורסצנטיות מוצגות לאחר חיתוך, דה-קונבולוציה, רישום והקרנה. התכונות מתוארות באמצעות סמן HMR-1::GFP (היפודרמיס ו-VPC) וסמן mCherry::moeABD (מתאר את ה-AC). הסרט נעשה בשימוש חוזר מברגר ואחרים.18. אנא לחץ כאן כדי להוריד את הסרט הזה.
קובץ משלים 1: קובץ CAD עבור מכשיר L1. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 2: קובץ CAD עבור מכשיר L1-4. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 3: קובץ CAD עבור התקן L2-A. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 4: קובץ CAD עבור התקן L3-A. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 5: קובץ CAD עבור מכשיר L4-A. אנא לחץ כאן להורדת קובץ זה.
תיק משלים 6: קובץ CAD למבנה חלוקת המזון. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 7: קובץ CAD לשכבת השסתום. אנא לחץ כאן להורדת קובץ זה.
Discussion
מאמר זה תיאר את פעולתה של פלטפורמת הדמיה מיקרופלואידית ייחודית לטווח ארוך, המתאימה להדמיה ברזולוציה גבוהה ומעקב אחר תהליכים התפתחותיים שונים ב- C. elegans במהלך כל ארבעת שלבי הזחל עד לבגרות המוקדמת18. היכולת לעקוב אחר תהליכי התפתחות לאורך זמן in vivo, תוך שימוש בשיטת הדמיה זו ואחרות, הפכה להכרחית בתחומים רבים של מחקר C. elegans ואפשרה לענות על שאלות שלא היו נגישות בעבר 23,24,29.
בניגוד לשיטות הדמיה מסורתיות המשתמשות ברפידות אגר ואסטרטגיות הדמיה ארוכות טווח מבוססות מיקרופלואידיקה שפורסמו בעבר, גישה זו שומרת על זהות וכיוון התולעת לאורך כל הניסוי, ומאפשרת מעקב אחר תהליכים התפתחותיים מורכבים לאורך זמן. ללא קשר לשלב ההתפתחותי, בעלי החיים מוגבלים לאחת מ-41 תעלות מלכודת מקבילות, שכל אחת מהן מחוברת לאספקת מזון על השבב ומכוסה על ידי שסתום הידראולי גדול. קיבוע של כל התולעים הלכודות מתרחש באמצעות ניפוח השסתום ההידראולי, ולוחץ את התולעים על זכוכית הכיסוי רק במהלך רכישת התמונה. הדמיה בתפוקה גבוהה אפשרית הודות למערך ערוצי המלכודת המרווחים בצמצום, עם מספר בעלי חיים הנראים בשדה ראייה אחד. מכשירי ההדמיה לטווח ארוך תואמים לרוב הגדרות המיקרוסקופ, ודורשים חומרה נוספת מינימלית (פחות מ-1000 דולר) וללא שינויים בחומרה הקיימת. פעולת המכשירים היא פשוטה בכוונה, כך שכל המשתמשים צריכים להיות מסוגלים ללמוד אותה במהירות על ידי ביצוע הפרוטוקול לעיל והתוצאות המתוארות.
בקצרה, חיות יכולות להיות מדומות על השבב על פני עד 2.5 שלבי זחל (איור 1C). בעלי חיים מסונכרנים בתחילה ונטענים ישירות על השבב (מכשיר L1) או נזרעים על לוחית ה-NGM עד לשלב ההתפתחותי הרצוי (התקני L1-L4 ו-L2-A). בעלי חיים על השבב מוזנים באמצעות תרחיף חיידקים מרוכז ביותר ומשותקים באמצעות שסתום הידראולי על-השבב המופעל על ידי תוכנת ההדמיה (איור 1B). חיות מתמרנות לתוך תעלות המלכודת באמצעות מזרק, מכוונות חיות בזהירות עם הראש לכיוון אספקת המזון, ולבסוף לוכדות חיות בקצה תעלת המלכודת (איור 1A ואיור 2). יש לנקוט בזהירות כדי שלא יילכד אוויר במזרקים, במחטים קהות ובצינורות, שכן בועות אוויר יפריעו בקלות למיקום החיה. ההתקנים תואמים לרוב שיטות ההדמיה 18,19,24, מכיוון שחומר ה-PDMS שקוף ביותר, אינו פלואורסצנטי ואטום כנגד זכוכית כיסוי דקה (איור 4, סרט משלים 1, סרט משלים 2 וסרט משלים 3). עם זאת, יש לנקוט בזהירות בבחירת תנאי הדמיה, שכן זמני חשיפה ארוכים ועוצמות עירור גבוהות ישפיעו בקלות על כדאיות בעלי החיים ויגרמו להלבנת פוטו.
בנוסף לגרסה המוצגת של שיטת הדמיה זו, מספר שינויים בפרוטוקול אפשריים וכבר זמינים. השינוי הפשוט ביותר הוא החלפת זני החיידקים הסטנדרטיים, למשל, בחיידקים המבטאים RNAi18 או חיידקים בעלי ערכים תזונתיים שונים32. ניתן להחליף בקלות זני חיידקים על ידי התאמת תכולת Optiprep כדי לקחת בחשבון את ההבדלים בצפיפות. באופן דומה, ניתן להוסיף כל מספר של תרכובות למזון החיידקי, למשל, אוקסין, חומרים מזינים או תרכובות תרופות מולקולות קטנות, והשפעתן נצפית ישירות in vivo, ללא כל צורך בשינויים כלשהם בפרוטוקול. בפרט, פותח מכשיר להחלפת מדיה לפירוק חלבון המושרה על ידי אוקסין או כל יישום הזקוק לחשיפה מתוזמנת או הפיכה על ידי הוספת כניסת מזון לפריסת המכשיר מבלי לשנות את הגיאומטריה או הפעולה. הכניסה הנוספת מאפשרת מעבר פשוט בין שני תנאים שונים, למשל, אוקסין וללא אוקסין, המחוברים למכשיר באותו אופן שמוצג כאן עבור מקור מזון יחיד, והשינויים המתקבלים נצפים ישירות. כמו כן, פותחו גרסאות מכשיר שבהן השסתום ההידראולי אינו משותף לכל היחידות במכשיר אלא מופרד עבור כל יחידה, כך שניתן לדמות מספר תנאים בתוך אותו מכשיר ולהתנסות בנפרד, מה שמפחית את ההשפעות המזיקות הפוטנציאליות של הפעלת שסתומים ארוכים וזמני רכישה. לבסוף, מעבר לגרסאות ההתקן המקוריות שתוארו ב-Berger et al.18, פותחו שתי גרסאות מכשיר חדשות, L3-A ו-L4-A (שהוצגו כאן), המאפשרות הדמיה מאמצע שלב L3 או אמצע L4 עד לבגרות. מטרת השינויים הללו היא לדחות את שעת ההתחלה של הניסוי לשלב זחל מאוחר יותר, כך שניתן יהיה להעמיס בעלי חיים גדולים יותר ביישומים שבהם שלבי ההתפתחות המוקדמים אינם מעניינים.
Disclosures
המחברים מצהירים שאין אינטרסים מתחרים או כלכליים.
Acknowledgements
אנו רוצים להודות לחברי מעבדת היינאל על דיון ביקורתי והערות על כתב היד. אנו אסירי תודה גם ל-C. elegans Genetics Center CGC, הממומן על ידי המשרד לתוכניות תשתית מחקר של ה-NIH (P40 OD010440). יתר על כן, אנו מבקשים להודות לחברי מעבדת גלי (מכון הוברכט), מעבדת קונרדט (יוניברסיטי קולג' לונדון) ומעבדת ואן דן היובל (אוניברסיטת אוטרכט) על תרומה חשובה על הפרוטוקול שהוצג. עבודה זו נתמכה על ידי מענקים מהקרן הלאומית השוויצרית למדע מס' 31003A-166580 ל-AH, הליגה השוויצרית לסרטן מס' 4377-02-2018 ל-AH, ומימון של ETH ציריך ל-AdM.
Materials
| Name | Company | Catalog Number | Comments |
| 3/2 solenoid valve | Distrelec | 154-22-898 and 154-22-899 | Alternative to above. Solenoid valve connecting the pressure regulator to the on-chip valve. |
| Arduino | Distrelec | 301-01-956 | Optional microcontroller depending on the selected controller and interface. |
| Bacto-Tryptone | Thermo Fisher Scientific | 211705 | For L Broth production. |
| Bacto-Yeast | Thermo Fisher Scientific | 212750 | For L Broth production. |
| Blunt needle 23G | Gonano Dosiertechnik | GGA723050 | Blunt needle connecting the 1/16" tubing to a syringe. |
| Blunt needle 30G | Gonano Dosiertechnik | IG-TE730050 | Blunt needle connecting the 1/32" tubing to a syringe. |
| C. elegans Construct 1 | NA | NA | AH5786 LGI: hmr-1(cp21[hmr-1::gfp + LoxP]) Marston, D.J. et al. MRCK-1 drives apical constriction in C. elegans by linking developmental patterning to force generation. Curr. Biol. 26 (16), 2079-2089. 2016. |
| C. elegans Construct 2 | NA | NA | AH1187 LGII: arIs92[egl-17::cfp] Yoo, A.S., Bais, C., Greenwald, I. Crosstalk between the EGFR and LIN-12/Notch pathways in C. elegans vulval development. Science. 303 (5658), 663-666. 2004. |
| C. elegans Construct 3 | NA | NA | AH5786 LGV: qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)] Ziel, J.W., Hagedorn, E.J., Audhya, A., Sherwood, D.R. UNC-6 (netrin) orients the invasive membrane of the anchor cell in C. elegans. Nat. Cell Biol., 11 (2), 183-189. 2009. |
| C. elegans Construct 4 | NA | NA | ML2615 LGX: dlg-1(mc103[dlg-1::gfp]) Vuong-Brender, T.T.K., Suman, S.K., Labouesse, M. The apical ECM preserves embryonic integrity and distributes mechanical stress during morphogenesis. Development. 144 (23), 4336-4349. 2017. |
| Cable | Distrelec | 143-46-644 | Needed if selecting the solenoid from distrelec. Cable connecting the solenoid to the MOSFET. |
| Chlorotrimethyl silane | Sigma Aldrich | 386529-25ML | Silane for wafer passivation. |
| Cholesterol | Sigma Aldrich | C8667 | For S-Basal production. |
| Flyback Diode | Distrelec | 110-52-628 | Flyback diode protecting the microcontroller. |
| Hollow steel pin | Gonano Dosiertechnik | GGA7R23050 | 23G hollow steel pin connecting the 1/16" tubing to the device. |
| L Broth | NA | NA | Prepared in house following standard recipe. 10 g Bacto-tryptone, 5 g Bacto-yeast, 5 g NaCl, H2O to 1 litre, pH to 7.0 using 1 M NaOH |
| Long-term Imaging Device L1 | NA | NA | Long-term imaging device for L1 to early/mid L2 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L1-4 | NA | NA | Long-term imaging device for mid L1 to mid L4 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L2-A | NA | NA | Long-term imaging device for mid L2 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L3-A | NA | NA | Long-term imaging device for mid L3 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L4-A | NA | NA | Long-term imaging device for mid L4 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| M9 Buffer | NA | NA | Prepared in house following standard recipe. |
| MOSFET | Distrelec | 303-41-391 | Metal-oxide-semiconductor field-effect transistor, used to switch the 24VDC required for the solenoid. |
| NGM plates | NA | NA | Prepared in house following standard recipe. |
| Nylon Luer-Fitting | Fisher Scientific | 11776048 | Adapter from OD 6mm tubing to 23G blunt needle. |
| Optiprep | Sigma Aldrich | D1556 | Density matching liquid. |
| PDMS | Ameba | Elastosil RT601A/B | PDMS elastomer kit. |
| Pluronic F-127 | Sigma Aldrich | P2443 | Non-ionic surfactant. |
| Potassium dihydrogen phosphate | Sigma Aldrich | 1.37039 | For S-Basal production. |
| Potassium hydrogen phosphate | Sigma Aldrich | 1.05099 | For S-Basal production. |
| Power Supply 24VDC | Distrelec | 301-63-304 | 24VDC power supply. Select a power supply suitable for the solenoid selected. |
| Precision pressure regulator | Distrelec | 154-23-578 | Alternativ to above. Pressure regulator. |
| Pressure Gauge G1/8 | Distrelec | 154-23-643 | Pressure gauge attaches to the pressure regulator. |
| PU Tubing OD 6mm | Distrelec | 154-23-866 | Tubing connecting the pressure source and regulator, as well as regulator and solenoid valve. |
| Push-in fitting G1/8 to 6mm | Distrelec | 301-69-330 | Alternativ to above. 2x Push-in fitting attaches to the pressure regulator and connects to the 6mm tubing. |
| Push-in fitting M5 to 6 mm | Distrelec | 301-69-459 | 2x Push-in fitting attaches to the solenoid and the 6mm tubing. |
| S-Basal Buffer | NA | NA | Prepared in house following standard recipe. 5.85 g NaCl, 1 g K2HPO4, 6 g KH2PO4, 1 ml cholesterol (5 mg/ml in ethanol), H2O to 1 litre. Sterilize by autoclaving. |
| Sodium Chloride | Sigma Aldrich | S9625 | For L Broth and S-Basal production. |
| Sodium hydroxite (5M) | Sigma Aldrich | 567530 | Sodium hydroxide used when bleaching C. elegans (prepare solution at 5M concentration) |
| Sodium hypochlorite (5%) | Sigma Aldrich | 1.05614 | Sodium hypochlorite used when bleaching C. elegans (prepare solution at 5% concentration) |
| Strainer 10 µm | pluriSelect | 43-10010-40 | Alternative for bacteria food preparation, especially if smaller devices are used. |
| Strainer 5 µm | pluriSelect | 43-10005-40 | Strainer used to filter L1 larvae after overnight starvation and bacteria after completed food preparation. |
| SU-8 | Gersteltec | GM1050 | SU-8 for height from 1-10 µm. |
| SU-8 | Gersteltec | GM1060 | SU-8 for height from 5-30 µm. |
| SU-9 | Gersteltec | GM1070 | SU-8 for height from 15-200 µm. |
| Syringe 1 mL | Fisher Scientific | 11338763 | 1mL syringe. If using a different type ensure that the syringe body and plunger are stiff, such that they won't be deformed by the syringe pump. |
| Syringe Pump | WPI | Al1000-220 | Syringe pump (https://www.wpiinc.com/var-2300-aladdin-single-syringe-pump.html). |
| Tube 15 mL | Fisher Scientific | 50-809-220 | Tube used for worm bleaching and bacteria preparation. |
| Tube 2 mL | Fisher Scientific | NC1186931 | Tube used for worm preparation and bacteria preparation. |
| Tube 50 mL | Fisher Scientific | 50-465-232 | Tube used for bacteria preparation and growth. |
| Tweezer SMD | Brütsch Rüegg Werkzeuge | 448980 | Tweezers used to plug the 1/32" tubing into the device. |
| Tygon tubing 1/16" | Fisher Scientific | 642002 | Flexible 1/16" OD tubing connecting most components to the device. |
| Tygon tubing 1/32" | Fisher Scientific | 641900 | Flexible 1/32" OD tubing connecting the bacteria supply to the device. |
| UV KUB-3 | Kloe | NA | Mask aligner and UV exposure system. |
| Wafer | Siegert Wafer | 4P0/>1/525±25/SSP/TTV<10 | Silicon Wafer. |
| Waste Container | NA | NA | Prepared in house using a 2mL tube or a cryo vial and hollow steel pins. |
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved