Method Article
Tüm larva aşamalarında yüksek çözünürlüklü C. elegans görüntüleme
Bu Makalede
Özet
Bu protokol, tüm embriyonik sonrası gelişim boyunca mikroakışkan tabanlı C. elegans hızlandırılmış görüntülemeyi tanımlar.
Özet
Caenorhabditis elegans , biyolojide en çok çalışılan ve en iyi anlaşılan hayvan modellerinden biri haline gelmiştir. C. elegans'ın model organizma olarak başarısının anahtarının üç özelliği vardır: değişmez hücre soyu, şeffaflığı ve genetik izlenebilirliği. Bunlar, onu doğrudan in vivo olarak çok çeşitli mikroskopi tabanlı çalışmalar için ideal hale getirir. Canlı C. elegans larvaları ve yetişkinlerin görüntü elde etme sırasında sıklıkla hareketsiz hale getirilmesi gerekir. Geleneksel immobilizasyon yöntemleri, özellikle hızlandırılmış görüntüleme uygulamalarında hayvan gelişimini olumsuz yönde etkilemektedir. Burada, geleneksel agar-ped tabanlı immobilizasyon ve diğer mikroakışkan stratejilerle ilişkili sınırlamaları ele alan yeni bir mikroakışkan görüntüleme yöntemi için ayrıntılı bir kurulum ve çalışma protokolü tanıtılmaktadır. Bu yaklaşım, zaman içinde solucan oryantasyonunu ve kimliğini korurken çeşitli larva aşamalarında eş zamanlı canlı görüntülemeyi mümkün kılar. Bunu başarmak için, büyüme ve tüy dökümünü barındırırken stabil bir solucan oryantasyonunu korumak için hassas bir şekilde tasarlanmış geometrisi ile bir mikroakışkan tuzak kanal dizisi kullanılır. İmmobilizasyon, yalnızca görüntü alımı sırasında solucanları kapak camına sabitlemek için basınç uygulayan aktif bir hidrolik valf ile kolaylaştırılır. Bu tasarım, solucan canlılığı veya gelişimsel zamanlama üzerinde minimum etkiyle yüksek çözünürlüklü görüntülemeye izin verir.
Giriş
C. elegans görüntüleme, uygulamaya, istenen verime ve çözünürlüğe bağlı olarak çeşitli şekillerde gerçekleştirilebilir. Yüksek bir çözünürlüğe ihtiyaç duyulduğunda, standart yöntem, cam slayt, agaroz ve kapak camından oluşan basit bir yapı olan agar pedleri 1,2,3'ü kullanır. Bu kaydıraklardaki hayvanlar, bir kapak camının uyguladığı basınçla hareketsiz hale getirilir. İmmobilizasyon, anestezitize edici ajanların, örneğin levamisol veya sodyum azid 1,2'nin eklenmesiyle daha da iyileştirilebilir, böylece agar pedleri üzerindeki hayvanlar mükemmel bir şekilde hareketsiz kalır ve çeşitli süper çözünürlük yöntemleri de dahil olmak üzere yüksek çözünürlükte görüntülenebilir2. Ne yazık ki, agar pedlerinin gelişimsel ilerlemeyi etkilediği, yüksek uygulanan basınçlar ve anestezik ajanların kombinasyonunun gelişimi geciktirdiği veya tam gelişimsel durmaya neden olduğu bilinmektedir 4,5.
Bu standart yöntemlerin yanı sıra, son yıllarda her biri kendi avantajları ve dezavantajları veya özel kullanım durumları olan çeşitli mikroakışkan metodolojiler ortaya çıkmıştır 6,7,8,9,10,11,12,13,14,15,16,17,18,19. Örneğin, Gritti ve ark.20, solucanların büyük odacıklar içinde hapsedildiği bir yöntem ortaya koymuştur. Bu odacıklara yerleştirilen embriyolar, mikroskopta belirlenen ilgi alanı içinde kalarak serbestçe gelişir ve hareket eder. Genel olarak etkili olmakla birlikte, bu yaklaşım parlak floresan işaretleyicilerin kullanımıyla sınırlıdır. Daha yakın zamanlarda, Keil ve ark.21, görüntü elde etme sırasında hayvanları dizginlemek için çip üzerinde bir hidrolik valf içeren bu yöntemin değiştirilmiş bir versiyonunu önerdi ve böylece orijinal yaklaşımın bazı sınırlamalarını ele aldı. Bununla birlikte, her iki yöntem de kapana kısılmış solucanlar için kullanılanlardan daha büyük odalar kullandığından, hayvanlar deney boyunca hareket etmeye ve dönmeye devam eder. Sonuç olarak, gelişimsel süreçleri izlemek zorlaşır ve hayvan hareketini düzeltmek için kapsamlı görüntü son işleme gerektirir.
Bu sınırlamaları ele almak için, Berger ve ark.18 (Şekil 1) tarafından tanıtılan, hayvanların büyük bir odada tutulmadığı, ancak hayvanları daha kısa bir gelişim penceresine (2,5 larva aşamasına kadar) sığdırmak için tasarlanmış bir tuzak kanalında barındırıldığı yaklaşım uyarlanmıştır. Mevcut mikroakışkan yöntemlerden farklı olarak, bu yaklaşım bir deney boyunca hayvan oryantasyonunu ve kimliğini korur ve tek bir cihazda paralel olarak ve birden fazla larva aşaması boyunca birden fazla solucanın yüksek çözünürlüklü görüntülerinin elde edilmesine izin verir.
Hayvanlar, bir deneyin başlangıcında kanal yüksekliğinin bir hayvanın kalınlığına yakın olduğu özel bir kanal geometrisi kullanılarak tuzağa düşürülür ve böylece rotasyon önlenir. Kanal genişlikleri ve uzunlukları, hayvanların zaman içinde hareket edebilmesi ve büyüyebilmesi için seçilir, bu da tüy dökümünü ve bir larva aşamasından diğerine geçişi kolaylaştırır. Paralelleştirme daha sonra, tek bir görüş alanında birden fazla hayvan görülebilecek şekilde (FOV, Şekil 1A') ve tek bir cihaz ünitesinde 41 adede kadar hayvan görüntülenebilecek şekilde birden fazla tuzak kanalının yan yana yerleştirilmesiyle elde edilir (Şekil 1A). Çip üzerindeki hayvanlara, düşük yükseklikteki bir kanal aracılığıyla sürekli olarak yüksek konsantrasyonlu bir bakteriyel gıda süspansiyonu verilir, bu aynı zamanda hayvanları tuzak kanal dizisinin sonunda hapsetmeye yardımcı olur (yükseklik adımı, Şekil 1A, kırmızı). Keil ve ark.21 tarafından benimsenen yaklaşıma benzer şekilde, görüntü elde etme sırasında şişirilebilen, hayvanları kapak camına bastıran ve böylece hayvan immobilizasyonunu iyileştiren büyük bir hidrolik, çip üstü valf uygulanır (Şekil 1B). Hidrolik valf çalıştırmasının sadece görüntü alma periyodu ile sınırlandırılması, hayvan gelişimi üzerindeki herhangi bir olumsuz etkiyi en aza indirerek tüm larva aşamalarında güvenilir gelişme sağlar. Gritti ve ark.20 ve Keil ve ark.21 tarafından tanımlanan yöntemlerin aksine, hayvanlar aynı cihaz içinde tüm embriyonik gelişim sonrası gelişim boyunca görüntülenemez. Bunun yerine, L1, L1-4, L2-A, L3-A ve L4-A olarak adlandırılan, tüm L1 aşaması ve erken L2 aşamasını, orta-geç L1 aşamasını orta L4 aşamasına kadar, orta-geç L2'den genç yetişkinliğe, orta-geç L3'ten genç yetişkinliğe kadar ve geç L4'ten genç yetişkinliğe kadar olan beş farklı cihaz tanıtılmıştır (Şekil 1C), Bu, embriyonik sonrası gelişimin büyük bölümlerinin kesintisiz görüntülenmesine izin verir. Bu yaklaşım, L1'den yetişkinliğe kadar hayvan boyutundaki büyük artış nedeniyle benimsenmiştir, öyle ki L1 hayvanları için uygun bir kanal yetişkinler için çok küçük olacak, bu da gelişimsel durmaya neden olacak ve yetişkinlere uyan bir kanal L1'ler için çok büyük olacak, bu da aşırı hareket, rotasyon ve tuzak kanallarından kaçan hayvanlarla sonuçlanacaktır.
Bu yaklaşımı kullanarak, çeşitli dokular için güvenilir gelişimsel ilerlemesağlanır 18, ör., hipodermisin embriyonik sonrası gelişimi (L1 ila L4 aşaması), vulva hücre kaderlerinin indüksiyonu (L2 ve L3 aşaması), vulval morfogenez (L3'ten yetişkinliğe19) ve çapa hücre invazyonu. Piyasaya sürüldüklerinden bu yana, bu uzun vadeli görüntüleme cihazları çeşitli süreçleri incelemek için kullanıldı22,23, hatta platform AiryScan süper çözünürlüklü mikroskopi24 gibi tekniklerle birleştirilerek daha önce imkansız olan çok sayıda keşfi mümkün kıldı.
Aşağıda, bu uzun vadeli görüntüleme cihazlarının çalışma yönleri, sistemi kurarken beklenen sonuçları ve bazı olası zorlukları vurgulayarak adım adım bir protokolde tanıtılmaktadır.
Protokol
Bu çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Cihaz imalatı
NOT: Tüm cihazlar aşağıdaki protokol kullanılarak üretilmiştir, ancak cihazlar doğrudan yazarlardan temin edilebilir. Her cihaz tipi için ayrı bir gofret üretilir ve her cihaz plakası farklı yüksekliklerde iki SU8 katmanından (yani gıda tabakası ve tuzak tabakası) üretilir. Valf plakası, 1.3-1.6 adımları atlanarak, tek bir SU-8 yüksekliğine sahip ayrı bir yonga plakası üzerinde üretilir. Silanlar toksiktir ve aşındırıcı buharlar açığa çıkarır. Bu nedenle, bu adımın bir davlumbazda yapılması gerekir. İmalat prosedürüyle ilgili ayrıntılar için Berger ve ark.18'e bakın.
- Gofretleri hava plazması kullanarak temizleyin.
- İlk SU8 katmanını sıkarak kaplayın, ardından 95 °C'de yumuşak bir pişirme yapın.
- İlk katmanı açığa çıkarın, ardından 95 °C'de pişirme sonrası ve geliştirme yapın.
- Gofret geliştirme ve kurutma işleminden sonra tekrar plazma temizliği yapın.
- İkinci SU8 katmanını sıkarak kaplayın, ardından 95 °C'de yumuşak bir fırında pişirin (gerekirse, ilk fırını 65 °C'de yapın).
- Gofretin her iki yanındaki hizalama işaretlerini kullanarak ikinci maskeyi mevcut özelliklerle hizalayın, ardından ikinci katmanı ortaya çıkarın.
- Gofret'i pişirdikten sonra geliştirin ve geliştirin, ardından 200 °C'de sert bir pişirme yapın.
- Gofrete en az 2 saat klorotrimetil silan uygulayın.
- 20 g PDMS prepolimerinden (Bölüm A) oluşan bir parti hazırlayın ve 1 g çapraz bağlayıcı (oran 20:1, Bölüm B) ile iyice karıştırın (bkz.
- 10 dakika veya tüm baloncuklar kaybolana kadar gazını boşaltın.
- PDMS karışımından 2 mL'yi çıkarın ve adım 1.13 için ayırın.
- Kalan PDMS karışımına 3 g daha çapraz bağlayıcı ekleyin ve iyice karıştırın (nihai oran yaklaşık 5:1).
- 20:1 PDMS partisini kullanarak, cihaz gofretini 30 saniye boyunca 750 rpm'de sıkarak kaplayın.
- Valf plakasını alüminyum bir tabağa yerleştirin ve üzerine 5:1 PDMS'yi dökün. Cihaz plakasının gazını yaklaşık 10 dakika boşaltın. Gazdan arındırma işleminden sonra, kalan kabarcıkları bir pipet kullanarak çıkarın.
- Hem valfi hem de cihaz katmanlarını 70 °C'de sırasıyla yaklaşık 15/20 dakika pişirin.
- Cihazın ve valf katmanlarının kürlenmesini bir pipet ucu veya cımbızla nazikçe inceleyerek değerlendirin. Valf tabakası sağlam olmalı, cihaz tabakası ise biraz yapışkan kalmalıdır.
- Valf katmanını ayırın ve bir neşter veya tıraş bıçağı kullanarak gerekli boyuta kesin.
- Valf kanalına bir erişim deliği açın (gösterge 20).
- Cihaz gofretini üstten aydınlatmalı bir stereomikroskop altına yerleştirin.
- Valf katmanını içeren PDMS parçasını dikkatlice cihaz plakasına yerleştirin.
- Valf ve cihaz özelliklerini hassas bir şekilde hizalayın ve katmanlar arasında sıkışan tüm havanın çıkarılmasını sağlayın.
- Monte edilen cihazı bir fırına aktarın ve gece boyunca 70 °C'de pişirin.
- Cihazı gofretten ayırın.
- Kalan tüm erişim deliklerini delin (gösterge 20).
- PDMS'yi hava plazması kullanarak bir kapak camına yapıştırın, ardından yapıştırılan cihazı birkaç saat boyunca 70 °C'de bir fırına koyun.
2. Solucan hazırlama
NOT: Bu bölüm, çok sayıda (yüzlerce) hayvanın üretilmesine izin veren ağartma yoluyla solucan hazırlamayı açıklar. Manuel toplama gibi diğer senkronizasyon yöntemleri de mümkündür ancak genellikle daha fazla zaman alıcı ve emek yoğundur. Protokolde kullanılan tüm solucanlar standart protokollere göre 20 °C'de ve E. coli OP50 ile tohumlanmış NGM plakalarında muhafaza edilir.
- Birçok gravid hayvanı olan plakalardan başlayarak.
- M9 tamponu kullanarak hayvanları tabaktan yıkayın.
- Solucan süspansiyonuna %5 NaClO ve 5 M NaOH ekleyin (her 1 mL solucan süspansiyonu için 200 μL/100 μL).
- Hayvanlar parçalanmaya başlayana kadar (~ 10 dakika) ağartma karışımını hafifçe çalkalayın.
- Oda sıcaklığında santrifüj ağartma karışımı, 1 dakika boyunca 1300 x g .
- Süpernatanı bir pipet kullanarak çıkarın ve eşit miktarda taze M9 tamponu ekleyin.
- Yine oda sıcaklığında, 1300 x g'da 1 dakika santrifüjleyin.
- Süpernatanı çıkarın ve peletlenmiş solucanları 5 mL taze M9 tamponu ile 15 mL'lik bir tüpe aktarın.
- Gece boyunca 20 °C'de çalkalayın.
- Solucan süspansiyonunu 10 μm'lik bir hücre süzgecinden geçirin.
- Solucan süspansiyonunu oda sıcaklığında 1 dakika boyunca 1300 × g'da santrifüjleyin.
- Süpernatanı atın ve solucanları eşit hacimde M9 tamponunda yeniden süspanse edin.
- Solucan karışımını tekrar 1300 × g'da oda sıcaklığında 1 dakika santrifüjleyin.
- Süpernatanı çıkarın ve solucanları NGM plakalarına aktarın. L1 larvalarına ihtiyaç duyulursa, hemen kullanın.
- Solucanlar istenen gelişim aşamasına ulaştığında, 0,2 μm'lik bir filtreden süzülen taze S-Basal tamponu kullanarak plakadan yıkayın.
- Solucanların yerçekimi ile çökelmesine izin verin veya oda sıcaklığında 1 dakika boyunca 750 × g'da santrifüjleme ile peletleyin.
- Süpernatanı atın ve eşit hacimde taze S-Bazal tamponu ekleyin.
- Sedimantasyon veya santrifüjleme adımlarını tekrarlayın (adım 2.16 ve 2.17)
- Süpernatanı çıkarın ve eşit hacimde taze S-Basal tamponu ekleyin.
- Sedimantasyon veya santrifüjleme adımlarını son bir kez gerçekleştirin.
- Süpernatantın çoğunu çıkarın.
- Deney başlayana kadar solucanları tüpte tutun.
3. Bakteri hazırlama
NOT: Çip üzerinde farklı bakteri suşları (örn. OP50, NA22, HT114, vb.) kullanılabilir. Yoğunluk farklılıklarını telafi etmek için gıda karışımına eklenen yoğunluk gradyan ortamının oranını ayarlayın. Partikülleri gidermek için tüm tamponlar 0,2 μm'lik bir filtreden geçirilir.
- Santrifüj tüplerinde, steril Erlenmeyer şişelerinde vb. 2 x 20 mL'lik 40 mL LBroth hazırlayın.
- LB'yi bir stok plakasından toplanan bakterilerle aşılayın.
- Gece boyunca 37 ° C'de (~ 16 saat) (OD600 = 1.9) sallarken bakterileri büyütün.
- Bakterileri 10 dakika boyunca 3000 x g'da santrifüjleyin.
- Süpernatanı çıkarın ve her tüpe 2 mL taze S-Bazal tamponu ekleyin. Tüm tüpleri birleştirin.
- Bir pipet kullanarak bakterileri mekanik olarak yeniden süspanse edin.
- Bakterileri 3000 x g'da 5 dakika santrifüjleyin.
- Süpernatanı çıkarın ve tekrar 2 mL taze S-Bazal tamponu ekleyin.
- Bir pipet kullanarak bakterileri mekanik olarak yeniden süspanse edin.
- Bakterileri 3000 x g'da 5 dakika santrifüjleyin.
- Süpernatantın mümkün olduğu kadar çoğunu çıkarın ve tüm bakterileri mekanik olarak yeniden süspanse etmeden önce 1 mL taze S-Bazal tamponu ekleyin.
- 0.60 mL yoğunluk gradyan ortamı, 0.38 mL S-Bazal + ağırlıkça %1 Pluronic F-127'yi (burada PF olarak temsil edilen iyonik olmayan bir triblok kopolimer) 1 mL OP50 bakteri süspansiyonu veya 0.65 mL yoğunluk gradyan ortamı, 0.33 mL S-Bazal + ağırlıkça %1 PF ile birleştirin 1 mL NA22 veya HT114 bakteri süspansiyonu ile.
- Yiyecek hazırlığını bir girdap karıştırıcı kullanarak iyice karıştırın.
- Yiyecekleri 5 μm veya 10 μm hücre süzgecinden süzün. L1 cihazları gibi daha küçük cihazlar kullanılırken özellikle daha küçük bir süzgeç tavsiye edilir.
NOT: Yiyecekler oda sıcaklığında 2 güne kadar saklanabilir.
4. Çip hazırlama
NOT: Cihaz, boru ve bağlantıların şematik bir özeti için Şekil 2'ye bakın. Tozu temizlemek için tüm tamponlar 0,2 μm'lik bir filtreden geçirilir. Aşağıdaki adımlarda bahsedilen çelik pim, daha büyük OD borusunu (1/16 inç) PDMS cihazında üretilen küçük çaplı deliklere bağlamak için kullanılan kısa, içi boş bir boruyu ifade eder. Bu çelik pimler basitçe borunun iç çapına yerleştirilir ve daha sonra PDMS malzemesine itilerek ikisini etkili bir şekilde birbirine bağlar.
- Bir şırıngayı deiyonize (DI) su ile doldurarak başlayın.
- 23 G'lik bir iğne ve ucunda içi boş bir çelik pim (90° açıyla bükülmüş) bulunan uzun bir 1/16" boru parçası takın. Boru, solenoidden mikroskop aşamasına kadar uzanacak kadar uzun olmalıdır.
- Boruyu şırıngadan gelen DI suyla doldurun ve çelik pimi delinmiş deliğe sokarak valf girişine bağlayın (Şekil 2A,J).
- Şırıngayı ve iğneyi çıkarın, ardından boruyu talaş dışı solenoide takın (Şekil 2A,J).
- Görüntüleme yazılımını kullanarak solenoidi açın ve valfteki tüm havayı dışarı atmak için cihaza birkaç dakika basınç uygulayın. Karanlık görünmesi ve PDMS malzemesinin içinde kaybolması gereken çip üzerindeki hava-su arayüzünü görsel olarak kontrol ederek tamamlandığını doğrulayın (Şekil 2B).
- Solenoidi kapatın (Şekil 2C).
- 1 mL'lik bir şırıngayı filtrelenmiş bakteri çözeltisiyle doldurun (~ 0.5 mL yiyecek yeterlidir).
- İğneye 30 G'lik bir iğne ve uzun bir 1/32" boru parçası takın.
- Hem iğneyi hem de bağlı boruyu doldurmak için pistona bastırın, şırıngada veya hortumda hava kalmadığından emin olun.
- Borunun hasar görmesini önlemek için cımbız kullanarak 1/32" boruyu doğrudan mikroakışkan cihazın gıda girişine yerleştirin (SMD cımbız önerilir) (Şekil 2D,K).
- Şırıngayı şırınga pompasına yerleştirin (Şekil 2D).
- Cihazı sıvı ile doldurmak için arkadaki kelebek vidayı kullanarak şırınga pistonuna bastırın. Her açık bağlantıda bir damla sıvı görünmelidir (Şekil 2D, ok).
- Hem sonsuz giriş hem de çıkışı sızdırmaz bir çelik pimle (kısa bir 1/16" boru parçası takılmış ve yakılarak kapatılmış çelik bir pim) ile bloke edin (Şekil 2E,L).
- Cihazda kalan havayı çıkarmak için kelebek vidayı kullanarak ek basınç uygulayın (Şekil 2E, ok).
- Çıkıştaki tıkalı pimi çıkarın ve atık kabını takın (kriyoviyal veya mikrosantrifüj tüpünden yapılmış, kapaktan iki çelik pim sıkışmış ve yapıştırıcı ile sabitlenmiş). Atık kabı, bir ucu konteynere ve diğer ucu içi boş bir çelik pime (90° bükülmüş) bağlı olacak şekilde kısa bir 1/16" boru parçası kullanılarak bağlanır (Şekil 2F,G,M).
- Atık kabının doğru şekilde bağlandığından ve sistemde herhangi bir tıkanıklık olmadığından emin olmak için şırıngayı itin. Bunun için, atık borudan sıvı akana kadar sistemden az miktarda sıvı itin (şırınga pompasındaki kelebek vidayı çevirin) (Şekil 2G, ok).
- Tıkalı ikinci çelik pimi çıkarın.
- Solucan girişinde küçük bir damla sıvı görünene kadar şırıngayı itin (Şekil 2H,N).
- 23 G'lik bir iğne kullanarak S-Bazal tamponu ile doldurulmuş 1 mL'lik bir şırıngaya daha uzun bir 1/16" boru parçası (15-20 cm) takın (Şekil 2H,N).
- Borunun diğer ucuna düz bir 23 G çelik pim takın.
- İğneyi ve hortumu şırıngadan tamponla doldurun, şırınga veya hortumda hava kalmadığından emin olun.
- Borunun ucundaki çelik pimi solucanları içeren tüpe yerleştirin.
- Borudan az miktarda sıvı itin ve hava kalmadığından emin olun.
- Solucanları borunun içine çekin, ancak şırınganın içine çekmeyin.
- Solucanlara bağlı şırıngayı, çelik pim üzerinde küçük bir damla sıvı görünene kadar itin (Şekil 2H).
- Çelik pimi sonsuz vida girişine yerleştirin (Şekil 2I).
NOT: Cihaz hazırlığı, son solucan hazırlığından önce yapılabilir ve solucanlar hazır olana kadar mikroskopta bırakılabilir.
5. Solucan yükleme ve görüntüleme
- Cihazı düşük büyütmeli (5x veya 10x) bir mikroskoba veya diseksiyon mikroskobuna yerleştirin.
- Şu anda kullanımda olan cihaz birimini tanımlayın ve parlak alan aydınlatmasını kullanarak sonsuz girişi bulun.
- Cihazı, görüş alanının bir tarafında giriş görünecek ve diğer tarafta tuzak kanalı girişinin arkası görünecek şekilde konumlandırın.
- Solucan şırıngasının pistonunu yavaşça itin. Sıvı, girişten kanal dizisinden çıkışa doğru gözle görülür şekilde akacaktır. Bakterilerin varlığı ve yoğunluk gradyan ortamının eklenmesinden dolayı kırılma indisindeki fark, sıvı akışını belirgin hale getirir.
- Solucanların girişten göründüğünden ve kanal dizisinin arkasına doğru aktığından emin olun.
- Hayvanları yavaşça kanal dizisine doğru itin. Bir hayvan kanala baktığında, onu kanalın içine itin ve diğer hayvanlar için tekrarlayın.
NOT: Hayvanların yiyeceğe kolay erişebilmeleri için başları prize doğru yönlendirilmelidir. Pistonu iterek ve çekerek ve yüzerek yönlendirilebilirler. - Yeterli sayıda hayvan yakalandıktan sonra, hala solucan girişine bağlı olan şırıngayı, deney boyunca kalacağı mikroskop aşamasına yerleştirin. Herhangi bir basınç birikimini serbest bırakmak için solucan hortumunu şırıngadan kısaca ayırmak ve ardından dikkatlice künt iğneye yeniden takmak gerekebilir.
- Yükleme bir diseksiyon mikroskobunda yapıldıysa, cihazı görüntüleme mikroskobuna aktarın. Boru çipe bağlı kalabilir ve şırınga pompaya bağlanır.
- Şırınga pompasını açın ve 0,5 μL için önceden ayarlanmış 1 μL/s hızında çalıştırın, hızı 0,5 μL için 100 μL/s artırın ve tekrar 1 μL/s'ye düşürün. Bu döngü tüm deney için otomatik olarak tekrarlanır. Pompanın nasıl programlanacağı hakkında bilgi için, ekipmanın kullanım kılavuzuna bakın.
- Cihazı mikroskop tablasına yerleştirin ve sıkıca tutulduğundan emin olun (montaj mekanizmaları için öneriler Şekil 3A'da bulunabilir).
- Görüntüleme mikroskobuna yükleme yapılmadıysa, düşük büyütmede ilgilenilen cihaz birimini tanımlayın.
- İstediğiniz görüntüleme büyütme oranına geçin.
NOT: Cihazlar tüm objektif türleri ile uyumludur. - Tuzak kanalı dizisi içindeki hayvanları ve ilgilenilen bölgeleri belirleyin ve istenen görüntüleme koşullarını ayarlayın.
- İstenilen görüntüleme koşullarında, çip üzerindeki valf ile, görüntü alınmadan 10 s önce solenoid aracılığıyla harekete geçirilir, böylece hayvanlar yerinde tutulur.
NOT: Çip üzerindeki valfin çalıştırılması, hayvanları uzatacak ve düzleştirecektir, bu da muhtemelen ilgilenilen görüntüleme bölgesinde (ROI) ayarlamalar gerektirecektir.
6. Kurulum hazırlığı
NOT: Bu bölüm, cihaz kontrol mekanizmasının ilk hazırlığına atıfta bulunur ve her deneyden önce tekrarlanmasına gerek yoktur. Şekil 3B,C'ye bakın. Birçok solenoid daha yüksek bir voltaj gerektirdiğinden, solenoid büyük olasılıkla doğrudan mikrodenetleyiciye değil, bir röle veya MOSFET aracılığıyla bağlanacaktır (bkz. Şekil 3C).
- Basınçlı bir hava kaynağı tanımlayın (örn. duvar besleme tesisatı veya gaz tüpü).
- Basınç kaynağını 0 mm boru (duvar kaynağı) kullanarak uygun bir basınç regülatörüne (2-6 bar basınç aralığı) bağlayın veya doğrudan gaz tüpüne uygun bir regülatör takın.
- Basınç regülatörünü solenoid valf girişine bağlayın (6 mm boru, bkz. Şekil 3B).
- Solenoidi mikroskop aşamasına mümkün olduğunca yakın yerleştirin (aşamadan ~ 0.5-1 m önerilir, ancak gerekirse daha uzun mesafeler mümkündür).
- Solenoid valfi elektronik olarak seçilen kontrolöre bağlayın. Ayrı bir mikrodenetleyici kartı (örneğin, Arduino) veya mevcut bir DAq kartı kullanarak kontrol etmek gibi farklı seçenekler mevcuttur.
7. Temizleme ve depolama
- Deney tamamlandıktan sonra cihazı mikroskoptan çıkarın.
- Daldırma sıvısını çıkarın. Daldırma yağı, organik çözücülerle (örn. aseton, metanol vb.) çıkarılabilir.
- Cihazı düz bir yüzeye yerleştirin ve valf borusu dışındaki tüm boruları ayırın. Her bir boruyu güvenli bir şekilde çıkarmak için, yakınındaki PDMS'ye bastırın ve yavaşça çekin. Kapak camının kırılmasına neden olabileceğinden cihazı kaldırmayın ve bükmeyin.
- PDMS yüzeyini %70 etanol ile temizleyin.
- Cihazı, valf hortumu takılıyken oda sıcaklığında saklayın.
NOT: Cihaz, tüm üniteler kullanılana kadar, muhtemelen valf borusunu yeniden doldurmaya gerek kalmadan yeniden kullanılabilir. Bununla birlikte, valf borusundaki su uzun bir süre boyunca buharlaşır ve sonunda yeniden doldurulması gerekebilir.
Sonuçlar
Cihaz tasarımı ve boyutları
Dört larva aşamasının tümünü barındırmak için beş farklı cihaz tasarlanmıştır. Bu cihazlar şu şekilde belirlenmiştir: L1, yumurtadan çıktıktan hemen sonra yüklenen ve L2 aşamasına kadar görüntülenen L1 larvaları için; L1-L4, larvaları orta-geç L1 aşamasından erken ve orta L4'e kadar tutabilir; L2-A, yaklaşık olarak L2 aşamasının ortalarından genç yetişkinliğe kadar olan hayvanlar için uygundur; L3-A, yaklaşık olarak L3 aşamasının ortalarından genç yetişkinliğe kadar olan hayvanlar için; ve yaklaşık olarak geç L4 aşamasından genç yetişkinliğe kadar hayvanları barındıran L4-A.
Tüm cihazlar, bir solucan girişi, 1 (veya medya değişimi durumunda 2) bakteriyel gıda girişi/girişleri ve ortak bir atık çıkışından oluşan aynı temel düzeni takip eder. Giriş ve çıkış kısmı arasına, giriş ve çıkış tarafı daha düşük yükseklikteki gıda besleme kanalı ile etkili bir şekilde ayrılmış olacak şekilde 41 paralel tuzak kanalı dizisi yerleştirilir (Şekil 1A,A'). Kanal boyutları, L1 cihazları için 400/15 μm, L1-L4 cihazları için 575/22 μm, L2-A cihazları için 800/27 μm, L3-A cihazları için 900/30 μm ve L4-A cihazları için 1000/65 μm uzunluk/genişlik ile bir deneyin başında yüklenen solucanlardan önemli ölçüde daha uzun ve daha geniş olacak şekilde seçilmiştir (Ek Dosya 1, Ek Dosya 2, Ek Dosya 3, Ek Dosya 4 ve Ek Dosya 5).
Kanal uzunluğu, deneyin sonunda hayvanların ulaştığı boyuta uyacak şekilde seçilirken, genişlik, deneyin başlangıcındaki solucanların kanal genişliğinin yaklaşık üçte ikisini işgal edeceği şekilde seçildi. Bu tasarım, solucanların dönmesini veya dönmesini önlerken, tüy dökümü sırasında büyüme ve hareket için yeterli alan sağlar. Genişlikten farklı olarak, kanal yüksekliği deneyin başında solucanların kalınlığına yakın ayarlandı: erken L1 larvaları için 8 μm, orta/geç L1 larvaları için 12 μm, orta L2 larvaları için 15 μm, orta L3 larvaları için 17.5 μm ve geç L4 larvaları için 22.5 μm, L1, L1-L4, L2-A, L3-A'ya karşılık gelir, ve sırasıyla L4-A cihazları. Küçültülmüş kanal yüksekliği, dikkatlice seçilmiş bir genişlikle (0,5-0,6 yükseklik-genişlik oranını koruyarak) birleştiğinde, solucanların sabit bir yönde kalmasını sağlar. Özellikle, yeterince küçük bir kanal yüksekliği ile, tüm solucanlar sürekli olarak istenen yanal yönde konumlandırılır.
Gıda tedarik kanalı, L1 için 3 μm ve diğer tüm cihazlar için 5 μm yükseklikte üretildi ve hayvanların tuzak kanallarından kaçması olmadan bakterilerin hayvanlara kolayca ulaşmasını sağladı. Tüm cihazlar aynı gıda besleme katmanını (Ek Dosya 6) ve aynı valf katmanını (Ek Dosya 7) kullanır. Valf katmanının, 20 μm yükseklikte ayrı bir yonga plakası üzerinde üretildiğini ve yalnızca PDMS cihaz imalatı sırasında cihaz katmanına yerleştirildiğini unutmayın (adım 1.21).
Solucanların baştan kuyruğa dönmesini veya tersine dönmesini önlemek için gerekli olan bu aşamaya özgü geometrik kısıtlamalar, tüm larva aşamalarını barındırmak için üç farklı cihaz tipinin kullanılmasını gerektirir. L1 larvaları genç yetişkin hayvanlar için büyüklükte bir kanala yerleştirilirse, sabit kalmazlar ve tuzak kanalından hızla çıkarlar.
C. elegans hazırlama
Aksi belirtilmedikçe, solucanlar 20 ° C'de E. coli OP50 ile ekilen NGM plakaları üzerinde standart protokoller25'e göre muhafaza edildi. Solucan hazırlama bölümü, bir görüntüleme deneyinde kullanılan senkronize bir solucan popülasyonunun hazırlanmasını açıkça açıklar. Senkronizasyon, gece boyunca açlıktan sonra kalıntıları ve yumurtadan çıkmamış hayvanları çıkarmak için ek bir filtreleme adımı ile modifiye edilmiş sodyum hipoklorit ağartıcı26 kullanılarak standart protokollere göre gerçekleştirildi. Amaç, daha sonra NGM plakalarına ekilen veya doğrudan görüntüleme cihazına yüklenen birçok senkronize L1 larvası elde etmektir. Manuel toplama veya kontrollü yumurtlama gibi diğer senkronizasyon yöntemleri de aynı derecede uygundur. Bununla birlikte, yeterli hayvan üretmede daha zahmetlidirler (koşul başına 200 önerilir).
Solucanlar istenen aşamaya ulaştıklarında, temiz S-Basal (ideal olarak 0,2 μm'lik bir filtreden süzülür) kullanılarak NGM plakasından nazikçe yıkanabilirler. Amaç, plakadan bakteri veya döküntü toplamadan mümkün olduğunca çok hayvan toplamaktır. Hayvanlar küçük bir santrifüj tüpünde toplanır ve 2-3 kez taze S-Basal tamponu ile yıkanır, sonunda mümkün olduğunca fazla sıvı çıkarılır. Hayvanlar daha sonra doğrudan konsantre hacimden alınır. Hayvan konsantrasyonu çok düşükse, yükleme daha yavaş olacak, cihazdan daha büyük hacimde sıvının akmasını gerektirecek ve tuzak kanallarını döküntülerle tıkama riskini artıracaktır.
Bakteriyel gıda hazırlama
Bakteri büyümesi standart protokollere göre gerçekleştirilir, ilk bakteri konsantrasyonu (OD600 = 1.9) S-Bazal tamponda (0.2 μm'lik bir filtreden süzülür) yaklaşık 40 kat arttırılır ve yoğunluk gradyan ortamı ve PF içeren S-Bazal tampon (0.2 μm'lik bir filtreden süzülür) ile karıştırılır. Bu işlem adımının beklenen sonucu, görüntüleme deneyi sırasında çok yoğun bir bakteri süspansiyonunun hazırlanması ve bakteri sedimantasyonunun önlenmesidir. Yüksek yoğunluk, hayvanları medya dağıtımında kullanılan düşük akış hızlarında (1 μL/s) çip üzerinde beslemek için gereklidir. Yoğunluk gradyan ortamının amacı, deney sırasında bakteri çökelmesini önlemektir ve PF'nin amacı, bakterilerin kanal duvarlarına yapışmasını önlemektir. Hem yoğunluk gradyan ortamı hem de PF toksik değildir ve hayvan canlılığını etkilemez.
Bir deneyde farklı bir bakteri türü kullanılıyorsa, yoğunluk gradyan ortamının gerekli konsantrasyonunun belirlenmesi gerekecektir. Bu, bakteri süspansiyonunun değişen miktarlarda ortamla karıştırılması ve ardından santrifüjleme ile elde edilebilir. Yoğunluk gradyan konsantrasyonu çok düşükse, bakteriler tortulaşır; Konsantrasyon çok yüksekse, bakteriler yüzer. Uygun bir konsantrasyon bulunduktan sonra, yiyeceğin deney boyunca nasıl davranacağını belirtmek için bakteri karışımını yaklaşık 48 saat oda sıcaklığında bırakarak sonucun doğrulanması önerilir. Deneyden sonra, bakterilerin beslendiği şırınganın kontrol edilmesi ve bakterilerin tortu oluşturmadığından veya yüzmediğinden emin olunması da aynı şekilde önerilir. Farklı miktarlarda Optiprep eklenmesinden kaynaklanan hacim farkı, ağırlıkça daha fazla veya daha az S-Bazal + %1 PF eklenerek telafi edilebilir. Benzer şekilde, süspansiyona ek ortam veya bileşikler (örneğin, oksin) eklenebilir ve ekstra hacim, S-Bazal + ağırlıkça %1 PF hacminden çıkarılır.
Kurulum hazırlığı
Basınç besleme sistemini, rahatça çalıştırılabilecek şekilde mikroskoba mümkün olduğunca yakın kurun. Tüm boru geçişleri, özellikle çipe bağlanan 1/16" boru kısa kalmalıdır (0.5/1" OD boru için 16 m'den az) (Şekil 2 ve Şekil 3B). Yukarıdaki bölümde belirtildiği gibi, çip üzerindeki valfin bilgisayar kontrolü çeşitli şekillerde sağlanabilir. Herhangi bir mikroskop yazılımında (Micro-Manager, Metamorph, NIS ve ZenBlue'da test edilmiştir), özel bir mikrodenetleyici kartı (örneğin, Arduino) bağlayarak veya sistemi mevcut bir veri toplama (DAq) kartına bağlayarak mümkün olmalıdır. Seçilen kart çıkışı daha sonra, görüntü alımından 10 saniye önce açılan veya cihaz kurulumu sırasında manuel olarak çalıştırılan bir deklanşör olarak yapılandırılmalıdır. Daha önce de belirtildiği gibi, solenoidin doğrudan mikrodenetleyiciye bağlanması önerilmez; bunun yerine, solenoid ve mikrodenetleyicinin elektronik olarak izole kalması için bir MOSFET veya röle anahtarı aracılığıyla bağlanın (Şekil 3C).
Basınç besleme borusuna benzer şekilde, çipe giden diğer tüm boru geçişlerini (1/16" OD ve 1/32" OD) mümkün olduğunca kısa tutun. Solucan ve atık borularını (1/16" OD) sırasıyla 2.5 cm ve 20 cm'nin altında tutun. Bakteri besleme borusu (1/32" OD), mikroskop aşamasına yerleştirildikten sonra şırınga pompasından cihaza bağlanacak kadar uzun olmalıdır. Bununla birlikte, bunu mümkün olduğunca kısaltmak ve şırınga pompasını mikroskop aşamasına yakın bir yere, örneğin sahnenin yanına, bir raf kullanarak veya bir inkübatör muhafazasının üzerine yerleştirmek şiddetle tavsiye edilir. Sisteme eklenen herhangi bir uzunluktaki boru, hayvanları cihaza yüklerken hissedilen geri basıncı artıracak ve mahsur kalan hayvanlar üzerindeki toplam basıncı artıracaktır.
Cihazın çalışması
Bu aşamada tüm borular hazırlanabilir ve ilgili künt iğneye, çelik pime ve şırıngaya bağlanabilir (protokol adımı 4'ün başlangıcı). Yukarıda belirtildiği gibi, boru uzunluğunu mümkün olduğunca kısa tutun (Şekil 2J-N). Daha da önemlisi, şırıngalarda veya borularda hava kabarcığı kalmamasına dikkat edilmelidir, çünkü bunlar hayvan yüklemesini engelleyecek ve deney sırasında hayvanların tuzak kanalından kaçmasına neden olabilir. Hava kabarcıkları şırıngadan birçok farklı yolla çıkarılabilir, örneğin şırıngayı doldurarak, ters çevirerek ve hava kabarcıkları şırınganın üstüne çıkacak şekilde hafifçe sallayarak (şırınganın hafifçe vurulması önerilmez, çünkü bu ek hava kabarcıklarının sıkışmasına neden olabilir). Alternatif olarak, şırınga tampona yapıştırılarak ve kabarcıkların çoğunu hızlı bir şekilde çıkarmak için pistonu hızla yukarı ve aşağı hareket ettirerek doldurulabilir.
Şırınga doldurulduktan ve kabarcıksız hale geldikten sonra, künt iğne ve boru takılır ve tampon ile doldurulur. Şırıngayı doldururken de özel dikkat gösterilmelidir, çünkü künt iğnenin plastik kısmında hava kolayca sıkışabilir. Hava sıkışırsa, iğneyi değiştirin. Alternatif olarak, iğneyi sıvı ile önceden doldurmak, örneğin bir pipet kullanmak sorunu hafifletebilir.
Tüm bileşenler yerindeyken, boru, solenoid ve çip üstü valfi bağlayan borudan başlayarak cihaza takılabilir (Şekil 2A-C,J). Bu boru başlangıçta deiyonize su ile doldurulur ve sistem, çıkmaz valf kanalındaki tüm havayı çıkarmak için basınçlandırılır. PDMS gaz geçirgendir; böylece yüksek basınç, kanaldaki tüm havayı PDMS'ye itecek ve valf kanalını suyla dolu bırakacaktır. Bu işlem mikroskop üzerinde takip edilebilir ve tüm valf kanalının dolduğundan emin olun. Vanayı doldurduktan sonra bakteri beslemesi bağlanabilir ve tüm açık giriş/çıkışlar bloke edilerek cihaz doldurulabilir ve basınçlandırılabilir (Şekil 2D,E,K,L). Hava yer değiştirir ve işlem bir mikroskopta izlenebilir. Tüm hava yer değiştirdikten sonra, bakteriler cihazı eşit şekilde doldurmalıdır. Engelleme pimleri çıkarılır ve atık toplama borusu bağlanır (Şekil 2F,G,M). Bu noktada, az miktarda sıvı cihazdan atık toplama tüpüne akmalı ve tüpe olan tüm bağlantıların açık olduğundan emin olmalıdır. Bu, boruyu toplama tüpüne bağlamadan önce görsel olarak onaylanabilir. Atık toplama tüpüne sıvı akmıyorsa, muhtemelen tıkanmıştır. Bu, deney üzerinde basınç oluşmasına neden olacak ve kapana kısılmış hayvanları olumsuz yönde etkileyecektir. Tüp veya bağlantıları tıkalıysa, çıkarın ve tüm bağlantıları bir iğne kullanarak temizleyin veya su dolu bir şırınga ile yıkayın.
Son olarak, sonsuz hortum bağlanabilir (Şekil 2H,N). Solucanlar, santrifüj tüpünden, S-Bazal dolgulu şırıngaya bağlı boruya emilerek alınır. Hayvanlar şırıngaya değil, sadece boruya çekilmelidir. Boru daha sonra cihaza bağlanabilir. Bundan önce, cihazdan ve sonsuz dişli borudan az miktarda sıvı dışarı itilir ve iki damlacık, yükleme sırasında cihaza hava itilmeyecek şekilde bağlanır.
Solucan yükleme
Tüm bağlantılar yapıldıktan sonra, solucan şırıngasının pistonu itilerek ve çekilerek hayvanlar yüklenebilir. Hayvanlar girişten tuzak kanalı dizisine doğru yıkanacaktır; Ancak, doğal olarak yaşadıkları akışa karşı yüzeceklerdir. Bu nedenle hayvanların, başları tuzak kanalına bakacak şekilde yeniden yönlendirilmesi gerekir. Doğru hayvan oryantasyonu, pistonu iterek ve çekerek ve hayvanlara istenen yöne dönmeleri için zaman vererek gerçekleştirilir. Bu neredeyse tek bir solucan temelinde başarılabilir, ancak biraz pratik gerektirecektir. Hayvanlar doğru bir şekilde yönlendirildikten sonra, tuzak kanalına itilebilir ve bir yükseklik basamağının onları durdurduğu kanalın sonuna kadar kayabilirler (Şekil 1A,B). Hayvanlar kanala giremezse, seçilen cihaz için çok büyüktürler ve daha büyük bir cihazda görüntülenmesi gerekir. Hayvanlar tuzak kanalına yerleştirildiğinde dönebiliyor veya dönebiliyorsa, çok gençtirler ve daha küçük bir cihaz kullanılması gerekir veya hayvanların birkaç saat daha büyümeye bırakılması gerekir.
Daha da önemlisi, farklı kanallardaki hayvanlar birbirini etkilemeyecektir. Bu nedenle, yanlış yüklenen hayvanlar, doğru yüklenenleri etkilemeyecek, ancak yiyeceğe yeterli erişime sahip olmayacak ve bu nedenle daha yavaş büyüyecek veya gelişimi durduracaktır.
Hayvanlar doğru yaşta yüklenirse, uzunlamasına kanal ekseni boyunca minimum hareket meydana gelmelidir. Bununla birlikte, hayvanlar kıpırdamakta serbesttir (Şekil 1B) ve birkaç dakika içinde beslenmeye başlar. Hayvanlar uzunlamasına kanal ekseni boyunca önemli bir hareket gösteriyorsa, bunun nedeni muhtemelen cihazdaki basınç birikmesi veya boru, künt iğne veya şırınganın bir yerine sıkışmış bir hava kabarcığıdır. Cihaz içindeki basınç birikmesi, sonsuz hortumu kör iğneden nazikçe ayırarak ve nazikçe yeniden takarak serbest bırakılabilir. Yukarıda belirtilen adımlara ve önlemlere rağmen sistem içinde bir hava kabarcığı kalmışsa, tüm solucan şırıngasının çıkarılması ve hava kabarcığı olmayan yenisiyle değiştirilmesi gerekebilir. Sistemdeki hava kabarcıkları, yükleme sırasında sıkışan ve hayvanları yükledikten sonra yavaşça serbest bırakılan yaylar olarak işlev görür. Genişleyen hava kabarcıklarının yarattığı akış, hayvanları tuzak kanallarının dışına iterek sistem kararsızlıklarına neden olabilir.
Çip üzerinde görüntü alma ve geliştirme
Son olarak, hayvanlar yüklendikten sonra görüntü alımı başlayabilir. Prensip olarak, cihazlar çoğu görüntüleme yöntemi, parlak alan, epifloresan 18,19,22,23 (Şekil 4), eğirme diski konfokal19 ve hatta süper çözünürlüklü modaliteler (AiryScan24) ile uyumludur, çünkü tüm görüntüleme 170 μm kalınlığında bir kapak camından gerçekleştirilir. Sonuç olarak, mikroakışkan cihaz, çip üzerinde elde edilebilir görüntü kalitesi üzerinde çok az etki gösterir veya hiç etki göstermez. Bununla birlikte, görüntüleme modalitesinden bağımsız olarak, hayvan canlılığını etkilemeyen uygun görüntüleme koşulları seçilmelidir. Yüksek uyarma yoğunlukları, numuneye verilen yüksek enerji ve ısı nedeniyle kolayca florofor ağartmasına ve gelişimsel durmaya neden olacaktır. Kısa pozlama süreleri (~10 ms) ve düşük uyarma yoğunlukları (tipik bir floresan LED kaynağının %10'undan az) önerilir, bu da min = 0 ve maks = 1000 kontrast ayarında kullanılabilir bir görüntü sağlar (16 bit kamera kullanırken) (Şekil 4).
L1, L1-4 ve L2-A cihazları kullanılarak elde edilen temsili veriler Şekil 4'te gösterilmektedir. Kuluçka/gece açlığından orta L2 larva aşamasına kadar C. elegans epitel hücrelerinin gelişiminin gösterilmesi (Şekil 4A, Ek Film 1), 1° kader vulva öncü hücrelerinin indüksiyonu ve bunların geç L1'den erken L4 larva aşamasına kadar müteakip bölünmeleri (Şekil 4B, Ek Film 2) ve son olarak erken L3 larva aşamasından yetişkinliğe geçişte eversiyona kadar C. elegans vulvasının oluşumu (Şekil 4C, Ek Film 3).
Her uygulamaya, farklı gelişimsel zamanlama metriklerinin bir nicelleştirmesi eşlik eder. Şekil 4A,B'deki görüntüler, herhangi bir işlem sonrası uygulanmadan gösterilmiştir, yani herhangi bir evrişim veya görüntü kaydı uygulanmamıştır. Öte yandan, Şekil 4C'deki görüntüler, uzun süreli görüntüleme cihazları kullanıldığında görüntü kalitesindeki olası iyileştirmeleri vurgulayarak,27 dekonvolvasyona tabi tutuldu ve kaydedildi.
İlk olarak, Şekil 4A'da gösterilen hayvanlar için her bir dikiş hücresi bölünmesinin başlangıcını belirlemek (tam zamanlı bir kurs için Ek Film 1'e bakınız), tüm hücrelerin 12 hayvanda tutarlı ve zamanında bölünmesini gösterir (Şekil 4D). Dikiş hücreleri kullanılarak, dört larva aşamasının tümünde genel gelişim zamanlaması da değerlendirildi ve tüm dikiş hücresi bölünmelerinin L1'de (n = 22) 12.0 saat ± 1.7 saat (ortalama ± SD), L2'de 10.2 saat ± 1.0 saat (n = 27), L3'te 1.9 saat ± 1.4 saat (n = 27) ve L4 hayvanlarında (n = 19) 14.6 saat ± 2.2 saat sonra tamamlandığı bulundu. Bu veriler, literatür değerleri 2,28 ve plaka üzerinde yetiştirilen hayvanlarda ölçülen değerlerle tutarlıdır ve L1 15 saat (n = 21), L2 10 saat (n = 15), L3 12 saat (n = 21) ve L4 12.5 saat (n = 61) için medyan gelişim süreleri vermiştir (Berger ve ark.18'den uyarlanmıştır). Gözlenen hafif gecikmeler, muhtemelen görüntü elde etmenin ve bunun sonucunda ortaya çıkan fototoksisitenin veya hayvanlar büyüdükten ve bir tuzak kanalı haline geldikten sonra artan hapsin bir sonucudur.
İkinci olarak, L2 ve L3 aşamaları boyunca hayvan büyümesini takip ettik ve gonad uzunluğunu gelişimsel ilerlemenin mükemmel bir göstergesi olarak ölçtük (Şekil 4E, tam zamanlı bir kurs için Ek Film 2'ye bakınız). Dikiş hücresi bölünmesinde olduğu gibi, düz hayvan oryantasyonu sayesinde kesin gonad uzunluğu ölçülebildi ve görüntülenen tüm hayvanlarda tutarlı gonad büyümesi bulundu (n = 19). Bu deneylerdeki ilk VPC bölünmesi, deney başladıktan 14.26 saat ± 2.47 saat sonra (tohumlamadan ~ 30 saat sonra) gözlendi, ikincisi ise 1.46 saat ± 0.13 saat sonra gerçekleşti (n = 19). Bu veriler, NGM plakaları 29,30'da oluşturulan literatür değerleri ile iyi bir uyum içindedir. Euling ve Ambros30, ilk bölünmenin yaklaşık 29 saat sonra, ikincisinin ise yaklaşık 3 saat sonra gerçekleştiğini buldu.
Son olarak, vulva gelişimindeki belirli aşamalara ulaşılma süresi ölçüldü (Şekil 4F, tam zamanlı kurs için Ek Film 3'e bakınız), özellikle Mok ve ark.31 tarafından tanımlanan alt aşamalara göre istiladan orta L4 aşamasına (L4.5, t4) ilerlemek için gereken süre değerlendirildi. T1-T2 arasındaki ortalama ilerleme süresi 3.8 saat ± 1.2 saat, t2-T3 arası 3.5 saat ± 1.2 saat ve t3-T4 arası 2.8 saat ± 1.6 saat (n = 7) idi, bu da yaklaşık olarak doğrusal bir gelişimsel ilerlemeyi gösterir. Gelişimsel zamanlama testine benzer şekilde, bu süreler, özellikle t1-t2, rapor edilen literatür değerlerine kıyasla (t1-t2: 0.7 saat, t2-t3: 3 saat, t3-t4: 2.3 saat31) biraz gecikmiş görünmektedir. Bununla birlikte, gelişimsel zamanlama hayvanlar arasında oldukça tutarlı kalır ve hepsi başarılı bir şekilde yetişkinliğe doğru ilerler.
Hayvan hareketini ve mikroskop sürüklenmesini dengeleme
Tek bir Z-yığını boyunca hayvan hareketi, çip üzerindeki valf çalıştırıldığında tipik olarak minimumdur. Bununla birlikte, hayvanların tamamen hareketsiz kalması beklenmemektedir. Tek bir yığında gözlemlenen artık titreme, talaş üzerindeki valfi harekete geçirmek için basıncın artırılması, kullanılan maruz kalma süresinin azaltılması veya yığın alımını hızlandırmak için seçilen Z adımının artırılmasıyla telafi edilebilir. Yığın toplama süresi, bir piezo Z-sürücüsü kullanılarak daha da azaltılabilir, bu da geleneksel bir mikroskop odak sürücüsüne kıyasla önemli ölçüde daha hızlı Z-hareketi ile sonuçlanır veya çok bantlı filtreler (örneğin, GFP/mCherry) kullanılarak ayrı renklerin elde edilebilmesi için zaman alıcı filtre değişikliklerine gerek kalmadan. Başvuru için, sağlanan örneklerde (Şekil 4 ve Ek Film 1, Ek Film 2 ve Ek Film 3), yığın edinme süresi tipik olarak 3 ile 8 saniye arasındaydı. Artık hareket, gerekirse çeşitli görüntü kayıt yöntemleriyle de kaldırılabilir.
Çip üzerindeki hayvanların istikrarlı bir şekilde büyümesi bekleniyor. Bu nedenle, ilgilenilen özellikler kaçınılmaz olarak uzunlamasına kanal ekseni boyunca kayacaktır (Şekil 4A,B, Ek Film 1 ve Ek Film 2). Bu nedenle, görüntüleme FOV'unun, ilgilenilen özelliğin FOV'a dönüşebileceği ve bir deney boyunca kaybolmayacağı şekilde ayarlanması önerilir (Şekil 1B ve Şekil 4A,B). Alternatif olarak, hayvanlar, tüm hayvan vücudunu kaplayan birden fazla bitişik FOV'da görüntülenebilir. Bununla birlikte, bu ek fototoksisite ve stres verebilir. Z-motion'da olduğu gibi, çeşitli kayıt prosedürleri zaman içinde kanaldaki hayvan hareketini telafi edebilir. Hayvanlar, uzunlamasına eksen boyunca, büyümeye atfedilebilecek olandan daha geniş düzensiz hareket gösteriyorsa, bunun bir hava kabarcığından kaynaklanması muhtemeldir.
Her uzun süreli görüntüleme cihazı, her biri ayrı bir deney için kullanılabilen altı ayrı görüntüleme ünitesi içerir. Her birim 41 hayvana kadar barındırabilir ve tuzak kanalları, tek bir FOV'da birden fazla hayvanın görüntülenebileceği şekilde aralıklıdır. Ek olarak, tek bir ünite veya cihaz içinde birden fazla FOV görüntülenebilir. Tüm mikroskop örneklerinde olduğu gibi, numune yüzeyi boyunca hareket, daldırma ortamının kaybı nedeniyle odak kaymasına neden olabilir. Bu sapma, daha düşük viskoziteli bir daldırma yağı kullanılarak veya çeşitli otomatik odaklama modaliteleri ile telafi edilebilir. Bununla birlikte, bazı donanım otofokus sistemleri, bir PDMS mikroakışkan cihazıyla birlikte kullanıldığında çalışmayabilir, çünkü bunlar camdan sulu bir ortama geçişi referans noktası olarak kullanır (kapak camının örnek tarafı). FOV'un çoğu, sudan daha yüksek bir kırılma indisine sahip olan cihaz içinde silikon ile doldurulur; Bu, görüntü kalitesini etkilemese de, otomatik odaklamayı olumsuz etkileyebilir. Tek bir FOV görüntülerken, cihaz içinde gözlemlenen odak kayması minimumdur (2 μm'den az). Aşırı odak kayması gözlenirse, bu, mikroskop sisteminin veya ortamın termal kararsızlığından, birden fazla FOV elde eden aşırı XY hareketinden veya cihazın mikroskop üzerine yanlış monte edilmesinden kaynaklanabilir (önerilen montaj mekanizmaları için Şekil 3A'ya bakın).
Benzer şekilde, aşırı XY hareketi ve yanlış montaj da XY kaymasına neden olabilir. Cihaz ve mikroskop objektifi daldırma sıvısı ile birbirine bağlı olduğundan, X, Y veya Z'deki hızlı hareketler cihaza kuvvet uygulanmasına neden olabilir. Cihazlar doğru şekilde monte edilmişse ve üzerlerine herhangi bir dış kuvvet etki etmiyorsa, minimum odak kayması ve XY kayması olmadan son derece kararlıdırlar.
Son olarak, belirli sistem parametreleri uygun değilse, PDMS mikroakışkan cihazları hayvan gelişimini olumsuz etkileyebilir. Canlılık, aşırı valf basıncından, yüksek uyarma yoğunluklarından kaynaklanan yüksek fototoksisiteden, uzun maruz kalma sürelerinden veya yığın alımları arasındaki kısa zaman aralıklarından etkilenir. Özellikle bu sistemi ilk kez kullanırken, görüntüleme durumunun hayvan büyümesini etkilemediğinden emin olmak için parlak bir floresan işaretleyici veya parlak alan görüntüleme kullanarak hayvan canlılığının değerlendirilmesi şiddetle tavsiye edilir. Hayvanlar güvenilir bir şekilde geliştikten sonra, görüntüleme parametreleri gerektiği gibi değiştirilebilir.
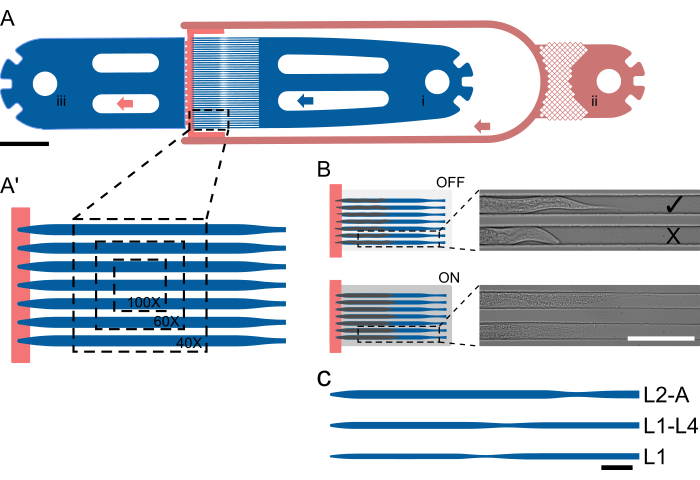
Şekil 1: Cihaz yerleşimi ve şematik işlem. (A) Solucan girişi (i), bakteriyel gıda girişi (ii) ve genel çıkış (iii) ile tek bir üniteyi gösteren cihaza genel bakış. (Bir') Farklı büyütme oranlarında (40x-100x) tek bir FOV'da görünen solucan sayısını vurgulayan, bir L2-A cihazındaki tuzak kanalının büyütülmüş görünümü. (B) Çip üzerindeki vananın çalışma prensibi. KAPALI olduğunda, hayvanların tuzak kanalına rahatça sığabilmesi için kanal yüksekliği seçilir. AÇIK olduğunda, kanal yüksekliği azalır, hayvanı kapak camına bastırır, böylece kapana kısılmış hayvanları geri dönüşümlü olarak hareketsiz hale getirir. Görüntüler, çip üzerinde mahsur kalmış iki hayvanın, çip üzerindeki valf KAPALI ve valf AÇIK durumdayken, hayvanların basınç altında gözle görülür şekilde düzleştiğini ve uzadığını gösteriyor. Üstteki hayvan doğru şekilde yüklendi ve besin kaynağına doğru bakıyor ( ) ve alt hayvan uzağa bakıyor (X). (C-C") Şematik cihaz kurulumu. (C) Mevcut cihaz boyutları. L1, L1 ila orta L2 aşamasından orta L2 aşamasına kadar olan hayvanlar için, L1-4, orta L2 ila orta L4 larva aşamasından hayvanlar için ve L2-A, orta L2 larva aşamasından yetişkinliğe kadar olan hayvanlar için uygundur. Ölçek çubukları (A) 1000 μm, (B) 100 μm ve (C) 50 μm'dir. Şekil kısmen Berger ve ark.18'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
) ve alt hayvan uzağa bakıyor (X). (C-C") Şematik cihaz kurulumu. (C) Mevcut cihaz boyutları. L1, L1 ila orta L2 aşamasından orta L2 aşamasına kadar olan hayvanlar için, L1-4, orta L2 ila orta L4 larva aşamasından hayvanlar için ve L2-A, orta L2 larva aşamasından yetişkinliğe kadar olan hayvanlar için uygundur. Ölçek çubukları (A) 1000 μm, (B) 100 μm ve (C) 50 μm'dir. Şekil kısmen Berger ve ark.18'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
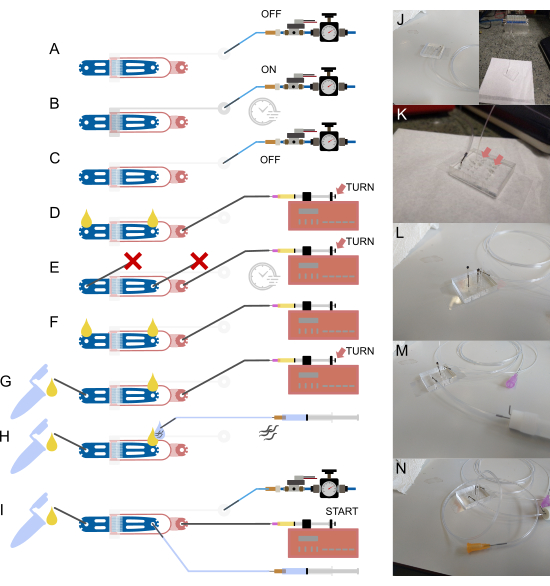
Şekil 2: Cihaz kurulumu ve bağlantıları. (A-I) Kurulum sürecine şematik genel bakış. (A) 1/16" su dolu borunun, diğer ucu basınç besleme sistemine bağlı olacak şekilde, içi boş bir çelik pim (gri) kullanarak valf girişine bağlanması. (B) Talaş üzerindeki hidrolik valfin talaş dışı solenoid ile doldurulması ve cihazın birkaç dakika basınçlandırılması. (C) Sonraki adımlara geçmeden önce basıncın devre dışı bırakılması. (D) Bakteriyel gıda içeren bir şırınganın 1/32" boru ve 30 G künt iğne kullanılarak gıda girişine bağlanması, ardından her iki açık bağlantıda sıvı görünene kadar cihazın doldurulması. (E) Solucan girişinin ve atık çıkışının bir parça 1/16" boru ( ) ile bloke edilmiş çelik pimlerle sızdırmaz hale getirilmesi ve gıda şırıngası ve pompası (kelebek vida ayarı ile) kullanılarak cihaza basınç uygulanması, basıncın birkaç dakika muhafaza edilmesi. (F) (E)'den tapaların çıkarılması, her açık bağlantıda sıvı damlacıklarının oluşmasını sağlamak. (G) Atık kabının kısa bir 1/16" boru parçası ve içi boş bir çelik pim ile bağlanması. (H) Tampon dolgulu bir şırınganın içi boş bir çelik pim ve 23 G künt iğne kullanılarak cihaza bağlanması. Cihaza bağlanmadan önce hortumun içine solucanlar çekilir, böylece giriş ve boru ucundaki sıvı damlacıkları hizalanarak hava girmemesi sağlanır. (I) Tüm cihaz bağlantıları kurulduktan sonra son kurulum. (J) (AC)'ye karşılık gelen, girişe ve solenoide (arka plan) bağlı valf hortumu ile cihazın görüntüsü. (K) Solucan girişi ve atık çıkışında (D)'ye karşılık gelen iki sıvı damlacığı (ok) gösteren, gıda besleme borusu takılıyken cihazın büyütülmüş görünümü. (L) (E)'ye karşılık gelen, gıda besleme borusu takılı ve solucan girişi ve atık çıkışı tıkalı olan cihazın büyütülmüş görünümü. (M) (G)'ye karşılık gelen, atık borusu ve kap takılıyken cihazın büyütülmüş görünümü. (N) (I)'ye karşılık gelen tüm boru bağlantıları yerindeyken son montaj. Kısmen Berger ve ark.18'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
) ile bloke edilmiş çelik pimlerle sızdırmaz hale getirilmesi ve gıda şırıngası ve pompası (kelebek vida ayarı ile) kullanılarak cihaza basınç uygulanması, basıncın birkaç dakika muhafaza edilmesi. (F) (E)'den tapaların çıkarılması, her açık bağlantıda sıvı damlacıklarının oluşmasını sağlamak. (G) Atık kabının kısa bir 1/16" boru parçası ve içi boş bir çelik pim ile bağlanması. (H) Tampon dolgulu bir şırınganın içi boş bir çelik pim ve 23 G künt iğne kullanılarak cihaza bağlanması. Cihaza bağlanmadan önce hortumun içine solucanlar çekilir, böylece giriş ve boru ucundaki sıvı damlacıkları hizalanarak hava girmemesi sağlanır. (I) Tüm cihaz bağlantıları kurulduktan sonra son kurulum. (J) (AC)'ye karşılık gelen, girişe ve solenoide (arka plan) bağlı valf hortumu ile cihazın görüntüsü. (K) Solucan girişi ve atık çıkışında (D)'ye karşılık gelen iki sıvı damlacığı (ok) gösteren, gıda besleme borusu takılıyken cihazın büyütülmüş görünümü. (L) (E)'ye karşılık gelen, gıda besleme borusu takılı ve solucan girişi ve atık çıkışı tıkalı olan cihazın büyütülmüş görünümü. (M) (G)'ye karşılık gelen, atık borusu ve kap takılıyken cihazın büyütülmüş görünümü. (N) (I)'ye karşılık gelen tüm boru bağlantıları yerindeyken son montaj. Kısmen Berger ve ark.18'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
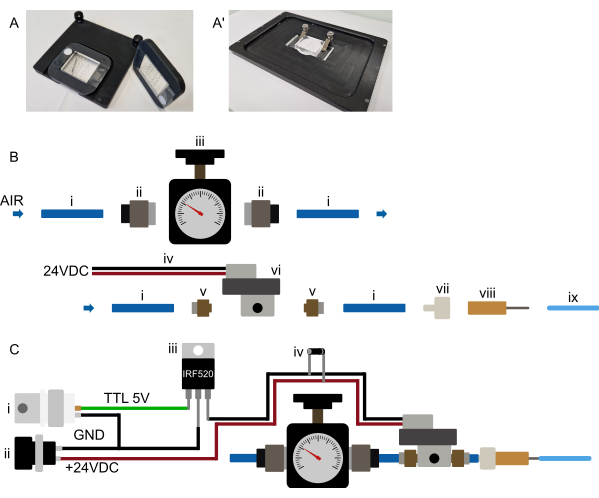
Şekil 3: Donanım kurulumu. (A-A') Önerilen cihaz montajı. (A) Dik bir mikroskop için olası montaj. Cihazlar, büyük bir merkezi oyuğa sahip dikdörtgen, 3D baskılı bir çerçeveye tutturulur. Başlangıçta iki küçük çift taraflı bant şeridi, cihazın PDMS kısmının her iki yanındaki kapak camına yerleştirilir. 3D baskılı çerçeve daha sonra cihazın üzerine yerleştirilir, böylece PDMS kısmı oyuktan yapışır ve çerçeve çift taraflı banda sıkıca bastırılır ve cihaz çerçeveye kalıcı olarak bağlanır. Bu nedenle çerçeve, cihazı güvenli bir şekilde tutar ve çerçeveye ve sahne ekine gömülü mıknatıslar kullanılarak mikroskop sahnesinde tutulur. Bu, cihazın dengeli bir şekilde monte edilmesini sağlar ve mikroskop objektifinin herhangi bir montaj donanımı ile çarpışmasını önler. Tüm borular cihazın önüne yönlendirilir. (Bir') Ters çevrilmiş bir mikroskop için olası montaj. Bir dizi kelepçe cihazı sıkıca tutar. cl'den emin olunampçalışma sırasında herhangi bir XY hareketini önlemek için cihazı sahne ekine bastırın. (B) Basınç sistemi parçaları görünümü. (i) Bir basınç kaynağına bağlı 6 mm OD poliüretan boru. (ii) Boruyu (i) basınç regülatörüne (iii) bağlayan G1/8 ila 6 mm itmeli adaptör. Boru daha sonra bir M5 ila 6 mm itme adaptörü (v) aracılığıyla bir solenoide (vi) bağlanır ve son olarak, boru bir luer kilidi-diken konektörüne (vii) ve kör bir 23 G iğneye bağlanır (viii) mikroakışkan cihaza bağlı 1/16" OD borusuna. (C) Elektronik bağlantıların ve monte edilmiş basınç sisteminin şematik genel görünümü. (i) Bir Arduino, bir DAq kartı veya başka bir mikrodenetleyici tarafından üretilen TTL tetikleyicisi (+3.3-5 V), uygun bir güç kaynağı (ii, 24 VDC) ile birlikte bir MOSFET'e bağlanır (iii) ve solenoidin elektronik bağlantıları, solenoidlerin güç bağlantılarına bağlı bir geri dönüş diyot (iv) ile şemada gösterildiği gibi. Mikrodenetleyiciden MOSFET'in kapısına bir TTL sinyali gönderildiğinde, normalde kapalı olan solenoide +24 VDC uygulanır ve çip üzerindeki hidrolik valf şişirilir. TTL sinyali çıkarıldıktan sonra, basınç serbest bırakılır ve çip üzerindeki hidrolik valf söndürülür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
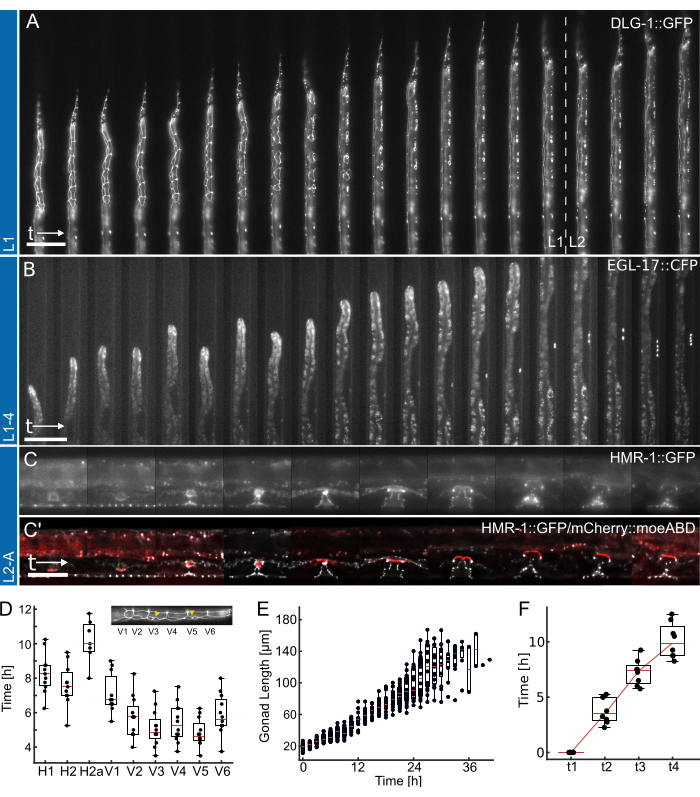
Şekil 4: Temsili sonuçlar. (A) L1 cihazını kullanarak, gece boyunca açlıktan erken/orta L2 larva aşamasına kadar büyüyen bir epitel bağlantı yapıcısı (ML2615, dlg-1(mc103[dlg-1::gfp])) gösteren hayvan. Görünür olan, bölünen dikiş hücrelerinin yanı sıra, geç L1 larva aşamasına doğru göç eden ve bölünen P hücreleridir. (B) L1-4 cihazı kullanılarak geç L1 larva aşamasından erken L4 aşamasına kadar büyüyen hayvan. Görünür, 1° kader vulva öncü hücresi (VPC) (AH1187, arIs92[egl-17::cfp]) için bir belirteçtir, deney sırasında erken dönemde görülebilen tek bir hücre ve ardından L3 larva aşamasında iki tur görünür hücre bölünmesi gelir. (C) L2-A cihazı kullanılarak geç L2 larva aşamasından erken yetişkinliğe kadar büyüyen hayvanlar. Görünür olan, belirgin toroidal yapılar oluşturan gelişmekte olan vulva dokusunu vurgulayan bir epitel bağlantı yapıcısıdır (AH5786, hmr-1(cp21[hmr-1::gfp + LoxP])) ve uterus çapa hücresi (AC) için bir işaretleyici ile birleştirilmiş bir görüntüdür (AH5786, qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)]) L3 larva evresinin sonuna doğru vulva dokusunu istila ederek dokuları birbirine bağlar. Tüm deneyler (AC) için, FOV başlangıçta hayvanların yalnızca bir kısmı görünecek şekilde ayarlanır. Deney ilerledikçe, hayvan, hayvan büyümesinin bir sonucu olarak kanal ekseni boyunca değişen özelliklerle kanalın daha fazlasını dolduracaktır. (D) L1 larva evresi sırasında bireysel dikiş hücresi bölünmelerinin bölünmeye başladığı zaman (n = 12). Ön-arka gövde ekseni boyunca dikiş hücresi kimliklerini (H1-V6) vurgulayın. (E) Şekil 4B'deki hayvanlar için zamanla gonad büyümesini gösterir (n = 19). (F) Vulval morfogenezde (t1-t4) 4 farklı gelişimsel zaman noktasına ulaşmak için gereken süreyi gösterir, bu da görüntülenen tüm hayvanlar için tutarlı geçişi gösterir (n = 7). Ölçek çubukları (A,B) 50 μm ve (C) 25 μm'dir. Tam zamanlı kurs için Ek Film 1, Ek Film 2 ve Ek Film 3'e bakın. Kutu grafikleri, üst ve alt dörtte birlikler ve aykırı değerler hariç dağılımın uç noktalarını gösteren çubuklarla birlikte medyan değerleri (kırmızı çizgiler) gösterir. Şekil Berger ve ark.18'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Film 1: Gece boyunca açlıktan erken L2 dönemine kadar gelişen tek C. elegans larvası. Görüntülenenler, aksi takdirde işlenmemiş formatta maksimum yoğunlukta yansıtılan epifloresan görüntülerdir (projeksiyonun toplam yüksekliği 1,5 μm'dir). Görünür, belirtilen aşamada (üstte) meydana gelen tüm dikiş hücresi bölünmesi ve füzyon olaylarıdır. Özellikler, DLG-1::GFP (epitel kavşak) işaretleyicisi kullanılarak 15 dakikalık aralıklarla toplam 25 saat boyunca özetlenir. Film, Berger ve ark.18'den yeniden kullanılmıştır. Bu filmi indirmek için lütfen buraya tıklayın.
Ek Film 2: Geç L1 evresinden erken L4 evresine kadar gelişen tek larva, bir EGL-17::CFP belirteci (1° kader vulva öncü hücresi (VPC)) eksprese eder. Erken L2'de (~ 400 dakika), EGL-17::CFP floresansı P6.p'de kendini gösterir ve yoğunluğu sürekli artar. L3 sırasında, P6.p, vulva gelişiminin 1 hücreli, 2 hücreli ve 4 hücreli aşamalarını oluşturan iki ardışık bölünme turuna uğrar. Görüntüler 30 dakikalık aralıklarla toplam 34 saat boyunca gösterilir. Film, Berger ve ark.18'den yeniden kullanılmıştır. Bu filmi indirmek için lütfen buraya tıklayın.
Ek Film 3: Üstten görünüm: L3 aşamasından L4/erişkin geçişine kadar gelişmekte olan vulvanın Z-projeksiyonu. Alttan görünüm: Aynı vulvanın zaman içindeki X projeksiyonu. Her iki görünüm de VPC'lerin ilk bölünmesini, ardından toroidlerin istilasını, oluşumunu ve genişlemesini ve ardından eversiyon sırasında çökmeyi gösterir. Epifloresan görüntüler, kırpma, evrişim giderme, kayıt ve projeksiyondan sonra görüntülenir. Özellikler, HMR-1::GFP işaretleyicisi (hipodermis ve VPC'ler) ve mCherry::moeABD işaretleyicisi (AC'nin ana hatlarını çizen) aracılığıyla özetlenmiştir. Film, Berger ve ark.18'den yeniden kullanılmıştır. Bu filmi indirmek için lütfen buraya tıklayın.
Ek Dosya 1: L1 cihazı için CAD dosyası. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 2: L1-4 cihazı için CAD dosyası. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 3: L2-A cihazı için CAD dosyası. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 4: L3-A cihazı için CAD dosyası. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 5: L4-A cihazı için CAD dosyası. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 6: Gıda dağıtım yapısı için CAD dosyası. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 7: Valf katmanı için CAD dosyası. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu makale, erken yetişkinliğe kadar dört larva aşamasının tamamında C. elegans'ta yüksek çözünürlüklü görüntüleme ve çeşitli gelişimsel süreçlerin izlenmesi için uygun olan benzersiz bir mikroakışkan uzun süreli görüntüleme platformunun çalışmasını açıklamıştır18. Bu görüntüleme yöntemini ve diğerlerini kullanarak zaman içindeki gelişimsel süreçleri in vivo olarak takip etme yeteneği, C. elegans araştırmasının birçok alanında vazgeçilmez hale gelmiş ve daha önce erişilemeyen soruların yanıtlanmasına izin vermiştir 23,24,29.
Agar pedleri ve daha önce yayınlanmış mikroakışkan tabanlı uzun vadeli görüntüleme stratejileri kullanan geleneksel görüntüleme yöntemlerinin aksine, bu yaklaşım deney boyunca solucan kimliğini ve yönelimini koruyarak zaman içindeki karmaşık gelişim süreçlerinin izlenmesini sağlar. Gelişim aşamasından bağımsız olarak, hayvanlar, her biri çip üzerindeki bir gıda kaynağına bağlı ve büyük bir hidrolik valf ile örtülen 41 paralel tuzak kanalından birine hapsedilir. Sıkışan tüm solucanların immobilizasyonu, hidrolik valfin şişirilmesi yoluyla gerçekleşir ve solucanları yalnızca görüntü alımı sırasında kapak camına bastırır. Tek bir görüş alanı içinde birden fazla hayvanın görülebildiği dar aralıklı tuzak kanal dizisi sayesinde yüksek verimli görüntüleme mümkündür. Uzun süreli görüntüleme cihazları, çoğu mikroskop kurulumuyla uyumludur, minimum ek donanım (1000 dolardan az) gerektirir ve mevcut donanımda değişiklik gerektirmez. Cihazların çalışması kasıtlı olarak basittir, bu nedenle tüm kullanıcılar yukarıdaki protokolü ve belirtilen sonuçları izleyerek hızlı bir şekilde öğrenebilmelidir.
Kısaca, hayvanlar 2,5 larva aşamasına kadar çip üzerinde görüntülenebilir (Şekil 1C). Hayvanlar başlangıçta senkronize edilir ve ya doğrudan çip üzerine yüklenir (L1 cihazı) ya da istenen gelişim aşamasına kadar (L1-L4 ve L2-A cihazları) NGM plakasına tohumlanır. Çip üzerindeki hayvanlar, yüksek konsantrasyonlu bir bakteri süspansiyonu kullanılarak beslenir ve görüntüleme yazılımı tarafından çalıştırılan çip üstü bir hidrolik valf kullanılarak hareketsiz hale getirilir (Şekil 1B). Hayvanlar bir şırınga kullanılarak tuzak kanallarına manevra yapılır, hayvanlar baş ile dikkatlice yiyecek kaynağına doğru yönlendirilir ve son olarak tuzak kanalının sonunda hayvanlar yakalanır (Şekil 1A ve Şekil 2). Hava kabarcıkları hayvanın pozisyonunu kolayca bozacağından, şırıngalarda, kör iğnelerde ve borularda hava sıkışmamasına dikkat edilmelidir. Cihazlar, PDMS malzemesi oldukça şeffaf, floresan olmayan ve ince bir kapak camına karşı sızdırmaz olduğu için çoğu görüntüleme modalitesi18,19,24 ile uyumludur (Şekil 4, Ek Film 1, Ek Film 2 ve Ek Film 3). Bununla birlikte, uzun maruz kalma süreleri ve yüksek uyarma yoğunlukları hayvan canlılığını kolayca etkileyeceğinden ve foto ağartma ile sonuçlanacağından, görüntüleme koşullarını seçerken dikkatli olunmalıdır.
Bu görüntüleme yönteminin sunulan versiyonuna ek olarak, protokolde çeşitli değişiklikler mümkündür ve halihazırda mevcuttur. En basit modifikasyon, standart bakteri suşlarının, örneğin RNAi eksprese eden bakteriler18 veya farklı besin değerlerine sahip bakteriler32 ile değiştirilmesidir. Bakteri suşları, yoğunluktaki farklılıkları hesaba katmak için Optiprep içeriği ayarlanarak kolayca değiştirilebilir. Benzer şekilde, bakteriyel gıdaya herhangi bir sayıda bileşik, örneğin oksin, besinler veya küçük moleküllü ilaç bileşikleri eklenebilir ve bunların etkileri, protokolde herhangi bir değişikliğe gerek kalmadan doğrudan in vivo olarak gözlemlenir. Özellikle, oksin kaynaklı protein bozunması veya geometriyi veya işlemi değiştirmeden cihaz düzenine bir gıda girişi ekleyerek zamanlanmış veya geri dönüşümlü maruz kalma gerektiren herhangi bir uygulama için bir medya değişim cihazı geliştirilmiştir. Ek giriş, tek bir gıda kaynağı için burada gösterildiği gibi cihaza bağlanan oksin ve oksin içermeyen iki farklı koşul arasında basit geçişe izin verir ve ortaya çıkan değişiklikler doğrudan gözlemlenir. Hidrolik valfin bir cihazdaki tüm birimler arasında paylaşılmadığı, ancak her birim için ayrı olduğu, böylece aynı cihaz içinde birden fazla koşulun görüntülenebildiği ve ayrı ayrı deney yapılabildiği, uzun valf çalıştırma ve edinme sürelerinin potansiyel olarak zararlı etkilerini azaltan cihaz varyantları da geliştirilmiştir. Son olarak, Berger ve ark.18'de açıklanan orijinal cihaz varyantlarının ötesinde, L3-A ve L4-A (burada tanıtılmıştır) olmak üzere iki yeni cihaz varyantı geliştirilmiştir ve L3 veya L4 ortası aşamasından yetişkinliğe kadar görüntülemeye izin verir. Bu modifikasyonların amacı, bir deneyin başlama zamanını daha sonraki bir larva aşamasına geciktirmektir, böylece daha önceki gelişim aşamalarının ilgi çekici olmadığı uygulamalarda daha büyük hayvanlar yüklenebilir.
Açıklamalar
Yazarlar herhangi bir rakip veya finansal çıkar beyan etmezler.
Teşekkürler
El yazması hakkındaki eleştirel tartışma ve yorumları için Hajnal laboratuvarı üyelerine teşekkür etmek istiyoruz. Ayrıca, NIH Araştırma Altyapısı Programları Ofisi (P40 OD010440) tarafından finanse edilen C. elegans Genetik Merkezi CGC'ye de minnettarız. Ayrıca, sunulan protokol hakkındaki değerli katkıları için Galli laboratuvarı (Hubrecht Enstitüsü), Conradt laboratuvarı (University College London) ve van den Heuvel laboratuvarı (Utrecht Üniversitesi) üyelerine teşekkür ederiz. Bu çalışma, İsviçre Ulusal Bilim Vakfı'ndan 31003A-166580 no'lu AH'ye, İsviçre Kanser Ligi no. 4377-02-2018'den AH'ye ve ETH Zürih'ten AdM'ye sağlanan fonlarla desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3/2 solenoid valve | Distrelec | 154-22-898 and 154-22-899 | Alternative to above. Solenoid valve connecting the pressure regulator to the on-chip valve. |
| Arduino | Distrelec | 301-01-956 | Optional microcontroller depending on the selected controller and interface. |
| Bacto-Tryptone | Thermo Fisher Scientific | 211705 | For L Broth production. |
| Bacto-Yeast | Thermo Fisher Scientific | 212750 | For L Broth production. |
| Blunt needle 23G | Gonano Dosiertechnik | GGA723050 | Blunt needle connecting the 1/16" tubing to a syringe. |
| Blunt needle 30G | Gonano Dosiertechnik | IG-TE730050 | Blunt needle connecting the 1/32" tubing to a syringe. |
| C. elegans Construct 1 | NA | NA | AH5786 LGI: hmr-1(cp21[hmr-1::gfp + LoxP]) Marston, D.J. et al. MRCK-1 drives apical constriction in C. elegans by linking developmental patterning to force generation. Curr. Biol. 26 (16), 2079-2089. 2016. |
| C. elegans Construct 2 | NA | NA | AH1187 LGII: arIs92[egl-17::cfp] Yoo, A.S., Bais, C., Greenwald, I. Crosstalk between the EGFR and LIN-12/Notch pathways in C. elegans vulval development. Science. 303 (5658), 663-666. 2004. |
| C. elegans Construct 3 | NA | NA | AH5786 LGV: qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)] Ziel, J.W., Hagedorn, E.J., Audhya, A., Sherwood, D.R. UNC-6 (netrin) orients the invasive membrane of the anchor cell in C. elegans. Nat. Cell Biol., 11 (2), 183-189. 2009. |
| C. elegans Construct 4 | NA | NA | ML2615 LGX: dlg-1(mc103[dlg-1::gfp]) Vuong-Brender, T.T.K., Suman, S.K., Labouesse, M. The apical ECM preserves embryonic integrity and distributes mechanical stress during morphogenesis. Development. 144 (23), 4336-4349. 2017. |
| Cable | Distrelec | 143-46-644 | Needed if selecting the solenoid from distrelec. Cable connecting the solenoid to the MOSFET. |
| Chlorotrimethyl silane | Sigma Aldrich | 386529-25ML | Silane for wafer passivation. |
| Cholesterol | Sigma Aldrich | C8667 | For S-Basal production. |
| Flyback Diode | Distrelec | 110-52-628 | Flyback diode protecting the microcontroller. |
| Hollow steel pin | Gonano Dosiertechnik | GGA7R23050 | 23G hollow steel pin connecting the 1/16" tubing to the device. |
| L Broth | NA | NA | Prepared in house following standard recipe. 10 g Bacto-tryptone, 5 g Bacto-yeast, 5 g NaCl, H2O to 1 litre, pH to 7.0 using 1 M NaOH |
| Long-term Imaging Device L1 | NA | NA | Long-term imaging device for L1 to early/mid L2 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L1-4 | NA | NA | Long-term imaging device for mid L1 to mid L4 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L2-A | NA | NA | Long-term imaging device for mid L2 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L3-A | NA | NA | Long-term imaging device for mid L3 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L4-A | NA | NA | Long-term imaging device for mid L4 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| M9 Buffer | NA | NA | Prepared in house following standard recipe. |
| MOSFET | Distrelec | 303-41-391 | Metal-oxide-semiconductor field-effect transistor, used to switch the 24VDC required for the solenoid. |
| NGM plates | NA | NA | Prepared in house following standard recipe. |
| Nylon Luer-Fitting | Fisher Scientific | 11776048 | Adapter from OD 6mm tubing to 23G blunt needle. |
| Optiprep | Sigma Aldrich | D1556 | Density matching liquid. |
| PDMS | Ameba | Elastosil RT601A/B | PDMS elastomer kit. |
| Pluronic F-127 | Sigma Aldrich | P2443 | Non-ionic surfactant. |
| Potassium dihydrogen phosphate | Sigma Aldrich | 1.37039 | For S-Basal production. |
| Potassium hydrogen phosphate | Sigma Aldrich | 1.05099 | For S-Basal production. |
| Power Supply 24VDC | Distrelec | 301-63-304 | 24VDC power supply. Select a power supply suitable for the solenoid selected. |
| Precision pressure regulator | Distrelec | 154-23-578 | Alternativ to above. Pressure regulator. |
| Pressure Gauge G1/8 | Distrelec | 154-23-643 | Pressure gauge attaches to the pressure regulator. |
| PU Tubing OD 6mm | Distrelec | 154-23-866 | Tubing connecting the pressure source and regulator, as well as regulator and solenoid valve. |
| Push-in fitting G1/8 to 6mm | Distrelec | 301-69-330 | Alternativ to above. 2x Push-in fitting attaches to the pressure regulator and connects to the 6mm tubing. |
| Push-in fitting M5 to 6 mm | Distrelec | 301-69-459 | 2x Push-in fitting attaches to the solenoid and the 6mm tubing. |
| S-Basal Buffer | NA | NA | Prepared in house following standard recipe. 5.85 g NaCl, 1 g K2HPO4, 6 g KH2PO4, 1 ml cholesterol (5 mg/ml in ethanol), H2O to 1 litre. Sterilize by autoclaving. |
| Sodium Chloride | Sigma Aldrich | S9625 | For L Broth and S-Basal production. |
| Sodium hydroxite (5M) | Sigma Aldrich | 567530 | Sodium hydroxide used when bleaching C. elegans (prepare solution at 5M concentration) |
| Sodium hypochlorite (5%) | Sigma Aldrich | 1.05614 | Sodium hypochlorite used when bleaching C. elegans (prepare solution at 5% concentration) |
| Strainer 10 µm | pluriSelect | 43-10010-40 | Alternative for bacteria food preparation, especially if smaller devices are used. |
| Strainer 5 µm | pluriSelect | 43-10005-40 | Strainer used to filter L1 larvae after overnight starvation and bacteria after completed food preparation. |
| SU-8 | Gersteltec | GM1050 | SU-8 for height from 1-10 µm. |
| SU-8 | Gersteltec | GM1060 | SU-8 for height from 5-30 µm. |
| SU-9 | Gersteltec | GM1070 | SU-8 for height from 15-200 µm. |
| Syringe 1 mL | Fisher Scientific | 11338763 | 1mL syringe. If using a different type ensure that the syringe body and plunger are stiff, such that they won't be deformed by the syringe pump. |
| Syringe Pump | WPI | Al1000-220 | Syringe pump (https://www.wpiinc.com/var-2300-aladdin-single-syringe-pump.html). |
| Tube 15 mL | Fisher Scientific | 50-809-220 | Tube used for worm bleaching and bacteria preparation. |
| Tube 2 mL | Fisher Scientific | NC1186931 | Tube used for worm preparation and bacteria preparation. |
| Tube 50 mL | Fisher Scientific | 50-465-232 | Tube used for bacteria preparation and growth. |
| Tweezer SMD | Brütsch Rüegg Werkzeuge | 448980 | Tweezers used to plug the 1/32" tubing into the device. |
| Tygon tubing 1/16" | Fisher Scientific | 642002 | Flexible 1/16" OD tubing connecting most components to the device. |
| Tygon tubing 1/32" | Fisher Scientific | 641900 | Flexible 1/32" OD tubing connecting the bacteria supply to the device. |
| UV KUB-3 | Kloe | NA | Mask aligner and UV exposure system. |
| Wafer | Siegert Wafer | 4P0/>1/525±25/SSP/TTV<10 | Silicon Wafer. |
| Waste Container | NA | NA | Prepared in house using a 2mL tube or a cryo vial and hollow steel pins. |
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır