Method Article
Визуализация C. elegans с высоким разрешением на всех личиночных стадиях
В этой статье
Резюме
Этот протокол описывает покадровую визуализацию C. elegans на основе микрофлюидики на протяжении всего постэмбрионального развития.
Аннотация
Caenorhabditis elegans стал одной из наиболее широко изученных и наиболее понятных животных моделей в биологии. Ключевыми для успеха C. elegans в качестве модельного организма являются три особенности: его инвариантная клеточная линия, прозрачность и генетическая податливость. Это делает его идеальным для проведения широкого спектра исследований на основе микроскопии непосредственно in vivo. Живые личинки и взрослые особи C. elegans часто нуждаются в иммобилизации во время получения изображения. Традиционные методы иммобилизации отрицательно влияют на развитие животных, особенно при покадровой съемке. В данной статье представлен подробный протокол настройки и работы нового метода микрофлюидной визуализации, который устраняет ограничения, связанные с традиционной иммобилизацией на основе агаровой прокладки и другими микрофлюидными стратегиями. Такой подход позволяет одновременно получать изображения в реальном времени на различных стадиях личинки с сохранением ориентации и идентичности червя с течением времени. Для достижения этой цели используется микрофлюидный массив каналов ловушки, геометрия которого точно спроектирована для поддержания стабильной ориентации червя при одновременном росте и линьке. Иммобилизация облегчается активным гидравлическим клапаном, который оказывает давление для фиксации червяков на покровном стекле только во время получения изображения. Такая конструкция позволяет получать изображения с высоким разрешением с минимальным влиянием на жизнеспособность червя или сроки его развития.
Введение
Визуализация C. elegans может быть выполнена несколькими способами в зависимости от области применения, желаемой пропускной способности и разрешения. Когда требуется высокое разрешение, в стандартном методе используются агаровые прокладки 1,2,3, простая конструкция из предметного стекла, агарозы и покровного стекла. Животные на этих горках обездвижены давлением, оказываемым покровным стеклом. Иммобилизация может быть дополнительно улучшена путем добавления обезболивающих агентов, например, левамизола или азида натрия 1,2, так что животные на агаровых подушечках остаются совершенно неподвижными и могут быть визуализированы с высоким разрешением, включаяразличные методы сверхвысокого разрешения. К сожалению, известно, что агаровые прокладки влияют на прогрессию развития, при этом сочетание высоких давлений и обезболивающих агентов замедляет развитие или вызывает полную остановку развития 4,5.
Помимо этих стандартных методов, в последние годы появилось несколько микрофлюидных методологий, каждая из которых имеет свои преимущества и недостатки или специализированные варианты использования 6,7,8,9,10,11,12,13,14,15,16,17,18,19. Например, Gritti et al.20 представили метод, при котором черви содержатся в больших камерах. Эмбрионы, помещенные в эти камеры, развиваются и перемещаются свободно, оставаясь в пределах обозначенной области интереса на микроскопе. Хотя в целом этот подход эффективен, он ограничен использованием ярких флуоресцентных маркеров. Совсем недавно Keil et al.21 предложили модифицированную версию этого метода, включающую встроенный гидравлический клапан для удержания животных во время получения изображения, тем самым устраняя некоторые ограничения исходного подхода. Однако, поскольку в обоих методах используются камеры большего размера, чем те, которые используются для пойманных червей, животные продолжают двигаться и вращаться на протяжении всего эксперимента. В результате отслеживание процессов развития становится сложной задачей и требует обширной постобработки изображений для коррекции движений животных.
Для устранения этих ограничений адаптирован подход, предложенный Berger et al.18 (рис. 1), при котором животные содержатся не в большой камере, а в канале ловушки, предназначенном для животных в пределах более короткого окна развития (до 2,5 личиночных стадий). В отличие от существующих микрофлюидных методов, этот подход сохраняет ориентацию и идентичность животного на протяжении всего эксперимента и позволяет получать изображения с высоким разрешением нескольких червей параллельно и на нескольких личиночных стадиях в одном устройстве.
Животные отлавливаются с помощью специализированной геометрии канала, где высота канала близка к толщине животного в начале эксперимента, что предотвращает вращение. Ширина и длина канала подбираются таким образом, чтобы животные могли двигаться и расти с течением времени, облегчая линьку и переход от одной личиночной стадии к другой. Распараллеливание достигается путем простого размещения нескольких каналов ловушек рядом друг с другом, так что несколько животных видны в одном поле зрения (FOV, рисунок 1A'), и до 41 животного могут быть изображены в одном устройстве (рисунок 1A). Животные на чипе постоянно получают высококонцентрированную бактериальную пищевую суспензию через канал низкой высоты, который в то же время помогает удерживать животных в конце массива каналов ловушки (шаг высоты, рисунок 1A, красный). Аналогично подходу, использованному Keil et al.21, реализован большой гидравлический клапан на кристалле, который можно раздувать во время получения изображения, прижимая животных к покровному стеклу, тем самым улучшая иммобилизацию животных (рис. 1B). Ограничение срабатывания гидравлического клапана только периодом получения изображения сводит к минимуму любое негативное влияние на развитие животных, обеспечивая надежное развитие на всех стадиях личинки. В отличие от методов, описанных Gritti et al.20 и Keil et al.21, животные не могут быть визуализированы на протяжении всего постэмбрионального развития в рамках одного и того же устройства. Вместо этого введены пять различных устройств, называемых L1, L1-4, L2-A, L3-A и L4-A, охватывающих всю стадию L1 и раннюю стадию L2, середину-позднюю стадию L1 до середины стадии L4, середину-конец L2 до юной взрослой жизни, середину-конец L3 до юного взрослого возраста и позднюю стадию L4 до юного взрослого возраста, соответственно (рисунок 1C). которые позволяют непрерывно визуализировать большие участки постэмбрионального развития. Этот подход принят из-за значительного увеличения размеров животных от L1 до взрослого возраста, так что канал, подходящий для животных L1, был бы слишком мал для взрослых особей, что приводило бы к остановке развития, а канал, подходящий взрослым особям, был бы слишком велик для L1, что приводило бы к чрезмерному движению, вращению и выходу животных из каналов ловушки.
С помощью этого подхода достигается надежная прогрессия развития различныхтканей18, например, постэмбриональное развитие гиподермы (стадия L1-L4), индукция судьбы клеток вульвы (стадия L2 и L3), морфогенез вульвы (от L3 до взрослоговозраста19) и инвазия якорных клеток. С момента своего появления эти устройства долговременной визуализации использовались для изучения различных процессов22,23, причем платформа даже сочеталась с такими методами, как микроскопия сверхвысокого разрешения AiryScan24, что позволило сделать множество открытий, которые ранее были невозможны.
Ниже в пошаговом протоколе представлены эксплуатационные аспекты этих устройств долговременной визуализации, в котором освещаются ожидаемые результаты и некоторые потенциальные проблемы при настройке системы.
протокол
Подробная информация о реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Изготовление устройств
ПРИМЕЧАНИЕ: Все устройства были изготовлены с использованием приведенного ниже протокола, однако устройства доступны непосредственно у авторов. Для каждого типа устройства изготавливается отдельная пластина, причем каждая пластина устройства изготавливается из двух слоев SU8 разной высоты (т.е. пищевого слоя и слоя ловушки). Клапанная пластина изготовлена на отдельной пластине, с одной высотой СУ-8, без этапов 1,3-1,6. Силаны токсичны и выделяют коррозионные пары. Поэтому этот этап необходимо выполнять в вытяжном шкафу. Для получения подробной информации о процедуре изготовления обратитесь к Berger et al.18.
- Очистите пластины с помощью воздушной плазмы.
- Отжмите первый слой SU8, затем выполните мягкую выпечку при температуре 95 °C.
- Экспонируйте первый слой, затем выпекайте при температуре 95 °C и проявите.
- Повторите плазменную очистку после проявления и сушки пластины.
- Отжмите второй слой SU8, после чего проведите мягкую выпечку при температуре 95 °C (при необходимости проведите первоначальную выпечку при температуре 65 °C).
- Выровняйте вторую маску по существующим объектам с помощью маркеров выравнивания по обе стороны от пластины, затем обнажите второй слой.
- После выпечки и проявите, затем выполните жесткую выпечку при температуре 200 °C.
- Обработайте пластину хлортриметилсиланом в течение не менее 2 ч.
- Приготовьте партию из 20 г предварительного полимера PDMS (Часть А) и тщательно перемешайте его с 1 г сшивающего агента (соотношение 20:1, Часть В) (см. Таблицу материалов).
- Дегазируйте в течение 10 минут или пока все пузырьки не исчезнут.
- Удалите 2 мл смеси PDMS и оставьте для шага 1.13.
- Добавьте еще 3 г сшивающего агента к оставшейся смеси PDMS и тщательно перемешайте (итоговое соотношение примерно 5:1).
- Используя партию PDMS 20:1, нанесите на пластину устройства отжим при 750 об/мин в течение 30 с.
- Поместите пластину клапана в алюминиевую чашку и отлите на нее PDMS 5:1. Дегазируйте пластину устройства в течение примерно 10 минут. После дегазации удалите оставшиеся пузырьки с помощью пипетки.
- Выпекайте слои клапана и устройства при температуре 70 °C в течение примерно 15-20 минут соответственно.
- Оцените отверждение устройств и слоев клапанов, осторожно прощупывая их наконечником для пипетки или пинцетом. Слой клапана должен быть твердым, в то время как слой устройства должен оставаться слегка липким.
- Отсоедините слой клапана и обрежьте его до необходимого размера с помощью скальпеля или лезвия бритвы.
- Пробейте отверстие для доступа в канал клапана (манометр 20).
- Расположите пластину устройства под стереомикроскопом, оснащенным верхней подсветкой.
- Осторожно поместите деталь PDMS, содержащую слой клапана, на пластину устройства.
- Точно выровняйте клапан и функции устройства, обеспечив удаление всего захваченного воздуха между слоями.
- Собранное устройство переложите в духовку и выпекайте при температуре 70 °C в течение ночи.
- Отсоедините устройство от клеевой пластины.
- Пробейте все оставшиеся отверстия для доступа (калибр 20).
- Приклейте PDMS к покровному стеклу с помощью воздушной плазмы, затем поместите склеенное устройство в печь при температуре 70 °C на несколько часов.
2. Подготовка червей
ПРИМЕЧАНИЕ: В этом разделе описывается приготовление червей методом отбеливания, которое позволяет получить большое количество (сотни) животных. Возможны и другие методы синхронизации, такие как ручная комплектация, но, как правило, они более трудоемкие и трудоемкие. Все черви, используемые в протоколе, поддерживаются в соответствии со стандартными протоколами при температуре 20 °C и на планшетах NGM, засеянных E. coli OP50.
- Начиная с тарелок с большим количеством гравидных животных.
- Смойте животных с тарелки с помощью буфера М9.
- Добавьте 5% NaClO и 5 М NaOH в суспензию червя (200 мкл/100 мкл на каждый 1 мл червячной суспензии).
- Аккуратно встряхивайте отбеливающую смесь, пока животные не начнут разваливаться на части (~10 минут).
- Центрифуга отбеливает смесь при комнатной температуре, 1300 х г в течение 1 мин.
- Удалите надосадочную жидкость с помощью пипетки и добавьте равное количество свежего буфера M9.
- Снова центрифугируйте при комнатной температуре, 1300 х г в течение 1 минуты.
- Удалите надосадочную жидкость и перенесите гранулированных червей в пробирку объемом 15 мл с 5 мл свежего буфера M9.
- Встряхните в течение ночи при температуре 20 °C.
- Пропустите суспензию червя через клеточное сетчатое фильтр размером 10 мкм.
- Центрифугировать червячную суспензию при 1300 × г в течение 1 мин при комнатной температуре.
- Выбросьте надосадочную жидкость и снова суспендируйте червей в буфере M9, равном объеме.
- Снова центрифугируйте червячную смесь при 1300 × г в течение 1 минуты при комнатной температуре.
- Удалите надосадочную жидкость и перенесите червей на планшеты NGM. Если нужны личинки L1, используйте их немедленно.
- Как только черви достигнут желаемой стадии развития, смойте их с пластины с помощью свежего S-базального буфера, отфильтрованного через фильтр 0,2 мкм.
- Дайте червям отсадиться под действием силы тяжести или гранулируйте их центрифугированием при концентрации 750 × г в течение 1 минуты при комнатной температуре.
- Выбросьте надосадочную жидкость и добавьте равный объем свежего S-базального буфера.
- Повторите этапы отстаивания или центрифугирования (шаги 2.16 и 2.17)
- Удалите надосадочную жидкость и добавьте равный объем свежего S-базального буфера.
- Выполните этапы осаждения или центрифугирования в последний раз.
- Удалите большую часть надосадочной жидкости.
- Держите червей в пробирке до начала эксперимента.
3. Подготовка бактерий
ПРИМЕЧАНИЕ: На чипе можно использовать различные штаммы бактерий (например, OP50, NA22, HT114 и т.д.). Отрегулируйте пропорцию градиента плотности среды, добавляемой в пищевую смесь, чтобы компенсировать разницу в плотности. Все буферы пропускаются через фильтр 0,2 мкм для удаления твердых частиц.
- Приготовьте 40 мл LBroth, либо в 2 x 20 мл в центрифужных пробирках, стерильных колбах Эрленмейера и т. д.
- Инокулируйте LB бактериями, собранными со складской пластины.
- Выращивайте бактерии во время встряхивания в течение ночи при температуре 37 °C (~16 ч) (наружный диаметр600 = 1,9).
- Центрифугируйте бактерии при 3000 х г в течение 10 минут.
- Удалите надосадочную жидкость и добавьте в каждую пробирку по 2 мл свежего S-базального буфера. Соедините все трубки.
- Механически суспендируйте бактерии с помощью пипетки.
- Центрифугируйте бактерии при давлении 3000 х г в течение 5 минут.
- Удалите надосадочную жидкость и снова добавьте 2 мл свежего S-базального буфера.
- Механически суспендируйте бактерии с помощью пипетки.
- Центрифугируйте бактерии при давлении 3000 х г в течение 5 минут.
- Удалите как можно больше надосадочной жидкости и добавьте 1 мл свежего S-базального буфера перед механическим восстановлением всех бактерий.
- Соедините 0,60 мл градиентной среды, 0,38 мл S-базала + 1% по весу Pluronic F-127 (неионогенный триблок-сополимер, представленный здесь как PF) с 1 мл суспензии бактерий OP50, или 0,65 мл градиентной среды, 0,33 мл S-Basal + 1% по весу PF с 1 мл суспензии бактерий NA22 или HT114.
- Тщательно перемешайте приготовленную пищу с помощью вихревого миксера.
- Процедите пищу через клеточное ситечко размером 5 мкм или 10 мкм. Использование фильтра меньшего размера особенно рекомендуется при использовании небольших устройств, например, устройств L1.
ПРИМЕЧАНИЕ: Продукты можно хранить при комнатной температуре до 2 дней.
4. Подготовка стружки
ПРИМЕЧАНИЕ: На рисунке 2 приведен схематический обзор устройства, трубок и соединений. Все буферы пропускаются через фильтр 0,2 мкм для удаления пыли. Стальной штифт, упомянутый в следующих шагах, относится к короткой полой трубке, которая используется для сопряжения трубки с большим наружным диаметром (1/16 дюйма) с отверстиями малого диаметра, изготовленными в устройстве PDMS. Эти стальные штифты просто вставляются во внутренний диаметр трубки, а затем вставляются в материал PDMS, эффективно соединяя их.
- Начните с наполнения шприца деионизированной (DI) водой.
- Прикрепите иглу 23 G и длинный кусок трубки 1/16 дюйма с полым стальным штифтом (изогнутым под углом 90°) на конце. Трубка должна быть достаточно длинной, чтобы простираться от соленоида до предметного столика микроскопа.
- Заполните трубку деионизионной водой из шприца и подсоедините ее к входу клапана, вставив стальной штифт в пробитое отверстие (рис. 2A, J).
- Извлеките шприц и иглу, затем прикрепите трубку к соленоиду (рис. 2A, J).
- Используя программное обеспечение для обработки изображений, включите соленоид и нагнетайте давление в устройстве в течение нескольких минут, чтобы вытеснить весь воздух из клапана. Проверьте завершение, визуально проверив интерфейс воздух-вода на микросхеме, который должен казаться темным и исчезать в материале PDMS (рис. 2B).
- Выключите соленоид (рисунок 2C).
- Наполните шприц объемом 1 мл отфильтрованным раствором бактерий (достаточно ~0,5 мл пищи).
- Прикрепите к игле иглу 30 G и длинный кусок трубки 1/32 дюйма.
- Нажмите на поршень, чтобы заполнить иглу и прикрепленную трубку, убедившись, что в шприце или трубке не осталось воздуха.
- Вставьте трубку 1/32 дюйма непосредственно во входное отверстие микрофлюидного устройства с помощью пинцета, чтобы предотвратить повреждение трубки (рекомендуется использовать пинцет SMD) (Рисунок 2D, K).
- Поместите шприц на шприцевой насос (рисунок 2D).
- Нажмите на поршень шприца с помощью винта с накатанной головкой сзади, чтобы наполнить устройство жидкостью. Капля жидкости должна появиться на каждом разомкнутом соединении (рисунок 2D, стрелка).
- Заблокируйте входное и выходное отверстия червяка герметичным стальным штифтом (стальным штифтом с коротким куском трубки 1/16 дюйма, прикрепленным и герметизированным путем обжига) (Рисунок 2E, L).
- Приложите дополнительное давление с помощью винта с накатанной головкой, чтобы удалить оставшийся воздух из устройства (рис. 2E, стрелка).
- Снимите заблокированный штифт на выходе и прикрепите контейнер для отходов (изготовленный из криовиальной или микроцентрифужной трубки, с двумя стальными штифтами, воткнутыми через крышку и закрепленными клеем). Контейнер для отходов соединяется с помощью короткого отрезка трубки 1/16 дюйма, один конец которого прикреплен к контейнеру, а другой конец соединен с полым стальным штифтом (изогнутым на 90 °) (Рисунок 2F, G, M).
- Нажмите на шприц, чтобы убедиться, что контейнер для отходов правильно подключен и что в системе нет засоров. Для этого протолкните небольшое количество жидкости через систему (поверните винт с накатанной головкой на шприцевом насосе) до тех пор, пока жидкость не потечет по отработанной трубке (рисунок 2G, стрелка).
- Снимите второй заблокированный стальной штифт.
- Нажимайте на шприц до тех пор, пока на входе червя не появится небольшая капля жидкости (рисунок 2H, N).
- Прикрепите более длинный кусок трубки 1/16 дюйма (15-20 см) к шприцу объемом 1 мл, заполненному S-базальным буфером, с помощью иглы 23 G (рис. 2H, N).
- Прикрепите прямой штифт из стали 23 G к другому концу трубки.
- Заполните иглу и трубку буфером от шприца, следя за тем, чтобы в шприце или трубке не оставалось воздуха.
- Вставьте стальной штифт на конце трубки в трубку, содержащую червяки.
- Протолкните небольшое количество жидкости через трубку, убедившись, что в ней не осталось воздуха.
- Втяните червей в трубку, но не втягивайте их в шприц.
- Нажмите на шприц, подключенный к червям, до тех пор, пока на стальном штифте не появится небольшая капля жидкости (рисунок 2H).
- Вставьте стальной штифт во впускное отверстие червяка (Рисунок 2I).
ПРИМЕЧАНИЕ: Подготовка устройства может быть выполнена до окончательной подготовки червей и оставлена на микроскопе до тех пор, пока черви не будут готовы.
5. Загрузка и визуализация червяка
- Поместите устройство на микроскоп с малым увеличением (5x или 10x) или на микроскоп для препарирования.
- Определите используемый в данный момент блок устройства и найдите червячное входное отверстие с помощью светлого освещения.
- Расположите устройство таким образом, чтобы входное отверстие было видно с одной стороны поля зрения, а задняя часть входного отверстия канала ловушки была видна с другой стороны.
- Осторожно надавите на поршень шприца с червями. Жидкость будет заметно вытекать из входного отверстия через массив каналов в сторону выхода. Присутствие бактерий и разница в показателе преломления из-за добавления градиента плотности среды делают поток жидкости очевидным.
- Убедитесь, что черви появляются из входного отверстия и направляются к задней части массива каналов.
- Осторожно подтолкните животных к массиву каналов. Как только животное повернется лицом к каналу, протолкните его в канал и повторите для других животных.
ПРИМЕЧАНИЕ: Животные должны быть ориентированы головой к выходу, чтобы иметь легкий доступ к пище. Их можно ориентировать, толкая и тяну поршень и плавая. - После того, как достаточное количество животных будет поймано, поместите шприц, все еще прикрепленный к входному отверстию червя, на предметный столик микроскопа, где он будет оставаться на протяжении всего эксперимента. Может потребоваться кратковременное отсоединение червячной трубки от шприца, чтобы ослабить нарастающее давление, а затем осторожно прикрепить ее к тупой игле.
- Если нагрузка производилась на диссекционный микроскоп, перенесите прибор в микроскоп для визуализации. Трубка может оставаться прикрепленной к чипу, а шприц подсоединяется к насосу.
- Включите шприцевой насос и запустите его с заданной скоростью 1 мкл/ч для 0,5 мкл, увеличьте скорость на 100 мкл/ч для 0,5 мкл и уменьшите ее до 1 мкл/ч. Этот цикл автоматически повторяется в течение всего эксперимента. Информацию о том, как запрограммировать насос, можно найти в руководстве пользователя оборудования.
- Поместите устройство на предметный столик микроскопа и убедитесь, что оно надежно закреплено (рекомендации по монтажным механизмам можно найти на рисунке 3A).
- Если загрузка не производилась на микроскопе, определите интересующую единицу устройства при малом увеличении.
- Переключитесь на нужное увеличение изображения.
ПРИМЕЧАНИЕ: Устройства совместимы со всеми типами объективов. - Определите животных и области интереса в массиве каналов ловушек и настройте желаемые условия визуализации.
- Изображение в желаемых условиях визуализации с помощью встроенного клапана, приводимого в действие через соленоид за 10 с до получения изображения, таким образом, животные удерживаются на месте.
ПРИМЕЧАНИЕ: Приведение в действие встроенного клапана приведет к удлинению и сплющиванию животных, что, возможно, потребует корректировки области визуализации (ROI).
6. Подготовка к настройке
ПРИМЕЧАНИЕ: Этот раздел относится к первоначальной подготовке механизма управления устройством и не требует повторения перед каждым экспериментом. Обратитесь к рисунку 3B,C. Поскольку многие соленоиды требуют более высокого напряжения, соленоид, скорее всего, будет подключен не напрямую к микроконтроллеру, а через реле или МОП-транзистор (см. рис. 3C).
- Определите источник сжатого воздуха (например, настенная система подачи или газовый баллон).
- Подключите источник давления к подходящему регулятору давления (диапазон давления 0-2 бар) с помощью трубки диаметром 6 мм (настенный источник) или прикрепите подходящий регулятор непосредственно к газовому баллону.
- Подсоедините регулятор давления к входу электромагнитного клапана (трубка 6 мм, см. рисунок 3B).
- Расположите соленоид как можно ближе к предметному столику микроскопа (рекомендуется на расстоянии ~0,5-1 м от предметного столика, хотя при необходимости возможны и большие расстояния).
- Подключите электромагнитный клапан электронным способом к выбранному контроллеру. Доступны различные варианты, такие как управление с помощью отдельной платы микроконтроллера (например, Arduino) или существующей платы DAq.
7. Очистка и хранение
- После завершения эксперимента извлеките прибор из микроскопа.
- Удалите жидкость для погружения. Погружное масло можно удалить органическими растворителями (например, ацетоном, метанолом и т.д.).
- Поместите устройство на ровную поверхность и отсоедините все трубки, кроме трубки клапана. Чтобы безопасно отсоединить каждую трубку, нажмите на ближайшую к ней PDMS и осторожно потяните. Не поднимайте и не сгибайте устройство, так как это может привести к разбиванию защитного стекла.
- Очистите поверхность PDMS 70% этанолом.
- Храните устройство при комнатной температуре с прикрепленной трубкой клапана.
ПРИМЕЧАНИЕ: Устройство можно использовать повторно до тех пор, пока не будут использованы все блоки, вероятно, без необходимости заправки трубки клапана. Тем не менее, вода в трубке клапана будет испаряться в течение длительного периода времени, и в конечном итоге ее может потребоваться повторное наполнение.
Результаты
Конструкция и габариты устройства
Пять отдельных устройств были разработаны для размещения всех четырех личиночных стадий. Эти устройства обозначаются следующим образом: L1 — для личинок L1, загруженных сразу после вылупления и визуализированных до стадии L2; L1-L4, способный удерживать личинки от средней до поздней стадии L1 до ранней-средней стадии L4; L2-A, подходит для животных примерно от середины стадии L2 до молодого взрослого возраста; L3-A, для животных примерно от середины стадии L3 до молодого взрослого возраста; и L4-A, который вмещает животных примерно от поздней стадии L4 до молодого взрослого возраста.
Все устройства имеют одну и ту же основную схему, состоящую из червячного входа, 1 (или 2 в случае обмена среды) бактериального пищевого отверстия и общего выпускного отверстия для отходов. Между входной и выходной частями размещен массив из 41 параллельного канала ловушки, при этом входная и выходная стороны эффективно разделены каналом подачи пищи меньшей высоты (рис. 1A, A'). Размеры канала были выбраны значительно длиннее и шире, чем у червей, загруженных в начале эксперимента, с длиной/шириной 400/15 мкм для устройств L1, 575/22 мкм для устройств L1-L4, 800/27 мкм для устройств L2-A, 900/30 мкм для устройств L3-A и 1000/65 мкм для устройств L4-A (Дополнительный файл 1, Дополнительный файл 2, Дополнительный файл 3, Дополнительный файл 4 и Дополнительный файл 5).
Длина канала была выбрана в соответствии с размерами, которых достигли животные к концу эксперимента, в то время как ширина была выбрана таким образом, чтобы черви в начале эксперимента занимали примерно две трети ширины канала. Такая конструкция обеспечивает достаточное пространство для роста и движения во время линьки, предотвращая при этом вращение червей. В отличие от ширины, в начале эксперимента высота канала была близка к толщине червей: 8 мкм для ранних личинок L1, 12 мкм для личинок среднего/позднего L1, 15 мкм для средних личинок L2, 17,5 мкм для средних личинок L3 и 22,5 мкм для поздних личинок L4, соответствующих L1, L1-L4, L2-A, L3-A, и устройства L4-A соответственно. Уменьшенная высота канала в сочетании с тщательно подобранной шириной (при сохранении соотношения высоты к ширине 0,5-0,6) гарантирует, что черви останутся в фиксированной ориентации. Примечательно, что при достаточно малой высоте канала все черви последовательно располагаются в желаемой боковой ориентации.
Канал подачи пищи был изготовлен на высоте 3 мкм для L1 и 5 мкм для всех остальных устройств, что гарантировало, что бактерии могут легко добраться до животных, не покидая животных из каналов ловушек. Во всех устройствах используется один и тот же слой подачи пищи (Дополнительный файл 6) и один и тот же слой клапанов (Дополнительный файл 7). Обратите внимание, что слой клапана изготавливается на отдельной пластине на высоте 20 мкм и размещается на слое устройства только во время изготовления устройства PDMS (шаг 1.21).
Эти специфические для стадии геометрические ограничения, необходимые для предотвращения вращения червей или переворачивания с головы на хвост, требуют использования трех различных типов устройств для учета всех личиночных стадий. Если бы личинки L1 были помещены в канал, размер которого предназначен для молодых взрослых животных, они не оставались бы стабильными и быстро покинули бы канал ловушки.
Подготовка C. elegans
Если не указано иное, червей содержали в соответствии со стандартными протоколами25 на планшетах NGM, засеянных E. coli OP50 при температуре 20 °C. В разделе о подготовке червей явно описывается подготовка синхронизированной популяции червей, используемая в эксперименте по визуализации. Синхронизацию проводили по стандартным протоколам с использованием отбеливателя гипохлорита натрия26, модифицированного дополнительной ступенью фильтрации для удаления мусора и невылупившихся животных после ночного голодания. Цель состоит в том, чтобы получить много синхронизированных личинок L1, которые затем засеиваются на планшеты NGM или загружаются непосредственно в устройство визуализации. Другие методы синхронизации, такие как ручной сбор или контролируемая закладка яиц, также подходят. Тем не менее, они более трудоемки в выращивании достаточного количества животных (рекомендуется 200 особей на одно условие).
Как только черви достигнут желаемой стадии, их можно аккуратно смыть с пластины NGM с помощью чистого S-базала (в идеале отфильтрованного через фильтр 0,2 мкм). Цель состоит в том, чтобы собрать как можно больше животных, не собирая бактерии или мусор с тарелки. Животных собирают в небольшую центрифужную пробирку и промывают 2-3 раза свежим S-базальным буфером, окончательно удаляя как можно больше жидкости. Затем животные отбираются непосредственно из концентрированного объема. Если концентрация животных слишком низкая, загрузка будет происходить медленнее, что потребует большего объема жидкости для протекания через устройство и увеличит риск блокировки каналов ловушек мусором.
Приготовление бактериальной пищи
Рост бактерий осуществляется по стандартным протоколам, при этом исходная концентрация бактерий (наружный диаметр600 = 1,9) увеличивается примерно в 40 раз в S-базальном буфере (фильтруемом через фильтр 0,2 мкм) и смешивается со средой градиента плотности и S-базальным буфером, содержащим PF (фильтруется через фильтр 0,2 мкм). Ожидаемым результатом этого технологического этапа является получение очень плотной бактериальной суспензии и предотвращение осаждения бактерий во время эксперимента по визуализации. Высокая плотность необходима для кормления животных на чипе при низких скоростях потока, используемых при доставке среды (1 μл/ч). Цель среды градиента плотности — предотвратить выпадение бактерий в осадок во время эксперимента, а цель PF — предотвратить прилипание бактерий к стенкам канала. Как среда с градиентом плотности, так и PF не токсичны и не влияют на жизнеспособность животных.
Если в эксперименте используется другой тип бактерий, необходимо определить необходимую концентрацию среды с градиентом плотности. Это может быть достигнуто путем смешивания суспензии бактерий с различными количествами среды с последующим центрифугированием. Если концентрация градиента плотности слишком низкая, бактерии будут осаждаться; Если концентрация слишком высокая, бактерии будут плавать. После того, как подходящая концентрация найдена, рекомендуется проверить результат, оставив смесь бактерий при комнатной температуре примерно на 48 часов, чтобы показать, как будет вести себя пища на протяжении всего эксперимента. После эксперимента также рекомендуется проверить шприц, через который подаются бактерии, и убедиться, что бактерии не оседают и не плавают. Разница в объеме, возникающая в результате добавления различных количеств Optiprep, может быть компенсирована добавлением большего или меньшего количества S-базала + 1% по весу PF. Аналогичным образом, в суспензию могут быть добавлены дополнительные среды или соединения (например, ауксин), и дополнительный объем вычитается из объема S-базала + 1% по весу PF.
Подготовка к настройке
Установите систему подачи давления как можно ближе к микроскопу, чтобы с ней можно было удобно работать. Все участки трубки, особенно трубка 1/16 дюйма, соединяющаяся с чипом, должны оставаться короткими (менее 0,5 м для трубки с наружным диаметром 1/16 дюйма) (рис. 2 и рис. 3B). Как указано в предыдущем разделе, компьютерное управление встроенным клапаном может быть достигнуто различными способами. Это должно быть возможно в любом программном обеспечении микроскопа (протестированном в Micro-Manager, Metamorph, NIS и ZenBlue) либо путем подключения специальной платы микроконтроллера (например, Arduino), либо путем подключения системы к существующей плате сбора данных (DAq) с помощью цифрового выхода. Затем выбранный выход платы должен быть сконфигурирован как затвор, который включается за 10 секунд до получения изображения или приводится в действие вручную во время настройки устройства. Как упоминалось ранее, не рекомендуется подключать соленоид напрямую к микроконтроллеру; вместо этого можно подключать с помощью МОП-транзистора или релейного переключателя, чтобы соленоид и микроконтроллер оставались электронно изолированными (рис. 3C).
Как и в случае с трубками подачи давления, все остальные участки трубок до стружки (наружный диаметр 1/16 дюйма и внешний диаметр 1/32 дюйма) должны быть как можно короче. Держите червячные и отходные трубки (1/16 дюйма OD) ниже 2,5 см и 20 см соответственно. Трубка подачи бактерий (1/32 дюйма OD) должна быть достаточно длинной, чтобы ее можно было подключить от шприцевого насоса к устройству после установки на предметный столик микроскопа. Тем не менее, настоятельно рекомендуется максимально сократить это время и разместить шприцевой насос рядом со столиком микроскопа, например, рядом со столиком, с помощью полки или на верхней части корпуса инкубатора. Любая длина трубки, добавленной в систему, увеличит обратное давление, ощущаемое при загрузке животных в устройство, и увеличит общее давление на пойманных животных.
Работа устройства
На этом этапе все трубки могут быть подготовлены и подключены к соответствующей тупой игле, стальному штифту и шприцу (начало шага протокола 4). Как упоминалось выше, длина трубки должна быть как можно короче (Рисунок 2J-N). Важно следить за тем, чтобы в шприцах или трубках не оставалось пузырьков воздуха, так как они будут мешать нагрузке животного и могут привести к побегу животных из канала ловушки во время эксперимента. Пузырьки воздуха можно удалить из шприца несколькими различными способами, например, наполнив шприц, перевернув его и осторожно встряхнув так, чтобы пузырьки воздуха поднялись к верхней части шприца (переворачивать шприц не рекомендуется, так как это может привести к попаданию дополнительных пузырьков воздуха). В качестве альтернативы шприц можно наполнить, вставив его в буфер и быстро перемещая поршень вверх и вниз, чтобы быстро удалить большую часть пузырьков.
После того, как шприц заполнен и не содержит пузырьков, тупая игла и трубка присоединяются и заполняются буфером. Особую осторожность следует также проявлять при наполнении шприца, так как воздух может легко попасть в пластиковую часть тупой иглы. Если воздух застрял, замените иглу. В качестве альтернативы, предварительное заполнение иглы жидкостью, например, с помощью пипетки, может облегчить проблему.
Когда все компоненты на месте, трубку можно прикрепить к устройству, начиная с трубки, соединяющей соленоид и внутричиповый клапан (рис. 2A-C,J). Эта трубка изначально заполняется деионизированной водой, а система находится под давлением для удаления всего воздуха из тупикового канала клапана. PDMS газопроницаема; таким образом, повышенное давление будет выталкивать весь воздух из канала в PDMS, оставляя канал клапана заполненным водой. Этот процесс можно проследить под микроскопом, убедившись, что весь канал клапана заполнен. После заполнения клапана можно подключить подачу бактерий, а также наполнить устройство и создать давление, заблокировав все открытые входы/выпуски (рис. 2D,E,K,L). Воздух вытесняется, и за процессом можно наблюдать с помощью микроскопа. После того, как весь воздух будет вытеснен, бактерии должны равномерно заполнить устройство. Блокирующие штифты удаляются, и подсоединяется трубка для сбора отходов (рис. 2F, G, M). В этот момент небольшое количество жидкости должно протекать через устройство в трубку для сбора отходов, гарантируя, что все соединения с трубкой открыты. Это можно визуально убедиться перед подключением трубки к сборной трубке. Если жидкость не поступает в трубку для сбора отходов, скорее всего, она заблокирована. Это привело бы к повышению давления во время эксперимента, что негативно сказалось бы на пойманных животных. Если трубка или ее соединения заблокированы, извлеките ее и очистите все соединения с помощью иглы или промойте их с помощью шприца, наполненного водой.
Наконец, можно подсоединить червячную трубку (рис. 2H, N). Черви забираются из центрифужной трубки, просто всасывая их в трубку, прикрепленную к шприцу, заполненному S-Basal. Животных следует тянуть только в трубку, а не в шприц. После этого трубку можно подключить к устройству. Перед этим из устройства и червячной трубки выталкивается небольшое количество жидкости, а две капли соединяются таким образом, чтобы воздух не проталкивался внутрь устройства во время загрузки.
Загрузка червяка
С помощью всех подключений животных можно загружать, нажимая и тяну за поршень шприца-червяка. Животные будут смываться из входного отверстия в сторону массива каналов-ловушек; Тем не менее, они естественным образом будут плыть против течения, которое они испытывают. Поэтому животных необходимо переориентировать головой к каналу ловушки. Правильная ориентация животного достигается путем нажатия и потягивания поршня, что дает животным время повернуться в желаемой ориентации. Это может быть достигнуто почти на основе одного червя, но потребует некоторой практики. Как только животные правильно ориентируются, их можно втолкнуть в канал ловушки и скользить до конца канала, где их останавливает ступенька высоты (рис. 1A, B). Если животные не могут войти в канал, значит, они слишком велики для выбранного устройства и их необходимо сфотографировать в более крупном устройстве. Если животные могут поворачиваться или поворачиваться при помещении в канал ловушки, они слишком молоды, и необходимо использовать устройство меньшего размера, или оставить животных расти еще на несколько часов.
Важно, что животные в разных каналах не будут влиять друг на друга. Таким образом, неправильно загруженные животные не повлияют на правильно загруженных, однако у них не будет достаточного доступа к пище, поэтому они будут расти медленнее или замедлять развитие.
Если животные нагружаются в нужном возрасте, то должно происходить минимальное движение вдоль продольной оси канала. Тем не менее, животные могут свободно покачиваться (рисунок 1B) и начинают питаться в течение нескольких минут. Если животные демонстрируют значительное движение вдоль продольной оси канала, это, вероятно, вызвано повышением давления в устройстве или пузырьком воздуха, застрявшим где-то в трубке, тупой игле или шприце. Нарастающее давление внутри устройства можно снять, аккуратно отсоединив червячную трубку от тупой иглы и аккуратно прикрепив ее обратно. Если пузырьки воздуха остались в системе, несмотря на вышеупомянутые шаги и меры предосторожности, может потребоваться удалить весь шприц с червями и заменить его на новый без пузырьков воздуха. Пузырьки воздуха в системе функционируют как пружины, которые сжимаются во время загрузки и медленно высвобождаются после загрузки животных. Поток, создаваемый расширением пузырьков воздуха, может привести к нестабильности системы, выталкивая животных из каналов ловушки.
Получение и проявка изображений на кристалле
Наконец, как только животные загружены, можно приступать к получению изображений. В принципе, устройства совместимы с большинством методов визуализации, светлым полем, эпифлуоресценцией 18,19,22,23 (рис. 4), конфокальным диском 19 и даже модальностями сверхвысокого разрешения (AiryScan24), поскольку вся визуализация выполняется через покровное стекло толщиной 170 мкм. Следовательно, микрофлюидное устройство практически не влияет на достижимое качество изображения на кристалле. Тем не менее, подходящие условия визуализации, которые не влияют на жизнеспособность животных, должны быть выбраны независимо от метода визуализации. Высокая интенсивность возбуждения легко приведет к обесцвечиванию флуорофоров и остановке развития из-за высокой энергии и тепла, передаваемых образцу. Рекомендуется использовать короткое время экспозиции (~10 мс) и низкую интенсивность возбуждения (менее 10% от типичного источника флуоресцентного светодиода), что позволяет получить пригодное для использования изображение при контрастности min = 0 и max = 1000 (при использовании 16-битной камеры) (рис. 4).
Репрезентативные данные, полученные с помощью устройств L1, L1-4 и L2-A, показаны на рисунке 4. Демонстрация развития эпителиальных клеток C. elegans от вылупления/ночного голодания до средней личиночной стадии L2 (Рисунок 4A, Дополнительный фильм 1), индукции клеток-предшественников вульвы 1° и их последующее деление от поздней L1 до ранней личиночной стадии L4 (Рисунок 4B, Дополнительный фильм 2) и, наконец, формирование вульвы C. elegans от ранней личиночной стадии L3 до эверсии при переходе во взрослую жизнь (Рисунок 4C., дополнительный фильм 3).
Каждое приложение сопровождается количественной оценкой различных метрик времени разработки. Изображения на рисунках 4A,B показаны без какой-либо примененной постобработки, т.е. без применения деконволюции или регистрации изображений. Изображения на рисунке 4C, с другой стороны, были деконволюционированыи зарегистрированы, что подчеркивает улучшение качества изображения, возможное при использовании устройств долговременной визуализации.
Во-первых, определение начала деления каждого шва клеток у животных, показанных на рисунке 4A (полный курс см. в дополнительном фильме 1), что указывает на последовательное и своевременное деление всех клеток у 12 животных (рисунок 4D). С помощью шовных клеток также оценивали общее время развития на всех четырех личиночных стадиях и обнаружили, что все деления швовых клеток были завершены через 12,0 ч ± 1,7 ч (среднее ± SD) у L1 (n = 22), 10,2 ч ± 1,0 ч у L2 (n = 27), 10,9 ч ± 1,4 ч у L3 (n = 27) и 14,6 ч ± 2,2 ч у L4 животных (n = 19). Эти данные согласуются с литературными значениями 2,28, а также со значениями, измеренными у животных, выращенных в тарелках, показали среднее время развития для L1 15 ч (n = 21), L2 10 ч (n = 15), L3 12 ч (n = 21) и L4 12,5 ч (n = 61) (Адаптировано из Berger et al.18). Наблюдаемые небольшие задержки, вероятно, являются следствием получения изображений и вызванной ею фототоксичности или увеличения содержания в изоляции после того, как животные выросли и у них появится канал ловушки.
Во-вторых, мы наблюдали за ростом животных на всех стадиях L2 и L3, количественно оценивая длину гонад как отличный индикатор прогресса в развитии (Рисунок 4E, см. Дополнительный фильм 2 для полного курса). Как и в случае с делением клеток шва, точная длина гонад могла быть измерена благодаря прямой ориентации животного, и был обнаружен постоянный рост гонад у всех изображенных животных (n = 19). Первое деление VPC в этих экспериментах наблюдалось через 14,26 ч ± 2,47 ч после начала эксперимента (~30 ч после посева), а второе — через 1,46 ч ± 0,13 ч (n = 19). Эти данные хорошо согласуются с литературными значениями, установленными на планшетах NGM29,30. Ойлинг и Амброс30 обнаружили, что первое деление произошло примерно через 29 часов, а второе — примерно через 3 часа.
Наконец, было количественно определено время, за которое достигаются определенные стадии развития вульвы (рис. 4F, см. дополнительный фильм 3 для полного курса), в частности, оценивалось время, необходимое для перехода от инвагинации (L4.0, t1) к средней стадии L4 (L4.5, t4) в соответствии с подстадиями, определенными Mok et al.31. Среднее время протекания между t1-t2 составило 3,8 ч ± 1,2 ч, между t2-t3 — 3,5 ч ± 1,2 ч, а между t3-t4 — 2,8 ч ± 1,6 ч (n = 7), что указывает на примерно линейную прогрессию развития. Как и при анализе сроков развития, эти времена, особенно t1-t2, кажутся немного отстающими по сравнению с опубликованными литературными значениями (t1-t2: 0,7 ч, t2-t3: 3 ч, t3-t4: 2,3 ч31), возможно, из-за узких размеров устройства, замедляющих линьку. Тем не менее, сроки развития у животных остаются очень постоянными, и все они успешно переходят во взрослую жизнь.
Компенсация движения животных и дрейфа микроскопа
Движение животного в одном Z-стеке обычно минимально при срабатывании встроенного клапана. Тем не менее, не ожидается, что животные будут оставаться полностью неподвижными. Остаточный джиттер, наблюдаемый в одном стеке, может быть компенсирован за счет увеличения давления для приведения в действие встроенного клапана, уменьшения используемого времени воздействия или увеличения выбранного Z-шага для ускорения захвата стека. Время захвата стека может быть дополнительно сокращено за счет использования пьезопривода Z, что приводит к значительно более быстрому Z-движению по сравнению с обычным приводом фокусировки микроскопа, или за счет использования многополосных фильтров (например, GFP/mCherry), чтобы можно было получать отдельные цвета без необходимости трудоемкой замены фильтров. Для справки, в приведенных примерах (Рисунок 4 и Дополнительный фильм 1, Дополнительный фильм 2 и Дополнительный фильм 3) время захвата стека обычно составляло от 3 до 8 секунд. При необходимости остаточное движение также может быть устранено с помощью различных методов регистрации изображений.
Ожидается, что животные на чипе будут неуклонно расти. Таким образом, интересующие нас объекты неизбежно будут смещаться вдоль продольной оси канала (рис. 4A, B, дополнительный фильм 1 и дополнительный фильм 2). Поэтому рекомендуется устанавливать поле зрения визуализации таким образом, чтобы интересующая функция могла перерасти в поле зрения и не была потеряна в ходе эксперимента (рис. 1B и рис. 4A, B). В качестве альтернативы животные могут быть изображены в нескольких смежных зонах обзора, охватывающих все тело животного. Однако это может привести к дополнительной фототоксичности и стрессу. Как и в случае с Z-motion, различные процедуры регистрации могут компенсировать движение животного в канале с течением времени. Если животные демонстрируют хаотичное движение вдоль продольной оси, более обширное, чем то, что можно отнести к росту, это, скорее всего, вызвано воздушным пузырем.
Каждое устройство долговременной визуализации содержит шесть отдельных устройств визуализации, каждый из которых может быть использован для отдельного эксперимента. В каждом блоке может разместиться до 41 животного, а каналы ловушек расположены таким образом, что можно сфотографировать несколько животных в одном поле зрения. Кроме того, в одном устройстве или устройстве можно визуализировать несколько полей зрения. Как и в случае со всеми образцами микроскопа, движение по поверхности образца может привести к смещению фокуса из-за потери иммерсионной среды. Этот дрейф можно компенсировать с помощью иммерсионного масла с более низкой вязкостью или с помощью различных методов автофокусировки. Тем не менее, некоторые аппаратные системы автофокусировки могут не работать при использовании с микрофлюидным устройством PDMS, поскольку они используют переход от стекла к водной среде в качестве точки отсчета (сторона образца покровного стекла). Большая часть поля зрения заполнена силиконом внутри устройства, который имеет более высокий показатель преломления, чем вода; Хотя это не влияет на качество изображения, это может негативно сказаться на автофокусе. При визуализации одного поля зрения дрейф фокуса, наблюдаемый внутри устройства, минимален (менее 2 мкм). Если наблюдается чрезмерный дрейф фокуса, это может быть результатом термической нестабильности системы микроскопа или окружающей среды, чрезмерного движения XY, приобретающего несколько углов обзора, или неправильного монтажа устройства на микроскопе (предлагаемые механизмы крепления см. на рисунке 3A ).
Аналогичным образом, чрезмерное смещение XY и неправильный монтаж также могут привести к смещению XY. Поскольку прибор и объектив микроскопа соединены между собой с помощью иммерсионной жидкости, быстрые движения по осям X, Y или Z могут привести к приложению усилий к устройству. Если устройства правильно смонтированы и на них не действуют внешние силы, они исключительно стабильны с минимальным дрейфом фокуса и отсутствием дрейфа по оси XY.
Наконец, если определенные параметры системы не подходят, микрофлюидные устройства PDMS могут отрицательно повлиять на развитие животных. Жизнеспособность зависит от чрезмерного давления клапана, высокой фототоксичности в результате высокой интенсивности возбуждения, длительного времени воздействия или коротких временных интервалов между захватом дымовой трубы. Особенно при первом использовании этой системы настоятельно рекомендуется оценить жизнеспособность животных с помощью яркого флуоресцентного маркера или светлопольной визуализации, гарантируя, что условия визуализации не влияют на рост животного. После того как животные начнут стабильно развиваться, параметры визуализации можно будет изменять по мере необходимости.
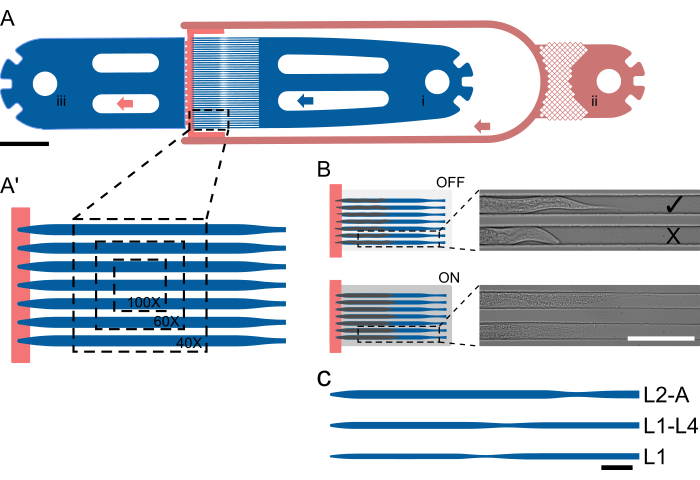
Рисунок 1: Схема устройства и схема работы. (A) Обзор устройства, показывающий одно устройство с входным отверстием для червяка (i), входным отверстием для бактериальной пищи (ii) и общим выходным отверстием (iii). (А') Увеличенное изображение канала ловушки в устройстве L2-A, показывающее количество червей, видимых в одном поле зрения при различных увеличениях (40x-100x). (B) Принцип действия встроенного клапана. При выключенном положении высота канала выбирается таким образом, чтобы животные могли комфортно разместиться в канале ловушки. При включении высота канала уменьшается, прижимая животное к покровному стеклу, тем самым обратимо обездвиживая пойманных животных. На изображениях показаны два пойманных в ловушку животных на чипе с полученным при выключенном клапане на чипе и при включенном клапане, при этом животные заметно выпрямляются и удлиняются под давлением. Верхнее животное нагружено правильно и обращено к источнику пищи ( ), а нижнее — к противоположной (X). (С-С") Настройка схематического устройства. (C) Доступные размеры устройств. L1 подходит для животных от L1 до середины L2 стадии, L1-4 — для животных от средней L2 до середины L4 личиночной стадии, а L2-A — для животных от средней личиночной стадии L2 до взрослой особи. Масштабные линейки: (A) 1000 μm, (B) 100 μm и (C) 50 μm. Рисунок частично адаптирован из Berger et al.18. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
), а нижнее — к противоположной (X). (С-С") Настройка схематического устройства. (C) Доступные размеры устройств. L1 подходит для животных от L1 до середины L2 стадии, L1-4 — для животных от средней L2 до середины L4 личиночной стадии, а L2-A — для животных от средней личиночной стадии L2 до взрослой особи. Масштабные линейки: (A) 1000 μm, (B) 100 μm и (C) 50 μm. Рисунок частично адаптирован из Berger et al.18. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
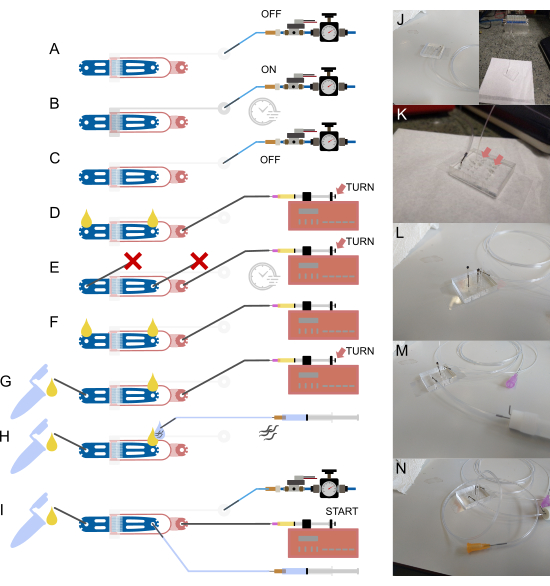
Рисунок 2: Настройка устройства и подключения. (А-И) Схематический обзор процесса настройки. (A) Подключение водонаполненной трубки 1/16" к входу клапана с помощью полого стального штифта (серого цвета), а другой конец должен быть прикреплен к системе подачи давления. (B) Заполнение встроенного гидравлического клапана с помощью автономного соленоида и создание давления в устройстве в течение нескольких минут. (C) Отключение давления перед переходом к следующим шагам. (D) Подключение шприца, содержащего бактериальную пищу, к входному отверстию для пищевых продуктов с помощью трубки 1/32" и тупой иглы 30 G, с последующим заполнением устройства до тех пор, пока жидкость не появится на обоих открытых соединениях. (E) Герметизация входного отверстия червяка и выпускного отверстия для отходов стальными штифтами, заблокированными куском трубки 1/16 дюйма ( ) и нагнетание давления в устройстве с помощью пищевого шприца и насоса (с помощью регулировки с помощью винта с накатанной головкой), поддерживая давление в течение нескольких минут. (F) Снятие заглушек с (E), обеспечение образования капель жидкости при каждом разомкнутом соединении. (G) Соединение контейнера для отходов с помощью короткого отрезка трубки 1/16 дюйма и полого стального штифта. (H) Прикрепление шприца, заполненного буфером, к устройству с помощью полого стального штифта и тупой иглы 23G. Черви втягиваются в трубку перед ее подключением к устройству, что предотвращает попадание воздуха за счет выравнивания капель жидкости на входе и конце трубки. (I) Окончательная настройка с установленными соединениями всех устройств. J) Изображение устройства с трубкой клапана, подсоединенной к впускному отверстию и соленоиду (на заднем плане), соответствующему пункту (А-С). (K) Увеличенный вид устройства с прикрепленной трубкой подачи пищи, показывающий две капли жидкости (стрелки) на входе червяка и выходе отходов, соответствующие (D). (L) Увеличенный вид устройства с прикрепленной трубкой подачи пищи и заблокированным входом червяка и выпускным отверстием для отходов, что соответствует пункту (E). (M) Увеличенный вид устройства с прикрепленными трубками для отходов и контейнером, соответствующий (G). (N) Окончательная сборка со всеми соединениями трубок, соответствующими пункту (I). Частично адаптировано из Berger et al.18. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
) и нагнетание давления в устройстве с помощью пищевого шприца и насоса (с помощью регулировки с помощью винта с накатанной головкой), поддерживая давление в течение нескольких минут. (F) Снятие заглушек с (E), обеспечение образования капель жидкости при каждом разомкнутом соединении. (G) Соединение контейнера для отходов с помощью короткого отрезка трубки 1/16 дюйма и полого стального штифта. (H) Прикрепление шприца, заполненного буфером, к устройству с помощью полого стального штифта и тупой иглы 23G. Черви втягиваются в трубку перед ее подключением к устройству, что предотвращает попадание воздуха за счет выравнивания капель жидкости на входе и конце трубки. (I) Окончательная настройка с установленными соединениями всех устройств. J) Изображение устройства с трубкой клапана, подсоединенной к впускному отверстию и соленоиду (на заднем плане), соответствующему пункту (А-С). (K) Увеличенный вид устройства с прикрепленной трубкой подачи пищи, показывающий две капли жидкости (стрелки) на входе червяка и выходе отходов, соответствующие (D). (L) Увеличенный вид устройства с прикрепленной трубкой подачи пищи и заблокированным входом червяка и выпускным отверстием для отходов, что соответствует пункту (E). (M) Увеличенный вид устройства с прикрепленными трубками для отходов и контейнером, соответствующий (G). (N) Окончательная сборка со всеми соединениями трубок, соответствующими пункту (I). Частично адаптировано из Berger et al.18. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
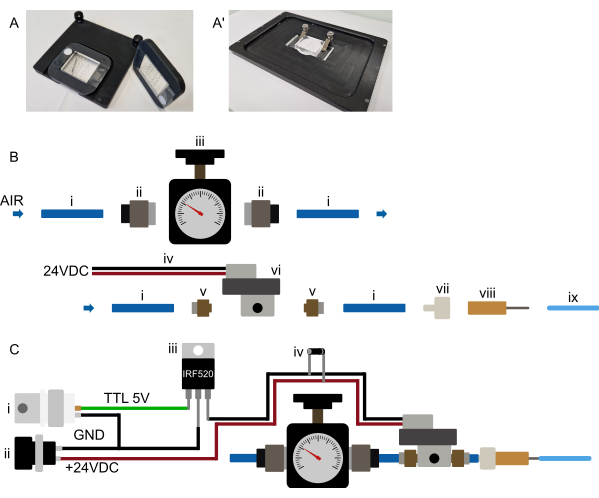
Рисунок 3: Настройка оборудования. (А-А') Предлагаемый монтаж устройства. (A) Возможное крепление для вертикального микроскопа. Устройства крепятся к прямоугольной, напечатанной на 3D-принтере раме с большим центральным вырезом. Две небольшие полоски двустороннего скотча первоначально размещаются на покровном стекле по обе стороны от части устройства PDMS. Затем напечатанная на 3D-принтере рама помещается над устройством таким образом, что часть PDMS протыкается через вырез, а рама плотно прижимается к двустороннему скоту, постоянно прикрепляя устройство к раме. Таким образом, рамка надежно удерживает прибор и сама удерживается на предметном столике микроскопа с помощью магнитов, встроенных в рамку и предметный вкладыш. Это обеспечивает стабильное крепление прибора и предотвращает столкновение объектива микроскопа с любым монтажным оборудованием. Все трубки проложены к передней части устройства. (А') Возможно крепление для инвертированного микроскопа. Комплект зажимов плотно удерживает устройство. Убедитесь, что зажимы прижимают устройство к вставке сцены, чтобы предотвратить любое смещение XY во время работы. (B) Вид деталей напорной системы. i) Полиуретановая трубка с наружным диаметром 6 мм, подсоединенная к источнику давления. (ii) Вставной адаптер G1/8-6 мм, соединяющий трубку (i) с регулятором давления (iii). Затем трубка подключается к соленоиду (vi) через вставной адаптер M5-6 мм (v), и, наконец, трубка подключается к соединителю люэр-фиксатор к заусенице (vii) и тупой игле 23 G (viii) к трубке наружным диаметром 1/16 дюйма, соединенной с микрофлюидным устройством. (C) Схематический обзор электронных соединений и собранной системы давления. (i) Пусковой сигнал TTL (+3,3-5 В), генерируемый Arduino, DAq-картой или любым другим микроконтроллером, вместе с подходящим источником питания (ii, 24 В постоянного тока) подключается к MOSFET (iii) и электронным соединениям соленоида, как показано на схеме, с помощью обратного диода (iv), подключенного через соединения питания соленоидов. После того, как сигнал TTL посылается от микроконтроллера к затвору МОП-транзистора, +24 В постоянного тока подается на нормально замкнутый соленоид, и интегрированный гидравлический клапан надувается. После того, как сигнал TTL снят, давление сбрасывается, и встроенный гидравлический клапан сдувается. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
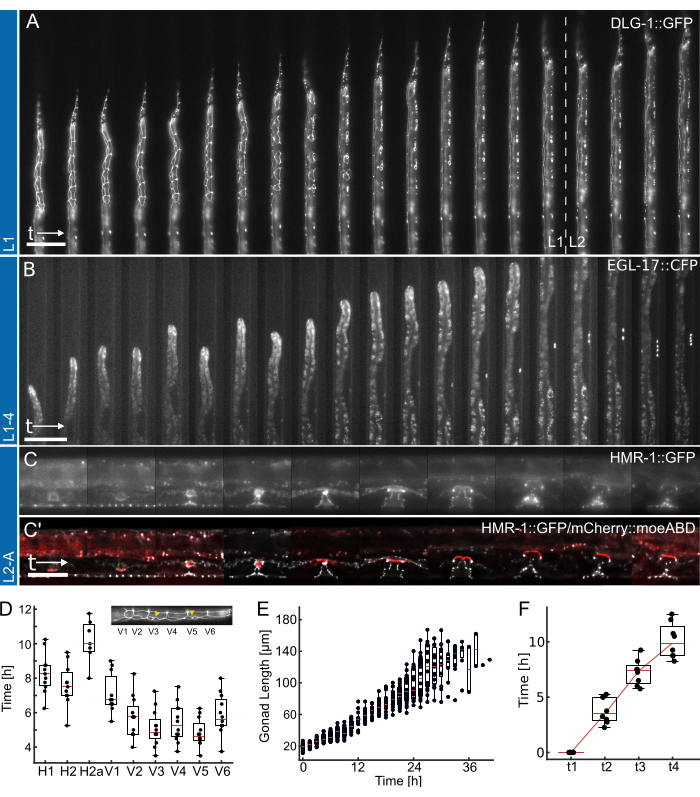
Рисунок 4: Репрезентативные результаты. (A) Животное с образцом эпителиального соединения (ML2615, dlg-1(mc103[dlg-1::gfp])), растущее от ночного голодания до ранней/средней личиночной стадии L2, с использованием устройства L1. Видны клетки делящегося шва, а также Р-клетки, которые мигрируют и делятся к поздней личиночной стадии L1. (B) Выращивание животных от поздней личиночной стадии L1 до ранней стадии L4 с использованием устройства L1-4. Visible — это маркер для клетки-предшественника вульвы (VPC) с 1° судьбой (AH1187, arIs92[egl-17::cfp]), при этом одна клетка видна в начале эксперимента, за которой последовали два раунда видимых делений клеток на личиночной стадии L3. (C) Животные, растущие от поздней личиночной стадии L2 до ранней взрослой жизни, с использованием устройства L2-A. Виден создатель эпителиального соединения (AH5786, hmr-1(cp21[hmr-1::gfp + LoxP])), выделяющий развивающуюся ткань вульвы, образующую отчетливые тороидальные структуры, и комбинированное изображение с маркером якорной клетки матки (AC) (AH5786, qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)]), которая проникает в ткань вульвы к концу личинковой стадии L3, соединяя ткани. Для всех экспериментов (A-C) поле зрения изначально настраивается таким образом, чтобы была видна только часть животных. По мере продвижения эксперимента животное будет заполнять все большую часть канала с элементами, смещающимися вдоль оси канала в результате роста животного. (D) Время, в которое отдельные клеточные деления начинают делиться на стадии личинки L1 (n = 12). Вставка выделяет идентичность клеток шва (H1-V6) вдоль передне-задней оси тела. (E) Показывает рост гонад со временем для животных на рисунке 4B (n = 19). (F) Показывает время, необходимое для достижения 4 различных временных точек развития в морфогенезе вульвы (t1-t4), что указывает на последовательный переход для всех изображенных животных (n = 7). Масштабные линейки бывают (A,B) 50 μм и (C) 25 μм. Смотрите Дополнительный фильм 1, Дополнительный фильм 2 и Дополнительный фильм 3 для очного курса. Ящичковые диаграммы показывают медианные значения (красные линии) с верхним и нижним квартилями и столбцами, обозначающими экстремумы распределения, исключая выбросы. Рисунок адаптирован из Berger et al.18. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный фильм 1: Одиночная личинка C. elegans , развивающаяся от ночного голодания до ранней стадии L2. Отображаются проецируемые эпифлуоресцентные изображения максимальной интенсивности (общая высота проекции 1,5 мкм) в необработанном формате. Видны все события деления и слияния клеток шва, происходящие на указанной стадии (вверху). Признаки обозначаются с помощью маркера DLG-1::GFP (эпителиальное соединение) с интервалом в 15 минут в общей сложности 25 часов. Фильм повторно использован из Berger et al.18. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Дополнительный фильм 2: Одиночная личинка, развивающаяся от поздней стадии L1 до ранней стадии L4, экспрессирующая маркер EGL-17::CFP (1°-fated vulval precursor cell (VPC))). В начале L2 (~400 мин) флуоресценция EGL-17::CFP проявляется в P6.p, интенсивность которой постоянно увеличивается. Во время L3 P6.p претерпевает два последовательных раунда деления, образуя 1-клеточные, 2-клеточные и 4-клеточные стадии развития вульвы. Изображения демонстрируются с интервалом в 30 минут в общей сложности в течение 34 часов. Фильм повторно использован из Berger et al.18. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Дополнительный фильм 3: Вид сверху: Z-проекция развивающейся вульвы от стадии L3 до перехода L4/взрослая особь. Вид снизу: X-проекция той же вульвы во времени. Оба вида показывают первоначальное деление ДПЦ, за которым следует инвагинация, образование и увеличение тороидов, за которым следует коллапс во время выворота. Эпифлуоресцентные изображения отображаются после обрезки, деконволюции, регистрации и проекции. Особенности обрисовываются с помощью маркера HMR-1::GFP (гиподерма и VPCs) и маркера mCherry::moeABD (обозначающего AC). Фильм повторно использован из Berger et al.18. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Дополнительный файл 1: Файл САПР для устройства L1. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Файл САПР для устройства L1-4. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 3: Файл САПР для устройства L2-A. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 4: Файл САПР для устройства L3-A. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 5: Файл САПР для устройства L4-A. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 6: Файл CAD для структуры распределения продуктов питания. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 7: CAD-файл для слоя клапанов. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В данной статье описана работа уникальной микрофлюидной платформы долговременной визуализации, которая подходит для визуализации с высоким разрешением и отслеживания различных процессов развития C. elegans на всех четырех личиночных стадиях до ранней взрослойжизни. Возможность отслеживать процессы развития с течением времени in vivo, используя этот и другие методы визуализации, стала незаменимой во многих областях исследований C. elegans ипозволила получить ответы на ранее недоступные вопросы.
В отличие от традиционных методов визуализации с использованием агаровых подушечек и ранее опубликованных стратегий долгосрочной визуализации на основе микрофлюидики, этот подход сохраняет идентичность и ориентацию червя на протяжении всего эксперимента, что позволяет отслеживать сложные процессы развития с течением времени. Независимо от стадии развития, животные ограничены одним из 41 параллельных каналов ловушки, каждый из которых подключен к встроенному источнику пищи и закрыт большим гидравлическим клапаном. Иммобилизация всех попавших червей происходит за счет надувания гидравлического клапана, прижимая червяков к покровному стеклу только во время получения изображения. Высокая пропускная способность визуализации возможна благодаря узко расположенному массиву каналов ловушек, в котором несколько животных видны в одном поле зрения. Устройства долговременной визуализации совместимы с большинством микроскопов, не требуя минимального дополнительного оборудования (менее 1000 долларов США) и не внося изменений в существующее оборудование. Эксплуатация устройств намеренно проста, поэтому все пользователи должны быстро освоить ее, следуя вышеуказанному протоколу и изложенным результатам.
Вкратце, животные могут быть изображены на чипе на протяжении до 2,5 личиночных стадий (рис. 1C). Животные изначально синхронизируются и либо напрямую загружаются на кристалл (устройство L1), либо засеваются на планшет NGM до желаемой стадии развития (устройства L1-L4 и L2-A). Животных на чипе кормят с использованием высококонцентрированной бактериальной суспензии и иммобилизуют с помощью встроенного гидравлического клапана, приводимого в действие программным обеспечением для визуализации (рис. 1B). Животных перемещают в каналы ловушки с помощью шприца, осторожно ориентируя животных головой к источнику пищи и, наконец, отлавливают животных в конце канала ловушки (рис. 1А и рис. 2). Необходимо следить за тем, чтобы воздух не задерживался в шприцах, тупых иглах и трубках, так как пузырьки воздуха могут легко нарушить положение животного. Устройства совместимы с большинством методов визуализации 18,19,24, так как материал PDMS является высокопрозрачным, нефлуоресцентным и герметизирован на тонком покровном стекле (рисунок 4, дополнительный фильм 1, дополнительный фильм 2 и дополнительный фильм 3). Тем не менее, необходимо соблюдать осторожность при выборе условий визуализации, так как длительное время экспозиции и высокая интенсивность возбуждения могут легко повлиять на жизнеспособность животных и привести к фотообесцвечиванию.
В дополнение к представленному варианту данного метода визуализации возможны и уже доступны несколько модификаций протокола. Наиболее простой модификацией является замена стандартных штаммов бактерий, например, бактериями, экспрессирующими РНК-интерференцию18 или бактериями с другой пищевойценностью32. Штаммы бактерий можно легко заменить, регулируя содержание Optiprep с учетом различий в плотности. Аналогичным образом, в бактериальную пищу может быть добавлено любое количество соединений, например, ауксин, питательные вещества или низкомолекулярные лекарственные соединения, и их действие наблюдается непосредственно in vivo, без необходимости внесения каких-либо изменений в протокол. В частности, было разработано устройство для обмена средами для индуцированной ауксин-индуцированной деградации белка или любого применения, которое требует временного или обратимого воздействия путем добавления входного отверстия для пищи в компоновку устройства без изменения геометрии или операции. Дополнительное входное отверстие позволяет легко переключаться между двумя различными условиями, например, ауксин и отсутствие ауксина, прикрепленными к устройству таким же образом, как показано здесь для одного источника пищи, и результирующие изменения наблюдаются непосредственно. Также были разработаны варианты устройств, в которых гидравлический клапан не является общим для всех блоков на устройстве, а разделен для каждого блока, так что в одном устройстве можно визуализировать несколько условий и экспериментировать по отдельности, снижая потенциально вредные последствия длительного времени срабатывания и захвата клапана. Наконец, в дополнение к оригинальным вариантам устройств, описанным в Berger et al.18, были разработаны два новых варианта устройства, L3-A и L4-A (представленные здесь), позволяющие визуализировать от середины L3 или середины стадии L4 до взрослого возраста. Цель этих модификаций состоит в том, чтобы отсрочить время начала эксперимента на более позднюю личиночную стадию, чтобы более крупные животные могли быть загружены в приложения, где более ранние стадии развития не представляют интереса.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих или финансовых интересов.
Благодарности
Мы хотели бы поблагодарить сотрудников лаборатории Hajnal за критическое обсуждение и комментарии к рукописи. Мы также благодарны Генетическому центру C. elegans CGC, финансируемому Управлением программ исследовательской инфраструктуры NIH (P40 OD010440). Кроме того, мы хотели бы выразить признательность членам лаборатории Галли (Институт Хубрехта), лаборатории Конрадта (Университетский колледж Лондона) и лаборатории ван ден Хойвеля (Утрехтский университет) за ценный вклад в представленный протокол. Эта работа была поддержана грантами Швейцарского национального научного фонда No 31003A-166580 для AH, Швейцарской онкологической лиги No 4377-02-2018 для AH, а также финансированием ETH Zürich для AdM.
Материалы
| Name | Company | Catalog Number | Comments |
| 3/2 solenoid valve | Distrelec | 154-22-898 and 154-22-899 | Alternative to above. Solenoid valve connecting the pressure regulator to the on-chip valve. |
| Arduino | Distrelec | 301-01-956 | Optional microcontroller depending on the selected controller and interface. |
| Bacto-Tryptone | Thermo Fisher Scientific | 211705 | For L Broth production. |
| Bacto-Yeast | Thermo Fisher Scientific | 212750 | For L Broth production. |
| Blunt needle 23G | Gonano Dosiertechnik | GGA723050 | Blunt needle connecting the 1/16" tubing to a syringe. |
| Blunt needle 30G | Gonano Dosiertechnik | IG-TE730050 | Blunt needle connecting the 1/32" tubing to a syringe. |
| C. elegans Construct 1 | NA | NA | AH5786 LGI: hmr-1(cp21[hmr-1::gfp + LoxP]) Marston, D.J. et al. MRCK-1 drives apical constriction in C. elegans by linking developmental patterning to force generation. Curr. Biol. 26 (16), 2079-2089. 2016. |
| C. elegans Construct 2 | NA | NA | AH1187 LGII: arIs92[egl-17::cfp] Yoo, A.S., Bais, C., Greenwald, I. Crosstalk between the EGFR and LIN-12/Notch pathways in C. elegans vulval development. Science. 303 (5658), 663-666. 2004. |
| C. elegans Construct 3 | NA | NA | AH5786 LGV: qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)] Ziel, J.W., Hagedorn, E.J., Audhya, A., Sherwood, D.R. UNC-6 (netrin) orients the invasive membrane of the anchor cell in C. elegans. Nat. Cell Biol., 11 (2), 183-189. 2009. |
| C. elegans Construct 4 | NA | NA | ML2615 LGX: dlg-1(mc103[dlg-1::gfp]) Vuong-Brender, T.T.K., Suman, S.K., Labouesse, M. The apical ECM preserves embryonic integrity and distributes mechanical stress during morphogenesis. Development. 144 (23), 4336-4349. 2017. |
| Cable | Distrelec | 143-46-644 | Needed if selecting the solenoid from distrelec. Cable connecting the solenoid to the MOSFET. |
| Chlorotrimethyl silane | Sigma Aldrich | 386529-25ML | Silane for wafer passivation. |
| Cholesterol | Sigma Aldrich | C8667 | For S-Basal production. |
| Flyback Diode | Distrelec | 110-52-628 | Flyback diode protecting the microcontroller. |
| Hollow steel pin | Gonano Dosiertechnik | GGA7R23050 | 23G hollow steel pin connecting the 1/16" tubing to the device. |
| L Broth | NA | NA | Prepared in house following standard recipe. 10 g Bacto-tryptone, 5 g Bacto-yeast, 5 g NaCl, H2O to 1 litre, pH to 7.0 using 1 M NaOH |
| Long-term Imaging Device L1 | NA | NA | Long-term imaging device for L1 to early/mid L2 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L1-4 | NA | NA | Long-term imaging device for mid L1 to mid L4 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L2-A | NA | NA | Long-term imaging device for mid L2 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L3-A | NA | NA | Long-term imaging device for mid L3 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L4-A | NA | NA | Long-term imaging device for mid L4 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| M9 Buffer | NA | NA | Prepared in house following standard recipe. |
| MOSFET | Distrelec | 303-41-391 | Metal-oxide-semiconductor field-effect transistor, used to switch the 24VDC required for the solenoid. |
| NGM plates | NA | NA | Prepared in house following standard recipe. |
| Nylon Luer-Fitting | Fisher Scientific | 11776048 | Adapter from OD 6mm tubing to 23G blunt needle. |
| Optiprep | Sigma Aldrich | D1556 | Density matching liquid. |
| PDMS | Ameba | Elastosil RT601A/B | PDMS elastomer kit. |
| Pluronic F-127 | Sigma Aldrich | P2443 | Non-ionic surfactant. |
| Potassium dihydrogen phosphate | Sigma Aldrich | 1.37039 | For S-Basal production. |
| Potassium hydrogen phosphate | Sigma Aldrich | 1.05099 | For S-Basal production. |
| Power Supply 24VDC | Distrelec | 301-63-304 | 24VDC power supply. Select a power supply suitable for the solenoid selected. |
| Precision pressure regulator | Distrelec | 154-23-578 | Alternativ to above. Pressure regulator. |
| Pressure Gauge G1/8 | Distrelec | 154-23-643 | Pressure gauge attaches to the pressure regulator. |
| PU Tubing OD 6mm | Distrelec | 154-23-866 | Tubing connecting the pressure source and regulator, as well as regulator and solenoid valve. |
| Push-in fitting G1/8 to 6mm | Distrelec | 301-69-330 | Alternativ to above. 2x Push-in fitting attaches to the pressure regulator and connects to the 6mm tubing. |
| Push-in fitting M5 to 6 mm | Distrelec | 301-69-459 | 2x Push-in fitting attaches to the solenoid and the 6mm tubing. |
| S-Basal Buffer | NA | NA | Prepared in house following standard recipe. 5.85 g NaCl, 1 g K2HPO4, 6 g KH2PO4, 1 ml cholesterol (5 mg/ml in ethanol), H2O to 1 litre. Sterilize by autoclaving. |
| Sodium Chloride | Sigma Aldrich | S9625 | For L Broth and S-Basal production. |
| Sodium hydroxite (5M) | Sigma Aldrich | 567530 | Sodium hydroxide used when bleaching C. elegans (prepare solution at 5M concentration) |
| Sodium hypochlorite (5%) | Sigma Aldrich | 1.05614 | Sodium hypochlorite used when bleaching C. elegans (prepare solution at 5% concentration) |
| Strainer 10 µm | pluriSelect | 43-10010-40 | Alternative for bacteria food preparation, especially if smaller devices are used. |
| Strainer 5 µm | pluriSelect | 43-10005-40 | Strainer used to filter L1 larvae after overnight starvation and bacteria after completed food preparation. |
| SU-8 | Gersteltec | GM1050 | SU-8 for height from 1-10 µm. |
| SU-8 | Gersteltec | GM1060 | SU-8 for height from 5-30 µm. |
| SU-9 | Gersteltec | GM1070 | SU-8 for height from 15-200 µm. |
| Syringe 1 mL | Fisher Scientific | 11338763 | 1mL syringe. If using a different type ensure that the syringe body and plunger are stiff, such that they won't be deformed by the syringe pump. |
| Syringe Pump | WPI | Al1000-220 | Syringe pump (https://www.wpiinc.com/var-2300-aladdin-single-syringe-pump.html). |
| Tube 15 mL | Fisher Scientific | 50-809-220 | Tube used for worm bleaching and bacteria preparation. |
| Tube 2 mL | Fisher Scientific | NC1186931 | Tube used for worm preparation and bacteria preparation. |
| Tube 50 mL | Fisher Scientific | 50-465-232 | Tube used for bacteria preparation and growth. |
| Tweezer SMD | Brütsch Rüegg Werkzeuge | 448980 | Tweezers used to plug the 1/32" tubing into the device. |
| Tygon tubing 1/16" | Fisher Scientific | 642002 | Flexible 1/16" OD tubing connecting most components to the device. |
| Tygon tubing 1/32" | Fisher Scientific | 641900 | Flexible 1/32" OD tubing connecting the bacteria supply to the device. |
| UV KUB-3 | Kloe | NA | Mask aligner and UV exposure system. |
| Wafer | Siegert Wafer | 4P0/>1/525±25/SSP/TTV<10 | Silicon Wafer. |
| Waste Container | NA | NA | Prepared in house using a 2mL tube or a cryo vial and hollow steel pins. |
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены