Method Article
تطوير نهج قائم على الموائع الدقيقة للتحقيق في ميكانيكا البوليمرات الدقيقة
In This Article
Summary
يوضح هذا البروتوكول بالتفصيل تصميم وتصنيع جهاز ميكروفيليديك مناسب للتحقيق في ميكانيكا البوليمرات الأنابيب الدقيقة. يتيح توليف التصنيع الدقيق والتحكم الآلي في التدفق وتقنيات النمذجة الحسابية نظاما مرنا مناسبا بشكل مثالي لاستكشاف الهيكل الخلوي الخلوي في المختبر.
Abstract
في هذا البروتوكول ، نصف تصميم وتصنيع جهاز موائع دقيقة تم تطويره للتحقيق في ميكانيكا البوليمر الأنابيب الدقيقة. يستخدم التصميم الفوائد الجوهرية للأجهزة الموائع الدقيقة القائمة على Polydimethylsiloxane (PDMS) ويقدم العديد من الميزات لتمكين نهج تجريبي قوي وقابل للتخصيص عالي الإنتاجية. يشتمل الجهاز المطور على قدرات محاصرة الفقاعات الزائدة عن الحاجة لمنع حدوث فقاعات الهواء الضارة. علاوة على ذلك ، يتفاعل الجهاز مع نظام التحكم الآلي في التدفق لتقليل التدخل اليدوي وتمكين التحليلات عالية الإنتاجية. يتم استخدام برنامج المحاكاة التجارية لتطوير وفهم نقل السوائل بشكل أفضل باستخدام هذا النظام. أخيرا ، نظهر القدرة على إجراء تجارب متعددة في وقت واحد داخل جهاز واحد من خلال تنمية امتدادات الأنابيب الدقيقة مع ملصقات فلورية مميزة في أقسام مختلفة من الجهاز. بشكل عام ، يمكن استخدام نظام تدفق الموائع الدقيقة هذا لاستكشاف ميكانيكا البوليمرات الدقيقة ويوفر تحسينات في التصميم التجريبي لدراسات الأنابيب الدقيقة الأوسع في المختبر . يتيح توليف التصنيع الدقيق والتحكم الآلي في التدفق وأساليب النمذجة الحسابية نظاما مرنا مناسبا بشكل مثالي لاستكشاف الهيكل الخلوي الخلوي في المختبر.
Introduction
تتيح الموائع الدقيقة التحكم الدقيق في أحجام السوائل الصغيرة ، وغالبا ما تكون أقل من ميكرولتر واحد ، من خلال التصميم المعقد وتصنيع قنوات تدفق السوائل1،2. يؤدي الحجم الصغير لأجهزة الموائع الدقيقة إلى ظهور ظواهر هندسية فريدة. وبالتحديد ، رقم رينولدز - وهو مقياس بلا أبعاد للنسبة بين القوى بالقصور الذاتي والقوى اللزجة في تدفق السوائل - صغير ، وعادة ما يكون بترتيب O (10) أو أقل في الموائع الدقيقة ، مما يؤكد أهمية القوى اللزجة في أجهزة الموائع الدقيقة. بالإضافة إلى ذلك ، يظهر رقم Péclet ، الذي يقارن النقل الحراري بالنقل المنتشر ، أن النقل الحراري لا يكاد يذكر بشكل عام في الموائع الدقيقة3،4،5. يعد نظام التدفق الصفحي المدفوع بالانتشار في الموائع الدقيقة مفيدا ، لأنه يدعم التجارب المتوازية على جهاز واحد من خلال الحفاظ على تدرجات السوائل الدقيقة.
يظل الطباعة الحجرية الضوئية هو الطريقة الأساسية لتصنيع أجهزة الموائع الدقيقة6،7،8. باختصار ، تتضمن هذه العملية إنشاء قالب محفور "رئيسي" لتصميم الموائع الدقيقة (الشكل 1). يتم تحضير ركيزة حساسة للضوء ، ويعرض قناع ضوئي لتصميم الموائع الدقيقة بشكل انتقائي مناطق مقاومة للضوء للأشعة فوق البنفسجية. تعمل طرق النقش اللاحقة على تطوير الركيزة ، مما ينتج عنه ارتياح للتصميم. غالبا ما يتم صب بولي ثنائي ميثيل سيلوكسان (PDMS) ومعالجته على السيد. ثم تتم إزالة PDMS المعالج ، والذي يعتمد السمات السلبية للتصميم ، من السيد وربطه بغطاء زجاجي. تستغرق عملية التصنيع بأكملها عادة من 1-2 أيام ، مما يتيح تكرارات التصميم السريعة وإنتاج أجهزة متعددة. تتوفر مراجعات مفصلة للطباعة الحجرية الناعمة وعمليات التصنيع الدقيق في مراجع أخرى1،2،3،10،11،12،13.
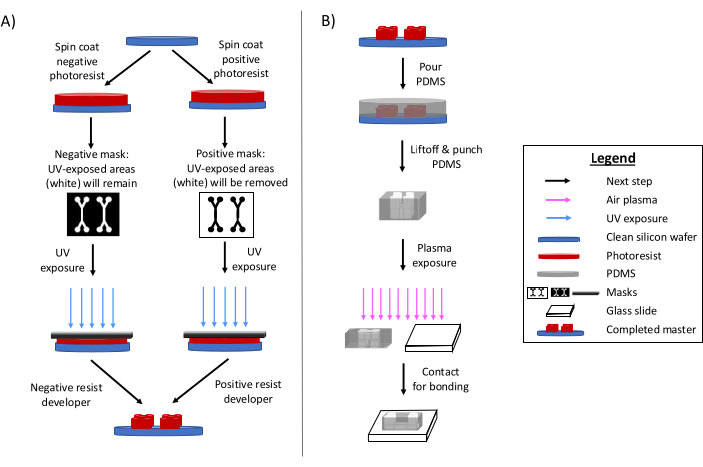
الشكل 1: لمحات عامة عن عملية الطباعة الحجرية الضوئية التقليدية وعملية التصنيع المجهر. (أ) عملية الطباعة الحجرية الضوئية التقليدية و (ب) عملية التصنيع الدقيق. اعتمادا على التطبيق وخصائص مقاومة الضوء المرغوبة ، يمكن استخدام مقاومة الضوء السلبية أو الإيجابية ، على الرغم من أنها ستنتج نفس سيد التصميم. تساعد الخصائص مثل ارتفاع الميزة المطلوبة أو درجة حرارة الانصهار المقاومة للضوء في تحديد نوع مقاومة الضوء المناسبة. تم تعديل هذا الرقم بإذن من روجرز (2022)14. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
أدى استخدام الموائع الدقيقة إلى توسيع الإمكانيات في العديد من مجالات البحث ، وكان أحدث تأثيرها في العلوم البيولوجية. نظرا لصغر حجمها ، تسمح الموائع الدقيقة بالإدارة الدقيقة للموارد المحدودة والقيمة مثل الخلايا أو البروتينات. والأكثر تأثيرا هو قابلية ضبط أنظمة الموائع الدقيقة لتقليد الظروف الفسيولوجية ، مثل التعديلات في صلابة الركيزة ، وممارسة القوة على العينة ، وحتى تكامل التيار الكهربائي. بالإضافة إلى ذلك ، يوفر استخدام الموائع الدقيقة القدرة على معالجة الكواشف المتعددة بالتوازي ووضع نماذج أولية سريعة وتحسين تصميمات النظام بشكل متكرر. تتيح هذه الميزات تصغير سير عمل المختبر بأكمله على جهاز واحد ، يشار إليه عادة باسم "مختبر على شريحة" 1،6،9،15،16،17،18،19.
أحد التطبيقات الخلوية البيولوجية للموائع الدقيقة هو التحقيق في بوليمرات الأنابيب الدقيقة. تعتبر الأنابيب الدقيقة مكونا أساسيا في الهيكل الخلوي للخلية ، وتلعب دورا حيويا في عمليات مثل انقسام الخلايا ونقل البضائع داخلالخلايا 20،21. باعتبارها العنصر الأكثر صلابة في الهيكل الخلوي ، تظهر الأنابيب الدقيقة معامل مرونة يمكن مقارنته بمعامل زجاج شبكي22،23. تعتبر خصائصها الميكانيكية القوية ضرورية للوظائف الخلوية المختلفة ، بما في ذلك ، على سبيل المثال ، تقلص عضلة القلب ، حيث تنحني وتسترخي بشكل دوري خلال المرحلتين الانقباضية والانبساطيللقلب 24. تم اعتماد أجهزة الموائع الدقيقة سابقا للتحقيق في خصائص الأنابيب الدقيقة وهياكلها ذات الترتيب الأعلى في المختبر. في الواقع ، تم استخدام الموائع الدقيقة لاستكشاف ديناميكيات بلمرة الأنابيب الدقيقة ، وتفاعلات الأنابيب الدقيقة والأنابيب الدقيقة ، وتأثيرات البروتينات المرتبطة بالأنابيب الدقيقة على الخصائص الميكانيكية للأنابيب الدقيقة25،26،27،28،29،30،31،32،33،34،35، 36،37،38،39،40،41.
في حين أن إدخال الموائع الدقيقة في مجال الأنابيب الدقيقة قد أدى إلى العديد من الاكتشافات المثيرة ، لا يزال هناك مجال للتحسين يكمن في تكييف هذه الأجهزة لأبحاث الأنابيب الدقيقة. في هذا العمل ، نتناول قيدين محددين لا يزالان في دراسة الأنابيب الدقيقة في أجهزة الموائع الدقيقة: إمكانية تكوين فقاعة الهواء داخل الجهاز ، والتي يتم إدخالها عادة عن طريق التلاعب اليدوي بأجهزة الموائع الدقيقة ، ونقص استخدام المقايسات عالية الإنتاجية. أولا ، يمكن أن تؤدي التلاعبات اليدوية ، مثل توصيل الأنابيب وفصلها ، إلى تكوين الفقاعات في القنوات. يعد تكوين فقاعة الهواء داخل خلية التدفق كارثيا ، حيث يمكن لفقاعات الهواء أن تفسد البروتينات ، وتقص بوليمرات الأنابيب الدقيقة ، وتؤثر سلبا على مزارع الخلايا42،43. بالإضافة إلى ذلك ، تؤدي الزوايا الحادة والزوايا المائلة في الجهاز إلى ترطيب السطح غير المنتظم ، مما يزيد من احتمالية احتجاز الهواء. تم تطوير العديد من التقنيات لتقليل تكوين فقاعات الهواء واستمرارها وتأثيرها. ومع ذلك ، فإن استخدام طرق تخفيف الفقاعات ليس عالميا42،43،44،45،46. علاوة على ذلك ، على الرغم من أن إحدى المزايا الرئيسية لاستخدام الموائع الدقيقة هي القدرة على التجارب عالية الإنتاجية ، إلا أن الموائع الدقيقة لم يتم استخدامها بعد لتوسيع نطاق أبحاث الأنابيب الدقيقة. يمكن تصميم أجهزة الموائع الدقيقة لاختبار ظروف تجريبية متعددة بالتوازي على نفس الجهاز. على سبيل المثال ، يمكن استخدام تدرجات السوائل لتوجيه تدفق البروتينات أو الأدوية المختلفة المرتبطة بالأنابيب الدقيقة ، مما يتيح توصيلها المستهدف إلى مناطق محددة من الأنابيب الدقيقة المقسمة داخل نفس الجهاز.
هنا ، قمنا بتصميم جهاز ميكروفلويديك بشكل متكرر يعالج هذه القيود. نحن نقدم بروتوكول خطوة بخطوة لتصنيع الجهاز ، وبالتالي تمكين جمهور أوسع من استخدام تقنية الموائع الدقيقة في أبحاث الأنابيب الدقيقة. يشتمل تصميم الجهاز هذا على ميزات محاصرة الفقاعات ويستخدم نظام التحكم الآلي في التدفق لتقليل التدخل اليدوي مع تمكين تدرجات الحلول في الجهاز لتحليلات الإنتاجية العالية. باختصار ، يمكن أن يؤدي تطوير هذا التصميم الموائع الدقيقة إلى تسهيل البحث والفهم الأوسع لميكانيكا الأنابيب الدقيقة مع تقديم تحسينات قيمة للتصميمات التجريبية عبر مجال أبحاث الأنابيب الدقيقة الأوسع.
Protocol
ملاحظة: تم تنفيذ العمل المفصل في هذا الجزء من البروتوكول في غرفة الأبحاث الأساسية من الفئة 100 من معهد فاندربيلت للعلوم والهندسة النانوية (VINSE). من المطلوب وجود غرفة نظيفة خاضعة للرقابة مع ثوب مناسب وإضاءة مفلترة بالأشعة فوق البنفسجية لمنع تلف الجهاز بسبب ظروف الإضاءة الرطبة / المحيطة ولمنع تلوث الجسيمات. يجب أن تتم جميع عمليات التلاعب على رقائق السيليكون بحيث يكون الجانب المصقول برقائق السيليكون متجها لأعلى. استخدم الملقط عند معالجة الرقائق وقلل من لمس أسطح الرقاقة لمنع الخدش. احتفظ برقائق الرقائق في أطباق بتري مع تغطية الأغطية عند النقل وفي نهاية كل يوم ما لم يتم توجيه خلاف ذلك.
1. الطباعة الحجرية الضوئية (6 - 8 ساعات)
- تقوم البلازما بتنظيف رقاقة السيليكون مقاس 3 بوصات لمدة 5 دقائق تحت الفراغ (من الناحية المثالية ، ضغط الفراغ < 5 × 10-5 torr) باستخدام الأكسجين (O2) أو البلازما بالهواء الجاف النظيف (CDA).
- قم بتوسيط رقاقة السيليكون على مغطي تدور لترسب المقاوم للضوء.
- قم بإيداع ~ 1-2 مل من SPR 220 7.0 مقاوم للضوء في مركز رقاقة السيليكون.
تنبيه: تعامل مع مقاومة الضوء بالقفازات وحماية العين وتخلص منها وفقا للبروتوكولات الخاصة بالشركة المصنعة / الموقع. - قم بتدوير مقاومة الضوء على رقاقة السيليكون إلى السماكة المطلوبة بناء على منحنيات دوران الشركة المصنعة. قم بتوليد طبقات بسمك ~ 13 ميكرومتر عن طريق الدوران بسرعة 1000 دورة في الدقيقة لمدة 30 ثانية. في وقت لاحق ، قم بتنظيف المقاومة الضوئية المتبقية على جهاز الطلاء الدوار باستخدام الأسيتون وتخلص منه وفقا للبروتوكولات الخاصة بالموقع.
ملاحظة: إذا لم يتم طلاء الرقاقة بشكل موحد بمقاومة الضوء بعد الدوران ، فكرر الخطوات 1.2-1.4. يمكن أن يكون الطلاء غير المنتظم ناتجا عن رقاقة غير مركزية على آلة طلاء الدوران ، باستخدام القليل جدا من مقاومة الضوء ، و / أو عدم ترسيب مقاومة الضوء في مركز الرقاقة. - أثناء لمس أقل قدر ممكن من مقاومة الضوء على الرقاقة ، انقل رقاقة السيليكون إلى صفيحة ساخنة مثبتة على 70 درجة مئوية.
- احتضان رقاقة السيليكون على اللوح الساخن ، وقم بزيادة درجة الحرارة بمقدار 10 درجات مئوية كل 3-5 دقائق حتى تصل درجة الحرارة إلى 115 درجة مئوية.
- قم بإيقاف تشغيل اللوح الساخن واترك رقاقة السيليكون تبرد حتى تقل درجة حرارتها عن 65 درجة مئوية.
ملاحظة: يتم تنفيذ خطوات التسخين والتبريد ببطء لمنع التشقق الحراري لمقاومة الضوء ، وهو أمر شائع في هذا السماكة. في حالة حدوث تشققات حرارية ، يمكن تصحيحها عادة عن طريق إعادة تسخين رقاقة السيليكون وإبطاء معدل التبريد. - باستخدام الملقط ، انقل رقاقة السيليكون المبردة إلى محاذاة القناع وقم بتحميل كل من رقاقة السيليكون والقناع الضوئي المقابل في محاذاة القناع باتباع البروتوكولات الخاصة بالشركة المصنعة / الموقع.
ملاحظة: تم تصنيع الأقنعة الضوئية بواسطة طرف خارجي باستخدام تصميم محدد تم إنشاؤه باستخدام AutoCAD. راجع الملف التكميلي 1 لعرض تصميم القناع. - قم بتعريض رقاقة السيليكون للأشعة فوق البنفسجية (UV) لفترة محددة (بناء على قوة مصباح الأشعة فوق البنفسجية) باتباع البروتوكولات الخاصة بالشركة المصنعة / الموقع. الطاقة المطلوبة لهذا التطبيق هي ~ 400 مللي جول / سم2 ، واحسب وقت التعرض بالصيغة:
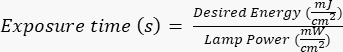 .
. - بعد التعرض ، قم بإزالة رقاقة السيليكون من تقويم القناع واسمح لمقاومة الضوء بإعادة الترطيب لمدة 4 ساعات عن طريق دوران الهواء. تأكد من ترك غطاء طبق بتري للسماح بتدوير الهواء ، لكن ضع الطبق في منطقة من غير المحتمل أن تتعرض للجسيمات.
ملاحظة: يمكن أخذ استراحة لمدة 4 ساعات خلال فترة الإماهة هذه ، ولكن يوصى بمواصلة الإجراء في نفس اليوم. - بعد إعادة الجفاف لمدة 4 ساعات ، انقل الرقاقة المكشوفة إلى لوح ساخن على درجة حرارة 70 درجة مئوية.
- احتضان رقاقة السيليكون على اللوح الساخن ، وقم بزيادة درجة الحرارة بمقدار 10 درجات مئوية كل 3-5 دقائق حتى تصل درجة الحرارة إلى 115 درجة مئوية.
- اترك الرقاقة تحتضن عند 115 درجة مئوية لمدة 10 دقائق.
- قم بإنشاء "غطاء" عازل للرقاقة المكشوفة عن طريق تشكيل لوح من رقائق الألومنيوم على شكل غطاء طبق بتري.
- قم بإيقاف تشغيل اللوح الساخن وقم بتغطية الرقاقة المكشوفة بغطاء رقائق الألومنيوم. دع الرقاقة تبرد بشكل محيط طوال الليل.
ملاحظة: يعد التكسير الحراري للمقاومة الضوئية أكثر شيوعا أثناء خطوة حضانة ما بعد التعرض ، ولهذا السبب يوصى بالتبريد البطيء بين عشية وضحاها. هذا يكمل الخطوات المطلوبة لليوم الأول من التصنيع. يوصى بالانتقال إلى القسم التالي في اليوم التالي.
2. التطوير (1 - 2 ساعة)
- عندما تكون جاهزا لتطوير الرقاقة المكشوفة ، احصل على حاوية نظيفة ومطور مناسب لمقاومة الضوء. هنا ، يتم استخدام مطور MF-319 مع حاوية مخصصة.
تنبيه: تعامل مع المطور بالقفازات وحماية العين ، وانقل الحاوية السائبة إلى حاوية ثانوية ، وتخلص منها وفقا للبروتوكولات الخاصة بالشركة المصنعة / الموقع. - صب ما يكفي من المطور في الحاوية لغمر الرقاقة المكشوفة بالكامل (سيختلف الحجم الفعلي بناء على الحاوية).
- اغمر الرقاقة المكشوفة في المطور وانتظر حتى يتم إذابة جميع المواد المقاومة للضوء غير المرغوب فيها. يساعد تحريك / تحريك الحاوية برفق في التطوير حتى يظهر القليل من المقاومة الضوئية المتبقية على الرقاقة بخلاف تصميم الجهاز.
ملاحظة: قد تكون هناك حاجة إلى تغييرات متعددة لحل المطور لإزالة مقاومة الضوء غير المرغوب فيها بالكامل ، اعتمادا على حجم حل المطور المستخدم. - قم بإزالة الرقاقة المطورة من محلول التطوير واشطف جانبي الرقاقة برفق بالماء منزوع الأيونات (DI) لمدة 30 ثانية.
- جفف الرقاقة المطورة بغاز النيتروجين (N2).
- قم بتخزين الرقاقة المطورة في طبق بتري في بيئة جافة وباردة حتى تصبح جاهزة للاستخدام مرة أخرى. لف طبق بتري بورق الألمنيوم لمنع تدهور مقاوم الضوء بسبب التعرض للضوء المحيط.
ملاحظة: يوصى ، ولكن ليس مطلوبا ، بالمتابعة إلى القسم التالي في نفس اليوم.
3. السيلانة (1 - 2 ساعة)
- انقل رقاقة السيليكون إلى مجفف.
- ضع وعاء صغير من الألومنيوم (أو قطعة من رقائق الألومنيوم مطوية على شكل حاوية) في المجفف.
- Pipet 1 قطرة (~ 50 ميكرولتر) من ثلاثي الكلورو (1H ، 1H ، 2H ، 2H-perfluorooctyl) silane في حاوية الألومنيوم.
تنبيه: تعامل مع محلول silane بالقفازات وحماية العين وتخلص منه وفقا للبروتوكولات الخاصة بالشركة المصنعة / الموقع. - أغلق المجفف وقم بتشغيل المكنسة الكهربائية.
- اسمح بالجفاف / السيلان ليحدث لمدة 1-2 ساعة.
- بعد انتهاء وقت السيلان ، قم بإيقاف تشغيل الفراغ واسترجع الرقاقة السيلانية. قم بتخزين الرقاقة المصنوعة من السيلان في طبق بتري ملفوف بورق الألمنيوم في بيئة جافة وباردة حتى تصبح جاهزة للاستخدام مرة أخرى.
ملاحظة: قد يلزم تكرار السيلانة بشكل دوري على الرقائق وبشكل متكرر على الأجهزة التي تستخدم فيها طبقات أرق من PDMS. إذا لوحظ التصاق PDMS عند إزالة PDMS من الرقاقة ، فقد تحتاج الرقاقة إلى إعادة السيلان ، ويجب تكرار هذا القسم بمجرد إزالة جميع PDMS من الرقاقة. هذا يكمل الخطوات المطلوبة لإنشاء أساتذة الأجهزة الموائع الدقيقة. الأساتذة مستقرة ويمكن تنفيذ الأقسام اللاحقة عند الرغبة.
4. ترسيب PDMS (1 - 2 ساعة)
ملاحظة: إذا كان هناك نظام إدارة بيانات متبقي على العنصر الرئيسي من تصنيع دقيق سابق، فيجب إزالة نظام إدارة بيانات التوجيه المتبقي قبل إيداع نظام إدارة بيانات الأوامر (PDMS) الجديد.
- على الميزان ، قم بوزن في حاوية PDMS وعامل المعالجة المرتبط بها بنسبة وزن 10: 1. سيختلف الوزن الإجمالي المطلوب اعتمادا على سمك PDMS المطلوب وحجم طبق بتري. بالنسبة لطبق بتري مقاس 4 بوصات ، سينتج ~ 20 جم من PDMS و ~ 2 جم من عامل المعالجة سمك 2-3 مم.
تنبيه: تعامل مع حل PDMS بالقفازات وحماية العين وتخلص منه وفقا للبروتوكولات الخاصة بالشركة المصنعة / الموقع. - امزج PDMS وعامل المعالجة في الحاوية لمدة 5 دقائق باستخدام ملعقة بلاستيكية أو أداة أخرى مناسبة.
- انقل حاوية PDMS المختلطة إلى مجفف للتفريغ.
- أغلق المجفف وقم بتشغيل المكنسة الكهربائية. ستبدأ فقاعات الهواء في الظهور في PDMS.
- اسمح بالجفاف / التفريغ لمدة 30 دقيقة. اعتمادا على كمية PDMS المستخدمة وشكل الحاوية ، قد يختلف الوقت الفعلي. نقطة النهاية العامة هي عندما تكون الفقاعات قليلة أو معدومة في PDMS.
- بعد التفريغ ، قم بإيقاف تشغيل المكنسة الكهربائية واسترجع حاوية PDMS.
- صب PDMS المختلط ومنزوع الغازات على السيد في طبق بتري.
- احتضن السيد في طبق بتري المغلق عند 65 درجة مئوية طوال الليل للسماح ل PDMS بالشفاء الكامل.
ملاحظة: هذا يكمل خطوات إيداع PDMS. يوصى بالسماح ل PDMS بالشفاء في حاضنة طوال الليل. ثم يكون نظام إدارة البرمجيات (PDMS) مستقرا، بحيث يمكن تنفيذ الأقسام اللاحقة عند الرغبة.
5. تجميع جهاز PDMS (1-2 ساعة)
- استرجع سيد (أسياد) الجهاز الذي عالج PDMS ، وزوج من الملقط ، وثقب خزعة قياسي 1.5 مم مع مكبس يدوي ، وشفرة مشرط / ماكينة حلاقة.
تنبيه: تعامل مع الشفرة بحذر ولا تقطع أبدا نحو نفسك أو الآخرين. يوصى باستخدام شفرة أمان ذاتية التراجع أو الأمان. - حول ميزات الجهاز ، قم بقص قطع مستطيلة من PDMS من الطبقة الرئيسية. تأكد من أن كل قطعة من نظام إدارة الأبعاد الرقمي بها مساحة على كل جانب ، مع إحاطة ميزات الجهاز لتسهيل ملامسة الترابط الجيدة مع التأكد من أن كل قطعة تتناسب مع غطاء زجاجي مقاس 22 مم × 22 مم.
ملاحظة: من المهم تجنب لمس السطح السفلي لنظام إدارة البيانات (الجانب) (الجانب الذي يحتوي على الميزات)، لذلك تعامل دائما مع نظام إدارة البرمجيات الشخصية من الحواف باستخدام الملقط. بالإضافة إلى ذلك، لا تضع أبدا جانب المعالم في نظام إدارة البرامج (PDMS) متجها لأسفل على أي سطح. عندما لا تكون قيد الاستخدام، قم بتخزين نظام إدارة البرامج (PDMS) بحيث يكون جانب المعالم متجها لأعلى في حاوية مغلقة لحين الحاجة. - قم بثقب فتحات المدخل والمخرج في قطع PDMS باستخدام ثقب ثقب نظيف مقاس 1.5 مم. قم بإدخال PDMS للجهاز في طبقة احتياطية من PDMS القرابين بدلا من السطح الصلب الذي قد يتلف ثقب الثقب.
- استرجع ونظف غطاء زجاجي مقاس 22 مم × 22 مم بمنديل مبلل بكحول الأيزوبروبيل (IPA).
- قم بتنظيف البلازما للغطاء مقاس 22 مم × 22 مم لمدة 5 دقائق تحت الفراغ (الضغط < 0.5 Torr) باستخدام بلازما CDA. سيؤدي ذلك إلى إزالة أي حطام أو طلاءات عضوية على الغطاء.
- امسح زلة الغطاء الزجاجية مقاس 22 مم × 22 مم والجانب المميز لنظام PDMS بمنديل مبلل ب IPA.
- ضع كل من PDMS (جانب الميزة متجها لأعلى) والغطاء الزجاجي (نفس الجانب المواجه لأعلى كما تم تنظيفه من قبل) في منظف البلازما وتنظيف البلازما في وقت واحد لمدة 30 ثانية تحت الفراغ (الضغط < 0.5 Torr) باستخدام بلازما CDA.
- قم بإزالة كل من الغطاء الزجاجي وجهاز PDMS من منظف البلازما. اقلب نظام إدارة البرامج (PDMS) بحيث يكون جانب المعالم متجها لأسفل وضعه على الغطاء الزجاجي. راقب الترابط واضغط برفق على PDMS حسب الحاجة لتسهيل الاتصال الجيد.
- احتضان الغطاء المستعبدين في طبق بتري مغلق عند 65 درجة مئوية لمدة 3 دقائق لتسهيل الترابط.
ملاحظة: يغير الترابط بالبلازما الكراهية للماء للغطاء الزجاجي ، مما يولد سطحا محبا للماء. لقد لوحظ من خلال الأدلة القصصية أن الحالة الأصلية الكارهة للماء للغطاء تعود بعد حوالي يومين من الحضانة في درجة حرارة الغرفة. يوصى باستخدام الأجهزة المصنعة في موعد لا يتجاوز يومين بعد ربط البلازما. هذا يكمل خطوات التصنيع الدقيق. لا تتمتع الأجهزة بمدة صلاحية محددة ولكن يجب تخزينها في مكان بارد وجاف عندما لا تكون قيد الاستخدام.
6. تحضير قناة تدفق الموائع الدقيقة (1 ساعة)
- قم بتأمين جهاز ميكروفلويديك مجمع في محول مرحلة مخصص نظيف47.
- استرجع حقنة ومحول قفل لور وطويق مناسب وقطعة من الأنابيب الشفافة بقطر خارجي 1.5 مم (طولها حوالي 15-20 سم). قم بتوصيل الأنبوب بالمحقنة عبر المحول.
- قم بتوصيل ثلاث قطع أخرى من الأنابيب بمنافذ جهاز الموائع الدقيقة (لا يلزم أن يكون هذا الأنبوب طولا محددا) وقم بتوجيه الطرف الآخر من هذه الأنابيب إلى قارورة نفايات في اتجاه مجرى النفايات.
- باستخدام المحقنة ، قم بإعداد جهاز الموائع الدقيقة عن طريق إدخال المحاليل وفقا للخطوات أدناه. تسلسل وحجم المحاليل هي كما يلي: 50 ميكرولتر من محلول الأجسام العازلة BRB80 ، 25 ميكرولتر من محلول الأجسام المضادة للرودامين ، انتظر لمدة 5 دقائق ، 50 ميكرولتر من BRB80 ، 25 ميكرولتر من بولوكسامير 407 (F127) ، انتظر لمدة 15 دقيقة ، و 50 ميكرولتر من BRB80. انظر الجدول 1 للحصول على مثال.
- ارسم المحلول من مصدره إلى الأنبوب.
ملاحظة: لا تسحب المحلول بالكامل إلى المحقنة نفسها. يجب أن يبقى الحل فقط في الأنبوب. - اضغط برفق على مكبس المحقنة حتى توجد قطرة صغيرة من السائل في نهاية الأنبوب. سيمنع ذلك أي هواء من دخول جهاز الموائع الدقيقة عند توصيل الأنبوب.
- قم بتوصيل الأنبوب بمدخل جهاز الموائع الدقيقة.
- اضغط ببطء على مكبس المحقنة حتى يطير معظم المحلول ، وليس كله ، عبر الأنبوب. سيضمن ترك كمية صغيرة من السائل في الأنبوب عدم دفع الهواء عن غير قصد عبر الأنبوب. راقب الأنابيب وقنوات الموائع الدقيقة أثناء عمليات النقل هذه ، وابحث عن أي فقاعات.
ملاحظة: في حالة حدوث فقاعات في الأنبوب ، ابدأ في استكشاف الأخطاء وإصلاحها (حاول إزالة الفقاعة قبل دخولها إلى جهاز الموائع الدقيقة عن طريق فصل الأنبوب قبل وصول الفقاعة مباشرة ثم إعادة توصيل الأنبوب بعد مرور الفقاعة ، وما إلى ذلك). - كرر الخطوات 6.4.1-6.4.4 للكاشف التالي حتى يتم نقل جميع الكواشف من خلالها. ستكون هناك حاجة إلى قطعة جديدة من أنابيب المدخل لكل كاشف لمنع التلوث المتبادل لكواشف المصدر. بمجرد اكتمال الغسيل النهائي BRB80 ، يكون الجهاز مستقرا لعدة دقائق. ستمنع قطرة من محلول BRB80 على المداخل جفاف الجهاز.
- ارسم المحلول من مصدره إلى الأنبوب.
- تحضير جوانوزين -5 '- [(α ، β) -ميثيلينو] ثلاثي الفوسفات (GMPCPP) - الأنابيب الدقيقة المستقرة وفقا للبروتوكولات القياسية (مع نسبة وضع العلامات على TTR ~ 25٪) 47،48.
- قم بإعداد محلول عازل للتصوير ("مضاد للتلاشي") بتركيز عمل 2x عن طريق الجمع بين الكواشف التالية بالكميات المعنية (اعتمادا على تركيزات المخزون) للحصول على تركيزاتها النهائية المحددة: BRB80 مكمل ب 40 ملي مولار من الجلوكوز ، و 40 ميكروغرام / مل جلوكوز أوكسيديز ، و 16 ميكروغرام / مل كاتالاز ، و 0.5 مجم / مل كازين ، و 50 ملي مولار كلوريد البوتاسيوم ، و 10 ملي مولار ثنائي ثيوثريتول (DTT). يستخدم المخزن المؤقت للتصوير هذا لإطالة الثبات الضوئي. انظر الجدول 2 للحصول على مثال.
- قم بتخفيف جزء من محلول 2x المضاد للبهتان 1: 1 في BRB80 للحصول على محلول عمل 1x من مضاد للبهتان. قم بتسخين هذا التلاشي إلى درجة حرارة الغرفة (RT) ؛ يجب حفظ محلول المخزون المضاد للبهتان على الجليد.
| ترتيب | الكواشف | تخفيف الحجم | حجم الغسيل | وقت الحضانة |
| 1 | BRB80 | غير متاح | 50 ميكرولتر | غير متاح |
| 2 | الأجسام المضادة للرودامين | 1:50 في BRB80 ، تخلط جيدا | 25 ميكرولتر | 5 دقائق |
| 3 | BRB80 | غير متاح | 50 ميكرولتر | غير متاح |
| 4 | بولوكسامير 407 (F127) | 1٪ في BRB80 | 25 ميكرولتر | 15 دقيقة |
| 5 | BRB80 | غير متاح | 50 ميكرولتر | غير متاح |
الجدول 1: ترتيب تحضير قنوات أجهزة الموائع الدقيقة.
| حجم | الكاشف | تركيز المخزون | التركيز النهائي |
| 16 ميكرولتر | د-جلوكوز | 2 م | 80 ملي |
| 16 ميكرولتر | الجلوكوز أوكسيديز | 2 ملغ/مل | 80 ميكروغرام / مل |
| 16 ميكرولتر | كاتالاز | 0.8 مجم / مل | 32 ميكروغرام / مل |
| 14 ميكرولتر | الكازين | 28 ملغم/مل | 0.16 مجم / مل |
| 8 ميكرولتر | DTT | 1 م | 20 ملم |
| 40 ميكرولتر | كلوريد البوتاسيوم | 1 م | 100 ملم |
| 290 ميكرولتر | BRB80 | 1x | غير متاح |
| 400 ميكرولتر | نهائي (تركيز عمل 2x) |
الجدول 2: وصفة محلول التصوير المضاد للبهتان (تركيز 2x).
7. إدخال بذور الأنابيب الدقيقة إلى الموائع الدقيقة (10-15 دقيقة)
- قم بتوصيل جهاز الموائع الدقيقة بالمجهر.
ملاحظة: نظرا لأن استقرار الأنابيب الدقيقة يعتمد على درجة الحرارة ، فمن المستحسن إجراء تجارب التصوير عند 35 درجة مئوية. - قم بتوصيل 10-15 سم من الأنابيب الجديدة بالمحقنة وارسم التخفيف المطلوب لبذور الأنابيب الدقيقة المستقرة GMPCPP في الأنبوب.
ملاحظة: بالنسبة لهذا الجهاز ، كانت بذور الأنابيب الدقيقة GMPCPP ~ 10 نانومتر هي التركيز الأمثل. - اضغط برفق على مكبس المحقنة حتى توجد قطرة صغيرة من السائل في نهاية الأنبوب. سيمنع ذلك أي هواء من دخول جهاز الموائع الدقيقة عند توصيل الأنبوب.
- قم بتوصيل الأنبوب بمدخل جهاز الموائع الدقيقة.
- اضغط ببطء على مكبس المحقنة حتى يطير معظم المحلول ، وليس كله ، عبر الأنبوب. سيضمن ترك كمية صغيرة من السائل في الأنبوب عدم دفع الهواء عن غير قصد عبر الأنبوب.
- افصل أنبوب المدخل عن جهاز الموائع الدقيقة والحقنة وقم بإرفاق قطعة جديدة من الأنبوب بالمحقنة.
- ارسم BRB80 في الأنبوب.
- كرر الخطوات 7.3-7.6 لغسل بذور الأنابيب الدقيقة غير المرتبطة من الجهاز.
- لاحظ ارتباط البذور بسطح الموائع الدقيقة باستخدام الفحص المجهري الفلوري للانعكاس الداخلي الكلي (TIRF). سيختلف العدد المثالي للبذور في مجال رؤية واحد بناء على التطبيق وحجم مجال الرؤية ، ولكن بشكل عام ، ~ 10-20 بذرة لكل 80 ميكرومتر × مجال رؤية 80 ميكرومتر هو الأمثل. كرر الخطوات 7.2-7.9 حسب الحاجة حتى يتم الوصول إلى كثافة البذور المطلوبة.
ملاحظة: لمراقبة كثافة بذور الأنابيب الدقيقة ، يجب استخدام التعرض المتقطع للضوء القصير (100 مللي ثانية) نظرا لعدم وجود مضاد للتلاشي في المحلول. - بمجرد الوصول إلى كثافة البذور المرتبطة المناسبة ، قم بإرفاق قطعة جديدة من أنابيب المدخل بالمحقنة.
- ارسم محلول دافئ مضاد للبهتان 1x في الأنبوب وكرر الخطوات 7.3-7.6.
ملاحظة: مع وجود محلول مضاد للبهتان الآن في الجهاز ، تم تحسين الثبات الضوئي بشكل كبير ، ويكون الجهاز مستقرا. ومع ذلك ، لا يزال يوصى بتقليل التعرض لضوء الليزر.
8. زراعة امتدادات الأنابيب الدقيقة من البذور (15-30 دقيقة)
- اجمع بين التوبولين المصنف بالفلورسنت ، والتوبولين غير المسمى ، ومحلول مضاد للبهتان 2x ، و Guanosine-5'-triphosphate (GTP) ، و BRB80 لتحقيق محلول نهائي يحتوي على 14 ميكرومتر من التوبولين بنسبة وضع العلامات الفلورية بنسبة 7٪ ، ومضاد للتلاشي بتركيز عمل 1x ، و 1 ملي مولار GTP.
ملاحظة: في حالة استخدام تركيزات مختلفة أو نسب مختلفة من التوبولين ، فستحتاج إلى تعديل حجم كل كاشف لتحقيق التركيز النهائي المطلوب ونسبة وضع العلامات. احتفظ بمحلول التوبولين على الجليد حتى ~ 30 ثانية قبل الإدخال ، وعند هذه النقطة ، انزع المحلول عن الجليد وقم بتسخينه في متناول اليد إلى RT. سيساعد هذا في بلمرة امتدادات الأنابيب الدقيقة ، وهي عملية تعتمد على درجة الحرارة. في الواقع ، يجب إجراء بلمرة الأنابيب الدقيقة عند 35 درجة مئوية ، بينما يمكن إجراء جميع الخطوات التجريبية الأخرى في RT. - قم بتوصيل 10-15 سم من الأنابيب الجديدة بالمحقنة واسحب محلول التوبولين في الأنبوب.
- اضغط برفق على مكبس المحقنة حتى توجد قطرة صغيرة من السائل في نهاية الأنبوب. سيمنع ذلك أي هواء من دخول جهاز الموائع الدقيقة عند توصيل الأنبوب.
- قم بتوصيل الأنبوب بمدخل جهاز الموائع الدقيقة.
- اضغط ببطء على مكبس المحقنة حتى يطير معظم المحلول ، وليس كله ، عبر الأنبوب. سيضمن ترك كمية صغيرة من السائل في الأنبوب عدم دفع الهواء عن غير قصد عبر الأنبوب. افصل أنبوب المدخل عن جهاز الموائع الدقيقة.
- الصورة بالتردد المطلوب لمدة 10-15 دقيقة أو حتى تصبح الامتدادات طويلة بما يكفي للانحناء. عادة ما يتم إجراء التصوير بسرعة 488 نانومتر كل 5 ثوان و 561 نانومتر كل 60 ثانية حتى يصل طول الامتدادات إلى 5-10 ميكرومتر على الأقل (~ 15 دقيقة).
ملاحظة: عند تركيز التوبولين هذا ، قد تنتقل الأنابيب الدقيقة عشوائيا بين فترات البلمرة وإزالة البلمرة. هذا أمر متوقع ، ولكن بشكل عام ، ستطيل امتدادات الأنابيب الدقيقة49.
9. تثبيت امتدادات الأنابيب الدقيقة (10-15 دقيقة)
- اجمع بين Taxol ، محلول مضاد للبهتان 2x ، و BRB80 لتحقيق محلول نهائي يحتوي على 10 ميكرومتر من التاكسول ومضاد للبهتان بتركيز عمل 1x.
ملاحظة: احتفظ بمحلول التاكسول على الجليد حتى ~ 30 ثانية قبل الإدخال ، وعند هذه النقطة انزع المحلول عن الجليد وقم بتسخينه في متناول اليد إلى RT. سيمنع ذلك إزالة بلمرة امتدادات الأنابيب الدقيقة ، وهي عملية تعتمد على درجة الحرارة. - قم بتوصيل 10-15 سم من الأنابيب الجديدة بالمحقنة واسحب محلول التاكسول في الأنبوب.
- اضغط برفق على مكبس المحقنة حتى توجد قطرة صغيرة من السائل في نهاية الأنبوب. سيمنع ذلك أي هواء من دخول جهاز الموائع الدقيقة عند توصيل الأنبوب.
- قم بتوصيل الأنبوب بمدخل جهاز الموائع الدقيقة.
- اضغط لأسفل على مكبس المحقنة حتى يطير معظم المحلول ، وليس كله ، عبر الأنبوب. سيضمن ترك كمية صغيرة من السائل في الأنبوب عدم دفع الهواء عن غير قصد عبر الأنبوب.
- كرر الخطوات 9.2-9.5 مرتين في تتابع سريع. يمكن استخدام نفس قطعة الأنبوب في هذه الحالة.
ملاحظة: يعزز Taxol تنوي الأنابيب الدقيقة من جديد من التوبولين في المحلول ، ويمكن أن تهبط هذه الأنابيب الدقيقة على سطح قناة الموائع الدقيقة وتتداخل مع التصوير / الانحناء اللاحق. لهذا السبب ، يجب أن يتدفق محلول التاكسول عبر الجهاز بسرعة وفي تكرارات متعددة لإزالة أكبر قدر من التوبولين الحر من الجهاز في أسرع وقت ممكن. - تحقق من أن الأنابيب الدقيقة المزروعة من البذور لا تزال موجودة ومستقرة في الجهاز.
10. الانحناء امتدادات الأنابيب الدقيقة المستقرة (10-15 دقيقة)
ملاحظة: يمكن الآن ثني امتدادات الأنابيب الدقيقة المستقرة باستخدام وحدة التحكم في التدفق. هنا ، تم استخدام نظام إزاحة الضغط الإيجابي المنظم (Elveflow OB1 MK3 +) لتدفق المحلول من قارورة مصدر محكمة الإغلاق عبر مقياس التدفق وإلى الموائع الدقيقة. اعتمادا على تفاصيل إعداد وحدة التحكم في التدفق المتوفرة، قد يتم إجراء تعديلات على الخطوات التالية.
- قم بإعداد وحدة التحكم في التدفق والمعدات المرتبطة بها وفقا للبروتوكولات الخاصة بالشركة المصنعة / الموقع ، باستخدام الأنابيب لتوصيل قارورة المصدر بمدخل مقياس التدفق ومخرج مقياس التدفق بمدخل الموائع الدقيقة ، ولكن لا تقم بتوصيل الأنبوب بجهاز الموائع الدقيقة حتى الآن.
- أدخل ~ 200 ميكرولتر من محلول التاكسول 10 ميكرومتر في قارورة المصدر التي يمكن توصيلها بإعداد وحدة التحكم في التدفق. يستخدم هذا الإعداد وصلات قفل Luer لإنشاء ختم محكم.
- قم بتشغيل نظام التحكم في التدفق وقم بتجهيز الأنبوب لإزالة أي هواء. سيمنع ذلك أي هواء من دخول جهاز الموائع الدقيقة عند توصيل الأنبوب.
- بعد تحضير الأنبوب من خلال مقياس الجريان ووجود قطرة صغيرة من السائل في نهاية الأنبوب ، قم بإيقاف تشغيل نظام التحكم في التدفق.
- قم بتوصيل الأنبوب بمدخل جهاز الموائع الدقيقة. استخدم مدخلا عموديا على المدخل المستخدم لإدخال بذور الأنابيب الدقيقة وتنمو امتدادات الأنابيب الدقيقة من أجل الانحناء بشكل متعامد.
- ثني الامتدادات عن طريق بدء التدفق وإيقافه بمعدل التدفق أو الضغط المطلوب. ضغط 30 ملي بار هو المعيار لهذا البروتوكول باستخدام تدفق تذبذبي لمدة 5 ثوان. تخيل الانحناء خلال هذا الوقت ، عادة كل 0.1 ثانية عند 488 نانومتر وكل 10 ثوان عند 561 نانومتر.
ملاحظة: هذا يكمل مقايسة ثني الأنابيب الدقيقة الأساسية. يمكن تنظيف / التخلص من جميع المعدات والكواشف وفقا للبروتوكولات الخاصة بالشركة المصنعة / الموقع.
النتائج
الأساس المنطقي لتصميم جهاز الموائع الدقيقة
استرشد تصميم جهاز الموائع الدقيقة في هذه الدراسة بالعديد من الميزات الرئيسية (الشكل 2) ، والتي تبني وتحسن التصميم التقليدي لخلية التدفق البسيطة. وتجدر الإشارة إلى أن جهاز الموائع الدقيقة له حجم داخلي يبلغ ~ 160 نانولتر ، وهو أصغر بكثير من حجم ~ 10 ميكرولتر لخلايا التدفق التقليدية47 ، مما يسمح باستخدام أكثر تحكما للكواشف التي يحتمل أن تكون ثمينة ، مثل مكونات البروتين المنقى. نظرا لأن وحدة التحكم في تدفق الموائع الدقيقة تحتوي على قناتين تنظيميتين ، فقد تم تطوير الجهاز على افتراض أن منفذي مدخل / مخرج فقط سيكون لهما التحكم في الضغط في أي وقت. يمكن تنفيذ المزيد من القنوات التي يتم التحكم فيها بالضغط ، إذا رغبت في ذلك.
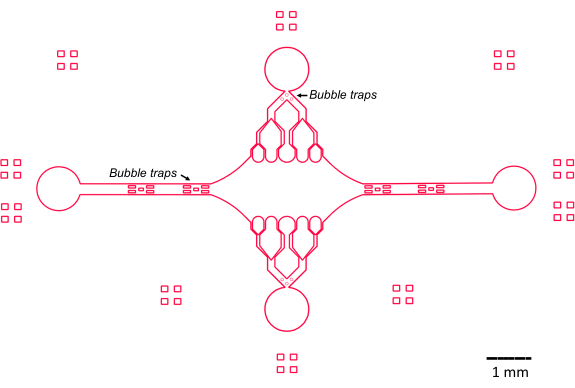
الشكل 2: تخطيطي لتصميم جهاز الموائع الدقيقة. العلامات المستطيلة على المحيط هي للمساعدة البصرية في رؤية محيط القنوات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تعمل غرفة الجهاز المركزية المستطيلة كمنطقة تصوير رئيسية حيث يتم توصيل بذور الأنابيب الدقيقة ، ويتم بلمرة امتدادات الأنابيب الدقيقة من هذه البذور. تتقاطع الغرفة بواسطة قناة تدفق على كل جانب ، مع قنوات مستقيمة على طول المحور x تعمل كمدخل ومخرج لتسهيل التبادل السريع لمحلول التفاعل. تستخدم قناة مدخل الأنابيب الدقيقة أيضا لإدخال بذور الأنابيب الدقيقة في الغرفة ، مع التدفق الرقائقي مما يؤدي إلى ارتباط البذور بالسطح الزجاجي على طول اتجاه التدفق. في الاتجاه العمودي (المحور y) ، تتفرع قنوات التدفق إلى قنوات أصغر باتجاه الغرفة ، على غرار بعض التصميمات السابقة25،28،36،39. الهندسة المتفرعة مناسبة بشكل خاص لدراسة الخواص الميكانيكية للأنابيب الدقيقة. يسمح تدفق المحلول إلى الغرفة المركزية من اتجاه عمودي على اتجاه بذور الأنابيب الدقيقة بقوى الانحناء الناجمة عن التدفق بزوايا شبه طبيعية. علاوة على ذلك ، فإن إدراج هندسة متفرعة مع العديد من قنوات التدفق الأصغر يسهل تطبيق قوة أكثر تجانسا على مساحة واسعة من الغرفة المركزية ، وهو ما لا يتحقق من خلال هندسة تدفق بسيطة أحادية القناة. بهذه الطريقة ، يمكن للفكرة المتفرعة ، على الرغم من أنها تبدو أكثر تعقيدا ، أن تقلل من التعقيد الكلي في تحديد القوة المنقولة إلى الأنابيب الدقيقة (الشكل 3). يتميز هذا التصميم أيضا بخطوط متعددة من التماثل ، مما يسمح بسهولة الاستخدام وفرصة تقييم الانحناء من عدة اتجاهات (على سبيل المثال ، أعلى مقابل أسفل).
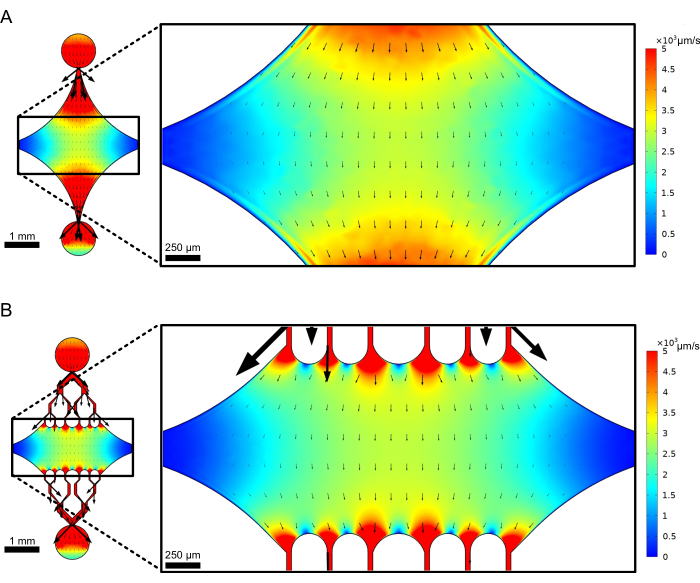
الشكل 3: ينتج عن إدراج شكل متفرع مساحة كبيرة من التدفق المماثل. محاكاة لتصميمين للجهاز في ظل تدفق الحالة المستقرة: أحدهما بدون قنوات متفرعة (A) والآخر بقنوات متفرعة (B). تشير الأسهم إلى اتجاه التدفق المحلي وتتناسب مع حجم التدفق. يشير تلوين السطح إلى سرعة خط الوسط. تظهر الصور الموجودة على اليمين قسما مكبرا من الجهاز حيث تخضع الأنابيب الدقيقة (غير المعروضة) الموجهة على طول المحور x لقوى الانحناء من سائل يتدفق في المنفذ العلوي وخارج المنفذ السفلي. يؤدي دمج القنوات المتفرعة إلى زيادة المساحة النسبية الخاضعة لحقول السرعة المماثلة مع عدم زيادة حجم الكاشف المطلوب. تم تعديل هذا الرقم بإذن من روجرز (2022)14. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
والجدير بالذكر أن الجهاز ينفذ أيضا سلسلة من مصائد الفقاعات في قنوات تدفق المدخل والمخرج لمنع فقاعات الهواء من دخول غرفة التصوير المركزية. على وجه التحديد ، اخترنا تضمين مصفوفات من الركائز الدقيقة داخل مسار التدفق من أجل منع فقاعات الهواء من السفر إلى الماضي بسبب التوتر السطحي (الشكل 2) 46. علاوة على ذلك ، لمنع احتباس الهواء ، قمنا بتصميم الحواف داخل الجهاز كمنحنيات ناعمة ، بدلا من وجود زوايا مائلة. مجتمعة ، تقلل ميزات التصميم هذه من احتمالية حدوث فقاعات هواء وتزيد من متانة الجهاز.
تصنيع جهاز الموائع الدقيقة
يتطلب تحديد المعلمات المناسبة لإنشاء الجهاز الرئيسي بعض التحسين. كما لوحظ سابقا ، فإن مقاومة الضوء هذه حساسة للغاية لمعلمات التشغيل الرئيسية مثل الإضاءة المحيطة ومعدلات التسخين والتبريد أثناء خطوات الطباعة الحجريةالضوئية 50. على سبيل المثال ، إذا تم تبريد السيد بسرعة كبيرة بعد التسخين ، فقد تتطور الشقوق الحرارية في مقاومة الضوء. هذا أمر غير مرغوب فيه ، لأن الشقوق يمكن أن تضر بسلامة القناة. بينما يمكن حل الشقوق عن طريق إعادة تسخين المقاومة إلى درجة حرارة قريبة من درجة الحرارة الانتقالية (~ 115 درجة مئوية) ، وجدنا أن السماح للسيد بالتبريد بشكل محيط على اللوح الساخن كان أقوى طريقة لمنع التشقق. علاوة على ذلك ، يمكن أن يؤدي الضوء المحيط الزائد إلى التعرض غير المقصود لمقاومة الضوء ، مما يضعف المقاومة ويؤدي إلى تعرض ميزات الجهاز نفسها (التي يجب أن تظل على الرقاقة بعد التطوير) لتجريد جزئي أثناء خطوة التطوير. لهذا السبب ، نشجع خطوة التطوير التي يجب تنفيذها في اليوم التالي لخطوات الخبز بعد التعرض والتبريد المحيط طوال الليل. علاوة على ذلك ، عندما لا يكون الجهاز الرئيسي قيد الاستخدام ، نوصي بتخزينه في مكان مظلم أو ملفوف بورق الألمنيوم لمنع التدهور بمرور الوقت. بمجرد تحديد هذه المعلمات ، كانت عملية الطباعة الحجرية الضوئية قابلة للتكرار بدرجة كبيرة (الشكل 4).
بعد إنشاء السيد، تم صب نظام إدارة البرمجيات السائلة فوق السيد، مما سمح ل PDMS بمعالجة وإنشاء بصمة سلبية لميزات السيد. وجدنا أن صب PDMS بسمك 2-3 مم سمح بسهولة التلاعب بالأجهزة ؛ في المقابل ، إذا كان الطلاء بالدوران لتحقيق سمك في نطاق ميكرومتر ، فإن PDMS كان عرضة للتمزق أو الالتصاق بنفسه ، مما يجعل التلاعب صعبا. علاوة على ذلك ، تسمح طبقة PDMS السميكة بتوصيل أسهل للأنبوب ، حيث سيبقى الأنبوب في منافذ المدخل / المخرج دون الحاجة إلى مادة مانعة للتسرب أو مشبك.
أخيرا ، في حين أن فحوصات خلايا التدفق التقليدية لهذه التطبيقات البيولوجية غالبا ما تستخدم أغطية زجاجية تم تنظيفها مسبقا باستخدام محلول سمكة الضاري المفترسة (بيروكسيد الهيدروجين وحمض الكبريتيك) ثم السيلان ، وجدنا أن الأغطية المعالجة بتنظيف البلازما الممتدة وغسل IPA كانت مناسبة لأغراضنا47. قد تتطلب التطبيقات الأخرى ، مثل التصوير أحادي الجزيء ، معالجة زجاجية أكثر شمولا.

الشكل 4: عملية الطباعة الحجرية الضوئية. (أ) القناع بالتصميم المطلوب (قناع مصنوع من الكروم محفور على الزجاج). (ب) تكسير طفيف في مقاومة الضوء على رقاقة السيليكون بسبب الإجهاد الحراري (تسلط الأسهم الضوء على بعض الشقوق). غالبا ما تمتد هذه الشقوق عبر الرقاقة بأكملها. (ج) السيد المتطور. (د) إعداد الموائع الدقيقة على المجهر. يتم تصنيف المكونات الفردية باللون الأخضر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
نمو الأنابيب الدقيقة والاستقرار والانحناء
تعمل بذور الأنابيب الدقيقة المزروعة في GMPCPP كمواقع تنوي لملحقات الأنابيب الدقيقة للبلمرة وهي نفسها مستقرة ضد إزالة البلمرة لعدة ساعات في درجة حرارة الغرفة. تم ربط البذور بالغطاء الزجاجي في قناة الموائع الدقيقة باستخدام جسم مضاد مضاد للرودامين47. ثم نمت امتدادات الأنابيب الدقيقة الديناميكية في وجود التوبولين القابل للذوبان (المسمى بالفلورسنت ولكن ليس مترافقا بالرودامين) و GTP. وبهذه الطريقة ، تم إرفاق مواقع تنوي البذور بالغطاء الزجاجي ، لكن الامتدادات لم تكن كذلك. خلال فترة نمو التمديد التي استمرت 15 دقيقة ، تم بلمرة امتدادات الأنابيب الدقيقة وإزالة البلمرة بشكل عشوائي ، كما هو متوقع بسبب عدم استقرارها الديناميكي الجوهري49. بعد فترة النمو هذه ، تم إجراء غسل 10 ميكرومتر من Taxol للتخلص من أي توبولين متبقي من المحلول وتثبيت امتدادات الأنابيب الدقيقة التي تشكلت. التثبيت هو المفتاح ، حيث أن امتدادات الأنابيب الدقيقة ستتفكك عند استنفاد الأنبوبولين. بالإضافة إلى ربط وتثبيت بوليمر الأنابيب الدقيقة ، ثبت أيضا أن Taxol يؤثر على ميكانيكا بوليمر الأنابيب الدقيقة وقد يؤدي إلى انحناء في امتدادات الأنابيب الدقيقة الخطية51،52،53،54. عكست النتائج المعروضة هنا هذه الملاحظات. ومع ذلك ، فإن تجعيد امتدادات الأنابيب الدقيقة أمر غير مرغوب فيه ، حيث ينتج عن ذلك قوى غير متساوية يتم نقلها على طول الشبكة أثناء الانحناء. لذلك ، تم استخدام الأنابيب الدقيقة فقط التي بقيت مستقيمة نسبيا بعد التثبيت لتحليل الانحناء. بدلا من ذلك ، بعد فترة النمو الأولية ، يمكن استخدام فترة نمو ثانوية بمحلول من التوبولين و GMPCPP (على عكس GTP الأولي) لإنشاء "أغطية" مستقرة على الأطراف المتنامية لشبكة الأنابيب الدقيقة ومنع إزالة البلمرة55.
ثم تم ثني الأنابيب الدقيقة عن طريق التدفق في المحلول العازل باستخدام نظام التحكم في الضغط للحفاظ على ضغط ثابت في المنبع (الشكل 5 ، الفيديو التكميلي 1). بهذه الطريقة ، يمكننا تقريب التدفق المحلي الذي تشهده الأنابيب الدقيقة. من خلال تدفق السائل من أعلى وخارج منفذ الجهاز السفلي ، كان من المفترض أن يكون اتجاه التدفق عموديا على اتجاه البذر.
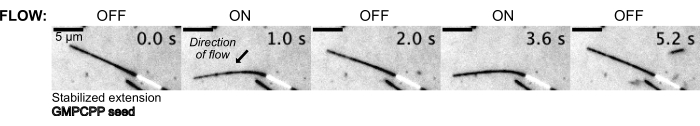
الشكل 5: يمكن استخدام إعداد الموائع الدقيقة لثني الأنابيب الدقيقة المستقرة. يتم ثني الأنابيب الدقيقة في حالة الراحة بعد الاستقرار باستخدام باكليتاكسيل أثناء التدفق النابض. يؤدي الضغط الثابت في المنبع البالغ 30 ملي بار إلى التدفق (يشير السهم إلى اتجاه التدفق). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تحديد ملف تعريف التدفق في جهاز الموائع الدقيقة
يمكن محاكاة سرعة الخط المركزي في الموائع الدقيقة حسابيا باستخدام برنامج COMSOL (برنامج المحاكاة ، الشكل 6 أ). ومع ذلك ، يتم توصيل الأنابيب الدقيقة بالغطاء الزجاجي للفحص المجهري TIRF في حدود ~ 100 نانومتر من السطح. لذلك ، فإن السرعة التي تتعرض لها الأنابيب الدقيقة ليست هي نفسها التي تم التنبؤ بها في المحاكاة ثنائية الأبعاد. لتقريب التدفق المحلي الذي تشهده الأنابيب الدقيقة ، استخدمنا معادلة Navier-Stokes العامة لتدفق السوائل غير القابل للانضغاط في بعد واحد:
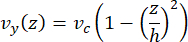
هنا ، z هو ارتفاع الأنابيب الدقيقة في الجهاز ، h هو الارتفاع الكلي للجهاز ، و vc هي سرعة خط الوسط في الجهاز. بحكم تعريف النظام ، فإن z-origin هو مركز الجهاز (الشكل 6 ب). باستخدام هذا التعريف وارتفاع القناة البالغ 13 ميكرومتر ، يتم تقريب ارتفاع الأنابيب الدقيقة على أنه z = -6.4 ميكرومتر. ينتج عن حل هذه المعادلة تقدير لسرعة السائل المحلية التي تتعرض لها الأنابيب الدقيقة:

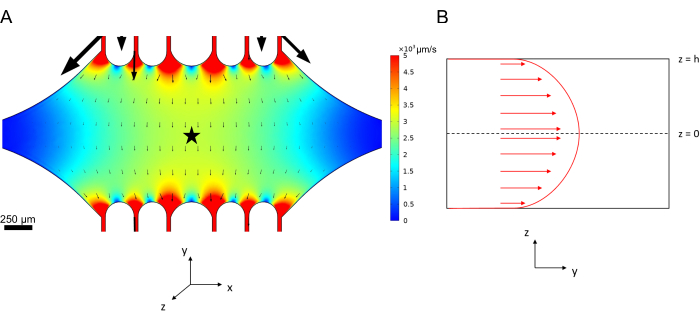
الشكل 6: تحديد نظام تحليل تدفق السوائل للسائل الذي يدخل الجهاز في المنفذ العلوي ويخرج من المنفذ السفلي (المنافذ غير معروضة). (أ) محاكاة مجال سرعة خط الوسط المتدرج كما في الشكل 3 ب. تشير النجمة إلى مجال اهتمام اللوحة B. (B) التمثيل المقطعي للجهاز. يوجد ملف تعريف تدفق السوائل المطور بالكامل في الاتجاه y مع سرعة خط الوسط vc عند z = 0 وحالة حدود عدم الانزلاق عند الجدران. لاحظ أن الأسهم الموجودة في هذه اللوحة لا يجب قياسها فيما يتعلق بمجال السرعة الفعلي الموضح في اللوحة A. تم تعديل هذا الرقم بإذن من روجرز (2022)14. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
بالإضافة إلى عمليات المحاكاة ، يمكن التحكم في سرعة السوائل باستخدام وحدة تحكم في التدفق تعتمد على معدل التدفق الحجمي بدلا من الحفاظ على الضغط. علاوة على ذلك ، يمكن تحديد معدل التدفق المحلي في كل جهاز بشكل مباشر من خلال تضمين حبات الفلورسنت ومراقبة سرعتها ، وبالتالي التخفيف من أي تباين من عينة إلى عينة.
النمذجة الحسابية والعروض التوضيحية المتدرجة
أخيرا ، أجرينا عمليات محاكاة حسابية مع التجارب لإثبات جدوى استخدام هذا الجهاز للتجارب عالية الإنتاجية. إلى جانب القدرة على ثني الأنابيب الدقيقة في اتجاهات متعددة بفضل تناظر الجهاز ، أظهرت عمليات المحاكاة أن الجهاز يمكنه الحفاظ على تدرجات دقيقة ، مما يتيح التحقيق المتزامن للظروف التجريبية المتعددة (الشكل 7 أ). أظهرت التجارب الأولية (الطرق التي لم يتم ذكرها صراحة كجزء من هذا المنشور) باستخدام صبغة الفلورسنت في المحلول الاتساق مع التنبؤات الحسابية (الشكل 7 ب). علاوة على ذلك ، أظهرنا بنجاح تقسيم البروتينات المختلفة في مناطق مختلفة من الجهاز عن طريق زيادة امتدادات الأنابيب الدقيقة في وقت واحد مع ملصقات فلورية مختلفة (الشكل 8). على حد علمنا ، هذا هو أول تطبيق للموائع الدقيقة عالية الإنتاجية على تحقيقات الأنابيب الدقيقة. يمكن استخدام هذه الميزة لهذا الجهاز لتقليل وقت وكميات الكواشف المطلوبة مع تحسين المتانة التجريبية أيضا. على سبيل المثال ، يمكن التحقيق في تأثيرات البروتينات المختلفة أو التركيزات المميزة للبروتينات الفردية على ميكانيكا وديناميكيات الأنابيب الدقيقة في وقت واحد في جهاز واحد.
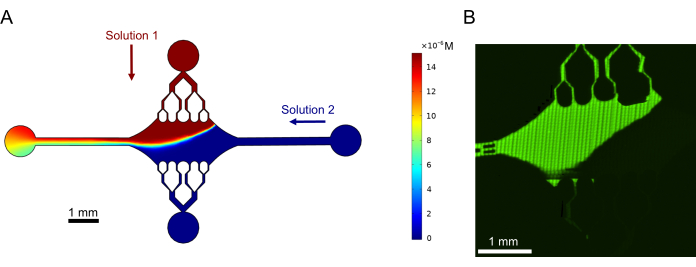
الشكل 7: تكوين التدرج. (أ) محاكاة تدرج من محلولين يدخلان الجهاز بنفس ضغط المدخل (50 ملي بار) والتركيز (15 ميكرومتر). يشار إلى منافذ المدخل لكل حل بأسهم ملونة (حل واحد في المنفذ العلوي وحل آخر في المنفذ الأيمن) ، ويعمل المنفذان المتبقيان كمنافذ. تظهر خريطة التمثيل اللوني ملف تعريف تركيز المحلول العلوي. تم تحقيق الحالة المستقرة عند t = 5 s. (ب) توليد تجريبي لتدرج مماثل باستخدام صبغة الفلورسنت في المحلول في المنفذ العلوي والمخزن المؤقت في المنفذ الأيمن. الصورة عبارة عن طبقة نقطية تم إنشاؤها عن طريق خياطة كل مجال رؤية (80 ميكرومتر × 80 ميكرومتر) لحل منطقة الجهاز بأكملها. تم تعديل هذا الرقم بإذن من روجرز (2022)14. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
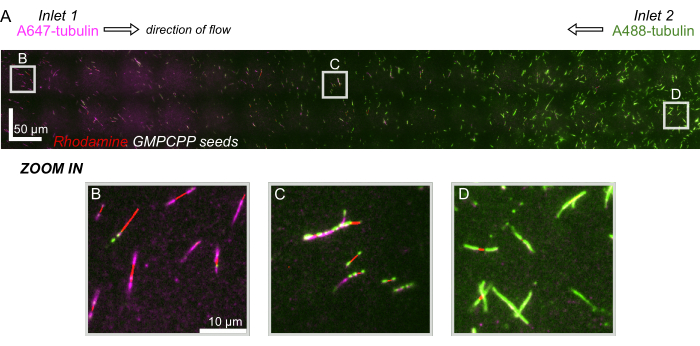
الشكل 8: إظهار تدرج البروتين في جهاز الموائع الدقيقة. تم نقل التوبولين المسمى AlexaFluor647 (أرجواني) في المدخل 1 ، وتم نقل التوبولين المسمى AlexaFluor488 (الأخضر) في المدخل 2 من الجهاز بتركيزات ومعدلات تدفق متساوية. تم تأرجح التدفق على / إيقاف تشغيله بزيادات 90 ثانية للسماح ببلمرة التوبولين من بذور GMPCPP المستقرة (الحمراء) مع تثبيط الخلط. (أ) طبقة نقطية واسعة النطاق مصنوعة من خياطة مجالات الرؤية (80 × 80 ميكرومتر) لحل طول الجهاز بالكامل. تحدد الرسائل الموقع النسبي لمجالات الرؤية الفردية في اللوحات اللاحقة. شريط المقياس هو 50 ميكرومتر في الموضع X و Y. (ب) مجال الرؤية بالقرب من المدخل 1 للجهاز ، حيث تتكون الامتدادات في الغالب من الأنابيب المسماة A647. (ج) مجال الرؤية بالقرب من منتصف الجهاز ، حيث تتكون الامتدادات من خليط من الأنابيب المصنفة ، كما هو متوقع. (د) مجال الرؤية بالقرب من الجزء السفلي من الجهاز ، حيث تتكون الامتدادات في الغالب من الأنابيب المسماة A488. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
يظهر مخطط تدفق العملية (PFD) للإعداد التجريبي للموائع الدقيقة على المجهر في الشكل التكميلي 1.
الشكل التكميلي 1: مخطط تدفق العملية (PFD) للإعداد التجريبي للموائع الدقيقة على المجهر. الرجاء النقر هنا لتنزيل هذا الملف.
فيديو تكميلي 1. يمكن استخدام إعداد الموائع الدقيقة لثني الأنابيب الدقيقة المستقرة. يتم ثني الأنابيب الدقيقة في حالة الراحة بعد الاستقرار باستخدام باكليتاكسيل أثناء التدفق النابض. ضغط ثابت في المنبع يبلغ 30 ملي بار يقود التدفق. معدل تشغيل الفيديو 10 إطارات في الثانية. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 1: ملف CAD لتصميم قناع الموائع الدقيقة. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
كان الهدف الأساسي من هذا البروتوكول هو تصميم وتصنيع جهاز ميكروفلويديك مناسب للتحقيق في ميكانيكا الأنابيب الدقيقة في المختبر. استند التصميم إلى الرغبة في الاستفادة من الفوائد الجوهرية للأجهزة الموائع الدقيقة القائمة على PDMS مع تضمين مجموعة من الميزات التي من شأنها تمكين تجربة قوية وقابلة للتخصيص عالية الإنتاجية.
وقد تحقق هذا الهدف بنجاح، مما أدى إلى بروتوكولات تصنيع ومبادئ توجيهية عامة يمكن أن تكون بمثابة أساس للمستخدمين المستقبليين لهذا النظام. يؤدي إدراج مصائد الفقاعات الزائدة عن الحاجة في الجهاز إلى تقليل احتمالية تمسخ البروتين بسبب وجود فقاعات الهواء. بينما لا يزال لدينا بعض فصل الأنابيب وإعادة توصيلها في الجهاز ، فإن مصائد الفقاعات هذه تقلل من احتمالية الفشل التجريبي. يمكن أن تؤدي التحسينات المستقبلية لإعداد الموائع الدقيقة إلى تقليل كمية التلاعب بالأنابيب اليدوية التي يتم إجراؤها أثناء التجربة. علاوة على ذلك ، فإن دمج جهاز الموائع الدقيقة مع برنامج التحكم الآلي في التدفق يسمح بتخصيص كبير للظروف التجريبية مع تقليل احتمالية حدوث خطأ يدوي. لقد أظهرنا الأداء الناجح للجهاز من خلال تصنيع الجهاز ثم زراعة امتدادات الأنابيب الدقيقة وتثبيتها وثنيها في الجهاز باستخدام التدفق التلقائي المنظم بواسطة وحدة التحكم. علاوة على ذلك ، من خلال إنشاء تدرج لمحاليل التوبولين المميزة ذات العلامات الفلورية داخل نفس الجهاز ، أظهرنا أنه يمكن تشغيل شروط متعددة في وقت واحد في جهاز واحد. بمساعدة تقنيات النمذجة والتحليل الحسابية ، يمكن لنظامنا فحص وتحديد الخصائص الميكانيكية الحيوية للأنابيب الدقيقة ، مثل صلابة الانحناء52،56،57،58،59.
ومن شأن التحسينات المستقبلية المحتملة أن تيسر نظاما أكثر قوة وما يرتبط به من تحليل تجريبي. أولا ، كان ترسيب مقاومة الضوء والتعرض والخبز من المعلمات الحاسمة التي أظهرت بعض التباين. تتطلب أحجام الميزات الطويلة نسبيا لمقاومة الضوء SPR تسخينا وتبريدا تدريجيا للغاية لمنع التشقق الحراري ، مما قد يؤدي إلى تدمير الأجهزة. أثناء محاولة استخدام أجهزة أرق ، وجدنا مشكلات في التلاعب بأحجام الميزات الأصغر هذه. يعد الاهتمام بالتفاصيل والصبر أمرا بالغ الأهمية لتكرار الأجهزة بهذا السماكة باستخدام مقاومة الضوء SPR. يمكن استخدام مقاومات ضوئية مختلفة لحل هذه المشكلة ، اعتمادا على التوافر.
مجتمعة ، يسمح جهاز الموائع الدقيقة والبروتوكول هنا بمجموعة من الإعدادات التجريبية ذات قدرات اختبار أكثر قوة وعالية الإنتاجية من فحوصات خلايا التدفقالسابقة 47. علاوة على ذلك ، يمكن أتمتة التجارب باستخدام وحدات التحكم في التدفق للحفاظ على ملفات تعريف التدفق الدقيقة أو تدرجات التركيز في الجهاز ، مما يقلل من التباين المتأصل في المستخدمين اليدويين. تشمل التطبيقات المحتملة المستقبلية لهذا الإعداد التحقيق في تأثيرات البروتينات المرتبطة بالأنابيب الدقيقة على صلابة انحناء الأنابيب الدقيقة ، والديناميكيات ، وتلف الشبكة ، والإصلاح ، بالإضافة إلى التفاعلات الميكانيكية الحيوية للأنابيب الدقيقة وخيوط الأكتين54،60،61،62،63،64،65،66،67،6869،70. يؤدي دمج التصنيع الدقيق والتحكم الآلي في التدفق وتقنيات النمذجة والتحليل الحسابية إلى إنشاء نظام متعدد الاستخدامات مناسب لدراسة الهيكل الخلوي في المختبر.
Disclosures
لا يوجد تضارب في المصالح بين المؤلفين. يكشف المؤلفون عن استخدام ChatGPT-4o OpenAI لمراجعة النص والتدقيق اللغوي.
Acknowledgements
نحن ممتنون للدعم والموارد التي قدمها معهد فاندربيلت للعلوم والهندسة النانوية (VINSE) ، حيث تم إجراء جزء من هذا البحث. تم تمويل هذا العمل جزئيا من خلال منحة NIH NIGMS إلى M. Zanic (R35 GM1192552) ومنحة NSF ID 2018661 إلى M. Zanic. تلقى M. Rogers دعما من منحة GM08320 من NIH T32 وجائزة تمويل تجريبي VINSE. L. Richardson مدعوم من قبل NSF GRFP Grant No. 1937963. يود المؤلفون أيضا أن يشكروا الدكتورة أليس ليتش وديفيد شافر والدكتورة كريستينا ماكجاهان ومختبر زانيك بأكمله على مساعدتهم ودعمهم.
Materials
| Name | Company | Catalog Number | Comments |
| 0.6 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mm standard biopsy punch | Integra LifeSciences | 33-31A-P/25 | |
| 100x/1.49 numerical aperture TIRF objective | Nikon | ||
| 22 x 22 mm glass coverslips | ThorLabs | CG15CH | |
| 3" single side polished silicon wafers | University Wafer | 447 | |
| 4" Petri dish | Any brand | ||
| 450 µL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter, Inc. | 345843 | Referred to as 'airfuge tube' in the protocol |
| 488-, 561, and 640-nm solid state lasers | Nikon | ||
| A-95 Fixed-Angle Rotor | Beckman Coulter, Inc. | 347595 | |
| Acetone | Any brand | ||
| Airfuge Air-Driven Ultracentrifuge | Beckman Coulter, Inc. | 347854 | Referred to as 'airfuge' in the protocol |
| Alexa Fluor 488 Microscale Protein Labeling Kit | Thermo Fisher Scientific | A30006 | |
| Aluminum foil | Any brand | ||
| Andor iXon Ultra EM-CCD | Nikon | ||
| Andor NEO sCMOS | Nikon | ||
| AutoCAD | Autodesk | Generic versions can be used | |
| Bovine brain unlabeled tubulin (purified) | N/A | Made in house, but can be purchased | |
| Casein | MilliporeSigma | C7078 | |
| Catalase | MilliporeSigma | C9322 | |
| Clean Dry Air (CDA) (pressurized gas) | Any brand | ||
| Compressed air supply | Any brand | Connects to the microfluidic flow controller | |
| COMSOL Multiphysics software | COMSOL, Inc. | ||
| Custom brass stage adapter | N/A | Made in house to fit our 22 mm x 22 mm coverslips onto the microscope | |
| De-ionized water | Any brand | ||
| Dessicator | Any brand | ||
| D-glucose | MilliporeSigma | G7528 | |
| Dithiothreitol (DTT) | MilliporeSigma | D0632 | |
| EGTA | MilliporeSigma | 324626 | |
| Elveflow Smart Interface (ESI) software | Elveflow | ||
| Flangeless PFA fittings with ETFE ¼”-28 to 1/16” outer diameter ferrules | Darwin Microfluidics | CIL-XP-245X | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack |
| Fluiwell 4-Channel 2 mL Low Pressure | Fluigent | 14002001 | Used to connect the flow control system to the the micrewtubes. Also refered to as 'pressurized reservoir rack' |
| Fume hood | Any brand | ||
| Glucose oxidase | MilliporeSigma | G6125 | |
| GMPCPP | Jena Bioscience | NU-405L | |
| Guanosine triphosphate (GTP) | MilliporeSigma | G8877 | |
| Hot plate | Any brand | ||
| HS-625 high-speed emission filter wheel | Finger Lakes Instrumentation | ||
| ImageJ software | N/A | Open access | |
| Incubator | Any brand | ||
| Isopropyl alcohol | Any brand | ||
| Karl Suss MA-6 mask aligner | SUSS MicroTec | ||
| Magnesium chloride | MilliporeSigma | 1.05833 | |
| MATLAB software | MathWorks | ||
| MEGAPOSIT SPR 220 7.0 photoresist | Dow, Inc. | ||
| Microfluidic Fittings 6-40 to 1/4"-28 Adapters Kit | Darwin Microfluidics | LVF-KFI-08 | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack (Fluiwell rack) |
| Microfluidic Fittings Female Luer Lock Adapter Kit | Darwin Microfluidics | LVF-KFI-04 | Used to connect the syringe to the tubing |
| Microfluidic flow controller | Elveflow | OB1 MK3+ | |
| Microfluidic flow sensor | Elveflow | MFS3 | This flow sensor range is 0-80 μL |
| MICROPOSIT MF-319 developer | Dow, Inc. | ||
| Microscope | Nikon | Eclipse Ti | |
| NIS-Elements software | Nikon | ||
| Nitrogen (pressurized gas) | Any brand | ||
| Objective heater | Tokai Hit | ||
| One-Piece Fingertight 10-32 Coned Fitting for 1/16" OD Tubing | Darwin Microfluidics | CIL-F-120X | Used to connect the syringe to the tubing |
| Paclitaxol (Taxol) | Tocris Bioscience | 1097 | |
| Photolithography masks | N/A | Made by an external party using our designs | |
| PIPES | Thermo Fisher Scientific | 172615000 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Plasma flowmeter system | Harrick Plasma | PDC-FMG | Integrates with plasma cleaner to enable flow control of pressurized gas |
| Plastic bulb pipet | Any brand | ||
| Pluoronic F-127 | MilliporeSigma | P2443 | Referred to as 'poloxomer 407' in the protocol |
| Potassium chloride | Research Products International | P41000 | |
| Saint Gobain Performance Plastics Tube Tygon .020 ID | Thermo Fisher Scientific | 50-206-8921 | Refered to as '1.5 mm tubing' and 'tubing' in the protocol |
| Scalpel | Any brand | ||
| Spin coater | Cost Effective Equipment, LLC. | 200x | This model may be discontinued |
| Standard pipets and tip sets | Any brand | ||
| Standard plastic syringe | Any brand | We used a 10 mL Luer-slip syringe | |
| Sylgard 184 silicone elastomer kit | Dow, Inc. | Referred to as 'PDMS' and 'curing agent' in the protocol | |
| T339 Micrewtube with Lip Seal and Flat Screw Cap | Medline Industried, LP. | T339 | Referred to as 'source vial' in the protocol. We used both 0.5 mL and 1.5 mL sizes |
| TAMRA, SE; 5-(and-6)-Carboxytetramethylrhodamine, Succinimidyl Ester | Invitrogen | C1171 | Referred to as 'TTR' in the protocol |
| Trichloro(1H, 1H, 2H, 2H-perfluorooctyl) silane | MilliporeSigma | 448931 | |
| Trion Phantom RIE ICP | Trion Technology, Inc. | This plasma cleaner is only used in Step 1.1 of the protocol. Another plasma cleaner, like the one used for PDMS bonding, can be used instead; we just prefer the much lower vacuum achievable by this system for cleaning the silicon wafer | |
| TRITC Polyclonal Antibody | Thermo Fisher Scientific | A6397 | Referred to as 'anti-rhodamine antibody' in the protocol |
| Tweezers | Any brand | ||
| Vacuum pump | Any brand |
References
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Phys Today. 54 (6), 42(2001).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev Mod Phys. 77, 977(2005).
- Beebe, D. J., Mensing, G. A., Walker, G. M. Physics and applications of microfluidics in biology. Annu Rev Biomed Eng. 4, 261-286 (2002).
- Ng, J. M. K., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. Electrophoresis. 23 (20), 3461-3473 (2010).
- Dellaquila, A. Five Short Stories on The History of Microfluidics. , https://www.elveflow.com/microfluidic-reviews/general-microfluidics/history-of-microfluidics/ (2025).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: Microfluidics in drug discovery. Nat Rev Drug Discov. 5 (3), 210-218 (2006).
- Neužil, P., Giselbrecht, S., Länge, K., Huang, T. J., Manz, A. Revisiting lab-on-a-chip technology for drug discovery. Nat Rev Drug Discov. 11 (8), 620-632 (2012).
- Manz, A., Graber, N., Widmer, H. M. Miniaturized total chemical analysis systems: a novel concept for chemical sensing. Sens Actuators B: Chem. 1 (1-6), 244-248 (1990).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Knight, J. Microfluidics: Honey, I shrunk the lab. Nature. 418 (6897), 474-475 (2002).
- Photolithographic fabrication techniques for transistors which are an integral part of a printed circuit. Nall, J. R., Lathrop, J. W. 1957 International Electron Devices Meeting, Washington, DC, USA, , (1957).
- Rogers, M. The design and fabrication of a two-layer microfluidic device for studying microtubules in vitro [Master's Thesis]. , Vanderbilt University. Nashville, TN. (2022).
- Lee, J. B., Choi, K. H., Yoo, K. Innovative SU-8 lithography techniques and their applications. Micromachines. 6 (1), 1-18 (2015).
- Kim, P., et al. Soft lithography for microfluidics: A Review. Biochip J. 2 (1), 1-11 (2008).
- Venkatesan, S. u, Jerald, J., Asokan, P., Prabakaran, R. A Comprehensive Review on Microfluidics Technology and its Applications. Recent Advances in Mechanical Engineering. , Springer. Singapore. 235-245 (2020).
- Minteer, S. Microfluidic Techniques: Reviews and Protocols. , Humana Press. New Jersey. (2006).
- Mitra, S. K., Chakraborty, S. Microfluidics and Nanofluidics Handbook: Fabrication, Implementation, and Applications. , Taylor and Francis Group. Florida. (2016).
- Alberts, B., et al. Molecular Biology of the Cell. , Garland Science. New York. (2014).
- Howard, J. Mechanics of Motor Proteins and the Cytoskeleton. , Springer. Heidelberg. (2001).
- Hawkins, T., Mirigian, M., Selcuk Yasar, M., Ross, J. L. Mechanics of microtubules. J Biomech. 43 (1), 23-30 (2010).
- Gardel, M. L., Kasza, K. E., Brangwynne, C. P., Liu, J., Weitz, D. A. Chapter 19: Mechanical Response of Cytoskeletal Networks. Methods Cell Biol. 89, 487-519 (2008).
- Caporizzo, M. A., Prosser, B. L. The microtubule cytoskeleton in cardiac mechanics and heart failure. Nat Rev Cardiol. 19 (6), 364-378 (2022).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nat Mater. 14 (11), 1156-1163 (2015).
- Chu, S. H., et al. A microfluidic device for in situ fixation and super-resolved mechanosensation studies of primary cilia. Biomicrofluidics. 13 (1), 014105(2019).
- Geisterfer, Z. M., Zhu, D. Y., Mitchison, T. J., Oakey, J., Gatlin, J. C. Microtubule growth rates are sensitive to global and local changes in microtubule plus-end density. Curr Biol. 30 (15), 3016-3023 (2020).
- Schaedel, L., et al. Lattice defects induce microtubule self-renewal. Nat Phys. 15 (8), 830-838 (2019).
- Aher, A., et al. CLASP mediates microtubule repair by restricting lattice damage and regulating tubulin incorporation. Curr Biol. 30 (11), 2175-2183 (2020).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. ELife. 5, e13470(2016).
- Fourniol, F. J., et al. Micropattern-guided assembly of overlapping pairs of dynamic microtubules. Methods Enzymol. 540, 339-360 (2014).
- Vleugel, M., Roth, S., Groenendijk, C. F., Dogterom, M. Reconstitution of basic mitotic spindles in spherical emulsion droplets. J Vis Exp. (114), e54278(2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Mol Biol Cell. 27 (22), 3563-3573 (2016).
- VanDelinder, V., Brener, S., Bachand, G. D. Mechanisms underlying the active self-assembly of microtubule rings and spools. Biomacromolecules. 17 (3), 1048-1056 (2016).
- Roth, S., Gârlea, I. C., Vleugel, M., Mulder, B. M., Dogterom, M. Reconstitution of basic mitotic spindles in cell-like confinement. bioRxiv. , (2019).
- Xu, Z., et al. Microtubules acquire resistance from mechanical breakage through intralumenal acetylation. Science. 356 (6335), 328-332 (2017).
- Fanalista, F., et al. Shape and size control of artificial cells for bottom-up biology. ACS Nano. 13 (5), 5439-5450 (2019).
- Velve-Casquillas, G., Costa, J., Carlier-Grynkorn, F., Mayeux, A., Tran, P. T. A fast microfluidic temperature control device for studying microtubule dynamics in fission yeast. Methods Cell Biol. 97, 185-201 (2010).
- Portran, D., Schaedel, L., Xu, Z., Théry, M., Nachury, M. V. Tubulin acetylation protects long-lived microtubules against mechanical ageing. Nat Cell Biol. 19 (4), 391-398 (2017).
- Huang, Y. M., Uppalapati, M., Hancock, W. O., Jackson, T. N. Microtubule transport, concentration and alignment in enclosed microfluidic channels. Biomed Microdevices. 9 (2), 175-184 (2007).
- Uppalapati, M., Huang, Y., Shastry, S., Jackson, T. N., Hancock, W. O. Microtubule Motors in Microfluidics. Methods in Bioengineering: Microfabrication and Microfluidics. , Artech House Publishers. Boston, MA. (2009).
- Sung, J. H., Shuler, M. L. Prevention of air bubble formation in a microfluidic perfusion cell culture system using a microscale bubble trap. Biomed Microdevices. 11 (4), 731-738 (2009).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360(2019).
- Nakayama, T., et al. Circumventing air bubbles in microfluidic systems and quantitative continuous-flow PCR applications. Anal Bioanal Chem. 386 (5), 1327-1333 (2006).
- Park, S., Cho, H., Kim, J., Han, K. -H. Lateral degassing method for disposable film-chip microfluidic devices. Membranes. 11 (5), 316(2021).
- Pereiro, I., Fomitcheva Khartchenko, A., Petrini, L., Kaigala, G. V. Nip the bubble in the bud: A guide to avoid gas nucleation in microfluidics. Lab Chip. 19 (14), 2296-2314 (2019).
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biol. 95, 221-245 (2010).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: Information from a slowly hydrolyzable analogue, GMPCPP. Mol Biol Cell. 3 (10), 1155-1167 (1992).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bartlett, N. W., Wood, R. J. Comparative analysis of fabrication methods for achieving rounded microchannels in PDMS. J Micromech Microeng. 26 (11), 115013(2016).
- Yang, C. P. H., Horwitz, S. B. Taxol®: The first microtubule stabilizing agent. Int J Mol Sci. 18 (8), 1733(2017).
- Gittes, F., Mickey, B., Nettleton, J., Howard, J. Flexural rigidity of microtubules and actin filaments measured from thermal fluctuations in shape. J Cell Biol. 120 (4), 923-934 (1993).
- VanBuren, V., Cassimeris, L., Odde, D. J. Mechanochemical model of microtubule structure and self-assembly kinetics. Biophys J. 89 (5), 2911-2926 (2005).
- Dye, R. B., Fink, S. P., Williams, R. C. Taxol-induced flexibility of microtubules and its reversal by MAP-2 and Tau. J Biol Chem. 268 (10), 6847-6850 (1993).
- Drechsel, D. N., Kirschnert, M. W. The minimum GTP cap required to stabilize microtubules. Curr Biol. 4 (12), 1053-1061 (1994).
- Wisanpitayakorn, P., Mickolajczyk, K. J., Hancock, W. O., Vidali, L., Tüzel, E. Measurement of the persistence length of cytoskeletal filaments using curvature distributions. Biophys J. 121 (10), 1813-1822 (2022).
- Mickey, B., Howard, J. Rigidity of microtubules is increased by stabilizing agents. J Cell Biol. 130 (4), 909-917 (1995).
- Brangwynne, C. P., et al. Bending dynamics of fluctuating biopolymers probed by automated high-resolution filament tracking. Biophys J. 93 (1), 346-359 (2007).
- Venier, P., Maggs, A. C., Carlier, M. F., Pantaloni, D. Analysis of microtubule rigidity using hydrodynamic flow and thermal fluctuations. J Biol Chem. 269 (18), 13353-13360 (1994).
- Felgner, H., Frank, R., Schliwa, M. Flexural rigidity of microtubules measured with the use of optical tweezers. J Cell Sci. 109 (Pt 2), 509-516 (1996).
- Felgner, H., et al. Domains of neuronal microtubule-associated proteins and flexural rigidity of microtubules. J Cell Biol. 138 (5), 1067-1075 (1997).
- Nishida, K., et al. Effects of three microtubule-associated proteins (MAP2, MAP4, and Tau) on microtubules' physical properties and neurite morphology. Sci Rep. 13, 8870(2023).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Brouhard, G. J., Rice, L. M. Microtubule dynamics: An interplay of biochemistry and mechanics. Nat Rev Mol Cell Biol. 19 (7), 451-463 (2018).
- Lawrence, E. J., Chatterjee, S., Zanic, M. More is different: Reconstituting complexity in microtubule regulation. J Biol Chem. 299 (12), 105398(2023).
- Howard, J., Hyman, A. A. Dynamics and mechanics of the microtubule plus end. Nature. 422 (6933), 753-758 (2003).
- Mehidi, A., Aumeier, C. Regulation of the microtubule network; the shaft matters. Curr Opin Syst Biol. 34, 100457(2023).
- Verhey, K. J., Ohi, R. Causes, costs and consequences of kinesin motors communicating through the microtubule lattice. J Cell Sci. 136 (5), jcs260735(2023).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nat Rev Mol Cell Biol. 20 (1), 38-54 (2019).
- Théry, M., Blanchoin, L. Microtubule self-repair. Curr Opin Cell Biol. 68, 144-154 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved