Method Article
Développement d’une approche basée sur la microfluidique pour l’étude de la mécanique des polymères de microtubules
Dans cet article
Résumé
Ce protocole détaille la conception et la fabrication d’un dispositif microfluidique adapté à l’étude de la mécanique des polymères de microtubules. La synthèse de techniques de microfabrication, de contrôle automatisé des flux et de modélisation informatique permet d’obtenir un système flexible parfaitement adapté à l’exploration du cytosquelette cellulaire in vitro.
Résumé
Dans ce protocole, nous décrivons la conception et la fabrication d’un dispositif microfluidique développé pour l’étude de la mécanique des polymères de microtubules. La conception utilise les avantages intrinsèques des dispositifs microfluidiques à base de polydiméthylsiloxane (PDMS) et introduit plusieurs caractéristiques pour permettre une approche expérimentale à haut débit robuste et personnalisable. Le dispositif développé intègre des capacités redondantes de piégeage des bulles pour éviter l’apparition de bulles d’air nuisibles. De plus, l’appareil s’interface avec un système de contrôle de flux automatisé afin de réduire les interventions manuelles et de permettre des analyses à haut débit. Un logiciel de simulation commercial est utilisé pour mieux développer et comprendre le transport des fluides à l’aide de ce système. Enfin, nous démontrons la capacité de mener plusieurs expériences simultanément au sein d’un seul dispositif en cultivant des extensions de microtubules avec des étiquettes fluorescentes distinctes dans différentes sections du dispositif. Dans l’ensemble, ce système d’écoulement microfluidique peut être utilisé pour sonder la mécanique des polymères de microtubules et apporte des améliorations à la conception expérimentale pour des études in vitro plus larges de microtubules. La synthèse d’approches de microfabrication, de contrôle automatisé des flux et de modélisation informatique permet d’obtenir un système flexible parfaitement adapté à l’exploration du cytosquelette cellulaire in vitro.
Introduction
La microfluidique permet un contrôle précis de volumes de fluide minuscules, souvent inférieurs à un microlitre, grâce à la conception et à la fabrication complexes de canaux d’écoulement de fluide 1,2. La petite échelle des dispositifs microfluidiques donne lieu à des phénomènes d’ingénierie uniques. À savoir, le nombre de Reynolds - une mesure sans dimension du rapport entre les forces d’inertie et visqueuses dans l’écoulement des fluides - est petit, généralement de l’ordre de O(10) ou inférieur en microfluidique, soulignant l’importance des forces visqueuses dans les dispositifs microfluidiques. De plus, le nombre de Péclet, qui compare le transport convectif au transport diffusif, montre que le transport convectif est généralement négligeable en microfluidique 3,4,5. Ce régime d’écoulement laminaire piloté par diffusion en microfluidique est avantageux, car il prend en charge des expériences parallèles sur un seul appareil en maintenant des gradients de fluide précis.
La photolithographie reste la principale méthode de fabrication de dispositifs microfluidiques 6,7,8. En bref, ce processus implique la création d’un modèle gravé « maître » de la conception microfluidique (Figure 1). Un substrat photosensible est préparé et un photomasque de conception microfluidique expose sélectivement les zones de photorésine au rayonnement ultraviolet. Les méthodes de gravure ultérieures développent le substrat, produisant un relief du motif. Le polydiméthylsiloxane (PDMS) est souvent coulé et durci sur le maître. Le PDMS durci, qui adopte les caractéristiques négatives de la conception, est ensuite retiré du maître et collé à une lamelle de recouvrement en verre. L’ensemble de ce processus de fabrication prend généralement 1 à 2 jours, ce qui permet des itérations de conception rapides et la production de plusieurs appareils. Des revues détaillées des procédés de lithographie douce et de microfabrication sont disponibles dans d’autres références 1,2,3,10,11,12,13.
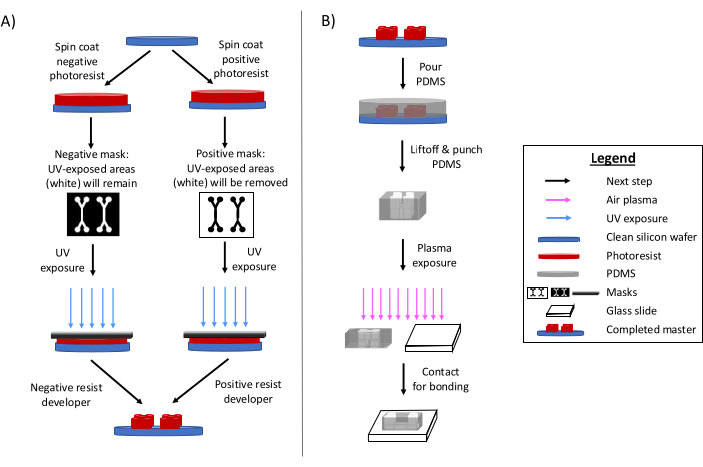
Figure 1 : Aperçus du processus traditionnel de photolithographie et du processus de microfabrication. (A) Procédé de photolithographie traditionnel et (B) Processus de microfabrication. En fonction de l’application et des caractéristiques de photorésine souhaitées, une résine photosensible négative ou positive peut être utilisée, même si elles donnent le même maître de conception. Des caractéristiques telles que la hauteur souhaitée ou la température de fusion de la résine photosensible aident à déterminer le type de résine photosensible approprié. Cette figure a été modifiée avec la permission de Rogers (2022)14. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’utilisation de la microfluidique a élargi les possibilités dans de nombreux domaines de recherche, son impact le plus récent étant dans les sciences biologiques. Compte tenu de sa petite échelle, la microfluidique permet de gérer avec précision des ressources limitées et précieuses telles que les cellules ou les protéines. Encore plus percutante est la capacité des systèmes microfluidiques à imiter les conditions physiologiques, telles que les modifications de la rigidité du substrat, l’exercice d’une force sur un échantillon et même l’intégration d’un courant électrique. De plus, l’utilisation de la microfluidique offre la possibilité de manipuler plusieurs réactifs en parallèle et de prototyper rapidement et d’affiner de manière itérative la conception des systèmes. Ces fonctionnalités permettent de miniaturiser l’ensemble des flux de travail du laboratoire sur un seul appareil, communément appelé « lab-on-a-chip »1,6,9,15,16,17,18,19.
L’une des applications de la microfluidique en biologie cellulaire est l’étude des polymères de microtubules. Les microtubules sont un composant essentiel du cytosquelette de la cellule, jouant un rôle essentiel dans des processus tels que la division cellulaire et le transport de marchandises intracellulaires20,21. En tant qu’élément le plus rigide du cytosquelette, les microtubules présentent un module d’élasticité comparable à celui du plexiglas22,23. Leurs propriétés mécaniques robustes sont cruciales pour diverses fonctions cellulaires, y compris, par exemple, la contraction des cardiomyocytes, où ils se plient et se détendent cycliquement pendant les phases systolique et diastolique24 du cœur. Des dispositifs microfluidiques ont déjà été adoptés pour étudier les propriétés des microtubules et de leurs structures d’ordre supérieur in vitro. En effet, la microfluidique a été utilisée pour sonder la dynamique de polymérisation des microtubules, les interactions microtubules-microtubules et les effets des protéines associées aux microtubules sur les propriétés mécaniques des microtubules 25,26,27,28,29,30,31,32,33,34,35 ,36,37,38,39,40,41.
Bien que l’introduction de la microfluidique dans le domaine des microtubules ait donné lieu à de nombreuses découvertes passionnantes, l’adaptation de ces dispositifs à la recherche sur les microtubules peut encore être améliorée. Dans ce travail, nous abordons deux limites spécifiques qui persistent dans l’étude des microtubules dans les dispositifs microfluidiques : le potentiel de formation de bulles d’air à l’intérieur du dispositif, généralement introduit par la manipulation manuelle des dispositifs microfluidiques, et la sous-utilisation des tests à haut débit. Tout d’abord, les manipulations manuelles, telles que le bouchage et le débouchage des tubes, peuvent introduire la formation de bulles dans les canaux. La formation de bulles d’air à l’intérieur d’une cellule d’écoulement est catastrophique, car les bulles d’air peuvent dénaturer les protéines, cisailler les polymères de microtubules et nuire aux cultures cellulaires42,43. De plus, les angles vifs et les angles obliques de l’appareil entraînent un mouillage non uniforme de la surface, ce qui augmente la possibilité d’entraînement d’air. De nombreuses techniques ont été développées pour réduire la formation, la persistance et l’impact des bulles d’air ; Cependant, l’utilisation de méthodes d’atténuation des bulles n’est pas universelle 42,43,44,45,46. De plus, bien que l’un des principaux avantages de l’utilisation de la microfluidique soit la capacité d’expérimentation à haut débit, la microfluidique n’a pas encore été utilisée pour intensifier la recherche sur les microtubules. Les dispositifs microfluidiques peuvent être conçus pour tester plusieurs conditions expérimentales en parallèle sur le même appareil. Par exemple, les gradients de fluide peuvent être utilisés pour diriger le flux de différentes protéines ou médicaments associés aux microtubules, ce qui permet leur administration ciblée vers des régions spécifiques de microtubules cloisonnés au sein du même dispositif.
Ici, nous avons conçu de manière itérative un dispositif microfluidique qui répond à ces limitations. Nous fournissons le protocole étape par étape de la fabrication du dispositif, permettant ainsi à un public plus large d’utiliser la technologie microfluidique dans leurs recherches sur les microtubules. Cette conception de l’appareil intègre des fonctions de piégeage des bulles et utilise un système de contrôle de flux automatisé pour réduire les interventions manuelles tout en permettant des gradients de solutions dans l’appareil pour des analyses à haut débit. En résumé, le développement de cette conception microfluidique peut faciliter la recherche et la compréhension plus larges de la mécanique des microtubules tout en apportant des améliorations précieuses aux conceptions expérimentales dans le domaine plus large de la recherche sur les microtubules.
Protocole
REMARQUE : Les travaux détaillés dans cette partie du protocole ont été effectués dans la salle blanche de classe 100 du Vanderbilt Institute of Nanoscale Science and Engineering (VINSE). Une salle blanche contrôlée avec une blouse appropriée et un éclairage filtré UV est souhaitée pour éviter d’endommager l’appareil en raison de l’humidité et de l’éclairage ambiant et pour éviter la contamination par les particules. Toutes les manipulations sur les plaquettes de silicium doivent être effectuées avec la face polie de la plaquette de silicium vers le haut. Utilisez une pince à épiler lorsque vous manipulez des plaquettes et minimisez les surfaces de contact de la plaquette pour éviter les rayures. Conservez les hosties dans des boîtes de Pétri avec les couvercles couverts lors du transport et à la fin de chaque journée, sauf indication contraire.
1. Photolithographie (6 - 8 h)
- Nettoyez au plasma une plaquette de silicium de 3 pouces pendant 5 minutes sous vide (idéalement, pression de vide < 5 × 10-5 torr) en utilisant du plasma d’oxygène (O2) ou d’air propre et sec (CDA).
- Centrez la plaquette de silicium sur un revêtement rotatif pour le dépôt de la résine photosensible.
- Déposez ~1 à 2 ml de résine photosensible SPR 220 7.0 au centre de la plaquette de silicium.
ATTENTION : Manipulez photoresist avec des gants et des lunettes de protection et jetez-le conformément aux protocoles spécifiques au fabricant/site. - Appliquez une couche de rotation sur la résine photosensible sur la plaquette de silicium à l’épaisseur souhaitée en fonction des courbes de rotation du fabricant. Générez des couches de ~13 μm d’épaisseur en tournant à 1000 tr/min pendant 30 s. Plus tard, nettoyez la résine photosensible résiduelle sur l’enrobeur d’essorage avec de l’acétone et jetez-la conformément aux protocoles spécifiques au site.
REMARQUE : Si, après le revêtement par centrifugation, la plaquette n’est pas uniformément recouverte de résine photosensible, répétez les étapes 1.2-1.4. Un revêtement non uniforme peut être dû à une plaquette non centrée sur la machine de revêtement par centrifugation, à l’utilisation d’une résine photosensible insuffisante et/ou au fait de ne pas déposer la résine photosensible au centre de la plaquette. - Tout en touchant le moins possible la résine photosensible sur la plaquette, transférez la plaquette de silicium sur une plaque chauffante réglée à 70 °C.
- Incuber la plaquette de silicium sur la plaque chauffante, en augmentant la température de 10 °C toutes les 3 à 5 minutes jusqu’à ce que la température atteigne 115 °C.
- Éteignez la plaque chauffante et laissez refroidir la plaquette de silicone jusqu’à ce que sa température soit inférieure à 65 °C.
REMARQUE : Les étapes de chauffage et de refroidissement sont effectuées lentement pour éviter la fissuration thermique de la résine photosensible, qui est courante à cette épaisseur. Si des fissures thermiques se produisent, elles peuvent généralement être corrigées en réchauffant la plaquette de silicium et en ralentissant le taux de refroidissement. - À l’aide d’une pince, transférez la plaquette de silicium refroidie dans un aligneur de masque et chargez la plaquette de silicium et un photomasque correspondant dans l’aligneur de masque en suivant les protocoles spécifiques au fabricant/site.
REMARQUE : les photomasques ont été fabriqués par une partie externe à l’aide d’un design spécifié, créé avec AutoCAD. Voir le fichier supplémentaire 1 pour le rendu de la conception du masque. - Exposez la plaquette de silicium aux rayons ultraviolets (UV) pendant une durée spécifique (en fonction de la puissance de la lampe UV) en suivant les protocoles spécifiques au fabricant/site. L’énergie souhaitée pour cette application est de ~400 mJ/cm2, et calculer le temps d’exposition à l’aide de la formule :
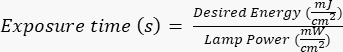 .
. - Après l’exposition, retirez la plaquette de silicium de l’aligneur du masque et laissez la résine photosensible se réhydrater pendant 4 h par circulation d’air. Assurez-vous que le couvercle de la boîte de Pétri est laissé éteint pour permettre la circulation de l’air, mais placez la boîte dans un endroit peu susceptible d’être exposé aux particules.
REMARQUE : Une pause de 4 heures peut être prise pendant ce temps de réhydratation, mais il est recommandé de poursuivre la procédure le même jour. - Après 4 h de réhydratation, transférez la plaquette exposée sur une plaque chauffante réglée à 70 °C.
- Incuber la plaquette de silicium sur la plaque chauffante, en augmentant la température de 10 °C toutes les 3 à 5 minutes jusqu’à ce que la température atteigne 115 °C.
- Laisser incuber la plaquette à 115 °C pendant 10 min.
- Créez un « couvercle » isolant pour la plaquette exposée en moulant une feuille de papier d’aluminium en forme de couvercle de boîte de Pétri.
- Éteignez la plaque chauffante et couvrez la plaquette exposée avec le couvercle en papier d’aluminium. Laissez la gaufrette refroidir à température ambiante pendant la nuit.
REMARQUE : La fissuration thermique de la résine photosensible est beaucoup plus fréquente pendant l’étape d’incubation post-exposition, c’est pourquoi un refroidissement lent pendant la nuit est recommandé. Cela complète les étapes requises pour le premier jour de fabrication. Il est recommandé de passer à la section suivante le lendemain.
2. Développement (1 - 2 h)
- Lorsque vous êtes prêt à développer la plaquette exposée, procurez-vous un récipient propre et un révélateur photosensible approprié. Ici, le révélateur MF-319 est utilisé avec un conteneur dédié.
ATTENTION : Manipulez le révélateur avec des gants et des lunettes de protection, transférez le contenant en vrac dans un contenant secondaire et éliminez-le conformément aux protocoles spécifiques au fabricant ou au site. - Versez suffisamment de révélateur dans le récipient pour immerger complètement la plaquette exposée (le volume réel variera en fonction du récipient).
- Immergez la plaquette exposée dans le révélateur et attendez que toute la résine photosensible indésirable ait été dissoute. Le fait de remuer/agiter doucement le récipient facilite le développement jusqu’à ce qu’il y ait peu ou pas de résine photosensible résiduelle visible sur la plaquette, à l’exception de la conception du dispositif.
REMARQUE : Plusieurs changements de la solution de développement peuvent être nécessaires pour éliminer complètement la résine photosensible indésirable, en fonction du volume de solution de développement utilisé. - Retirez la plaquette développée de la solution de développement et rincez doucement les deux côtés de la plaquette avec de l’eau désionisée (DI) pendant 30 s.
- Séchez la plaquette développée avec de l’azote (N2) gazeux.
- Conservez la plaquette développée dans une boîte de Pétri dans un environnement sec et frais jusqu’à ce qu’elle soit prête à être utilisée ultérieurement. Enveloppez la boîte de Pétri dans du papier d’aluminium pour éviter la dégradation de la résine photosensible due à l’exposition à la lumière ambiante.
REMARQUE : Il est recommandé, mais non obligatoire, de passer à la section suivante le même jour.
3. Silanisation (1 - 2 h)
- Transférez la plaquette de silicium dans un dessiccateur.
- Placez un petit récipient en aluminium (ou un morceau de papier d’aluminium plié en forme de récipient) dans le dessiccateur.
- Pipeter 1 goutte (~50 μL) de silane trichlor(1H, 1H, 2H, 2H-perfluorooctyle) dans le récipient en aluminium.
ATTENTION : Manipulez la solution de silane avec des gants et des lunettes de protection et jetez-la conformément aux protocoles spécifiques au fabricant/site. - Fermez le dessiccateur et allumez l’aspirateur.
- Laisser la dessiccation/silanisation se produire pendant 1 à 2 h.
- Une fois le temps de silanisation terminé, éteignez l’aspirateur et récupérez la plaquette silanisée. Conservez la gaufrette silanisée dans une boîte de Pétri enveloppée de papier d’aluminium dans un environnement sec et frais jusqu’à ce qu’elle soit prête à être utilisée ultérieurement.
REMARQUE : Il peut être nécessaire de répéter périodiquement la silanisation sur les plaquettes et plus fréquemment sur les appareils où des couches plus minces de PDMS sont utilisées. Si une adhérence PDMS est remarquée lors du retrait du PDMS de la plaquette, il peut être nécessaire de resilaniser la plaquette, et cette section doit être répétée une fois que tous les PDMS ont été retirés de la plaquette. Les étapes requises pour la création de maîtres de dispositifs microfluidiques sont terminées. Les masters sont stables et les sections suivantes peuvent être exécutées si on le souhaite.
4. Dépôt PDMS (1 - 2 h)
REMARQUE : S’il y a des PDMS résiduels sur le maître d’une microfabrication précédente, les PDMS résiduels doivent être retirés avant de déposer de nouveaux PDMS.
- Sur une balance, peser dans un récipient PDMS et l’agent de durcissement associé dans un rapport de poids de 10:1. Le poids total requis variera en fonction de l’épaisseur du PDMS souhaitée et de la taille de la boîte de Pétri. Pour une boîte de Pétri de 4 pouces, ~20 g de PDMS et ~2 g d’agent de durcissement donneront une épaisseur de 2-3 mm.
ATTENTION : Manipulez la solution PDMS avec des gants et des lunettes de protection et jetez-la conformément aux protocoles spécifiques au fabricant/site. - Mélangez le PDMS et l’agent de durcissement dans le récipient pendant 5 min à l’aide d’une spatule en plastique ou d’un autre outil approprié.
- Transférez le récipient PDMS mixte dans un dessiccateur pour le dégazage.
- Fermez le dessiccateur et allumez l’aspirateur. Des bulles d’air commenceront à apparaître dans le PDMS.
- Laisser la dessiccation/dégazage se produire pendant 30 min. En fonction de la quantité de PDMS utilisée et de la forme du contenant, le temps réel peut varier ; un point final général est lorsque peu ou pas de bulles sont présentes dans le PDMS.
- Après le dégazage, éteignez l’aspirateur et récupérez le récipient PDMS.
- Versez le PDMS mélangé et dégazé sur le master dans une boîte de Pétri.
- Incuber le maître dans la boîte de Pétri fermée à 65 °C pendant la nuit pour permettre au PDMS de durcir complètement.
REMARQUE : Cela termine les étapes de dépôt PDMS. Il est recommandé de laisser le PDMS durcir dans un incubateur pendant la nuit. Le PDMS est alors stable, de sorte que les sections suivantes peuvent être exécutées si nécessaire.
5. Assemblage de l’appareil PDMS (1 - 2 h)
- Récupérez le(s) maître(s) de l’appareil qui ont durci le PDMS, une paire de pinces, un poinçon de biopsie standard de 1,5 mm avec un piston manuel et un scalpel/lame de rasoir.
ATTENTION : Manipulez la lame avec précaution et ne coupez jamais vers vous-même ou vers les autres. Une lame autorétractable ou de sécurité est recommandée. - Autour des fonctionnalités de l’appareil, découpez des morceaux rectangulaires de PDMS à partir du maître de couche. Assurez-vous que chaque pièce de PDMS dispose d’un peu d’espace de chaque côté, en flanquant les caractéristiques de l’appareil pour faciliter un bon contact de liaison tout en veillant à ce que chaque pièce s’adapte sur sa propre lamelle en verre de 22 mm × 22 mm.
REMARQUE : Il est important d’éviter de toucher la surface inférieure du PDMS (le côté avec les caractéristiques), alors manipulez toujours le PDMS par les bords à l’aide d’une pince à épiler. De plus, ne placez jamais le côté caractéristique du PDMS vers le bas sur une surface. Lorsqu’il n’est pas utilisé, rangez le PDMS avec le côté de la fonction vers le haut dans un récipient fermé jusqu’à ce que vous en ayez besoin. - Percez les trous d’entrée et de sortie dans les pièces du PDMS à l’aide d’un poinçon propre de 1,5 mm. Perforez le PDMS de l’appareil dans une couche de rechange de PDMS sacrificiel plutôt que dans une surface dure qui pourrait endommager la perforation.
- Récupérez et nettoyez une lamelle en verre de 22 mm × 22 mm avec une lingette imbibée d’alcool isopropylique (IPA).
- Nettoyez au plasma la lamelle de 22 mm × 22 mm pendant 5 min sous vide (pression < 0,5 Torr) à l’aide d’un plasma CDA. Cela permettra d’enlever tous les débris ou revêtements organiques sur la lamelle.
- Essuyez la lamelle en verre de 22 mm × 22 mm et le côté caractéristique du PDMS avec une lingette imbibée d’alcool IPA.
- Placez le PDMS (côté caractéristique vers le haut) et la lamelle en verre (le même côté vers le haut que celui nettoyé auparavant) dans le nettoyeur plasma et nettoyez au plasma simultanément pendant 30 s sous vide (pression < 0,5 Torr) à l’aide de plasma CDA.
- Retirez à la fois la lamelle en verre et le dispositif PDMS du nettoyeur plasma. Inversez le PDMS de sorte que le côté de la fonction soit orienté vers le bas et placez-le sur la lamelle en verre. Observez le collage et appuyez légèrement sur le PDMS au besoin pour faciliter un bon contact.
- Incuber la lamelle collée dans une boîte de Pétri fermée à 65 °C pendant 3 min pour faciliter le collage.
REMARQUE : La liaison plasma modifie l’hydrophobicité de la lamelle de verre, générant une surface hydrophile. Des preuves anecdotiques ont permis d’observer que l’état hydrophobe initial de la lamelle réapparaît après environ 2 jours d’incubation à température ambiante. Il est recommandé d’utiliser des dispositifs fabriqués au plus tôt 2 jours après le collage plasma. Les étapes de microfabrication sont terminées. Les appareils n’ont pas de durée de conservation définie, mais doivent être stockés dans un endroit frais et sec lorsqu’ils ne sont pas utilisés.
6. Préparation du canal d’écoulement microfluidique (1 h)
- Fixez un dispositif microfluidique assemblé dans un adaptateur de platine personnalisé propre47.
- Récupérez une seringue, un adaptateur Lour-lock et une virole de raccord, ainsi qu’un morceau de tube transparent de 1,5 mm de diamètre extérieur (environ 15-20 cm de long). Connectez la tubulure à la seringue via l’adaptateur.
- Connectez trois autres morceaux de tube aux sorties du dispositif microfluidique (ce tube n’a pas besoin d’être d’une longueur spécifique) et dirigez l’autre extrémité de ces tubes dans une fiole de déchets en aval.
- À l’aide de la seringue, préparez le dispositif microfluidique en introduisant les solutions selon les étapes ci-dessous. La séquence et le volume des solutions sont les suivants : 50 μL de solution tampon BRB80, 25 μL de solution d’anticorps anti-rhodamine, attendre 5 min, 50 μL de BRB80, 25 μL de poloxamère 407 (F127), attendre 15 min et 50 μL de BRB80. Voir le tableau 1 pour un exemple.
- Aspirez la solution de sa source dans le tube.
REMARQUE : Ne tirez pas la solution complètement dans la seringue elle-même. La solution ne doit rester que dans le tube. - Appuyez doucement sur le piston de la seringue jusqu’à ce qu’une petite gouttelette de liquide soit présente à l’extrémité de la tubulure. Cela empêchera l’air de pénétrer dans le dispositif microfluidique lorsque le tube est fixé.
- Fixez le tube à l’entrée du dispositif microfluidique.
- Appuyez lentement sur le piston de la seringue jusqu’à ce que la majeure partie, mais pas la totalité, de la solution ait traversé le tube. En laissant une petite quantité de liquide dans le tube, vous vous assurerez qu’aucun air n’est forcé par inadvertance à travers le tube. Observez les tubes et les canaux microfluidiques pendant ces transferts, à la recherche de bulles.
REMARQUE : Si des bulles se produisent dans le tube, commencez le dépannage (essayez de retirer la bulle avant qu’elle n’entre dans le dispositif microfluidique en débranchant le tube juste avant l’arrivée de la bulle, puis en rattachant le tube après le passage de la bulle, etc.). - Répétez les étapes 6.4.1 à 6.4.4 pour le réactif suivant jusqu’à ce que tous les réactifs aient été traversés. Un nouveau morceau de tube d’entrée sera nécessaire pour chaque réactif afin d’éviter la contamination croisée des réactifs sources. Une fois le lavage final du BRB80 terminé, l’appareil est stable pendant plusieurs minutes. Une goutte de solution BRB80 sur les entrées empêchera le dessèchement de l’appareil.
- Aspirez la solution de sa source dans le tube.
- Préparer des « graines » de microtubules stabilisées à la guanosine-5'-[(α,β)-méthyléno]triphosphate (GMPCPP) conformément aux protocoles standard (avec un taux de marquage TTR de ~25 %)47,48.
- Préparez une solution tampon d’imagerie (« antifade ») à une concentration de travail de 2x en combinant les réactifs suivants en quantités respectives (en fonction des concentrations de stock) pour obtenir les concentrations finales spécifiées : BRB80 complété par 40 mM de glucose, 40 μg/mL de glucose oxydase, 16 μg/mL de catalase, 0,5 mg/mL de caséine, 50 mM de chlorure de potassium et 10 mM de dithiothréitol (DTT). Ce tampon d’imagerie est utilisé pour prolonger la photostabilité. Voir le tableau 2 pour un exemple.
- Diluez une partie de la solution d’anti-décoloration 2x 1:1 dans BRB80 pour obtenir une solution de travail 1x d’anti-décoloration. Réchauffez cet anti-décoloration à température ambiante (RT) ; La solution mère d’Antifade doit être conservée sur de la glace.
| Commande | Réactifs | Dilution volumique | Volume de lavage | Temps d’incubation |
| 1 | BRB80 | N/A | 50 μL | N/A |
| 2 | Anticorps anti-rhodamine | 1:50 en BRB80, bien mélanger | 25 μL | Durée : 5 minutes |
| 3 | BRB80 | N/A | 50 μL | N/A |
| 4 | Poloxamère 407 (F127) | 1 % dans BRB80 | 25 μL | Durée : 15 minutes |
| 5 | BRB80 | N/A | 50 μL | N/A |
Tableau 1 : Ordre de préparation des canaux du dispositif microfluidique.
| Volume | Réactif | Concentration des actions | Concentration finale |
| 16 μL | D-Glucose | 2 M | 80 millions de mètres |
| 16 μL | Glucose oxydase | 2 mg/mL | 80 μg/mL |
| 16 μL | Catalase | 0,8 mg/mL | 32 μg/mL |
| 14 μL | Caséine | 28 mg/mL | 0,16 mg/mL |
| 8 μL | La TNT | 1 M | 20 millions d’euros |
| 40 μL | Chlorure de potassium | 1 M | 100 millions d’euros |
| 290 μL | BRB80 | 1x | N/A |
| 400 μL | FINAL (2x concentration de travail) |
Tableau 2 : Recette de la solution d’imagerie anti-décoloration (concentration 2x).
7. Introduction des graines de microtubules à la microfluidique (10 - 15 min)
- Connectez le dispositif microfluidique au microscope.
REMARQUE : La stabilité des microtubules dépendant de la température est recommandée pour les expériences d’imagerie à 35 °C. - Fixez 10 à 15 cm de nouveau tube à la seringue et aspirez une dilution souhaitée de graines de microtubules stabilisées au GMPCPP dans le tube.
REMARQUE : Pour cet appareil, ~10 nM de graines de microtubules GMPCPP étaient la concentration optimale. - Appuyez doucement sur le piston de la seringue jusqu’à ce qu’une petite gouttelette de liquide soit présente à l’extrémité de la tubulure. Cela empêchera l’air de pénétrer dans le dispositif microfluidique lorsque le tube est fixé.
- Fixez le tube à l’entrée du dispositif microfluidique.
- Appuyez lentement sur le piston de la seringue jusqu’à ce que la majeure partie, mais pas la totalité, de la solution ait traversé le tube. En laissant une petite quantité de liquide dans le tube, vous vous assurerez qu’aucun air n’est forcé par inadvertance à travers le tube.
- Détachez le tube d’entrée du dispositif microfluidique et de la seringue et fixez un nouveau morceau de tube à la seringue.
- Aspirez le BRB80 dans le tube.
- Répétez les étapes 7.3 à 7.6 pour éliminer les graines de microtubules non liées de l’appareil.
- Observez la fixation des graines à la surface microfluidique à l’aide de la microscopie à fluorescence par réflexion interne totale (TIRF). Le nombre idéal de graines dans un seul champ de vision varie en fonction de l’application et de la taille du champ de vision, mais généralement, ~10-20 graines par champ de vision de 80 μm × 80 μm est optimal. Répétez les étapes 7.2 à 7.9 au besoin jusqu’à ce que la densité de graines souhaitée soit atteinte.
REMARQUE : Pour surveiller la densité des graines de microtubules, une exposition intermittente à la lumière courte (100 ms) doit être utilisée car aucun anti-décoloration n’est encore présent dans la solution. - Une fois que la densité de graines liée appropriée est atteinte, fixez un nouveau morceau de tube d’entrée à la seringue.
- Aspirez une solution anti-décoloration chaude 1x dans le tube et répétez les étapes 7.3-7.6.
REMARQUE : Avec la solution anti-décoloration maintenant dans l’appareil, la photostabilité est considérablement améliorée et l’appareil est stable. Cependant, il est toujours recommandé de minimiser l’exposition à la lumière laser.
8. Croissance des extensions de microtubules à partir de graines (15 - 30 min)
- Combinez de la tubuline marquée par fluorescence, de la tubuline non marquée, une solution anti-décoloration 2x, de la guanosine-5'-triphosphate (GTP) et du BRB80 pour obtenir une solution finale contenant 14 μM de tubuline à un rapport de marquage fluorescent de 7 %, un anti-décoloration à une concentration de travail de 1x et 1 mM GTP.
REMARQUE : Si vous utilisez des concentrations différentes ou des pourcentages d’étiquetage différents de tubuline, le volume de chaque réactif devra être ajusté pour obtenir la concentration finale souhaitée et le rapport de marquage. Maintenir la solution de tubuline sur de la glace jusqu’à ~30 s avant l’introduction, après quoi retirer la solution de la glace et la réchauffer à la main pour la soumettre à la RT. Cela aidera à la polymérisation des extensions de microtubules, qui est un processus dépendant de la température. En effet, la polymérisation des microtubules doit être réalisée à 35 °C, tandis que toutes les autres étapes expérimentales peuvent être réalisées à RT. - Fixez 10 à 15 cm de nouveau tube à la seringue et aspirez la solution de tubuline dans le tube.
- Appuyez doucement sur le piston de la seringue jusqu’à ce qu’une petite gouttelette de liquide soit présente à l’extrémité de la tubulure. Cela empêchera l’air de pénétrer dans le dispositif microfluidique lorsque le tube est fixé.
- Fixez le tube à l’entrée du dispositif microfluidique.
- Appuyez lentement sur le piston de la seringue jusqu’à ce que la majeure partie, mais pas la totalité, de la solution ait traversé le tube. En laissant une petite quantité de liquide dans le tube, vous vous assurerez qu’aucun air n’est forcé par inadvertance à travers le tube. Détachez le tube d’entrée du dispositif microfluidique.
- Imagez à la fréquence souhaitée pendant 10 à 15 minutes ou jusqu’à ce que les extensions soient assez longues pour se plier. En règle générale, l’imagerie est effectuée à 488 nm toutes les 5 s et à 561 nm toutes les 60 s jusqu’à ce que les extensions mesurent au moins 5 à 10 μm (~15 min).
REMARQUE : À cette concentration de tubuline, les microtubules peuvent basculer stochastiquement entre les périodes de polymérisation et de dépolymérisation ; Il faut s’y attendre, mais dans l’ensemble, les extensions des microtubules s’allongerontde 49.
9. Stabilisation des extensions de microtubules (10-15 min)
- Combinez le Taxol, une solution anti-décoloration 2x et le BRB80 pour obtenir une solution finale contenant 10 μM de taxol et d’anti-décoloration à une concentration de travail de 1x.
REMARQUE : Garder la solution de taxol sur de la glace jusqu’à ~30 s avant l’introduction, après quoi retirer la solution de la glace et la réchauffer à la main à RT. Cela empêchera la dépolymérisation des extensions de microtubules, qui est un processus dépendant de la température. - Fixez 10 à 15 cm de nouveau tube à la seringue et aspirez la solution de taxol dans le tube.
- Appuyez doucement sur le piston de la seringue jusqu’à ce qu’une petite gouttelette de liquide soit présente à l’extrémité de la tubulure. Cela empêchera l’air de pénétrer dans le dispositif microfluidique lorsque le tube est fixé.
- Fixez le tube à l’entrée du dispositif microfluidique.
- Appuyez sur le piston de la seringue jusqu’à ce que la majeure partie, mais pas la totalité, de la solution ait traversé le tube. En laissant une petite quantité de liquide dans le tube, vous vous assurerez qu’aucun air n’est forcé par inadvertance à travers le tube.
- Répétez les étapes 9.2 à 9.5 deux fois de suite. Le même morceau de tube peut être utilisé dans ce cas.
REMARQUE : Le Taxol favorise la nucléation de novo des microtubules à partir de la tubuline en solution, et ces microtubules peuvent atterrir à la surface du canal microfluidique et interférer avec l’imagerie/flexion ultérieure. Pour cette raison, la solution de taxol doit s’écouler rapidement et en plusieurs itérations pour éliminer le plus rapidement possible la quantité de tubuline libre du dispositif. - Vérifiez que les microtubules cultivés à partir de graines sont toujours présents et stabilisés dans l’appareil.
10. Flexion des extensions de microtubules stabilisés (10 - 15 min)
REMARQUE : Les extensions de microtubules stabilisées peuvent maintenant être pliées à l’aide d’un régulateur de débit. Ici, un système de déplacement à pression positive régulé (Elveflow OB1 MK3+) a été utilisé pour faire couler la solution d’un flacon de source étanche à l’air à travers un débitmètre et dans la microfluidique. En fonction des spécificités de la configuration du contrôleur de débit disponible, des modifications peuvent être apportées aux étapes suivantes.
- Installez le régulateur de débit et l’équipement associé selon les protocoles spécifiques au fabricant/site, en utilisant un tube pour connecter le flacon source à l’entrée du débitmètre et la sortie du débitmètre à l’entrée microfluidique, mais ne fixez pas encore le tube au dispositif microfluidique.
- Insérez ~200 μL de la solution de taxol 10 μM dans un flacon source qui peut être fixé à la configuration du régulateur de débit. Cette configuration utilise des raccords Luer-lock pour créer un joint étanche à l’air.
- Allumez le système de contrôle du débit et amorcez le tube pour évacuer l’air. Cela empêchera l’air de pénétrer dans le dispositif microfluidique lorsque le tube est fixé.
- Une fois que le tube a été amorcé à travers le débitmètre et qu’une petite gouttelette de liquide est présente à l’extrémité du tube, éteignez le système de contrôle de débit.
- Connectez le tube à l’entrée du dispositif microfluidique. Utilisez une entrée perpendiculaire à l’entrée utilisée pour introduire les graines de microtubules et faites pousser les extensions de microtubules afin de les plier orthogonalement.
- Pliez les extensions en démarrant et en arrêtant le débit au débit ou à la pression souhaités. Une pression de 30 mbar est la norme pour ce protocole utilisant un écoulement oscillatoire de période de 5 s. Imagez la courbure pendant ce temps, généralement toutes les 0,1 s à 488 nm et toutes les 10 s à 561 nm.
REMARQUE : Ceci termine le test de base de flexion des microtubules. Tous les équipements et réactifs peuvent être nettoyés/éliminés conformément aux protocoles spécifiques au fabricant/site.
Résultats
Justification de la conception du dispositif microfluidique
La conception du dispositif microfluidique dans cette étude a été guidée par plusieurs caractéristiques clés (Figure 2), qui s’appuient et améliorent la conception traditionnelle simple des cellules à écoulement. Il convient de noter que le dispositif microfluidique a un volume interne de ~160 nL, nettement inférieur au volume de ~10 μL des cellules à flux plus traditionnelles47, ce qui permet une utilisation plus contrôlée de réactifs potentiellement précieux, tels que les composants protéiques purifiés. Étant donné que le régulateur de débit microfluidique contient deux canaux de régulation, le dispositif a été développé en supposant que seuls deux orifices d’entrée/sortie auraient un contrôle de pression à un moment donné. Des canaux plus amples à pression contrôlée peuvent être mis en œuvre, si nécessaire.
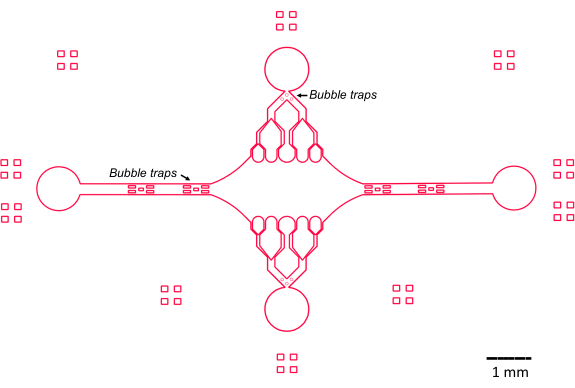
Figure 2 : Schéma de la conception du dispositif microfluidique. Des marques rectangulaires sur la périphérie servent à aider visuellement à voir la périphérie des canaux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La chambre centrale rectangulaire du dispositif sert de zone d’imagerie principale où les graines de microtubules sont attachées, et les extensions de microtubules sont polymérisées à partir de ces graines. La chambre est coupée par un canal d’écoulement de chaque côté, avec des canaux droits le long de l’axe des x servant d’entrée et de sortie pour faciliter l’échange rapide de la solution réactionnelle. Le canal d’entrée des microtubules est également utilisé pour introduire des graines de microtubules dans la chambre, avec un flux laminaire entraînant la liaison de la graine à la surface du verre le long du sens d’écoulement. Dans la direction perpendiculaire (axe y), les canaux d’écoulement se ramifient en canaux plus petits vers la chambre, similaires à certains des modèles précédents 25,28,36,39. La géométrie ramifiée est particulièrement adaptée à l’étude des propriétés mécaniques des microtubules. L’écoulement d’une solution dans la chambre centrale à partir d’une direction perpendiculaire à l’orientation des graines de microtubules permet des forces de flexion induites par l’écoulement à des angles proches de la normale. De plus, l’inclusion d’une géométrie de ramification avec de nombreux canaux d’écoulement plus petits facilite une application de force plus homogène sur une large zone de la chambre centrale, ce qui n’est pas réalisé par une simple géométrie d’écoulement à canal unique. De cette façon, le motif de ramification, bien qu’apparemment plus compliqué, peut réduire la complexité globale de la détermination de la force conférée aux microtubules (Figure 3). Cette conception comporte également plusieurs lignes de symétrie, ce qui permet une utilisation facile et la possibilité d’évaluer la flexion dans plusieurs directions (par exemple, en haut ou en bas).
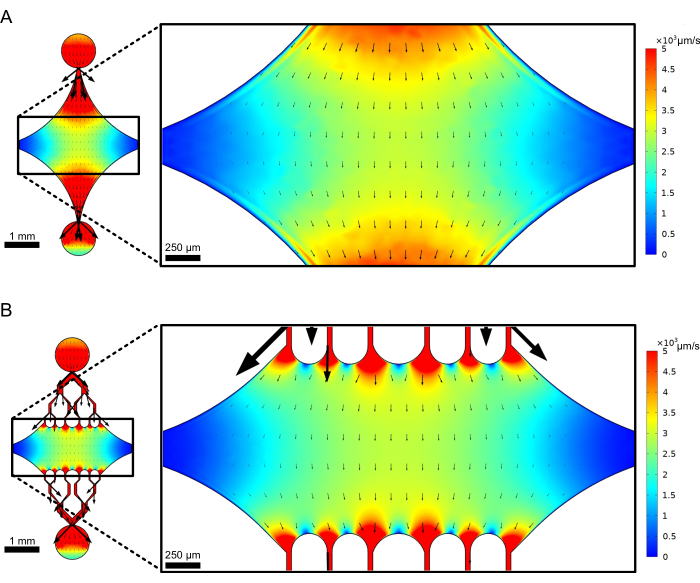
Figure 3 : L’inclusion d’un motif ramifié entraîne une grande zone d’écoulement similaire. Simulations de deux conceptions de dispositifs en régime permanent : l’une sans canaux de dérivation (A) et l’autre avec des canaux de dérivation (B). Les flèches indiquent la direction locale de l’écoulement et sont proportionnelles à l’amplitude de l’écoulement. La coloration de surface indique la vitesse de l’axe. Les images de droite montrent une section agrandie de l’appareil où les microtubules (non illustrés) orientés le long de l’axe x seraient soumis aux forces de flexion d’un fluide s’écoulant dans l’orifice supérieur et sortant par l’orifice inférieur. L’incorporation de canaux de ramification augmente la surface relative soumise à des champs de vitesse similaires sans augmenter le volume de réactif requis. Cette figure a été modifiée avec la permission de Rogers (2022)14. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Notamment, l’appareil met également en œuvre une série de pièges à bulles dans les canaux d’entrée et de sortie pour empêcher les bulles d’air de pénétrer dans la chambre d’imagerie centrale. Plus précisément, nous avons choisi d’inclure des réseaux de micropiliers dans le chemin d’écoulement afin d’empêcher les bulles d’air de passer en raison de la tension superficielle (Figure 2)46. De plus, pour éviter l’entraînement d’air, nous avons conçu les bords à l’intérieur de l’appareil comme des courbes lisses, par opposition à des angles obliques. Ensemble, ces caractéristiques de conception réduisent la possibilité de bulles d’air et augmentent la robustesse de l’appareil.
Fabrication de dispositifs microfluidiques
La détermination des paramètres appropriés pour la création du maître de périphérique nécessitait une certaine optimisation. Comme observé précédemment, cette résine photosensible est très sensible aux paramètres de fonctionnement clés tels que l’éclairage ambiant et les taux de chauffage et de refroidissement lors des étapes de photolithographie50. Par exemple, si le master a été refroidi trop rapidement après le chauffage, des fissures thermiques peuvent se développer dans la résine photosensible. Ce n’est pas souhaitable, car les fissures peuvent compromettre l’intégrité du canal. Bien que les fissures puissent être résolues en réchauffant la résine à une température proche de sa température de transition (~115 °C), nous avons constaté que le fait de laisser le master refroidir à température ambiante sur la plaque chauffante était le moyen le plus robuste de prévenir la fissuration. De plus, un excès de lumière ambiante peut entraîner une exposition involontaire de la résine photosensible, affaiblissant la résine et entraînant le dépouillement partiel des caractéristiques du dispositif elles-mêmes (qui doivent rester sur la plaquette après le développement) au cours de l’étape de développement. Pour cette raison, nous encourageons l’étape de développement à effectuer le lendemain des étapes de cuisson post-exposition et de refroidissement à température ambiante pendant la nuit. De plus, chaque fois que le maître de l’appareil n’est pas utilisé, nous vous recommandons de le stocker dans un endroit sombre ou enveloppé dans une feuille d’aluminium pour éviter toute dégradation au fil du temps. Une fois ces paramètres déterminés, le processus de photolithographie était hautement reproductible (Figure 4).
Après la création du maître, le PDMS liquide a été coulé sur le maître, ce qui a permis au PDMS de durcir et de créer une empreinte négative des caractéristiques du maître. Nous avons constaté que la coulée du PDMS à une épaisseur de 2-3 mm permettait une manipulation facile des appareils ; en revanche, s’il était revêtu par centrifugation pour atteindre une épaisseur de l’ordre du μm, le PDMS avait tendance à se déchirer ou à s’auto-adhérer, ce qui rendait la manipulation difficile. De plus, une couche PDMS plus épaisse permet de brancher plus facilement les tubes, car les tubes resteront dans les orifices d’entrée/sortie sans avoir besoin d’un mastic ou d’une pince.
Enfin, alors que les tests traditionnels à cellules d’écoulement pour ces applications biologiques utilisent souvent des lamelles en verre qui ont été pré-nettoyées à l’aide d’une solution Piranha (peroxyde d’hydrogène et acide sulfurique) puis silanisées, nous avons constaté que les lamelles traitées avec un nettoyage au plasma prolongé et un lavage IPA convenaient à nos objectifs47. D’autres applications, telles que l’imagerie de molécules uniques, peuvent nécessiter un traitement plus étendu du verre de protection.

Figure 4 : Procédé de photolithographie. (A) Le masque avec le motif souhaité (masque en chrome gravé sur verre). (B) Légère fissuration de la résine photosensible sur la plaquette de silicium due à une contrainte thermique (les flèches mettent en évidence quelques fissures). Ces fissures s’étendent souvent sur l’ensemble de la plaquette. (C) Le maître développé. (D) La configuration microfluidique sur le microscope. Les composants individuels sont étiquetés en vert. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Croissance, stabilisation et flexion des microtubules
Les graines de microtubules cultivées au GMPCPP servent de sites de nucléation pour les extensions de microtubules à polymériser et sont elles-mêmes stables contre la dépolymérisation pendant plusieurs heures à température ambiante. Les graines ont été liées à la lamelle de verre dans le canal microfluidique à l’aide d’un anticorps anti-rhodamine47. Des extensions dynamiques de microtubules ont ensuite été cultivées en présence de tubuline soluble (marquée par fluorescence mais non conjuguée à la rhodamine) et de GTP. De cette façon, les sites de nucléation des graines ont été attachés à la lamelle de verre, mais les extensions ne l’ont pas été. Au cours de la période de croissance d’extension de 15 minutes, les extensions de microtubules se polymérisent et se dépolymérisent stochastiquement, comme prévu en raison de leur instabilité dynamique intrinsèque49. Après cette période de croissance, un lavage au Taxol de 10 μM a été effectué pour éliminer toute tubuline restante de la solution et stabiliser les extensions de microtubules qui s’étaient formées. La stabilisation est essentielle, car les extensions des microtubules se dépolymériseraient autrement lors de l’épuisement de la tubuline. En plus de lier et de stabiliser le polymère de microtubules, il a également été démontré que le Taxol a un impact sur la mécanique des polymères de microtubules et peut induire une courbure dans les extensions de microtubules autrement linéaires 51,52,53,54. Les résultats présentés ici reflètent ces observations ; Cependant, l’enroulement des extensions des microtubules n’est pas souhaitable, car il en résulte des forces inégales transmises le long du réseau lors de la flexion. Par conséquent, seuls les microtubules qui sont restés relativement droits après la stabilisation ont été utilisés pour l’analyse de la flexion. Alternativement, après la période de croissance initiale, une période de croissance secondaire avec une solution de tubuline et de GMPCPP (par opposition au GTP initial) peut être utilisée pour créer des « capuchons » stables sur les extrémités de croissance du réseau de microtubules et empêcher la dépolymérisation55.
Les microtubules ont ensuite été pliés en s’écoulant dans la solution tampon à l’aide du système de contrôle de la pression pour maintenir une pression constante en amont (figure 5, vidéo supplémentaire 1). De cette façon, nous avons pu estimer le flux local subi par les microtubules. En faisant entrer le fluide par le haut et à sortir de l’orifice inférieur de l’appareil, l’orientation de l’écoulement devait être perpendiculaire à l’orientation de l’ensemencement.
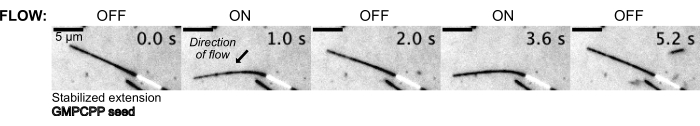
Figure 5 : La configuration microfluidique peut être utilisée pour plier des microtubules stabilisés. Les microtubules à l’état de repos après stabilisation avec le paclitaxel sont pliés pendant le flux pulsatile. Une pression amont constante de 30 mbar entraîne l’écoulement (la flèche indique le sens de l’écoulement). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Détermination du profil d’écoulement dans le dispositif microfluidique
La vitesse de l’axe dans la microfluidique peut être simulée par calcul à l’aide du logiciel COMSOL (logiciel de simulation, Figure 6A). Cependant, les microtubules sont fixés à la lamelle de verre pour la microscopie TIRF à ~100 nm de la surface. Par conséquent, la vitesse ressentie par le microtubule n’est pas la même que celle prédite dans la simulation 2D. Pour approximer l’écoulement local subi par les microtubules, nous avons utilisé l’équation générale de Navier-Stokes pour un écoulement de fluide incompressible en une dimension :
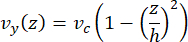
Ici, z est la hauteur des microtubules dans l’appareil, h est la hauteur totale de l’appareil et vc est la vitesse de la ligne médiane dans l’appareil. Par définition du système, l’origine z est le centre de l’appareil (Figure 6B). En utilisant cette définition et une hauteur de canal de 13 μm, la hauteur des microtubules est estimée comme z = -6,4 μm. La résolution de cette équation permet d’estimer la vitesse locale du fluide subie par les microtubules :

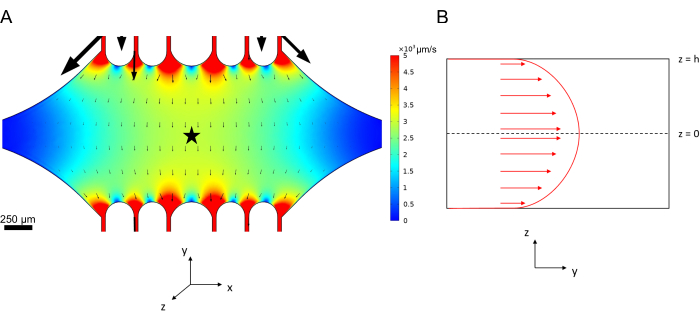
Figure 6 : Définition du système d’analyse de l’écoulement du fluide entrant dans l’appareil par l’orifice supérieur et sortant de l’orifice inférieur (orifices non illustrés). (A) Simulation du champ de vitesse de l’axe mis à l’échelle comme dans la figure 3B. L’étoile désigne la zone d’intérêt du panneau B. (B) Représentation en coupe transversale de l’appareil. Le profil d’écoulement du fluide entièrement développé est dans la direction y avec une vitesse axiale vc à z = 0 et une condition limite sans glissement au niveau des parois. Notez que les flèches de ce panneau ne sont pas à l’échelle par rapport au champ de vitesse réel affiché dans le panneau A. Cette figure a été modifiée avec la permission de Rogers (2022)14. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Au-delà des simulations, la vitesse du fluide peut être contrôlée à l’aide d’un régulateur de débit basé sur un débit volumétrique plutôt que sur le maintien de la pression. De plus, le débit local dans chaque appareil peut être déterminé directement en incluant des billes fluorescentes et en surveillant leur vitesse, atténuant ainsi toute variabilité d’un échantillon à l’autre.
Modélisation computationnelle et démonstrations de gradient
Enfin, nous avons effectué des simulations informatiques en combinaison avec des expériences pour démontrer la faisabilité de l’utilisation de ce dispositif pour des expériences à haut débit. En plus de la capacité de plier les microtubules dans plusieurs directions grâce à la symétrie du dispositif, les simulations ont montré que le dispositif peut maintenir des gradients précis, permettant l’étude simultanée de plusieurs conditions expérimentales (Figure 7A). Des expériences préliminaires (méthodes non explicitement mentionnées dans le cadre de cette publication) utilisant un colorant fluorescent en solution ont démontré la cohérence avec les prédictions computationnelles (Figure 7B). De plus, nous avons réussi à démontrer la répartition de différentes protéines dans différentes zones du dispositif en cultivant simultanément des extensions de microtubules avec différents marqueurs fluorescents (Figure 8). À notre connaissance, il s’agit de la première application de la microfluidique à haut débit à l’étude des microtubules. Cette caractéristique de ce dispositif peut être utilisée pour réduire le temps et les quantités de réactifs nécessaires tout en améliorant la robustesse expérimentale. Par exemple, les effets de différentes protéines ou de concentrations distinctes de protéines individuelles sur la mécanique et la dynamique des microtubules peuvent être étudiés simultanément dans un seul appareil.
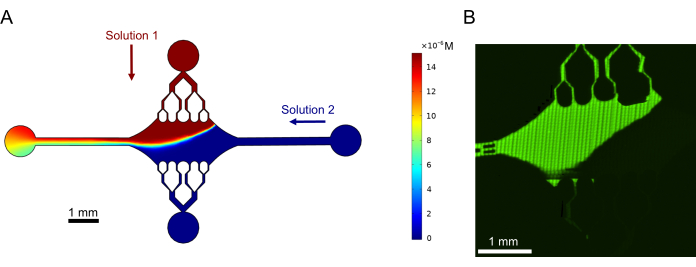
Figure 7 : Formation d’un gradient. (A) Simulation d’un gradient de deux solutions entrant dans le dispositif à la même pression d’entrée (50 mbar) et à la même concentration (15 μM). Les orifices d’entrée de chaque solution sont indiqués par des flèches colorées (une solution dans l’orifice supérieur et une autre solution dans l’orifice droit), et les deux autres orifices servent de sorties. La carte thermique montre le profil de concentration de la solution supérieure. L’état d’équilibre a été obtenu à t = 5 s. (B) Génération expérimentale d’un gradient similaire à l’aide d’un colorant fluorescent en solution dans l’orifice supérieur et d’un tampon dans l’orifice droit. L’image est une couche raster réalisée en assemblant chaque champ de vision (80 μm × 80 μm) pour résoudre toute la zone de l’appareil. Cette figure a été modifiée avec la permission de Rogers (2022)14. Veuillez cliquer ici pour voir une version agrandie de cette figure.
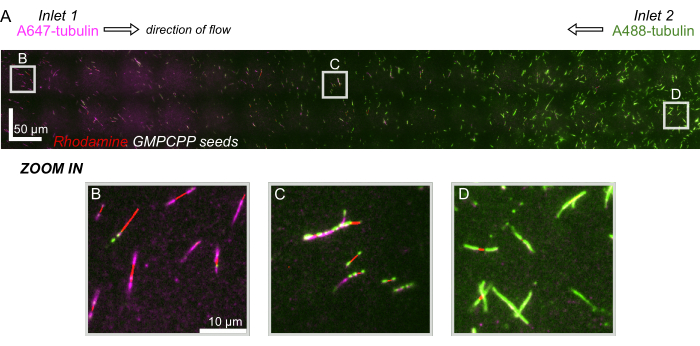
Figure 8 : Démonstration d’un gradient protéique dans le dispositif microfluidique. La tubuline marquée AlexaFluor647 (magenta) a été transportée dans l’entrée 1, et la tubuline marquée AlexaFluor488 (verte) a été transportée dans l’entrée 2 de l’appareil à des concentrations et des débits égaux. L’écoulement a été oscillé par incréments de 90 s pour permettre la polymérisation de la tubuline à partir de graines stabilisées de GMPCPP (rouge) tout en inhibant le mélange. (A) Couche raster à grande échelle réalisée en assemblant des champs de vision (80x80 μm) pour résoudre toute la longueur de l’appareil. Les lettres désignent l’emplacement relatif des champs de vision individuels dans les panneaux suivants. La barre d’échelle est de 50 μm en position X et Y. (B) Champ de vision près de l’entrée 1 du dispositif, où les extensions sont principalement composées de tubuline marquée A647. (C) Champ de vision près du milieu de l’appareil, où les extensions sont composées d’un mélange de tubulines marquées, comme prévu. (D) Champ de vision près de la partie inférieure de l’appareil, où les extensions sont principalement composées de tubuline étiquetée A488. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La figure supplémentaire 1 présente un organigramme de processus (PFD) pour le dispositif expérimental de microfluidique au microscope.
Figure supplémentaire 1 : Organigramme de procédé (PFD) pour le dispositif expérimental de microfluidique au microscope. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire 1. La configuration microfluidique peut être utilisée pour plier des microtubules stabilisés. Les microtubules à l’état de repos après stabilisation avec le paclitaxel sont pliés pendant le flux pulsatile. Une pression amont constante de 30 mbar entraîne le débit. Taux de lecture vidéo 10 ips. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 1 : Un fichier CAO de la conception du masque microfluidique. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
L’objectif principal de ce protocole était de concevoir et de fabriquer un dispositif microfluidique adapté à l’étude de la mécanique des microtubules in vitro. La conception était basée sur le désir d’utiliser les avantages intrinsèques des dispositifs microfluidiques basés sur PDMS tout en incluant une combinaison de fonctionnalités qui permettraient une expérimentation à haut débit robuste et personnalisable.
Cet objectif a été atteint avec succès, ce qui a donné lieu à des protocoles de fabrication et à des directives générales qui peuvent servir de base aux futurs utilisateurs de ce système. L’inclusion de pièges à bulles redondants dans le dispositif diminue la probabilité de dénaturation des protéines due à la présence de bulles d’air. Bien qu’il y ait encore quelques débranchements et rebranchements des tubes dans l’appareil, ces pièges à bulles réduisent la probabilité d’échec expérimental. Les améliorations futures de la configuration microfluidique pourraient encore réduire le nombre de manipulations manuelles des tubes effectuées au cours d’une expérience. De plus, l’intégration du dispositif microfluidique avec un logiciel de contrôle de débit automatisé permet une personnalisation significative des conditions expérimentales tout en réduisant la possibilité d’erreur manuelle. Nous avons démontré les performances réussies de l’appareil en fabriquant l’appareil, puis en développant, stabilisant et pliant les extensions de microtubules dans l’appareil à l’aide d’un flux automatique régulé par le contrôleur. De plus, en établissant un gradient de solutions de tubuline marquées par fluorescence distinctes dans le même dispositif, nous avons montré que plusieurs conditions peuvent être exécutées simultanément dans un seul dispositif. À l’aide de techniques de modélisation et d’analyse informatiques, notre système peut sonder et déterminer les propriétés biomécaniques des microtubules, telles que la rigidité en flexion 52,56,57,58,59.
D’éventuelles améliorations à l’avenir permettraient de mettre en place un système encore plus robuste et d’effectuer des analyses expérimentales connexes. Tout d’abord, le dépôt, l’exposition et la cuisson de la résine photosensible étaient des paramètres cruciaux qui ont démontré une certaine variabilité. Les tailles relativement grandes des caractéristiques de la résine photosensible SPR nécessitaient un chauffage et un refroidissement très progressifs pour éviter la fissuration thermique, ce qui pouvait endommager les appareils. Bien que des appareils plus minces aient été essayés, nous avons rencontré des problèmes avec la manipulation de ces fonctionnalités de plus petite taille. L’attention portée aux détails et la patience sont cruciales pour reproduire des appareils de cette épaisseur avec la résine photosensible SPR. Différentes résines photosensibles peuvent être utilisées pour résoudre ce problème, en fonction de la disponibilité.
Ensemble, le dispositif microfluidique et le protocole permettent ici une gamme de configurations expérimentales avec des capacités d’essai à haut débit plus robustes que les tests de cellules d’écoulement précédents47. De plus, les expériences peuvent être automatisées à l’aide de contrôleurs de débit pour maintenir des profils d’écoulement ou des gradients de concentration précis dans l’appareil, réduisant ainsi la variabilité inhérente aux utilisateurs manuels. Les applications potentielles futures de ce dispositif comprennent l’étude des effets des protéines associées aux microtubules sur la rigidité en flexion, la dynamique, les dommages au réseau et la réparation des microtubules, ainsi que les interactions biomécaniques des microtubules et des filaments d’actine 54,60,61,62,63,64,65,66,67,68 ,69,70. L’intégration de la microfabrication, du contrôle automatisé des flux et de la modélisation et de l’analyse informatiques crée un système polyvalent adapté à l’étude du cytosquelette cellulaire in vitro.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts. Les auteurs divulguent l’utilisation de ChatGPT-4o OpenAI pour la révision et la relecture de texte.
Remerciements
Nous sommes reconnaissants du soutien et des ressources fournis par le Vanderbilt Institute of Nanoscale Science and Engineering (VINSE), où une partie de cette recherche a été menée. Ce travail a été partiellement financé par une subvention NIH NIGMS à M. Zanic (R35 GM1192552) et une subvention NSF ID 2018661 à M. Zanic. M. Rogers a reçu le soutien de la subvention T32 GM08320 des NIH et d’une bourse de financement pilote VINSE. L. Richardson est soutenu par la subvention n° 1937963 de la NSF GRFP. Les auteurs tiennent également à remercier la Dre Alice Leach, David Schaffer, la Dre Christina McGahan et l’ensemble du laboratoire Zanic pour leur aide et leur soutien.
matériels
| Name | Company | Catalog Number | Comments |
| 0.6 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mm standard biopsy punch | Integra LifeSciences | 33-31A-P/25 | |
| 100x/1.49 numerical aperture TIRF objective | Nikon | ||
| 22 x 22 mm glass coverslips | ThorLabs | CG15CH | |
| 3" single side polished silicon wafers | University Wafer | 447 | |
| 4" Petri dish | Any brand | ||
| 450 µL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter, Inc. | 345843 | Referred to as 'airfuge tube' in the protocol |
| 488-, 561, and 640-nm solid state lasers | Nikon | ||
| A-95 Fixed-Angle Rotor | Beckman Coulter, Inc. | 347595 | |
| Acetone | Any brand | ||
| Airfuge Air-Driven Ultracentrifuge | Beckman Coulter, Inc. | 347854 | Referred to as 'airfuge' in the protocol |
| Alexa Fluor 488 Microscale Protein Labeling Kit | Thermo Fisher Scientific | A30006 | |
| Aluminum foil | Any brand | ||
| Andor iXon Ultra EM-CCD | Nikon | ||
| Andor NEO sCMOS | Nikon | ||
| AutoCAD | Autodesk | Generic versions can be used | |
| Bovine brain unlabeled tubulin (purified) | N/A | Made in house, but can be purchased | |
| Casein | MilliporeSigma | C7078 | |
| Catalase | MilliporeSigma | C9322 | |
| Clean Dry Air (CDA) (pressurized gas) | Any brand | ||
| Compressed air supply | Any brand | Connects to the microfluidic flow controller | |
| COMSOL Multiphysics software | COMSOL, Inc. | ||
| Custom brass stage adapter | N/A | Made in house to fit our 22 mm x 22 mm coverslips onto the microscope | |
| De-ionized water | Any brand | ||
| Dessicator | Any brand | ||
| D-glucose | MilliporeSigma | G7528 | |
| Dithiothreitol (DTT) | MilliporeSigma | D0632 | |
| EGTA | MilliporeSigma | 324626 | |
| Elveflow Smart Interface (ESI) software | Elveflow | ||
| Flangeless PFA fittings with ETFE ¼”-28 to 1/16” outer diameter ferrules | Darwin Microfluidics | CIL-XP-245X | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack |
| Fluiwell 4-Channel 2 mL Low Pressure | Fluigent | 14002001 | Used to connect the flow control system to the the micrewtubes. Also refered to as 'pressurized reservoir rack' |
| Fume hood | Any brand | ||
| Glucose oxidase | MilliporeSigma | G6125 | |
| GMPCPP | Jena Bioscience | NU-405L | |
| Guanosine triphosphate (GTP) | MilliporeSigma | G8877 | |
| Hot plate | Any brand | ||
| HS-625 high-speed emission filter wheel | Finger Lakes Instrumentation | ||
| ImageJ software | N/A | Open access | |
| Incubator | Any brand | ||
| Isopropyl alcohol | Any brand | ||
| Karl Suss MA-6 mask aligner | SUSS MicroTec | ||
| Magnesium chloride | MilliporeSigma | 1.05833 | |
| MATLAB software | MathWorks | ||
| MEGAPOSIT SPR 220 7.0 photoresist | Dow, Inc. | ||
| Microfluidic Fittings 6-40 to 1/4"-28 Adapters Kit | Darwin Microfluidics | LVF-KFI-08 | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack (Fluiwell rack) |
| Microfluidic Fittings Female Luer Lock Adapter Kit | Darwin Microfluidics | LVF-KFI-04 | Used to connect the syringe to the tubing |
| Microfluidic flow controller | Elveflow | OB1 MK3+ | |
| Microfluidic flow sensor | Elveflow | MFS3 | This flow sensor range is 0-80 μL |
| MICROPOSIT MF-319 developer | Dow, Inc. | ||
| Microscope | Nikon | Eclipse Ti | |
| NIS-Elements software | Nikon | ||
| Nitrogen (pressurized gas) | Any brand | ||
| Objective heater | Tokai Hit | ||
| One-Piece Fingertight 10-32 Coned Fitting for 1/16" OD Tubing | Darwin Microfluidics | CIL-F-120X | Used to connect the syringe to the tubing |
| Paclitaxol (Taxol) | Tocris Bioscience | 1097 | |
| Photolithography masks | N/A | Made by an external party using our designs | |
| PIPES | Thermo Fisher Scientific | 172615000 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Plasma flowmeter system | Harrick Plasma | PDC-FMG | Integrates with plasma cleaner to enable flow control of pressurized gas |
| Plastic bulb pipet | Any brand | ||
| Pluoronic F-127 | MilliporeSigma | P2443 | Referred to as 'poloxomer 407' in the protocol |
| Potassium chloride | Research Products International | P41000 | |
| Saint Gobain Performance Plastics Tube Tygon .020 ID | Thermo Fisher Scientific | 50-206-8921 | Refered to as '1.5 mm tubing' and 'tubing' in the protocol |
| Scalpel | Any brand | ||
| Spin coater | Cost Effective Equipment, LLC. | 200x | This model may be discontinued |
| Standard pipets and tip sets | Any brand | ||
| Standard plastic syringe | Any brand | We used a 10 mL Luer-slip syringe | |
| Sylgard 184 silicone elastomer kit | Dow, Inc. | Referred to as 'PDMS' and 'curing agent' in the protocol | |
| T339 Micrewtube with Lip Seal and Flat Screw Cap | Medline Industried, LP. | T339 | Referred to as 'source vial' in the protocol. We used both 0.5 mL and 1.5 mL sizes |
| TAMRA, SE; 5-(and-6)-Carboxytetramethylrhodamine, Succinimidyl Ester | Invitrogen | C1171 | Referred to as 'TTR' in the protocol |
| Trichloro(1H, 1H, 2H, 2H-perfluorooctyl) silane | MilliporeSigma | 448931 | |
| Trion Phantom RIE ICP | Trion Technology, Inc. | This plasma cleaner is only used in Step 1.1 of the protocol. Another plasma cleaner, like the one used for PDMS bonding, can be used instead; we just prefer the much lower vacuum achievable by this system for cleaning the silicon wafer | |
| TRITC Polyclonal Antibody | Thermo Fisher Scientific | A6397 | Referred to as 'anti-rhodamine antibody' in the protocol |
| Tweezers | Any brand | ||
| Vacuum pump | Any brand |
Références
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Phys Today. 54 (6), 42(2001).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev Mod Phys. 77, 977(2005).
- Beebe, D. J., Mensing, G. A., Walker, G. M. Physics and applications of microfluidics in biology. Annu Rev Biomed Eng. 4, 261-286 (2002).
- Ng, J. M. K., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. Electrophoresis. 23 (20), 3461-3473 (2010).
- Dellaquila, A. Five Short Stories on The History of Microfluidics. , https://www.elveflow.com/microfluidic-reviews/general-microfluidics/history-of-microfluidics/ (2025).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: Microfluidics in drug discovery. Nat Rev Drug Discov. 5 (3), 210-218 (2006).
- Neužil, P., Giselbrecht, S., Länge, K., Huang, T. J., Manz, A. Revisiting lab-on-a-chip technology for drug discovery. Nat Rev Drug Discov. 11 (8), 620-632 (2012).
- Manz, A., Graber, N., Widmer, H. M. Miniaturized total chemical analysis systems: a novel concept for chemical sensing. Sens Actuators B: Chem. 1 (1-6), 244-248 (1990).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Knight, J. Microfluidics: Honey, I shrunk the lab. Nature. 418 (6897), 474-475 (2002).
- Photolithographic fabrication techniques for transistors which are an integral part of a printed circuit. Nall, J. R., Lathrop, J. W. 1957 International Electron Devices Meeting, Washington, DC, USA, , (1957).
- Rogers, M. The design and fabrication of a two-layer microfluidic device for studying microtubules in vitro [Master's Thesis]. , Vanderbilt University. Nashville, TN. (2022).
- Lee, J. B., Choi, K. H., Yoo, K. Innovative SU-8 lithography techniques and their applications. Micromachines. 6 (1), 1-18 (2015).
- Kim, P., et al. Soft lithography for microfluidics: A Review. Biochip J. 2 (1), 1-11 (2008).
- Venkatesan, S. u, Jerald, J., Asokan, P., Prabakaran, R. A Comprehensive Review on Microfluidics Technology and its Applications. Recent Advances in Mechanical Engineering. , Springer. Singapore. 235-245 (2020).
- Minteer, S. Microfluidic Techniques: Reviews and Protocols. , Humana Press. New Jersey. (2006).
- Mitra, S. K., Chakraborty, S. Microfluidics and Nanofluidics Handbook: Fabrication, Implementation, and Applications. , Taylor and Francis Group. Florida. (2016).
- Alberts, B., et al. Molecular Biology of the Cell. , Garland Science. New York. (2014).
- Howard, J. Mechanics of Motor Proteins and the Cytoskeleton. , Springer. Heidelberg. (2001).
- Hawkins, T., Mirigian, M., Selcuk Yasar, M., Ross, J. L. Mechanics of microtubules. J Biomech. 43 (1), 23-30 (2010).
- Gardel, M. L., Kasza, K. E., Brangwynne, C. P., Liu, J., Weitz, D. A. Chapter 19: Mechanical Response of Cytoskeletal Networks. Methods Cell Biol. 89, 487-519 (2008).
- Caporizzo, M. A., Prosser, B. L. The microtubule cytoskeleton in cardiac mechanics and heart failure. Nat Rev Cardiol. 19 (6), 364-378 (2022).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nat Mater. 14 (11), 1156-1163 (2015).
- Chu, S. H., et al. A microfluidic device for in situ fixation and super-resolved mechanosensation studies of primary cilia. Biomicrofluidics. 13 (1), 014105(2019).
- Geisterfer, Z. M., Zhu, D. Y., Mitchison, T. J., Oakey, J., Gatlin, J. C. Microtubule growth rates are sensitive to global and local changes in microtubule plus-end density. Curr Biol. 30 (15), 3016-3023 (2020).
- Schaedel, L., et al. Lattice defects induce microtubule self-renewal. Nat Phys. 15 (8), 830-838 (2019).
- Aher, A., et al. CLASP mediates microtubule repair by restricting lattice damage and regulating tubulin incorporation. Curr Biol. 30 (11), 2175-2183 (2020).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. ELife. 5, e13470(2016).
- Fourniol, F. J., et al. Micropattern-guided assembly of overlapping pairs of dynamic microtubules. Methods Enzymol. 540, 339-360 (2014).
- Vleugel, M., Roth, S., Groenendijk, C. F., Dogterom, M. Reconstitution of basic mitotic spindles in spherical emulsion droplets. J Vis Exp. (114), e54278(2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Mol Biol Cell. 27 (22), 3563-3573 (2016).
- VanDelinder, V., Brener, S., Bachand, G. D. Mechanisms underlying the active self-assembly of microtubule rings and spools. Biomacromolecules. 17 (3), 1048-1056 (2016).
- Roth, S., Gârlea, I. C., Vleugel, M., Mulder, B. M., Dogterom, M. Reconstitution of basic mitotic spindles in cell-like confinement. bioRxiv. , (2019).
- Xu, Z., et al. Microtubules acquire resistance from mechanical breakage through intralumenal acetylation. Science. 356 (6335), 328-332 (2017).
- Fanalista, F., et al. Shape and size control of artificial cells for bottom-up biology. ACS Nano. 13 (5), 5439-5450 (2019).
- Velve-Casquillas, G., Costa, J., Carlier-Grynkorn, F., Mayeux, A., Tran, P. T. A fast microfluidic temperature control device for studying microtubule dynamics in fission yeast. Methods Cell Biol. 97, 185-201 (2010).
- Portran, D., Schaedel, L., Xu, Z., Théry, M., Nachury, M. V. Tubulin acetylation protects long-lived microtubules against mechanical ageing. Nat Cell Biol. 19 (4), 391-398 (2017).
- Huang, Y. M., Uppalapati, M., Hancock, W. O., Jackson, T. N. Microtubule transport, concentration and alignment in enclosed microfluidic channels. Biomed Microdevices. 9 (2), 175-184 (2007).
- Uppalapati, M., Huang, Y., Shastry, S., Jackson, T. N., Hancock, W. O. Microtubule Motors in Microfluidics. Methods in Bioengineering: Microfabrication and Microfluidics. , Artech House Publishers. Boston, MA. (2009).
- Sung, J. H., Shuler, M. L. Prevention of air bubble formation in a microfluidic perfusion cell culture system using a microscale bubble trap. Biomed Microdevices. 11 (4), 731-738 (2009).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360(2019).
- Nakayama, T., et al. Circumventing air bubbles in microfluidic systems and quantitative continuous-flow PCR applications. Anal Bioanal Chem. 386 (5), 1327-1333 (2006).
- Park, S., Cho, H., Kim, J., Han, K. -H. Lateral degassing method for disposable film-chip microfluidic devices. Membranes. 11 (5), 316(2021).
- Pereiro, I., Fomitcheva Khartchenko, A., Petrini, L., Kaigala, G. V. Nip the bubble in the bud: A guide to avoid gas nucleation in microfluidics. Lab Chip. 19 (14), 2296-2314 (2019).
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biol. 95, 221-245 (2010).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: Information from a slowly hydrolyzable analogue, GMPCPP. Mol Biol Cell. 3 (10), 1155-1167 (1992).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bartlett, N. W., Wood, R. J. Comparative analysis of fabrication methods for achieving rounded microchannels in PDMS. J Micromech Microeng. 26 (11), 115013(2016).
- Yang, C. P. H., Horwitz, S. B. Taxol®: The first microtubule stabilizing agent. Int J Mol Sci. 18 (8), 1733(2017).
- Gittes, F., Mickey, B., Nettleton, J., Howard, J. Flexural rigidity of microtubules and actin filaments measured from thermal fluctuations in shape. J Cell Biol. 120 (4), 923-934 (1993).
- VanBuren, V., Cassimeris, L., Odde, D. J. Mechanochemical model of microtubule structure and self-assembly kinetics. Biophys J. 89 (5), 2911-2926 (2005).
- Dye, R. B., Fink, S. P., Williams, R. C. Taxol-induced flexibility of microtubules and its reversal by MAP-2 and Tau. J Biol Chem. 268 (10), 6847-6850 (1993).
- Drechsel, D. N., Kirschnert, M. W. The minimum GTP cap required to stabilize microtubules. Curr Biol. 4 (12), 1053-1061 (1994).
- Wisanpitayakorn, P., Mickolajczyk, K. J., Hancock, W. O., Vidali, L., Tüzel, E. Measurement of the persistence length of cytoskeletal filaments using curvature distributions. Biophys J. 121 (10), 1813-1822 (2022).
- Mickey, B., Howard, J. Rigidity of microtubules is increased by stabilizing agents. J Cell Biol. 130 (4), 909-917 (1995).
- Brangwynne, C. P., et al. Bending dynamics of fluctuating biopolymers probed by automated high-resolution filament tracking. Biophys J. 93 (1), 346-359 (2007).
- Venier, P., Maggs, A. C., Carlier, M. F., Pantaloni, D. Analysis of microtubule rigidity using hydrodynamic flow and thermal fluctuations. J Biol Chem. 269 (18), 13353-13360 (1994).
- Felgner, H., Frank, R., Schliwa, M. Flexural rigidity of microtubules measured with the use of optical tweezers. J Cell Sci. 109 (Pt 2), 509-516 (1996).
- Felgner, H., et al. Domains of neuronal microtubule-associated proteins and flexural rigidity of microtubules. J Cell Biol. 138 (5), 1067-1075 (1997).
- Nishida, K., et al. Effects of three microtubule-associated proteins (MAP2, MAP4, and Tau) on microtubules' physical properties and neurite morphology. Sci Rep. 13, 8870(2023).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Brouhard, G. J., Rice, L. M. Microtubule dynamics: An interplay of biochemistry and mechanics. Nat Rev Mol Cell Biol. 19 (7), 451-463 (2018).
- Lawrence, E. J., Chatterjee, S., Zanic, M. More is different: Reconstituting complexity in microtubule regulation. J Biol Chem. 299 (12), 105398(2023).
- Howard, J., Hyman, A. A. Dynamics and mechanics of the microtubule plus end. Nature. 422 (6933), 753-758 (2003).
- Mehidi, A., Aumeier, C. Regulation of the microtubule network; the shaft matters. Curr Opin Syst Biol. 34, 100457(2023).
- Verhey, K. J., Ohi, R. Causes, costs and consequences of kinesin motors communicating through the microtubule lattice. J Cell Sci. 136 (5), jcs260735(2023).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nat Rev Mol Cell Biol. 20 (1), 38-54 (2019).
- Théry, M., Blanchoin, L. Microtubule self-repair. Curr Opin Cell Biol. 68, 144-154 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon