Method Article
Разработка подхода на основе микрофлюидики для исследования механики полимеров микротрубочек
В этой статье
Резюме
В этом протоколе подробно описывается проектирование и изготовление микрофлюидного устройства, пригодного для исследования механики полимеров микротрубочек. Синтез методов микропроизводства, автоматизированного управления потоком и компьютерного моделирования позволяет создать гибкую систему, идеально подходящую для зондирования клеточного цитоскелета in vitro.
Аннотация
В этом протоколе мы описываем конструкцию и изготовление микрофлюидного устройства, разработанного для исследования механики полимеров микротрубочек. В конструкции используются внутренние преимущества микрофлюидных устройств на основе полидиметилсилоксана (PDMS) и представлен ряд функций, обеспечивающих надежный и настраиваемый экспериментальный подход с высокой пропускной способностью. Разработанное устройство включает в себя резервные возможности улавливания пузырьков для предотвращения возникновения вредных пузырьков воздуха. Кроме того, устройство взаимодействует с автоматизированной системой управления потоком, что сокращает ручное вмешательство и позволяет проводить высокопроизводительный анализ. Коммерческое программное обеспечение для моделирования используется для лучшей разработки и понимания переноса жидкости с помощью этой системы. Наконец, мы демонстрируем возможность проводить несколько экспериментов одновременно в одном устройстве путем выращивания микротрубочек с четкими флуоресцентными метками в разных секциях устройства. В целом, эта микрофлюидная проточная система может быть использована для исследования механики микротрубочек и обеспечивает улучшения в экспериментальном дизайне для более широких исследований микротрубочек in vitro . Синтез подходов к микропроизводству, автоматизированному управлению потоком и компьютерному моделированию позволяет создать гибкую систему, идеально подходящую для зондирования клеточного цитоскелета in vitro.
Введение
Микрофлюидика позволяет точно контролировать крошечные объемы жидкости, часто менее одного микролитра, благодаря сложному проектированию и изготовлению каналов потока жидкости 1,2. Малые масштабы микрофлюидных устройств порождают уникальные инженерные феномены. А именно, число Рейнольдса — безразмерная мера отношения между инерционными и вязкими силами в потоке жидкости — невелико, обычно порядка O(10) или ниже в микрофлюидике, что подчеркивает важность вязких сил в микрофлюидных устройствах. Кроме того, число Пекле, которое сравнивает конвективный и диффузионный перенос, показывает, что конвективный перенос в целом пренебрежимо мал в микрофлюидике 3,4,5. Этот режим ламинарного потока, управляемый диффузией, в микрофлюидике является преимуществом, поскольку он поддерживает параллельные эксперименты на одном устройстве, поддерживая точные градиенты жидкости.
Фотолитография остается основным методом изготовления микрофлюидных устройств 6,7,8. Вкратце, этот процесс включает в себя создание «основного» травленого шаблона микрофлюидного дизайна (рис. 1). Подготавливается светочувствительная подложка, а фотошаблон микрофлюидной конструкции избирательно подвергает участки фоторезиста воздействию ультрафиолетового излучения. Последующие методы травления прорабатывают основание, создавая рельеф рисунка. Полидиметилсилоксан (PDMS) часто отливают и отверждают на мастере. Отвержденный PDMS, который перенимает негативные черты конструкции, затем извлекается из мастера и приклеивается к стеклянному покровному стеклу. Весь процесс изготовления обычно занимает 1-2 дня, что позволяет быстро выполнять итерации проектирования и производить несколько устройств. Подробные обзоры процессов мягкой литографии и микропроизводства доступны в других ссылках 1,2,3,10,11,12,13.
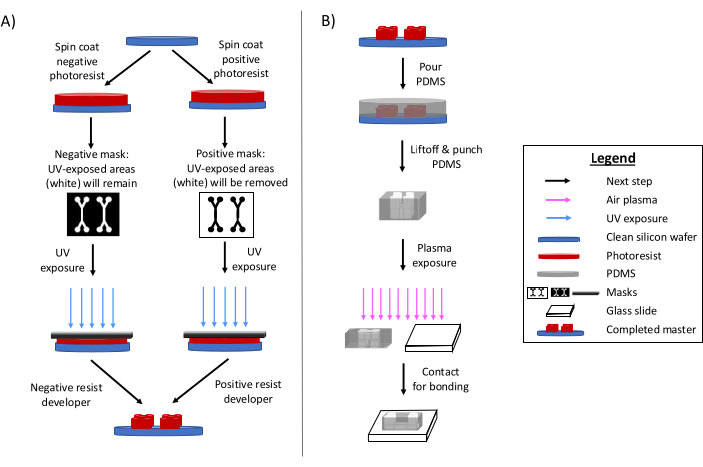
Рисунок 1: Обзоры традиционного процесса фотолитографии и процесса микропроизводства. (А) Традиционный процесс фотолитографии и (Б) процесс микропроизводства. В зависимости от области применения и желаемых характеристик фоторезиста можно использовать негативный или позитивный фоторезист, даже если они будут иметь один и тот же мастер дизайна. Такие характеристики, как желаемая высота элемента или температура плавления фоторезиста, помогают определить подходящий тип фоторезиста. Эта цифра была изменена с разрешения Rogers (2022)14. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Использование микрофлюидики расширило возможности во многих областях исследований, а последнее ее влияние произошло в биологических науках. Учитывая свои небольшие масштабы, микрофлюидика позволяет точно управлять ограниченными, ценными ресурсами, такими как клетки или белки. Еще более важным является способность микрофлюидных систем имитировать физиологические условия, такие как изменение жесткости субстрата, воздействие силы на образец и даже интеграция электрического тока. Кроме того, использование микрофлюидики дает возможность манипулировать несколькими реагентами параллельно, а также быстро создавать прототипы и итеративно совершенствовать конструкции систем. Эти функции позволяют миниатюризировать целые лабораторные рабочие процессы на одном устройстве, обычно называемом «лабораторией на чипе»1,6,9,15,16,17,18,19.
Одним из клеточно-биологических применений микрофлюидики является исследование полимеров микротрубочек. Микротрубочки являются важным компонентом цитоскелета клетки, играя жизненно важную роль в таких процессах, как деление клеток и внутриклеточный транспорт грузов20,21. Являясь наиболее жестким элементом цитоскелета, микротрубочки демонстрируют модуль упругости, сравнимый с модулем упругости плексигласа 22,23. Их прочные механические свойства имеют решающее значение для различных клеточных функций, включая, например, сокращение кардиомиоцитов, когда они циклически изгибаются и расслабляются во время систолической и диастолической фазсердца. Ранее были приняты микрофлюидные устройства для исследования свойств микротрубочек и их структур более высокого порядка in vitro. Действительно, микрофлюидика использовалась для исследования динамики полимеризации микротрубочек, взаимодействий микротрубочек и влияния белков, связанных с микротрубочками, на механические свойства микротрубочек 25,26,27,28,29,30,31,32,33,34,35 ,36,37,38,39,40,41.
В то время как внедрение микрофлюидики в область микротрубочек привело ко многим захватывающим открытиям, возможности для улучшения все еще лежат в области адаптации этих устройств для исследования микротрубочек. В этой работе мы рассматриваем два конкретных ограничения, которые сохраняются при изучении микротрубочек в микрофлюидных устройствах: возможность образования пузырьков воздуха внутри устройства, обычно возникающих при ручном манипулировании микрофлюидными устройствами, и недостаточное использование высокопроизводительных анализов. Во-первых, ручные манипуляции, такие как закупорка и откупорка трубки, могут привести к образованию пузырьков в каналах. Образование пузырьков воздуха в проточной ячейке является катастрофическим, так как пузырьки воздуха могут денатурировать белки, разрезать полимеры микротрубочек и отрицательно влиять на клеточные культуры42,43. Кроме того, острые углы и косые углы в устройстве приводят к неравномерному смачиванию поверхности, увеличивая возможность уноса воздуха. Было разработано множество методов для уменьшения образования, стойкости и воздействия пузырьков воздуха; Тем не менее, использование методов смягчения последствий пузырей не является универсальным 42,43,44,45,46. Кроме того, хотя одним из основных преимуществ использования микрофлюидики является возможность проведения экспериментов с высокой пропускной способностью, микрофлюидика еще не использовалась для расширения исследований микротрубочек. Микрофлюидные устройства могут быть спроектированы для параллельной проверки нескольких экспериментальных условий на одном и том же устройстве. Например, градиенты жидкости могут быть использованы для направления потока различных белков или лекарств, связанных с микротрубочками, что позволяет осуществлять их целевую доставку в определенные области разделенных микротрубочек в пределах одного и того же устройства.
В этой статье мы итеративно разработали микрофлюидное устройство, которое устраняет эти ограничения. Мы предоставляем пошаговый протокол изготовления устройства, тем самым позволяя более широкой аудитории использовать микрофлюидные технологии в своих исследованиях микротрубочек. Эта конструкция устройства включает в себя функции улавливания пузырьков и использует автоматизированную систему управления потоком для сокращения ручного вмешательства, а также позволяет создавать градиенты решений в устройстве для высокопроизводительного анализа. Таким образом, разработка этой микрофлюидной конструкции может способствовать более широким исследованиям и пониманию механики микротрубочек, а также предложить ценные улучшения для экспериментальных конструкций в более широкой области исследований микротрубочек.
протокол
ПРИМЕЧАНИЕ: Работа, подробно описанная в этой части протокола, была выполнена в основной чистой комнате класса 100 Института наноразмерной науки и инженерии Вандербильта (VINSE). Желательно использовать контролируемое чистое помещение с соответствующим халатом и освещением с УФ-фильтром, чтобы предотвратить повреждение устройства из-за влажности/условий окружающего освещения, а также предотвратить загрязнение твердыми частицами. Все манипуляции с кремниевыми пластинами следует производить полированной стороной кремниевой пластины вверх. Используйте пинцет при работе с пластинами и сведите к минимуму соприкосновение с поверхностью пластины, чтобы предотвратить появление царапин. Храните в чашках Петри с закрытыми крышками при транспортировке и в конце каждого дня, если не указано иное.
1. Фотолитография (6 - 8 часов)
- Плазменная очистка 3-дюймовой кремниевой пластины в течение 5 минут под вакуумом (в идеале давление вакуума < 5 × 10-5 торр) с использованием кислорода (O2) или плазмы чистого сухого воздуха (CDA).
- Центрируйте кремниевую пластину на вращающемся устройстве для нанесения фоторезиста.
- Нанесите ~1-2 мл фоторезиста SPR 220 7.0 на центр кремниевой пластины.
ВНИМАНИЕ: Обращайтесь с фоторезистом в перчатках и в защитных средствах защиты и утилизируйте в соответствии с протоколами производителя / объекта. - Нанесите фоторезист на кремниевую пластину на желаемую толщину на основе кривых отжима производителя. Создание слоев толщиной ~13 мкм путем вращения со скоростью 1000 об/мин в течение 30 с. Позже очистите остатки фоторезиста на спиннинговой установке ацетоном и утилизируйте его в соответствии с протоколами для конкретного места.
ПРИМЕЧАНИЕ: Если после отжима пластина не покрыта фоторезистом равномерно, повторите шаги 1.2-1.4. Неоднородное покрытие может быть связано с тем, что пластина не отцентрирована на аппарате для нанесения покрытия, используется слишком мало фоторезиста и/или фоторезист не осаждается в центре пластины. - Касаясь как можно меньше фоторезиста на пластине, перенесите кремниевую пластину на горячую пластину, установленную при температуре 70 °C.
- Инкубируйте кремниевую пластину на конфорке, повышая температуру на 10 °C каждые 3-5 минут, пока температура не достигнет 115 °C.
- Выключите конфорку и дайте силиконовой пластине остыть, пока ее температура не опустится ниже 65 °C.
ПРИМЕЧАНИЕ: Этапы нагрева и охлаждения выполняются медленно, чтобы предотвратить термическое растрескивание фоторезиста, которое часто встречается при такой толщине. Если термические трещины все же возникают, их обычно можно устранить путем повторного нагрева кремниевой пластины и замедления скорости охлаждения. - С помощью щипцов перенесите охлажденную кремниевую пластину в юстировщик маски и загрузите кремниевую пластину и соответствующую фотомаску в юстировщик маски, следуя протоколам производителя и сайта.
ПРИМЕЧАНИЕ: Фотошаблоны были изготовлены сторонней стороной с использованием заданного проекта, который был создан с помощью AutoCAD. Смотрите дополнительный файл 1 для рендеринга дизайна маски. - Подвергайте кремниевую пластину воздействию ультрафиолетового (УФ) излучения в течение определенного времени (в зависимости от мощности УФ-лампы) в соответствии с протоколами производителя и объекта. Желаемая энергия для этого применения составляет ~400 мДж/см2, и рассчитайте время воздействия по формуле:
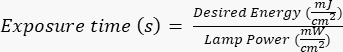 .
. - После экспонирования извлеките кремниевую пластину из выравнивателя маски и дайте фоторезисту регидратироваться в течение 4 часов за счет циркуляции воздуха. Убедитесь, что крышка чашки Петри не закрыта, чтобы обеспечить циркуляцию воздуха, но поместите чашку в место, которое вряд ли будет подвергаться воздействию твердых частиц.
ПРИМЕЧАНИЕ: В течение этого времени регидратации можно сделать 4-часовой перерыв, но рекомендуется продолжить процедуру в тот же день. - После 4-часовой регидратации перенесите экспонированную пластину на горячую плиту, установленную при температуре 70 °C.
- Инкубируйте кремниевую пластину на конфорке, повышая температуру на 10 °C каждые 3-5 минут, пока температура не достигнет 115 °C.
- Дайте вафле инкубироваться при температуре 115 °C в течение 10 минут.
- Создайте изолирующую «крышку» для открытой пластины, отлив лист алюминиевой фольги в форме крышки чашки Петри.
- Выключите конфорку и накройте открытую пластину крышкой из алюминиевой фольги. Дайте вафле остыть в течение ночи.
ПРИМЕЧАНИЕ: Термическое растрескивание фоторезиста гораздо чаще встречается на этапе инкубации после экспонирования, поэтому рекомендуется медленное охлаждение в течение ночи. На этом этапы, необходимые для первого дня изготовления, завершены. Рекомендуется переходить к следующему разделу на следующий день.
2. Проявка (1 - 2 ч)
- Когда вы будете готовы к проявлению экспонированной пластины, приобретите чистый контейнер и подходящий проявитель фоторезиста. В данном случае проявитель MF-319 используется со специальным контейнером.
ВНИМАНИЕ: Обращайтесь с проявителем в перчатках и в средствах защиты глаз, переложите контейнер для сыпучих материалов во вторичный контейнер и утилизируйте его в соответствии с протоколами производителя / объекта. - Залейте в контейнер достаточное количество проявителя, чтобы полностью погрузить открытую пластину (фактический объем зависит от контейнера).
- Погрузите экспонированную пластину в проявитель и подождите, пока весь нежелательный фоторезист не растворится. Осторожное вращение/перемешивание контейнера способствует проявке до тех пор, пока на пластине практически не будет видно остаточного фоторезиста, отличного от конструкции устройства.
ПРИМЕЧАНИЕ: В зависимости от объема используемого раствора проявителя может потребоваться многократная замена раствора проявителя для полного удаления нежелательного фоторезиста. - Извлеките проявленную пластину из проявочного раствора и аккуратно промойте обе стороны пластины деионизированной (DI) водой в течение 30 с.
- Высушите разработанную пластину газообразным азотом (N2).
- Храните разработанную в чашке Петри в сухом прохладном месте до тех пор, пока она не будет готова к дальнейшему использованию. Оберните чашку Петри алюминиевой фольгой, чтобы предотвратить деградацию фоторезиста из-за воздействия окружающего света.
ПРИМЕЧАНИЕ: Рекомендуется, но не обязательно, переходить к следующему разделу в тот же день.
3. Силанизация (1 - 2 ч)
- Перенесите кремниевую пластину в эксикатор.
- Поместите небольшой алюминиевый контейнер (или кусок алюминиевой фольги, сложенный в форму контейнера) в эксикатор.
- Пипетируйте 1 каплю (~50 μл) трихлор(1H, 1H, 2H, 2H-перфтороктил) силана в алюминиевую емкость.
ВНИМАНИЕ: Работайте с силановым раствором в перчатках и защитных средствах защиты глаз и утилизируйте его в соответствии с протоколами производителя / объекта. - Закройте эксикатор и включите пылесос.
- Дайте произойти высыханию/силанизации в течение 1-2 часов.
- По истечении времени силанизации выключите пылесос и извлеките силанизированную пластину. Храните силанизированную пластину в чашке Петри, завернутой в алюминиевую фольгу, в сухом прохладном месте до тех пор, пока она не будет готова к дальнейшему использованию.
ПРИМЕЧАНИЕ: Может потребоваться периодическое повторение силанизации на пластинах и чаще на устройствах, где используются более тонкие слои PDMS. Если при извлечении PDMS из пластины замечена адгезия PDMS, возможно, потребуется повторная силанизация пластины, и этот раздел следует повторить после того, как все PDMS будут удалены из пластины. На этом этапы, необходимые для создания мастеров микрофлюидных устройств, завершены. Мастера стабильны, и последующие секции могут быть выполнены при желании.
4. Осаждение PDMS (1 - 2 ч)
ПРИМЕЧАНИЕ: Если на ведущем устройстве есть остатки PDMS от предыдущего микропроизводства, остатки PDMS должны быть удалены перед нанесением нового PDMS.
- На весах взвесьте в контейнер PDMS и соответствующий отвердитель в весовом соотношении 10:1. Общий требуемый вес будет варьироваться в зависимости от желаемой толщины PDMS и размера чашки Петри. Для чашки Петри 4" ~20 г PDMS и ~2 г отвердителя дадут толщину 2-3 мм.
ВНИМАНИЕ: Обращайтесь с раствором PDMS в перчатках и средствах защиты глаз и утилизируйте его в соответствии с протоколами производителя / объекта. - Смешайте PDMS и отвердитель в контейнере в течение 5 минут с помощью пластикового шпателя или другого подходящего инструмента.
- Переложите контейнер со смешанной PDMS в эксикатор для дегазации.
- Закройте эксикатор и включите пылесос. В ПДМС начнут появляться пузырьки воздуха.
- Дайте произойти высыханию/дегазации в течение 30 минут. В зависимости от используемого количества PDMS и формы контейнера фактическое время может варьироваться; Общая конечная точка — это когда в PDMS присутствует мало пузырьков или их нет.
- После дегазации выключите вакуум и извлеките контейнер PDMS.
- Вылейте смешанную и дегазированную PDMS на мастер в чашке Петри.
- Инкубируйте мастер в закрытой чашке Петри при температуре 65 °C в течение ночи, чтобы PDMS полностью затвердел.
ПРИМЕЧАНИЕ: На этом этапы нанесения PDMS завершены. Рекомендуется дать ПДМС вылечиться в инкубаторе в течение ночи. В этом случае PDMS стабилен, поэтому последующие разделы могут быть выполнены при необходимости.
5. Сборка устройства PDMS (1 - 2 часа)
- Достаньте мастера (мастеров) устройства, которые вылечили PDMS, пару щипцов, стандартный 1,5-миллиметровый биопсийный перфоратор с ручным поршнем, а также лезвие скальпеля/бритвы.
ВНИМАНИЕ: Обращайтесь с лезвием осторожно и никогда не режьте в свою сторону или других. Рекомендуется использовать самовтягивающееся или предохранительное лезвие. - Вокруг особенностей устройства вырежьте прямоугольные куски PDMS из мастера слоя. Убедитесь, что у каждого элемента PDMS есть место с каждой стороны, фланкируя функции устройства для обеспечения хорошего контакта склеивания, при этом убедитесь, что каждый элемент подходит к отдельному стеклянному покровному стеклу толщиной 22 мм × 22 мм.
ПРИМЕЧАНИЕ: Важно избегать прикосновения к нижней поверхности PDMS (стороне с элементами), поэтому всегда обрабатывайте PDMS за края с помощью пинцета. Кроме того, никогда не размещайте основную сторону PDMS стороной вниз на какой-либо поверхности. Когда PDMS не используется, храните его функциональной стороной вверх в закрытом контейнере до тех пор, пока он не понадобится. - Пробивайте входные и выходные отверстия в деталях PDMS с помощью чистого дырокола диаметром 1,5 мм. Пробивайте через устройство PDMS в запасной слой жертвенного PDMS, а не в твердую поверхность, которая может повредить дырокол.
- Извлеките и очистите стеклянный покровный стекло диаметром 22 мм × 22 мм смоченной салфеткой из изопропилового спирта (IPA).
- Плазменная очистка покровного стекла диаметром 22 мм × 22 мм в течение 5 минут под вакуумом (давление < 0,5 мм рт. ст.) с помощью плазмы CDA. Это удалит любой мусор или органические покрытия с покровного стекла.
- Протрите стеклянную защитную крышку диаметром 22 мм × 22 мм и основную сторону PDMS салфеткой, смоченной в IPA.
- Поместите PDMS (лицевой стороной вверх) и стеклянное покровное стекло (той же стороной вверх, что и раньше) в плазменный очиститель и одновременно проведите плазменную очистку в течение 30 с под вакуумом (давление < 0,5 мм рт. ст.) с помощью плазмы CDA.
- Снимите стеклянную защитную крышку и устройство PDMS с плазменного очистителя. Переверните PDMS так, чтобы сторона элемента была обращена вниз, и поместите его на стеклянную защитную крышку. Следите за склеиванием и при необходимости слегка нажимайте на PDMS, чтобы обеспечить хороший контакт.
- Инкубируйте склеенный покровный лист в закрытой чашке Петри при температуре 65 °C в течение 3 минут для облегчения склеивания.
ПРИМЕЧАНИЕ: Плазменное связывание изменяет гидрофобность стеклянного покровного стекла, создавая гидрофильную поверхность. Было замечено, что исходное гидрофобное состояние покровного стекла возвращается примерно через 2 дня инкубации при комнатной температуре. Изготавливаемые устройства рекомендуется использовать не ранее, чем через 2 суток после плазменного склеивания. На этом этапы микропроизводства завершены. Устройства не имеют установленного срока годности, но их следует хранить в прохладном, сухом месте, когда они не используются.
6. Подготовка микрофлюидного проточного канала (1 ч)
- Закрепите собранное микрофлюидное устройство в чистом адаптере специального столика47.
- Возьмите шприц, адаптер Lour-lock и фитинговый наконечник, а также кусок прозрачной трубки наружного диаметра 1,5 мм (длиной примерно 15-20 см). Подсоедините трубку к шприцу с помощью адаптера.
- Подсоедините еще три части трубки к выходным отверстиям микрофлюидного устройства (эта трубка не обязательно должна быть определенной длины) и направьте другой конец этих трубок в пробирку для отходов ниже по потоку.
- С помощью шприца подготовьте микрофлюидное устройство, вводя растворы в соответствии с приведенными ниже инструкциями. Последовательность и объем растворов следующие: 50 мкл буферного раствора BRB80, 25 мкл раствора антиродаминового антитела, подождать 5 мин, 50 мкл BRB80, 25 мкл полоксамера 407 (F127), подождать 15 мин и 50 мкл BRB80. Пример приведен в таблице 1 .
- Втяните раствор из источника в трубку.
ПРИМЕЧАНИЕ: Не вытягивайте раствор полностью в сам шприц. Раствор должен оставаться только в трубке. - Осторожно надавите на поршень шприца, пока на конце трубки не появится небольшая капля жидкости. Это предотвратит попадание воздуха в микрофлюидное устройство, когда трубка прикреплена.
- Подсоедините трубку к входному отверстию микрофлюидного устройства.
- Медленно нажимайте на поршень шприца, пока большая часть, но не весь раствор не пройдет через трубку. Если оставить небольшое количество жидкости в трубке, вы гарантируете, что воздух случайно не пройдет через трубку. Наблюдайте за трубками и микрофлюидными каналами во время этих пересадок, ища любые пузырьки.
ПРИМЕЧАНИЕ: Если в трубке появились пузырьки, начните устранение неполадок (попытайтесь удалить пузырь до того, как он попадет в микрофлюидное устройство, отсоединив трубку непосредственно перед прибытием пузырька, а затем снова прикрепив трубку после того, как пузырь пройдет и т. д.). - Повторяйте шаги 6.4.1-6.4.4 для следующего реагента до тех пор, пока все реагенты не будут пролетены. Для каждого реагента потребуется новый участок входной трубки, чтобы предотвратить перекрестное загрязнение исходных реагентов. После завершения окончательной стирки BRB80 устройство стабильно работает в течение нескольких минут. Капля раствора BRB80 на входные отверстия предотвратит высыхание устройства.
- Втяните раствор из источника в трубку.
- Приготовление стабилизированных гуанозин-5'-[(α,β)-метилен]трифосфатом (GMPCPP)-стабилизированных микротрубочек в соответствии со стандартными протоколами (с коэффициентом мечения TTR ~25%)47,48.
- Приготовьте буферный раствор для визуализации («антифейд») в 2-кратной рабочей концентрации, комбинируя следующие реагенты в соответствующих количествах (в зависимости от исходных концентраций) для получения указанных конечных концентраций: BRB80 с добавлением 40 мМ глюкозы, 40 мкг/мл глюкозооксидазы, 16 мкг/мл каталазы, 0,5 мг/мл казеина, 50 мМ хлорида калия и 10 мМ дитиотреитола (DTT). Этот буфер изображения используется для продления фотостабильности. Пример приведен в таблице 2 .
- Разбавьте порцию 2x раствора antifade 1:1 в BRB80 до получения 1x рабочего раствора antifade. Нагрейте этот антифейдер до комнатной температуры (RT); Стоковый раствор Antifade следует держать на льду.
| Порядок | Реагентов | Разбавление объема | Объем стирки | Время инкубации |
| 1 | БРБ80 | Н/Д | 50 μл | Н/Д |
| 2 | Антитела к родамину | 1:50 в BRB80, хорошо перемешать | 25 мкл | 5 мин |
| 3 | БРБ80 | Н/Д | 50 μл | Н/Д |
| 4 | Полоксамер 407 (F127) | 1% в BRB80 | 25 мкл | 15 мин |
| 5 | БРБ80 | Н/Д | 50 μл | Н/Д |
Таблица 1: Порядок подготовки каналов микрофлюидного устройства.
| Том | Реагент | Концентрация запасов | Окончательная концентрация |
| 16 μл | D-глюкоза | 2 Ф. | 80 мМ |
| 16 μл | Глюкозооксидаза | 2 мг/мл | 80 мкг/мл |
| 16 μл | Каталазы | 0,8 мг/мл | 32 мкг/мл |
| 14 μЛ | Казеин | 28 мг/мл | 0,16 мг/мл |
| 8 μл | ДТТ | 1 М | 20 мМ |
| 40 μл | Хлористый калий | 1 М | 100 мМ |
| 290 мкл | БРБ80 | 1x | Н/Д |
| 400 мкл | FINAL (2x рабочая концентрация) |
Таблица 2: Рецепт раствора для визуализации Antifade (концентрация 2x).
7. Введение семян микротрубочек в микрофлюидную терапию (10 - 15 мин)
- Подключите микрофлюидное устройство к микроскопу.
ПРИМЕЧАНИЕ: Поскольку стабильность микротрубочек зависит от температуры, рекомендуется проводить эксперименты по визуализации при температуре 35 °C. - Прикрепите к шприцу 10-15 см новой трубки и втяните в трубку желаемое разведение семян микротрубочек, стабилизированных GMPCPP.
ПРИМЕЧАНИЕ: Для этого устройства оптимальной концентрацией было ~10 нМ семян GMPCPP-микротрубочек. - Осторожно надавите на поршень шприца, пока на конце трубки не появится небольшая капля жидкости. Это предотвратит попадание воздуха в микрофлюидное устройство, когда трубка прикреплена.
- Подсоедините трубку к входному отверстию микрофлюидного устройства.
- Медленно нажимайте на поршень шприца, пока большая часть, но не весь раствор не пройдет через трубку. Если оставить небольшое количество жидкости в трубке, вы гарантируете, что воздух случайно не пройдет через трубку.
- Отсоедините входную трубку от микрофлюидного устройства и шприца и прикрепите к шприцу новый кусок трубки.
- Втяните BRB80 в трубку.
- Повторите шаги 7.3-7.6, чтобы вымыть из устройства несвязанные семена микротрубочек.
- Наблюдайте за прикреплением семян к микрофлюидной поверхности с помощью микроскопии полного внутреннего отражения (TIRF). Идеальное количество семян в одном поле зрения будет варьироваться в зависимости от применения и размера поля зрения, но в целом оптимальным является ~10-20 семян на 80 мкм × 80 мкм. При необходимости повторяйте шаги 7.2-7.9 до тех пор, пока не будет достигнута желаемая плотность семян.
ПРИМЕЧАНИЕ: Для контроля плотности семян микротрубочек следует использовать прерывистое воздействие ближним светом (100 мс), поскольку в растворе еще нет антивыцветания. - Как только будет достигнута соответствующая плотность связанного семени, прикрепите к шприцу новый кусок входной трубки.
- Наберите теплый 1x раствор против выцветания в трубку и повторите шаги 7.3-7.6.
ПРИМЕЧАНИЕ: С помощью решения для защиты от выцветания в устройстве фотостабильность значительно улучшается, и устройство работает стабильно. Тем не менее, все же рекомендуется свести к минимуму воздействие лазерного света.
8. Выращивание отростков микротрубочек из семян (15 - 30 мин)
- Объедините флуоресцентно меченный тубулин, немеченый тубулин, 2x раствор для защиты от выцветания, гуанозин-5'-трифосфат (GTP) и BRB80 для получения конечного раствора, содержащего 14 мкМ тубулин при 7% соотношении флуоресцентного мечения, антификацию от выцветания при 1x рабочей концентрации и 1 мМ ГТФ.
ПРИМЕЧАНИЕ: При использовании различных концентраций или разного процентного содержания тубулина, объем каждого реагента необходимо будет скорректировать для достижения желаемой конечной концентрации и коэффициента мечения. Держите раствор тубулина на льду до ~30 с перед введением, после чего снимите раствор со льда и согрейте его в руке до состояния RT. Это поможет в полимеризации расширений микротрубочек, что является процессом, зависящим от температуры. Действительно, полимеризацию микротрубочек следует проводить при 35 °C, в то время как все остальные экспериментальные этапы можно проводить при RT. - Подсоедините к шприцу 10-15 см новой трубки и наберите в трубку раствор тубулина.
- Осторожно надавите на поршень шприца, пока на конце трубки не появится небольшая капля жидкости. Это предотвратит попадание воздуха в микрофлюидное устройство, когда трубка прикреплена.
- Подсоедините трубку к входному отверстию микрофлюидного устройства.
- Медленно нажимайте на поршень шприца, пока большая часть, но не весь раствор не пройдет через трубку. Если оставить небольшое количество жидкости в трубке, вы гарантируете, что воздух случайно не пройдет через трубку. Отсоедините впускную трубку от микрофлюидного устройства.
- Изображение с нужной частотой в течение 10-15 минут или до тех пор, пока удлинители не станут достаточно длинными для сгибания. Как правило, визуализацию проводят с длиной волны 488 нм каждые 5 с и 561 нм каждые 60 с до тех пор, пока длина расширений не составит не менее 5-10 мкм (~15 мин).
ПРИМЕЧАНИЕ: При такой концентрации тубулина микротрубочки могут стохастически переключаться между периодами полимеризации и деполимеризации; Этого и следовало ожидать, но в целом расширения микротрубочек удлинятсяв 49 раз.
9. Стабилизирующее разгибание микротрубочек (10-15 мин)
- Объедините таксол, 2x раствор antifade и BRB80 для получения конечного раствора, содержащего 10 мкМ таксол и антифальцвецию в 1x рабочей концентрации.
ПРИМЕЧАНИЕ: Держите раствор таксола на льду до ~30 с перед введением, после чего снимите раствор со льда и согрейте его в руке до состояния RT. Это предотвратит деполимеризацию микротрубочек, которая является процессом, зависящим от температуры. - Присоедините к шприцу 10-15 см новой трубки и наберите в нее раствор таксола.
- Осторожно надавите на поршень шприца, пока на конце трубки не появится небольшая капля жидкости. Это предотвратит попадание воздуха в микрофлюидное устройство, когда трубка прикреплена.
- Подсоедините трубку к входному отверстию микрофлюидного устройства.
- Нажимайте на поршень шприца до тех пор, пока большая часть, но не весь раствор не пройдет через трубку. Если оставить небольшое количество жидкости в трубке, вы гарантируете, что воздух случайно не пройдет через трубку.
- Повторите шаги 9.2-9.5 дважды в быстрой последовательности. В этом случае можно использовать тот же кусок трубки.
ПРИМЕЧАНИЕ: Таксол способствует зарождению микротрубочек de novo из тубулина в растворе, и эти микротрубочки могут приземляться на поверхность микрофлюидного канала и препятствовать последующей визуализации/изгибу. Из-за этого раствор таксола должен протекать через устройство быстро и в несколько итераций, чтобы как можно быстрее удалить как можно больше свободного тубулина из устройства. - Убедитесь, что микротрубочки, выращенные из семян, все еще присутствуют и стабилизируются в устройстве.
10. Изгибание стабилизированных микротрубочек (10 - 15 мин)
ПРИМЕЧАНИЕ: Стабилизированные удлинители микротрубочек теперь можно согнуть с помощью регулятора потока. Здесь использовалась регулируемая система вытеснения с положительным давлением (Elveflow OB1 MK3+) для подачи раствора из герметичного флакона через расходомер в микрофлюид. В зависимости от специфики имеющейся конфигурации регулятора расхода могут быть внесены изменения в следующие этапы.
- Настройте регулятор расхода и соответствующее оборудование в соответствии с протоколами производителя и объекта, используя трубки для подключения исходного флакона к входу расходомера и выходного отверстия расходомера к входному отверстию микрофлюидного устройства, но пока не подключайте трубку к микрофлюидному устройству.
- Вставьте ~200 μL раствора таксола 10 μМ в исходный флакон, который можно прикрепить к настройке регулятора расхода. В этой конфигурации используются соединения Luer-lock для создания герметичного уплотнения.
- Включите систему управления потоком и загрунтуйте трубку, чтобы удалить воздух. Это предотвратит попадание воздуха в микрофлюидное устройство, когда трубка прикреплена.
- После того, как трубка была пропущена через расходомер и на конце трубки появилась небольшая капля жидкости, выключите систему управления потоком.
- Подсоедините трубку к входному отверстию микрофлюидного устройства. Используйте входное отверстие перпендикулярно входу, используемому для введения семян микротрубочек, и выращивайте расширения микротрубочек, чтобы они изгибались ортогонально.
- Изгибайте удлинители, запуская и останавливая поток при желаемом расходе или давлении. Давление 30 мбар является стандартом для этого протокола с использованием колебательного потока с периодом 5 с. Представьте себе изгиб в течение этого времени, обычно каждые 0,1 с при длине волны 488 нм и каждые 10 с при длине волны 561 нм.
ПРИМЕЧАНИЕ: На этом основной анализ изгиба микротрубочек завершен. Все оборудование и реагенты могут быть очищены/утилизированы в соответствии с протоколами производителя / объекта.
Результаты
Обоснование конструкции микрофлюидного устройства
При проектировании микрофлюидного устройства в этом исследовании учитывались несколько ключевых особенностей (рис. 2), которые дополняют и улучшают традиционную простую конструкцию проточной ячейки. Следует отметить, что микрофлюидное устройство имеет внутренний объем ~160 нл, что значительно меньше, чем объем ~10 мкл более традиционных проточных ячеек47, что позволяет более контролируемо использовать потенциально ценные реагенты, такие как очищенные белковые компоненты. Поскольку микрофлюидный регулятор потока содержит два регулирующих канала, устройство было разработано с учетом того, что только два входных/выходных отверстия будут контролировать давление в любой момент времени. При желании можно реализовать больше каналов с регулируемым давлением.
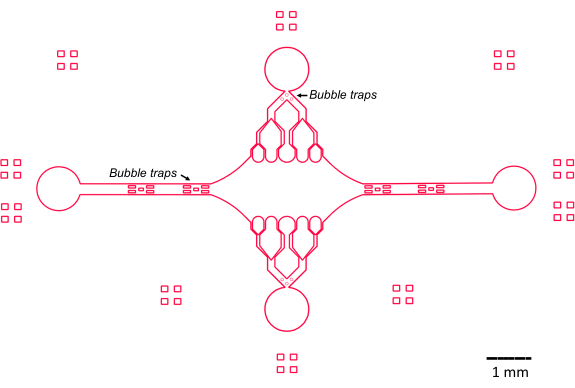
Рисунок 2: Схема конструкции микрофлюидного устройства. Прямоугольная разметка на периферии предназначена для визуального облегчения видения периферии каналов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Центральная прямоугольная камера устройства служит основной областью визуализации, где прикрепляются семена микротрубочек, а из этих семян полимеризуются расширения микротрубочек. Камера пересекается проточным каналом с каждой стороны, с прямыми каналами по оси X, служащими входом и выходом для обеспечения быстрого обмена реакционным раствором. Входной канал микротрубочек также используется для введения семян микротрубочек в камеру, при этом ламинарный поток приводит к связыванию семян с поверхностью стекла по направлению потока. В перпендикулярном (по оси y) направлении проточные каналы разветвляются на более мелкие каналы по направлению к камере, аналогично некоторым из предыдущих конструкций 25,28,36,39. Геометрия ветвления особенно подходит для изучения механических свойств микротрубочек. Подача раствора в центральную камеру с направления, перпендикулярного ориентации семян микротрубочек, позволяет создавать индуцированные потоком изгибающие силы под углами, близкими к нормальным. Кроме того, включение разветвляющейся геометрии с большим количеством меньших каналов потока способствует более равномерному приложению силы на широкой площади центральной камеры, что не достигается простой одноканальной геометрией потока. Таким образом, мотив ветвления, хотя и кажется более сложным, может уменьшить общую сложность в определении силы, передаваемой микротрубочкам (рис. 3). Эта конструкция также имеет несколько линий симметрии, что обеспечивает простоту использования и возможность оценки изгиба с нескольких направлений (например, сверху или снизу).
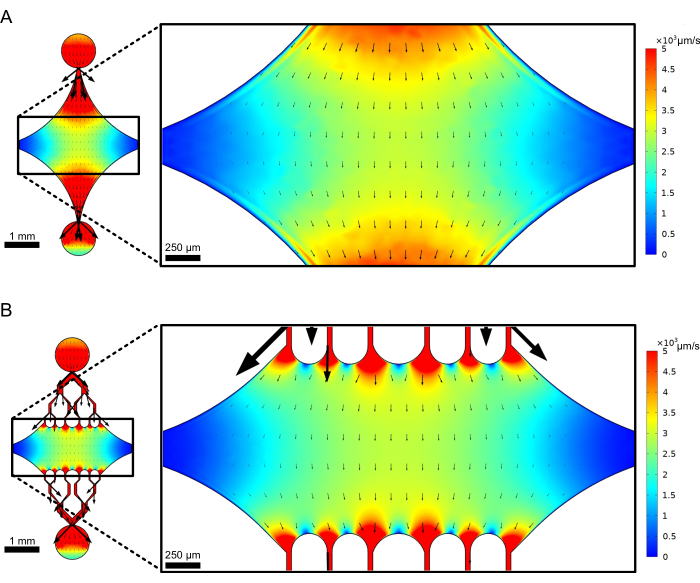
Рисунок 3: Включение разветвляющегося мотива приводит к образованию большой области подобного потока. Моделирование двух конструкций устройств в установившемся потоке: одного без разветвляющихся каналов (A) и одного с разветвляющимися каналами (B). Стрелки обозначают местное направление стока и пропорциональны величине стока. Окраска поверхности обозначает скорость осевой линии. Изображения справа показывают увеличенную часть устройства, где микротрубочки (не показаны), ориентированные по оси X, будут подвергаться изгибающим силам от жидкости, протекающей в верхнем порту и выходящей из нижнего порта. Включение разветвляющихся каналов увеличивает относительную площадь под действием аналогичных полей скоростей при этом не увеличивает объем требуемого реагента. Эта цифра была изменена с разрешения Rogers (2022)14. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Примечательно, что в устройстве также реализован ряд пузырьковых ловушек во входном и выходном каналах потока для предотвращения попадания пузырьков воздуха в центральную камеру визуализации. В частности, мы решили включить массивы микростолбов в путь потока, чтобы блокировать прохождение пузырьков воздуха из-за поверхностного натяжения (Рисунок 2)46. Кроме того, чтобы предотвратить захват воздуха, мы спроектировали края внутри устройства в виде плавных изгибов, а не под косыми углами. В совокупности эти конструктивные особенности снижают вероятность образования пузырьков воздуха и повышают надежность устройства.
Изготовление микрофлюидных устройств
Определение правильных параметров для создания мастера устройства потребовало некоторой оптимизации. Как было отмечено ранее, этот фоторезист очень чувствителен к ключевым рабочим параметрам, таким как окружающее освещение и скорости нагрева и охлаждения во время фотолитографии50 шагов. Например, если мастер охлаждался слишком быстро после нагрева, в фоторезисте могли образоваться термические трещины. Это нежелательно, так как трещины могут нарушить целостность канала. В то время как трещины могут быть устранены путем повторного нагрева резиста до температуры, близкой к температуре перехода (~115 °C), мы обнаружили, что предоставление мастеру возможности охлаждения окружающей среды на горячей пластине является наиболее надежным способом предотвращения растрескивания. Кроме того, избыток окружающего света может привести к непреднамеренному воздействию фоторезиста, ослаблению резиста и к тому, что сами функции устройства (которые должны остаться на пластине после проявки) будут частично удалены на этапе разработки. По этой причине мы рекомендуем выполнять этап разработки на следующий день после этапа выпечки после выдержки и ночного охлаждения при температуре окружающей среды. Более того, когда мастер-устройство не используется, мы рекомендуем хранить его в темном месте или завернуть в алюминиевую фольгу, чтобы предотвратить его износ со временем. Как только эти параметры были определены, процесс фотолитографии стал очень воспроизводимым (Рисунок 4).
После того, как мастер был создан, жидкий PDMS был отлит поверх мастера, что позволило PDMS отверждаться и создать негативный отпечаток черт мастера. Мы обнаружили, что литье PDMS толщиной 2-3 мм позволяет легко манипулировать устройствами; Напротив, при нанесении спинового покрытия для достижения толщины в диапазоне мкм, PDMS был склонен к разрыву или самосклеиванию, что затрудняло манипуляции. Кроме того, более толстый слой PDMS облегчает засорение трубок, так как трубки остаются во входных/выходных отверстиях без необходимости использования герметика или зажима.
Наконец, в то время как в традиционных анализах проточных ячеек для этих биологических применений часто используются стеклянные покровные стекла, которые были предварительно очищены с помощью раствора пираньи (перекись водорода и серной кислоты) и затем силанизированы, мы обнаружили, что покровные стекла, обработанные пролонгированной плазмой и промывкой изопропила, подходят для наших целей. Другие приложения, такие как визуализация с использованием одной молекулы, могут потребовать более обширной обработки покровного стекла.

Рисунок 4: Процесс фотолитографии. (А) Маска с желаемым дизайном (маска изготовлена из хрома, выгравированного на стекле). (Б) Незначительное растрескивание фоторезиста на кремниевой пластине из-за термического напряжения (стрелками выделены несколько трещин). Эти трещины часто тянутся по всей пластине. (C) Развитый мастер. (D) Микрофлюидная установка на микроскопе. Отдельные компоненты помечены зеленым цветом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Рост, стабилизация и изгиб микротрубочек
Выращенные в GMPCPP семена микротрубочек служат центрами зарождения для полимеризации микротрубочек и сами устойчивы к деполимеризации в течение нескольких часов при комнатной температуре. Семена связывали со стеклянным покровным стеклом в микрофлюидном канале с помощью антиродаминового антитела47. Затем динамические расширения микротрубочек выращивали в присутствии растворимого тубулина (флуоресцентно меченного, но не конъюгированного с родамином) и ГТФ. Таким образом, сайты зарождения семян были прикреплены к стеклянному покровному стеклу, а удлинители — нет. В течение 15-минутного периода роста удлинения микротрубочки полимеризуются и деполимеризуются стохастически, как и ожидалось, из-за их внутренней динамической нестабильности49. После этого периода роста проводили промывку таксолом 10 мкМ для удаления остатков тубулина из раствора и стабилизации образовавшихся расширений микротрубочек. Стабилизация является ключевым фактором, так как в противном случае расширения микротрубочек деполимеризуются при истощении тубулина. В дополнение к связыванию и стабилизации полимера микротрубочек, было также продемонстрировано, что Таксол влияет на механику полимера микротрубочек и может вызывать искривление в других линейных расширениях микротрубочек 51,52,53,54. Показанные здесь результаты отражают эти наблюдения; Тем не менее, скручивание расширений микротрубочек нежелательно, так как это приводит к неравномерным усилиям, прилагаемым вдоль решетки во время изгиба. Поэтому для анализа изгиба использовались только микротрубочки, которые оставались относительно прямыми после стабилизации. В качестве альтернативы, после начального периода роста, вторичный период роста с раствором тубулина и GMPCPP (в отличие от исходного ГТФ) может быть использован для создания стабильных «колпачков» на растущих концах решетки микротрубочек и предотвращения деполимеризации55.
Затем микротрубочки изгибались путем протекания в буферном растворе с использованием системы контроля давления для поддержания постоянного давления на входе (рис. 5, дополнительное видео 1). Таким образом, мы могли бы аппроксимировать локальный поток, испытываемый микротрубочками. За счет подачи жидкости сверху и из нижнего отверстия устройства ориентация потока должна быть перпендикулярна ориентации посева.
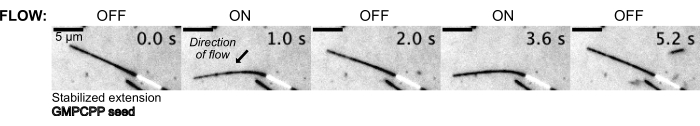
Рисунок 5: Микрофлюидная установка может быть использована для изгиба стабилизированных микротрубочек. Микротрубочки в состоянии покоя после стабилизации паклитакселом изгибаются во время пульсирующего потока. Постоянное давление на входе 30 мбар приводит в движение поток (стрелка обозначает направление потока). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Определение профиля потока в микрофлюидном устройстве
Скорость осевой линии в микрофлюидике может быть смоделирована вычислительно с помощью программного обеспечения COMSOL (программное обеспечение для моделирования, рисунок 6A). Тем не менее, микротрубочки прикрепляются к стеклянному покровному стеклу для микроскопии TIRF в пределах ~100 нм от поверхности. Таким образом, скорость, испытываемая микротрубочками, не совпадает с той, которая предсказана в 2D-моделировании. Чтобы аппроксимировать локальный поток, испытываемый микротрубочками, мы использовали общее уравнение Навье-Стокса для потока несжимаемой жидкости в одном измерении:
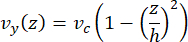
Здесь z — высота микротрубочек в устройстве, h — общая высота устройства, а vc — скорость осевой линии в устройстве. По определению системы, z-начало координат является центром устройства (рис. 6B). Используя это определение и высоту канала 13 мкм, высота микротрубочек аппроксимируется как z = -6,4 мкм. Решение этого уравнения дает оценку локальной скорости жидкости, испытываемой микротрубочками:

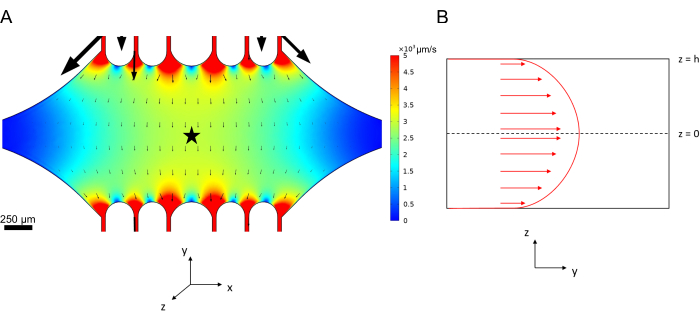
Рисунок 6: Определение системы анализа потока жидкости жидкости, входящей в устройство через верхний порт и выходящей через нижний порт (порты не показаны). (A) Моделирование масштабированного поля скорости осевой линии, как показано на рисунке 3B. Звездочкой обозначена область интереса для панели B. (B) Поперечное представление устройства. Полностью разработанный профиль потока жидкости находится в направлении y с осевой скоростью vc при z = 0 и граничным условием отсутствия скольжения у стенок. Обратите внимание, что стрелки на этой панели не должны масштабироваться относительно фактического поля скорости, показанного на панели А. Эта цифра была изменена с разрешения Rogers (2022)14. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Помимо моделирования, скоростью жидкости можно управлять с помощью регулятора потока, основанного на объемном расходе, а не на поддержании давления. Кроме того, локальная скорость потока в каждом устройстве может быть напрямую определена путем включения флуоресцентных гранул и мониторинга их скорости, что снижает любую вариабельность от образца к образцу.
Компьютерное моделирование и демонстрация градиента
Наконец, мы провели вычислительное моделирование в сочетании с экспериментами, чтобы продемонстрировать возможность использования этого устройства для экспериментов с высокой пропускной способностью. Наряду с возможностью изгибать микротрубочки в нескольких направлениях благодаря симметрии устройства, моделирование показало, что устройство может поддерживать точные градиенты, что позволяет одновременно исследовать несколько экспериментальных условий (рис. 7A). Предварительные эксперименты (методы, явно не указанные в данной публикации) с использованием флуоресцентного красителя в растворе продемонстрировали согласованность с вычислительными предсказаниями (рис. 7B). Кроме того, мы успешно продемонстрировали разделение различных белков в разных областях устройства путем одновременного выращивания расширений микротрубочек с различными флуоресцентными метками (рис. 8). Насколько нам известно, это первое применение высокопроизводительной микрофлюидики для исследования микротрубочек. Эта особенность данного устройства может быть использована для сокращения времени и количества необходимых реагентов, а также для повышения надежности экспериментов. Например, влияние различных белков или различных концентраций отдельных белков на механику и динамику микротрубочек может быть одновременно исследовано в одном устройстве.
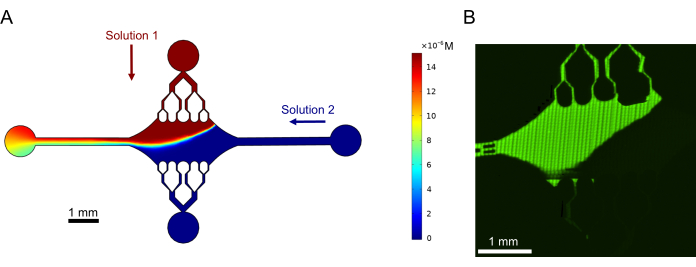
Рисунок 7: Формирование градиента. (A) Моделирование градиента двух растворов, поступающих в устройство при одинаковом давлении на входе (50 мбар) и концентрации (15 мкМ). Входные отверстия для каждого решения обозначены цветными стрелками (один раствор в верхнем порту, а другой раствор в правом порту), а два оставшихся порта служат выходами. Тепловая карта показывает профиль концентрации верхнего раствора. Стационарное состояние было достигнуто при t = 5 с. (B) Экспериментальная генерация аналогичного градиента с использованием флуоресцентного красителя в растворе в верхнем порту и буфере в правом порту. Изображение представляет собой растровый слой, выполненный путем сшивания каждого поля зрения (80 мкм × 80 мкм) для разрешения всей области устройства. Эта цифра была изменена с разрешения Rogers (2022)14. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
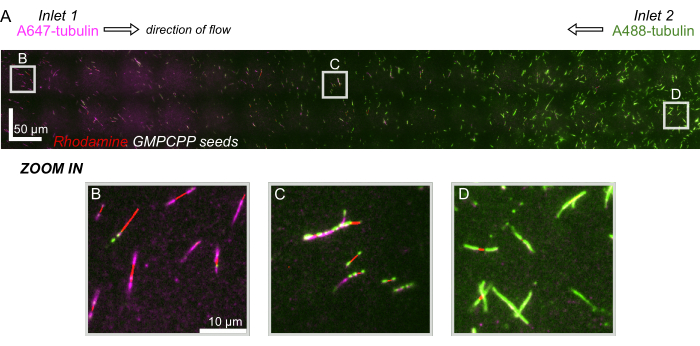
Рисунок 8: Демонстрация белкового градиента в микрофлюидном устройстве. Меченый тубулин AlexaFluor647 (пурпурный) был запущен во входе 1, а меченый Tubulin AlexaFluor488 (зеленый) был запущен во входе 2 устройства при равных концентрациях и скоростях потока. Поток осциллировался вкл/выключался с шагом 90 с, чтобы обеспечить полимеризацию тубулина из стабилизированных семян GMPCPP (красный) при одновременном ингибировании перемешивания. (A) Крупномасштабный растровый слой, выполненный путем сшивания полей зрения (80x80 мкм) для разрешения по всей длине устройства. Буквы обозначают относительное расположение отдельных полей зрения на последующих панелях. Масштабная линейка имеет 50 мкм в положениях X и Y. (B) Поле зрения вблизи входа 1 устройства, где расширения состоят преимущественно из тубулина, меченного A647. (C) Поле зрения вблизи середины устройства, где расширения состоят из смеси меченых тубулинов, как и прогнозируется. (D) Поле зрения в нижней части устройства, где расширения состоят преимущественно из тубулина, меченного A488. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Технологическая схема (PFD) для экспериментальной установки микрофлюидики на микроскопе показана на дополнительном рисунке 1.
Дополнительный рисунок 1: Технологическая схема (PFD) для экспериментальной установки микрофлюидики на микроскопе. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительное видео 1. Микрофлюидная установка может быть использована для изгиба стабилизированных микротрубочек. Микротрубочки в состоянии покоя после стабилизации паклитакселом изгибаются во время пульсирующего потока. Постоянное давление на входе 30 мбар приводит в движение поток. Скорость воспроизведения видео 10 кадров в секунду. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 1: Файл САПР конструкции микрофлюидной маски. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Основной целью этого протокола было спроектировать и изготовить микрофлюидное устройство, пригодное для исследования механики микротрубочек in vitro. Дизайн был основан на желании использовать внутренние преимущества микрофлюидных устройств на основе PDMS, а также включить комбинацию функций, которые позволили бы проводить надежные и настраиваемые эксперименты с высокой пропускной способностью.
Эта цель была успешно достигнута, в результате чего были разработаны протоколы изготовления и общие рекомендации, которые могут послужить основой для будущих пользователей этой системы. Включение в состав устройства резервных пузырьковых ловушек снижает вероятность денатурации белка из-за наличия пузырьков воздуха. Несмотря на то, что нам все еще приходится отключать и повторно подключать трубки в устройстве, эти пузырьковые ловушки снижают вероятность неудачи эксперимента. Будущие усовершенствования микрофлюидной установки могут еще больше сократить количество ручных манипуляций с трубками, выполняемых во время эксперимента. Кроме того, интеграция микрофлюидного устройства с программным обеспечением для автоматического управления потоком позволяет значительно адаптировать условия эксперимента при одновременном снижении вероятности ручной ошибки. Мы продемонстрировали успешную работу устройства, изготовив устройство, а затем вырастив, стабилизировав и изгиб удлинителей микротрубочек в устройстве с помощью автоматического потока, регулируемого контроллером. Кроме того, установив градиент различных флуоресцентно меченых растворов тубулина в одном и том же устройстве, мы показали, что в одном устройстве может одновременно выполняться несколько условий. С помощью методов вычислительного моделирования и анализа наша система может исследовать и определять биомеханические свойства микротрубочек, такие как жесткость при изгибе 52,56,57,58,59.
Потенциальные будущие усовершенствования будут способствовать еще более надежной системе и связанному с ней экспериментальному анализу. Во-первых, осаждение фоторезиста, экспозиция и запекание были ключевыми параметрами, которые продемонстрировали некоторую изменчивость. Относительно большие размеры фоторезиста SPR требовали очень постепенного нагрева и охлаждения для предотвращения термического растрескивания, которое могло бы испортить устройства. Хотя мы пробовали использовать более тонкие устройства, мы обнаружили проблемы с манипулированием этими меньшими размерами функций. Внимание к деталям и терпение имеют решающее значение для воспроизведения устройств такой толщины с фоторезистом SPR. Для решения этой проблемы могут использоваться различные фоторезисты, в зависимости от доступности.
В совокупности микрофлюидное устройство и протокол позволяют использовать ряд экспериментальных установок с более надежными и высокопроизводительными возможностями тестирования по сравнению с предыдущими анализами проточных ячеек. Кроме того, эксперименты могут быть автоматизированы с помощью регуляторов потока для поддержания точных профилей потока или градиентов концентрации в устройстве, уменьшая вариативность, присущую ручным пользователям. Будущие потенциальные применения этой установки включают исследование влияния белков, связанных с микротрубочками, на жесткость изгиба микротрубочек, динамику, повреждение и восстановление решетки, а также биомеханические взаимодействия микротрубочек и актиновых филаментов 54,60,61,62,63,64,65,66,67,68 ,69,70. Интеграция методов микропроизводства, автоматизированного управления потоком и вычислительного моделирования и анализа создает универсальную систему, пригодную для изучения клеточного цитоскелета in vitro.
Раскрытие информации
У авторов нет конфликта интересов. Авторы раскрывают использование ChatGPT-4o OpenAI для доработки и корректуры текста.
Благодарности
Мы благодарны за поддержку и ресурсы, предоставленные Институтом наноразмерной науки и техники Вандербильта (VINSE), где была проведена часть этих исследований. Эта работа была частично профинансирована за счет гранта NIH NIGMS для M. Zanic (R35 GM1192552) и гранта NSF ID 2018661 для M. Zanic. М. Роджерс получил поддержку от гранта NIH T32 GM08320 и грант VINSE за финансирование пилотного проекта. Л. Ричардсон получает грант NSF GRFP No 1937963. Авторы также хотели бы поблагодарить доктора Элис Лич, Дэвида Шаффера, доктора Кристину МакГахан и всю лабораторию Zanic за их помощь и поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.6 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mm standard biopsy punch | Integra LifeSciences | 33-31A-P/25 | |
| 100x/1.49 numerical aperture TIRF objective | Nikon | ||
| 22 x 22 mm glass coverslips | ThorLabs | CG15CH | |
| 3" single side polished silicon wafers | University Wafer | 447 | |
| 4" Petri dish | Any brand | ||
| 450 µL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter, Inc. | 345843 | Referred to as 'airfuge tube' in the protocol |
| 488-, 561, and 640-nm solid state lasers | Nikon | ||
| A-95 Fixed-Angle Rotor | Beckman Coulter, Inc. | 347595 | |
| Acetone | Any brand | ||
| Airfuge Air-Driven Ultracentrifuge | Beckman Coulter, Inc. | 347854 | Referred to as 'airfuge' in the protocol |
| Alexa Fluor 488 Microscale Protein Labeling Kit | Thermo Fisher Scientific | A30006 | |
| Aluminum foil | Any brand | ||
| Andor iXon Ultra EM-CCD | Nikon | ||
| Andor NEO sCMOS | Nikon | ||
| AutoCAD | Autodesk | Generic versions can be used | |
| Bovine brain unlabeled tubulin (purified) | N/A | Made in house, but can be purchased | |
| Casein | MilliporeSigma | C7078 | |
| Catalase | MilliporeSigma | C9322 | |
| Clean Dry Air (CDA) (pressurized gas) | Any brand | ||
| Compressed air supply | Any brand | Connects to the microfluidic flow controller | |
| COMSOL Multiphysics software | COMSOL, Inc. | ||
| Custom brass stage adapter | N/A | Made in house to fit our 22 mm x 22 mm coverslips onto the microscope | |
| De-ionized water | Any brand | ||
| Dessicator | Any brand | ||
| D-glucose | MilliporeSigma | G7528 | |
| Dithiothreitol (DTT) | MilliporeSigma | D0632 | |
| EGTA | MilliporeSigma | 324626 | |
| Elveflow Smart Interface (ESI) software | Elveflow | ||
| Flangeless PFA fittings with ETFE ¼”-28 to 1/16” outer diameter ferrules | Darwin Microfluidics | CIL-XP-245X | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack |
| Fluiwell 4-Channel 2 mL Low Pressure | Fluigent | 14002001 | Used to connect the flow control system to the the micrewtubes. Also refered to as 'pressurized reservoir rack' |
| Fume hood | Any brand | ||
| Glucose oxidase | MilliporeSigma | G6125 | |
| GMPCPP | Jena Bioscience | NU-405L | |
| Guanosine triphosphate (GTP) | MilliporeSigma | G8877 | |
| Hot plate | Any brand | ||
| HS-625 high-speed emission filter wheel | Finger Lakes Instrumentation | ||
| ImageJ software | N/A | Open access | |
| Incubator | Any brand | ||
| Isopropyl alcohol | Any brand | ||
| Karl Suss MA-6 mask aligner | SUSS MicroTec | ||
| Magnesium chloride | MilliporeSigma | 1.05833 | |
| MATLAB software | MathWorks | ||
| MEGAPOSIT SPR 220 7.0 photoresist | Dow, Inc. | ||
| Microfluidic Fittings 6-40 to 1/4"-28 Adapters Kit | Darwin Microfluidics | LVF-KFI-08 | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack (Fluiwell rack) |
| Microfluidic Fittings Female Luer Lock Adapter Kit | Darwin Microfluidics | LVF-KFI-04 | Used to connect the syringe to the tubing |
| Microfluidic flow controller | Elveflow | OB1 MK3+ | |
| Microfluidic flow sensor | Elveflow | MFS3 | This flow sensor range is 0-80 μL |
| MICROPOSIT MF-319 developer | Dow, Inc. | ||
| Microscope | Nikon | Eclipse Ti | |
| NIS-Elements software | Nikon | ||
| Nitrogen (pressurized gas) | Any brand | ||
| Objective heater | Tokai Hit | ||
| One-Piece Fingertight 10-32 Coned Fitting for 1/16" OD Tubing | Darwin Microfluidics | CIL-F-120X | Used to connect the syringe to the tubing |
| Paclitaxol (Taxol) | Tocris Bioscience | 1097 | |
| Photolithography masks | N/A | Made by an external party using our designs | |
| PIPES | Thermo Fisher Scientific | 172615000 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Plasma flowmeter system | Harrick Plasma | PDC-FMG | Integrates with plasma cleaner to enable flow control of pressurized gas |
| Plastic bulb pipet | Any brand | ||
| Pluoronic F-127 | MilliporeSigma | P2443 | Referred to as 'poloxomer 407' in the protocol |
| Potassium chloride | Research Products International | P41000 | |
| Saint Gobain Performance Plastics Tube Tygon .020 ID | Thermo Fisher Scientific | 50-206-8921 | Refered to as '1.5 mm tubing' and 'tubing' in the protocol |
| Scalpel | Any brand | ||
| Spin coater | Cost Effective Equipment, LLC. | 200x | This model may be discontinued |
| Standard pipets and tip sets | Any brand | ||
| Standard plastic syringe | Any brand | We used a 10 mL Luer-slip syringe | |
| Sylgard 184 silicone elastomer kit | Dow, Inc. | Referred to as 'PDMS' and 'curing agent' in the protocol | |
| T339 Micrewtube with Lip Seal and Flat Screw Cap | Medline Industried, LP. | T339 | Referred to as 'source vial' in the protocol. We used both 0.5 mL and 1.5 mL sizes |
| TAMRA, SE; 5-(and-6)-Carboxytetramethylrhodamine, Succinimidyl Ester | Invitrogen | C1171 | Referred to as 'TTR' in the protocol |
| Trichloro(1H, 1H, 2H, 2H-perfluorooctyl) silane | MilliporeSigma | 448931 | |
| Trion Phantom RIE ICP | Trion Technology, Inc. | This plasma cleaner is only used in Step 1.1 of the protocol. Another plasma cleaner, like the one used for PDMS bonding, can be used instead; we just prefer the much lower vacuum achievable by this system for cleaning the silicon wafer | |
| TRITC Polyclonal Antibody | Thermo Fisher Scientific | A6397 | Referred to as 'anti-rhodamine antibody' in the protocol |
| Tweezers | Any brand | ||
| Vacuum pump | Any brand |
Ссылки
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Phys Today. 54 (6), 42(2001).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev Mod Phys. 77, 977(2005).
- Beebe, D. J., Mensing, G. A., Walker, G. M. Physics and applications of microfluidics in biology. Annu Rev Biomed Eng. 4, 261-286 (2002).
- Ng, J. M. K., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. Electrophoresis. 23 (20), 3461-3473 (2010).
- Dellaquila, A. Five Short Stories on The History of Microfluidics. , https://www.elveflow.com/microfluidic-reviews/general-microfluidics/history-of-microfluidics/ (2025).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: Microfluidics in drug discovery. Nat Rev Drug Discov. 5 (3), 210-218 (2006).
- Neužil, P., Giselbrecht, S., Länge, K., Huang, T. J., Manz, A. Revisiting lab-on-a-chip technology for drug discovery. Nat Rev Drug Discov. 11 (8), 620-632 (2012).
- Manz, A., Graber, N., Widmer, H. M. Miniaturized total chemical analysis systems: a novel concept for chemical sensing. Sens Actuators B: Chem. 1 (1-6), 244-248 (1990).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Knight, J. Microfluidics: Honey, I shrunk the lab. Nature. 418 (6897), 474-475 (2002).
- Photolithographic fabrication techniques for transistors which are an integral part of a printed circuit. Nall, J. R., Lathrop, J. W. 1957 International Electron Devices Meeting, Washington, DC, USA, , (1957).
- Rogers, M. The design and fabrication of a two-layer microfluidic device for studying microtubules in vitro [Master's Thesis]. , Vanderbilt University. Nashville, TN. (2022).
- Lee, J. B., Choi, K. H., Yoo, K. Innovative SU-8 lithography techniques and their applications. Micromachines. 6 (1), 1-18 (2015).
- Kim, P., et al. Soft lithography for microfluidics: A Review. Biochip J. 2 (1), 1-11 (2008).
- Venkatesan, S. u, Jerald, J., Asokan, P., Prabakaran, R. A Comprehensive Review on Microfluidics Technology and its Applications. Recent Advances in Mechanical Engineering. , Springer. Singapore. 235-245 (2020).
- Minteer, S. Microfluidic Techniques: Reviews and Protocols. , Humana Press. New Jersey. (2006).
- Mitra, S. K., Chakraborty, S. Microfluidics and Nanofluidics Handbook: Fabrication, Implementation, and Applications. , Taylor and Francis Group. Florida. (2016).
- Alberts, B., et al. Molecular Biology of the Cell. , Garland Science. New York. (2014).
- Howard, J. Mechanics of Motor Proteins and the Cytoskeleton. , Springer. Heidelberg. (2001).
- Hawkins, T., Mirigian, M., Selcuk Yasar, M., Ross, J. L. Mechanics of microtubules. J Biomech. 43 (1), 23-30 (2010).
- Gardel, M. L., Kasza, K. E., Brangwynne, C. P., Liu, J., Weitz, D. A. Chapter 19: Mechanical Response of Cytoskeletal Networks. Methods Cell Biol. 89, 487-519 (2008).
- Caporizzo, M. A., Prosser, B. L. The microtubule cytoskeleton in cardiac mechanics and heart failure. Nat Rev Cardiol. 19 (6), 364-378 (2022).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nat Mater. 14 (11), 1156-1163 (2015).
- Chu, S. H., et al. A microfluidic device for in situ fixation and super-resolved mechanosensation studies of primary cilia. Biomicrofluidics. 13 (1), 014105(2019).
- Geisterfer, Z. M., Zhu, D. Y., Mitchison, T. J., Oakey, J., Gatlin, J. C. Microtubule growth rates are sensitive to global and local changes in microtubule plus-end density. Curr Biol. 30 (15), 3016-3023 (2020).
- Schaedel, L., et al. Lattice defects induce microtubule self-renewal. Nat Phys. 15 (8), 830-838 (2019).
- Aher, A., et al. CLASP mediates microtubule repair by restricting lattice damage and regulating tubulin incorporation. Curr Biol. 30 (11), 2175-2183 (2020).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. ELife. 5, e13470(2016).
- Fourniol, F. J., et al. Micropattern-guided assembly of overlapping pairs of dynamic microtubules. Methods Enzymol. 540, 339-360 (2014).
- Vleugel, M., Roth, S., Groenendijk, C. F., Dogterom, M. Reconstitution of basic mitotic spindles in spherical emulsion droplets. J Vis Exp. (114), e54278(2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Mol Biol Cell. 27 (22), 3563-3573 (2016).
- VanDelinder, V., Brener, S., Bachand, G. D. Mechanisms underlying the active self-assembly of microtubule rings and spools. Biomacromolecules. 17 (3), 1048-1056 (2016).
- Roth, S., Gârlea, I. C., Vleugel, M., Mulder, B. M., Dogterom, M. Reconstitution of basic mitotic spindles in cell-like confinement. bioRxiv. , (2019).
- Xu, Z., et al. Microtubules acquire resistance from mechanical breakage through intralumenal acetylation. Science. 356 (6335), 328-332 (2017).
- Fanalista, F., et al. Shape and size control of artificial cells for bottom-up biology. ACS Nano. 13 (5), 5439-5450 (2019).
- Velve-Casquillas, G., Costa, J., Carlier-Grynkorn, F., Mayeux, A., Tran, P. T. A fast microfluidic temperature control device for studying microtubule dynamics in fission yeast. Methods Cell Biol. 97, 185-201 (2010).
- Portran, D., Schaedel, L., Xu, Z., Théry, M., Nachury, M. V. Tubulin acetylation protects long-lived microtubules against mechanical ageing. Nat Cell Biol. 19 (4), 391-398 (2017).
- Huang, Y. M., Uppalapati, M., Hancock, W. O., Jackson, T. N. Microtubule transport, concentration and alignment in enclosed microfluidic channels. Biomed Microdevices. 9 (2), 175-184 (2007).
- Uppalapati, M., Huang, Y., Shastry, S., Jackson, T. N., Hancock, W. O. Microtubule Motors in Microfluidics. Methods in Bioengineering: Microfabrication and Microfluidics. , Artech House Publishers. Boston, MA. (2009).
- Sung, J. H., Shuler, M. L. Prevention of air bubble formation in a microfluidic perfusion cell culture system using a microscale bubble trap. Biomed Microdevices. 11 (4), 731-738 (2009).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360(2019).
- Nakayama, T., et al. Circumventing air bubbles in microfluidic systems and quantitative continuous-flow PCR applications. Anal Bioanal Chem. 386 (5), 1327-1333 (2006).
- Park, S., Cho, H., Kim, J., Han, K. -H. Lateral degassing method for disposable film-chip microfluidic devices. Membranes. 11 (5), 316(2021).
- Pereiro, I., Fomitcheva Khartchenko, A., Petrini, L., Kaigala, G. V. Nip the bubble in the bud: A guide to avoid gas nucleation in microfluidics. Lab Chip. 19 (14), 2296-2314 (2019).
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biol. 95, 221-245 (2010).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: Information from a slowly hydrolyzable analogue, GMPCPP. Mol Biol Cell. 3 (10), 1155-1167 (1992).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bartlett, N. W., Wood, R. J. Comparative analysis of fabrication methods for achieving rounded microchannels in PDMS. J Micromech Microeng. 26 (11), 115013(2016).
- Yang, C. P. H., Horwitz, S. B. Taxol®: The first microtubule stabilizing agent. Int J Mol Sci. 18 (8), 1733(2017).
- Gittes, F., Mickey, B., Nettleton, J., Howard, J. Flexural rigidity of microtubules and actin filaments measured from thermal fluctuations in shape. J Cell Biol. 120 (4), 923-934 (1993).
- VanBuren, V., Cassimeris, L., Odde, D. J. Mechanochemical model of microtubule structure and self-assembly kinetics. Biophys J. 89 (5), 2911-2926 (2005).
- Dye, R. B., Fink, S. P., Williams, R. C. Taxol-induced flexibility of microtubules and its reversal by MAP-2 and Tau. J Biol Chem. 268 (10), 6847-6850 (1993).
- Drechsel, D. N., Kirschnert, M. W. The minimum GTP cap required to stabilize microtubules. Curr Biol. 4 (12), 1053-1061 (1994).
- Wisanpitayakorn, P., Mickolajczyk, K. J., Hancock, W. O., Vidali, L., Tüzel, E. Measurement of the persistence length of cytoskeletal filaments using curvature distributions. Biophys J. 121 (10), 1813-1822 (2022).
- Mickey, B., Howard, J. Rigidity of microtubules is increased by stabilizing agents. J Cell Biol. 130 (4), 909-917 (1995).
- Brangwynne, C. P., et al. Bending dynamics of fluctuating biopolymers probed by automated high-resolution filament tracking. Biophys J. 93 (1), 346-359 (2007).
- Venier, P., Maggs, A. C., Carlier, M. F., Pantaloni, D. Analysis of microtubule rigidity using hydrodynamic flow and thermal fluctuations. J Biol Chem. 269 (18), 13353-13360 (1994).
- Felgner, H., Frank, R., Schliwa, M. Flexural rigidity of microtubules measured with the use of optical tweezers. J Cell Sci. 109 (Pt 2), 509-516 (1996).
- Felgner, H., et al. Domains of neuronal microtubule-associated proteins and flexural rigidity of microtubules. J Cell Biol. 138 (5), 1067-1075 (1997).
- Nishida, K., et al. Effects of three microtubule-associated proteins (MAP2, MAP4, and Tau) on microtubules' physical properties and neurite morphology. Sci Rep. 13, 8870(2023).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Brouhard, G. J., Rice, L. M. Microtubule dynamics: An interplay of biochemistry and mechanics. Nat Rev Mol Cell Biol. 19 (7), 451-463 (2018).
- Lawrence, E. J., Chatterjee, S., Zanic, M. More is different: Reconstituting complexity in microtubule regulation. J Biol Chem. 299 (12), 105398(2023).
- Howard, J., Hyman, A. A. Dynamics and mechanics of the microtubule plus end. Nature. 422 (6933), 753-758 (2003).
- Mehidi, A., Aumeier, C. Regulation of the microtubule network; the shaft matters. Curr Opin Syst Biol. 34, 100457(2023).
- Verhey, K. J., Ohi, R. Causes, costs and consequences of kinesin motors communicating through the microtubule lattice. J Cell Sci. 136 (5), jcs260735(2023).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nat Rev Mol Cell Biol. 20 (1), 38-54 (2019).
- Théry, M., Blanchoin, L. Microtubule self-repair. Curr Opin Cell Biol. 68, 144-154 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены