Method Article
פיתוח גישה מבוססת מיקרופלואידיקה לחקר מכניקת פולימרים מיקרו-צינוריים
In This Article
Summary
פרוטוקול זה מפרט את התכנון והייצור של מכשיר מיקרופלואידי, המתאים לחקירת מכניקת פולימרים מיקרו-צינוריים. הסינתזה של מיקרו-ייצור, בקרת זרימה אוטומטית וטכניקות מידול חישוביות מאפשרת מערכת גמישה המתאימה באופן אידיאלי לחקירת השלד התאי במבחנה.
Abstract
בפרוטוקול זה, אנו מתארים את התכנון והייצור של מכשיר מיקרופלואידית שפותח לחקירת מכניקת פולימרים מיקרו-צינוריים. העיצוב מנצל את היתרונות המהותיים של התקנים מיקרופלואידיים מבוססי פולידימתילסילוקסן (PDMS) ומציג מספר תכונות כדי לאפשר גישה ניסיונית חזקה וניתנת להתאמה אישית בתפוקה גבוהה. המכשיר שפותח משלב יכולות לכידת בועות מיותרות כדי למנוע התרחשות של בועות אוויר מזיקות. יתר על כן, המכשיר מתממשק למערכת בקרת זרימה אוטומטית כדי להפחית התערבות ידנית ולאפשר ניתוחים בתפוקה גבוהה. תוכנת סימולציה מסחרית משמשת לפיתוח והבנה טובה יותר של הובלת הנוזלים באמצעות מערכת זו. לבסוף, אנו מדגימים את היכולת לבצע ניסויים מרובים בו זמנית בתוך מכשיר יחיד על ידי גידול הרחבות מיקרו-צינוריות עם תוויות פלואורסצנטיות מובהקות בחלקים שונים של המכשיר. בסך הכל, ניתן להשתמש במערכת זרימה מיקרופלואידית זו כדי לחקור את מכניקת הפולימר של מיקרו-צינוריות ומספקת שיפורים בתכנון ניסיוני למחקרי מיקרו-צינורות רחבים יותר במבחנה . הסינתזה של מיקרו-ייצור, בקרת זרימה אוטומטית וגישות מודלים חישוביים מאפשרת מערכת גמישה המתאימה באופן אידיאלי לחקירת השלד התאי במבחנה.
Introduction
מיקרופלואידיקה מאפשרת שליטה מדויקת בנפחי נוזלים זעירים, לרוב פחות ממיקרוליטר אחד, על ידי תכנון וייצור מורכבים של תעלות זרימת נוזלים 1,2. קנה המידה הקטן של מכשירים מיקרופלואידיים מוליד תופעות הנדסיות ייחודיות. כלומר, מספר ריינולדס - מדד חסר מימד של היחס בין כוחות אינרציאלים וצמיגים בזרימת נוזלים - הוא קטן, בדרך כלל בסדר גודל של O(10) או נמוך יותר במיקרופלואידיקה, מה שמדגיש את החשיבות של כוחות צמיגים במכשירים מיקרופלואידיים. בנוסף, מספר Péclet, המשווה הסעה להובלה דיפוזית, מראה כי הובלת הסעה היא בדרך כלל זניחה במיקרופלואידיקה 3,4,5. משטר זרימה למינרי מונע דיפוזיה זה במיקרופלואידיקה הוא יתרון, מכיוון שהוא תומך בניסויים מקבילים במכשיר יחיד על ידי שמירה על שיפועי נוזלים מדויקים.
פוטוליתוגרפיה נותרה השיטה העיקרית לייצור מכשירים מיקרופלואידיים 6,7,8. בקצרה, תהליך זה כרוך ביצירת תבנית חרוטה 'מאסטר' של התכן המיקרופלואידי (איור 1). מכינים מצע רגיש לאור, ומסכת פוטו של העיצוב המיקרופלואידי חושפת באופן סלקטיבי אזורים של פוטו-רזיסט לקרינה אולטרה סגולה. שיטות תחריט עוקבות מפתחות את המצע, ומייצרות תבליט של העיצוב. פולידימתילסילוקסן (PDMS) נוצק לעתים קרובות ונרפא על המאסטר. ה-PDMS הנרפא, המאמץ את התכונות השליליות של העיצוב, מוסר לאחר מכן מהמאסטר ומודבק לכיסוי זכוכית. כל תהליך הייצור הזה אורך בדרך כלל 1-2 ימים, מה שמאפשר איטרציות עיצוב מהירות וייצור של מספר מכשירים. סקירות מפורטות של תהליכי ליתוגרפיה רכה ומיקרו-ייצור זמינות בהפניות אחרות 1,2,3,10,11,12,13.
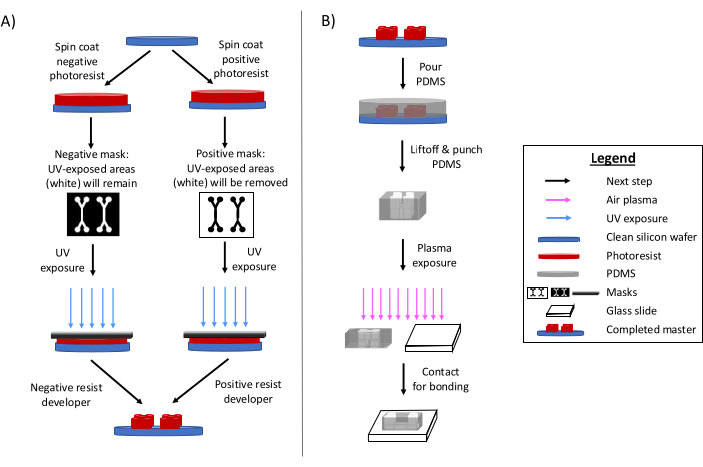
איור 1: סקירה כללית של תהליך הפוטוליתוגרפיה המסורתי ותהליך המיקרו-ייצור. (A) תהליך פוטוליתוגרפיה מסורתי ו-(B) תהליך מיקרו-ייצור. בהתאם ליישום ולמאפייני הפוטו-התנגדות הרצויים, ניתן להשתמש בפוטו-רזיסט שלילי או חיובי, למרות שהם יניבו את אותו מאסטר עיצובי. מאפיינים כגון גובה תכונה רצוי או טמפרטורת התכה של פוטו-התנגדות עוזרים לקבוע את סוג הפוטו-התנגדות המתאים. נתון זה שונה באישור רוג'רס (2022)14. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
השימוש במיקרופלואידיקה הרחיב את האפשרויות בתחומי מחקר רבים, כאשר השפעתו האחרונה היא במדעי הביולוגיה. בהתחשב בקנה המידה הקטן שלה, מיקרופלואידיקה מאפשרת ניהול מדויק של משאבים מוגבלים ויקרי ערך כגון תאים או חלבונים. משפיעה עוד יותר היא יכולת הכוונון של מערכות מיקרופלואידיות לחקות תנאים פיזיולוגיים, כגון שינויים בנוקשות המצע, הפעלת כוח על דגימה ואפילו שילוב זרם חשמלי. בנוסף, השימוש במיקרופלואידיקה מציע את היכולת לתפעל מספר ריאגנטים במקביל וליצור במהירות אב-טיפוס ולחדד באופן איטרטיבי עיצובי מערכת. תכונות אלה מאפשרות מזעור של זרימות עבודה שלמות במעבדה למכשיר יחיד, המכונה בדרך כלל "מעבדה על שבב"1,6,9,15,16,17,18,19.
אחד היישומים התאיים-ביולוגיים של מיקרופלואידיקה הוא חקירת פולימרים מיקרו-צינוריים. מיקרו-צינורות הם מרכיב חיוני בשלד התא, וממלאים תפקיד חיוני בתהליכים כמו חלוקת תאים והובלת מטען תוך תאי20,21. כאלמנט הנוקשה ביותר של השלד הציטוטי, מיקרו-צינורות מציגים מודול אלסטי הדומה לזה של פרספקס22,23. התכונות המכניות החזקות שלהם חיוניות לתפקודים תאיים שונים, כולל, למשל, התכווצות קרדיומיוציטים, שם הם מתכופפים ונרגעים באופן מחזורי במהלך השלבים הסיסטוליים והדיאסטוליים של הלב24. מכשירים מיקרופלואידיים אומצו בעבר כדי לחקור את המאפיינים של מיקרו-צינורות ואת המבנים שלהם מסדר גבוה יותר במבחנה. ואכן, מיקרופלואידיקה שימשה כדי לחקור דינמיקת פילמור מיקרו-צינורית, אינטראקציות מיקרו-צינוריות-מיקרו-צינוריות וההשפעות של חלבונים הקשורים למיקרו-צינוריות על התכונות המכניות של מיקרו-צינוריות 25,26,27,28,29,30,31,32,33,34,35 ,36,37,38,39,40,41.
בעוד שהכנסת מיקרופלואידיקה לתחום המיקרו-צינוריות הביאה לתגליות מרגשות רבות, עדיין טמון מקום לשיפור בהתאמה של מכשירים אלה למחקר מיקרו-צינוריות. בעבודה זו, אנו מתייחסים לשתי מגבלות ספציפיות המתמשכות בחקר מיקרו-צינורות במכשירים מיקרופלואידיים: הפוטנציאל להיווצרות בועות אוויר בתוך המכשיר, המוצג בדרך כלל על ידי מניפולציה ידנית של התקנים מיקרופלואידיים, וניצול חסר של מבחנים בעלי תפוקה גבוהה. ראשית, מניפולציות ידניות, כגון חיבור וניתוק צינורות, יכולות להכניס היווצרות בועות לערוצים. היווצרות בועות אוויר בתוך תא זרימה היא קטסטרופלית, שכן בועות אוויר עלולות לפגוע בחלבונים, לגזור פולימרים מיקרו-צינוריים ולהשפיע לרעה על תרביות תאים42,43. בנוסף, פינות חדות וזוויות אלכסוניות במכשיר גורמות להרטבת משטח לא אחידה, מה שמגדיל את האפשרות של כניסת אוויר. טכניקות רבות פותחו כדי להפחית את היווצרותן, התמדה וההשפעה של בועות אוויר; עם זאת, השימוש בשיטות להפחתת בועות אינו אוניברסלי 42,43,44,45,46. יתר על כן, למרות שאחד היתרונות העיקריים של שימוש במיקרופלואידיקה הוא היכולת של ניסויים בתפוקה גבוהה, מיקרופלואידיקה עדיין לא שימשה להגדלת מחקר המיקרו-צינורות. ניתן לתכנן התקנים מיקרופלואידיים לבדיקת תנאי ניסוי מרובים במקביל באותו מכשיר. לדוגמה, ניתן להשתמש בשיפועי נוזלים כדי לכוון את הזרימה של חלבונים או תרופות שונות הקשורות למיקרו-צינוריות, מה שמאפשר את מסירתם הממוקדת לאזורים ספציפיים של מיקרו-צינורות מחולקים בתוך אותו מכשיר.
כאן, עיצבנו באופן איטרטיבי מכשיר מיקרופלואידי הנותן מענה למגבלות אלה. אנו מספקים את הפרוטוקול שלב אחר שלב של ייצור המכשיר, ובכך מאפשרים לקהל רחב יותר להשתמש בטכנולוגיה מיקרופלואידית במחקר המיקרו-צינוריות שלהם. עיצוב מכשיר זה משלב תכונות לכידת בועות ומשתמש במערכת בקרת זרימה אוטומטית כדי להפחית את ההתערבות הידנית תוך מתן אפשרות לשיפועי פתרונות במכשיר לניתוחים בתפוקה גבוהה. לסיכום, הפיתוח של עיצוב מיקרופלואידי זה יכול להקל על מחקר והבנה רחבים יותר של מכניקת המיקרו-צינוריות תוך הצעת שיפורים יקרי ערך לעיצובים ניסיוניים בתחום המחקר הרחב יותר של מיקרו-צינוריות.
Protocol
הערה: העבודה המפורטת בחלק זה של הפרוטוקול בוצעה בחדר הנקי של מכון ונדרבילט למדע והנדסה בקנה מידה ננומטרי (VINSE). רצוי חדר נקי מבוקר עם חלוק מתאים ותאורה מסוננת UV כדי למנוע נזק למכשיר עקב תנאי לחות/תאורת סביבה ולמנוע זיהום חלקיקים. כל המניפולציות על פרוסות סיליקון צריכות להיעשות כשהצד המלוטש של פרוסת הסיליקון פונה כלפי מעלה. השתמש בפינצטה בעת מניפולציה של פרוסות ומזער את המגע במשטחי הפרוסה כדי למנוע שריטות. שמור ופלים בצלחות פטרי כשהמכסים מכוסים בעת ההובלה ובסוף כל יום אלא אם כן הוראה אחרת.
1. פוטוליתוגרפיה (6 - 8 שעות)
- נקה פלזמה פרוסת סיליקון בגודל 3 אינץ' למשך 5 דקות בוואקום (באופן אידיאלי, לחץ ואקום < 5 × 10-5 טור) באמצעות פלזמת חמצן (O2) או אוויר יבש נקי (CDA).
- מרכז את פרוסת הסיליקון על ציפוי מסתובב לתצהיר של הפוטו-רזיסט.
- הפקידו ~1-2 מ"ל של SPR 220 7.0 photoresist על מרכז פרוסת הסיליקון.
זהירות: טפל בפוטו-רזיסט עם כפפות והגנה על העיניים והשליך בהתאם לפרוטוקולים הספציפיים ליצרן/אתר. - ציפוי סובב את הפוטו-רזיסט על פרוסת הסיליקון לעובי הרצוי בהתבסס על עקומות הסיבוב של היצרן. צור שכבות בעובי ~13 מיקרומטר על ידי סיבוב ב-1000 סל"ד למשך 30 שניות. מאוחר יותר, נקה את שאריות הפוטו-רזיסט על ציפוי הסיבוב עם אצטון והשליכו אותו לפי פרוטוקולים ספציפיים לאתר.
הערה: אם לאחר ציפוי הסיבוב, הוופל אינו מצופה באופן אחיד בפוטו-רזיסט, חזור על שלבים 1.2-1.4. ציפוי לא אחיד יכול לנבוע מפרוסת לא מרוכזת על ציפוי הספין, שימוש במעט מדי התנגדות לאור ו/או אי הפקדת הפוטו-רזיסט על מרכז הוופל. - תוך נגיעה מועטה ככל האפשר בפוטו-רזיסט על הוופל, העבירו את פרוסת הסיליקון לפלטה חמה המוגדרת ב-70 מעלות צלזיוס.
- דגרו את פרוסת הסיליקון על הפלטה החמה, והעלו את הטמפרטורה ב-10 מעלות צלזיוס כל 3-5 דקות עד שהטמפרטורה מגיעה ל-115 מעלות צלזיוס.
- כבה את הפלטה החמה ואפשר לפרוסת הסיליקון להתקרר עד שהטמפרטורה שלה נמוכה מ-65 מעלות צלזיוס.
הערה: שלבי החימום והקירור מבוצעים לאט כדי למנוע סדקים תרמיים של הפוטו-רזיסט, הנפוץ בעובי זה. אם אכן מתרחשים סדקים תרמיים, בדרך כלל ניתן לתקן אותם על ידי חימום מחדש של פרוסת הסיליקון והאטת קצב הקירור. - בעזרת מלקחיים, העבירו את פרוסת הסיליקון המקוררת ליישור מסכה וטענו גם את פרוסת הסיליקון וגם את מסיכת הפוטו המתאימה ליישור המסכה בהתאם לפרוטוקולים הספציפיים ליצרן/לאתר.
הערה: מסכות צילום יוצרו על ידי גורם חיצוני תוך שימוש בעיצוב מוגדר, שנוצר עם AutoCAD. ראו קובץ משלים 1 לעיבוד עיצוב המסיכה. - חשוף את פרוסת הסיליקון לקרינה אולטרה סגולה (UV) לזמן מסוים (בהתבסס על עוצמת מנורת ה-UV) בהתאם לפרוטוקולים הספציפיים ליצרן/אתר. האנרגיה הרצויה ליישום זה היא ~400 mJ/cm2, וחשב את זמן החשיפה לפי הנוסחה:
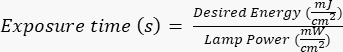 .
. - לאחר החשיפה, הסר את פרוסת הסיליקון מיישור המסכה ואפשר לפוטו-רזיסט להתייבש למשך 4 שעות על ידי זרימת אוויר. ודא שמכסה צלחת הפטרי נשאר סגור כדי לאפשר זרימת אוויר, אך הנח את המנה באזור שסביר להניח שלא יהיה חשוף לחלקיקים.
הערה: ניתן לקחת הפסקה של 4 שעות במהלך זמן ההתייבשות הזה, אך מומלץ להמשיך בהליך באותו היום. - לאחר ההתייבשות של 4 שעות, העבירו את הוופל החשוף לפלטה חמה המוגדרת על 70 מעלות צלזיוס.
- דגרו את פרוסת הסיליקון על הפלטה החמה, והעלו את הטמפרטורה ב-10 מעלות צלזיוס כל 3-5 דקות עד שהטמפרטורה מגיעה ל-115 מעלות צלזיוס.
- הניחו לוופל לדגור בטמפרטורה של 115 מעלות צלזיוס למשך 10 דקות.
- צור 'כיסוי' מבודד לפרוסה החשופה על ידי יציקת יריעת נייר אלומיניום בצורת מכסה צלחת פטרי.
- כבה את הפלטה החמה וכסה את הוופל החשוף במכסה נייר האלומיניום. הניחו לוופל להתקרר באופן סביבתי למשך הלילה.
הערה: פיצוח תרמי של הפוטו-רזיסט נפוץ הרבה יותר במהלך שלב הדגירה שלאחר החשיפה, וזו הסיבה שמומלץ קירור איטי בן לילה. זה משלים את השלבים הנדרשים ליום הראשון לייצור. מומלץ להמשיך לחלק הבא למחרת.
2. פיתוח (1 - 2 שעות)
- כאשר מוכנים לפתח את הוופל החשוף, השג מיכל נקי ומפתח פוטו-רזיסט מתאים. כאן, מפתח MF-319 משמש עם מיכל ייעודי.
זהירות: טפל במפתח עם כפפות והגנה על העיניים, העבר את המיכל בתפזורת למיכל משני והשליך אותו בהתאם לפרוטוקולים הספציפיים ליצרן/לאתר. - יוצקים מספיק מפתח לתוך המיכל כדי לטבול את הוופל החשוף במלואו (הנפח בפועל ישתנה בהתאם למיכל).
- טבלו את הפרוסה החשופה במפתח והמתינו עד שכל ההתנגדות הלא רצויה לאור תתמוסס. סיבוב/ערבוב עדין של המיכל מסייע בפיתוח עד שנראה מעט שאריות פוטו-רזיסט על הפרוסה מלבד עיצוב המכשיר.
הערה: ייתכן שיידרשו שינויים מרובים של פתרון המפתחים כדי להסיר לחלוטין את ההתנגדות הלא רצויה לאור, בהתאם לנפח הפתרון למפתח שבו נעשה שימוש. - הסר את הוופל שפותח מתמיסת הפיתוח ושטוף בעדינות את שני צידי הוופל במים נטולי יונים (DI) למשך 30 שניות.
- יבש את הוופל המפותח בגז חנקן (N2).
- אחסן את הוופל המפותח בצלחת פטרי בסביבה יבשה וקרירה עד שהוא מוכן לשימוש נוסף. עטפו את צלחת הפטרי בנייר אלומיניום כדי למנוע השפלה של הפוטו-רזיסט עקב חשיפה לאור הסביבה.
הערה: מומלץ, אך לא חובה, להמשיך לסעיף הבא באותו היום.
3. סילניזציה (1 - 2 שעות)
- העבירו את פרוסת הסיליקון לחומר ייבוש.
- מניחים מיכל אלומיניום קטן (או חתיכת נייר אלומיניום מקופלת לצורת מיכל) בחומר הייבוש.
- הכניסו טיפה אחת (~50 מיקרוליטר) של טריכלורו (1H, 1H, 2H, 2H-perfluorooctyl) סילאן לתוך מיכל האלומיניום.
זהירות: טפל בתמיסת סילאן עם כפפות ומגן עיניים והשליך אותה בהתאם לפרוטוקולים הספציפיים ליצרן/אתר. - סגור את מייבש הכביסה והפעל את הוואקום.
- אפשר ייבוש/סילניזציה להתרחש למשך 1-2 שעות.
- לאחר סיום זמן הסילניזציה, כבה את הוואקום ואחזר את הוופל הסילני. אחסן את הוופל הסילאני בצלחת פטרי עטופה בנייר אלומיניום בסביבה יבשה וקרירה עד שמוכן לשימוש נוסף.
הערה: ייתכן שיהיה צורך לחזור על סילניזציה מעת לעת על הפרוסות ובתדירות גבוהה יותר במכשירים שבהם נעשה שימוש בשכבות דקות יותר של PDMS. אם מבחינים בהידבקות PDMS בעת הוצאת ה-PDMS מהרקיק, ייתכן שיהיה צורך לסילן מחדש את הוופל, ויש לחזור על סעיף זה לאחר הסרת כל ה-PDMS מהפרוסה. זה משלים את השלבים הנדרשים ליצירת מאסטרים למכשירים מיקרופלואידיים. המאסטרים יציבים וניתן לבצע את הקטעים הבאים כאשר רוצים.
4. תצהיר PDMS (1 - 2 שעות)
הערה: אם יש שאריות PDMS על המאסטר ממיקרו-ייצור קודם, יש להסיר את שאריות ה-PDMS לפני הפקדת PDMS חדשים.
- במשקל, שקלו למיכל PDMS וחומר ריפוי נלווה ביחס משקל של 10:1. המשקל הכולל הנדרש ישתנה בהתאם לעובי ה-PDMS הרצוי ולגודל צלחת הפטרי. עבור צלחת פטרי בגודל 4 אינץ', ~20 גרם PDMS ו~2 גרם חומר ריפוי יניבו עובי של 2-3 מ"מ.
זהירות: טפל בתמיסת PDMS עם כפפות והגנה על העיניים והשליך אותה בהתאם לפרוטוקולים הספציפיים ליצרן/אתר. - מערבבים את ה-PDMS וחומר הריפוי במיכל למשך 5 דקות בעזרת מרית פלסטיק או כלי מתאים אחר.
- העבירו את מיכל ה-PDMS המעורב לחומר ייבוש להסרת גזים.
- סגור את מייבש הכביסה והפעל את הוואקום. בועות אוויר יתחילו להופיע ב- PDMS.
- אפשר לייבוש/הסרת גז להתרחש למשך 30 דקות. בהתאם לכמות ה-PDMS בשימוש ולצורת המיכל, הזמן בפועל עשוי להשתנות; נקודת קצה כללית היא כאשר מעט בועות קיימות ב-PDMS.
- לאחר הסרת הגז, כבה את הוואקום ואחזר את מיכל ה-PDMS.
- יוצקים את ה-PDMS המעורבב והנטול גז על המאסטר בצלחת פטרי.
- דגרו את המאסטר בצלחת הפטרי הסגורה בטמפרטורה של 65 מעלות צלזיוס למשך הלילה כדי לאפשר ל-PDMS להתרפא במלואו.
הערה: פעולה זו משלימה את השלבים עבור תצהיר PDMS. מומלץ לאפשר ל-PDMS להתרפא באינקובטור למשך הלילה. לאחר מכן ה-PDMS יציב, כך שניתן לבצע את החלקים הבאים כאשר רוצים.
5. מכלול מכשיר PDMS (1 - 2 שעות)
- אחזר את מאסטר המכשירים שריפא PDMS, זוג מלקחיים, אגרוף ביופסיה סטנדרטי של 1.5 מ"מ עם בוכנה ידנית ואזמל/סכין גילוח.
זהירות: טפל בלהב בזהירות ולעולם אל תחתוך לכיוון עצמך או לאחרים. מומלץ להב נסוג מעצמו או בטיחות. - סביב תכונות המכשיר, גזרו חתיכות מלבניות של PDMS ממאסטר השכבות. ודא שלכל חלק של PDMS יש מקום בכל צד, לצד תכונות המכשיר כדי להקל על מגע הדבקה טוב תוך הבטחה שכל חלק מתאים לכיסוי זכוכית של 22 מ"מ × 22 מ"מ משלו.
הערה: חשוב להימנע מנגיעה במשטח התחתון של ה-PDMS (הצד עם התכונות), לכן טפל תמיד ב-PDMS בקצוות באמצעות פינצטה. בנוסף, לעולם אל תניח את צד התכונה של ה-PDMS כלפי מטה על משטח כלשהו. כאשר אינו בשימוש, אחסן את ה-PDMS כשצד התכונה פונה כלפי מעלה במיכל סגור עד לצורך. - נקב חורי כניסה ויציאה בחלקי PDMS באמצעות ניקוב חורים נקי של 1.5 מ"מ. נקב את ה-PDMS של המכשיר לשכבה רזרבית של PDMS קורבן במקום לתוך משטח קשיח שעלול לפגוע באגרוף החורים.
- אחזר ונקה כיסוי זכוכית בגודל 22 מ"מ × 22 מ"מ עם מגבון רטוב איזופרופיל אלכוהול (IPA).
- נקה פלזמה את הכיסוי בגודל 22 מ"מ ×-22 מ"מ למשך 5 דקות בוואקום (לחץ < 0.5 Torr) באמצעות פלזמה CDA. זה יסיר כל פסולת או ציפויים אורגניים על הכיסוי.
- נגב את כיסוי הזכוכית בגודל 22 מ"מ ×-22 מ"מ ואת צד התכונה של ה-PDMS עם מגבון רטוב IPA.
- הנח גם את ה-PDMS (צד התכונה פונה כלפי מעלה) וגם את כיסוי הזכוכית (אותו צד הפונה כלפי מעלה כפי שנוקה קודם) לתוך שואב הפלזמה ונקה פלזמה בו זמנית למשך 30 שניות בוואקום (לחץ < 0.5 Torr) באמצעות פלזמה CDA.
- הסר גם את כיסוי הזכוכית וגם את מכשיר ה-PDMS ממנקה הפלזמה. הפוך את ה-PDMS כך שצד התכונה פונה כלפי מטה והנח אותו על כיסוי הזכוכית. שימו לב להדבקה ולחצו קלות על ה-PDMS לפי הצורך כדי להקל על מגע טוב.
- דגרו את הכיסוי המלוכד בצלחת פטרי סגורה בטמפרטורה של 65 מעלות צלזיוס למשך 3 דקות כדי להקל על ההדבקה.
הערה: מליטה פלזמה משנה את ההידרופוביות של כיסוי הזכוכית, ויוצרת משטח הידרופילי. נצפה באמצעות עדויות אנקדוטליות כי המצב ההידרופובי המקורי של הכיסוי חוזר לאחר כיומיים של דגירה בטמפרטורת החדר. מומלץ להשתמש במכשירים מפוברקים לא לפני יומיים לאחר הדבקת הפלזמה. זה משלים את שלבי המיקרו-ייצור. למכשירים אין חיי מדף מוגדרים אך יש לאחסן אותם באזור קריר ויבש כאשר אינם בשימוש.
6. הכנת תעלת זרימה מיקרופלואידית (1 שעה)
- אבטח מכשיר מיקרופלואידית מורכב למתאם במה מותאם אישית נקי47.
- אחזר מזרק, מתאם לור-לוק וטבעת מתאימה, וחתיכת צינור שקוף בקוטר חיצוני של 1.5 מ"מ (אורך של כ-15-20 ס"מ). חבר את הצינור למזרק באמצעות המתאם.
- חבר שלוש חתיכות נוספות של צינורות לשקעי המכשיר המיקרופלואידיים (צינור זה אינו חייב להיות באורך ספציפי) וכוון את הקצה השני של צינורות אלה לבקבוקון פסולת במורד הזרם.
- בעזרת המזרק, הכינו את המכשיר המיקרופלואידי על ידי הכנסת פתרונות לפי השלבים הבאים. הרצף והנפח של התמיסות הם כדלקמן: 50 מיקרוליטר של תמיסת חיץ BRB80, 25 מיקרוליטר של תמיסת נוגדנים נגד רודמין, המתינו 5 דקות, 50 מיקרוליטר של BRB80, 25 מיקרוליטר של פולוקסמר 407 (F127), המתינו 15 דקות ו-50 מיקרוליטר של BRB80. ראה טבלה 1 לדוגמא.
- משוך את התמיסה ממקורה לתוך הצינור.
הערה: אל תמשוך את התמיסה עד הסוף לתוך המזרק עצמו. הפתרון צריך להישאר רק בצינור. - לחץ בעדינות כלפי מטה על בוכנת המזרק עד שנמצאת טיפת נוזל קטנה בקצה הצינור. זה ימנע כניסת אוויר למכשיר המיקרופלואידי כאשר הצינור מחובר.
- חבר את הצינור לכניסה של המכשיר המיקרופלואידי.
- לחץ לאט כלפי מטה על בוכנת המזרק עד שרוב התמיסה עפה דרך הצינור, אך לא כולה. השארת כמות קטנה של נוזלים בצינור תבטיח שלא ייאלץ אוויר בטעות דרך הצינור. התבונן בצינורות ובתעלות המיקרופלואידיות במהלך העברות אלה, וחפש בועות כלשהן.
הערה: אם מתרחשות בועות בצינור, התחל בפתרון בעיות (נסה להסיר את הבועה לפני כניסתה למכשיר המיקרופלואידי על ידי ניתוק הצינור ממש לפני שהבועה מגיעה ולאחר מכן חיבור מחדש של הצינור לאחר שהבועה עוברת וכו'). - חזור על שלבים 6.4.1-6.4.4 עבור המגיב הבא עד שכל הריאגנטים יוטסו. יהיה צורך בחתיכת צינור כניסה חדשה עבור כל מגיב כדי למנוע זיהום צולב של ריאגנטים מקוריים. לאחר השלמת הכביסה הסופית של BRB80, המכשיר יציב למשך מספר דקות. טיפה של תמיסת BRB80 על הכניסות תמנע את התייבשות המכשיר.
- משוך את התמיסה ממקורה לתוך הצינור.
- הכן 'זרעים' מיקרו-צינוריים מיוצבים גואנוזין-5'-[(α,β)-מתילנו]טריפוספט (GMPCPP) על פי פרוטוקולים סטנדרטיים (עם יחס תיוג TTR של ~25%)47,48.
- הכן תמיסת חיץ הדמיה ('אנטיפייד') בריכוז עבודה פי 2 על ידי שילוב הריאגנטים הבאים בכמויות המתאימות (בהתאם לריכוזי המלאי) כדי להניב את הריכוזים הסופיים שצוינו: BRB80 בתוספת 40 מ"מ גלוקוז, 40 מיקרוגרם/מ"ל גלוקוז אוקסידאז, 16 מיקרוגרם/מ"ל קטלאז, 0.5 מ"ג/מ"ל קזאין, 50 מ"מ אשלגן כלורי ו-10 מ"מ דיתיותרייטול (DTT). מאגר הדמיה זה משמש להארכת יציבות האור. ראה טבלה 2 לדוגמא.
- יש לדלל חלק מתמיסת האנטי-דהייה 2x 1:1 ב-BRB80 כדי להניב פתרון עבודה פי 1 של אנטי-דהייה. לחמם את האנטי-דהייה הזו לטמפרטורת החדר (RT); יש לשמור את תמיסת האנטי-דהייה על הקרח.
| הזמנה | ריאגנטים | דילול נפח | נפח כביסה | זמן הדגירה |
| 1 | BRB80 | לא ישים | 50 מיקרוליטר | לא ישים |
| 2 | נוגדן נגד רודמין | 1:50 ב-BRB80, מערבבים היטב | 25 מיקרוליטר | 5 דק' |
| 3 | BRB80 | לא ישים | 50 מיקרוליטר | לא ישים |
| 4 | פולוקסמר 407 (F127) | 1% ב-BRB80 | 25 מיקרוליטר | 15 דק' |
| 5 | BRB80 | לא ישים | 50 מיקרוליטר | לא ישים |
טבלה 1: סדר ההכנה של תעלות מכשירים מיקרופלואידיים.
| נפח | מגיב | ריכוז מלאי | ריכוז סופי |
| 16 מיקרוליטר | D-גלוקוז | 2 מ' | 80 מ"מ |
| 16 מיקרוליטר | גלוקוז אוקסידאז | 2 מ"ג/מ"ל | 80 מיקרוגרם/מ"ל |
| 16 מיקרוליטר | קטלאז | 0.8 מ"ג/מ"ל | 32 מיקרוגרם/מ"ל |
| 14 מיקרוליטר | קזאין | 28 מ"ג/מ"ל | 0.16 מ"ג/מ"ל |
| 8 מיקרוליטר | DTT | 1 מ' | 20 מ"מ |
| 40 מיקרוליטר | אשלגן כלורי | 1 מ' | 100 מ"מ |
| 290 מיקרוליטר | BRB80 | 1x | לא ישים |
| 400 מיקרוליטר | סופי (ריכוז עבודה פי 2) |
טבלה 2: מתכון לתמיסת הדמיה נגד דהייה (ריכוז פי 2).
7. הכנסת זרעי מיקרו-צינורות למיקרופלואידית (10 - 15 דקות)
- חבר את המכשיר המיקרופלואידי למיקרוסקופ.
הערה: מכיוון שיציבות המיקרו-צינורות תלויה בטמפרטורה, מומלץ לבצע את ניסויי ההדמיה ב-35 מעלות צלזיוס. - חבר 10-15 ס"מ של צינורות חדשים למזרק ושאב דילול רצוי של זרעי מיקרו-צינורות מיוצבים GMPCPP לתוך הצינור.
הערה: עבור מכשיר זה, ~10 ננומטר GMPCPP-זרעי מיקרו-צינורות היה הריכוז האופטימלי. - לחץ בעדינות כלפי מטה על בוכנת המזרק עד שנמצאת טיפת נוזל קטנה בקצה הצינור. זה ימנע כניסת אוויר למכשיר המיקרופלואידי כאשר הצינור מחובר.
- חבר את הצינור לכניסה של המכשיר המיקרופלואידי.
- לחץ לאט כלפי מטה על בוכנת המזרק עד שרוב התמיסה עפה דרך הצינור, אך לא כולה. השארת כמות קטנה של נוזלים בצינור תבטיח שלא ייאלץ אוויר בטעות דרך הצינור.
- נתק את צינור הכניסה מהמכשיר המיקרופלואידי והמזרק והצמד חתיכת צינור חדשה למזרק.
- משוך BRB80 לתוך הצינור.
- חזור על שלבים 7.3-7.6 כדי לשטוף זרעי מיקרו-צינורות שאינם קשורים מהמכשיר.
- שימו לב להצמדת הזרעים למשטח המיקרופלואידי באמצעות מיקרוסקופ פלואורסצנטי השתקפות פנימית כוללת (TIRF). המספר האידיאלי של זרעים בשדה ראייה יחיד ישתנה בהתאם ליישום ולגודל שדה הראייה, אך באופן כללי, ~10-20 זרעים לכל 80 מיקרומטר × 80 מיקרומטר שדה ראייה הוא אופטימלי. חזור על שלבים 7.2-7.9 לפי הצורך עד שתגיע לצפיפות הזרעים הרצויה.
הערה: לניטור צפיפות זרעי המיקרו-צינורות, יש להשתמש בחשיפה לאור קצר לסירוגין (100 אלפיות השנייה) מכיוון שעדיין אין אנטי-דהייה בתמיסה. - לאחר הגעה לצפיפות הזרעים הקשורה המתאימה, חבר חתיכה חדשה של צינור כניסה למזרק.
- שאב תמיסת אנטי-דהייה חמה 1x לתוך הצינור וחזור על שלבים 7.3-7.6.
הערה: עם תמיסת האנטי-דהייה כעת במכשיר, היציבות באור משופרת משמעותית והמכשיר יציב. עם זאת, עדיין מומלץ למזער את החשיפה לאור לייזר.
8. גידול הרחבות מיקרו-צינורות מזרעים (15 - 30 דקות)
- שלב טובולין עם תווית פלואורסצנטית, טובולין ללא תווית, תמיסת אנטי-דהייה 2x, גואנוזין-5'-טריפוספט (GTP) ו-BRB80 כדי להשיג פתרון סופי המכיל 14 מיקרומטר טובולין ביחס תיוג פלואורסצנטי של 7%, נוגד דהייה בריכוז עבודה פי 1 ו-1 מ"מ GTP.
הערה: אם משתמשים בריכוזים שונים או באחוזי תיוג שונים של טובולין, יהיה צורך להתאים את הנפח של כל מגיב כדי להשיג את הריכוז הסופי הרצוי ויחס התיוג. שמור את תמיסת הטובולין על קרח עד ~30 שניות לפני ההחדרה, ובשלב זה, הסר את התמיסה מהקרח וחמם אותה ביד ל-RT. זה יסייע בפילמור של הרחבות מיקרו-צינוריות, שהוא תהליך תלוי טמפרטורה. ואכן, פילמור מיקרו-צינורות צריך להתבצע ב-35 מעלות צלזיוס, בעוד שניתן לבצע את כל שאר שלבי הניסוי ב-RT. - חבר 10-15 ס"מ של צינור חדש למזרק ושאב תמיסת טובולין לתוך הצינור.
- לחץ בעדינות כלפי מטה על בוכנת המזרק עד שנמצאת טיפת נוזל קטנה בקצה הצינור. זה ימנע כניסת אוויר למכשיר המיקרופלואידי כאשר הצינור מחובר.
- חבר את הצינור לכניסה של המכשיר המיקרופלואידי.
- לחץ לאט כלפי מטה על בוכנת המזרק עד שרוב התמיסה עפה דרך הצינור, אך לא כולה. השארת כמות קטנה של נוזלים בצינור תבטיח שלא ייאלץ אוויר בטעות דרך הצינור. נתק את צינור הכניסה מהמכשיר המיקרופלואידי.
- תמונה בתדר הרצוי למשך 10-15 דקות או עד שההארכות ארוכות מספיק כדי להתכופף. בדרך כלל, הדמיה מתבצעת ב-488 ננומטר כל 5 שניות ו-561 ננומטר כל 60 שניות עד שההרחבות מגיעות באורך של לפחות 5-10 מיקרומטר (~15 דקות).
הערה: בריכוז זה של טובולין, המיקרו-צינורות עשויים לעבור באופן סטוכסטי בין תקופות של פילמור ודה-פולימריזציה; זה צפוי, אך בסך הכל, הרחבות המיקרו-צינורות יתארכו49.
9. ייצוב הרחבות מיקרו-צינורות (10-15 דקות)
- שלב טקסול, תמיסת אנטי-פייד 2x ו-BRB80 כדי להשיג פתרון סופי המכיל 10 מיקרומטר טקסול ואנטי-דהייה בריכוז עבודה פי 1.
הערה: שמור את תמיסת הטקסול על הקרח עד ~30 שניות לפני ההחדרה, ואז הסר את התמיסה מהקרח וחמם אותה ביד ל-RT. זה ימנע דה-פולימריזציה של הרחבות מיקרו-צינוריות, שהוא תהליך תלוי טמפרטורה. - חבר 10-15 ס"מ של צינור חדש למזרק ושאב תמיסת טקסול לתוך הצינור.
- לחץ בעדינות כלפי מטה על בוכנת המזרק עד שנמצאת טיפת נוזל קטנה בקצה הצינור. זה ימנע כניסת אוויר למכשיר המיקרופלואידי כאשר הצינור מחובר.
- חבר את הצינור לכניסה של המכשיר המיקרופלואידי.
- לחץ כלפי מטה על בוכנת המזרק עד שרוב התמיסה עפה דרך הצינור, אך לא כולה. השארת כמות קטנה של נוזלים בצינור תבטיח שלא ייאלץ אוויר בטעות דרך הצינור.
- חזור על שלבים 9.2-9.5 פעמיים ברצף מהיר. ניתן להשתמש באותה פיסת צינור במקרה זה.
הערה: טקסול מקדם גרעין מיקרו-צינורות דה נובו מטובולין בתמיסה, ומיקרו-צינורות אלה יכולים לנחות על פני התעלה המיקרופלואידית ולהפריע להדמיה/כיפוף שלאחר מכן. מסיבה זו, תמיסת הטקסול צריכה לזרום דרך המכשיר במהירות ובמספר איטרציות כדי להסיר כמה שיותר טובולין חופשי מהמכשיר במהירות האפשרית. - ודא שמיקרו-צינורות הגדלים מזרעים עדיין קיימים ומיוצבים במכשיר.
10. כיפוף הרחבות מיקרו-צינורות מיוצבות (10 - 15 דקות)
הערה: כעת ניתן לכופף הרחבות מיקרו-צינורות מיוצבות באמצעות בקר זרימה. כאן, נעשה שימוש במערכת תזוזה מווסתת בלחץ חיובי (Elveflow OB1 MK3+) כדי להזרים את התמיסה מבקבוקון מקור אטום דרך מד זרימה ולתוך המיקרופלואידיק. בהתאם לפרטים הספציפיים של הגדרת בקר הזרימה הזמינה, ייתכן שיבוצעו שינויים בשלבים הבאים.
- הגדר בקר זרימה וציוד נלווה לפי פרוטוקולים ספציפיים ליצרן/אתר, באמצעות צינורות כדי לחבר את בקבוקון המקור לכניסת מד הזרימה ואת יציאת מד הזרימה לכניסת המיקרופלואידית, אך אל תחבר את הצינור למכשיר המיקרופלואידי.
- הכנס ~200 מיקרוליטר מתמיסת טקסול 10 מיקרומטר לבקבוקון מקור שניתן לחבר למערך בקר הזרימה. הגדרה זו משתמשת בחיבורי Luer-lock כדי ליצור אטימה אטומה.
- הפעל את מערכת בקרת הזרימה ופתח את הצינור כדי להסיר אוויר. זה ימנע כניסת אוויר למכשיר המיקרופלואידי כאשר הצינור מחובר.
- לאחר שהצינור הוכנס דרך מד הזרימה ויש טיפת נוזל קטנה בקצה הצינור, כבה את מערכת בקרת הזרימה.
- חבר את הצינור לכניסה של המכשיר המיקרופלואידי. השתמש בכניסה בניצב לכניסה המשמשת להכנסת זרעי המיקרו-צינורות ולגדל את הרחבות המיקרו-צינורות על מנת להתכופף אורתוגונלית.
- כופפו הרחבות על ידי התחלה ועצירה של זרימה בקצב הזרימה או הלחץ הרצויים. לחץ של 30 mbar הוא הסטנדרט לפרוטוקול זה באמצעות זרימה תנודתית של 5 שניות. דמיין את הכיפוף במהלך תקופה זו, בדרך כלל כל 0.1 שניות ב-488 ננומטר וכל 10 שניות ב-561 ננומטר.
הערה: זה משלים את בדיקת כיפוף המיקרו-צינורות הבסיסית. ניתן לנקות/להשליך את כל הציוד והריאגנטים בהתאם לפרוטוקולים הספציפיים ליצרן/אתר.
תוצאות
רציונל תכנון מכשיר מיקרופלואידי
התכנון של המכשיר המיקרופלואידי במחקר זה הונחה על ידי מספר מאפיינים מרכזיים (איור 2), אשר בונים ומשפרים את העיצוב המסורתי של תאי זרימה פשוטים. יש לציין כי למכשיר המיקרופלואידי יש נפח פנימי של ~160 ננוטר, קטן משמעותית מנפח ~10 מיקרוליטר של תאי זרימה מסורתיים יותר47, מה שמאפשר שימוש מבוקר יותר בריאגנטים יקרי ערך, כגון רכיבי חלבון מטוהרים. מכיוון שבקר הזרימה המיקרופלואידי מכיל שני ערוצי ויסות, המכשיר פותח בהנחה שרק לשתי יציאות כניסה/יציאה תהיה בקרת לחץ בכל זמן נתון. ניתן ליישם יותר ערוצים מבוקרי לחץ, אם תרצה.
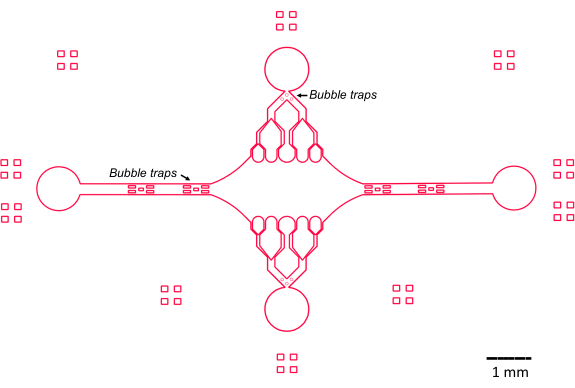
איור 2: סכמטי של תכן ההתקן המיקרו-נוזלי. סימונים מלבניים בפריפריה מיועדים לסיוע חזותי בראיית היקף הערוצים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
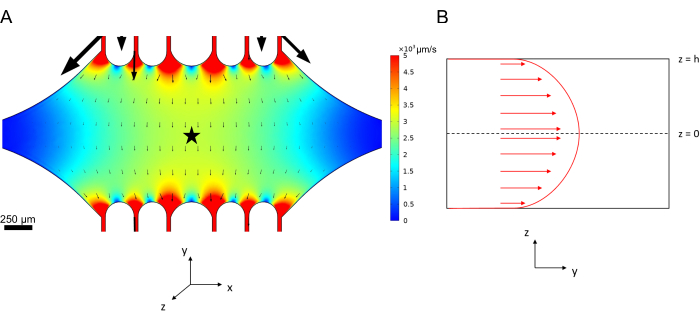
תא ההתקן המלבני המרכזי משמש כאזור ההדמיה העיקרי שבו מחוברים זרעי מיקרו-צינוריות, והרחבות מיקרו-צינוריות מפולימרים מזרעים אלה. החדר נחצה על ידי תעלת זרימה מכל צד, כאשר תעלות ישרות לאורך ציר ה-x משמשות ככניסה ויציאה כדי להקל על החלפה מהירה של תמיסת התגובה. תעלת כניסת מיקרו-צינורות משמשת גם להחדרת זרעי מיקרו-צינורות לתא, עם זרימה למינרית וכתוצאה מכך הזרע נקשר למשטח הזכוכית לאורך כיוון הזרימה. בכיוון הניצב (ציר Y), תעלות הזרימה מסתעפות לתעלות קטנות יותר לכיוון החדר, בדומה לחלק מהעיצובים הקודמים 25,28,36,39. גיאומטריית ההסתעפות מתאימה במיוחד לחקר התכונות המכניות של מיקרו-צינורות. הזרמת תמיסה לתוך החדר המרכזי מכיוון הניצב לכיוון זרעי המיקרו-צינוריות מאפשרת כוחות כיפוף המושרים על ידי זרימה בזוויות כמעט נורמליות. יתר על כן, הכללת גיאומטריית הסתעפות עם ערוצי זרימה קטנים יותר מאפשרת הפעלת כוח הומוגנית יותר על פני שטח רחב של החדר המרכזי, שאינו מושג על ידי גיאומטריית זרימה פשוטה של ערוץ יחיד. באופן זה, מוטיב ההסתעפות, למרות שהוא לכאורה מסובך יותר, יכול להפחית את המורכבות הכוללת בקביעת הכוח המוענק למיקרו-צינורות (איור 3). עיצוב זה כולל גם קווי סימטריה מרובים, המאפשרים קלות שימוש והזדמנות להעריך כיפוף מכמה כיוונים (למשל, למעלה לעומת למטה).
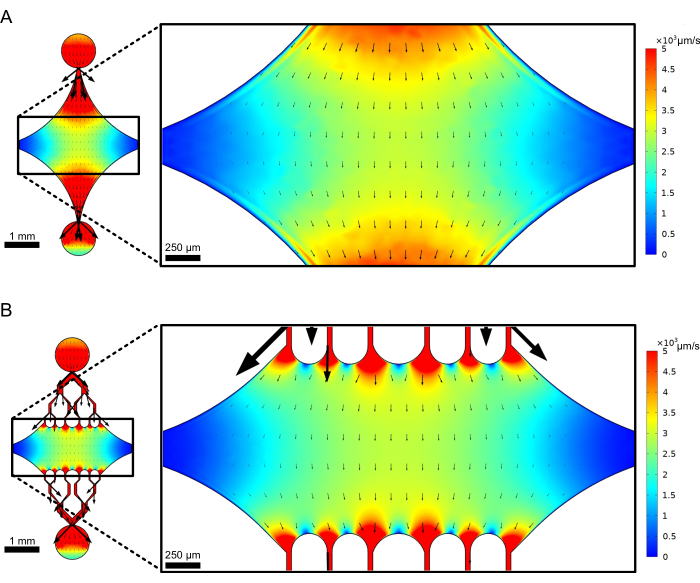
איור 3: הכללת מוטיב הסתעפות מביאה לשטח גדול של זרימה דומה. סימולציות של שני עיצובי מכשירים בזרימה במצב יציב: אחד ללא ערוצים מסתעפים (A) ואחד עם ערוצים מסתעפים (B). החצים מציינים כיוון זרימה מקומי והם פרופורציונליים לגודל הזרימה. צבע פני השטח מציין את מהירות קו המרכז. תמונות מימין מראות קטע מוגדל של המכשיר שבו מיקרו-צינורות (לא מוצגים) המכוונים לאורך ציר ה-x יהיו נתונים לכוחות כיפוף מנוזל הזורם ביציאה העליונה והחוצה מהיציאה התחתונה. שילוב תעלות הסתעפות מגדיל את השטח היחסי הנתון לשדות מהירות דומים מבלי להגדיל את נפח המגיב הנדרש. נתון זה שונה באישור רוג'רס (2022)14. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
יש לציין כי המכשיר מיישם גם סדרה של מלכודות בועות בתעלות זרימת הכניסה והיציאה כדי למנוע כניסת בועות אוויר לתא ההדמיה המרכזי. באופן ספציפי, בחרנו לכלול מערכים של מיקרו-עמודים בתוך נתיב הזרימה על מנת לחסום בועות אוויר מלעבור בגלל מתח פנים (איור 2)46. יתר על כן, כדי למנוע כניסת אוויר, עיצבנו את הקצוות בתוך המכשיר כקימורים חלקים, בניגוד לזוויות אלכסוניות. יחד, תכונות עיצוב אלה מפחיתות את האפשרות לבועות אוויר ומגבירות את חוסן המכשיר.
ייצור מכשירים מיקרופלואידיים
קביעת הפרמטרים המתאימים ליצירת מאסטר המכשיר דרשה אופטימיזציה מסוימת. כפי שנצפה קודם לכן, פוטו-רזיסט זה רגיש מאוד לפרמטרי הפעלה מרכזיים כגון תאורת סביבה ושיעורי החימום והקירור במהלך שלבי הפוטוליתוגרפיה50. לדוגמה, אם המאסטר התקרר מהר מדי לאחר החימום, עלולים להתפתח סדקים תרמיים בפוטו-רזיסט. זה לא רצוי, מכיוון שהסדקים עלולים לפגוע בשלמות הערוץ. בעוד שניתן לפתור סדקים על ידי חימום מחדש של ההתנגדות לטמפרטורה הקרובה לטמפרטורת המעבר שלה (~115 מעלות צלזיוס), מצאנו שמתן אפשרות למאסטר להתקרר באופן סביבתי על הפלטה החמה הייתה הדרך החזקה ביותר למנוע סדקים. יתר על כן, עודף אור סביבתי עלול לגרום לחשיפה לא מכוונת של הפוטו-רזיסט, להחליש את ההתנגדות וכתוצאה מכך תכונות המכשיר עצמן (שאמורות להישאר על הפרוסה לאחר הפיתוח) עוברות הפשטה חלקית במהלך שלב הפיתוח. מסיבה זו, אנו מעודדים את שלב הפיתוח להתבצע ביום שלאחר שלבי האפייה שלאחר החשיפה ושלבי קירור הלילה. יתר על כן, בכל פעם שהמכשיר הראשי אינו בשימוש, אנו ממליצים לאחסן אותו באזור חשוך או עטוף בנייר אלומיניום כדי למנוע השפלה לאורך זמן. ברגע שהפרמטרים האלה נקבעו, תהליך הפוטוליתוגרפיה היה מאוד חוזר על עצמו (איור 4).
לאחר יצירת המאסטר, PDMS נוזלי נוצק על גבי המאסטר, מה שאפשר ל-PDMS לרפא וליצור חותם שלילי של תווי המאסטר. מצאנו כי יציקת ה-PDMS בעובי של 2-3 מ"מ אפשרה מניפולציה קלה של המכשירים; לעומת זאת, אם מצופה ספין כדי להשיג עובי בתחום המיקרומטר, ה-PDMS היה נוטה להיקרע או להיצמד לעצמו, מה שהקשה על המניפולציה. יתר על כן, שכבת PDMS עבה יותר מאפשרת חיבור קל יותר של צינורות, מכיוון שהצינור יישאר ביציאות הכניסה/יציאה ללא צורך בחומר איטום או מהדק.
לבסוף, בעוד שבדיקות תאי זרימה מסורתיות ליישומים ביולוגיים אלה משתמשות לעתים קרובות בכיסויי זכוכית שנוקו מראש באמצעות תמיסת פיראנה (מי חמצן וחומצה גופרתית) ולאחר מכן סילאנו, מצאנו כי כיסויים שטופלו בניקוי פלזמה מורחב ושטיפת IPA התאימו למטרותינו47. יישומים אחרים, כגון הדמיה של מולקולה אחת, עשויים לדרוש טיפול נרחב יותר בזכוכית כיסוי.

איור 4: תהליך פוטוליתוגרפיה. (A) המסכה עם העיצוב הרצוי (מסכה עשויה מכרום חרוט על זכוכית). (B) סדקים קלים של פוטו-רזיסט על פרוסת הסיליקון עקב מתח תרמי (חיצים מדגישים כמה סדקים). סדקים אלה נמתחים לעתים קרובות על פני כל הוופל. (ג) המאסטר המפותח. (D) המערך המיקרופלואידי במיקרוסקופ. רכיבים בודדים מסומנים בירוק. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
צמיחה, ייצוב וכיפוף של מיקרו-צינורות
זרעי מיקרו-צינורות הגדלים ב-GMPCPP משמשים כאתרי גרעין להרחבות מיקרו-צינורות לפילמור והם עצמם יציבים מפני דה-פולימריזציה למשך מספר שעות בטמפרטורת החדר. הזרעים נקשרו לכיסוי הזכוכית בתעלה המיקרופלואידית באמצעות נוגדן אנטי-רודמין47. לאחר מכן גודלו הרחבות מיקרו-צינורות דינמיות בנוכחות טובולין מסיס (מסומן פלואורסצנטי אך לא מצומד לרודמין) ו-GTP. בדרך זו, אתרי גרעין הזרעים חוברו לכיסוי הזכוכית, אך ההרחבות לא הוצמדו. במהלך תקופת הגידול של 15 דקות, הרחבות המיקרו-צינורות עוברות פילמור ודה-פולימר באופן סטוכסטי, כצפוי בשל חוסר היציבות הדינמית הפנימית שלהן49. לאחר תקופת גידול זו, בוצעה שטיפת טקסול של 10 מיקרומטר כדי לחסל את כל הטובולין שנותר מהתמיסה ולייצב את הרחבות המיקרו-צינורות שנוצרו. הייצוב הוא המפתח, מכיוון שהרחבות המיקרו-צינורות היו מתפרקות עם דלדול הטובולין. בנוסף לקשירת וייצוב פולימר מיקרו-צינוריות, טקסול הוכח גם כמשפיע על מכניקת המיקרו-צינורות ועשוי לגרום לעקמומיות בהרחבות המיקרו-צינורות הליניאריותאחרת 51,52,53,54. התוצאות המוצגות כאן שיקפו את התצפיות הללו; עם זאת, סלסול הרחבות המיקרו-צינורות אינו רצוי, מכיוון שהדבר גורם לכוחות לא אחידים המועברים לאורך הסריג במהלך הכיפוף. לכן, רק מיקרו-צינורות שנשארו ישרים יחסית לאחר הייצוב שימשו לניתוח כיפוף. לחלופין, לאחר תקופת הגידול הראשונית, ניתן להשתמש בתקופת גידול משנית עם תמיסה של טובולין ו-GMPCPP (בניגוד ל-GTP הראשוני) כדי ליצור 'כובעים' יציבים בקצוות הצומחים של סריג המיקרו-צינוריות ולמנוע דה-פולימריזציה55.
לאחר מכן המיקרו-צינוריות כופפו על ידי זרימה בתמיסת החיץ באמצעות מערכת בקרת הלחץ כדי לשמור על לחץ קבוע במעלה הזרם (איור 5, סרטון משלים 1). בדרך זו, יכולנו להעריך את הזרימה המקומית שחווים המיקרו-צינורות. על ידי הזרמת נוזל פנימה מהחלק העליון והחוצה מיציאת המכשיר התחתונה, כיוון הזרימה נועד להיות מאונך לכיוון הזריעה.
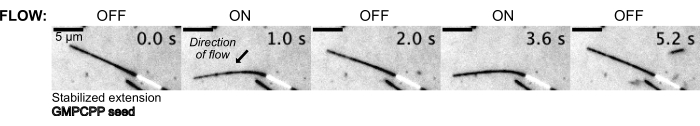
איור 5: ניתן להשתמש במערך המיקרו-נוזלי לכיפוף מיקרו-צינוריות מיוצבות. מיקרו-צינורות במצב מנוחה לאחר ייצוב עם פקליטקסל כפופים במהלך זרימה פועמת. לחץ קבוע במעלה הזרם של 30 mbar מניע זרימה (חץ מציין את כיוון הזרימה). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
קביעת פרופיל הזרימה במכשיר המיקרופלואידי
ניתן לדמות את מהירות קו המרכז במיקרופלואידיקה באופן חישובי באמצעות תוכנת COMSOL (תוכנת סימולציה, איור 6A). עם זאת, המיקרו-צינורות מחוברים לכיסוי הזכוכית עבור מיקרוסקופ TIRF בטווח של ~100 ננומטר מהמשטח. לכן, המהירות שחווה המיקרו-צינורית אינה זהה לזו שנחזה בסימולציה הדו-ממדית. כדי להעריך את הזרימה המקומית שחווים המיקרו-צינורות, השתמשנו במשוואת Navier-Stokes הכללית לזרימת נוזל בלתי ניתנת לדחיסה בממד אחד:
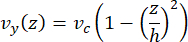
כאן, z הוא גובה המיקרו-צינורות במכשיר, h הוא הגובה הכולל של המכשיר, ו-vc הוא מהירות קו המרכז במכשיר. לפי הגדרת המערכת, מקור z הוא מרכז ההתקן (איור 6B). באמצעות הגדרה זו וגובה תעלה של 13 מיקרומטר, גובה המיקרו-צינורות משוער כ-z = -6.4 מיקרומטר. פתרון משוואה זו מניב אומדן למהירות הנוזל המקומית שחווים המיקרו-צינורות:

איור 6: הגדרת המערכת עבור ניתוח זרימת נוזל של נוזל הנכנס להתקן ביציאה העליונה ויוצא ביציאה התחתונה (יציאות אינן מוצגות). (A) סימולציה של שדה מהירות קו מרכזי בקנה מידה כמו באיור 3B. כוכב מציין את אזור העניין של פאנל B. (B) ייצוג חתך של המכשיר. פרופיל זרימת נוזלים מפותח במלואו הוא בכיוון y עם מהירות קו מרכז vc ב-z = 0 ומצב גבול ללא החלקה בקירות. שים לב שהחצים בלוח זה אינם בקנה מידה ביחס לשדה המהירות בפועל המוצג בלוח A. נתון זה שונה באישור רוג'רס (2022)14. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
מעבר לסימולציות, ניתן לשלוט במהירות הנוזל באמצעות בקר זרימה המבוסס על קצב זרימה נפחי במקום לשמור על לחץ. יתר על כן, ניתן לקבוע ישירות את קצב הזרימה המקומי בכל מכשיר על ידי הכללת חרוזי פלורסנט וניטור מהירותם, ובכך להקל על כל שונות מדגימה לדגימה.
מודלים חישוביים והדגמות שיפוע
לבסוף, ביצענו סימולציות חישוביות בשילוב עם ניסויים כדי להדגים את היתכנות השימוש במכשיר זה לניסויים בעלי תפוקה גבוהה. יחד עם היכולת לכופף מיקרו-צינוריות לכיוונים מרובים הודות לסימטריה של ההתקן, הסימולציות הראו שההתקן יכול לשמור על שיפועים מדויקים, מה שמאפשר חקירה בו-זמנית של תנאי ניסוי מרובים (איור 7A). ניסויים ראשוניים (שיטות שלא צוינו במפורש כחלק מפרסום זה) שהשתמשו בצבע פלואורסצנטי בתמיסה הראו עקביות עם התחזיות החישוביות (איור 7B). יתר על כן, הדגמנו בהצלחה חלוקה של חלבונים שונים באזורים שונים של המכשיר על ידי גידול בו-זמנית של הרחבות מיקרו-צינוריות עם תוויות פלואורסצנטיות שונות (איור 8). למיטב ידיעתנו, זהו היישום הראשון של מיקרופלואידיקה בתפוקה גבוהה לחקירות מיקרו-צינוריות. ניתן להשתמש בתכונה זו של מכשיר זה כדי להפחית את הזמן והכמויות של ריאגנטים הדרושים תוך שיפור החוסן הניסיוני. לדוגמה, ניתן לחקור בו זמנית את ההשפעות של חלבונים שונים או ריכוזים שונים של חלבונים בודדים על מכניקת המיקרו-צינורות והדינמיקה שלהם במכשיר יחיד.
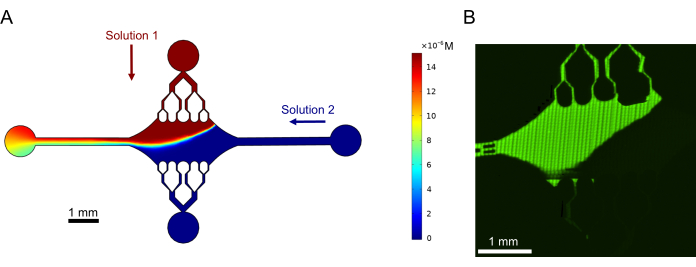
איור 7: היווצרות שיפוע. (A) סימולציה של שיפוע של שני פתרונות הנכנסים להתקן באותו לחץ כניסה (50 mbar) וריכוז (15 μM). יציאות כניסה עבור כל פתרון מסומנות בחצים צבעוניים (פתרון אחד ביציאה העליונה ופתרון אחר ביציאה הימנית), ושתי היציאות הנותרות משמשות כיציאות. מפת חום מציגה את פרופיל הריכוז של הפתרון העליון. מצב יציב הושג ב-t = 5 שניות. (B) יצירה ניסויית של שיפוע דומה באמצעות צבע פלואורסצנטי בתמיסה ביציאה העליונה ובמאגר ביציאה הימנית. תמונה היא שכבת רסטר שנוצרת על ידי תפירת כל שדה ראייה (80 מיקרומטר × 80 מיקרומטר) כדי לפתור את כל אזור המכשיר. נתון זה שונה באישור רוג'רס (2022)14. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
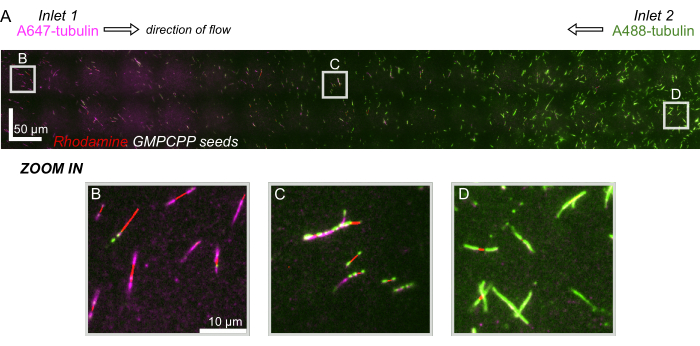
איור 8: הדגמת שיפוע חלבון בהתקן המיקרופלואידי. טובולין עם תווית AlexaFluor647 (מגנטה) הוטס בכניסה 1, וטובולין עם תווית AlexaFluor488 (ירוק) הוטס בכניסה 2 של המכשיר בריכוזים ובקצבי זרימה שווים. הזרימה התנודדה להפעלה/כיבוי במרווחים של 90 שניות כדי לאפשר פילמור טובולין מזרעי GMPCPP מיוצבים (אדום) תוך עיכוב ערבוב. (A) שכבת רסטר בקנה מידה גדול שנעשית על ידי תפירת שדות ראייה (80x80 מיקרומטר) כדי לפתור את כל אורך המכשיר. אותיות מציינות את המיקום היחסי של שדות ראייה בודדים בחלוניות הבאות. סרגל קנה המידה הוא 50 מיקרומטר במצב X ו-Y. (B) שדה ראייה ליד כניסה 1 של המכשיר, כאשר הרחבות מורכבות בעיקר מטובולין עם תווית A647. (C) שדה ראייה ליד מרכז המכשיר, שבו הרחבות מורכבות מתערובת של טובולינים מסומנים, כפי שחזו. (D) שדה ראייה ליד החלק התחתון של המכשיר, כאשר הרחבות מורכבות בעיקר מטובולין עם תווית A488. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
דיאגרמת זרימת תהליך (PFD) עבור מערך הניסוי של מיקרופלואידיקה במיקרוסקופ מוצגת באיור משלים 1.
איור משלים 1: דיאגרמת זרימת תהליך (PFD) עבור מערך הניסוי של מיקרופלואידיקה במיקרוסקופ. אנא לחץ כאן להורדת קובץ זה.
סרטון משלים 1. ניתן להשתמש במערך המיקרופלואידי לכיפוף מיקרו-צינורות מיוצבים. מיקרו-צינורות במצב מנוחה לאחר ייצוב עם פקליטקסל כפופים במהלך זרימה פועמת. לחץ קבוע במעלה הזרם של 30 mbar מניע זרימה. קצב הפעלת וידאו 10 פריימים לשנייה. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 1: קובץ CAD של עיצוב המסכה המיקרופלואידית. אנא לחץ כאן להורדת קובץ זה.
Discussion
המטרה העיקרית של פרוטוקול זה הייתה לתכנן ולייצר מכשיר מיקרופלואידי, המתאים לחקר מכניקת מיקרו-צינוריות במבחנה. התכנון התבסס על הרצון לנצל את היתרונות המהותיים של התקנים מיקרופלואידיים מבוססי PDMS תוך הכללת שילוב של תכונות שיאפשרו ניסויים חזקים וניתנים להתאמה אישית בתפוקה גבוהה.
מטרה זו הושגה בהצלחה, וכתוצאה מכך נוצרו פרוטוקולי ייצור והנחיות כלליות שיכולות לשמש בסיס למשתמשים עתידיים במערכת זו. הכללת מלכודות בועות מיותרות במכשיר מפחיתה את הסבירות לדנטורציה של חלבון עקב נוכחותן של בועות אוויר. אמנם עדיין יש לנו קצת ניתוק וחיבור מחדש של צינורות במכשיר, מלכודות בועות אלה מפחיתות את ההסתברות לכישלון ניסוי. שיפורים עתידיים במערך המיקרופלואידיקה יכולים אפילו להפחית עוד יותר את כמות המניפולציות הידניות של צינורות שבוצעו במהלך ניסוי. יתרה מכך, השילוב של המכשיר המיקרופלואידית עם תוכנת בקרת זרימה אוטומטית מאפשר התאמה אישית משמעותית של תנאי הניסוי תוך הפחתת האפשרות לטעות ידנית. הדגמנו את הביצועים המוצלחים של ההתקן על ידי ייצור המכשיר ולאחר מכן גידול, ייצוב וכיפוף הרחבות מיקרו-צינוריות בהתקן באמצעות זרימה אוטומטית מיוצבת בקר. יתר על כן, על ידי קביעת שיפוע של תמיסות טובולין מובחנות עם תווית פלואורסצנטית בתוך אותו מכשיר, הראינו שניתן להפעיל מספר תנאים בו זמנית במכשיר יחיד. בעזרת טכניקות מודלים וניתוח חישוביים, המערכת שלנו יכולה לחקור ולקבוע את התכונות הביומכניות של מיקרו-צינורות, כגון קשיחות כיפוף 52,56,57,58,59.
שיפורים עתידיים פוטנציאליים יאפשרו מערכת חזקה עוד יותר וניתוח ניסיוני נלווה. ראשית, שקיעת האור-התנגדות, החשיפה והאפייה היו פרמטרים מכריעים שהפגינו שונות מסוימת. גדלי התכונות הגבוהים יחסית של ה-SPR photoresist דרשו חימום וקירור הדרגתיים מאוד כדי למנוע סדקים תרמיים, שעלולים להרוס את המכשירים. בעוד שניסו מכשירים דקים יותר, מצאנו בעיות במניפולציה של גדלי התכונות הקטנים הללו. תשומת לב לפרטים וסבלנות הם חיוניים לשכפול התקנים בעובי זה עם עמידות לאור SPR. ניתן להשתמש בפוטו-רזיסטים שונים כדי לפתור בעיה זו, בהתאם לזמינות.
יחד, המכשיר והפרוטוקול המיקרופלואידיים כאן מאפשרים מגוון של מערכי ניסוי עם יכולות בדיקה חזקות יותר בתפוקה גבוהה מאשר מבחני תאי זרימה קודמים47. יתר על כן, ניתן לבצע אוטומציה של ניסויים באמצעות בקרי זרימה כדי לשמור על פרופילי זרימה מדויקים או שיפועי ריכוז במכשיר, מה שמפחית את השונות הטבועה במשתמשים ידניים. יישומים פוטנציאליים עתידיים של מערך זה כוללים חקירת ההשפעות של חלבונים הקשורים למיקרו-צינורות על קשיחות כיפוף המיקרו-צינורות, דינמיקה, נזק לסריג ותיקון, כמו גם האינטראקציות הביומכניות של מיקרו-צינורות וחוטי אקטין 54,60,61,62,63,64,65,66,67,68,69,70. השילוב של מיקרו-ייצור, בקרת זרימה אוטומטית וטכניקות מידול וניתוח חישוביות יוצר מערכת רב-תכליתית המתאימה לחקר השלד התאי במבחנה.
Disclosures
למחברים אין ניגודי אינטרסים. המחברים חושפים את השימוש ב-ChatGPT-4o OpenAI לתיקון טקסט והגהה.
Acknowledgements
אנו אסירי תודה על התמיכה והמשאבים שמספק מכון ונדרבילט למדע והנדסה בקנה מידה ננומטרי (VINSE), שם נערך חלק ממחקר זה. עבודה זו מומנה בחלקה באמצעות מענק NIH NIGMS ל-M. Zanic (R35 GM1192552) ומענק NSF ID 2018661 ל-M. Zanic. מ. רוג'רס קיבל תמיכה ממענק GM08320 של NIH T32 ומענק מימון פיילוט של VINSE. ל. ריצ'רדסון נתמך על ידי מענק NSF GRFP מס' 1937963. המחברים רוצים גם להודות לד"ר אליס ליץ', דיוויד שפר, ד"ר כריסטינה מקגהאן ולכל מעבדת Zanic על הסיוע והתמיכה.
Materials
| Name | Company | Catalog Number | Comments |
| 0.6 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mm standard biopsy punch | Integra LifeSciences | 33-31A-P/25 | |
| 100x/1.49 numerical aperture TIRF objective | Nikon | ||
| 22 x 22 mm glass coverslips | ThorLabs | CG15CH | |
| 3" single side polished silicon wafers | University Wafer | 447 | |
| 4" Petri dish | Any brand | ||
| 450 µL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter, Inc. | 345843 | Referred to as 'airfuge tube' in the protocol |
| 488-, 561, and 640-nm solid state lasers | Nikon | ||
| A-95 Fixed-Angle Rotor | Beckman Coulter, Inc. | 347595 | |
| Acetone | Any brand | ||
| Airfuge Air-Driven Ultracentrifuge | Beckman Coulter, Inc. | 347854 | Referred to as 'airfuge' in the protocol |
| Alexa Fluor 488 Microscale Protein Labeling Kit | Thermo Fisher Scientific | A30006 | |
| Aluminum foil | Any brand | ||
| Andor iXon Ultra EM-CCD | Nikon | ||
| Andor NEO sCMOS | Nikon | ||
| AutoCAD | Autodesk | Generic versions can be used | |
| Bovine brain unlabeled tubulin (purified) | N/A | Made in house, but can be purchased | |
| Casein | MilliporeSigma | C7078 | |
| Catalase | MilliporeSigma | C9322 | |
| Clean Dry Air (CDA) (pressurized gas) | Any brand | ||
| Compressed air supply | Any brand | Connects to the microfluidic flow controller | |
| COMSOL Multiphysics software | COMSOL, Inc. | ||
| Custom brass stage adapter | N/A | Made in house to fit our 22 mm x 22 mm coverslips onto the microscope | |
| De-ionized water | Any brand | ||
| Dessicator | Any brand | ||
| D-glucose | MilliporeSigma | G7528 | |
| Dithiothreitol (DTT) | MilliporeSigma | D0632 | |
| EGTA | MilliporeSigma | 324626 | |
| Elveflow Smart Interface (ESI) software | Elveflow | ||
| Flangeless PFA fittings with ETFE ¼”-28 to 1/16” outer diameter ferrules | Darwin Microfluidics | CIL-XP-245X | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack |
| Fluiwell 4-Channel 2 mL Low Pressure | Fluigent | 14002001 | Used to connect the flow control system to the the micrewtubes. Also refered to as 'pressurized reservoir rack' |
| Fume hood | Any brand | ||
| Glucose oxidase | MilliporeSigma | G6125 | |
| GMPCPP | Jena Bioscience | NU-405L | |
| Guanosine triphosphate (GTP) | MilliporeSigma | G8877 | |
| Hot plate | Any brand | ||
| HS-625 high-speed emission filter wheel | Finger Lakes Instrumentation | ||
| ImageJ software | N/A | Open access | |
| Incubator | Any brand | ||
| Isopropyl alcohol | Any brand | ||
| Karl Suss MA-6 mask aligner | SUSS MicroTec | ||
| Magnesium chloride | MilliporeSigma | 1.05833 | |
| MATLAB software | MathWorks | ||
| MEGAPOSIT SPR 220 7.0 photoresist | Dow, Inc. | ||
| Microfluidic Fittings 6-40 to 1/4"-28 Adapters Kit | Darwin Microfluidics | LVF-KFI-08 | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack (Fluiwell rack) |
| Microfluidic Fittings Female Luer Lock Adapter Kit | Darwin Microfluidics | LVF-KFI-04 | Used to connect the syringe to the tubing |
| Microfluidic flow controller | Elveflow | OB1 MK3+ | |
| Microfluidic flow sensor | Elveflow | MFS3 | This flow sensor range is 0-80 μL |
| MICROPOSIT MF-319 developer | Dow, Inc. | ||
| Microscope | Nikon | Eclipse Ti | |
| NIS-Elements software | Nikon | ||
| Nitrogen (pressurized gas) | Any brand | ||
| Objective heater | Tokai Hit | ||
| One-Piece Fingertight 10-32 Coned Fitting for 1/16" OD Tubing | Darwin Microfluidics | CIL-F-120X | Used to connect the syringe to the tubing |
| Paclitaxol (Taxol) | Tocris Bioscience | 1097 | |
| Photolithography masks | N/A | Made by an external party using our designs | |
| PIPES | Thermo Fisher Scientific | 172615000 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Plasma flowmeter system | Harrick Plasma | PDC-FMG | Integrates with plasma cleaner to enable flow control of pressurized gas |
| Plastic bulb pipet | Any brand | ||
| Pluoronic F-127 | MilliporeSigma | P2443 | Referred to as 'poloxomer 407' in the protocol |
| Potassium chloride | Research Products International | P41000 | |
| Saint Gobain Performance Plastics Tube Tygon .020 ID | Thermo Fisher Scientific | 50-206-8921 | Refered to as '1.5 mm tubing' and 'tubing' in the protocol |
| Scalpel | Any brand | ||
| Spin coater | Cost Effective Equipment, LLC. | 200x | This model may be discontinued |
| Standard pipets and tip sets | Any brand | ||
| Standard plastic syringe | Any brand | We used a 10 mL Luer-slip syringe | |
| Sylgard 184 silicone elastomer kit | Dow, Inc. | Referred to as 'PDMS' and 'curing agent' in the protocol | |
| T339 Micrewtube with Lip Seal and Flat Screw Cap | Medline Industried, LP. | T339 | Referred to as 'source vial' in the protocol. We used both 0.5 mL and 1.5 mL sizes |
| TAMRA, SE; 5-(and-6)-Carboxytetramethylrhodamine, Succinimidyl Ester | Invitrogen | C1171 | Referred to as 'TTR' in the protocol |
| Trichloro(1H, 1H, 2H, 2H-perfluorooctyl) silane | MilliporeSigma | 448931 | |
| Trion Phantom RIE ICP | Trion Technology, Inc. | This plasma cleaner is only used in Step 1.1 of the protocol. Another plasma cleaner, like the one used for PDMS bonding, can be used instead; we just prefer the much lower vacuum achievable by this system for cleaning the silicon wafer | |
| TRITC Polyclonal Antibody | Thermo Fisher Scientific | A6397 | Referred to as 'anti-rhodamine antibody' in the protocol |
| Tweezers | Any brand | ||
| Vacuum pump | Any brand |
References
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Phys Today. 54 (6), 42(2001).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev Mod Phys. 77, 977(2005).
- Beebe, D. J., Mensing, G. A., Walker, G. M. Physics and applications of microfluidics in biology. Annu Rev Biomed Eng. 4, 261-286 (2002).
- Ng, J. M. K., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. Electrophoresis. 23 (20), 3461-3473 (2010).
- Dellaquila, A. Five Short Stories on The History of Microfluidics. , https://www.elveflow.com/microfluidic-reviews/general-microfluidics/history-of-microfluidics/ (2025).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: Microfluidics in drug discovery. Nat Rev Drug Discov. 5 (3), 210-218 (2006).
- Neužil, P., Giselbrecht, S., Länge, K., Huang, T. J., Manz, A. Revisiting lab-on-a-chip technology for drug discovery. Nat Rev Drug Discov. 11 (8), 620-632 (2012).
- Manz, A., Graber, N., Widmer, H. M. Miniaturized total chemical analysis systems: a novel concept for chemical sensing. Sens Actuators B: Chem. 1 (1-6), 244-248 (1990).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Knight, J. Microfluidics: Honey, I shrunk the lab. Nature. 418 (6897), 474-475 (2002).
- Photolithographic fabrication techniques for transistors which are an integral part of a printed circuit. Nall, J. R., Lathrop, J. W. 1957 International Electron Devices Meeting, Washington, DC, USA, , (1957).
- Rogers, M. The design and fabrication of a two-layer microfluidic device for studying microtubules in vitro [Master's Thesis]. , Vanderbilt University. Nashville, TN. (2022).
- Lee, J. B., Choi, K. H., Yoo, K. Innovative SU-8 lithography techniques and their applications. Micromachines. 6 (1), 1-18 (2015).
- Kim, P., et al. Soft lithography for microfluidics: A Review. Biochip J. 2 (1), 1-11 (2008).
- Venkatesan, S. u, Jerald, J., Asokan, P., Prabakaran, R. A Comprehensive Review on Microfluidics Technology and its Applications. Recent Advances in Mechanical Engineering. , Springer. Singapore. 235-245 (2020).
- Minteer, S. Microfluidic Techniques: Reviews and Protocols. , Humana Press. New Jersey. (2006).
- Mitra, S. K., Chakraborty, S. Microfluidics and Nanofluidics Handbook: Fabrication, Implementation, and Applications. , Taylor and Francis Group. Florida. (2016).
- Alberts, B., et al. Molecular Biology of the Cell. , Garland Science. New York. (2014).
- Howard, J. Mechanics of Motor Proteins and the Cytoskeleton. , Springer. Heidelberg. (2001).
- Hawkins, T., Mirigian, M., Selcuk Yasar, M., Ross, J. L. Mechanics of microtubules. J Biomech. 43 (1), 23-30 (2010).
- Gardel, M. L., Kasza, K. E., Brangwynne, C. P., Liu, J., Weitz, D. A. Chapter 19: Mechanical Response of Cytoskeletal Networks. Methods Cell Biol. 89, 487-519 (2008).
- Caporizzo, M. A., Prosser, B. L. The microtubule cytoskeleton in cardiac mechanics and heart failure. Nat Rev Cardiol. 19 (6), 364-378 (2022).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nat Mater. 14 (11), 1156-1163 (2015).
- Chu, S. H., et al. A microfluidic device for in situ fixation and super-resolved mechanosensation studies of primary cilia. Biomicrofluidics. 13 (1), 014105(2019).
- Geisterfer, Z. M., Zhu, D. Y., Mitchison, T. J., Oakey, J., Gatlin, J. C. Microtubule growth rates are sensitive to global and local changes in microtubule plus-end density. Curr Biol. 30 (15), 3016-3023 (2020).
- Schaedel, L., et al. Lattice defects induce microtubule self-renewal. Nat Phys. 15 (8), 830-838 (2019).
- Aher, A., et al. CLASP mediates microtubule repair by restricting lattice damage and regulating tubulin incorporation. Curr Biol. 30 (11), 2175-2183 (2020).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. ELife. 5, e13470(2016).
- Fourniol, F. J., et al. Micropattern-guided assembly of overlapping pairs of dynamic microtubules. Methods Enzymol. 540, 339-360 (2014).
- Vleugel, M., Roth, S., Groenendijk, C. F., Dogterom, M. Reconstitution of basic mitotic spindles in spherical emulsion droplets. J Vis Exp. (114), e54278(2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Mol Biol Cell. 27 (22), 3563-3573 (2016).
- VanDelinder, V., Brener, S., Bachand, G. D. Mechanisms underlying the active self-assembly of microtubule rings and spools. Biomacromolecules. 17 (3), 1048-1056 (2016).
- Roth, S., Gârlea, I. C., Vleugel, M., Mulder, B. M., Dogterom, M. Reconstitution of basic mitotic spindles in cell-like confinement. bioRxiv. , (2019).
- Xu, Z., et al. Microtubules acquire resistance from mechanical breakage through intralumenal acetylation. Science. 356 (6335), 328-332 (2017).
- Fanalista, F., et al. Shape and size control of artificial cells for bottom-up biology. ACS Nano. 13 (5), 5439-5450 (2019).
- Velve-Casquillas, G., Costa, J., Carlier-Grynkorn, F., Mayeux, A., Tran, P. T. A fast microfluidic temperature control device for studying microtubule dynamics in fission yeast. Methods Cell Biol. 97, 185-201 (2010).
- Portran, D., Schaedel, L., Xu, Z., Théry, M., Nachury, M. V. Tubulin acetylation protects long-lived microtubules against mechanical ageing. Nat Cell Biol. 19 (4), 391-398 (2017).
- Huang, Y. M., Uppalapati, M., Hancock, W. O., Jackson, T. N. Microtubule transport, concentration and alignment in enclosed microfluidic channels. Biomed Microdevices. 9 (2), 175-184 (2007).
- Uppalapati, M., Huang, Y., Shastry, S., Jackson, T. N., Hancock, W. O. Microtubule Motors in Microfluidics. Methods in Bioengineering: Microfabrication and Microfluidics. , Artech House Publishers. Boston, MA. (2009).
- Sung, J. H., Shuler, M. L. Prevention of air bubble formation in a microfluidic perfusion cell culture system using a microscale bubble trap. Biomed Microdevices. 11 (4), 731-738 (2009).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360(2019).
- Nakayama, T., et al. Circumventing air bubbles in microfluidic systems and quantitative continuous-flow PCR applications. Anal Bioanal Chem. 386 (5), 1327-1333 (2006).
- Park, S., Cho, H., Kim, J., Han, K. -H. Lateral degassing method for disposable film-chip microfluidic devices. Membranes. 11 (5), 316(2021).
- Pereiro, I., Fomitcheva Khartchenko, A., Petrini, L., Kaigala, G. V. Nip the bubble in the bud: A guide to avoid gas nucleation in microfluidics. Lab Chip. 19 (14), 2296-2314 (2019).
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biol. 95, 221-245 (2010).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: Information from a slowly hydrolyzable analogue, GMPCPP. Mol Biol Cell. 3 (10), 1155-1167 (1992).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bartlett, N. W., Wood, R. J. Comparative analysis of fabrication methods for achieving rounded microchannels in PDMS. J Micromech Microeng. 26 (11), 115013(2016).
- Yang, C. P. H., Horwitz, S. B. Taxol®: The first microtubule stabilizing agent. Int J Mol Sci. 18 (8), 1733(2017).
- Gittes, F., Mickey, B., Nettleton, J., Howard, J. Flexural rigidity of microtubules and actin filaments measured from thermal fluctuations in shape. J Cell Biol. 120 (4), 923-934 (1993).
- VanBuren, V., Cassimeris, L., Odde, D. J. Mechanochemical model of microtubule structure and self-assembly kinetics. Biophys J. 89 (5), 2911-2926 (2005).
- Dye, R. B., Fink, S. P., Williams, R. C. Taxol-induced flexibility of microtubules and its reversal by MAP-2 and Tau. J Biol Chem. 268 (10), 6847-6850 (1993).
- Drechsel, D. N., Kirschnert, M. W. The minimum GTP cap required to stabilize microtubules. Curr Biol. 4 (12), 1053-1061 (1994).
- Wisanpitayakorn, P., Mickolajczyk, K. J., Hancock, W. O., Vidali, L., Tüzel, E. Measurement of the persistence length of cytoskeletal filaments using curvature distributions. Biophys J. 121 (10), 1813-1822 (2022).
- Mickey, B., Howard, J. Rigidity of microtubules is increased by stabilizing agents. J Cell Biol. 130 (4), 909-917 (1995).
- Brangwynne, C. P., et al. Bending dynamics of fluctuating biopolymers probed by automated high-resolution filament tracking. Biophys J. 93 (1), 346-359 (2007).
- Venier, P., Maggs, A. C., Carlier, M. F., Pantaloni, D. Analysis of microtubule rigidity using hydrodynamic flow and thermal fluctuations. J Biol Chem. 269 (18), 13353-13360 (1994).
- Felgner, H., Frank, R., Schliwa, M. Flexural rigidity of microtubules measured with the use of optical tweezers. J Cell Sci. 109 (Pt 2), 509-516 (1996).
- Felgner, H., et al. Domains of neuronal microtubule-associated proteins and flexural rigidity of microtubules. J Cell Biol. 138 (5), 1067-1075 (1997).
- Nishida, K., et al. Effects of three microtubule-associated proteins (MAP2, MAP4, and Tau) on microtubules' physical properties and neurite morphology. Sci Rep. 13, 8870(2023).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Brouhard, G. J., Rice, L. M. Microtubule dynamics: An interplay of biochemistry and mechanics. Nat Rev Mol Cell Biol. 19 (7), 451-463 (2018).
- Lawrence, E. J., Chatterjee, S., Zanic, M. More is different: Reconstituting complexity in microtubule regulation. J Biol Chem. 299 (12), 105398(2023).
- Howard, J., Hyman, A. A. Dynamics and mechanics of the microtubule plus end. Nature. 422 (6933), 753-758 (2003).
- Mehidi, A., Aumeier, C. Regulation of the microtubule network; the shaft matters. Curr Opin Syst Biol. 34, 100457(2023).
- Verhey, K. J., Ohi, R. Causes, costs and consequences of kinesin motors communicating through the microtubule lattice. J Cell Sci. 136 (5), jcs260735(2023).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nat Rev Mol Cell Biol. 20 (1), 38-54 (2019).
- Théry, M., Blanchoin, L. Microtubule self-repair. Curr Opin Cell Biol. 68, 144-154 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved