Method Article
Entwicklung eines mikrofluidikbasierten Ansatzes zur Untersuchung der Mikrotubuli-Polymermechanik
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt das Design und die Herstellung eines mikrofluidischen Geräts, das für die Untersuchung der Mikrotubuli-Polymermechanik geeignet ist. Die Synthese von Mikrofabrikation, automatisierter Flusskontrolle und computergestützten Modellierungstechniken ermöglicht ein flexibles System, das sich ideal für die Untersuchung des zellulären Zytoskeletts in vitro eignet.
Zusammenfassung
In diesem Protokoll beschreiben wir das Design und die Herstellung eines mikrofluidischen Geräts, das für die Untersuchung der Mikrotubuli-Polymermechanik entwickelt wurde. Das Design nutzt die intrinsischen Vorteile von Mikrofluidik-Bauelementen auf Basis von Polydimethylsiloxan (PDMS) und führt mehrere Funktionen ein, um einen robusten und anpassbaren experimentellen Ansatz mit hohem Durchsatz zu ermöglichen. Das entwickelte Gerät verfügt über redundante Blasenfangfunktionen, um das Auftreten schädlicher Luftblasen zu verhindern. Darüber hinaus ist das Gerät mit einem automatisierten Durchflusskontrollsystem verbunden, um manuelle Eingriffe zu reduzieren und Hochdurchsatzanalysen zu ermöglichen. Kommerzielle Simulationssoftware wird eingesetzt, um den Flüssigkeitstransport mit diesem System besser zu entwickeln und zu verstehen. Schließlich demonstrieren wir die Fähigkeit, mehrere Experimente gleichzeitig in einem einzigen Gerät durchzuführen, indem wir Mikrotubuli-Erweiterungen mit unterschiedlichen Fluoreszenzmarkierungen in verschiedenen Abschnitten des Geräts züchten. Insgesamt kann dieses mikrofluidische Durchflusssystem zur Untersuchung der Polymermechanik von Mikrotubuli verwendet werden und bietet Verbesserungen im Versuchsdesign für breitere Mikrotubuli-In-vitro-Studien . Die Synthese von Mikrofabrikation, automatisierter Flusskontrolle und computergestützten Modellierungsansätzen ermöglicht ein flexibles System, das sich ideal für die Untersuchung des zellulären Zytoskeletts in vitro eignet.
Einleitung
Die Mikrofluidik ermöglicht die präzise Steuerung winziger Flüssigkeitsvolumina, oft weniger als ein Mikroliter, durch das komplizierte Design und die Herstellung von Strömungskanälen 1,2. Der kleine Maßstab der mikrofluidischen Geräte führt zu einzigartigen technischen Phänomenen. Die Reynolds-Zahl - ein dimensionsloses Maß für das Verhältnis zwischen Trägheits- und viskosen Kräften in der Fluidströmung - ist nämlich klein, typischerweise in der Größenordnung von O(10) oder niedriger in der Mikrofluidik, was die Bedeutung viskoser Kräfte in mikrofluidischen Geräten unterstreicht. Darüber hinaus zeigt die Péclet-Zahl, die den konvektiven mit dem diffusiven Transport vergleicht, dass der konvektive Transport in der Mikrofluidik im Allgemeinen vernachlässigbar ist 3,4,5. Dieses diffusionsgetriebene, laminare Strömungsregime in der Mikrofluidik ist vorteilhaft, da es parallele Experimente auf einem einzigen Gerät unterstützt, indem es präzise Fluidgradienten beibehält.
Die Photolithographie ist nach wie vor die primäre Methode zur Herstellung mikrofluidischer Bauelemente 6,7,8. Kurz gesagt, beinhaltet dieser Prozess die Erstellung einer "Master"-Ätzschablone des mikrofluidischen Designs (Abbildung 1). Ein lichtempfindliches Substrat wird hergestellt, und eine Photomaske im mikrofluidischen Design belichtet selektiv Bereiche des Fotolacks mit ultravioletter Strahlung. Nachfolgende Ätzverfahren entwickeln das Substrat und erzeugen ein Relief des Designs. Polydimethylsiloxan (PDMS) wird häufig auf den Master gegossen und ausgehärtet. Das ausgehärtete PDMS, das die negativen Merkmale des Designs übernimmt, wird dann vom Master entfernt und mit einem Glasdeckglas verklebt. Dieser gesamte Herstellungsprozess dauert in der Regel 1-2 Tage, was schnelle Design-Iterationen und die Produktion mehrerer Geräte ermöglicht. Detaillierte Übersichten über weiche Lithographie und Mikrofabrikationsprozesse sind in anderen Referenzenverfügbar: 1,2,3,10,11,12,13.
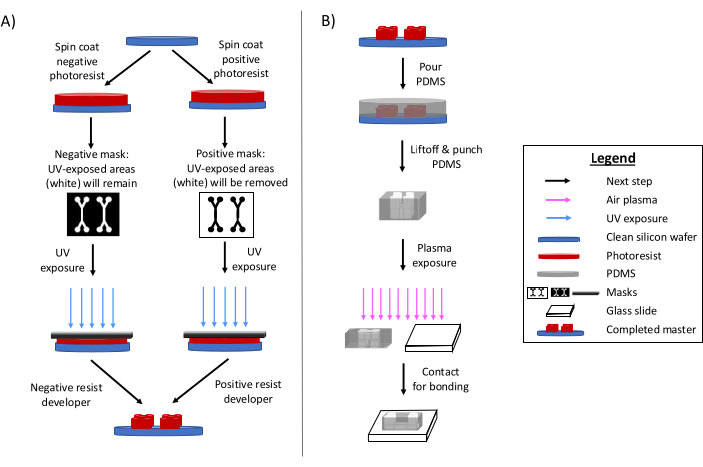
Abbildung 1: Überblick über das traditionelle Photolithographieverfahren und das Mikrofabrikationsverfahren. (A) Traditionelles Fotolithographieverfahren und (B) Mikrofabrikationsverfahren. Abhängig von der Anwendung und den gewünschten Eigenschaften des Fotolacks kann ein negativer oder ein positiver Fotolack verwendet werden, obwohl sie das gleiche Design-Master ergeben. Eigenschaften wie die gewünschte Merkmalshöhe oder die Schmelztemperatur des Fotolacks helfen bei der Bestimmung des geeigneten Fotolacktyps. Diese Abbildung wurde mit Genehmigung von Rogers (2022)14 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Der Einsatz der Mikrofluidik hat die Möglichkeiten in vielen Forschungsbereichen erweitert, zuletzt in den Biowissenschaften. Aufgrund ihres geringen Maßstabs ermöglicht die Mikrofluidik die präzise Verwaltung begrenzter, wertvoller Ressourcen wie Zellen oder Proteine. Noch wichtiger ist die Abstimmbarkeit mikrofluidischer Systeme, um physiologische Bedingungen nachzuahmen, wie z. B. Änderungen der Substratsteifigkeit, die Kraftausübung auf eine Probe und sogar die Integration von elektrischem Strom. Darüber hinaus bietet der Einsatz von Mikrofluidik die Möglichkeit, mehrere Reagenzien parallel zu manipulieren und Systemdesigns schnell zu prototypisieren und iterativ zu verfeinern. Diese Funktionen ermöglichen die Miniaturisierung ganzer Laborabläufe auf einem einzigen Gerät, das allgemein als "Lab-on-a-Chip" bezeichnet wird1,6,9,15,16,17,18,19.
Eine der zellbiologischen Anwendungen der Mikrofluidik ist die Untersuchung von Mikrotubuli-Polymeren. Mikrotubuli sind ein wesentlicher Bestandteil des Zellskeletts und spielen eine wichtige Rolle bei Prozessen wie der Zellteilung und dem intrazellulären Frachttransport20,21. Als steifstes Element des Zytoskeletts weisen Mikrotubuli einen Elastizitätsmodul auf, der mit dem von Plexiglas vergleichbarist 22,23. Ihre robusten mechanischen Eigenschaften sind entscheidend für verschiedene zelluläre Funktionen, wie z. B. die Kontraktion von Kardiomyozyten, bei der sie sich während der systolischen und diastolischen Phase des Herzens zyklisch biegen und entspannen24. Mikrofluidische Geräte wurden bisher eingesetzt, um die Eigenschaften von Mikrotubuli und ihre Strukturen höherer Ordnung in vitro zu untersuchen. In der Tat wurde die Mikrofluidik verwendet, um die Polymerisationsdynamik von Mikrotubuli, Mikrotubuli-Mikrotubuli-Wechselwirkungen und die Auswirkungen von Mikrotubuli-assoziierten Proteinen auf die mechanischen Eigenschaften von Mikrotubuli zu untersuchen 25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41.
Während die Einführung der Mikrofluidik in den Bereich der Mikrotubuli viele aufregende Entdeckungen hervorgebracht hat, gibt es noch Raum für Verbesserungen bei der Adaption dieser Geräte für die Mikrotubuli-Forschung. In dieser Arbeit befassen wir uns mit zwei spezifischen Einschränkungen, die bei der Untersuchung von Mikrotubuli in mikrofluidischen Geräten bestehen bleiben: das Potenzial für die Bildung von Luftblasen innerhalb des Geräts, das typischerweise durch manuelle Manipulation von mikrofluidischen Geräten entsteht, und die unzureichende Nutzung von Hochdurchsatz-Assays. Erstens können manuelle Manipulationen, wie z. B. das Verstopfen und Lösen von Schläuchen, zur Blasenbildung in den Kanälen führen. Die Bildung von Luftblasen in einer Durchflusszelle ist katastrophal, da Luftblasen Proteine denaturieren, Mikrotubuli-Polymere scheren und Zellkulturen beeinträchtigen können42,43. Darüber hinaus führen scharfe Ecken und schräge Winkel im Gerät zu einer ungleichmäßigen Oberflächenbenetzung, was die Möglichkeit von Lufteinschlüssen erhöht. Zahlreiche Techniken wurden entwickelt, um die Bildung, Persistenz und Auswirkungen von Luftblasen zu reduzieren. Die Verwendung von Methoden zur Blasenminderung ist jedoch nicht universell 42,43,44,45,46. Obwohl einer der Hauptvorteile der Mikrofluidik die Möglichkeit des Experimentierens mit hohem Durchsatz ist, wurde die Mikrofluidik bisher nicht zur Ausweitung der Mikrotubuli-Forschung eingesetzt. Mikrofluidische Geräte können so konzipiert werden, dass sie mehrere experimentelle Bedingungen parallel auf demselben Gerät testen. Zum Beispiel können Flüssigkeitsgradienten verwendet werden, um den Fluss verschiedener Mikrotubuli-assoziierter Proteine oder Wirkstoffe zu lenken und so ihre gezielte Abgabe an bestimmte Regionen partitionierter Mikrotubuli innerhalb desselben Geräts zu ermöglichen.
Hier haben wir iterativ ein mikrofluidisches Gerät entwickelt, das diese Einschränkungen behebt. Wir stellen das Schritt-für-Schritt-Protokoll der Herstellung des Geräts zur Verfügung und ermöglichen es so einem breiteren Publikum, die Mikrofluidik-Technologie in ihrer Mikrotubuli-Forschung einzusetzen. Dieses Gerätedesign verfügt über Blasenfangfunktionen und verwendet ein automatisiertes Durchflussregelungssystem, um manuelle Eingriffe zu reduzieren und gleichzeitig Lösungsgradienten im Gerät für Hochdurchsatzanalysen zu ermöglichen. Zusammenfassend lässt sich sagen, dass die Entwicklung dieses mikrofluidischen Designs die breitere Forschung und das Verständnis der Mikrotubuli-Mechanik erleichtern und gleichzeitig wertvolle Verbesserungen für experimentelle Designs im breiteren Bereich der Mikrotubuli-Forschung bieten kann.
Protokoll
HINWEIS: Die in diesem Teil des Protokolls beschriebenen Arbeiten wurden im Kernreinraum der Klasse 100 des Vanderbilt Institute of Nanoscale Science and Engineering (VINSE) durchgeführt. Gewünscht ist ein kontrollierter Reinraum mit entsprechender Bekleidung und UV-gefilterter Beleuchtung, um Geräteschäden durch Feuchtigkeit/Umgebungslichtverhältnisse zu vermeiden und eine Kontamination durch Feinstaub zu verhindern. Alle Manipulationen an Siliziumwafern sollten mit der polierten Seite des Siliziumwafers nach oben durchgeführt werden. Verwenden Sie eine Pinzette, wenn Sie Wafer manipulieren, und minimieren Sie das Berühren von Oberflächen des Wafers, um Kratzer zu vermeiden. Bewahren Sie die Waffeln während des Transports und am Ende eines jeden Tages mit abgedeckten Deckeln in Petrischalen auf, sofern nicht anders angegeben.
1. Fotolithographie (6 - 8 h)
- Reinigen Sie einen 3-Zoll-Siliziumwafer 5 Minuten lang unter Vakuum (idealerweise Vakuumdruck < 5 × 10-5 Torr) mit Sauerstoff (O2) oder Clean Dry Air (CDA) Plasma.
- Zentrieren Sie den Siliziumwafer auf einem Spin-Coater, um den Fotolack abzuscheiden.
- Legen Sie ~1-2 mL SPR 220 7.0 Fotolack auf die Mitte des Siliziumwafers.
ACHTUNG: Fassen Sie Fotolack mit Handschuhen und Augenschutz an und entsorgen Sie ihn gemäß den hersteller-/standortspezifischen Protokollen. - Schleudern Sie den Fotolack auf dem Siliziumwafer auf die gewünschte Dicke basierend auf den Spinkurven des Herstellers. Erzeugen Sie ~13 μm dicke Schichten, indem Sie 30 s lang mit 1000 U/min drehen. Reinigen Sie später den restlichen Fotolack auf dem Spin Coater mit Aceton und entsorgen Sie ihn gemäß den standortspezifischen Protokollen.
HINWEIS: Wenn der Wafer nach dem Schleudern nicht gleichmäßig mit Fotolack beschichtet ist, wiederholen Sie die Schritte 1.2-1.4. Eine ungleichmäßige Beschichtung könnte darauf zurückzuführen sein, dass ein nicht zentrierter Wafer auf dem Spin-Coater zu wenig Fotolack verwendet und/oder der Fotolack nicht auf der Mitte des Wafers abgeschieden wird. - Während Sie so wenig wie möglich mit dem Fotolack auf dem Wafer in Berührung kommen, übertragen Sie den Siliziumwafer auf eine auf 70 °C eingestellte Heizplatte.
- Inkubieren Sie den Siliziumwafer auf der Heizplatte und erhöhen Sie die Temperatur alle 3-5 Minuten um 10 °C, bis die Temperatur 115 °C erreicht.
- Schalten Sie die Heizplatte aus und lassen Sie den Siliziumwafer abkühlen, bis seine Temperatur unter 65 °C liegt.
HINWEIS: Die Heiz- und Abkühlschritte werden langsam durchgeführt, um eine thermische Rissbildung des Fotolacks zu verhindern, die bei dieser Dicke üblich ist. Treten thermische Risse auf, können diese in der Regel durch erneutes Erhitzen des Siliziumwafers und Verlangsamung der Abkühlgeschwindigkeit behoben werden. - Übertragen Sie den abgekühlten Siliziumwafer mit einer Pinzette auf einen Masken-Aligner und laden Sie sowohl den Siliziumwafer als auch eine entsprechende Photomaske in den Masken-Aligner gemäß den hersteller-/standortspezifischen Protokollen.
HINWEIS: Fotomasken wurden von einem externen Anbieter unter Verwendung eines bestimmten Designs hergestellt, das mit AutoCAD erstellt wurde. Siehe Ergänzende Datei 1 für das Rendern des Maskendesigns. - Setzen Sie den Siliziumwafer für eine bestimmte Zeit (basierend auf der Leistung der UV-Lampe) ultravioletter (UV) Strahlung aus, wobei Sie den hersteller-/standortspezifischen Protokollen folgen. Die gewünschte Energie für diese Anwendung beträgt ~400 mJ/cm2 und berechnen Sie die Expositionszeit nach folgender Formel:
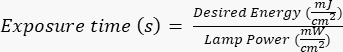 .
. - Entfernen Sie nach der Belichtung den Silikonwafer aus dem Masken-Aligner und lassen Sie den Fotolack 4 h lang durch Luftzirkulation rehydrieren. Stellen Sie sicher, dass der Deckel der Petrischale abgenommen ist, um die Luftzirkulation zu ermöglichen, aber stellen Sie die Schale an einem Ort auf, an dem es unwahrscheinlich ist, dass sie Partikeln ausgesetzt ist.
HINWEIS: Während dieser Rehydrationszeit kann eine 4-stündige Pause eingelegt werden, es wird jedoch empfohlen, den Eingriff am selben Tag fortzusetzen. - Nach der 4-stündigen Rehydrierung wird der belichtete Wafer auf eine auf 70 °C eingestellte Heizplatte umgefüllt.
- Inkubieren Sie den Siliziumwafer auf der Heizplatte und erhöhen Sie die Temperatur alle 3-5 Minuten um 10 °C, bis die Temperatur 115 °C erreicht.
- Lassen Sie den Wafer 10 min lang bei 115 °C inkubieren.
- Erstellen Sie eine isolierende "Abdeckung" für den freiliegenden Wafer, indem Sie ein Blatt Aluminiumfolie in Form eines Petrischale-Deckels formen.
- Schalten Sie die Heizplatte aus und decken Sie den freiliegenden Wafer mit der Aluminiumfolienabdeckung ab. Lassen Sie die Waffel über Nacht bei hellem Licht abkühlen.
HINWEIS: Thermische Risse des Fotolacks treten während des Inkubationsschritts nach der Belichtung viel häufiger auf, weshalb eine langsame Abkühlung über Nacht empfohlen wird. Damit sind die Schritte abgeschlossen, die für den ersten Tag der Fertigung erforderlich sind. Es wird empfohlen, am nächsten Tag mit dem nächsten Abschnitt fortzufahren.
2. Entwicklung (1 - 2 h)
- Wenn Sie bereit sind, den belichteten Wafer zu entwickeln, besorgen Sie sich einen sauberen Behälter und einen geeigneten Fotolackentwickler. Hier wird der MF-319-Entwickler mit einem dedizierten Container verwendet.
ACHTUNG: Fassen Sie den Entwickler mit Handschuhen und Augenschutz an, füllen Sie den Schüttgutbehälter in einen Zweitbehälter um und entsorgen Sie ihn gemäß den hersteller-/standortspezifischen Protokollen. - Gießen Sie so viel Entwickler in den Behälter, dass der freigelegte Wafer vollständig untergetaucht wird (das tatsächliche Volumen variiert je nach Behälter).
- Tauchen Sie den belichteten Wafer in den Entwickler und warten Sie, bis sich alle unerwünschten Fotolacke aufgelöst haben. Das sanfte Schwenken/Rühren des Behälters hilft bei der Entwicklung, bis nur noch wenige bis gar keine Reste von Fotolack auf dem Wafer sichtbar sind, abgesehen vom Bauelementdesign.
HINWEIS: Je nach Volumen der verwendeten Entwicklerlösung können mehrere Änderungen der Entwicklerlösung erforderlich sein, um den unerwünschten Fotolack vollständig zu entfernen. - Nehmen Sie den entwickelten Wafer aus der Entwicklungslösung und spülen Sie beide Seiten des Wafers vorsichtig 30 s lang vorsichtig mit deionisiertem (DI) Wasser ab.
- Trocknen Sie den entwickelten Wafer mit Stickstoff (N2)-Gas.
- Lagern Sie den entwickelten Wafer in einer Petrischale in einer trockenen, kühlen Umgebung, bis er für die weitere Verwendung bereit ist. Wickeln Sie die Petrischale in Aluminiumfolie ein, um eine Verschlechterung des Fotolacks durch Umgebungslicht zu verhindern.
HINWEIS: Es wird empfohlen, ist aber nicht erforderlich, am selben Tag mit dem nächsten Abschnitt fortzufahren.
3. Silanisierung (1 - 2 h)
- Übertragen Sie den Siliziumwafer in einen Exsikkator.
- Lege einen kleinen Aluminiumbehälter (oder ein Stück Alufolie, das in eine Behälterform gefaltet ist) in den Exsikkator.
- Pipettieren Sie 1 Tropfen (~50 μL) Trichlor(1H, 1H, 2H, 2H-Perfluoroctyl)-Silan in den Aluminiumbehälter.
ACHTUNG: Die Silanlösung mit Handschuhen und Augenschutz anfassen und gemäß den hersteller-/standortspezifischen Protokollen entsorgen. - Schließen Sie den Exsikkator und schalten Sie den Staubsauger ein.
- Lassen Sie die Austrocknung/Silanisierung 1-2 Stunden lang erfolgen.
- Schalten Sie nach Ablauf der Silanisierungszeit das Vakuum aus und holen Sie den silanisierten Wafer heraus. Lagern Sie den silanisierten Wafer in einer mit Aluminiumfolie umwickelten Petrischale in einer trockenen, kühlen Umgebung, bis er für die weitere Verwendung bereit ist.
HINWEIS: Die Silanisierung muss möglicherweise regelmäßig auf den Wafern und häufiger auf Geräten wiederholt werden, bei denen dünnere PDMS-Schichten verwendet werden. Wenn beim Entfernen des PDMS vom Wafer eine PDMS-Adhäsion festgestellt wird, muss der Wafer möglicherweise erneut silanisiert werden, und dieser Abschnitt sollte wiederholt werden, sobald alle PDMS vom Wafer entfernt wurden. Damit sind die Schritte abgeschlossen, die zum Erstellen von Mikrofluidik-Gerätemastern erforderlich sind. Die Master sind stabil und nachfolgende Abschnitte können auf Wunsch ausgeführt werden.
4. PDMS-Abscheidung (1 - 2 h)
HINWEIS: Wenn auf dem Master PDMS-Reste aus einer früheren Mikrofabrikation vorhanden sind, müssen die PDMS-Reste entfernt werden, bevor neue PDMS hinterlegt werden.
- Wiegen Sie auf einer Waage PDMS und das zugehörige Härter im Gewichtsverhältnis von 10:1 in einen Behälter. Das erforderliche Gesamtgewicht variiert je nach gewünschter PDMS-Dicke und Petrischalengröße. Bei einer 4" Petrischale ergeben ~20 g PDMS und ~2 g Härter eine Dicke von 2-3 mm.
ACHTUNG: Fassen Sie PDMS-Lösung mit Handschuhen und Augenschutz an und entsorgen Sie sie gemäß den hersteller-/standortspezifischen Protokollen. - Mischen Sie das PDMS und das Härter im Behälter für 5 Minuten mit einem Plastikspatel oder einem anderen geeigneten Werkzeug.
- Den gemischten PDMS-Behälter zur Entgasung in einen Exsikkator umfüllen.
- Schließen Sie den Exsikkator und schalten Sie den Staubsauger ein. Im PDMS erscheinen Luftblasen.
- Lassen Sie die Trocknung/Entgasung 30 Minuten lang erfolgen. Abhängig von der Menge des verwendeten PDMS und der Behälterform kann die tatsächliche Zeit variieren. Ein allgemeiner Endpunkt liegt vor, wenn wenige bis keine Blasen im PDMS vorhanden sind.
- Schalten Sie nach der Entgasung das Vakuum aus und nehmen Sie den PDMS-Behälter heraus.
- Gießen Sie das gemischte und entgaste PDMS in einer Petrischale auf den Master.
- Inkubieren Sie den Master über Nacht in der geschlossenen Petrischale bei 65 °C, damit PDMS vollständig aushärten kann.
HINWEIS: Damit sind die Schritte für die PDMS-Abscheidung abgeschlossen. Es wird empfohlen, das PDMS über Nacht in einem Inkubator aushärten zu lassen. Das PDMS ist dann stabil, so dass nachfolgende Abschnitte bei Bedarf ausgeführt werden können.
5. Montage des PDMS-Geräts (1 - 2 h)
- Entnehmen Sie den/die Gerätemaster, die das PDMS ausgehärtet haben, eine Pinzette, einen standardmäßigen 1,5-mm-Biopsiestempel mit einem manuellen Kolben und ein Skalpell/eine Rasierklinge.
ACHTUNG: Gehen Sie vorsichtig mit der Klinge um und schneiden Sie niemals in Richtung sich selbst oder andere. Es wird eine selbsteinrollende oder Sicherheitsklinge empfohlen. - Schneiden Sie um die Geräteelemente herum rechteckige PDMS-Stücke aus dem Layer-Master aus. Stellen Sie sicher, dass jedes PDMS-Stück auf jeder Seite etwas Platz hat und die Gerätefunktionen flankiert, um einen guten Klebekontakt zu ermöglichen und gleichzeitig sicherzustellen, dass jedes Stück auf sein eigenes 22 mm × 22 mm Glasdeckglas passt.
HINWEIS: Es ist wichtig, die Unterseite des PDMS (die Seite mit den Merkmalen) nicht zu berühren, also fassen Sie das PDMS immer mit einer Pinzette an den Kanten an. Platzieren Sie außerdem niemals die Feature-Seite des PDMS mit der Vorderseite nach unten auf einer Fläche. Bewahren Sie das PDMS bei Nichtgebrauch mit der Feature-Seite nach oben in einem geschlossenen Behälter auf, bis es benötigt wird. - Stanzen Sie Ein- und Auslasslöcher in die PDMS-Teile mit einem sauberen 1,5-mm-Locher. Stanzen Sie durch das PDMS des Geräts in eine Ersatzschicht aus Opfer-PDMS und nicht in eine harte Oberfläche, die den Locher beschädigen könnte.
- Nehmen Sie ein 22 mm × 22 mm Glasdeckglas heraus und reinigen Sie es mit einem mit Isopropylalkohol (IPA) benetzten Tuch.
- Plasma reinigen Sie das Deckglas 22 mm × 22 mm für 5 min unter Vakuum (Druck < 0,5 Torr) mit CDA-Plasma. Dadurch werden alle Ablagerungen oder organischen Beschichtungen auf dem Deckglas entfernt.
- Wischen Sie das 22 mm × 22 mm Glasdeckglas und die Feature-Seite des PDMS mit einem IPA-benetzten Tuch ab.
- Legen Sie sowohl das PDMS (mit der Merkmalsseite nach oben) als auch das Deckglas (die gleiche Seite nach oben, wie es zuvor gereinigt wurde) in den Plasmareiniger und reinigen Sie das Plasma gleichzeitig für 30 s unter Vakuum (Druck < 0,5 Torr) mit CDA-Plasma.
- Entfernen Sie sowohl das Glasdeckglas als auch das PDMS-Gerät aus dem Plasmareiniger. Drehen Sie das PDMS so um, dass die Feature-Seite nach unten zeigt, und platzieren Sie es auf dem Glasdeckglas. Beobachten Sie die Verklebung und drücken Sie bei Bedarf leicht auf das PDMS, um einen guten Kontakt zu ermöglichen.
- Inkubieren Sie das geklebte Deckglas in einer geschlossenen Petrischale bei 65 °C für 3 Minuten, um die Verklebung zu erleichtern.
HINWEIS: Durch die Plasmaverklebung wird die Hydrophobie des Glasdeckglases verändert, wodurch eine hydrophile Oberfläche entsteht. Es wurde durch anekdotische Beweise beobachtet, dass der ursprüngliche hydrophobe Zustand des Deckglases nach etwa 2 Tagen Inkubation bei Raumtemperatur zurückkehrt. Es wird empfohlen, vorgefertigte Geräte frühestens 2 Tage nach dem Plasmakleben zu verwenden. Damit sind die Schritte der Mikrofabrikation abgeschlossen. Die Geräte haben keine festgelegte Haltbarkeit, sollten aber bei Nichtgebrauch an einem kühlen, trockenen Ort gelagert werden.
6. Vorbereitung des mikrofluidischen Strömungskanals (1 h)
- Befestigen Sie eine zusammengebaute mikrofluidische Vorrichtung in einem sauberen kundenspezifischen Tischadapter47.
- Nehmen Sie eine Spritze, einen Lour-Lock-Adapter und eine passende Ferrule sowie ein Stück transparenten Schlauch mit einem Außendurchmesser von 1,5 mm (ca. 15-20 cm lang). Verbinden Sie den Schlauch über den Adapter mit der Spritze.
- Schließen Sie drei weitere Schlauchstücke an die Ausgänge des mikrofluidischen Geräts an (dieser Schlauch muss keine bestimmte Länge haben) und leiten Sie das andere Ende dieser Schläuche in ein nachgeschaltetes Abfallfläschchen.
- Bereiten Sie das mikrofluidische Gerät mit der Spritze vor, indem Sie Lösungen gemäß den folgenden Schritten einführen. Die Reihenfolge und das Volumen der Lösungen sind wie folgt: 50 μl BRB80-Pufferlösung, 25 μl Anti-Rhodamin-Antikörperlösung, 5 min warten, 50 μl BRB80, 25 μl Poloxamer 407 (F127), 15 min warten und 50 μl BRB80. Ein Beispiel finden Sie in Tabelle 1 .
- Ziehe die Lösung von ihrer Quelle in den Schlauch.
HINWEIS: Ziehen Sie die Lösung nicht ganz in die Spritze selbst. Die Lösung sollte nur im Schlauch verbleiben. - Drücken Sie den Spritzenkolben vorsichtig nach unten, bis sich am Ende des Schlauchs ein kleiner Flüssigkeitstropfen befindet. Dadurch wird verhindert, dass Luft in das mikrofluidische Gerät eindringt, wenn der Schlauch angebracht ist.
- Befestigen Sie den Schlauch am Einlass des mikrofluidischen Geräts.
- Drücken Sie den Spritzenkolben langsam nach unten, bis der meiste, aber nicht die gesamte Lösung durch den Schlauch geflossen ist. Wenn Sie eine kleine Menge Flüssigkeit im Schlauch belassen, wird sichergestellt, dass keine Luft versehentlich durch den Schlauch gedrückt wird. Beobachten Sie die Schläuche und mikrofluidischen Kanäle während dieser Transfers und suchen Sie nach Blasen.
HINWEIS: Wenn Blasen in den Schläuchen auftreten, beginnen Sie mit der Fehlerbehebung (versuchen Sie, die Blase zu entfernen, bevor sie in das mikrofluidische Gerät gelangt, indem Sie den Schlauch kurz vor dem Eintreffen der Blase abziehen und den Schlauch wieder anbringen, nachdem die Blase passiert ist usw.). - Wiederholen Sie die Schritte 6.4.1 bis 6.4.4 für das nächste Reagenz, bis alle Reagenzien durchlaufen wurden. Für jedes Reagenz wird ein neues Stück Einlassschlauch benötigt, um eine Kreuzkontamination der Quellreagenzien zu verhindern. Sobald die letzte BRB80-Wäsche abgeschlossen ist, ist das Gerät für mehrere Minuten stabil. Ein Tropfen BRB80-Lösung auf die Einlässe verhindert das Austrocknen des Geräts.
- Ziehe die Lösung von ihrer Quelle in den Schlauch.
- Guanosin-5'-[(α,β)-Methyleno]triphosphat (GMPCPP)-stabilisierte Mikrotubuli-"Samen" gemäß Standardprotokollen (mit einem TTR-Markierungsverhältnis von ~25%)47,48 herstellen.
- Bereiten Sie eine bildgebende Pufferlösung ("Antifade") mit einer 2-fachen Arbeitskonzentration her, indem Sie die folgenden Reagenzien in den jeweiligen Mengen (abhängig von den Stammkonzentrationen) kombinieren, um die angegebenen Endkonzentrationen zu erhalten: BRB80 ergänzt mit 40 mM Glukose, 40 μg/ml Glukoseoxidase, 16 μg/ml Katalase, 0,5 mg/ml Kasein, 50 mM Kaliumchlorid und 10 mM Dithiothreitol (DTT). Dieser Bildgebungspuffer wird verwendet, um die Photostabilität zu verlängern. Ein Beispiel finden Sie in Tabelle 2 .
- Verdünnen Sie einen Teil der 2x Antifade-Lösung 1:1 in BRB80, um eine 1x Arbeitslösung aus Antifade zu erhalten. Erwärmen Sie dieses Antifaden auf Raumtemperatur (RT); Die Antifading-Lösung sollte auf Eis aufbewahrt werden.
| Bestellung | Reagenzien | Volumen-Verdünnung | Waschvolumen | Inkubationszeit |
| 1 | BRB80 | N/A | 50 μL | N/A |
| 2 | Anti-Rhodamin-Antikörper | 1:50 in BRB80, gut mischen | ca. 25 μl | 5 Minuten |
| 3 | BRB80 | N/A | 50 μL | N/A |
| 4 | Poloxamer 407 (F127) | 1% in BRB80 | ca. 25 μl | 15 Minuten |
| 5 | BRB80 | N/A | 50 μL | N/A |
Tabelle 1: Reihenfolge der Vorbereitung der Kanäle für mikrofluidische Geräte.
| Volumen | Reagenz | Bestandskonzentration | Endkonzentration |
| 16 μL | D-Glukose | ca. 2 m | 80 mM |
| 16 μL | Glukose-Oxidase | 2 mg/ml | 80 μg/mL |
| 16 μL | Katalase | 0,8 mg/ml | 32 μg/ml |
| 14 μL | Casein | 28 mg/ml | 0,16 mg/ml |
| 8 μL | DVB-T | 1 Mio. | ca. 20 mM |
| 40 μL | Kaliumchlorid | 1 Mio. | ca. 100 mM |
| 290 μL | BRB80 | 1x | N/A |
| 400 μL | FINAL (2x Arbeitskonzentration) |
Tabelle 2: Rezeptur der Antifading-Bildgebungslösung (2x-Konzentration).
7.Einführung von Mikrotubuli-Seeds in die Mikrofluidik (10 - 15 min)
- Verbinden Sie das mikrofluidische Gerät mit dem Mikroskop.
HINWEIS: Da die Stabilität der Mikrotubuli temperaturabhängig ist, wird empfohlen, die bildgebenden Experimente bei 35 °C durchzuführen. - Befestigen Sie 10-15 cm neuen Schlauch an der Spritze und ziehen Sie eine gewünschte Verdünnung von GMPCPP-stabilisierten Mikrotubuli-Seeds in den Schlauch.
HINWEIS: Für dieses Gerät waren ~10 nM GMPCPP-Mikrotubuli-Seeds die optimale Konzentration. - Drücken Sie den Spritzenkolben vorsichtig nach unten, bis sich am Ende des Schlauchs ein kleiner Flüssigkeitstropfen befindet. Dadurch wird verhindert, dass Luft in das mikrofluidische Gerät eindringt, wenn der Schlauch angebracht ist.
- Befestigen Sie den Schlauch am Einlass des mikrofluidischen Geräts.
- Drücken Sie den Spritzenkolben langsam nach unten, bis der meiste, aber nicht die gesamte Lösung durch den Schlauch geflossen ist. Wenn Sie eine kleine Menge Flüssigkeit im Schlauch belassen, wird sichergestellt, dass keine Luft versehentlich durch den Schlauch gedrückt wird.
- Lösen Sie den Einlassschlauch von der mikrofluidischen Vorrichtung und der Spritze und befestigen Sie ein neues Schlauchstück an der Spritze.
- Ziehen Sie BRB80 in den Schlauch.
- Wiederholen Sie die Schritte 7.3-7.6, um ungebundene Mikrotubuli-Seeds aus dem Gerät auszuwaschen.
- Beobachten Sie die Anhaftung von Seeds an der mikrofluidischen Oberfläche mit Hilfe der Totalreflexionsfluoreszenzmikroskopie (TIRF). Die ideale Anzahl von Seeds in einem einzigen Sichtfeld variiert je nach Anwendung und Größe des Sichtfelds, aber im Allgemeinen sind ~10-20 Seeds pro 80 μm × 80 μm Sichtfeld optimal. Die Schritte 7.2-7.9 nach Bedarf wiederholen, bis die gewünschte Saatgutdichte erreicht ist.
HINWEIS: Zur Überwachung der Keimdichte der Mikrotubuli sollte eine intermittierende Kurzlichtbelichtung (100 ms) verwendet werden, da in der Lösung noch kein Antifade vorhanden ist. - Sobald die entsprechende gebundene Samendichte erreicht ist, befestigen Sie ein neues Stück Einlaufschlauch an der Spritze.
- Ziehen Sie warme 1x Antifading-Lösung in den Schlauch und wiederholen Sie die Schritte 7.3-7.6.
HINWEIS: Mit der Antifading-Lösung, die sich jetzt im Gerät befindet, wird die Photostabilität erheblich verbessert und das Gerät ist stabil. Es wird jedoch weiterhin empfohlen, die Exposition gegenüber Laserlicht zu minimieren.
8. Züchten von Mikrotubuli-Erweiterungen aus Samen (15 - 30 min)
- Kombinieren Sie fluoreszenzmarkiertes Tubulin, unmarkiertes Tubulin, 2x Antifading-Lösung, Guanosin-5'-triphosphat (GTP) und BRB80, um eine endgültige Lösung zu erhalten, die 14 μM Tubulin bei einem Fluoreszenzmarkierungsverhältnis von 7 %, Antifading bei einer 1x Arbeitskonzentration und 1 mM GTP enthält.
HINWEIS: Wenn unterschiedliche Konzentrationen oder unterschiedliche Markierungsprozentsätze von Tubulin verwendet werden, muss das Volumen jedes Reagenzes angepasst werden, um die gewünschte Endkonzentration und das gewünschte Markierungsverhältnis zu erreichen. Halten Sie die Tubulinlösung bis ~30 s vor der Einführung auf Eis, nehmen Sie dann die Lösung vom Eis und erwärmen Sie sie in der Hand auf RT. Dies wird bei der Polymerisation von Mikrotubuli-Fortsätzen helfen, was ein temperaturabhängiger Prozess ist. In der Tat sollte die Mikrotubuli-Polymerisation bei 35 °C durchgeführt werden, während alle anderen experimentellen Schritte bei RT durchgeführt werden können. - Befestigen Sie 10-15 cm neuen Schlauch an der Spritze und ziehen Sie Tubulinlösung in den Schlauch.
- Drücken Sie den Spritzenkolben vorsichtig nach unten, bis sich am Ende des Schlauchs ein kleiner Flüssigkeitstropfen befindet. Dadurch wird verhindert, dass Luft in das mikrofluidische Gerät eindringt, wenn der Schlauch angebracht ist.
- Befestigen Sie den Schlauch am Einlass des mikrofluidischen Geräts.
- Drücken Sie den Spritzenkolben langsam nach unten, bis der meiste, aber nicht die gesamte Lösung durch den Schlauch geflossen ist. Wenn Sie eine kleine Menge Flüssigkeit im Schlauch belassen, wird sichergestellt, dass keine Luft versehentlich durch den Schlauch gedrückt wird. Lösen Sie den Einlassschlauch vom mikrofluidischen Gerät.
- Bild mit der gewünschten Frequenz für 10-15 Minuten oder bis die Extensions lang genug sind, um sich zu biegen. Typischerweise wird die Bildgebung bei 488 nm alle 5 s und 561 nm alle 60 s durchgeführt, bis die Erweiterungen mindestens 5-10 μm lang sind (~15 min).
HINWEIS: Bei dieser Tubulinkonzentration können die Mikrotubuli stochastisch zwischen Polymerisations- und Depolymerisationsperioden wechseln; Dies ist zu erwarten, aber insgesamt werden sich die Mikrotubuli-Fortsätzeum 49 verlängern.
9. Stabilisierung der Mikrotubuli-Erweiterungen (10-15 min)
- Kombinieren Sie Taxol, 2x Antifade-Lösung und BRB80, um eine endgültige Lösung zu erhalten, die 10 μM Taxol und Antifade bei einer 1-fachen Arbeitskonzentration enthält.
HINWEIS: Halten Sie die Taxollösung bis ~30 s vor der Einführung auf Eis, nehmen Sie dann die Lösung vom Eis und erwärmen Sie sie in der Hand auf RT. Dadurch wird die Depolymerisation von Mikrotubuli-Erweiterungen verhindert, die ein temperaturabhängiger Prozess ist. - Befestigen Sie 10-15 cm neuen Schlauch an der Spritze und ziehen Sie Taxollösung in den Schlauch.
- Drücken Sie den Spritzenkolben vorsichtig nach unten, bis sich am Ende des Schlauchs ein kleiner Flüssigkeitstropfen befindet. Dadurch wird verhindert, dass Luft in das mikrofluidische Gerät eindringt, wenn der Schlauch angebracht ist.
- Befestigen Sie den Schlauch am Einlass des mikrofluidischen Geräts.
- Drücken Sie den Spritzenkolben nach unten, bis der Großteil, aber nicht die gesamte Lösung durch den Schlauch geflossen ist. Wenn Sie eine kleine Menge Flüssigkeit im Schlauch belassen, wird sichergestellt, dass keine Luft versehentlich durch den Schlauch gedrückt wird.
- Wiederholen Sie die Schritte 9.2-9.5 zweimal kurz hintereinander. In diesem Fall kann das gleiche Stück Schlauch verwendet werden.
HINWEIS: Taxol fördert die De-novo-Keimbildung von Mikrotubuli aus Tubulin in Lösung, und diese Mikrotubuli können auf der Oberfläche des mikrofluidischen Kanals landen und die nachfolgende Bildgebung/Biegung beeinträchtigen. Aus diesem Grund sollte die Taxollösung schnell und in mehreren Iterationen durch das Gerät fließen, um so viel freies Tubulin wie möglich so schnell wie möglich aus dem Gerät zu entfernen. - Vergewissern Sie sich, dass die aus Samen gezüchteten Mikrotubuli noch im Gerät vorhanden und stabilisiert sind.
10. Biegestabilisierte Mikrotubuli-Verlängerungen (10 - 15 min)
HINWEIS: Stabilisierte Mikrotubuli-Verlängerungen können jetzt mit einem Durchflussregler gebogen werden. Hier wurde ein geregeltes Überdruckverdrängersystem (Elveflow OB1 MK3+) verwendet, um die Lösung aus einem luftdichten Quellfläschchen durch ein Durchflussmessgerät in den Mikrofluidiker zu fließen. Abhängig von den Besonderheiten der verfügbaren Flow-Controller-Einrichtung können Änderungen an den folgenden Schritten vorgenommen werden.
- Richten Sie den Durchflussregler und die zugehörige Ausrüstung gemäß hersteller-/standortspezifischen Protokollen ein, indem Sie Schläuche verwenden, um das Quellfläschchen mit dem Einlass des Durchflussmessers und den Auslass des Durchflussmessers mit dem mikrofluidischen Einlass zu verbinden, aber befestigen Sie die Schläuche noch nicht am mikrofluidischen Gerät.
- Geben Sie ~200 μl der 10 μM Taxollösung in ein Quellfläschchen, das an das Flow-Controller-Setup angeschlossen werden kann. Bei diesem Setup werden Luer-Lock-Verbindungen verwendet, um eine luftdichte Abdichtung zu erzielen.
- Schalten Sie das Durchflusskontrollsystem ein und entleeren Sie den Schlauch, um Luft zu entfernen. Dadurch wird verhindert, dass Luft in das mikrofluidische Gerät eindringt, wenn der Schlauch angebracht ist.
- Nachdem der Schlauch durch den Durchflussmesser geführt wurde und sich ein kleiner Flüssigkeitstropfen am Ende des Schlauchs befindet, schalten Sie das Durchflusskontrollsystem aus.
- Verbinden Sie den Schlauch mit dem Einlass des mikrofluidischen Geräts. Verwenden Sie einen Einlass senkrecht zu dem Einlass, der zum Einbringen der Mikrotubuli-Samen verwendet wurde, und züchten Sie die Mikrotubuli-Verlängerungen, um sie orthogonal zu biegen.
- Biegen Sie Verlängerungen, indem Sie den Durchfluss mit der gewünschten Durchflussmenge oder dem gewünschten Druck starten und stoppen. Ein Druck von 30 mbar ist der Standard für dieses Protokoll bei Verwendung einer 5 s periodischen oszillatorischen Strömung. Stellen Sie sich die Biegung während dieser Zeit vor, typischerweise alle 0,1 s bei 488 nm und alle 10 s bei 561 nm.
HINWEIS: Damit ist der grundlegende Mikrotubuli-Biege-Assay abgeschlossen. Alle Geräte und Reagenzien können gemäß hersteller-/standortspezifischen Protokollen gereinigt/entsorgt werden.
Ergebnisse
Begründung für das Design mikrofluidischer Geräte
Das Design des mikrofluidischen Geräts in dieser Studie wurde von mehreren Schlüsselmerkmalen geleitet (Abbildung 2), die auf dem traditionellen einfachen Durchflusszellendesign aufbauen und es verbessern. Bemerkenswert ist, dass die mikrofluidische Vorrichtung ein internes Volumen von ~160 nL aufweist, das deutlich kleiner ist als das ~10 μl Volumen herkömmlicher Durchflusszellen47, was eine kontrolliertere Verwendung von potenziell wertvollen Reagenzien, wie z. B. gereinigten Proteinkomponenten, ermöglicht. Da der mikrofluidische Durchflussregler zwei Regelkanäle enthält, wurde das Gerät unter der Annahme entwickelt, dass zu einem bestimmten Zeitpunkt nur zwei Einlass-/Auslassöffnungen über eine Druckregelung verfügen. Auf Wunsch können weitere druckgesteuerte Kanäle implementiert werden.
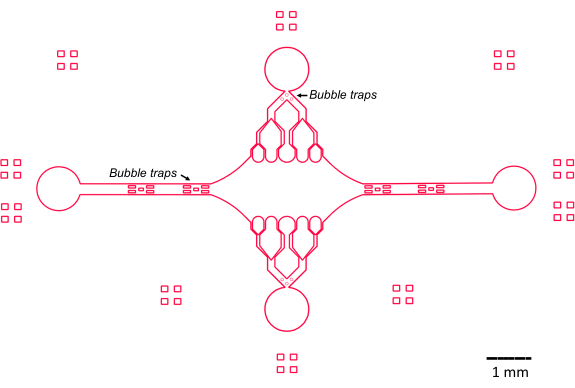
Abbildung 2: Schematische Darstellung des mikrofluidischen Gerätedesigns. Rechteckige Markierungen an der Peripherie dienen der visuellen Hilfe, um die Peripherie der Kanäle zu erkennen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die zentrale, rechteckige Gerätekammer dient als Hauptbildgebungsbereich, an dem Mikrotubuli-Seeds befestigt werden und Mikrotubuli-Fortsätze von diesen Seeds polymerisiert werden. Die Kammer wird auf jeder Seite von einem Strömungskanal durchschnitten, wobei gerade Kanäle entlang der x-Achse als Ein- und Auslass dienen, um einen schnellen Austausch der Reaktionslösung zu ermöglichen. Der Mikrotubuli-Einlasskanal wird auch verwendet, um Mikrotubuli-Seeds in die Kammer einzuführen, wobei die laminare Strömung dazu führt, dass sich der Seed entlang der Strömungsrichtung an die Glasoberfläche bindet. In senkrechter Richtung (y-Achse) verzweigen sich die Strömungskanäle in kleinere Kanäle zur Kammer hin, ähnlich wie bei einigen der bisherigen Bauformen 25,28,36,39. Die Verzweigungsgeometrie eignet sich besonders gut, um die mechanischen Eigenschaften von Mikrotubuli zu untersuchen. Das Einströmen einer Lösung in die zentrale Kammer aus einer Richtung, die senkrecht zur Ausrichtung der Mikrotubuli-Seeds verläuft, ermöglicht strömungsinduzierte Biegekräfte in nahezu normalen Winkeln. Des Weiteren ermöglicht die Einbeziehung einer Verzweigungsgeometrie mit vielen kleineren Strömungskanälen eine homogenere Krafteinleitung über einen weiten Bereich der zentralen Kammer, die durch eine einfache einkanalige Strömungsgeometrie nicht erreicht wird. Auf diese Weise kann das Verzweigungsmotiv, obwohl es scheinbar komplizierter ist, die Gesamtkomplexität bei der Bestimmung der Kraft reduzieren, die auf Mikrotubuli ausgeübt wird (Abbildung 3). Dieses Design zeichnet sich auch durch mehrere Symmetrielinien aus, was eine einfache Handhabung und die Möglichkeit bietet, die Biegung aus mehreren Richtungen (z. B. oben vs. unten) zu bewerten.
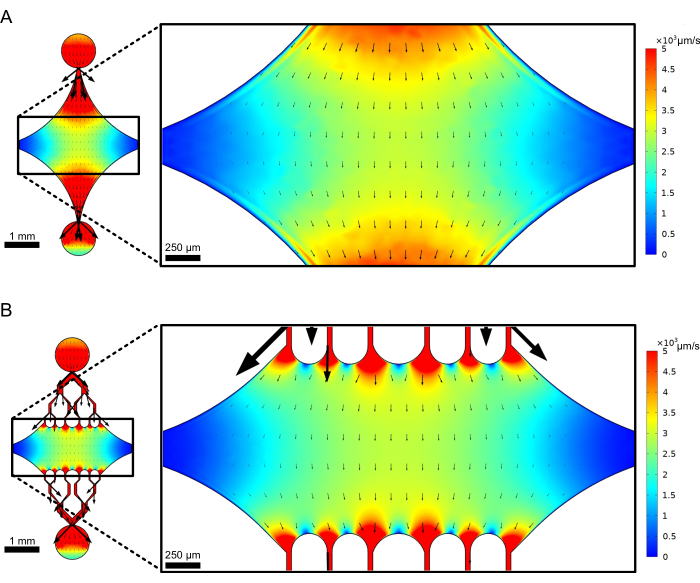
Abbildung 3: Durch die Einbeziehung eines Verzweigungsmotivs ergibt sich eine große Fläche mit ähnlicher Strömung. Simulationen von zwei Bauelementdesigns unter stationärer Strömung: eines ohne verzweigte Kanäle (A) und eines mit verzweigten Kanälen (B). Pfeile geben die lokale Strömungsrichtung an und sind proportional zur Durchflussgröße. Die Oberflächenfärbung bezeichnet die Geschwindigkeit der Mittellinie. Die Bilder auf der rechten Seite zeigen einen vergrößerten Abschnitt des Geräts, in dem Mikrotubuli (nicht gezeigt), die entlang der x-Achse ausgerichtet sind, Biegekräften von einer Flüssigkeit ausgesetzt sind, die in die obere Öffnung hinein und aus der unteren Öffnung fließt. Durch den Einbau von Verzweigungskanälen wird die relative Fläche vergrößert, die ähnlichen Geschwindigkeitsfeldern ausgesetzt ist, ohne das erforderliche Reagenzvolumen zu erhöhen. Diese Abbildung wurde mit Genehmigung von Rogers (2022)14 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Insbesondere implementiert das Gerät auch eine Reihe von Blasenfallen in den Einlass- und Auslassströmungskanälen, um zu verhindern, dass Luftblasen in die zentrale Bildgebungskammer gelangen. Insbesondere haben wir uns dafür entschieden, Arrays von Mikrosäulen in den Strömungsweg einzubauen, um zu verhindern, dass Luftblasen aufgrund der Oberflächenspannung vorbeiwandern (Abbildung 2)46. Um Lufteinschlüsse zu verhindern, haben wir die Kanten im Inneren des Geräts als glatte Kurven gestaltet, im Gegensatz zu schrägen Winkeln. Zusammengenommen verringern diese Konstruktionsmerkmale die Möglichkeit von Luftblasen und erhöhen die Robustheit des Geräts.
Herstellung von mikrofluidischen Geräten
Die Bestimmung der richtigen Parameter für die Erstellung des Gerätemasters erforderte einige Optimierungen. Wie bereits beobachtet, reagiert dieser Fotolack sehr empfindlich auf wichtige Betriebsparameter wie die Umgebungsbeleuchtung und die Heiz- und Abkühlungsraten während der Photolithographieschritte50. Wurde der Master zum Beispiel nach dem Erhitzen zu schnell abgekühlt, könnten thermische Risse im Fotolack entstehen. Dies ist unerwünscht, da die Risse die Integrität des Kanals beeinträchtigen können. Während Risse durch erneutes Erhitzen des Lacks auf eine Temperatur in der Nähe seiner Sprungtemperatur (~115 °C) behoben werden konnten, stellten wir fest, dass das Abkühlen des Masters auf der Heizplatte die robusteste Methode war, um Risse zu verhindern. Darüber hinaus kann übermäßiges Umgebungslicht zu einer unbeabsichtigten Belichtung des Fotolacks führen, wodurch der Lack geschwächt wird und die Bauteilmerkmale selbst (die nach der Entwicklung auf dem Wafer verbleiben sollten) während des Entwicklungsschritts teilweise entfernt werden. Aus diesem Grund empfehlen wir, den Entwicklungsschritt am Tag nach dem Backen nach der Exposition durchzuführen und über Nacht bei Umgebungstemperatur zu kühlen. Wenn der Gerätemaster nicht verwendet wird, empfehlen wir außerdem, ihn an einem dunklen Ort aufzubewahren oder in Aluminiumfolie einzuwickeln, um eine Verschlechterung im Laufe der Zeit zu vermeiden. Sobald diese Parameter bestimmt waren, war der Photolithographie-Prozess sehr wiederholbar (Abbildung 4).
Nachdem der Master erstellt wurde, wurde flüssiges PDMS auf den Master gegossen, sodass das PDMS aushärten und einen negativen Abdruck der Merkmale des Masters erzeugen konnte. Wir stellten fest, dass das Gießen des PDMS in einer Dicke von 2-3 mm eine einfache Manipulation der Geräte ermöglichte. Im Gegensatz dazu neigte das PDMS bei einer Spin-Beschichtung, um eine Dicke im μm-Bereich zu erreichen, zum Reißen oder Selbstkleben, was die Manipulation erschwerte. Darüber hinaus ermöglicht eine dickere PDMS-Schicht ein einfacheres Einstecken der Schläuche, da die Schläuche in den Einlass-/Auslassöffnungen verbleiben, ohne dass ein Dichtmittel oder eine Klemme erforderlich ist.
Während bei herkömmlichen Durchflusszellen-Assays für diese biologischen Anwendungen häufig Glasdeckgläser verwendet werden, die mit einer Piranha-Lösung (Wasserstoffperoxid und Schwefelsäure) vorgereinigt und dann silanisiert wurden, stellten wir fest, dass Deckgläser, die mit einer erweiterten Plasmareinigung und IPA-Waschung behandelt wurden, für unsere Zwecke geeignet waren47. Andere Anwendungen, wie z. B. die Einzelmolekül-Bildgebung, erfordern möglicherweise eine umfangreichere Behandlung von Deckglas.

Abbildung 4: Photolithographie-Prozess. (A) Die Maske mit dem gewünschten Design (Maske aus Chrom auf Glas geätzt). (B) Leichte Rissbildung des Fotolacks auf dem Siliziumwafer aufgrund thermischer Belastung (Pfeile markieren einige Risse). Diese Risse erstrecken sich oft über den gesamten Wafer. (C) Der entwickelte Master. (D) Der mikrofluidische Aufbau am Mikroskop. Einzelne Komponenten sind grün gekennzeichnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Wachstum, Stabilisierung und Biegung von Mikrotubuli
GMPCPP-gezüchtete Mikrotubuli-Samen dienen als Keimbildungsstellen für Mikrotubuli-Fortsätze zur Polymerisation und sind selbst mehrere Stunden bei Raumtemperatur gegen Depolymerisation stabil. Die Samen wurden mit einem Anti-Rhodamin-Antikörper47 an das Glasdeckglas im mikrofluidischen Kanal gebunden. Dynamische Mikrotubuli-Fortsätze wurden dann in Gegenwart von löslichem Tubulin (fluoreszenzmarkiert, aber nicht Rhodamin-konjugiert) und GTP gezüchtet. Auf diese Weise wurden die Keimbildungsstellen an dem Glasdeckglas befestigt, die Verlängerungen jedoch nicht. Während der 15-minütigen Wachstumsphase der Extension polymerisierten und depolymerisierten die Mikrotubuli-Fortsätze stochastisch, wie aufgrund ihrer intrinsischen dynamischen Instabilität zu erwarten war49. Im Anschluss an diese Wachstumsphase wurde eine 10 μM Taxol-Auswaschung durchgeführt, um das verbleibende Tubulin aus der Lösung zu entfernen und die gebildeten Mikrotubuli-Fortsätze zu stabilisieren. Die Stabilisierung ist entscheidend, da die Mikrotubuli-Fortsätze sonst bei Tubulin-Degeneration depolymerisieren würden. Zusätzlich zur Bindung und Stabilisierung des Mikrotubuli-Polymers wurde auch gezeigt, dass Taxol die Mikrotubuli-Polymermechanik beeinflusst und eine Krümmung in den ansonsten linearen Mikrotubuli-Fortsätzen induzierenkann 51,52,53,54. Die hier gezeigten Ergebnisse spiegeln diese Beobachtungen wider; Die Krümmung der Mikrotubuli-Fortsätze ist jedoch unerwünscht, da dadurch beim Biegen ungleichmäßige Kräfte entlang des Gitters aufgebracht werden. Daher wurden nur Mikrotubuli für die Biegeanalyse verwendet, die nach der Stabilisierung relativ gerade blieben. Alternativ kann nach der anfänglichen Wachstumsperiode eine sekundäre Wachstumsperiode mit einer Lösung aus Tubulin und GMPCPP (im Gegensatz zum anfänglichen GTP) verwendet werden, um stabile "Kappen" an den wachsenden Enden des Mikrotubuli-Gitters zu erzeugen und eine Depolymerisationzu verhindern 55.
Die Mikrotubuli wurden dann durch Einströmen der Pufferlösung unter Verwendung des Druckregelsystems gebogen, um einen konstanten Vordruck aufrechtzuerhalten (Abbildung 5, Ergänzendes Video 1). Auf diese Weise konnten wir die lokale Strömung der Mikrotubuli approximieren. Durch das Einströmen der Flüssigkeit von oben und aus dem unteren Geräteanschluss sollte die Ausrichtung der Strömung senkrecht zur Ausrichtung der Aussaat erfolgen.
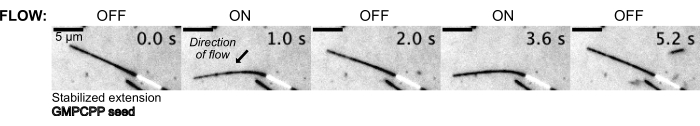
Abbildung 5: Der mikrofluidische Aufbau kann verwendet werden, um stabilisierte Mikrotubuli zu biegen. Mikrotubuli im Ruhezustand nach Stabilisierung mit Paclitaxel werden während der pulsierenden Strömung gebogen. Ein konstanter Anströmdruck von 30 mbar treibt die Strömung an (Pfeil zeigt die Strömungsrichtung an). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Bestimmung des Strömungsprofils im mikrofluidischen Gerät
Die Mittelliniengeschwindigkeit in der Mikrofluidik kann mit der COMSOL-Software rechnerisch simuliert werden (Simulationssoftware, Abbildung 6A). Die Mikrotubuli sind jedoch für die TIRF-Mikroskopie innerhalb von ~100 nm über der Oberfläche an dem Glasdeckglas befestigt. Daher ist die Geschwindigkeit, die der Mikrotubuli erfährt, nicht die gleiche wie in der 2D-Simulation vorhergesagt. Um die lokale Strömung der Mikrotubuli zu approximieren, haben wir die allgemeine Navier-Stokes-Gleichung für eine inkompressible Fluidströmung in einer Dimension verwendet:
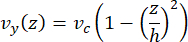
Dabei ist z die Höhe der Mikrotubuli im Gerät, h ist die Gesamthöhe des Geräts und vc ist die Mittelliniengeschwindigkeit im Gerät. Per Definition des Systems ist der Z-Ursprung das Zentrum des Geräts (Abbildung 6B). Unter Verwendung dieser Definition und einer Kanalhöhe von 13 μm wird die Höhe der Mikrotubuli als z = -6,4 μm approximiert. Die Lösung dieser Gleichung ergibt eine Schätzung der lokalen Fluidgeschwindigkeit, die die Mikrotubuli erfahren:

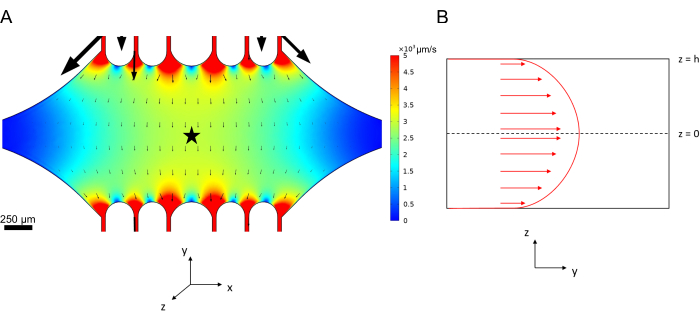
Abbildung 6: Definition des Systems für die Analyse der Strömung von Flüssigkeit, die an der oberen Öffnung in das Gerät eintritt und an der unteren Öffnung austritt (Anschlüsse nicht dargestellt). (A) Simulation des skalierten Geschwindigkeitsfeldes der Mittellinie wie in Abbildung 3B. Der Stern kennzeichnet den Interessenbereich für Feld B. (B) Querschnittsdarstellung des Geräts. Das voll entwickelte Strömungsprofil des Fluids befindet sich in y-Richtung mit einer Mittelliniengeschwindigkeit vc bei z = 0 und einer rutschfesten Randbedingung an den Wänden. Beachten Sie, dass die Pfeile in diesem Bereich nicht in Bezug auf das tatsächliche Geschwindigkeitsfeld skaliert werden sollen, das in Feld A angezeigt wird. Diese Abbildung wurde mit Genehmigung von Rogers (2022)14 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Über Simulationen hinaus kann die Strömungsgeschwindigkeit mit einem Durchflussregler gesteuert werden, der auf einer volumetrischen Durchflussrate basiert, anstatt den Druck aufrecht zu erhalten. Darüber hinaus kann die lokale Durchflussrate in jedem Gerät direkt bestimmt werden, indem fluoreszierende Kügelchen einbezogen und deren Geschwindigkeit überwacht werden, wodurch die Variabilität von Probe zu Probe verringert wird.
Computergestützte Modellierung und Gradientendemonstrationen
Schließlich führten wir computergestützte Simulationen in Kombination mit Experimenten durch, um die Machbarkeit des Einsatzes dieses Geräts für Hochdurchsatzexperimente zu demonstrieren. Neben der Fähigkeit, Mikrotubuli dank der Symmetrie des Geräts in mehrere Richtungen zu biegen, zeigten die Simulationen, dass das Gerät präzise Gradienten beibehalten kann, was die gleichzeitige Untersuchung mehrerer experimenteller Bedingungen ermöglicht (Abbildung 7A). Vorläufige Experimente (Methoden, die in dieser Veröffentlichung nicht explizit genannt werden) mit Fluoreszenzfarbstoff in Lösung zeigten Konsistenz mit den rechnerischen Vorhersagen (Abbildung 7B). Darüber hinaus konnten wir erfolgreich die Partitionierung verschiedener Proteine in verschiedenen Bereichen des Geräts demonstrieren, indem wir gleichzeitig Mikrotubuli-Erweiterungen mit unterschiedlichen Fluoreszenzmarkierungen züchteten (Abbildung 8). Unseres Wissens ist dies die erste Anwendung der Hochdurchsatz-Mikrofluidik auf Mikrotubuli-Untersuchungen. Diese Eigenschaft dieses Geräts kann genutzt werden, um den Zeitaufwand und die Menge der benötigten Reagenzien zu reduzieren und gleichzeitig die experimentelle Robustheit zu verbessern. So können beispielsweise die Auswirkungen verschiedener Proteine oder unterschiedlicher Konzentrationen einzelner Proteine auf die Mechanik und Dynamik von Mikrotubuli gleichzeitig in einem einzigen Gerät gleichzeitig untersucht werden.
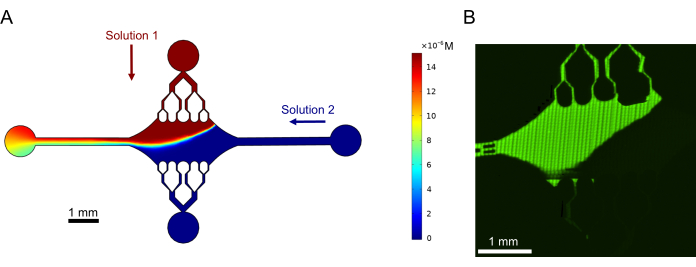
Abbildung 7: Gradientenbildung. (A) Simulation eines Gradienten von zwei Lösungen, die mit dem gleichen Eingangsdruck (50 mbar) und der gleichen Konzentration (15 μM) in das Gerät eintreten. Die Einlassanschlüsse für jede Lösung sind mit farbigen Pfeilen gekennzeichnet (eine Lösung im oberen Anschluss und eine andere Lösung im rechten Anschluss), und die beiden verbleibenden Anschlüsse dienen als Ausgänge. Die Heatmap zeigt das Konzentrationsprofil der Top-Lösung. Der stationäre Zustand wurde bei t = 5 s erreicht. (B) Experimentelle Erzeugung eines ähnlichen Gradienten unter Verwendung von Fluoreszenzfarbstoff in Lösung im oberen Port und Puffer im rechten Port. Das Bild ist eine Rasterschicht, die erstellt wird, indem jedes Sichtfeld (80 μm × 80 μm) zusammengefügt wird, um den gesamten Gerätebereich aufzulösen. Diese Abbildung wurde mit Genehmigung von Rogers (2022)14 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
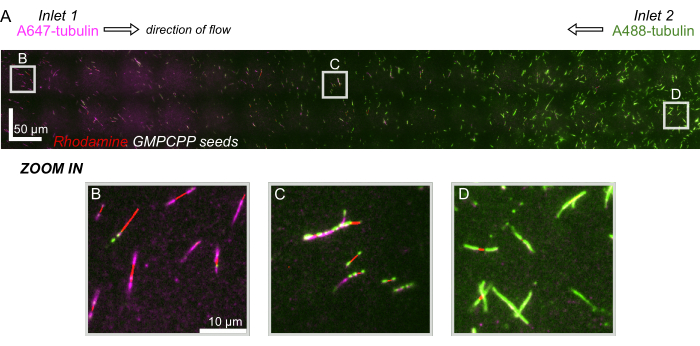
Abbildung 8: Demonstration eines Proteingradienten in der mikrofluidischen Vorrichtung. AlexaFluor647-markiertes Tubulin (magenta) wurde in Einlass 1 geflogen, und AlexaFluor488-markiertes Tubulin (grün) wurde in Einlass 2 des Geräts mit gleichen Konzentrationen und Durchflussraten geflogen. Die Strömung wurde in 90-s-Schritten ein- und ausgeschaltet, um eine Tubulinpolymerisation von stabilisierten GMPCPP-Seeds (rot) zu ermöglichen und gleichzeitig das Mischen zu hemmen. (A) Großflächige Rasterschicht, die durch Zusammenfügen von Sichtfeldern (80 x 80 μm) erstellt wird, um die gesamte Länge des Geräts aufzulösen. Buchstaben bezeichnen die relative Position einzelner Sichtfelder in den nachfolgenden Fenstern. Die Maßstabsleiste beträgt 50 μm in X- und Y-Position. (B) Sichtfeld in der Nähe des Einlasses 1 der Vorrichtung, wobei die Erweiterungen überwiegend aus A647-markiertem Tubulin bestehen. (C) Sichtfeld in der Nähe der Mitte des Geräts, wobei die Fortsätze wie vorhergesagt aus einer Mischung von markierten Tubulinen bestehen. (D) Sichtfeld in der Nähe der Unterseite des Geräts, wobei die Erweiterungen überwiegend aus A488-markiertem Tubulin bestehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ein Prozessablaufdiagramm (PFD) für den Mikrofluidik-Versuchsaufbau an einem Mikroskop ist in der ergänzenden Abbildung 1 dargestellt.
Ergänzende Abbildung 1: Ein Prozessflussdiagramm (PFD) für den Mikrofluidik-Versuchsaufbau an einem Mikroskop. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzendes Video 1. Der mikrofluidische Aufbau kann verwendet werden, um stabilisierte Mikrotubuli zu biegen. Mikrotubuli im Ruhezustand nach Stabilisierung mit Paclitaxel werden während der pulsierenden Strömung gebogen. Ein konstanter Vordruck von 30 mbar treibt den Durchfluss an. Videowiedergaberate 10 fps. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 1: Eine CAD-Datei des Designs der mikrofluidischen Maske. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das Hauptziel dieses Protokolls war es, ein mikrofluidisches Gerät zu entwerfen und herzustellen, das für die Untersuchung der Mikrotubuli-Mechanik in vitro geeignet ist. Das Design basierte auf dem Wunsch, die intrinsischen Vorteile von PDMS-basierten mikrofluidischen Bauelementen zu nutzen und gleichzeitig eine Kombination von Funktionen zu enthalten, die robuste und anpassbare Experimente mit hohem Durchsatz ermöglichen würden.
Dieses Ziel wurde erfolgreich erreicht, was zu Fertigungsprotokollen und allgemeinen Richtlinien führte, die als Grundlage für zukünftige Benutzer dieses Systems dienen können. Die Aufnahme von redundanten Blasenfallen in das Gerät verringert die Wahrscheinlichkeit einer Proteindenaturierung aufgrund des Vorhandenseins von Luftblasen. Wir müssen zwar noch einige Schläuche im Gerät aus- und wieder einstecken, aber diese Blasenfallen verringern die Wahrscheinlichkeit eines experimentellen Versagens. Zukünftige Verbesserungen des mikrofluidischen Aufbaus könnten die Anzahl der manuellen Manipulationen an den Schläuchen während eines Experiments sogar noch weiter reduzieren. Darüber hinaus ermöglicht die Integration des mikrofluidischen Geräts in eine automatisierte Durchflussregelungssoftware eine signifikante Anpassung der Versuchsbedingungen bei gleichzeitiger Reduzierung der Möglichkeit manueller Fehler. Wir haben die erfolgreiche Leistung des Geräts demonstriert, indem wir das Gerät hergestellt und dann Mikrotubuli-Erweiterungen im Gerät mit automatischer, controller-geregelter Strömung gezüchtet, stabilisiert und gebogen haben. Darüber hinaus haben wir durch die Etablierung eines Gradienten von unterschiedlichen fluoreszenzmarkierten Tubulinlösungen innerhalb desselben Geräts gezeigt, dass mehrere Bedingungen gleichzeitig in einem einzigen Gerät ausgeführt werden können. Mit Hilfe von computergestützten Modellierungs- und Analysetechniken kann unser System die biomechanischen Eigenschaften von Mikrotubuli untersuchen und bestimmen, wie z. B. die Biegesteifigkeit 52,56,57,58,59.
Mögliche zukünftige Verbesserungen würden ein noch robusteres System und die damit verbundene experimentelle Analyse ermöglichen. Erstens waren die Abscheidung des Fotolacks, die Belichtung und das Einbrennen entscheidende Parameter, die eine gewisse Variabilität zeigten. Die relativ hohen Strukturgrößen des SPR-Fotolacks erforderten ein sehr allmähliches Erhitzen und Abkühlen, um thermische Rissbildung zu verhindern, die die Bauelemente ruinieren könnte. Obwohl dünnere Geräte ausprobiert wurden, fanden wir Probleme mit der Manipulation dieser kleineren Funktionsgrößen. Liebe zum Detail und Geduld sind entscheidend, um Geräte dieser Dicke mit SPR-Fotolack zu replizieren. Je nach Verfügbarkeit können verschiedene Fotolacke verwendet werden, um dieses Problem zu lösen.
Zusammengenommen ermöglichen das mikrofluidische Gerät und das Protokoll hier eine Reihe von Versuchsaufbauten mit robusteren Testmöglichkeiten mit hohem Durchsatz als frühere Durchflusszellen-Assays47. Darüber hinaus können Experimente mit Durchflussreglern automatisiert werden, um präzise Strömungsprofile oder Konzentrationsgradienten im Gerät beizubehalten und so die Variabilität manueller Benutzer zu reduzieren. Zu den zukünftigen potenziellen Anwendungen dieses Aufbaus gehören die Untersuchung der Auswirkungen von Mikrotubuli-assoziierten Proteinen auf die Biegesteifigkeit, Dynamik, Gitterschädigung und -reparatur von Mikrotubuli sowie die biomechanischen Wechselwirkungen von Mikrotubuli und Aktinfilamenten 54,60,61,62,63,64,65,66,67,68 ,69,70. Die Integration von Mikrofabrikation, automatisierter Flusskontrolle und computergestützten Modellierungs- und Analysetechniken schafft ein vielseitiges System, das sich für die Untersuchung des zellulären Zytoskeletts in vitro eignet.
Offenlegungen
Die Autoren haben keine Interessenkonflikte. Die Autoren legen die Verwendung von ChatGPT-4o OpenAI für die Textüberarbeitung und das Korrekturlesen offen.
Danksagungen
Wir sind dankbar für die Unterstützung und die Ressourcen des Vanderbilt Institute of Nanoscale Science and Engineering (VINSE), wo ein Teil dieser Forschung durchgeführt wurde. Diese Arbeit wurde teilweise durch einen NIH NIGMS-Zuschuss an M. Zanic (R35 GM1192552) und einen NSF ID 2018661-Zuschuss an M. Zanic finanziert. M. Rogers erhielt Unterstützung durch den NIH T32 GM08320 Grant und einen VINSE Pilot Funding Award. L. Richardson wird durch den NSF GRFP Grant No. 1937963 unterstützt. Die Autoren danken auch Dr. Alice Leach, David Schaffer, Dr. Christina McGahan und dem gesamten Zanic-Labor für ihre Hilfe und Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.6 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mm standard biopsy punch | Integra LifeSciences | 33-31A-P/25 | |
| 100x/1.49 numerical aperture TIRF objective | Nikon | ||
| 22 x 22 mm glass coverslips | ThorLabs | CG15CH | |
| 3" single side polished silicon wafers | University Wafer | 447 | |
| 4" Petri dish | Any brand | ||
| 450 µL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter, Inc. | 345843 | Referred to as 'airfuge tube' in the protocol |
| 488-, 561, and 640-nm solid state lasers | Nikon | ||
| A-95 Fixed-Angle Rotor | Beckman Coulter, Inc. | 347595 | |
| Acetone | Any brand | ||
| Airfuge Air-Driven Ultracentrifuge | Beckman Coulter, Inc. | 347854 | Referred to as 'airfuge' in the protocol |
| Alexa Fluor 488 Microscale Protein Labeling Kit | Thermo Fisher Scientific | A30006 | |
| Aluminum foil | Any brand | ||
| Andor iXon Ultra EM-CCD | Nikon | ||
| Andor NEO sCMOS | Nikon | ||
| AutoCAD | Autodesk | Generic versions can be used | |
| Bovine brain unlabeled tubulin (purified) | N/A | Made in house, but can be purchased | |
| Casein | MilliporeSigma | C7078 | |
| Catalase | MilliporeSigma | C9322 | |
| Clean Dry Air (CDA) (pressurized gas) | Any brand | ||
| Compressed air supply | Any brand | Connects to the microfluidic flow controller | |
| COMSOL Multiphysics software | COMSOL, Inc. | ||
| Custom brass stage adapter | N/A | Made in house to fit our 22 mm x 22 mm coverslips onto the microscope | |
| De-ionized water | Any brand | ||
| Dessicator | Any brand | ||
| D-glucose | MilliporeSigma | G7528 | |
| Dithiothreitol (DTT) | MilliporeSigma | D0632 | |
| EGTA | MilliporeSigma | 324626 | |
| Elveflow Smart Interface (ESI) software | Elveflow | ||
| Flangeless PFA fittings with ETFE ¼”-28 to 1/16” outer diameter ferrules | Darwin Microfluidics | CIL-XP-245X | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack |
| Fluiwell 4-Channel 2 mL Low Pressure | Fluigent | 14002001 | Used to connect the flow control system to the the micrewtubes. Also refered to as 'pressurized reservoir rack' |
| Fume hood | Any brand | ||
| Glucose oxidase | MilliporeSigma | G6125 | |
| GMPCPP | Jena Bioscience | NU-405L | |
| Guanosine triphosphate (GTP) | MilliporeSigma | G8877 | |
| Hot plate | Any brand | ||
| HS-625 high-speed emission filter wheel | Finger Lakes Instrumentation | ||
| ImageJ software | N/A | Open access | |
| Incubator | Any brand | ||
| Isopropyl alcohol | Any brand | ||
| Karl Suss MA-6 mask aligner | SUSS MicroTec | ||
| Magnesium chloride | MilliporeSigma | 1.05833 | |
| MATLAB software | MathWorks | ||
| MEGAPOSIT SPR 220 7.0 photoresist | Dow, Inc. | ||
| Microfluidic Fittings 6-40 to 1/4"-28 Adapters Kit | Darwin Microfluidics | LVF-KFI-08 | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack (Fluiwell rack) |
| Microfluidic Fittings Female Luer Lock Adapter Kit | Darwin Microfluidics | LVF-KFI-04 | Used to connect the syringe to the tubing |
| Microfluidic flow controller | Elveflow | OB1 MK3+ | |
| Microfluidic flow sensor | Elveflow | MFS3 | This flow sensor range is 0-80 μL |
| MICROPOSIT MF-319 developer | Dow, Inc. | ||
| Microscope | Nikon | Eclipse Ti | |
| NIS-Elements software | Nikon | ||
| Nitrogen (pressurized gas) | Any brand | ||
| Objective heater | Tokai Hit | ||
| One-Piece Fingertight 10-32 Coned Fitting for 1/16" OD Tubing | Darwin Microfluidics | CIL-F-120X | Used to connect the syringe to the tubing |
| Paclitaxol (Taxol) | Tocris Bioscience | 1097 | |
| Photolithography masks | N/A | Made by an external party using our designs | |
| PIPES | Thermo Fisher Scientific | 172615000 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Plasma flowmeter system | Harrick Plasma | PDC-FMG | Integrates with plasma cleaner to enable flow control of pressurized gas |
| Plastic bulb pipet | Any brand | ||
| Pluoronic F-127 | MilliporeSigma | P2443 | Referred to as 'poloxomer 407' in the protocol |
| Potassium chloride | Research Products International | P41000 | |
| Saint Gobain Performance Plastics Tube Tygon .020 ID | Thermo Fisher Scientific | 50-206-8921 | Refered to as '1.5 mm tubing' and 'tubing' in the protocol |
| Scalpel | Any brand | ||
| Spin coater | Cost Effective Equipment, LLC. | 200x | This model may be discontinued |
| Standard pipets and tip sets | Any brand | ||
| Standard plastic syringe | Any brand | We used a 10 mL Luer-slip syringe | |
| Sylgard 184 silicone elastomer kit | Dow, Inc. | Referred to as 'PDMS' and 'curing agent' in the protocol | |
| T339 Micrewtube with Lip Seal and Flat Screw Cap | Medline Industried, LP. | T339 | Referred to as 'source vial' in the protocol. We used both 0.5 mL and 1.5 mL sizes |
| TAMRA, SE; 5-(and-6)-Carboxytetramethylrhodamine, Succinimidyl Ester | Invitrogen | C1171 | Referred to as 'TTR' in the protocol |
| Trichloro(1H, 1H, 2H, 2H-perfluorooctyl) silane | MilliporeSigma | 448931 | |
| Trion Phantom RIE ICP | Trion Technology, Inc. | This plasma cleaner is only used in Step 1.1 of the protocol. Another plasma cleaner, like the one used for PDMS bonding, can be used instead; we just prefer the much lower vacuum achievable by this system for cleaning the silicon wafer | |
| TRITC Polyclonal Antibody | Thermo Fisher Scientific | A6397 | Referred to as 'anti-rhodamine antibody' in the protocol |
| Tweezers | Any brand | ||
| Vacuum pump | Any brand |
Referenzen
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Phys Today. 54 (6), 42(2001).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev Mod Phys. 77, 977(2005).
- Beebe, D. J., Mensing, G. A., Walker, G. M. Physics and applications of microfluidics in biology. Annu Rev Biomed Eng. 4, 261-286 (2002).
- Ng, J. M. K., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. Electrophoresis. 23 (20), 3461-3473 (2010).
- Dellaquila, A. Five Short Stories on The History of Microfluidics. , https://www.elveflow.com/microfluidic-reviews/general-microfluidics/history-of-microfluidics/ (2025).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: Microfluidics in drug discovery. Nat Rev Drug Discov. 5 (3), 210-218 (2006).
- Neužil, P., Giselbrecht, S., Länge, K., Huang, T. J., Manz, A. Revisiting lab-on-a-chip technology for drug discovery. Nat Rev Drug Discov. 11 (8), 620-632 (2012).
- Manz, A., Graber, N., Widmer, H. M. Miniaturized total chemical analysis systems: a novel concept for chemical sensing. Sens Actuators B: Chem. 1 (1-6), 244-248 (1990).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Knight, J. Microfluidics: Honey, I shrunk the lab. Nature. 418 (6897), 474-475 (2002).
- Photolithographic fabrication techniques for transistors which are an integral part of a printed circuit. Nall, J. R., Lathrop, J. W. 1957 International Electron Devices Meeting, Washington, DC, USA, , (1957).
- Rogers, M. The design and fabrication of a two-layer microfluidic device for studying microtubules in vitro [Master's Thesis]. , Vanderbilt University. Nashville, TN. (2022).
- Lee, J. B., Choi, K. H., Yoo, K. Innovative SU-8 lithography techniques and their applications. Micromachines. 6 (1), 1-18 (2015).
- Kim, P., et al. Soft lithography for microfluidics: A Review. Biochip J. 2 (1), 1-11 (2008).
- Venkatesan, S. u, Jerald, J., Asokan, P., Prabakaran, R. A Comprehensive Review on Microfluidics Technology and its Applications. Recent Advances in Mechanical Engineering. , Springer. Singapore. 235-245 (2020).
- Minteer, S. Microfluidic Techniques: Reviews and Protocols. , Humana Press. New Jersey. (2006).
- Mitra, S. K., Chakraborty, S. Microfluidics and Nanofluidics Handbook: Fabrication, Implementation, and Applications. , Taylor and Francis Group. Florida. (2016).
- Alberts, B., et al. Molecular Biology of the Cell. , Garland Science. New York. (2014).
- Howard, J. Mechanics of Motor Proteins and the Cytoskeleton. , Springer. Heidelberg. (2001).
- Hawkins, T., Mirigian, M., Selcuk Yasar, M., Ross, J. L. Mechanics of microtubules. J Biomech. 43 (1), 23-30 (2010).
- Gardel, M. L., Kasza, K. E., Brangwynne, C. P., Liu, J., Weitz, D. A. Chapter 19: Mechanical Response of Cytoskeletal Networks. Methods Cell Biol. 89, 487-519 (2008).
- Caporizzo, M. A., Prosser, B. L. The microtubule cytoskeleton in cardiac mechanics and heart failure. Nat Rev Cardiol. 19 (6), 364-378 (2022).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nat Mater. 14 (11), 1156-1163 (2015).
- Chu, S. H., et al. A microfluidic device for in situ fixation and super-resolved mechanosensation studies of primary cilia. Biomicrofluidics. 13 (1), 014105(2019).
- Geisterfer, Z. M., Zhu, D. Y., Mitchison, T. J., Oakey, J., Gatlin, J. C. Microtubule growth rates are sensitive to global and local changes in microtubule plus-end density. Curr Biol. 30 (15), 3016-3023 (2020).
- Schaedel, L., et al. Lattice defects induce microtubule self-renewal. Nat Phys. 15 (8), 830-838 (2019).
- Aher, A., et al. CLASP mediates microtubule repair by restricting lattice damage and regulating tubulin incorporation. Curr Biol. 30 (11), 2175-2183 (2020).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. ELife. 5, e13470(2016).
- Fourniol, F. J., et al. Micropattern-guided assembly of overlapping pairs of dynamic microtubules. Methods Enzymol. 540, 339-360 (2014).
- Vleugel, M., Roth, S., Groenendijk, C. F., Dogterom, M. Reconstitution of basic mitotic spindles in spherical emulsion droplets. J Vis Exp. (114), e54278(2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Mol Biol Cell. 27 (22), 3563-3573 (2016).
- VanDelinder, V., Brener, S., Bachand, G. D. Mechanisms underlying the active self-assembly of microtubule rings and spools. Biomacromolecules. 17 (3), 1048-1056 (2016).
- Roth, S., Gârlea, I. C., Vleugel, M., Mulder, B. M., Dogterom, M. Reconstitution of basic mitotic spindles in cell-like confinement. bioRxiv. , (2019).
- Xu, Z., et al. Microtubules acquire resistance from mechanical breakage through intralumenal acetylation. Science. 356 (6335), 328-332 (2017).
- Fanalista, F., et al. Shape and size control of artificial cells for bottom-up biology. ACS Nano. 13 (5), 5439-5450 (2019).
- Velve-Casquillas, G., Costa, J., Carlier-Grynkorn, F., Mayeux, A., Tran, P. T. A fast microfluidic temperature control device for studying microtubule dynamics in fission yeast. Methods Cell Biol. 97, 185-201 (2010).
- Portran, D., Schaedel, L., Xu, Z., Théry, M., Nachury, M. V. Tubulin acetylation protects long-lived microtubules against mechanical ageing. Nat Cell Biol. 19 (4), 391-398 (2017).
- Huang, Y. M., Uppalapati, M., Hancock, W. O., Jackson, T. N. Microtubule transport, concentration and alignment in enclosed microfluidic channels. Biomed Microdevices. 9 (2), 175-184 (2007).
- Uppalapati, M., Huang, Y., Shastry, S., Jackson, T. N., Hancock, W. O. Microtubule Motors in Microfluidics. Methods in Bioengineering: Microfabrication and Microfluidics. , Artech House Publishers. Boston, MA. (2009).
- Sung, J. H., Shuler, M. L. Prevention of air bubble formation in a microfluidic perfusion cell culture system using a microscale bubble trap. Biomed Microdevices. 11 (4), 731-738 (2009).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360(2019).
- Nakayama, T., et al. Circumventing air bubbles in microfluidic systems and quantitative continuous-flow PCR applications. Anal Bioanal Chem. 386 (5), 1327-1333 (2006).
- Park, S., Cho, H., Kim, J., Han, K. -H. Lateral degassing method for disposable film-chip microfluidic devices. Membranes. 11 (5), 316(2021).
- Pereiro, I., Fomitcheva Khartchenko, A., Petrini, L., Kaigala, G. V. Nip the bubble in the bud: A guide to avoid gas nucleation in microfluidics. Lab Chip. 19 (14), 2296-2314 (2019).
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biol. 95, 221-245 (2010).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: Information from a slowly hydrolyzable analogue, GMPCPP. Mol Biol Cell. 3 (10), 1155-1167 (1992).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bartlett, N. W., Wood, R. J. Comparative analysis of fabrication methods for achieving rounded microchannels in PDMS. J Micromech Microeng. 26 (11), 115013(2016).
- Yang, C. P. H., Horwitz, S. B. Taxol®: The first microtubule stabilizing agent. Int J Mol Sci. 18 (8), 1733(2017).
- Gittes, F., Mickey, B., Nettleton, J., Howard, J. Flexural rigidity of microtubules and actin filaments measured from thermal fluctuations in shape. J Cell Biol. 120 (4), 923-934 (1993).
- VanBuren, V., Cassimeris, L., Odde, D. J. Mechanochemical model of microtubule structure and self-assembly kinetics. Biophys J. 89 (5), 2911-2926 (2005).
- Dye, R. B., Fink, S. P., Williams, R. C. Taxol-induced flexibility of microtubules and its reversal by MAP-2 and Tau. J Biol Chem. 268 (10), 6847-6850 (1993).
- Drechsel, D. N., Kirschnert, M. W. The minimum GTP cap required to stabilize microtubules. Curr Biol. 4 (12), 1053-1061 (1994).
- Wisanpitayakorn, P., Mickolajczyk, K. J., Hancock, W. O., Vidali, L., Tüzel, E. Measurement of the persistence length of cytoskeletal filaments using curvature distributions. Biophys J. 121 (10), 1813-1822 (2022).
- Mickey, B., Howard, J. Rigidity of microtubules is increased by stabilizing agents. J Cell Biol. 130 (4), 909-917 (1995).
- Brangwynne, C. P., et al. Bending dynamics of fluctuating biopolymers probed by automated high-resolution filament tracking. Biophys J. 93 (1), 346-359 (2007).
- Venier, P., Maggs, A. C., Carlier, M. F., Pantaloni, D. Analysis of microtubule rigidity using hydrodynamic flow and thermal fluctuations. J Biol Chem. 269 (18), 13353-13360 (1994).
- Felgner, H., Frank, R., Schliwa, M. Flexural rigidity of microtubules measured with the use of optical tweezers. J Cell Sci. 109 (Pt 2), 509-516 (1996).
- Felgner, H., et al. Domains of neuronal microtubule-associated proteins and flexural rigidity of microtubules. J Cell Biol. 138 (5), 1067-1075 (1997).
- Nishida, K., et al. Effects of three microtubule-associated proteins (MAP2, MAP4, and Tau) on microtubules' physical properties and neurite morphology. Sci Rep. 13, 8870(2023).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Brouhard, G. J., Rice, L. M. Microtubule dynamics: An interplay of biochemistry and mechanics. Nat Rev Mol Cell Biol. 19 (7), 451-463 (2018).
- Lawrence, E. J., Chatterjee, S., Zanic, M. More is different: Reconstituting complexity in microtubule regulation. J Biol Chem. 299 (12), 105398(2023).
- Howard, J., Hyman, A. A. Dynamics and mechanics of the microtubule plus end. Nature. 422 (6933), 753-758 (2003).
- Mehidi, A., Aumeier, C. Regulation of the microtubule network; the shaft matters. Curr Opin Syst Biol. 34, 100457(2023).
- Verhey, K. J., Ohi, R. Causes, costs and consequences of kinesin motors communicating through the microtubule lattice. J Cell Sci. 136 (5), jcs260735(2023).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nat Rev Mol Cell Biol. 20 (1), 38-54 (2019).
- Théry, M., Blanchoin, L. Microtubule self-repair. Curr Opin Cell Biol. 68, 144-154 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten