Method Article
Desarrollo de un enfoque basado en la microfluídica para investigar la mecánica de los polímeros de microtúbulos
En este artículo
Resumen
Este protocolo detalla el diseño y la fabricación de un dispositivo microfluídico adecuado para investigar la mecánica de los polímeros de microtúbulos. La síntesis de técnicas de microfabricación, control de flujo automatizado y modelado computacional permite un sistema flexible ideal para sondear el citoesqueleto celular in vitro.
Resumen
En este protocolo, describimos el diseño y fabricación de un dispositivo microfluídico desarrollado para la investigación de la mecánica de polímeros de microtúbulos. El diseño utiliza los beneficios intrínsecos de los dispositivos microfluídicos basados en polidimetilsiloxano (PDMS) e introduce varias características para permitir un enfoque experimental robusto y personalizable de alto rendimiento. El dispositivo desarrollado incorpora capacidades redundantes de captura de burbujas para evitar la aparición de burbujas de aire perjudiciales. Además, el dispositivo interactúa con un sistema de control de flujo automatizado para reducir la intervención manual y permitir análisis de alto rendimiento. El software de simulación comercial se utiliza para desarrollar y comprender mejor el transporte de fluidos utilizando este sistema. Finalmente, demostramos la capacidad de realizar múltiples experimentos simultáneamente dentro de un solo dispositivo mediante el crecimiento de extensiones de microtúbulos con etiquetas fluorescentes distintas en diferentes secciones del dispositivo. En general, este sistema de flujo microfluídico se puede utilizar para sondear la mecánica de los polímeros de microtúbulos y proporciona mejoras en el diseño experimental para estudios in vitro de microtúbulos más amplios. La síntesis de los enfoques de microfabricación, control de flujo automatizado y modelado computacional permite un sistema flexible ideal para sondear el citoesqueleto celular in vitro.
Introducción
La microfluídica permite un control preciso de minúsculos volúmenes de fluido, a menudo menos de un microlitro, mediante el intrincado diseño y la fabricación de canales de flujo de fluido 1,2. La pequeña escala de los dispositivos microfluídicos da lugar a fenómenos de ingeniería únicos. Es decir, el número de Reynolds, una medida adimensional de la relación entre las fuerzas inerciales y viscosas en el flujo de fluidos, es pequeño, generalmente del orden de O(10) o menor en microfluídica, lo que subraya la importancia de las fuerzas viscosas en los dispositivos microfluídicos. Además, el número de Péclet, que compara el transporte convectivo con el difusivo, muestra que el transporte convectivo es generalmente insignificante en microfluídica 3,4,5. Este régimen de flujo laminar impulsado por la difusión en microfluídica es ventajoso, ya que admite experimentos paralelos en un solo dispositivo al mantener gradientes de fluido precisos.
La fotolitografía sigue siendo el método principal para la fabricación de dispositivos microfluídicos 6,7,8. En resumen, este proceso implica la creación de una plantilla grabada "maestra" del diseño microfluídico (Figura 1). Se prepara un sustrato fotosensible y una fotomáscara de diseño microfluídico expone selectivamente las áreas de fotorresistencia a la radiación ultravioleta. Los métodos de grabado posteriores desarrollan el sustrato, produciendo un relieve del diseño. El polidimetilsiloxano (PDMS) a menudo se moldea y se cura en el maestro. El PDMS curado, que adopta las características negativas del diseño, se retira del maestro y se adhiere a un cubreobjetos de vidrio. Todo este proceso de fabricación suele tardar entre 1 y 2 días, lo que permite iteraciones rápidas de diseño y la producción de múltiples dispositivos. Revisiones detalladas de los procesos de litografía blanda y microfabricación están disponibles en otras referencias 1,2,3,10,11,12,13.
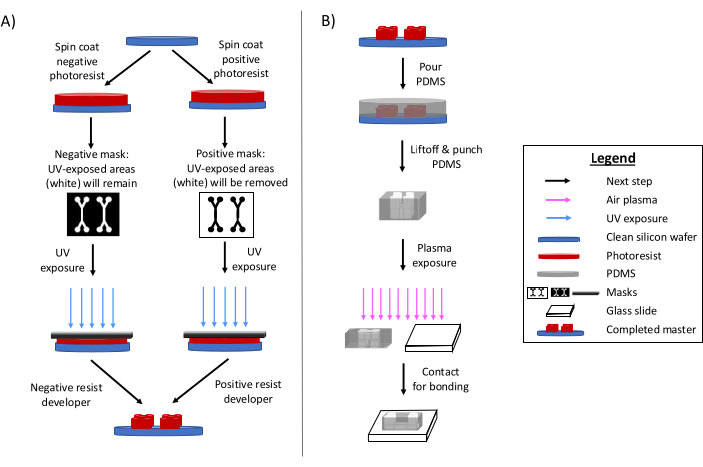
Figura 1: Descripciones generales del proceso tradicional de fotolitografía y el proceso de microfabricación. (A) Proceso de fotolitografía tradicional y (B) Proceso de microfabricación. Dependiendo de la aplicación y de las características deseadas de la fotorresistencia, se puede utilizar una fotorresistencia negativa o positiva, aunque produzcan el mismo maestro de diseño. Características como la altura de la característica deseada o la temperatura de fusión de la fotorresistencia ayudan a determinar el tipo de fotorresistencia adecuado. Esta cifra ha sido modificada con permiso de Rogers (2022)14. Haga clic aquí para ver una versión más grande de esta figura.
El uso de la microfluídica ha ampliado las posibilidades en muchos campos de investigación, y su impacto más reciente se ha producido en las ciencias biológicas. Dada su pequeña escala, la microfluídica permite la gestión precisa de recursos limitados y valiosos, como células o proteínas. Aún más impactante es la capacidad de ajuste de los sistemas microfluídicos para imitar condiciones fisiológicas, como modificaciones en la rigidez del sustrato, el ejercicio de fuerza sobre una muestra e incluso la integración de corriente eléctrica. Además, el uso de la microfluídica ofrece la capacidad de manipular múltiples reactivos en paralelo y de crear rápidamente prototipos y refinar iterativamente los diseños de los sistemas. Estas características permiten la miniaturización de flujos de trabajo de laboratorio completos en un solo dispositivo, comúnmente conocido como "laboratorio en un chip"1,6,9,15,16,17,18,19.
Una de las aplicaciones celulares y biológicas de la microfluídica es la investigación de polímeros de microtúbulos. Los microtúbulos son un componente esencial del citoesqueleto de la célula, desempeñando un papel vital en procesos como la división celular y el transporte de carga intracelular20,21. Como el elemento más rígido del citoesqueleto, los microtúbulos exhiben un módulo elástico comparable al del plexiglás22,23. Sus robustas propiedades mecánicas son cruciales para diversas funciones celulares, incluyendo, por ejemplo, la contracción de los cardiomiocitos, donde se doblan y relajan cíclicamente durante las fases sistólica y diastólicadel corazón 24. Los dispositivos microfluídicos se han adoptado previamente para investigar las propiedades de los microtúbulos y sus estructuras de orden superior in vitro. De hecho, la microfluídica se ha utilizado para investigar la dinámica de polimerización de los microtúbulos, las interacciones entre microtúbulos y los efectos de las proteínas asociadas a los microtúbulos en las propiedades mecánicas de los microtúbulos 25,26,27,28,29,30,31,32,33,34,35 ,36,37,38,39,40,41.
Si bien la introducción de la microfluídica en el campo de los microtúbulos ha dado lugar a muchos descubrimientos interesantes, aún hay margen de mejora en la adaptación de estos dispositivos para la investigación de los microtúbulos. En este trabajo, abordamos dos limitaciones específicas que persisten en el estudio de los microtúbulos en dispositivos microfluídicos: el potencial de formación de burbujas de aire dentro del dispositivo, típicamente introducido por la manipulación manual de dispositivos microfluídicos, y la infrautilización de ensayos de alto rendimiento. En primer lugar, las manipulaciones manuales, como taponar y desenchufar los tubos, pueden introducir la formación de burbujas en los canales. La formación de burbujas de aire dentro de una celda de flujo es catastrófica, ya que las burbujas de aire pueden desnaturalizar proteínas, cortar polímeros de microtúbulos y afectar negativamente a los cultivos celulares42,43. Además, las esquinas afiladas y los ángulos oblicuos del dispositivo dan como resultado una humectación superficial no uniforme, lo que aumenta la posibilidad de arrastre de aire. Se han desarrollado numerosas técnicas para reducir la formación, la persistencia y el impacto de las burbujas de aire; Sin embargo, el uso de métodos de mitigación de burbujas no es universal 42,43,44,45,46. Además, aunque una de las principales ventajas del uso de la microfluídica es la capacidad de experimentación de alto rendimiento, la microfluídica aún no se ha utilizado para ampliar la investigación de los microtúbulos. Los dispositivos microfluídicos pueden diseñarse para probar múltiples condiciones experimentales en paralelo en el mismo dispositivo. Por ejemplo, los gradientes de fluidos se pueden utilizar para dirigir el flujo de diferentes proteínas o fármacos asociados a los microtúbulos, lo que permite su administración dirigida a regiones específicas de microtúbulos particionados dentro del mismo dispositivo.
Aquí, diseñamos iterativamente un dispositivo microfluídico que aborda estas limitaciones. Proporcionamos el protocolo paso a paso de la fabricación del dispositivo, lo que permite que un público más amplio emplee la tecnología microfluídica en su investigación sobre microtúbulos. Este diseño de dispositivo incorpora funciones de captura de burbujas y utiliza un sistema de control de flujo automatizado para reducir la intervención manual, al tiempo que permite gradientes de soluciones en el dispositivo para análisis de alto rendimiento. En resumen, el desarrollo de este diseño microfluídico puede facilitar una investigación y una comprensión más amplias de la mecánica de los microtúbulos, al tiempo que ofrece valiosas mejoras a los diseños experimentales en el campo más amplio de la investigación de los microtúbulos.
Protocolo
NOTA: El trabajo detallado en esta parte del protocolo se realizó en la sala limpia central de Clase 100 del Instituto de Ciencia e Ingeniería a Nanoescala de Vanderbilt (VINSE). Es deseable una sala limpia controlada con batas adecuadas e iluminación con filtro UV para evitar daños en el dispositivo debido a las condiciones de humedad/iluminación ambiental y para evitar la contaminación por partículas. Todas las manipulaciones de obleas de silicio deben realizarse con el lado pulido de la oblea de silicona hacia arriba. Use pinzas cuando manipule obleas y minimice el contacto con las superficies de la oblea para evitar que se raye. Mantenga las obleas en placas de Petri con las tapas cubiertas cuando las transporte y al final de cada día, a menos que se indique lo contrario.
1. Fotolitografía (6 - 8 h)
- Limpie con plasma una oblea de silicio de 3" durante 5 minutos al vacío (idealmente, la presión de vacío < 5 × 10-5 torr) utilizando plasma de oxígeno (O2) o aire limpio y seco (CDA).
- Centre la oblea de silicio en un recubridor giratorio para la deposición de la fotorresistencia.
- Deposite ~1-2 mL de fotorresistencia SPR 220 7.0 en el centro de la oblea de silicio.
PRECAUCIÓN: Manipule la fotorresistencia con guantes y protección ocular y deséchela de acuerdo con los protocolos específicos del fabricante / sitio. - Aplicar una capa de centrifugado de la fotorresistencia en la oblea de silicio hasta obtener el grosor deseado en función de las curvas de centrifugado del fabricante. Genere capas de ~13 μm de espesor girando a 1000 RPM durante 30 s. Más tarde, limpie la fotorresistencia residual en el barnizador giratorio con acetona y deséchela según los protocolos específicos del sitio.
NOTA: Si después del recubrimiento por centrifugación, la oblea no está uniformemente cubierta con fotorresistencia, repita los pasos 1.2-1.4. Un recubrimiento no uniforme podría deberse a una oblea no centrada en el recubridor giratorio, al uso de muy poca fotorresistencia y/o a que no se deposita la fotorresistencia en el centro de la oblea. - Mientras toca la menor cantidad posible de fotorresistencia en la oblea, transfiera la oblea de silicio a una placa caliente colocada a 70 °C.
- Incubar la oblea de silicona en la placa calefactora, aumentando la temperatura en 10 °C cada 3-5 minutos hasta que la temperatura alcance los 115 °C.
- Apague la placa calefactora y deje que la oblea de silicona se enfríe hasta que su temperatura sea inferior a 65 °C.
NOTA: Los pasos de calentamiento y enfriamiento se realizan lentamente para evitar el agrietamiento térmico de la fotorresistencia, que es común en este espesor. Si se producen grietas térmicas, generalmente se pueden rectificar recalentando la oblea de silicio y disminuyendo la velocidad de enfriamiento. - Con pinzas, transfiera la oblea de silicona enfriada a un alineador de mascarillas y cargue tanto la oblea de silicona como la fotomascarilla correspondiente en el alineador de mascarillas siguiendo los protocolos específicos del fabricante o del sitio.
NOTA: Las fotomáscaras fueron fabricadas por una parte externa utilizando un diseño específico, que se creó con AutoCAD. Consulte el Archivo complementario 1 para ver la representación del diseño de la máscara. - Exponga la oblea de silicio a la radiación ultravioleta (UV) durante un tiempo específico (en función de la potencia de la lámpara UV) siguiendo los protocolos específicos del fabricante/sitio. La energía deseada para esta aplicación es de ~400 mJ/cm2, y calcule el tiempo de exposición mediante la fórmula:
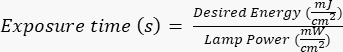 .
. - Después de la exposición, retire la oblea de silicona del alineador de la mascarilla y deje que el fotorresistente se rehidrate durante 4 h mediante la circulación de aire. Asegúrese de que la tapa de la placa de Petri esté abierta para permitir la circulación de aire, pero coloque la placa en un área que probablemente no esté expuesta a partículas.
NOTA: Se puede tomar un descanso de 4 horas durante este tiempo de rehidratación, pero se recomienda continuar con el procedimiento el mismo día. - Después de la rehidratación de 4 horas, transfiera la oblea expuesta a una placa caliente colocada a 70 °C.
- Incubar la oblea de silicona en la placa calefactora, aumentando la temperatura en 10 °C cada 3-5 minutos hasta que la temperatura alcance los 115 °C.
- Deje que la oblea se incube a 115 °C durante 10 minutos.
- Cree una "cubierta" aislante para la oblea expuesta moldeando una hoja de papel de aluminio en forma de tapa de placa de Petri.
- Apague la placa calefactora y cubra la oblea expuesta con la cubierta de papel de aluminio. Deje que la oblea se enfríe a temperatura ambiente durante la noche.
NOTA: El agrietamiento térmico de la fotorresistencia es mucho más común durante la etapa de incubación posterior a la exposición, por lo que se recomienda un enfriamiento lento durante la noche. Esto completa los pasos necesarios para el primer día de fabricación. Se recomienda pasar a la siguiente sección al día siguiente.
2. Desarrollo (1 - 2 h)
- Cuando esté listo para revelar la oblea expuesta, obtenga un recipiente limpio y un revelador fotorresistente adecuado. Aquí, el revelador MF-319 se utiliza con un contenedor dedicado.
PRECAUCIÓN: Manipule el revelador con guantes y protección para los ojos, transfiera el contenedor a granel a un contenedor secundario y deséchelo de acuerdo con los protocolos específicos del fabricante / sitio. - Vierta suficiente revelador en el recipiente para sumergir completamente la oblea expuesta (el volumen real variará según el recipiente).
- Sumerja la oblea expuesta en el revelador y espere hasta que se hayan disuelto todos los fotorresistentes no deseados. Girar/agitar suavemente el recipiente ayuda en el desarrollo hasta que se vea poca o ninguna fotorresistencia residual en la oblea, aparte del diseño del dispositivo.
NOTA: Es posible que se requieran varios cambios de la solución de revelador para eliminar por completo la fotorresistencia no deseada, según el volumen de la solución de revelador utilizada. - Retire la oblea desarrollada de la solución de revelado y enjuague suavemente ambos lados de la oblea con agua desionizada (DI) durante 30 s.
- Seque la oblea desarrollada con gas nitrógeno (N2).
- Guarde la oblea desarrollada en una placa de Petri en un ambiente seco y fresco hasta que esté lista para su uso posterior. Envuelva la placa de Petri en papel de aluminio para evitar la degradación de la fotorresistencia debido a la exposición a la luz ambiental.
NOTA: Se recomienda, pero no es obligatorio, pasar a la siguiente sección el mismo día.
3. Silanización (1 - 2 h)
- Transfiera la oblea de silicio a un desecador.
- Coloque un pequeño recipiente de aluminio (o un trozo de papel de aluminio doblado en forma de recipiente) en el desecador.
- Pipetee 1 gota (~50 μL) de tricloro (1H, 1H, 2H, 2H-perfluorooctyl) en el recipiente de aluminio.
PRECAUCIÓN: Manipule la solución de silano con guantes y protección ocular y deséchela de acuerdo con los protocolos específicos del fabricante / sitio. - Cierre el desecador y encienda la aspiradora.
- Permita que se produzca la desecación/silanización durante 1-2 h.
- Una vez finalizado el tiempo de silanización, apague la aspiradora y recupere la oblea silanizada. Guarde la oblea silanizada en una placa de Petri envuelta en papel de aluminio en un ambiente seco y fresco hasta que esté lista para su uso posterior.
NOTA: Es posible que sea necesario repetir periódicamente la silanización en las obleas y con mayor frecuencia en los dispositivos donde se utilizan capas más delgadas de PDMS. Si se nota una adherencia de PDMS al retirar el PDMS de la oblea, es posible que sea necesario volver a silanizar la oblea, y esta sección debe repetirse una vez que se hayan eliminado todos los PDMS de la oblea. Esto completa los pasos necesarios para crear maestros de dispositivos microfluídicos. Los masters son estables y las secciones subsiguientes se pueden ejecutar cuando se desee.
4. Deposición de PDMS (1 - 2 h)
NOTA: Si hay PDMS residual en el maestro de una microfabricación anterior, el PDMS residual debe eliminarse antes de depositar un nuevo PDMS.
- En una báscula, pese en un contenedor el PDMS y el agente de curado asociado en una proporción de peso de 10:1. El peso total requerido variará según el grosor deseado del PDMS y el tamaño de la placa de Petri. Para una placa de Petri de 4", ~ 20 g de PDMS y ~ 2 g de agente de curado producirán un grosor de 2-3 mm.
PRECAUCIÓN: Manipule la solución de PDMS con guantes y protección ocular y deséchela de acuerdo con los protocolos específicos del fabricante / sitio. - Mezcle el PDMS y el agente de curado en el recipiente durante 5 minutos con una espátula de plástico u otra herramienta adecuada.
- Transfiera el contenedor de PDMS mezclado a un desecador para la desgasificación.
- Cierre el desecador y encienda la aspiradora. Las burbujas de aire comenzarán a aparecer en el PDMS.
- Deje que se produzca la desecación/desgasificación durante 30 minutos. Dependiendo de la cantidad de PDMS utilizada y de la forma del contenedor, el tiempo real puede variar; un punto final general es cuando hay pocas o ninguna burbuja presente en el PDMS.
- Después de la desgasificación, apague la aspiradora y recupere el contenedor PDMS.
- Vierta el PDMS mezclado y desgasificado en el maestro en una placa de Petri.
- Incube el maestro en la placa de Petri cerrada a 65 °C durante la noche para permitir que el PDMS se cure por completo.
NOTA: Esto completa los pasos para la deposición de PDMS. Se recomienda dejar que el PDMS se cure en una incubadora durante la noche. El PDMS es entonces estable, por lo que las secciones posteriores se pueden ejecutar cuando se desee.
5. Montaje del dispositivo PDMS (1 - 2 h)
- Recupere el/los maestro(s) del dispositivo que han curado el PDMS, un par de pinzas, un punzón de biopsia estándar de 1,5 mm con un émbolo manual y un bisturí/hoja de afeitar.
PRECAUCIÓN: Manipule la hoja con cuidado y nunca corte hacia usted o hacia otras personas. Se recomienda una cuchilla autorretráctil o de seguridad. - Alrededor de las características del dispositivo, recorte piezas rectangulares de PDMS del maestro de capas. Asegúrese de que cada pieza de PDMS tenga algo de espacio en cada lado, flanqueando las características del dispositivo para facilitar un buen contacto de unión y asegurando que cada pieza encaje por sí sola cubreobjetos de vidrio de 22 mm × 22 mm.
NOTA: Es importante evitar tocar la superficie inferior del PDMS (el lado con las características), por lo que siempre manipule el PDMS por los bordes con pinzas. Además, nunca coloque el lado de la característica del PDMS hacia abajo sobre ninguna superficie. Cuando no esté en uso, guarde el PDMS con el lado de la función hacia arriba en un recipiente cerrado hasta que lo necesite. - Perfore los orificios de entrada y salida en las piezas de PDMS con un punzón limpio de 1,5 mm. Perfore el dispositivo PDMS en una capa de repuesto de PDMS de sacrificio en lugar de en una superficie dura que pueda dañar la perforadora.
- Recupere y limpie un cubreobjetos de vidrio de 22 mm × 22 mm con una toallita húmeda con alcohol isopropílico (IPA).
- Limpie con plasma el cubreobjetos de 22 mm × 22 mm durante 5 minutos al vacío (presión < 0,5 Torr) con plasma CDA. Esto eliminará cualquier residuo o recubrimiento orgánico en el cubreobjetos.
- Limpie el cubreobjetos de vidrio de 22 mm × 22 mm y el lado característico del PDMS con una toallita humedecida con IPA.
- Coloque tanto el PDMS (con el lado de la característica hacia arriba) como el cubreobjetos de vidrio (el mismo lado hacia arriba que se limpió antes) en el limpiador de plasma y limpie con plasma simultáneamente durante 30 s al vacío (presión < 0,5 Torr) utilizando plasma CDA.
- Retire tanto el cubreobjetos de vidrio como el dispositivo PDMS del limpiador de plasma. Invierta el PDMS de modo que el lado de la característica quede hacia abajo y colóquelo en el cubreobjetos de vidrio. Observe la unión y presione ligeramente el PDMS según sea necesario para facilitar un buen contacto.
- Incubar el cubreobjetos adherido en una placa de Petri cerrada a 65 °C durante 3 min para facilitar la adhesión.
NOTA: La unión por plasma cambia la hidrofobicidad del cubreobjetos de vidrio, generando una superficie hidrófila. Se ha observado a través de evidencia anecdótica que el estado hidrofóbico original del cubreobjetos regresa después de aproximadamente 2 días de incubación a temperatura ambiente. Se recomienda utilizar los dispositivos fabricados no antes de 2 días después de la unión por plasma. Esto completa los pasos de microfabricación. Los dispositivos no tienen una vida útil establecida, pero deben almacenarse en un lugar fresco y seco cuando no estén en uso.
6. Preparación del canal de flujo microfluídico (1 h)
- Asegure un dispositivo microfluídico ensamblado en un adaptador de etapa personalizado limpio47.
- Recupere una jeringa, un adaptador Lour-lock y una férula de conexión, y un trozo de tubo transparente de 1,5 mm de diámetro exterior (aproximadamente 15-20 cm de largo). Conecte el tubo a la jeringa a través del adaptador.
- Conecte tres piezas más de tubo a las salidas del dispositivo microfluídico (este tubo no necesita tener una longitud específica) y dirija el otro extremo de estos tubos hacia un vial de desecho aguas abajo.
- Con la jeringa, prepare el dispositivo microfluídico introduciendo soluciones de acuerdo con los pasos a continuación. La secuencia y el volumen de las soluciones son los siguientes: 50 μL de solución tampón BRB80, 25 μL de solución de anticuerpos antirrodamina, esperar 5 min, 50 μL de BRB80, 25 μL de poloxamer 407 (F127), esperar 15 min, y 50 μL de BRB80. Consulte la Tabla 1 para ver un ejemplo.
- Extraiga la solución desde su origen hasta el tubo.
NOTA: No introduzca la solución hasta el fondo de la jeringa. La solución debe permanecer solo en el tubo. - Presione suavemente el émbolo de la jeringa hasta que haya una pequeña gota de líquido en el extremo del tubo. Esto evitará que el aire entre en el dispositivo microfluídico cuando el tubo esté conectado.
- Conecte el tubo a la entrada del dispositivo microfluídico.
- Presione lentamente el émbolo de la jeringa hasta que la mayor parte, pero no toda, la solución haya volado a través del tubo. Dejar una pequeña cantidad de líquido en el tubo asegurará que no se fuerce aire inadvertidamente a través del tubo. Observe los tubos y los canales microfluídicos durante estas transferencias, en busca de burbujas.
NOTA: Si se producen burbujas en el tubo, comience a solucionar el problema (intente eliminar la burbuja antes de que ingrese al dispositivo microfluídico desenchufando el tubo justo antes de que llegue la burbuja y luego vuelva a colocar el tubo después de que pase la burbuja, etc.). - Repita los pasos 6.4.1-6.4.4 para el siguiente reactivo hasta que todos los reactivos hayan volado. Se necesitará una nueva pieza de tubo de entrada para cada reactivo para evitar la contaminación cruzada de los reactivos de origen. Una vez que se completa el lavado final del BRB80, el dispositivo es estable durante varios minutos. Una gota de solución BRB80 en las entradas evitará que el dispositivo se seque.
- Extraiga la solución desde su origen hasta el tubo.
- Prepare "semillas" de microtúbulos estabilizadas con guanosina-5'-[(α,β)-metileno]trifosfato (GMPCPP) de acuerdo con los protocolos estándar (con una proporción de etiquetado TTR de ~25%)47,48.
- Prepare una solución tampón de imagen («antidescolorimiento») a una concentración de trabajo 2x combinando los siguientes reactivos en las cantidades respectivas (en función de las concentraciones de existencias) para obtener las concentraciones finales especificadas: BRB80 suplementado con 40 mM de glucosa, 40 μg/mL de glucosa oxidasa, 16 μg/mL de catalasa, 0,5 mg/mL de caseína, 50 mM de cloruro de potasio y 10 mM de ditiotreitol (DTT). Este tampón de imagen se utiliza para prolongar la fotoestabilidad. Consulte la Tabla 2 para ver un ejemplo.
- Diluya una porción de la solución antidecoloración 2x 1:1 en BRB80 para obtener una solución de trabajo 1x de antidecoloración. Caliente este antidecoloración a temperatura ambiente (RT); La solución antidecoloración debe mantenerse en hielo.
| Orden | Reactivos | Dilución en volumen | Volumen de lavado | Tiempo de incubación |
| 1 | BRB80 | N/A | 50 μL | N/A |
| 2 | Anticuerpo anti-rodamina | 1:50 en BRB80, mezclar bien | 25 μL | 5 minutos |
| 3 | BRB80 | N/A | 50 μL | N/A |
| 4 | Poloxámero 407 (F127) | 1% en BRB80 | 25 μL | 15 minutos |
| 5 | BRB80 | N/A | 50 μL | N/A |
Tabla 1: Orden de preparación de los canales de los dispositivos microfluídicos.
| Volumen | Reactivo | Concentración de existencias | Concentración final |
| 16 μL | D-Glucosa | 2 M | 80 mM |
| 16 μL | Glucosa oxidasa | 2 mg/mL | 80 μg/mL |
| 16 μL | Catalasa | 0,8 mg/mL | 32 μg/mL |
| 14 μL | Caseína | 28 mg/mL | 0,16 mg/mL |
| 8 μL | TDT | 1 M | 20 mM |
| 40 μL | Cloruro de potasio | 1 M | 100 mM |
| 290 μL | BRB80 | 1 vez | N/A |
| 400 μL | FINAL (2x concentración de trabajo) |
Tabla 2: Receta de la solución de imagen antidesvanecimiento (concentración 2x).
7.Introducción de semillas de microtúbulos a microfluidos (10 - 15 min)
- Conecte el dispositivo microfluídico al microscopio.
NOTA: Debido a que la estabilidad de los microtúbulos depende de la temperatura, se recomienda que los experimentos de imagen se realicen a 35 °C. - Conecte 10-15 cm de tubo nuevo a la jeringa y extraiga la dilución deseada de semillas de microtúbulos estabilizadas con GMPCPP en el tubo.
NOTA: Para este dispositivo, ~10 nM de semillas de microtúbulos GMPCPP fue la concentración óptima. - Presione suavemente el émbolo de la jeringa hasta que haya una pequeña gota de líquido en el extremo del tubo. Esto evitará que el aire entre en el dispositivo microfluídico cuando el tubo esté conectado.
- Conecte el tubo a la entrada del dispositivo microfluídico.
- Presione lentamente el émbolo de la jeringa hasta que la mayor parte, pero no toda, la solución haya volado a través del tubo. Dejar una pequeña cantidad de líquido en el tubo asegurará que no se fuerce aire inadvertidamente a través del tubo.
- Separe el tubo de entrada del dispositivo microfluídico y de la jeringa y conecte un nuevo trozo de tubo a la jeringa.
- Introduzca BRB80 en el tubo.
- Repita los pasos 7.3-7.6 para lavar las semillas de microtúbulos no unidas del dispositivo.
- Observe la unión de las semillas a la superficie microfluídica utilizando microscopía de fluorescencia de reflexión interna total (TIRF). El número ideal de semillas en un solo campo de visión variará según la aplicación y el tamaño del campo de visión, pero en general, ~ 10-20 semillas por 80 μm × 80 μm de campo de visión es óptimo. Repita los pasos 7.2-7.9 según sea necesario hasta alcanzar la densidad de semillas deseada.
NOTA: Para controlar la densidad de semillas de microtúbulos, se debe utilizar una exposición intermitente a la luz corta (100 ms) ya que aún no hay antidesvanecimiento en la solución. - Una vez que se alcance la densidad de semilla unida adecuada, conecte una nueva pieza de tubo de entrada a la jeringa.
- Introduzca 1x solución antidecoloración tibia en el tubo y repita los pasos 7.3-7.6.
NOTA: Con la solución antidesvanecimiento ahora en el dispositivo, la fotoestabilidad mejora significativamente y el dispositivo es estable. Sin embargo, se recomienda minimizar la exposición a la luz láser.
8. Crecimiento de extensiones de microtúbulos a partir de semillas (15 - 30 min)
- Combine tubulina marcada con fluorescencia, tubulina no marcada, solución antidecoloración 2x, guanosina-5'-trifosfato (GTP) y BRB80 para lograr una solución final que contenga 14 μM de tubulina con una proporción de marcado fluorescente del 7 %, antidecoloración a una concentración de trabajo 1x y 1 mM de GTP.
NOTA: Si se utilizan diferentes concentraciones o diferentes porcentajes de etiquetado de tubulina, será necesario ajustar el volumen de cada reactivo para lograr la concentración final deseada y la proporción de etiquetado. Mantenga la solución de tubulina en hielo hasta ~ 30 s antes de la introducción, momento en el que retire la solución del hielo y caliéntela en la mano hasta RT. Esto ayudará en la polimerización de las extensiones de microtúbulos, que es un proceso dependiente de la temperatura. De hecho, la polimerización de microtúbulos debe llevarse a cabo a 35 °C, mientras que todos los demás pasos experimentales se pueden realizar en RT. - Conecte 10-15 cm de tubo nuevo a la jeringa y extraiga la solución de tubulina en el tubo.
- Presione suavemente el émbolo de la jeringa hasta que haya una pequeña gota de líquido en el extremo del tubo. Esto evitará que el aire entre en el dispositivo microfluídico cuando el tubo esté conectado.
- Conecte el tubo a la entrada del dispositivo microfluídico.
- Presione lentamente el émbolo de la jeringa hasta que la mayor parte, pero no toda, la solución haya volado a través del tubo. Dejar una pequeña cantidad de líquido en el tubo asegurará que no se fuerce aire inadvertidamente a través del tubo. Desconecte el tubo de entrada del dispositivo microfluídico.
- Imagen a la frecuencia deseada durante 10-15 minutos o hasta que las extensiones sean lo suficientemente largas como para doblarse. Por lo general, las imágenes se realizan a 488 nm cada 5 s y a 561 nm cada 60 s hasta que las extensiones tengan al menos 5-10 μm de largo (~15 min).
NOTA: A esta concentración de tubulina, los microtúbulos pueden cambiar estocásticamente entre períodos de polimerización y despolimerización; Esto es de esperarse, pero en general, las extensiones de los microtúbulos se alargarán49.
9. Extensiones estabilizadoras de microtúbulos (10-15 min)
- Combine Taxol, 2x solución antidecoloración y BRB80 para lograr una solución final que contenga 10 μM de taxol y antidecoloración a una concentración de trabajo 1x.
NOTA: Mantenga la solución de taxol en hielo hasta ~ 30 s antes de la introducción, momento en el que retire la solución del hielo y caliéntela en la mano hasta RT. Esto evitará la despolimerización de las extensiones de microtúbulos, que es un proceso dependiente de la temperatura. - Conecte 10-15 cm de tubo nuevo a la jeringa y extraiga la solución de taxol en el tubo.
- Presione suavemente el émbolo de la jeringa hasta que haya una pequeña gota de líquido en el extremo del tubo. Esto evitará que el aire entre en el dispositivo microfluídico cuando el tubo esté conectado.
- Conecte el tubo a la entrada del dispositivo microfluídico.
- Presione el émbolo de la jeringa hasta que la mayor parte, pero no toda, la solución haya volado a través del tubo. Dejar una pequeña cantidad de líquido en el tubo asegurará que no se fuerce aire inadvertidamente a través del tubo.
- Repita los pasos 9.2-9.5 dos veces en rápida sucesión. En este caso, se puede utilizar el mismo trozo de tubo.
NOTA: Taxol promueve la nucleación de novo de microtúbulos a partir de la tubulina en solución, y estos microtúbulos pueden aterrizar en la superficie del canal microfluídico e interferir con la obtención de imágenes/flexión posterior. Debido a esto, la solución de taxol debe fluir a través del dispositivo rápidamente y en múltiples iteraciones para eliminar la mayor cantidad de tubulina libre del dispositivo lo más rápido posible. - Verifique que los microtúbulos cultivados a partir de semillas aún estén presentes y estabilizados en el dispositivo.
10. Flexión, extensiones de microtúbulos estabilizados (10 - 15 min)
NOTA: Las extensiones de microtúbulos estabilizadas ahora se pueden doblar usando un controlador de flujo. En este caso, se utilizó un sistema de desplazamiento de presión positiva regulado (Elveflow OB1 MK3+) para hacer fluir la solución desde un vial de origen hermético a través de un caudalímetro hasta el microfluídico. Dependiendo de los detalles de la configuración del controlador de flujo disponible, se pueden realizar modificaciones en los siguientes pasos.
- Configure el controlador de flujo y el equipo asociado según los protocolos específicos del fabricante/sitio, utilizando tubos para conectar el vial de origen a la entrada del medidor de flujo y la salida del medidor de flujo a la entrada microfluídica, pero aún no conecte el tubo al dispositivo microfluídico.
- Inserte ~ 200 μL de la solución de taxol de 10 μM en un vial de origen que se pueda conectar a la configuración del controlador de flujo. Esta configuración utiliza conexiones Luer-lock para crear un sello hermético.
- Encienda el sistema de control de flujo y cebe la tubería para eliminar el aire. Esto evitará que el aire entre en el dispositivo microfluídico cuando el tubo esté conectado.
- Después de que la tubería se haya cebado a través del medidor de flujo y haya una pequeña gota de fluido en el extremo de la tubería, apague el sistema de control de flujo.
- Conecte el tubo a la entrada del dispositivo microfluídico. Utilice una entrada perpendicular a la entrada utilizada para introducir las semillas de microtúbulos y crezca las extensiones de microtúbulos para doblarse ortogonalmente.
- Doble las extensiones iniciando y deteniendo el flujo al caudal o presión deseados. Una presión de 30 mbar es el estándar para este protocolo que utiliza un flujo oscilatorio de período de 5 s. Imagine la flexión durante este tiempo, normalmente cada 0,1 s a 488 nm y cada 10 s a 561 nm.
NOTA: Esto completa el ensayo básico de flexión de microtúbulos. Todos los equipos y reactivos se pueden limpiar/desechar de acuerdo con los protocolos específicos del fabricante/sitio.
Resultados
Justificación del diseño de dispositivos microfluídicos
El diseño del dispositivo microfluídico en este estudio se guió por varias características clave (Figura 2), que se basan y mejoran el diseño tradicional de celda de flujo simple. Cabe destacar que el dispositivo microfluídico tiene un volumen interno de ~160 nL, significativamente menor que el volumen de ~10 μL de las celdas de flujo más tradicionales47, lo que permite un uso más controlado de reactivos potencialmente valiosos, como los componentes de proteínas purificadas. Debido a que el controlador de flujo microfluídico contiene dos canales de regulación, el dispositivo se desarrolló asumiendo que solo dos puertos de entrada/salida tendrían control de presión en un momento dado. Si se desea, se pueden implementar más canales controlados por presión.
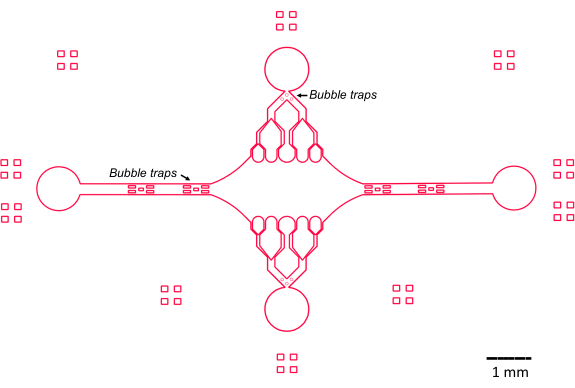
Figura 2: Esquema del diseño del dispositivo microfluídico. Las marcas rectangulares en la periferia son para ayudar visualmente a ver la periferia de los canales. Haga clic aquí para ver una versión más grande de esta figura.
La cámara central rectangular del dispositivo sirve como el área principal de imagen donde se adhieren las semillas de microtúbulos y las extensiones de microtúbulos se polimerizan a partir de estas semillas. La cámara está intersectada por un canal de flujo a cada lado, con canales rectos a lo largo del eje x que sirven como entrada y salida para facilitar el intercambio rápido de la solución de reacción. El canal de entrada de microtúbulos también se utiliza para introducir semillas de microtúbulos en la cámara, con un flujo laminar que da como resultado la unión de la semilla a la superficie del vidrio a lo largo de la dirección del flujo. En la dirección perpendicular (eje y), los canales de flujo se ramifican en canales más pequeños hacia la cámara, similar a algunos de los diseños anteriores 25,28,36,39. La geometría de ramificación es especialmente adecuada para estudiar las propiedades mecánicas de los microtúbulos. El flujo de una solución hacia la cámara central desde una dirección perpendicular a la orientación de las semillas de microtúbulos permite fuerzas de flexión inducidas por el flujo en ángulos casi normales. Además, la inclusión de una geometría de ramificación con muchos canales de flujo más pequeños facilita una aplicación de fuerza más homogénea en un área amplia de la cámara central, lo que no se logra con una simple geometría de flujo de un solo canal. De esta manera, el motivo de ramificación, aunque aparentemente más complicado, puede reducir la complejidad general en la determinación de la fuerza impartida a los microtúbulos (Figura 3). Este diseño también cuenta con múltiples líneas de simetría, lo que permite la facilidad de uso y la oportunidad de evaluar la flexión desde varias direcciones (por ejemplo, superior frente a inferior).
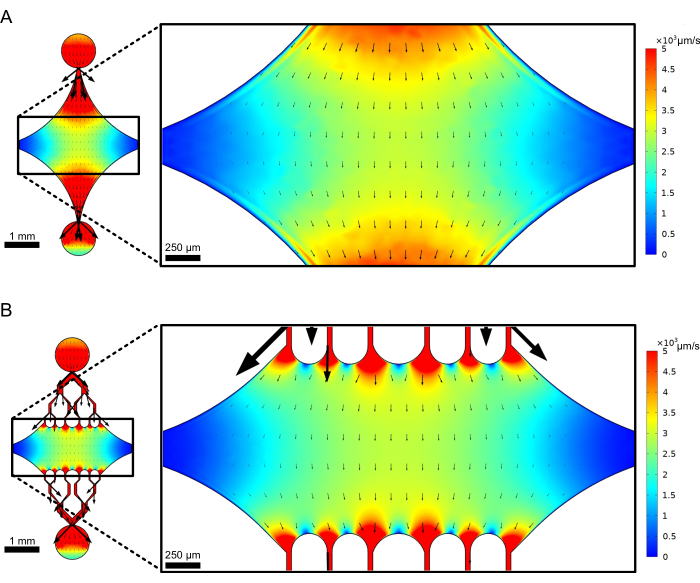
Figura 3: La inclusión de un motivo de ramificación da como resultado una gran área de flujo similar. Simulaciones de dos diseños de dispositivos bajo flujo en estado estacionario: uno sin canales ramificados (A) y otro con canales ramificados (B). Las flechas denotan la dirección del flujo local y son proporcionales a la magnitud del flujo. La coloración de la superficie denota la velocidad de la línea central. Las imágenes de la derecha muestran una sección ampliada del dispositivo donde los microtúbulos (no mostrados) orientados a lo largo del eje x estarían sujetos a fuerzas de flexión de un fluido que fluye por el puerto superior y sale por el puerto inferior. La incorporación de canales ramificados aumenta el área relativa sujeta a campos de velocidad similares sin aumentar el volumen de reactivo requerido. Esta cifra ha sido modificada con permiso de Rogers (2022)14. Haga clic aquí para ver una versión más grande de esta figura.
En particular, el dispositivo también implementa una serie de trampas de burbujas en los canales de flujo de entrada y salida para evitar que las burbujas de aire ingresen a la cámara central de imágenes. Específicamente, elegimos incluir matrices de micropilares dentro de la trayectoria del flujo para bloquear el paso de las burbujas de aire debido a la tensión superficial (Figura 2)46. Además, para evitar el arrastre de aire, diseñamos los bordes dentro del dispositivo como curvas suaves, en lugar de tener ángulos oblicuos. En conjunto, estas características de diseño reducen la posibilidad de burbujas de aire y aumentan la robustez del dispositivo.
Fabricación de dispositivos microfluídicos
La determinación de los parámetros adecuados para crear el maestro de dispositivo requirió cierta optimización. Como se ha observado anteriormente, este fotorresistente es muy sensible a los parámetros clave de funcionamiento, como la iluminación ambiental y las tasas de calentamiento y enfriamiento durante las etapas de fotolitografía50. Por ejemplo, si el maestro se enfrió demasiado rápido después del calentamiento, podrían desarrollarse grietas térmicas en la fotorresistencia. Esto no es deseable, ya que las grietas pueden comprometer la integridad del canal. Si bien las grietas podían resolverse recalentando la resistencia a una temperatura cercana a su temperatura de transición (~115 °C), descubrimos que permitir que el maestro se enfriara a temperatura ambiente en la placa calefactora era la forma más sólida de evitar el agrietamiento. Además, el exceso de luz ambiental puede dar lugar a una exposición involuntaria de la fotorresistencia, debilitándola y haciendo que las propias características del dispositivo (que deben permanecer en la oblea después del revelado) sufran un desprendimiento parcial durante el paso de revelado. Por esta razón, recomendamos que el paso de desarrollo se realice el día después de los pasos de horneado posterior a la exposición y enfriamiento ambiental durante la noche. Además, siempre que el maestro del dispositivo no esté en uso, recomendamos guardarlo en un área oscura o envuelto en papel de aluminio para evitar la degradación con el tiempo. Una vez determinados estos parámetros, el proceso de fotolitografía fue altamente repetible (Figura 4).
Después de crear el maestro, se moldeó el PDMS líquido sobre el maestro, lo que permitió que el PDMS se curara y creara una impresión negativa de las características del maestro. Descubrimos que la fundición del PDMS a un grosor de 2-3 mm permitía una fácil manipulación de los dispositivos; por el contrario, si se recubría con rotación para lograr un espesor en el rango de μm, el PDMS era propenso a romperse o autoadherirse, lo que dificultaba la manipulación. Además, una capa de PDMS más gruesa permite una conexión más fácil de la tubería, ya que la tubería permanecerá en los puertos de entrada / salida sin la necesidad de un sellador o abrazadera.
Por último, mientras que los ensayos tradicionales de celda de flujo para estas aplicaciones biológicas a menudo utilizan cubreobjetos de vidrio que se han limpiado previamente con una solución de piraña (peróxido de hidrógeno y ácido sulfúrico) y luego se han silanizado, descubrimos que los cubreobjetos tratados con una limpieza con plasma prolongada y un lavado con alcohol isopropílico eran adecuados para nuestros propósitos47. Otras aplicaciones, como la obtención de imágenes de una sola molécula, pueden requerir un tratamiento más extenso con cubreobjetos.

Figura 4: Proceso de fotolitografía. (A) La máscara con el diseño deseado (máscara hecha de cromo grabado sobre vidrio). (B) Ligero agrietamiento de la fotorresistencia en la oblea de silicio debido al estrés térmico (las flechas resaltan algunas grietas). Estas grietas a menudo se extienden por toda la oblea. (C) El maestro desarrollado. (D) La configuración microfluídica en el microscopio. Los componentes individuales están etiquetados en verde. Haga clic aquí para ver una versión más grande de esta figura.
Crecimiento, estabilización y flexión de los microtúbulos
Las semillas de microtúbulos cultivadas por GMPCPP sirven como sitios de nucleación para que las extensiones de microtúbulos polimericen y son estables contra la despolimerización durante varias horas a temperatura ambiente. Las semillas se unieron al cubreobjetos de vidrio en el canal microfluídico utilizando un anticuerpo anti-rodamina47. A continuación, se cultivaron extensiones dinámicas de microtúbulos en presencia de tubulina soluble (marcada con fluorescencia pero no conjugada con rodamina) y GTP. De esta manera, los sitios de nucleación de las semillas se unieron al cubreobjetos de vidrio, pero las extensiones no. Durante el período de crecimiento de extensión de 15 minutos, las extensiones de microtúbulos polimerizaron y despolimerizaron estocásticamente, como se esperaba debido a su inestabilidad dinámica intrínseca49. Después de este período de crecimiento, se llevó a cabo un lavado de Taxol de 10 μM para eliminar cualquier resto de tubulina de la solución y estabilizar las extensiones de microtúbulos que se habían formado. La estabilización es clave, ya que las extensiones de los microtúbulos se despolimerizarían tras el agotamiento de la tubulina. Además de unirse y estabilizar el polímero de microtúbulos, también se ha demostrado que Taxol afecta la mecánica del polímero de microtúbulos y puede inducir curvatura en las extensiones de microtúbuloslineales 51,52,53,54. Los resultados que se muestran aquí reflejaron estas observaciones; Sin embargo, el curvamiento de las extensiones de los microtúbulos no es deseable, ya que esto da como resultado fuerzas desiguales impartidas a lo largo de la red durante la flexión. Por lo tanto, solo se utilizaron los microtúbulos que permanecieron relativamente rectos después de la estabilización para el análisis de flexión. Alternativamente, después del período de crecimiento inicial, se puede utilizar un período de crecimiento secundario con una solución de tubulina y GMPCPP (en lugar del GTP inicial) para crear "tapas" estables en los extremos de crecimiento de la red de microtúbulos y evitar la despolimerización55.
A continuación, los microtúbulos se doblaron fluyendo en la solución tampón utilizando el sistema de control de presión para mantener una presión constante aguas arriba (Figura 5, Video complementario 1). De esta manera, podríamos aproximar el flujo local que experimentan los microtúbulos. Al hacer fluir el fluido desde la parte superior y fuera del puerto inferior del dispositivo, se pretendía que la orientación del flujo fuera perpendicular a la orientación de la siembra.
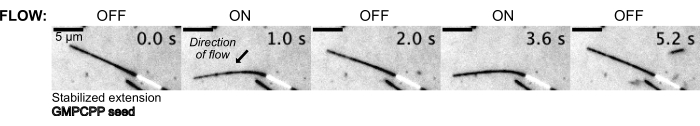
Figura 5: La configuración microfluídica se puede utilizar para doblar microtúbulos estabilizados. Los microtúbulos en estado de reposo después de la estabilización con paclitaxel se doblan durante el flujo pulsátil. Una presión constante aguas arriba de 30 mbar impulsa el flujo (la flecha denota la dirección del flujo). Haga clic aquí para ver una versión más grande de esta figura.
Determinación del perfil de flujo en el dispositivo microfluídico
La velocidad de la línea central en el microfluídico se puede simular computacionalmente utilizando el software COMSOL (software de simulación, Figura 6A). Sin embargo, los microtúbulos se adhieren al cubreobjetos de vidrio para la microscopía TIRF dentro de ~ 100 nm de la superficie. Por lo tanto, la velocidad experimentada por el microtúbulo no es la misma que la predicha en la simulación 2D. Para aproximar el flujo local experimentado por los microtúbulos, utilizamos la ecuación general de Navier-Stokes para un flujo de fluido incompresible en una dimensión:
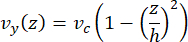
Aquí, z es la altura de los microtúbulos en el dispositivo, h es la altura total del dispositivo y vc es la velocidad de la línea central en el dispositivo. Por definición del sistema, el origen z es el centro del dispositivo (Figura 6B). Usando esta definición y una altura de canal de 13 μm, la altura de los microtúbulos se aproxima como z = -6,4 μm. La resolución de esta ecuación produce una estimación de la velocidad del fluido local experimentada por los microtúbulos:

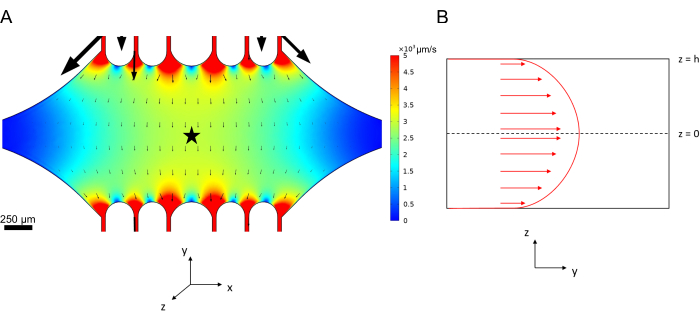
Figura 6: Definición del sistema para el análisis del flujo de fluido del fluido que ingresa al dispositivo por el puerto superior y sale por el puerto inferior (puertos no mostrados). (A) Simulación del campo de velocidad de la línea central a escala como en la Figura 3B. La estrella indica el área de interés del panel B. (B) Representación de la sección transversal del dispositivo. El perfil de flujo de fluido completamente desarrollado está en la dirección y con una velocidad de línea central vc en z = 0 y una condición de contorno sin deslizamiento en las paredes. Tenga en cuenta que las flechas de este panel no deben escalar con respecto al campo de velocidad real que se muestra en el panel A. Esta cifra ha sido modificada con permiso de Rogers (2022)14. Haga clic aquí para ver una versión más grande de esta figura.
Más allá de las simulaciones, la velocidad del fluido se puede controlar mediante un controlador de flujo basado en un caudal volumétrico en lugar de mantener la presión. Además, el caudal local en cada dispositivo se puede determinar directamente mediante la inclusión de perlas fluorescentes y el control de su velocidad, aliviando así cualquier variabilidad de muestra a muestra.
Modelado computacional y demostraciones de gradiente
Finalmente, realizamos simulaciones computacionales en combinación con experimentos para demostrar la factibilidad de usar este dispositivo para experimentos de alto rendimiento. Junto con la capacidad de doblar microtúbulos en múltiples direcciones gracias a la simetría del dispositivo, las simulaciones mostraron que el dispositivo puede mantener gradientes precisos, lo que permite la investigación simultánea de múltiples condiciones experimentales (Figura 7A). Los experimentos preliminares (métodos no mencionados explícitamente como parte de esta publicación) utilizando tinte fluorescente en solución demostraron consistencia con las predicciones computacionales (Figura 7B). Además, demostramos con éxito la partición de diferentes proteínas en diferentes áreas del dispositivo mediante el crecimiento simultáneo de extensiones de microtúbulos con diferentes etiquetas fluorescentes (Figura 8). Hasta donde sabemos, esta es la primera aplicación de la microfluídica de alto rendimiento a las investigaciones de microtúbulos. Esta característica de este dispositivo se puede utilizar para reducir el tiempo y las cantidades de reactivos necesarios y, al mismo tiempo, mejorar la robustez experimental. Por ejemplo, los efectos de diferentes proteínas o distintas concentraciones de proteínas individuales en la mecánica y la dinámica de los microtúbulos se pueden investigar simultáneamente en un solo dispositivo.
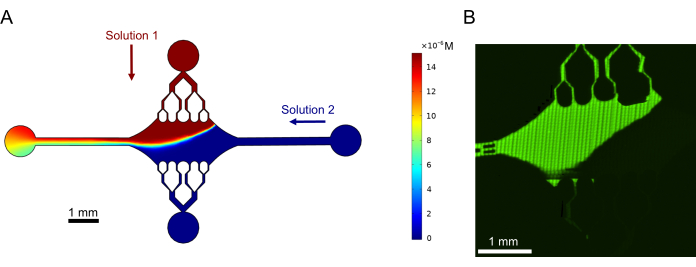
Figura 7: Formación de gradiente. (A) Simulación de un gradiente de dos soluciones que ingresan al dispositivo a la misma presión de entrada (50 mbar) y concentración (15 μM). Los puertos de entrada para cada solución se indican con flechas de colores (una solución en el puerto superior y otra solución en el puerto derecho), y los dos puertos restantes sirven como salidas. El mapa de calor muestra el perfil de concentración de la solución superior. El estado estacionario se logró a t = 5 s. (B) Generación experimental de un gradiente similar utilizando colorante fluorescente en solución en el puerto superior y tampón en el puerto derecho. La imagen es una capa ráster creada uniendo cada campo de visión (80 μm × 80 μm) para resolver toda el área del dispositivo. Esta cifra ha sido modificada con permiso de Rogers (2022)14. Haga clic aquí para ver una versión más grande de esta figura.
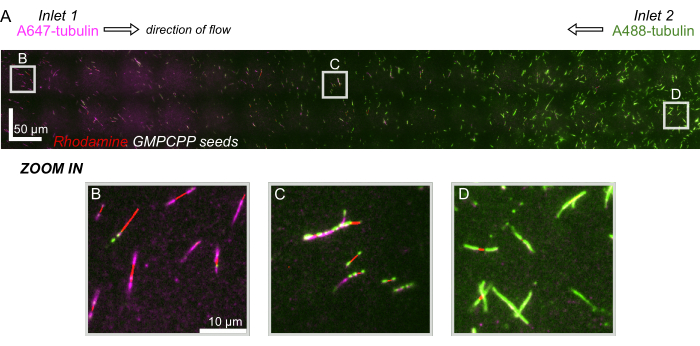
Figura 8: Demostración de un gradiente de proteínas en el dispositivo microfluídico. La tubulina marcada con AlexaFluor647 (magenta) se voló en la entrada 1, y la tubulina marcada con AlexaFluor488 (verde) se voló en la entrada 2 del dispositivo a concentraciones y caudales iguales. El flujo se activó y apagó en incrementos de 90 s para permitir la polimerización de la tubulina a partir de semillas GMPCPP estabilizadas (rojo) mientras se inhibía la mezcla. (A) Capa ráster a gran escala hecha uniendo campos de visión (80x80 μm) para resolver toda la longitud del dispositivo. Las letras designan la ubicación relativa de los campos de visión individuales en los paneles siguientes. La barra de escala es de 50 μm en las posiciones X e Y. (B) Campo de visión cerca de la entrada 1 del dispositivo, donde las extensiones están compuestas predominantemente por tubulina marcada con A647. (C) Campo de visión cerca de la mitad del dispositivo, donde las extensiones están compuestas por una mezcla de tubulinas marcadas, como se predijo. (D) Campo de visión cerca de la parte inferior del dispositivo, donde las extensiones se componen predominantemente de tubulina marcada con A488. Haga clic aquí para ver una versión más grande de esta figura.
En la Figura complementaria 1 se muestra un diagrama de flujo de proceso (PFD) para la configuración experimental de microfluídica en un microscopio.
Figura complementaria 1: Un diagrama de flujo de proceso (PFD) para la configuración experimental de microfluídica en un microscopio. Haga clic aquí para descargar este archivo.
Video complementario 1. La configuración microfluídica se puede utilizar para doblar microtúbulos estabilizados. Los microtúbulos en estado de reposo después de la estabilización con paclitaxel se doblan durante el flujo pulsátil. Una presión constante aguas arriba de 30 mbar impulsa el flujo. Velocidad de reproducción de video 10 fps. Haga clic aquí para descargar este archivo.
Archivo complementario 1: Un archivo CAD del diseño de la máscara microfluídica. Haga clic aquí para descargar este archivo.
Discusión
El objetivo principal de este protocolo fue diseñar y fabricar un dispositivo microfluídico adecuado para la investigación de la mecánica de los microtúbulos in vitro. El diseño se basó en el deseo de utilizar los beneficios intrínsecos de los dispositivos microfluídicos basados en PDMS, al tiempo que incluía una combinación de características que permitirían una experimentación robusta y personalizable de alto rendimiento.
Este objetivo se ha logrado con éxito, dando como resultado protocolos de fabricación y pautas generales que pueden servir de base para futuros usuarios de este sistema. La inclusión de trampas de burbujas redundantes en el dispositivo disminuye la probabilidad de desnaturalización de proteínas debido a la presencia de burbujas de aire. Si bien todavía tenemos que desenchufar y volver a enchufar los tubos en el dispositivo, estas trampas de burbujas reducen la probabilidad de fracaso experimental. Las mejoras futuras en la configuración microfluídica podrían reducir aún más la cantidad de manipulaciones manuales de tubos realizadas durante un experimento. Además, la integración del dispositivo microfluídico con un software de control de flujo automatizado permite una personalización significativa de las condiciones experimentales al tiempo que reduce la posibilidad de error manual. Hemos demostrado el rendimiento exitoso del dispositivo fabricando el dispositivo y luego creciendo, estabilizando y doblando extensiones de microtúbulos en el dispositivo mediante un flujo automático regulado por el controlador. Además, al establecer un gradiente de distintas soluciones de tubulina marcadas con fluorescencia dentro del mismo dispositivo, demostramos que se pueden ejecutar múltiples condiciones simultáneamente en un solo dispositivo. Con la ayuda de técnicas de análisis y modelado computacional, nuestro sistema puede sondear y determinar las propiedades biomecánicas de los microtúbulos, como la rigidez a la flexión 52,56,57,58,59.
Las posibles mejoras futuras facilitarían un sistema aún más robusto y el análisis experimental asociado. En primer lugar, la deposición, la exposición y el horneado de la fotorresistencia fueron parámetros cruciales que demostraron cierta variabilidad. Los tamaños de características relativamente altos del SPR photoresist requirieron un calentamiento y enfriamiento muy graduales para evitar el agrietamiento térmico, que podría arruinar los dispositivos. Si bien se intentaron dispositivos más delgados, encontramos problemas con la manipulación de estos tamaños de características más pequeños. La atención al detalle y la paciencia son cruciales para replicar dispositivos de este grosor con SPR photoresist. Se pueden utilizar diferentes fotorresistencias para resolver este problema, dependiendo de la disponibilidad.
En conjunto, el dispositivo y el protocolo microfluídicos permiten una gama de configuraciones experimentales con capacidades de prueba más robustas y de alto rendimiento que los ensayos de celda de flujo anteriores47. Además, los experimentos pueden automatizarse mediante controladores de caudal para mantener perfiles de caudal precisos o gradientes de concentración en el dispositivo, reduciendo la variabilidad inherente a los usuarios manuales. Las aplicaciones potenciales futuras de esta configuración incluyen la investigación de los efectos de las proteínas asociadas a los microtúbulos en la rigidez de la flexión, la dinámica, el daño y la reparación de la red de los microtúbulos, así como las interacciones biomecánicas de los microtúbulos y los filamentos de actina 54,60,61,62,63,64,65,66,67,6869,70. La integración de la microfabricación, el control de flujo automatizado y las técnicas de modelado y análisis computacional crea un sistema versátil adecuado para estudiar el citoesqueleto celular in vitro.
Divulgaciones
Los autores no tienen conflictos de intereses. Los autores divulgan el uso de ChatGPT-4o OpenAI para la revisión y corrección de textos.
Agradecimientos
Estamos agradecidos por el apoyo y los recursos proporcionados por el Instituto Vanderbilt de Ciencia e Ingeniería a Nanoescala (VINSE), donde se llevó a cabo una parte de esta investigación. Este trabajo fue parcialmente financiado a través de una subvención NIH NIGMS a M. Zanic (R35 GM1192552) y una subvención NSF ID 2018661 a M. Zanic. M. Rogers recibió apoyo de la subvención de GM08320 T32 de los NIH y un premio de financiación piloto VINSE. L. Richardson cuenta con el apoyo de la subvención n.º 1937963 de NSF GRFP. Los autores también desean agradecer a la Dra. Alice Leach, David Schaffer, la Dra. Christina McGahan y todo el laboratorio de Zanic por su asistencia y apoyo.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.6 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mm standard biopsy punch | Integra LifeSciences | 33-31A-P/25 | |
| 100x/1.49 numerical aperture TIRF objective | Nikon | ||
| 22 x 22 mm glass coverslips | ThorLabs | CG15CH | |
| 3" single side polished silicon wafers | University Wafer | 447 | |
| 4" Petri dish | Any brand | ||
| 450 µL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter, Inc. | 345843 | Referred to as 'airfuge tube' in the protocol |
| 488-, 561, and 640-nm solid state lasers | Nikon | ||
| A-95 Fixed-Angle Rotor | Beckman Coulter, Inc. | 347595 | |
| Acetone | Any brand | ||
| Airfuge Air-Driven Ultracentrifuge | Beckman Coulter, Inc. | 347854 | Referred to as 'airfuge' in the protocol |
| Alexa Fluor 488 Microscale Protein Labeling Kit | Thermo Fisher Scientific | A30006 | |
| Aluminum foil | Any brand | ||
| Andor iXon Ultra EM-CCD | Nikon | ||
| Andor NEO sCMOS | Nikon | ||
| AutoCAD | Autodesk | Generic versions can be used | |
| Bovine brain unlabeled tubulin (purified) | N/A | Made in house, but can be purchased | |
| Casein | MilliporeSigma | C7078 | |
| Catalase | MilliporeSigma | C9322 | |
| Clean Dry Air (CDA) (pressurized gas) | Any brand | ||
| Compressed air supply | Any brand | Connects to the microfluidic flow controller | |
| COMSOL Multiphysics software | COMSOL, Inc. | ||
| Custom brass stage adapter | N/A | Made in house to fit our 22 mm x 22 mm coverslips onto the microscope | |
| De-ionized water | Any brand | ||
| Dessicator | Any brand | ||
| D-glucose | MilliporeSigma | G7528 | |
| Dithiothreitol (DTT) | MilliporeSigma | D0632 | |
| EGTA | MilliporeSigma | 324626 | |
| Elveflow Smart Interface (ESI) software | Elveflow | ||
| Flangeless PFA fittings with ETFE ¼”-28 to 1/16” outer diameter ferrules | Darwin Microfluidics | CIL-XP-245X | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack |
| Fluiwell 4-Channel 2 mL Low Pressure | Fluigent | 14002001 | Used to connect the flow control system to the the micrewtubes. Also refered to as 'pressurized reservoir rack' |
| Fume hood | Any brand | ||
| Glucose oxidase | MilliporeSigma | G6125 | |
| GMPCPP | Jena Bioscience | NU-405L | |
| Guanosine triphosphate (GTP) | MilliporeSigma | G8877 | |
| Hot plate | Any brand | ||
| HS-625 high-speed emission filter wheel | Finger Lakes Instrumentation | ||
| ImageJ software | N/A | Open access | |
| Incubator | Any brand | ||
| Isopropyl alcohol | Any brand | ||
| Karl Suss MA-6 mask aligner | SUSS MicroTec | ||
| Magnesium chloride | MilliporeSigma | 1.05833 | |
| MATLAB software | MathWorks | ||
| MEGAPOSIT SPR 220 7.0 photoresist | Dow, Inc. | ||
| Microfluidic Fittings 6-40 to 1/4"-28 Adapters Kit | Darwin Microfluidics | LVF-KFI-08 | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack (Fluiwell rack) |
| Microfluidic Fittings Female Luer Lock Adapter Kit | Darwin Microfluidics | LVF-KFI-04 | Used to connect the syringe to the tubing |
| Microfluidic flow controller | Elveflow | OB1 MK3+ | |
| Microfluidic flow sensor | Elveflow | MFS3 | This flow sensor range is 0-80 μL |
| MICROPOSIT MF-319 developer | Dow, Inc. | ||
| Microscope | Nikon | Eclipse Ti | |
| NIS-Elements software | Nikon | ||
| Nitrogen (pressurized gas) | Any brand | ||
| Objective heater | Tokai Hit | ||
| One-Piece Fingertight 10-32 Coned Fitting for 1/16" OD Tubing | Darwin Microfluidics | CIL-F-120X | Used to connect the syringe to the tubing |
| Paclitaxol (Taxol) | Tocris Bioscience | 1097 | |
| Photolithography masks | N/A | Made by an external party using our designs | |
| PIPES | Thermo Fisher Scientific | 172615000 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Plasma flowmeter system | Harrick Plasma | PDC-FMG | Integrates with plasma cleaner to enable flow control of pressurized gas |
| Plastic bulb pipet | Any brand | ||
| Pluoronic F-127 | MilliporeSigma | P2443 | Referred to as 'poloxomer 407' in the protocol |
| Potassium chloride | Research Products International | P41000 | |
| Saint Gobain Performance Plastics Tube Tygon .020 ID | Thermo Fisher Scientific | 50-206-8921 | Refered to as '1.5 mm tubing' and 'tubing' in the protocol |
| Scalpel | Any brand | ||
| Spin coater | Cost Effective Equipment, LLC. | 200x | This model may be discontinued |
| Standard pipets and tip sets | Any brand | ||
| Standard plastic syringe | Any brand | We used a 10 mL Luer-slip syringe | |
| Sylgard 184 silicone elastomer kit | Dow, Inc. | Referred to as 'PDMS' and 'curing agent' in the protocol | |
| T339 Micrewtube with Lip Seal and Flat Screw Cap | Medline Industried, LP. | T339 | Referred to as 'source vial' in the protocol. We used both 0.5 mL and 1.5 mL sizes |
| TAMRA, SE; 5-(and-6)-Carboxytetramethylrhodamine, Succinimidyl Ester | Invitrogen | C1171 | Referred to as 'TTR' in the protocol |
| Trichloro(1H, 1H, 2H, 2H-perfluorooctyl) silane | MilliporeSigma | 448931 | |
| Trion Phantom RIE ICP | Trion Technology, Inc. | This plasma cleaner is only used in Step 1.1 of the protocol. Another plasma cleaner, like the one used for PDMS bonding, can be used instead; we just prefer the much lower vacuum achievable by this system for cleaning the silicon wafer | |
| TRITC Polyclonal Antibody | Thermo Fisher Scientific | A6397 | Referred to as 'anti-rhodamine antibody' in the protocol |
| Tweezers | Any brand | ||
| Vacuum pump | Any brand |
Referencias
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Phys Today. 54 (6), 42(2001).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev Mod Phys. 77, 977(2005).
- Beebe, D. J., Mensing, G. A., Walker, G. M. Physics and applications of microfluidics in biology. Annu Rev Biomed Eng. 4, 261-286 (2002).
- Ng, J. M. K., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. Electrophoresis. 23 (20), 3461-3473 (2010).
- Dellaquila, A. Five Short Stories on The History of Microfluidics. , https://www.elveflow.com/microfluidic-reviews/general-microfluidics/history-of-microfluidics/ (2025).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: Microfluidics in drug discovery. Nat Rev Drug Discov. 5 (3), 210-218 (2006).
- Neužil, P., Giselbrecht, S., Länge, K., Huang, T. J., Manz, A. Revisiting lab-on-a-chip technology for drug discovery. Nat Rev Drug Discov. 11 (8), 620-632 (2012).
- Manz, A., Graber, N., Widmer, H. M. Miniaturized total chemical analysis systems: a novel concept for chemical sensing. Sens Actuators B: Chem. 1 (1-6), 244-248 (1990).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Knight, J. Microfluidics: Honey, I shrunk the lab. Nature. 418 (6897), 474-475 (2002).
- Photolithographic fabrication techniques for transistors which are an integral part of a printed circuit. Nall, J. R., Lathrop, J. W. 1957 International Electron Devices Meeting, Washington, DC, USA, , (1957).
- Rogers, M. The design and fabrication of a two-layer microfluidic device for studying microtubules in vitro [Master's Thesis]. , Vanderbilt University. Nashville, TN. (2022).
- Lee, J. B., Choi, K. H., Yoo, K. Innovative SU-8 lithography techniques and their applications. Micromachines. 6 (1), 1-18 (2015).
- Kim, P., et al. Soft lithography for microfluidics: A Review. Biochip J. 2 (1), 1-11 (2008).
- Venkatesan, S. u, Jerald, J., Asokan, P., Prabakaran, R. A Comprehensive Review on Microfluidics Technology and its Applications. Recent Advances in Mechanical Engineering. , Springer. Singapore. 235-245 (2020).
- Minteer, S. Microfluidic Techniques: Reviews and Protocols. , Humana Press. New Jersey. (2006).
- Mitra, S. K., Chakraborty, S. Microfluidics and Nanofluidics Handbook: Fabrication, Implementation, and Applications. , Taylor and Francis Group. Florida. (2016).
- Alberts, B., et al. Molecular Biology of the Cell. , Garland Science. New York. (2014).
- Howard, J. Mechanics of Motor Proteins and the Cytoskeleton. , Springer. Heidelberg. (2001).
- Hawkins, T., Mirigian, M., Selcuk Yasar, M., Ross, J. L. Mechanics of microtubules. J Biomech. 43 (1), 23-30 (2010).
- Gardel, M. L., Kasza, K. E., Brangwynne, C. P., Liu, J., Weitz, D. A. Chapter 19: Mechanical Response of Cytoskeletal Networks. Methods Cell Biol. 89, 487-519 (2008).
- Caporizzo, M. A., Prosser, B. L. The microtubule cytoskeleton in cardiac mechanics and heart failure. Nat Rev Cardiol. 19 (6), 364-378 (2022).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nat Mater. 14 (11), 1156-1163 (2015).
- Chu, S. H., et al. A microfluidic device for in situ fixation and super-resolved mechanosensation studies of primary cilia. Biomicrofluidics. 13 (1), 014105(2019).
- Geisterfer, Z. M., Zhu, D. Y., Mitchison, T. J., Oakey, J., Gatlin, J. C. Microtubule growth rates are sensitive to global and local changes in microtubule plus-end density. Curr Biol. 30 (15), 3016-3023 (2020).
- Schaedel, L., et al. Lattice defects induce microtubule self-renewal. Nat Phys. 15 (8), 830-838 (2019).
- Aher, A., et al. CLASP mediates microtubule repair by restricting lattice damage and regulating tubulin incorporation. Curr Biol. 30 (11), 2175-2183 (2020).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. ELife. 5, e13470(2016).
- Fourniol, F. J., et al. Micropattern-guided assembly of overlapping pairs of dynamic microtubules. Methods Enzymol. 540, 339-360 (2014).
- Vleugel, M., Roth, S., Groenendijk, C. F., Dogterom, M. Reconstitution of basic mitotic spindles in spherical emulsion droplets. J Vis Exp. (114), e54278(2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Mol Biol Cell. 27 (22), 3563-3573 (2016).
- VanDelinder, V., Brener, S., Bachand, G. D. Mechanisms underlying the active self-assembly of microtubule rings and spools. Biomacromolecules. 17 (3), 1048-1056 (2016).
- Roth, S., Gârlea, I. C., Vleugel, M., Mulder, B. M., Dogterom, M. Reconstitution of basic mitotic spindles in cell-like confinement. bioRxiv. , (2019).
- Xu, Z., et al. Microtubules acquire resistance from mechanical breakage through intralumenal acetylation. Science. 356 (6335), 328-332 (2017).
- Fanalista, F., et al. Shape and size control of artificial cells for bottom-up biology. ACS Nano. 13 (5), 5439-5450 (2019).
- Velve-Casquillas, G., Costa, J., Carlier-Grynkorn, F., Mayeux, A., Tran, P. T. A fast microfluidic temperature control device for studying microtubule dynamics in fission yeast. Methods Cell Biol. 97, 185-201 (2010).
- Portran, D., Schaedel, L., Xu, Z., Théry, M., Nachury, M. V. Tubulin acetylation protects long-lived microtubules against mechanical ageing. Nat Cell Biol. 19 (4), 391-398 (2017).
- Huang, Y. M., Uppalapati, M., Hancock, W. O., Jackson, T. N. Microtubule transport, concentration and alignment in enclosed microfluidic channels. Biomed Microdevices. 9 (2), 175-184 (2007).
- Uppalapati, M., Huang, Y., Shastry, S., Jackson, T. N., Hancock, W. O. Microtubule Motors in Microfluidics. Methods in Bioengineering: Microfabrication and Microfluidics. , Artech House Publishers. Boston, MA. (2009).
- Sung, J. H., Shuler, M. L. Prevention of air bubble formation in a microfluidic perfusion cell culture system using a microscale bubble trap. Biomed Microdevices. 11 (4), 731-738 (2009).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360(2019).
- Nakayama, T., et al. Circumventing air bubbles in microfluidic systems and quantitative continuous-flow PCR applications. Anal Bioanal Chem. 386 (5), 1327-1333 (2006).
- Park, S., Cho, H., Kim, J., Han, K. -H. Lateral degassing method for disposable film-chip microfluidic devices. Membranes. 11 (5), 316(2021).
- Pereiro, I., Fomitcheva Khartchenko, A., Petrini, L., Kaigala, G. V. Nip the bubble in the bud: A guide to avoid gas nucleation in microfluidics. Lab Chip. 19 (14), 2296-2314 (2019).
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biol. 95, 221-245 (2010).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: Information from a slowly hydrolyzable analogue, GMPCPP. Mol Biol Cell. 3 (10), 1155-1167 (1992).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bartlett, N. W., Wood, R. J. Comparative analysis of fabrication methods for achieving rounded microchannels in PDMS. J Micromech Microeng. 26 (11), 115013(2016).
- Yang, C. P. H., Horwitz, S. B. Taxol®: The first microtubule stabilizing agent. Int J Mol Sci. 18 (8), 1733(2017).
- Gittes, F., Mickey, B., Nettleton, J., Howard, J. Flexural rigidity of microtubules and actin filaments measured from thermal fluctuations in shape. J Cell Biol. 120 (4), 923-934 (1993).
- VanBuren, V., Cassimeris, L., Odde, D. J. Mechanochemical model of microtubule structure and self-assembly kinetics. Biophys J. 89 (5), 2911-2926 (2005).
- Dye, R. B., Fink, S. P., Williams, R. C. Taxol-induced flexibility of microtubules and its reversal by MAP-2 and Tau. J Biol Chem. 268 (10), 6847-6850 (1993).
- Drechsel, D. N., Kirschnert, M. W. The minimum GTP cap required to stabilize microtubules. Curr Biol. 4 (12), 1053-1061 (1994).
- Wisanpitayakorn, P., Mickolajczyk, K. J., Hancock, W. O., Vidali, L., Tüzel, E. Measurement of the persistence length of cytoskeletal filaments using curvature distributions. Biophys J. 121 (10), 1813-1822 (2022).
- Mickey, B., Howard, J. Rigidity of microtubules is increased by stabilizing agents. J Cell Biol. 130 (4), 909-917 (1995).
- Brangwynne, C. P., et al. Bending dynamics of fluctuating biopolymers probed by automated high-resolution filament tracking. Biophys J. 93 (1), 346-359 (2007).
- Venier, P., Maggs, A. C., Carlier, M. F., Pantaloni, D. Analysis of microtubule rigidity using hydrodynamic flow and thermal fluctuations. J Biol Chem. 269 (18), 13353-13360 (1994).
- Felgner, H., Frank, R., Schliwa, M. Flexural rigidity of microtubules measured with the use of optical tweezers. J Cell Sci. 109 (Pt 2), 509-516 (1996).
- Felgner, H., et al. Domains of neuronal microtubule-associated proteins and flexural rigidity of microtubules. J Cell Biol. 138 (5), 1067-1075 (1997).
- Nishida, K., et al. Effects of three microtubule-associated proteins (MAP2, MAP4, and Tau) on microtubules' physical properties and neurite morphology. Sci Rep. 13, 8870(2023).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Brouhard, G. J., Rice, L. M. Microtubule dynamics: An interplay of biochemistry and mechanics. Nat Rev Mol Cell Biol. 19 (7), 451-463 (2018).
- Lawrence, E. J., Chatterjee, S., Zanic, M. More is different: Reconstituting complexity in microtubule regulation. J Biol Chem. 299 (12), 105398(2023).
- Howard, J., Hyman, A. A. Dynamics and mechanics of the microtubule plus end. Nature. 422 (6933), 753-758 (2003).
- Mehidi, A., Aumeier, C. Regulation of the microtubule network; the shaft matters. Curr Opin Syst Biol. 34, 100457(2023).
- Verhey, K. J., Ohi, R. Causes, costs and consequences of kinesin motors communicating through the microtubule lattice. J Cell Sci. 136 (5), jcs260735(2023).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nat Rev Mol Cell Biol. 20 (1), 38-54 (2019).
- Théry, M., Blanchoin, L. Microtubule self-repair. Curr Opin Cell Biol. 68, 144-154 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados