Method Article
开发基于微流体的方法,用于研究微管聚合物力学
摘要
该协议详细介绍了适用于研究微管聚合物力学的微流体装置的设计和制造。微加工、自动流量控制和计算建模技术的合成使灵活的系统非常适合 在体外探测细胞骨架。
摘要
在该协议中,我们描述了为研究微管聚合物力学而开发的微流体装置的设计和制造。该设计利用了基于聚二甲基硅氧烷 (PDMS) 的微流控装置的内在优势,并引入了多项功能,以实现稳健且可定制的高通量实验方法。开发的设备结合了冗余的气泡捕获功能,以防止有害气泡的发生。此外,该设备与自动流量控制系统连接,以减少人工干预并实现高通量分析。商业模拟软件用于更好地开发和理解使用该系统的流体传输。最后,我们通过在设备的不同部分生长具有不同荧光标记的微管延伸,展示了在单个设备中同时进行多个实验的能力。总体而言,这种微流体流动系统可用于探测微管聚合物力学,并为更广泛的微管 体外 研究提供实验设计的改进。微加工、自动流量控制和计算建模方法的合成使灵活的系统非常适合 在体外探测细胞骨架。
引言
微流体技术通过流体流动通道的复杂设计和制造,能够精确控制微小的液体体积,通常小于 1 微升 1,2。小规模的微流体器件产生了独特的工程现象。也就是说,雷诺数(流体流动中惯性力和粘性力之比的无量纲量度)很小,在微流体中通常约为 O(10) 或更低,这强调了粘性力在微流体设备中的重要性。此外,将对流传输与扩散传输进行比较的 Péclet 数表明,在微流体中,对流传输通常可以忽略不计 3,4,5。微流体中的这种扩散驱动的层流态是有利的,因为它通过保持精确的流体梯度来支持在单个设备上进行平行实验。
光刻技术仍然是制造微流体器件的主要方法 6,7,8。简而言之,此过程涉及创建微流体设计的“主”蚀刻模板(图 1)。制备光敏基板,微流体设计的光掩模选择性地将光刻胶区域暴露在紫外线辐射下。随后的蚀刻方法显影基板,产生设计的浮雕。聚二甲基硅氧烷 (PDMS) 通常浇铸并固化到母体上。然后,将采用设计缺点的固化 PDMS 从母版中取出并粘合到玻璃盖玻片上。整个制造过程通常需要 1-2 天,从而实现快速设计迭代和多个器件的生产。其他参考文献 1,2,3,10,11,12,13 中提供了软光刻和微纳加工工艺的详细综述。
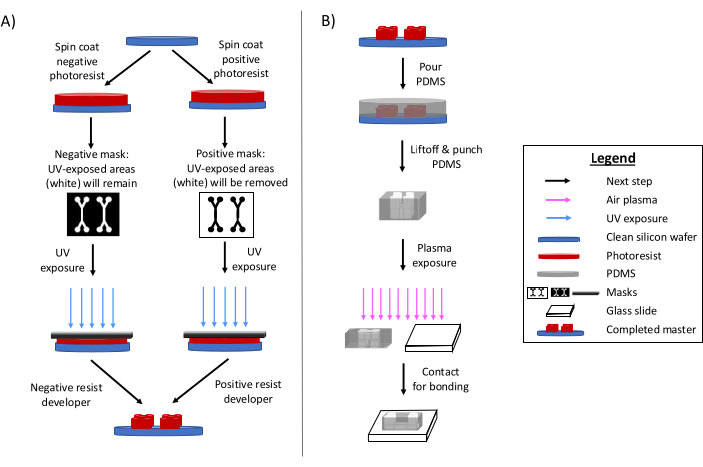
图 1:传统光刻工艺和微纳加工工艺概述。 (A) 传统光刻工艺和 (B) 微纳加工工艺。根据应用和所需的光刻胶特性,可以使用负性或正性光刻胶,即使它们会产生相同的设计母版。所需的特征高度或光刻胶熔化温度等特性有助于确定合适的光刻胶类型。此数字经 Rogers (2022)14 许可修改。 请单击此处查看此图的较大版本。
微流体的使用扩大了许多研究领域的可能性,其最近的影响是在生物科学中。鉴于其规模小,微流体技术允许精确管理有限的宝贵资源,例如细胞或蛋白质。更具影响力的是微流体系统模拟生理条件的可调性,例如基材刚度的改变、对样品施加的力,甚至电流的积分。此外,微流体的使用提供了并行作多种试剂的能力,并能够快速原型化和迭代改进系统设计。这些功能能够将整个实验室工作流程小型化到单个设备上,通常称为“芯片实验室”1,6,9,15,16,17,18,19。
微流体的细胞生物学应用之一是研究微管聚合物。微管是细胞骨架的重要组成部分,在细胞分裂和细胞内货物运输等过程中起着至关重要的作用20,21。作为细胞骨架中最坚硬的元素,微管表现出与有机玻璃相当的弹性模量22,23。它们强大的机械性能对各种细胞功能至关重要,包括心肌细胞收缩,它们在心脏的收缩期和舒张期周期性弯曲和放松24。微流控器件以前已被用于研究体外微管及其高级结构的特性。事实上,微流体已被用于探测微管聚合动力学、微管-微管相互作用以及微管相关蛋白对微管机械性能的影响 25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41。
虽然将微流体技术引入微管领域带来了许多令人兴奋的发现,但改进空间仍在于这些设备对微管研究的适应。在这项工作中,我们解决了研究微流体设备中微管时持续存在的两个特定限制:设备内形成气泡的可能性,通常是通过手动作微流体设备引入的,以及高通量分析的利用不足。首先,手动作(例如插拔管路)可能会将气泡形成引入通道。流通池内气泡的形成是灾难性的,因为气泡会使蛋白质变性,剪切微管聚合物,并对细胞培养物产生不利影响42,43。此外,设备中的尖角和斜角会导致表面润湿不均匀,增加了空气夹带的可能性。已经开发了许多技术来减少气泡的形成、持久性和影响;然而,气泡缓解方法的使用并不普遍 42,43,44,45,46。此外,尽管使用微流体技术的主要优势之一是高通量实验的能力,但微流体技术尚未用于扩大微管研究规模。微流体设备可以设计为在同一设备上并行测试多个实验条件。例如,流体梯度可用于引导不同微管相关蛋白或药物的流动,使其能够靶向递送到同一装置内分区微管的特定区域。
在这里,我们迭代设计了一个解决这些限制的微流体设备。我们提供设备制造的分步方案,从而使更广泛的受众能够在他们的微管研究中采用微流体技术。该设备设计结合了气泡捕获功能,并利用自动流量控制系统来减少人工干预,同时还可以在设备中实现溶液梯度以进行高通量分析。总之,这种微流体设计的开发可以促进对微管力学的更广泛研究和理解,同时为更广泛的微管研究领域的实验设计提供有价值的改进。
研究方案
注意:协议的这一部分详述的工作是在范德比尔特纳米科学与工程研究所 (VINSE) 核心 100 级洁净室中进行的。需要一个具有适当防护服和紫外线过滤照明的受控洁净室,以防止因湿度/环境照明条件而损坏设备,并防止颗粒污染。对硅晶片的所有作都应在硅晶片抛光面朝上的情况下进行。作晶圆时使用镊子,并尽量减少接触晶圆的表面以防止划伤。除非另有指示,否则在运输时和每天结束时,请将威化饼放在培养皿中并盖上盖子。
1. 光刻 (6 - 8 小时)
- 使用氧气 (O2) 或清洁干燥空气 (CDA) 等离子体在真空下(理想情况下,真空压力< 5 × 10-5 torr)对 3 英寸硅晶片进行等离子体清洁 5 分钟。
- 将硅晶片居中放在旋涂机上,以沉积光刻胶。
- 将 ~1-2 mL 的 SPR 220 7.0 光刻胶沉积到硅晶片的中心。
注意: 戴手套和护目镜处理光刻胶,并根据制造商/现场特定的方案进行处理。 - 根据制造商的自旋曲线,将光刻胶旋涂在硅晶片上至所需的厚度。通过以 1000 RPM 旋转 30 秒生成 ~13 μm 厚的层。然后,用丙酮清洁旋涂机上残留的光刻胶,并按照特定部位的方案进行处理。
注意:如果在旋涂后,晶圆没有均匀地涂覆光刻胶,请重复步骤 1.2-1.4。涂层不均匀可能是由于旋涂机上的晶圆不居中、使用的光刻胶太少和/或没有将光刻胶沉积到晶圆中心。 - 在尽可能少地接触晶片上的光刻胶的同时,将硅晶片转移到设置为 70 °C 的热板上。
- 在热板上孵育硅片,每 3-5 分钟将温度升高 10 °C,直到温度达到 115 °C。
- 关闭热板,让硅晶片冷却至温度低于 65 °C。
注意:加热和冷却步骤缓慢进行,以防止光刻胶出现热裂纹,这种情况在此厚度下很常见。如果确实发生热裂纹,通常可以通过重新加热硅晶片并减慢冷却速度来纠正它们。 - 使用镊子将冷却的硅晶片转移到掩模对准器上,并按照制造商/现场特定的协议将硅晶片和相应的光掩模加载到掩模对准器中。
注意:光掩版由外部方使用指定的设计制造,该设计是使用 AutoCAD 创建的。有关蒙版设计渲染,请参阅 补充文件 1 。 - 按照制造商/现场特定的协议,将硅晶片暴露在紫外线 (UV) 辐射下特定时间(基于 UV 灯的功率)。此应用所需的能量为 ~400 mJ/cm2,并通过以下公式计算曝光时间:
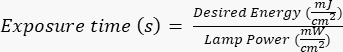 。
。 - 曝光后,从掩模对准器中取出硅晶片,让光刻胶通过空气流通再水化 4 小时。确保盖上培养皿盖,以便空气流通,但将培养皿放置在不太可能接触颗粒物的区域。
注意:在此补液时间内可以休息 4 小时,但建议在同一天继续该过程。 - 4 小时再水化后,将曝光的晶片转移到设置为 70 °C 的热板上。
- 在热板上孵育硅片,每 3-5 分钟将温度升高 10 °C,直到温度达到 115 °C。
- 让晶片在 115 °C 下孵育 10 分钟。
- 通过模制培养皿盖形状的铝箔片,为裸露的晶片创建一个绝缘“盖子”。
- 关闭热板并用铝箔盖住裸露的晶圆。让晶片在室温下冷却过夜。
注意:在曝光后孵育步骤中,光刻胶的热裂纹更为常见,这就是为什么建议缓慢冷却过夜的原因。这样就完成了制造第一天所需的步骤。建议在第二天继续下一部分。
2. 开发 (1 - 2 小时)
- 当准备好显影曝光的晶圆时,请获得一个干净的容器和合适的光刻胶显影剂。在这里,MF-319 显影剂与专用容器一起使用。
注意: 戴上手套和护目镜处理显影剂,将散装容器转移到辅助容器中,并根据制造商/现场特定的方案进行处理。 - 将足够的显影液倒入容器中,以完全浸没暴露的晶圆(实际体积因容器而异)。
- 将曝光的晶圆浸入显影剂中,等待所有不需要的光刻胶溶解。轻轻旋转/搅动容器有助于显影,直到除器件设计外,晶圆上几乎看不到残留光刻胶。
注意:可能需要多次更换显影液才能完全去除不需要的光刻胶,具体取决于使用的显影液的体积。 - 从显影溶液中取出显影的晶片,并用去离子 (DI) 水轻轻冲洗晶片的两侧 30 秒。
- 用氮气 (N2) 气体干燥显影的晶片。
- 将显影的晶片储存在干燥、凉爽环境中的培养皿中,直到准备好进一步使用。用铝箔包裹培养皿,以防止光刻胶因暴露在环境光下而降解。
注意:建议(但不要求)在同一天继续下一部分。
3. 硅烷化 (1 - 2 h)
- 将硅晶片转移到干燥器中。
- 将一个小铝容器(或一块折叠成容器形状的铝箔)放入干燥器中。
- 将 1 滴 (~50 μL) 三氯(1H、1H、2H、2H-全氟辛基)硅烷移入铝制容器中。
注意:戴手套和护目镜处理硅烷溶液,并根据制造商/现场特定方案进行处理。 - 关闭干燥器并打开真空吸尘器。
- 让干燥/硅烷化发生 1-2 小时。
- 硅烷化时间结束后,关闭真空并取回硅烷化晶圆。将硅烷化晶片储存在铝箔包裹的培养皿中,置于干燥、凉爽的环境中,直到准备好进一步使用。
注意:硅烷化可能需要在晶圆上定期重复,而在使用较薄 PDMS 层的器件上则需要更频繁地重复进行。如果在从晶圆上移除 PDMS 时发现 PDMS 粘附,则可能需要重新对晶圆进行硅化处理,并且应在从晶圆上移除所有 PDMS 后重复此过程。这样就完成了创建微流体设备主控器所需的步骤。主节点是稳定的,后续部分可以在需要时执行。
4. PDMS 沉积 (1 - 2 h)
注意:如果主站上有先前微加工的残留 PDMS,则必须在沉积新的 PDMS 之前去除残留的 PDMS。
- 在秤上,以 10:1 的重量比称量到容器 PDMS 和相关固化剂中。所需的总重量将根据所需的 PDMS 厚度和培养皿尺寸而变化。对于 4 英寸培养皿,~20 g PDMS 和 ~2 g 固化剂将产生 2-3 mm 的厚度。
注意:戴手套和护目镜处理 PDMS 溶液,并根据制造商/现场特定的方案进行处理。 - 使用塑料刮刀或其他适当工具将 PDMS 和固化剂在容器中混合 5 分钟。
- 将混合的 PDMS 容器转移到干燥器中进行脱气。
- 关闭干燥器并打开真空吸尘器。PDMS 中将开始出现气泡。
- 让干燥/脱气 30 分钟。根据 PDMS 的使用量和容器形状,实际时间可能会有所不同;一般终点是 PDMS 中几乎没有气泡。
- 脱气后,关闭真空并取回 PDMS 容器。
- 将混合和脱气的 PDMS 倒入培养皿中的母版上。
- 将母版在密闭培养皿中于 65 °C 孵育过夜,以使 PDMS 完全固化。
注:这样就完成了 PDMS 沉积的步骤。建议让 PDMS 在培养箱中固化过夜。然后 PDMS 是稳定的,因此可以在需要时执行后续部分。
5. PDMS 设备组装 (1 - 2 小时)
- 取回已固化 PDMS 的设备主设备、一对镊子、带手动柱塞的标准 1.5 mm 活检打孔器和手术刀/剃须刀片。
注意: 小心处理刀片,切勿割向自己或他人。建议使用自动回缩或安全刀片。 - 在器件特征周围,从层主控上剪下矩形的 PDMS。确保每个 PDMS 的每一侧都有一些空间,位于器件特征的两侧,以促进良好的粘合接触,同时确保每个部件都适合其自身的 22 mm × 22 mm 玻璃盖玻片。
注意: 请务必避免接触 PDMS 的底面(具有特征的一侧),因此请始终使用镊子处理 PDMS 的边缘。此外,切勿将 PDMS 的特征面朝下放在任何表面上。不使用时,请将 PDMS 的功能面朝上存放在密闭容器中,直到需要为止。 - 使用干净的 1.5 mm 孔冲头在 PDMS 的工件上打入口和出口孔。将器件 PDMS 打孔到牺牲 PDMS 的备用层中,而不是打入可能损坏打孔器的坚硬表面。
- 取回并用异丙醇 (IPA) 湿巾清洁 22 mm × 22 mm 玻璃盖玻片。
- 使用 CDA 等离子体在真空(压力< 0.5 Torr)下对 22 mm × 22 mm 盖玻片进行等离子清洁 5 分钟。这将去除盖玻片上的任何碎屑或有机涂层。
- 用 IPA 湿布擦拭 22 mm × 22 mm 玻璃盖玻片和 PDMS 的功能面。
- 将 PDMS(特征面朝上)和玻璃盖玻片(与之前清洁的同一面朝上)放入等离子清洁器中,并在真空(压力< 0.5 Torr)下使用 CDA 等离子体同时清洁 30 秒。
- 从等离子清洁器中取出玻璃盖玻片和 PDMS 设备。倒置 PDMS,使特征面朝下,然后将其放在玻璃盖玻片上。观察粘合情况,并根据需要轻轻按压 PDMS 以促进良好的接触。
- 将粘合的盖玻片在 65 °C 的密闭培养皿中孵育 3 分钟,以促进粘合。
注:等离子键合会改变玻璃盖玻片的疏水性,从而产生亲水表面。通过轶事证据观察到,在室温下孵育约 2 天后,盖玻片的原始疏水状态恢复。建议在等离子键合后 2 天内使用预制设备。这样就完成了微纳加工步骤。这些设备没有固定的保质期,但不使用时应存放在阴凉干燥的地方。
6. 微流体流道准备 (1 h)
- 将组装的微流体装置固定到干净的定制载物台适配器47 中。
- 取回注射器、Lour-lock 适配器和接头套圈,以及一根外径为 1.5 毫米的透明管(约 15-20 厘米长)。通过适配器将管路连接到注射器。
- 将另外三根管路连接到微流体设备出口(该管路不需要特定长度),并将这些管路的另一端引导至下游的废液瓶中。
- 使用注射器,根据以下步骤引入溶液来准备微流体装置。溶液的顺序和体积如下:50 μL BRB80 缓冲溶液,25 μL 抗罗丹明抗体溶液,等待 5 分钟,50 μL BRB80,25 μL 泊洛沙姆 407 (F127),等待 15 分钟,和 50 μL BRB80。有关示例,请参阅 表 1 。
- 将溶液从其源头抽入管路中。
注意:不要将溶液完全拉入注射器本身。溶液应仅保留在管路中。 - 轻轻按下注射器柱塞,直到管子末端出现一小滴液体。这将防止在连接管道时任何空气进入微流体装置。
- 将管道连接到微流体装置的入口。
- 慢慢按下注射器柱塞,直到大部分(但不是全部)溶液流过管道。在管路中留下少量液体将确保没有空气无意中被迫通过管路。在这些转移过程中观察管道和微流体通道,寻找任何气泡。
注:如果管道中出现气泡,请开始故障排除(尝试在气泡进入微流体设备之前将其去除,方法是在气泡到达之前拔下管道,然后在气泡通过后重新连接管道,等等)。 - 对下一个试剂重复步骤 6.4.1-6.4.4,直到所有试剂都通过。每种试剂都需要一根新的进样管,以防止源试剂交叉污染。一旦最终的 BRB80 洗涤完成,该装置将稳定数分钟。在入口处滴一滴 BRB80 溶液将防止设备干燥。
- 将溶液从其源头抽入管路中。
- 根据标准方案制备鸟苷-5'-[(α,β)-甲基烯基]三磷酸 (GMPCPP) 稳定的微管“种子”(TTR 标记比率为 ~25%)47,48。
- 通过混合相应数量(取决于储备浓度)的以下试剂,制备 2 倍工作浓度的成像缓冲溶液(“抗淬灭”),以产生其指定的最终浓度:补充有 40 mM 葡萄糖、40 μg/mL 葡萄糖氧化酶、16 μg/mL 过氧化氢酶、0.5 mg/mL 酪蛋白、50 mM 氯化钾和 10 mM 二硫苏糖醇 (DTT) 的 BRB80。该成像缓冲液用于延长光稳定性。有关示例,请参阅 表 2 。
- 在 BRB80 中以 1:1 的比例稀释一部分 2x 抗淬灭溶液,得到 1x 抗淬灭溶液。将此抗淬灭剂加热至室温 (RT);储备抗淬灭溶液应保存在冰上。
| 次序 | 试剂 | 体积稀释 | 洗涤体积 | 孵育时间 |
| 1 | BRB80 系列 | 不适用 | 50 微升 | 不适用 |
| 2 | 抗罗丹明抗体 | 在 BRB80 中按 1:50 的比例,混合均匀 | 25 微升 | 5 分钟 |
| 3 | BRB80 系列 | 不适用 | 50 微升 | 不适用 |
| 4 | 泊洛沙姆 407 (F127) | 1% 巴西雷亚尔 80 | 25 微升 | 15 分钟 |
| 5 | BRB80 系列 | 不适用 | 50 微升 | 不适用 |
表 1:微流体器件通道的准备顺序。
| 卷 | 试剂 | 库存集中 | 最终浓度 |
| 16 微升 | D-葡萄糖 | 2 米 | 80 毫米 |
| 16 微升 | 葡糖氧化酶 | 2 毫克/毫升 | 80 微克/毫升 |
| 16 微升 | 过氧化氢酶 | 0.8 毫克/毫升 | 32 微克/毫升 |
| 14 微升 | 酪蛋白 | 28 毫克/毫升 | 0.16 毫克/毫升 |
| 8 微升 | DTT | 1 米 | 20 毫米 |
| 40 微升 | 氯化钾 | 1 米 | 100 毫米 |
| 290 微升 | BRB80 系列 | 1 倍 | 不适用 |
| 400 微升 | FINAL(2 倍工作浓度) |
表 2:抗淬灭成像溶液配方(2 倍浓度)。
7. 将微管种子引入微流控(10 - 15 分钟)
- 将微流体设备连接到显微镜。
注意:由于微管稳定性与温度有关,因此建议在 35 °C 下进行成像实验。 - 将 10-15 cm 的新管子连接到注射器上,并将所需稀释的 GMPCPP 稳定的微管种子吸入管中。
注:对于该装置,~10 nM GMPCPP 微管种子是最佳浓度。 - 轻轻按下注射器柱塞,直到管子末端出现一小滴液体。这将防止在连接管道时任何空气进入微流体装置。
- 将管道连接到微流体装置的入口。
- 慢慢按下注射器柱塞,直到大部分(但不是全部)溶液流过管道。在管路中留下少量液体将确保没有空气无意中被迫通过管路。
- 从微流体装置和注射器上拆下入口管,并将一根新管连接到注射器上。
- 将 BRB80 吸入管路中。
- 重复步骤 7.3-7.6 以从设备中洗出未结合的微管种子。
- 使用全内反射荧光 (TIRF) 显微镜观察种子与微流体表面的附着。单个视野中的理想种子数量将根据应用和视野大小而变化,但通常,每 80 μm × 80 μm 视野 ~10-20 颗种子是最佳的。根据需要重复步骤 7.2-7.9,直到达到所需的种子密度。
注意:为了监测微管种子密度,应使用间歇性短光曝光(100 毫秒),因为溶液中尚不存在抗淬灭剂。 - 一旦达到适当的结合种子密度,将一根新的入口管连接到注射器上。
- 将温热的 1x 抗淬灭溶液吸入管中,然后重复步骤 7.3-7.6。
注意:现在在设备中使用抗淬灭溶液后,光稳定性显着提高,并且设备稳定。但是,仍然建议尽量减少暴露在激光下。
8. 从种子中生长微管延伸部分(15 - 30 分钟)
- 将荧光标记的微管蛋白、未标记的微管蛋白、2x 抗淬灭溶液、鸟苷-5'-三磷酸 (GTP) 和 BRB80 混合,得到含有 14 μM 微管蛋白(荧光标记比为 7%)、1x 工作浓度的抗淬灭蛋白和 1 mM GTP 的最终溶液。
注:如果使用不同浓度或不同标记百分比的微管蛋白,则需要调整每种试剂的体积以达到所需的最终浓度和标记比率。将微管蛋白溶液在冰上放置至 ~30 秒后,此时将溶液从冰上取下并用手加热至 RT。这将有助于微管延伸的聚合,这是一个与温度相关的过程。事实上,微管聚合应在 35 °C 下进行,而所有其他实验步骤都可以在 RT 下进行。 - 将 10-15 cm 的新管路连接到注射器上,并将微管蛋白溶液吸入管中。
- 轻轻按下注射器柱塞,直到管子末端出现一小滴液体。这将防止在连接管道时任何空气进入微流体装置。
- 将管道连接到微流体装置的入口。
- 慢慢按下注射器柱塞,直到大部分(但不是全部)溶液流过管道。在管路中留下少量液体将确保没有空气无意中被迫通过管路。从微流体设备上拆下入口管。
- 以所需频率成像 10-15 分钟或直到延伸足够长以弯曲。通常,每 5 秒以 488 nm 和每 60 秒 561 nm 进行成像,直到延伸段至少 5-10 μm 长(~15 分钟)。
注意:在这种微管蛋白浓度下,微管可以在聚合和解聚期之间随机切换;这是意料之中的,但总体而言,微管延伸部分将伸长49。
9. 稳定微管延伸(10-15 分钟)
- 将紫杉醇、2x 抗淬灭溶液和 BRB80 混合,得到含有 10 μM 紫杉醇和 1x 工作浓度抗淬灭剂的最终溶液。
注意:将紫杉醇溶液在冰上放置至 ~30 秒后再引入,此时将溶液从冰上取下并用手加热至 RT。这将防止微管延伸物的解聚,这是一个与温度相关的过程。 - 将 10-15 cm 的新管路连接到注射器上,并将紫杉醇溶液吸入管中。
- 轻轻按下注射器柱塞,直到管子末端出现一小滴液体。这将防止在连接管道时任何空气进入微流体装置。
- 将管道连接到微流体装置的入口。
- 按下注射器柱塞,直到大部分(但不是全部)溶液流过管道。在管路中留下少量液体将确保没有空气无意中被迫通过管路。
- 快速连续重复步骤 9.2-9.5 两次。在这种情况下,可以使用同一根管子。
注意:紫杉醇促进微管在溶液中从 头 微管成核,这些微管可以落在微流体通道的表面并干扰随后的成像/弯曲。因此,紫杉醇溶液应快速并多次迭代流过装置,以尽快从装置中去除尽可能多的游离微管蛋白。 - 验证从种子生长的微管是否仍然存在并在设备中稳定。
10. 弯曲稳定微管扩展 (10 - 15 分钟)
注意:稳定的微管延伸部分现在可以使用流量控制器弯曲。在这里,使用可调节的正压置换系统 (Elveflow OB1 MK3+) 将溶液从气密源小瓶流过流量计并进入微流体。根据可用流量控制器设置的具体情况,可能会对以下步骤进行修改。
- 根据制造商/现场特定的协议设置流量控制器和相关设备,使用管道将源小瓶连接到流量计入口,将流量计出口连接到微流体入口,但不要将管道连接到微流体设备。
- 将 ~200 μL 的 10 μM 紫杉醇溶液插入可连接到流量控制器装置的源样品瓶中。此设置使用 Luer 锁连接来形成气密密封。
- 打开流量控制系统并灌注管道以去除任何空气。这将防止在连接管道时任何空气进入微流体装置。
- 当管道通过流量计灌注并且管道末端有一小滴液体后,关闭流量控制系统。
- 将管道连接到微流体装置的入口。使用垂直于用于引入微管种子的入口并生长微管延伸部分,以便正交弯曲。
- 通过以所需的流速或压力启动和停止流量来弯曲扩展。30 mbar 的压力是该协议的标准,使用 5 s 周期的振荡流。在此期间对弯曲进行成像,通常在 488 nm 处每 0.1 秒一次,在 561 nm 处每 10 秒一次。
注意:这完成了基本的微管弯曲测定。所有设备和试剂都可以根据制造商/现场特定的方案进行清洁/处置。
结果
微流体器件设计原理
本研究中微流体装置的设计以几个关键特征(图 2)为指导,这些功能建立并改进了传统的简单流通池设计。值得注意的是,微流控装置的内部体积为 ~160 nL,明显小于更传统的流动池的 ~10 μL 体积47,允许更可控地使用可能珍贵的试剂,例如纯化的蛋白质成分。由于微流体流量控制器包含两个调节通道,因此开发该装置时假设在任何给定时间只有两个入口/出口具有压力控制。如果需要,可以实施更多的压力控制通道。
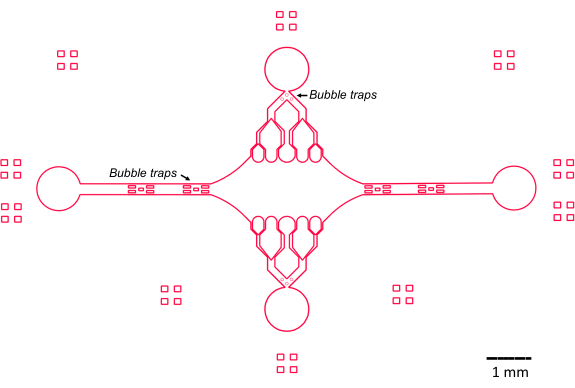
图 2:微流体器件设计示意图。 外围的矩形标记用于视觉辅助查看通道的外围。 请单击此处查看此图的较大版本。
中央矩形装置室用作连接微管种子的主要成像区域,微管延伸部分从这些种子中聚合出来。腔室每侧都有一个流道相交,沿 x 轴的直线通道用作入口和出口,以促进反应溶液的快速交换。微管入口通道也用于将微管种子引入腔室,层流导致晶种沿流动方向与玻璃表面结合。在垂直(y 轴)方向上,流道分支成朝向腔室的较小通道,类似于以前的一些设计25、28、36、39。分支几何形状特别适合研究微管的机械特性。将溶液从垂直于微管种子方向的方向流入中央腔室,允许以接近法向角产生流诱导弯曲力。此外,包含具有许多较小流道的分支几何形状有助于在中心腔的较大区域上施加更均匀的力,这是简单的单通道流几何形状无法实现的。通过这种方式,分支基序虽然看起来更复杂,但可以降低确定施加给微管的力的整体复杂性(图 3)。这种设计还具有多条对称线,易于使用,并有机会从多个方向(例如,顶部与底部)评估弯曲。
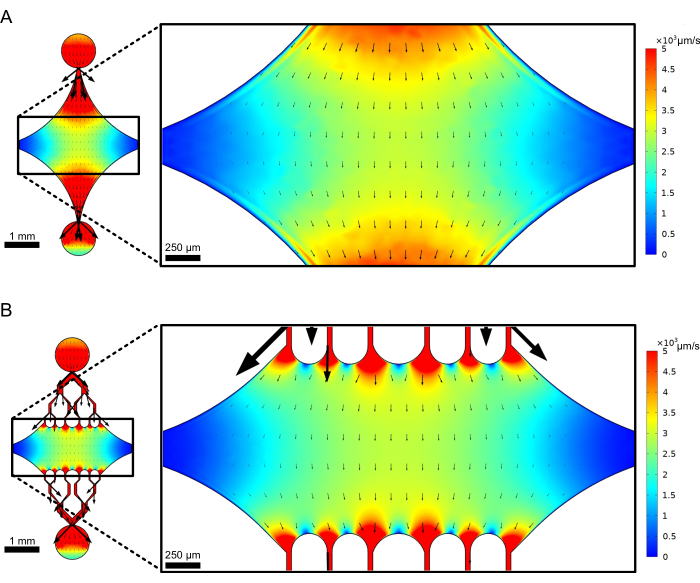
图 3:包含分支基序会导致大面积的相似流。 稳态流下的两种器件设计仿真:一种无分支通道 (A),另一种有分支通道 (B)。箭头表示局部流向,与流量大小成正比。表面着色表示中心线速度。右侧的图像显示了设备的放大部分,其中沿 x 轴定向的微管(未显示)将受到来自流入顶部端口和底部端口的流体的弯曲力。加入支化通道会增加受相似速度场影响的相对面积,同时不会增加所需试剂的体积。此数字经 Rogers (2022)14 许可修改。 请单击此处查看此图的较大版本。
值得注意的是,该设备还在入口和出口流道中实施了一系列气泡捕集器,以防止气泡进入中央成像室。具体来说,我们选择在流路中包括微柱阵列,以阻止气泡由于表面张力而流过(图 2)46。此外,为了防止空气夹带,我们将设备内部的边缘设计为平滑曲线,而不是斜角。总之,这些设计特点减少了气泡的可能性,并提高了器件的稳健性。
微流控器件制造
确定用于创建 device master 的适当参数需要一些优化。如前所述,这种光刻胶对关键作参数非常敏感,例如环境照明以及光刻步骤50 期间的加热和冷却速率。例如,如果母版在加热后冷却得太快,光刻胶中就会产生热裂纹。这是不可取的,因为裂缝会损害通道完整性。虽然可以通过将光刻胶重新加热到接近其转变温度 (~115 °C) 的温度来解决裂纹,但我们发现让母版在热板上常冷是防止开裂的最有效方法。此外,过多的环境光会导致光刻胶的意外曝光,削弱光刻胶,并导致器件特征本身(显影后应保留在晶圆上)在显影步骤中部分剥离。因此,我们鼓励在暴露后烘烤和环境过夜冷却步骤后的第二天执行显影步骤。此外,每当不使用 Device Master 时,我们建议将其存放在黑暗区域或用铝箔包裹,以防止随着时间的推移而退化。一旦确定了这些参数,光刻过程就具有高度可重复性(图 4)。
创建母版后,将液体 PDMS 浇铸在母版顶部,使 PDMS 固化并形成母版特征的负面印记。我们发现,以 2-3 mm 的厚度铸造 PDMS 可以轻松作器件;相比之下,如果旋涂以达到 μm 范围内的厚度,PDMS 容易撕裂或自粘,从而使作变得困难。此外,较厚的 PDMS 层允许更轻松地插入管路,因为管路将保留在入口/出口中,而无需密封剂或卡箍。
最后,虽然用于这些生物应用的传统流通池分析通常使用使用食人鱼溶液(过氧化氢和硫酸)进行预清洁然后硅烷化的玻璃盖玻片,但我们发现经过延长等离子清洁和 IPA 清洗处理的盖玻片适用于我们的目的47。其他应用(如单分子成像)可能需要更广泛的盖玻片处理。

图 4:光刻工艺。 (A) 具有所需设计的掩模(由蚀刻在玻璃上的铬制成的掩模)。(B) 由于热应力,硅晶片上的光刻胶出现轻微开裂(箭头突出显示了一些裂纹)。这些裂纹通常延伸到整个晶圆。(C) 开发的母版。(D) 显微镜上的微流体设置。单个组件标记为绿色。 请单击此处查看此图的较大版本。
微管生长、稳定和弯曲
GMPCPP 生长的微管种子作为微管延伸聚合的成核位点,并且本身在室温下可稳定数小时抵抗解聚。使用抗罗丹明抗体将种子结合到微流体通道中的玻璃盖玻片上 47。然后在可溶性微管蛋白 (荧光标记但未罗丹明偶联) 和 GTP 存在下生长动态微管延伸。以这种方式,种子成核位点连接到玻璃盖玻片上,但延伸部分没有。在 15 分钟的延伸生长期,微管延伸随机聚合和解聚,正如预期的那样,由于其固有的动态不稳定性49。在此生长期之后,进行 10 μM 紫杉醇洗脱,以消除溶液中残留的微管蛋白并稳定已形成的微管延伸。稳定性是关键,因为微管延伸部分会在微管蛋白耗尽时解聚。除了结合和稳定微管聚合物外,紫杉醇还被证明会影响微管聚合物力学,并可能在原本线性的微管延伸中诱导弯曲 51,52,53,54。此处显示的结果反映了这些观察结果;然而,微管延伸部分的卷曲是不可取的,因为这会导致在弯曲过程中沿晶格施加不均匀的力。因此,只有稳定后保持相对笔直的微管才用于弯曲分析。或者,在初始生长期之后,可以使用微管蛋白和 GMPCPP 溶液(而不是初始 GTP)的次生长期在微管晶格的生长端创建稳定的“帽”并防止解聚55。
然后使用压力控制系统在缓冲溶液中流动,使微管弯曲,以保持恒定的上游压力(图 5, 补充视频 1)。通过这种方式,我们可以近似微管所经历的局部流动。通过从底部设备端口流入和流出流体,流动方向应垂直于接种方向。
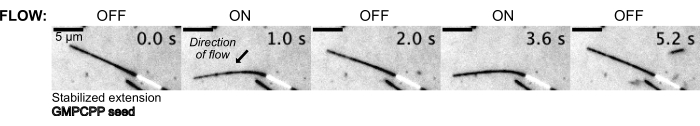
图 5:微流体装置可用于弯曲稳定的微管。 用紫杉醇稳定后处于静止状态的微管在搏动流动期间弯曲。30 mbar 的恒定上游压力驱动流动(箭头表示流动方向)。 请单击此处查看此图的较大版本。
确定微流体装置中的流动剖面
微流体中的中心线速度可以使用 COMSOL 软件(仿真软件, 图 6A)进行计算模拟。然而,微管附着在表面 ~100 nm 内用于 TIRF 显微镜的玻璃盖玻片上。因此,微管所经历的速度与 2D 仿真中预测的速度不同。为了近似微管所经历的局部流动,我们使用了一般的 Navier-Stokes 方程来表示一维的不可压缩流体流动:
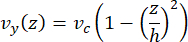
其中,z 是器件中微管的高度,h 是器件的总高度,vc 是器件中的中心线速度。根据系统的定义,z 原点是设备的中心(图 6B)。使用此定义和 13 μm 的通道高度,微管的高度近似为 z = -6.4 μm。求解此方程可得出微管所经历的局部流体速度的估计值:

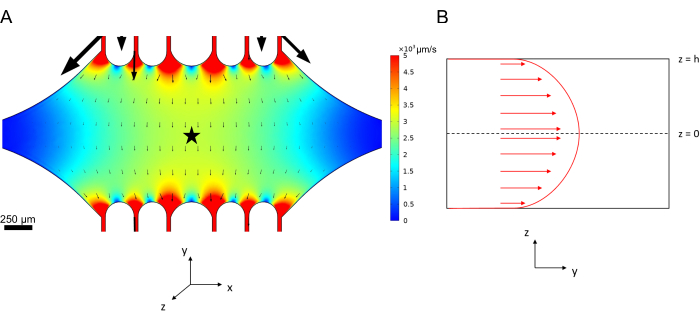
图 6:定义流体从顶部端口进入设备并从底部端口流出的流体流动分析系统(未显示端口)。 (A) 如图 3B 所示的缩放中心线速度场的模拟。星形表示面板 B 的感兴趣区域。(B) 设备的横截面表示。完全展开的流体流动剖面在 y 方向上,在 z = 0 处具有中心线速度 vc ,在壁上具有无滑移边界条件。请注意,此面板中的箭头不会相对于面板 A 中显示的实际速度场进行缩放。此数字经 Rogers (2022)14 许可修改。 请单击此处查看此图的较大版本。
除了模拟之外,还可以使用基于体积流量的流量控制器来控制流体速度,而不是保持压力。此外,通过包含荧光珠并监测其速度,可以直接确定每个装置中的局部流速,从而减轻样品间的任何差异。
计算建模和梯度演示
最后,我们进行了计算模拟和实验,以证明使用该设备进行高通量实验的可行性。由于设备的对称性,除了能够向多个方向弯曲微管外,模拟还表明该设备可以保持精确的梯度,从而能够同时研究多个实验条件(图 7A)。在溶液中使用荧光染料的初步实验(本出版物中未明确说明的方法)表明与计算预测一致(图 7B)。此外,我们通过同时生长具有不同荧光标记的微管延伸,成功地证明了不同蛋白质在设备不同区域的分配(图 8)。据我们所知,这是高通量微流体技术在微管研究中的第一个应用。该设备的这一功能可用于减少所需试剂的时间和数量,同时提高实验稳定性。例如,可以在单个设备中同时研究不同蛋白质或不同浓度的单个蛋白质对微管力学和动力学的影响。
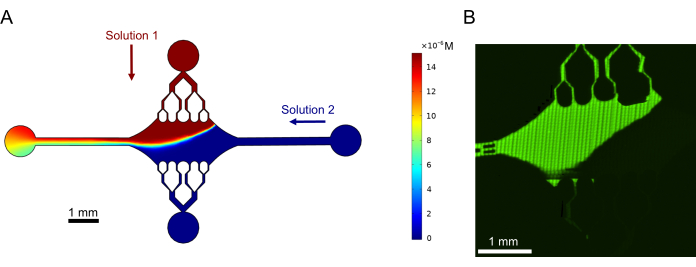
图 7:梯度形成。 (A) 模拟两种溶液在相同入口压力 (50 mbar) 和浓度 (15 μM) 下进入装置的梯度。每种溶液的入口端口用彩色箭头表示(一个溶液位于顶部端口,另一个溶液位于右侧端口),其余两个端口用作出口。热图显示顶部溶液的浓度分布。在 t = 5 s 时达到稳态。(B) 在顶部端口使用荧光染料溶液和右侧端口中的缓冲液实验生成相似的梯度。图像是通过拼接每个视场(80 μm × 80 μm)以解析整个器件区域而制成的光栅层。此数字经 Rogers (2022)14 许可修改。 请单击此处查看此图的较大版本。
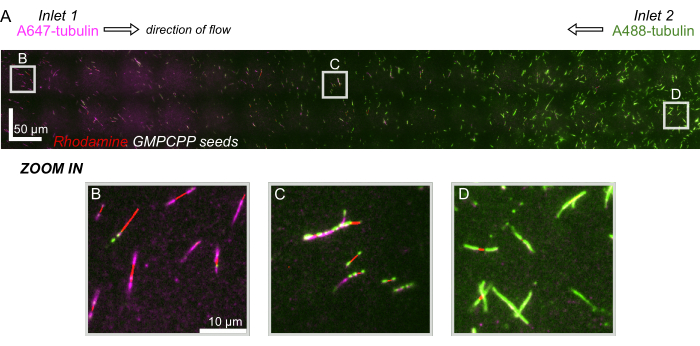
图 8:演示微流体装置中的蛋白质梯度。 AlexaFluor647 标记的微管蛋白(品红色)在进样口 1 中飞出,AlexaFluor488 标记的微管蛋白(绿色)以相同的浓度和流速在装置的进样口 2 中飞出。以 90 秒的增量振荡流速开/关,以允许稳定的 GMPCPP 种子(红色)的微管蛋白聚合,同时抑制混合。(A) 通过拼接视野 (80x80 μm) 制成的大比例尺光栅图层,以解析设备的整个长度。字母表示后续面板中各个视野的相对位置。比例尺在 X 和 Y 位置为 50 μm。(B) 装置入口 1 附近的视野,其中延伸部分主要由 A647 标记的微管蛋白组成。(C) 设备中间附近的视野,如预测的那样,延伸部分由标记的微管蛋白混合物组成。(D) 设备底部附近的视野,其中延伸部分主要由 A488 标记的微管蛋白组成。 请单击此处查看此图的较大版本。
显微镜上微流体实验装置的工艺流程图 (PFD) 如 补充图 1 所示。
补充图 1:显微镜上微流体实验装置的工艺流程图 (PFD)。请点击此处下载此文件。
补充视频 1.微流体设置可用于弯曲稳定的微管。用紫杉醇稳定后处于静止状态的微管在搏动流动期间弯曲。30 mbar 的恒定上游压力驱动流量。视频播放速率 10 fps。 请点击此处下载此文件。
补充文件 1:微流体掩模设计的 CAD 文件。请点击此处下载此文件。
讨论
该协议的主要目标是设计和制造适用于体外研究微管力学的微流体 装置。该设计基于利用基于 PDMS 的微流体设备的内在优势的愿望,同时还包括实现稳健和可定制的高通量实验的功能组合。
这一目标已经成功实现,从而产生了可以作为该系统未来用户的基础的制造协议和通用指南。在装置中包含多余的气泡阱可降低由于气泡的存在而导致蛋白质变性的可能性。虽然我们仍然在设备中拔出和重新插入管道,但这些气泡捕集器降低了实验失败的可能性。未来对微流体设置的改进甚至可以进一步减少实验期间手动作管道的数量。此外,微流体设备与自动流量控制软件的集成允许对实验条件进行重大定制,同时减少人为错误的可能性。我们通过制造该设备,然后使用自动控制器调节的流量在设备中生长、稳定和弯曲微管延伸部分,证明了该设备的成功性能。此外,通过在同一设备内建立不同荧光标记的微管蛋白溶液的梯度,我们表明可以在单个设备中同时运行多个条件。在计算建模和分析技术的帮助下,我们的系统可以探测和确定微管的生物力学特性,例如弯曲刚度 52,56,57,58,59。
未来潜在的改进将有助于建立更稳健的系统和相关实验分析。首先,光刻胶沉积、曝光和烘烤是表现出一些可变性的关键参数。SPR 光刻胶相对较高的特征尺寸需要非常缓慢的加热和冷却,以防止热开裂,这可能会损坏器件。虽然尝试了更薄的设备,但我们发现处理这些较小的特征大小存在问题。对细节的关注和耐心对于使用 SPR 光刻胶复制这种厚度的器件至关重要。根据可用性,可以使用不同的光刻胶来解决这个问题。
综上所述,这里的微流体设备和方案允许一系列实验设置,与以前的流通池检测相比,具有更强大、高通量的检测能力47。此外,可以使用流量控制器进行自动化实验,以保持设备中精确的流速曲线或浓度梯度,从而减少手动用户固有的可变性。该设置的未来潜在应用包括研究微管相关蛋白对微管弯曲刚度、动力学、晶格损伤和修复的影响,以及微管和肌动蛋白丝的生物力学相互作用 54,60,61,62,63,64,65,66,67,68,69,70。微加工、自动流量控制以及计算建模和分析技术的集成创建了一个适合在体外研究细胞骨架的多功能系统。
披露声明
作者没有利益冲突。作者披露了使用 ChatGPT-4o OpenAI 进行文本修订和校对。
致谢
我们感谢范德比尔特纳米科学与工程研究所 (VINSE) 提供的支持和资源,这项研究的一部分就是在那里进行的。这项工作部分由对 M. Zanic 的 NIH NIGMS 赠款 (R35 GM1192552) 和对 M. Zanic 的 NSF ID 2018661 赠款资助。M. Rogers 获得了 NIH T32 GM08320 资助和 VINSE 试点资助奖的支持。L. Richardson 得到了 NSF GRFP 第 1937963 号资助的支持。作者还要感谢 Alice Leach 博士、David Schaffer 博士、Christina McGahan 博士以及整个 Zanic 实验室的帮助和支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.6 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mm standard biopsy punch | Integra LifeSciences | 33-31A-P/25 | |
| 100x/1.49 numerical aperture TIRF objective | Nikon | ||
| 22 x 22 mm glass coverslips | ThorLabs | CG15CH | |
| 3" single side polished silicon wafers | University Wafer | 447 | |
| 4" Petri dish | Any brand | ||
| 450 µL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter, Inc. | 345843 | Referred to as 'airfuge tube' in the protocol |
| 488-, 561, and 640-nm solid state lasers | Nikon | ||
| A-95 Fixed-Angle Rotor | Beckman Coulter, Inc. | 347595 | |
| Acetone | Any brand | ||
| Airfuge Air-Driven Ultracentrifuge | Beckman Coulter, Inc. | 347854 | Referred to as 'airfuge' in the protocol |
| Alexa Fluor 488 Microscale Protein Labeling Kit | Thermo Fisher Scientific | A30006 | |
| Aluminum foil | Any brand | ||
| Andor iXon Ultra EM-CCD | Nikon | ||
| Andor NEO sCMOS | Nikon | ||
| AutoCAD | Autodesk | Generic versions can be used | |
| Bovine brain unlabeled tubulin (purified) | N/A | Made in house, but can be purchased | |
| Casein | MilliporeSigma | C7078 | |
| Catalase | MilliporeSigma | C9322 | |
| Clean Dry Air (CDA) (pressurized gas) | Any brand | ||
| Compressed air supply | Any brand | Connects to the microfluidic flow controller | |
| COMSOL Multiphysics software | COMSOL, Inc. | ||
| Custom brass stage adapter | N/A | Made in house to fit our 22 mm x 22 mm coverslips onto the microscope | |
| De-ionized water | Any brand | ||
| Dessicator | Any brand | ||
| D-glucose | MilliporeSigma | G7528 | |
| Dithiothreitol (DTT) | MilliporeSigma | D0632 | |
| EGTA | MilliporeSigma | 324626 | |
| Elveflow Smart Interface (ESI) software | Elveflow | ||
| Flangeless PFA fittings with ETFE ¼”-28 to 1/16” outer diameter ferrules | Darwin Microfluidics | CIL-XP-245X | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack |
| Fluiwell 4-Channel 2 mL Low Pressure | Fluigent | 14002001 | Used to connect the flow control system to the the micrewtubes. Also refered to as 'pressurized reservoir rack' |
| Fume hood | Any brand | ||
| Glucose oxidase | MilliporeSigma | G6125 | |
| GMPCPP | Jena Bioscience | NU-405L | |
| Guanosine triphosphate (GTP) | MilliporeSigma | G8877 | |
| Hot plate | Any brand | ||
| HS-625 high-speed emission filter wheel | Finger Lakes Instrumentation | ||
| ImageJ software | N/A | Open access | |
| Incubator | Any brand | ||
| Isopropyl alcohol | Any brand | ||
| Karl Suss MA-6 mask aligner | SUSS MicroTec | ||
| Magnesium chloride | MilliporeSigma | 1.05833 | |
| MATLAB software | MathWorks | ||
| MEGAPOSIT SPR 220 7.0 photoresist | Dow, Inc. | ||
| Microfluidic Fittings 6-40 to 1/4"-28 Adapters Kit | Darwin Microfluidics | LVF-KFI-08 | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack (Fluiwell rack) |
| Microfluidic Fittings Female Luer Lock Adapter Kit | Darwin Microfluidics | LVF-KFI-04 | Used to connect the syringe to the tubing |
| Microfluidic flow controller | Elveflow | OB1 MK3+ | |
| Microfluidic flow sensor | Elveflow | MFS3 | This flow sensor range is 0-80 μL |
| MICROPOSIT MF-319 developer | Dow, Inc. | ||
| Microscope | Nikon | Eclipse Ti | |
| NIS-Elements software | Nikon | ||
| Nitrogen (pressurized gas) | Any brand | ||
| Objective heater | Tokai Hit | ||
| One-Piece Fingertight 10-32 Coned Fitting for 1/16" OD Tubing | Darwin Microfluidics | CIL-F-120X | Used to connect the syringe to the tubing |
| Paclitaxol (Taxol) | Tocris Bioscience | 1097 | |
| Photolithography masks | N/A | Made by an external party using our designs | |
| PIPES | Thermo Fisher Scientific | 172615000 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Plasma flowmeter system | Harrick Plasma | PDC-FMG | Integrates with plasma cleaner to enable flow control of pressurized gas |
| Plastic bulb pipet | Any brand | ||
| Pluoronic F-127 | MilliporeSigma | P2443 | Referred to as 'poloxomer 407' in the protocol |
| Potassium chloride | Research Products International | P41000 | |
| Saint Gobain Performance Plastics Tube Tygon .020 ID | Thermo Fisher Scientific | 50-206-8921 | Refered to as '1.5 mm tubing' and 'tubing' in the protocol |
| Scalpel | Any brand | ||
| Spin coater | Cost Effective Equipment, LLC. | 200x | This model may be discontinued |
| Standard pipets and tip sets | Any brand | ||
| Standard plastic syringe | Any brand | We used a 10 mL Luer-slip syringe | |
| Sylgard 184 silicone elastomer kit | Dow, Inc. | Referred to as 'PDMS' and 'curing agent' in the protocol | |
| T339 Micrewtube with Lip Seal and Flat Screw Cap | Medline Industried, LP. | T339 | Referred to as 'source vial' in the protocol. We used both 0.5 mL and 1.5 mL sizes |
| TAMRA, SE; 5-(and-6)-Carboxytetramethylrhodamine, Succinimidyl Ester | Invitrogen | C1171 | Referred to as 'TTR' in the protocol |
| Trichloro(1H, 1H, 2H, 2H-perfluorooctyl) silane | MilliporeSigma | 448931 | |
| Trion Phantom RIE ICP | Trion Technology, Inc. | This plasma cleaner is only used in Step 1.1 of the protocol. Another plasma cleaner, like the one used for PDMS bonding, can be used instead; we just prefer the much lower vacuum achievable by this system for cleaning the silicon wafer | |
| TRITC Polyclonal Antibody | Thermo Fisher Scientific | A6397 | Referred to as 'anti-rhodamine antibody' in the protocol |
| Tweezers | Any brand | ||
| Vacuum pump | Any brand |
参考文献
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Phys Today. 54 (6), 42(2001).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev Mod Phys. 77, 977(2005).
- Beebe, D. J., Mensing, G. A., Walker, G. M. Physics and applications of microfluidics in biology. Annu Rev Biomed Eng. 4, 261-286 (2002).
- Ng, J. M. K., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. Electrophoresis. 23 (20), 3461-3473 (2010).
- Dellaquila, A. Five Short Stories on The History of Microfluidics. , https://www.elveflow.com/microfluidic-reviews/general-microfluidics/history-of-microfluidics/ (2025).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: Microfluidics in drug discovery. Nat Rev Drug Discov. 5 (3), 210-218 (2006).
- Neužil, P., Giselbrecht, S., Länge, K., Huang, T. J., Manz, A. Revisiting lab-on-a-chip technology for drug discovery. Nat Rev Drug Discov. 11 (8), 620-632 (2012).
- Manz, A., Graber, N., Widmer, H. M. Miniaturized total chemical analysis systems: a novel concept for chemical sensing. Sens Actuators B: Chem. 1 (1-6), 244-248 (1990).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Knight, J. Microfluidics: Honey, I shrunk the lab. Nature. 418 (6897), 474-475 (2002).
- Photolithographic fabrication techniques for transistors which are an integral part of a printed circuit. Nall, J. R., Lathrop, J. W. 1957 International Electron Devices Meeting, Washington, DC, USA, , (1957).
- Rogers, M. The design and fabrication of a two-layer microfluidic device for studying microtubules in vitro [Master's Thesis]. , Vanderbilt University. Nashville, TN. (2022).
- Lee, J. B., Choi, K. H., Yoo, K. Innovative SU-8 lithography techniques and their applications. Micromachines. 6 (1), 1-18 (2015).
- Kim, P., et al. Soft lithography for microfluidics: A Review. Biochip J. 2 (1), 1-11 (2008).
- Venkatesan, S. u, Jerald, J., Asokan, P., Prabakaran, R. A Comprehensive Review on Microfluidics Technology and its Applications. Recent Advances in Mechanical Engineering. , Springer. Singapore. 235-245 (2020).
- Minteer, S. Microfluidic Techniques: Reviews and Protocols. , Humana Press. New Jersey. (2006).
- Mitra, S. K., Chakraborty, S. Microfluidics and Nanofluidics Handbook: Fabrication, Implementation, and Applications. , Taylor and Francis Group. Florida. (2016).
- Alberts, B., et al. Molecular Biology of the Cell. , Garland Science. New York. (2014).
- Howard, J. Mechanics of Motor Proteins and the Cytoskeleton. , Springer. Heidelberg. (2001).
- Hawkins, T., Mirigian, M., Selcuk Yasar, M., Ross, J. L. Mechanics of microtubules. J Biomech. 43 (1), 23-30 (2010).
- Gardel, M. L., Kasza, K. E., Brangwynne, C. P., Liu, J., Weitz, D. A. Chapter 19: Mechanical Response of Cytoskeletal Networks. Methods Cell Biol. 89, 487-519 (2008).
- Caporizzo, M. A., Prosser, B. L. The microtubule cytoskeleton in cardiac mechanics and heart failure. Nat Rev Cardiol. 19 (6), 364-378 (2022).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nat Mater. 14 (11), 1156-1163 (2015).
- Chu, S. H., et al. A microfluidic device for in situ fixation and super-resolved mechanosensation studies of primary cilia. Biomicrofluidics. 13 (1), 014105(2019).
- Geisterfer, Z. M., Zhu, D. Y., Mitchison, T. J., Oakey, J., Gatlin, J. C. Microtubule growth rates are sensitive to global and local changes in microtubule plus-end density. Curr Biol. 30 (15), 3016-3023 (2020).
- Schaedel, L., et al. Lattice defects induce microtubule self-renewal. Nat Phys. 15 (8), 830-838 (2019).
- Aher, A., et al. CLASP mediates microtubule repair by restricting lattice damage and regulating tubulin incorporation. Curr Biol. 30 (11), 2175-2183 (2020).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. ELife. 5, e13470(2016).
- Fourniol, F. J., et al. Micropattern-guided assembly of overlapping pairs of dynamic microtubules. Methods Enzymol. 540, 339-360 (2014).
- Vleugel, M., Roth, S., Groenendijk, C. F., Dogterom, M. Reconstitution of basic mitotic spindles in spherical emulsion droplets. J Vis Exp. (114), e54278(2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Mol Biol Cell. 27 (22), 3563-3573 (2016).
- VanDelinder, V., Brener, S., Bachand, G. D. Mechanisms underlying the active self-assembly of microtubule rings and spools. Biomacromolecules. 17 (3), 1048-1056 (2016).
- Roth, S., Gârlea, I. C., Vleugel, M., Mulder, B. M., Dogterom, M. Reconstitution of basic mitotic spindles in cell-like confinement. bioRxiv. , (2019).
- Xu, Z., et al. Microtubules acquire resistance from mechanical breakage through intralumenal acetylation. Science. 356 (6335), 328-332 (2017).
- Fanalista, F., et al. Shape and size control of artificial cells for bottom-up biology. ACS Nano. 13 (5), 5439-5450 (2019).
- Velve-Casquillas, G., Costa, J., Carlier-Grynkorn, F., Mayeux, A., Tran, P. T. A fast microfluidic temperature control device for studying microtubule dynamics in fission yeast. Methods Cell Biol. 97, 185-201 (2010).
- Portran, D., Schaedel, L., Xu, Z., Théry, M., Nachury, M. V. Tubulin acetylation protects long-lived microtubules against mechanical ageing. Nat Cell Biol. 19 (4), 391-398 (2017).
- Huang, Y. M., Uppalapati, M., Hancock, W. O., Jackson, T. N. Microtubule transport, concentration and alignment in enclosed microfluidic channels. Biomed Microdevices. 9 (2), 175-184 (2007).
- Uppalapati, M., Huang, Y., Shastry, S., Jackson, T. N., Hancock, W. O. Microtubule Motors in Microfluidics. Methods in Bioengineering: Microfabrication and Microfluidics. , Artech House Publishers. Boston, MA. (2009).
- Sung, J. H., Shuler, M. L. Prevention of air bubble formation in a microfluidic perfusion cell culture system using a microscale bubble trap. Biomed Microdevices. 11 (4), 731-738 (2009).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360(2019).
- Nakayama, T., et al. Circumventing air bubbles in microfluidic systems and quantitative continuous-flow PCR applications. Anal Bioanal Chem. 386 (5), 1327-1333 (2006).
- Park, S., Cho, H., Kim, J., Han, K. -H. Lateral degassing method for disposable film-chip microfluidic devices. Membranes. 11 (5), 316(2021).
- Pereiro, I., Fomitcheva Khartchenko, A., Petrini, L., Kaigala, G. V. Nip the bubble in the bud: A guide to avoid gas nucleation in microfluidics. Lab Chip. 19 (14), 2296-2314 (2019).
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biol. 95, 221-245 (2010).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: Information from a slowly hydrolyzable analogue, GMPCPP. Mol Biol Cell. 3 (10), 1155-1167 (1992).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bartlett, N. W., Wood, R. J. Comparative analysis of fabrication methods for achieving rounded microchannels in PDMS. J Micromech Microeng. 26 (11), 115013(2016).
- Yang, C. P. H., Horwitz, S. B. Taxol®: The first microtubule stabilizing agent. Int J Mol Sci. 18 (8), 1733(2017).
- Gittes, F., Mickey, B., Nettleton, J., Howard, J. Flexural rigidity of microtubules and actin filaments measured from thermal fluctuations in shape. J Cell Biol. 120 (4), 923-934 (1993).
- VanBuren, V., Cassimeris, L., Odde, D. J. Mechanochemical model of microtubule structure and self-assembly kinetics. Biophys J. 89 (5), 2911-2926 (2005).
- Dye, R. B., Fink, S. P., Williams, R. C. Taxol-induced flexibility of microtubules and its reversal by MAP-2 and Tau. J Biol Chem. 268 (10), 6847-6850 (1993).
- Drechsel, D. N., Kirschnert, M. W. The minimum GTP cap required to stabilize microtubules. Curr Biol. 4 (12), 1053-1061 (1994).
- Wisanpitayakorn, P., Mickolajczyk, K. J., Hancock, W. O., Vidali, L., Tüzel, E. Measurement of the persistence length of cytoskeletal filaments using curvature distributions. Biophys J. 121 (10), 1813-1822 (2022).
- Mickey, B., Howard, J. Rigidity of microtubules is increased by stabilizing agents. J Cell Biol. 130 (4), 909-917 (1995).
- Brangwynne, C. P., et al. Bending dynamics of fluctuating biopolymers probed by automated high-resolution filament tracking. Biophys J. 93 (1), 346-359 (2007).
- Venier, P., Maggs, A. C., Carlier, M. F., Pantaloni, D. Analysis of microtubule rigidity using hydrodynamic flow and thermal fluctuations. J Biol Chem. 269 (18), 13353-13360 (1994).
- Felgner, H., Frank, R., Schliwa, M. Flexural rigidity of microtubules measured with the use of optical tweezers. J Cell Sci. 109 (Pt 2), 509-516 (1996).
- Felgner, H., et al. Domains of neuronal microtubule-associated proteins and flexural rigidity of microtubules. J Cell Biol. 138 (5), 1067-1075 (1997).
- Nishida, K., et al. Effects of three microtubule-associated proteins (MAP2, MAP4, and Tau) on microtubules' physical properties and neurite morphology. Sci Rep. 13, 8870(2023).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Brouhard, G. J., Rice, L. M. Microtubule dynamics: An interplay of biochemistry and mechanics. Nat Rev Mol Cell Biol. 19 (7), 451-463 (2018).
- Lawrence, E. J., Chatterjee, S., Zanic, M. More is different: Reconstituting complexity in microtubule regulation. J Biol Chem. 299 (12), 105398(2023).
- Howard, J., Hyman, A. A. Dynamics and mechanics of the microtubule plus end. Nature. 422 (6933), 753-758 (2003).
- Mehidi, A., Aumeier, C. Regulation of the microtubule network; the shaft matters. Curr Opin Syst Biol. 34, 100457(2023).
- Verhey, K. J., Ohi, R. Causes, costs and consequences of kinesin motors communicating through the microtubule lattice. J Cell Sci. 136 (5), jcs260735(2023).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nat Rev Mol Cell Biol. 20 (1), 38-54 (2019).
- Théry, M., Blanchoin, L. Microtubule self-repair. Curr Opin Cell Biol. 68, 144-154 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。