Method Article
Mikrotübül Polimer Mekaniğinin İncelenmesi için Mikroakışkan Tabanlı Bir Yaklaşımın Geliştirilmesi
Bu Makalede
Özet
Bu protokol, mikrotübül polimer mekaniğini araştırmak için uygun bir mikroakışkan cihazın tasarımını ve üretimini detaylandırır. Mikrofabrikasyon, otomatik akış kontrolü ve hesaplamalı modelleme tekniklerinin sentezi, hücresel hücre iskeletini in vitro olarak araştırmak için ideal olan esnek bir sistem sağlar.
Özet
Bu protokolde, mikrotübül polimer mekaniğinin araştırılması için geliştirilen bir mikroakışkan cihazın tasarımını ve üretimini açıklıyoruz. Tasarım, Polidimetilsiloksan (PDMS) tabanlı mikroakışkan cihazların kendine özgü faydalarından yararlanır ve sağlam ve özelleştirilebilir yüksek verimli deneysel bir yaklaşım sağlamak için çeşitli özellikler sunar. Geliştirilen cihaz, zararlı hava kabarcıklarının oluşmasını önlemek için yedekli kabarcık yakalama özelliklerine sahiptir. Ayrıca cihaz, manuel müdahaleyi azaltmak ve yüksek verimli analizler sağlamak için otomatik bir akış kontrol sistemi ile arayüz oluşturur. Bu sistemi kullanarak sıvı taşınmasını daha iyi geliştirmek ve anlamak için ticari simülasyon yazılımı kullanılır. Son olarak, cihazın farklı bölümlerinde farklı floresan etiketlere sahip mikrotübül uzantılarını büyüterek tek bir cihaz içinde aynı anda birden fazla deney yapma yeteneğini gösteriyoruz. Genel olarak, bu mikroakışkan akış sistemi, mikrotübül polimer mekaniğini araştırmak için kullanılabilir ve daha geniş mikrotübül in vitro çalışmalar için deneysel tasarımda iyileştirmeler sağlar. Mikrofabrikasyon, otomatik akış kontrolü ve hesaplamalı modelleme yaklaşımlarının sentezi, hücresel hücre iskeletini in vitro olarak araştırmak için ideal olan esnek bir sistem sağlar.
Giriş
Mikroakışkanlar, sıvı akış kanallarının karmaşık tasarımı ve üretimi ile genellikle bir mikrolitreden daha az olan küçük sıvı hacimlerinin hassas kontrolünü sağlar 1,2. Küçük ölçekli mikroakışkan cihazlar, benzersiz mühendislik olaylarına yol açar. Yani, sıvı akışındaki atalet ve viskoz kuvvetler arasındaki oranın boyutsuz bir ölçüsü olan Reynolds sayısı küçüktür, tipik olarak mikroakışkanlarda O(10) veya daha düşüktür ve mikroakışkan cihazlarda viskoz kuvvetlerin önemini vurgular. Ek olarak, konvektif ile difüzif taşımayı karşılaştıran Péclet sayısı, konvektif taşımanın mikroakışkanlarda genellikle ihmal edilebilir olduğunu gösterir 3,4,5. Mikroakışkanlardaki bu difüzyon odaklı, laminer akış rejimi, hassas sıvı gradyanlarını koruyarak tek bir cihaz üzerinde paralel deneyleri desteklediği için avantajlıdır.
Fotolitografi, mikroakışkan cihazlarınimalatı için birincil yöntem olmaya devam etmektedir 6,7,8. Kısacası, bu süreç, mikroakışkan tasarımın 'ana' kazınmış bir şablonunun oluşturulmasını içerir (Şekil 1). Işığa duyarlı bir substrat hazırlanır ve mikroakışkan tasarımın bir fotomaskesi, fotorezist alanlarını seçici olarak ultraviyole radyasyona maruz bırakır. Sonraki aşındırma yöntemleri, alt tabakayı geliştirerek tasarımın bir rahatlamasını sağlar. Polidimetilsiloksan (PDMS) genellikle master üzerine dökülür ve sertleştirilir. Tasarımın olumsuz özelliklerini benimseyen kürlenmiş PDMS, daha sonra master'dan çıkarılır ve bir cam lamel üzerine yapıştırılır. Tüm bu üretim süreci tipik olarak 1-2 gün sürer ve hızlı tasarım yinelemelerine ve birden fazla cihazın üretilmesine olanak tanır. Yumuşak litografi ve mikrofabrikasyon işlemlerinin ayrıntılı incelemeleri diğer referanslardamevcuttur 1,2,3,10,11,12,13.
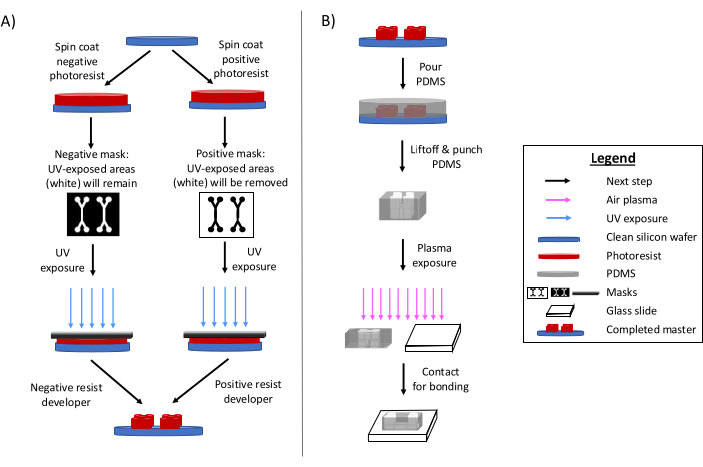
Şekil 1: Geleneksel fotolitografi sürecine ve mikrofabrikasyon sürecine genel bakış. (A) Geleneksel fotolitografi işlemi ve (B) mikrofabrikasyon işlemi. Uygulamaya ve istenen fotorezist özelliklerine bağlı olarak, aynı tasarım master'ı verecek olsalar bile, negatif veya pozitif bir fotorezist kullanılabilir. İstenen özellik yüksekliği veya fotorezist erime sıcaklığı gibi özellikler, uygun fotorezist tipinin belirlenmesine yardımcı olur. Bu rakam Rogers'ın (2022)14 izniyle değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Mikroakışkanların kullanımı, birçok araştırma alanındaki olanakları genişletmiştir ve en son etkisi biyolojik bilimlerde olmuştur. Küçük ölçeği göz önüne alındığında, mikroakışkanlar, hücreler veya proteinler gibi sınırlı, değerli kaynakların hassas yönetimine izin verir. Daha da etkili olanı, mikroakışkan sistemlerin, substrat sertliğindeki modifikasyonlar, bir numuneye kuvvet uygulanması ve hatta elektrik akımının entegrasyonu gibi fizyolojik koşulları taklit edecek şekilde ayarlanabilirliğidir. Ek olarak, mikroakışkanların kullanımı, birden fazla reaktifi paralel olarak manipüle etme ve sistem tasarımlarını hızlı bir şekilde prototipleme ve yinelemeli olarak iyileştirme yeteneği sunar. Bu özellikler, tüm laboratuvar iş akışlarının genellikle "çip üzerinde laboratuvar" olarak adlandırılan tek bir cihazda minyatürleştirilmesini sağlar1,6,9,15,16,17,18,19.
Mikroakışkanların hücre biyolojik uygulamalarından biri, mikrotübül polimerlerinin araştırılmasıdır. Mikrotübüller, hücre hücre iskeletinin önemli bir bileşenidir ve hücre bölünmesi ve hücre içi kargo taşınması gibi süreçlerde hayati bir rol oynar20,21. Hücre iskeletinin en sert elemanı olan mikrotübüller, Pleksiglas22,23 ile karşılaştırılabilir bir elastik modül sergiler. Sağlam mekanik özellikleri, örneğin kalbin sistolik ve diyastolik fazları24 sırasında döngüsel olarak büküldükleri ve gevşedikleri kardiyomiyosit kasılması da dahil olmak üzere çeşitli hücresel fonksiyonlar için çok önemlidir. Mikroakışkan cihazlar, mikrotübüllerin özelliklerini ve in vitro olarak daha yüksek dereceli yapılarını araştırmak için daha önce benimsenmiştir. Gerçekten de mikroakışkanlar, mikrotübül polimerizasyon dinamiklerini, mikrotübül-mikrotübül etkileşimlerini ve mikrotübül ile ilişkili proteinlerin mikrotübül mekanik özellikleri üzerindeki etkilerini araştırmak için kullanılmıştır 25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41.
Mikroakışkanların mikrotübül alanına girmesi birçok heyecan verici keşfi beraberinde getirmiş olsa da, bu cihazların mikrotübül araştırmaları için uyarlanmasında hala iyileştirme alanı bulunmaktadır. Bu çalışmada, mikroakışkan cihazlardaki mikrotübülleri incelemeye devam eden iki özel sınırlamayı ele alıyoruz: tipik olarak mikroakışkan cihazların manuel manipülasyonu ile ortaya çıkan cihaz içinde hava kabarcığı oluşumu potansiyeli ve yüksek verimli tahlillerin yetersiz kullanımı. İlk olarak, borunun takılması ve çıkarılması gibi manuel manipülasyonlar, kanallarda kabarcık oluşumuna neden olabilir. Bir akış hücresi içinde hava kabarcığı oluşumu felakettir, çünkü hava kabarcıkları proteinleri denatüre edebilir, mikrotübül polimerlerini kesebilir ve hücre kültürlerini olumsuz etkileyebilir42,43. Ek olarak, cihazdaki keskin köşeler ve eğik açılar, düzgün olmayan yüzey ıslanmasına neden olarak hava sürüklenme olasılığını artırır. Hava kabarcıklarının oluşumunu, kalıcılığını ve etkisini azaltmak için çok sayıda teknik geliştirilmiştir; Bununla birlikte, kabarcık azaltma yöntemlerinin kullanımı evrensel değildir 42,43,44,45,46. Ayrıca, mikroakışkan kullanmanın en büyük avantajlarından biri yüksek verimli deney yeteneği olmasına rağmen, mikroakışkanlar henüz mikrotübül araştırmalarını büyütmek için kullanılmamıştır. Mikroakışkan cihazlar, aynı cihaz üzerinde birden fazla deneysel koşulu paralel olarak test etmek için tasarlanabilir. Örneğin, sıvı gradyanları, farklı mikrotübül ile ilişkili proteinlerin veya ilaçların akışını yönlendirmek için kullanılabilir ve bunların aynı cihaz içindeki bölünmüş mikrotübüllerin belirli bölgelerine hedeflenen dağıtımını sağlar.
Burada, yinelemeli olarak bu sınırlamaları ele alan bir mikroakışkan cihaz tasarladık. Cihazın imalatının adım adım protokolünü sağlıyoruz, böylece daha geniş bir kitlenin mikrotübül araştırmalarında mikroakışkan teknolojisini kullanmasını sağlıyoruz. Bu cihaz tasarımı, kabarcık yakalama özelliklerini içerir ve manuel müdahaleyi azaltmak için otomatik bir akış kontrol sistemi kullanır ve aynı zamanda yüksek verimli analizler için cihazdaki çözüm gradyanlarını mümkün kılar. Özetle, bu mikroakışkan tasarımın geliştirilmesi, daha geniş mikrotübül araştırma alanındaki deneysel tasarımlarda değerli iyileştirmeler sunarken, mikrotübül mekaniğinin daha geniş bir şekilde araştırılmasını ve anlaşılmasını kolaylaştırabilir.
Protokol
NOT: Protokolün bu bölümünde ayrıntılı olarak açıklanan çalışma, Vanderbilt Nano Ölçekli Bilim ve Mühendislik Enstitüsü (VINSE) çekirdek Sınıf 100 temiz odasında gerçekleştirilmiştir. Nem/ortam aydınlatma koşulları nedeniyle cihazın hasar görmesini önlemek ve partikül kontaminasyonunu önlemek için uygun önlük ve UV filtreli aydınlatmaya sahip kontrollü bir temiz oda arzu edilir. Silikon gofretler üzerindeki tüm manipülasyonlar, silikon gofret cilalı tarafı yukarı bakacak şekilde yapılmalıdır. Gofretleri manipüle ederken cımbız kullanın ve çizilmeyi önlemek için gofretin temas yüzeylerini en aza indirin. Gofretleri, aksi belirtilmedikçe, taşıma sırasında ve her günün sonunda kapakları kapalı olarak Petri kaplarında saklayın.
1. Fotolitografi (6 - 8 saat)
- Oksijen (O2) veya temiz kuru hava (CDA) plazması kullanarak 3 inçlik bir silikon gofreti vakum altında (ideal olarak 5 × 10-5 torr < vakum basıncı) 5 dakika boyunca plazma ile temizleyin.
- Fotorezistin biriktirilmesi için silikon gofreti bir spin kaplayıcı üzerine ortalayın.
- Silikon gofretin merkezine ~ 1-2 mL SPR 220 7.0 fotorezist biriktirin.
DİKKAT: Fotorezisti eldiven ve göz koruması ile tutun ve üreticiye/sahaya özel protokollere göre atın. - Silikon gofret üzerindeki fotorezisti, üreticinin sıkma eğrilerine göre istenen kalınlığa kadar döndürün. 30 saniye boyunca 1000 RPM'de döndürerek ~13 μm kalınlığında katmanlar oluşturun. Daha sonra, spin kaplayıcı üzerindeki artık fotorezisti asetonla temizleyin ve sahaya özgü protokollere göre atın.
NOT: Sıkma işleminden sonra, yonga plakası fotorezist ile düzgün bir şekilde kaplanmazsa, 1.2-1.4 adımlarını tekrarlayın. Düzgün olmayan bir kaplama, spin kaplayıcı üzerinde merkezlenmemiş bir gofretten, çok az fotorezist kullanılmasından ve/veya fotorezistin gofretin merkezine bırakılmamasından kaynaklanabilir. - Gofret üzerindeki fotorezistin mümkün olduğunca azına dokunurken, silikon gofretleri 70 °C'ye ayarlanmış bir sıcak plakaya aktarın.
- Silikon gofreti sıcak plaka üzerinde inkübe edin, sıcaklık 115 °C'ye ulaşana kadar sıcaklığı her 3-5 dakikada bir 10 °C artırın.
- Sıcak plakayı kapatın ve silikon gofretin sıcaklığı 65 °C'nin altına düşene kadar soğumaya bırakın.
NOT: Isıtma ve soğutma adımları, bu kalınlıkta yaygın olan fotorezistin termal çatlamasını önlemek için yavaş yavaş gerçekleştirilir. Termal çatlaklar meydana gelirse, bunlar genellikle silikon gofretin yeniden ısıtılması ve soğutma hızının yavaşlatılmasıyla düzeltilebilir. - Forseps kullanarak, soğutulmuş silikon gofreti bir maske hizalayıcıya aktarın ve hem silikon gofret'i hem de karşılık gelen bir fotomaskeyi, üreticiye/sahaya özel protokolleri izleyerek maske hizalayıcıya yükleyin.
NOT: Fotoğraf maskeleri, AutoCAD ile oluşturulan belirli bir tasarım kullanılarak harici bir tarafça üretilmiştir. Maske tasarımı oluşturma için Ek Dosya 1'e bakın. - Silikon gofretleri, üreticiye/siteye özel protokolleri izleyerek belirli bir süre (UV lambasının gücüne bağlı olarak) ultraviyole (UV) radyasyona maruz bırakın. Bu uygulama için istenen enerji ~ 400 mJ /cm2'dir ve maruz kalma süresini aşağıdaki formüle göre hesaplayın:
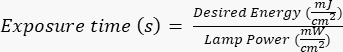 .
. - Maruz kaldıktan sonra, silikon gofreti maske hizalayıcısından çıkarın ve fotorezistin hava sirkülasyonu ile 4 saat boyunca yeniden sulanmasına izin verin. Hava sirkülasyonuna izin vermek için Petri kabı kapağının kapalı bırakıldığından emin olun, ancak kabı partiküllere maruz kalma olasılığı düşük bir alana yerleştirin.
NOT: Bu rehidrasyon süresi boyunca 4 saatlik bir ara verilebilir, ancak aynı gün işleme devam edilmesi önerilir. - 4 saatlik rehidrasyondan sonra, açıkta kalan gofreti 70 °C'ye ayarlanmış bir sıcak plakaya aktarın.
- Silikon gofreti sıcak plaka üzerinde inkübe edin, sıcaklık 115 °C'ye ulaşana kadar sıcaklığı her 3-5 dakikada bir 10 °C artırın.
- Gofretin 115 °C'de 10 dakika inkübe etmesine izin verin.
- Petri kabı kapağı şeklinde bir alüminyum folyo tabakası kalıplayarak açıkta kalan gofret için yalıtkan bir 'kapak' oluşturun.
- Sıcak plakayı kapatın ve açıkta kalan gofretini alüminyum folyo kapakla kapatın. Gofretin gece boyunca ortam sıcaklığında soğumasına izin verin.
NOT: Fotorezistin termal çatlaması, maruziyet sonrası inkübasyon adımı sırasında çok daha yaygındır, bu nedenle gece boyunca yavaş bir soğutma önerilir. Bu, imalatın ilk günü için gerekli adımları tamamlar. Ertesi gün bir sonraki bölüme geçmeniz önerilir.
2. Geliştirme (1 - 2 saat)
- Açıkta kalan gofretleri geliştirmeye hazır olduğunuzda, temiz bir kap ve uygun bir fotorezist geliştirici edinin. Burada, MF-319 geliştiricisi özel bir konteyner ile kullanılır.
DİKKAT: Geliştiriciyi eldiven ve göz koruması ile tutun, dökme konteyneri ikincil bir konteynere aktarın ve üreticiye/sahaya özel protokollere göre atın. - Açıkta kalan gofreti tamamen daldırmak için kabın içine yeterince geliştirici dökün (gerçek hacim kaba göre değişecektir).
- Açıkta kalan gofreti geliştiriciye batırın ve tüm istenmeyen fotorezist çözülene kadar bekleyin. Kabın hafifçe döndürülmesi/çalkalanması, cihaz tasarımı dışında gofret üzerinde çok az veya hiç kalıntı fotorezist görünmeyene kadar geliştirmeye yardımcı olur.
NOT: Kullanılan geliştirici çözümünün hacmine bağlı olarak, istenmeyen fotorezisti tamamen kaldırmak için geliştirici çözümünün birden çok kez değiştirilmesi gerekebilir. - Geliştirilen gofretleri geliştirme solüsyonundan çıkarın ve gofretin her iki tarafını deiyonize (DI) su ile 30 saniye boyunca nazikçe durulayın.
- Geliştirilen gofreti nitrojen (N2) gazı ile kurutun.
- Geliştirilen gofret, daha fazla kullanıma hazır olana kadar kuru ve serin bir ortamda bir Petri kabında saklayın. Ortam ışığına maruz kalma nedeniyle fotorezistin bozulmasını önlemek için Petri kabını alüminyum folyoya sarın.
NOT: Aynı gün bir sonraki bölüme geçmeniz önerilir, ancak zorunlu değildir.
3. Silanizasyon (1 - 2 saat)
- Silikon gofreti bir desikatöre aktarın.
- Desikatöre küçük bir alüminyum kap (veya kap şeklinde katlanmış bir alüminyum folyo parçası) yerleştirin.
- Alüminyum kabın içine 1 damla (~ 50 μL) trikloro (1H, 1H, 2H, 2H-perflorooktil) silan pipetleyin.
DİKKAT: Silan solüsyonunu eldiven ve göz koruması ile kullanın ve üreticiye/sahaya özel protokollere göre atın. - Kurutucuyu kapatın ve vakumu açın.
- 1-2 saat kuruma / silanizasyonun gerçekleşmesine izin verin.
- Silanizasyon süresi bittikten sonra vakumu kapatın ve silanize gofretleri alın. Sililanize gofret, alüminyum folyo sarılı bir Petri kabında, daha fazla kullanıma hazır olana kadar kuru ve serin bir ortamda saklayın.
NOT: Silanizasyonun gofretler üzerinde periyodik olarak ve daha ince PDMS katmanlarının kullanıldığı cihazlarda daha sık tekrarlanması gerekebilir. PDMS'yi gofretten çıkarırken PDMS yapışması fark edilirse, gofretin yeniden silanize edilmesi gerekebilir ve tüm PDMS gofretten çıkarıldıktan sonra bu bölüm tekrarlanmalıdır. Bu, mikroakışkan cihaz master'ları oluşturmak için gereken adımları tamamlar. Ustalar kararlıdır ve istenildiğinde sonraki bölümler yürütülebilir.
4. PDMS biriktirme (1 - 2 saat)
NOT: Master üzerinde önceki bir mikrofabrikasyondan kalan PDMS varsa, yeni PDMS yerleştirilmeden önce kalan PDMS çıkarılmalıdır.
- Bir terazide, 10:1 ağırlık oranında bir kap PDMS'ye ve ilgili kürleme maddesine tartın. Gereken toplam ağırlık, istenen PDMS kalınlığına ve Petri kabı boyutuna bağlı olarak değişecektir. 4 inçlik bir Petri kabı için, ~ 20 g PDMS ve ~ 2 g kürleme maddesi 2-3 mm'lik bir kalınlık verecektir.
DİKKAT: PDMS solüsyonunu eldiven ve göz koruması ile kullanın ve üreticiye/sahaya özel protokollere göre atın. - PDMS'yi ve kürleme maddesini plastik bir spatula veya başka bir uygun alet kullanarak kapta 5 dakika karıştırın.
- Karışık PDMS kabını gazdan arındırmak için bir desikatöre aktarın.
- Kurutucuyu kapatın ve vakumu açın. PDMS'de hava kabarcıkları görünmeye başlayacaktır.
- 30 dakika boyunca kurutma/gaz giderme işleminin gerçekleşmesine izin verin. Kullanılan PDMS miktarına ve kap şekline bağlı olarak, gerçek süre değişebilir; genel bir uç nokta, PDMS'de çok az kabarcık bulunduğu veya hiç kabarcık bulunmadığı zamandır.
- Gazdan arındırdıktan sonra vakumu kapatın ve PDMS kabını geri alın.
- Karıştırılmış ve gazı alınmış PDMS'yi bir Petri kabındaki master'a dökün.
- PDMS'nin tamamen kürlenmesini sağlamak için master'ı kapalı Petri kabında gece boyunca 65 ° C'de inkübe edin.
NOT: Bu, PDMS biriktirme adımlarını tamamlar. PDMS'nin gece boyunca bir inkübatörde kürlenmesine izin verilmesi önerilir. PDMS daha sonra kararlıdır, böylece istendiğinde sonraki bölümler yürütülebilir.
5. PDMS cihaz düzeneği (1 - 2 saat)
- Kürlenmiş PDMS, bir çift forseps, manuel pistonlu standart 1.5 mm biyopsi zımbası ve bir neşter/tıraş bıçağı olan cihaz ustalarını alın.
DİKKAT: Bıçağı dikkatli tutun ve asla kendinize veya başkalarına doğru kesmeyin. Kendiliğinden geri çekilen veya emniyet bıçağı önerilir. - Cihaz özelliklerinin etrafında, katman ustasından dikdörtgen PDMS parçalarını kesin. Her bir PDMS parçasının her iki tarafında biraz boşluk olduğundan emin olun, her bir parçanın kendi 22 mm × 22 mm cam lamele oturmasını sağlarken iyi bir yapıştırma temasını kolaylaştırmak için cihaz özelliklerini çevreleyin.
NOT: PDMS'nin alt yüzeyine (özelliklerin bulunduğu taraf) dokunmaktan kaçınmak önemlidir, bu nedenle PDMS'yi her zaman cımbız kullanarak kenarlarından tutun. Ek olarak, PDMS'nin özellik tarafını asla aşağı bakacak şekilde herhangi bir yüzeye yerleştirmeyin. Kullanılmadığı zaman, PDMS'yi özellik tarafı yukarı bakacak şekilde ihtiyaç duyulana kadar kapalı bir kapta saklayın. - Temiz bir 1.5 mm delgeç kullanarak PDMS parçalarına giriş ve çıkış delikleri açın. Cihaz PDMS'sini, delgeciye zarar verebilecek sert bir yüzey yerine yedek bir kurban PDMS katmanına delin.
- 22 mm × 22 mm cam lamel alın ve izopropil alkol (IPA) ile ıslatılmış bir mendille temizleyin.
- 22 mm × 22 mm lamel vakum altında (basınç < 0,5 Torr) CDA plazma kullanarak 5 dakika boyunca plazma ile temizleyin. Bu, lamel üzerindeki kalıntıları veya organik kaplamaları temizleyecektir.
- 22 mm × 22 mm cam lamel ve PDMS'nin özellikli tarafını IPA ile ıslatılmış bir mendille silin.
- Hem PDMS'yi (özellik tarafı yukarı bakacak şekilde) hem de cam lamelli (daha önce temizlendiği taraf yukarı bakacak şekilde) plazma temizleyiciye yerleştirin ve CDA plazma kullanarak vakum altında (basınç < 0,5 Torr) 30 saniye boyunca aynı anda plazmayı temizleyin.
- Hem cam lamel hem de PDMS cihazını plazma temizleyiciden çıkarın. PDMS'yi, özellik tarafı aşağı bakacak şekilde ters çevirin ve cam lamel üzerine yerleştirin. Yapışmayı gözlemleyin ve iyi teması kolaylaştırmak için gerektiği gibi PDMS'ye hafifçe bastırın.
- Yapıştırılmış lamel kapalı bir Petri kabında 65 °C'de 3 dakika boyunca inkübe edin.
NOT: Plazma bağı, cam lamellerin hidrofobikliğini değiştirerek hidrofilik bir yüzey oluşturur. Lamelin orijinal hidrofobik durumunun, oda sıcaklığında yaklaşık 2 günlük inkübasyondan sonra geri döndüğü anekdot niteliğindeki kanıtlarla gözlemlenmiştir. Plazma yapıştırmasından en geç 2 gün sonra fabrikasyon cihazların kullanılması tavsiye edilir. Bu, mikrofabrikasyon adımlarını tamamlar. Cihazların ayarlanmış bir raf ömrü yoktur, ancak kullanılmadığı zaman serin ve kuru bir yerde saklanmalıdır.
6. Mikroakışkan akış kanalı hazırlığı (1 saat)
- Monte edilmiş bir mikroakışkan cihazı temiz bir özel s'ye sabitleyintage adaptör47.
- Bir şırınga, bir Lour-lock adaptörü ve bağlantı halkası ve 1,5 mm dış çaplı şeffaf borudan (yaklaşık 15-20 cm uzunluğunda) bir parça alın. Hortumu adaptör aracılığıyla şırıngaya bağlayın.
- Mikroakışkan cihaz çıkışlarına üç parça daha boru bağlayın (bu borunun belirli bir uzunlukta olması gerekmez) ve bu boruların diğer ucunu aşağı akıştaki bir atık şişesine yönlendirin.
- Şırıngayı kullanarak, aşağıdaki adımlara göre çözeltiler sunarak mikroakışkan cihazı hazırlayın. Çözeltilerin sırası ve hacmi şu şekildedir: 50 μL BRB80 tampon çözeltisi, 25 μL anti-rodamin antikor çözeltisi, 5 dakika bekleyin, 50 μL BRB80, 25 μL poloksamer 407 (F127), 15 dakika bekleyin ve 50 μL BRB80. Bir örnek için Tablo 1'e bakın.
- Çözeltiyi kaynağından boruya çekin.
NOT: Solüsyonu şırınganın içine tamamen çekmeyin. Çözelti sadece boruda kalmalıdır. - Borunun sonunda küçük bir sıvı damlası oluşana kadar şırınga pistonuna hafifçe bastırın. Bu, boru takılıyken mikroakışkan cihaza herhangi bir havanın girmesini önleyecektir.
- Hortumu mikroakışkan cihazın girişine takın.
- Çözeltinin tamamı olmasa da çoğu borudan akana kadar şırınga pistonuna yavaşça bastırın. Boruda az miktarda sıvı bırakmak, borudan yanlışlıkla hava girmemesini sağlayacaktır. Bu transferler sırasında boru ve mikroakışkan kanalları gözlemleyin ve herhangi bir kabarcık arayın.
NOT: Tüpte kabarcıklar meydana gelirse, sorun gidermeye başlayın (kabarcık gelmeden hemen önce hortumu fişten çekerek ve ardından kabarcık geçtikten sonra boruyu yeniden takarak mikroakışkan cihaza girmeden önce kabarcığı çıkarmaya çalışın, vb.). - Tüm reaktifler akana kadar bir sonraki reaktif için 6.4.1-6.4.4 adımlarını tekrarlayın. Kaynak reaktiflerin çapraz kontaminasyonunu önlemek için her reaktif için yeni bir giriş borusu parçasına ihtiyaç duyulacaktır. Son BRB80 yıkama işlemi tamamlandıktan sonra, cihaz birkaç dakika boyunca stabil kalır. Girişlere bir damla BRB80 çözeltisi cihazın kurumasını önleyecektir.
- Çözeltiyi kaynağından boruya çekin.
- Guanosin-5' - [(α,β)-metileno]trifosfat (GMPCPP)-stabilize mikrotübül 'tohumlarını' standart protokollere göre hazırlayın (~%25 TTR etiketleme oranı ile)47,48.
- Belirtilen nihai konsantrasyonları elde etmek için aşağıdaki reaktifleri ilgili miktarlarda (stok konsantrasyonlarına bağlı olarak) birleştirerek 2x çalışma konsantrasyonunda bir görüntüleme tamponu çözeltisi ('antifade') hazırlayın: 40 mM glikoz, 40 μg/mL glikoz oksidaz, 16 μg/mL katalaz, 0.5 mg/mL kazein, 50 mM potasyum klorür ve 10 mM ditiyotreitol (DTT) ile desteklenmiş BRB80. Bu görüntüleme tamponu, fotostabiliteyi uzatmak için kullanılır. Bir örnek için Tablo 2'ye bakın.
- 2x antifade çözeltisinin bir kısmını BRB80'de 1: 1 oranında seyreltin ve 1x çalışan bir antifade çözeltisi elde edin. Bu antifadeyi oda sıcaklığına (RT) ısıtın; Stok antifade çözeltisi buz üzerinde tutulmalıdır.
| Sipariş | Reaktif | Hacim Seyreltme | Yıkama Hacmi | Kuluçka Süresi |
| 1 | BRB80 Serisi | YOK | 50 μL | YOK |
| 2 | Anti-rodamin antikoru | BRB80'de 1:50, iyice karıştırın | 25 μL | 5 dk |
| 3 | BRB80 Serisi | YOK | 50 μL | YOK |
| 4 | Poloksamer 407 (F127) | BRB80 içerisinde %1 | 25 μL | 15 dk |
| 5 | BRB80 Serisi | YOK | 50 μL | YOK |
Tablo 1: Mikroakışkan cihaz kanallarının hazırlanma sırası.
| Hacim | Reaktif | Stok Konsantrasyonu | Son Konsantrasyon |
| 16 μL | D-Glikoz | 2 AYLIK | 80 milyon |
| 16 μL | Glikoz Oksidaz | 2 mg / mL | 80 μg/mL |
| 16 μL | Katalaz | 0.8 mg / mL | 32 μg/mL |
| 14 μL | Kazein | 28 mg / mL | 0.16 mg / mL |
| 8 μL | DTT (DTT) | 1 AYLIK | 20 milyon |
| 40 μL | Potasyum Klorür | 1 AYLIK | 100 milyon |
| 290 μL | BRB80 Serisi | 1 katı | YOK |
| 400 μL | FİNAL (2x çalışma konsantrasyonu) |
Tablo 2: Antifade görüntüleme çözeltisi tarifi (2x konsantrasyon).
7. Mikrotübül tohumlarının mikroakışkanlara tanıtılması (10 - 15 dk)
- Mikroakışkan cihazı mikroskoba bağlayın.
NOT: Mikrotübül stabilitesi sıcaklığa bağlı olduğundan, görüntüleme deneylerinin 35 °C'de yapılması önerilir. - Şırıngaya 10-15 cm yeni boru takın ve istenen bir GMPCPP ile stabilize edilmiş mikrotübül tohumlarını boruya çekin.
NOT: Bu cihaz için ~ 10 nM GMPCPP-mikrotübül tohumları en uygun konsantrasyondu. - Borunun sonunda küçük bir sıvı damlası oluşana kadar şırınga pistonuna hafifçe bastırın. Bu, boru takılıyken mikroakışkan cihaza herhangi bir havanın girmesini önleyecektir.
- Hortumu mikroakışkan cihazın girişine takın.
- Çözeltinin tamamı olmasa da çoğu borudan akana kadar şırınga pistonuna yavaşça bastırın. Boruda az miktarda sıvı bırakmak, borudan yanlışlıkla hava girmemesini sağlayacaktır.
- Giriş borusunu mikroakışkan cihazdan ve şırıngadan ayırın ve şırıngaya yeni bir boru parçası takın.
- BRB80'i boruya çekin.
- Bağlı olmayan mikrotübül tohumlarını cihazdan yıkamak için 7.3-7.6 adımlarını tekrarlayın.
- Toplam iç yansıma floresan (TIRF) mikroskobu kullanarak tohumların mikroakışkan yüzeye yapışmasını gözlemleyin. Tek bir görüş alanındaki ideal tohum sayısı, uygulamaya ve görüş alanı boyutuna bağlı olarak değişecektir, ancak genel olarak, 80 μm × 80 μm görüş alanı başına ~10-20 tohum en uygunudur. İstenen tohum yoğunluğuna ulaşılana kadar 7.2-7.9 adımlarını gerektiği kadar tekrarlayın.
NOT: Mikrotübül tohum yoğunluğunu izlemek için, çözeltide henüz bir antifade bulunmadığından aralıklı kısa ışığa maruz kalma (100 ms) kullanılmalıdır. - Uygun bağlı tohum yoğunluğuna ulaşıldığında, şırıngaya yeni bir giriş borusu parçası takın.
- Tüpe ılık 1x antifade çözeltisi çekin ve 7.3-7.6 adımlarını tekrarlayın.
NOT: Artık cihazda bulunan antifade çözeltisi ile fotostabilite önemli ölçüde iyileştirilmiştir ve cihaz stabildir. Ancak yine de lazer ışığına maruz kalmanın en aza indirilmesi önerilir.
8. Tohumlardan büyüyen mikrotübül uzantıları (15 - 30 dk)
- %7 floresan etiketleme oranında 14 μM tübülin, 1x çalışma konsantrasyonunda antifade ve 1 mM GTP içeren nihai bir çözelti elde etmek için floresan etiketli tübülin, etiketsiz tübülin, 2x antifade çözeltisi, Guanozin-5'-trifosfat (GTP) ve BRB1'i birleştirin.
NOT: Farklı konsantrasyonlarda veya farklı etiketleme yüzdelerinde tübülin kullanılıyorsa, istenen nihai konsantrasyonu ve etiketleme oranını elde etmek için her bir reaktifin hacminin ayarlanması gerekecektir. Tübülin çözeltisini girişten ~ 30 s öncesine kadar buz üzerinde tutun, bu noktada çözeltiyi buzdan çıkarın ve RT'ye kadar elinizde ısıtın. Bu, sıcaklığa bağlı bir süreç olan mikrotübül uzantılarının polimerizasyonuna yardımcı olacaktır. Gerçekten de, mikrotübül polimerizasyonu 35 °C'de yapılmalıdır, diğer tüm deneysel adımlar ise RT'de gerçekleştirilebilir. - Şırıngaya 10-15 cm yeni boru takın ve boruya tübülin çözeltisi çekin.
- Borunun sonunda küçük bir sıvı damlası oluşana kadar şırınga pistonuna hafifçe bastırın. Bu, boru takılıyken mikroakışkan cihaza herhangi bir havanın girmesini önleyecektir.
- Hortumu mikroakışkan cihazın girişine takın.
- Çözeltinin tamamı olmasa da çoğu borudan akana kadar şırınga pistonuna yavaşça bastırın. Boruda az miktarda sıvı bırakmak, borudan yanlışlıkla hava girmemesini sağlayacaktır. Giriş borusunu mikroakışkan cihazdan ayırın.
- 10-15 dakika boyunca veya uzantılar bükülecek kadar uzun olana kadar istenen frekansta görüntü. Tipik olarak, görüntüleme, uzantılar en az 5-10 μm uzunluğunda (~ 15 dakika) olana kadar her 5 saniyede bir 488 nm'de ve her 60 saniyede bir 561 nm'de gerçekleştirilir.
NOT: Bu tübülin konsantrasyonunda, mikrotübüller polimerizasyon ve depolimerizasyon dönemleri arasında stokastik olarak geçiş yapabilir; Bu beklenen bir durumdur, ancak genel olarak, mikrotübül uzantıları49 uzayacaktır.
9. Stabilize edici mikrotübül uzantıları (10-15 dk)
- 1x çalışma konsantrasyonunda 10 μM taksol ve antifade içeren nihai bir çözelti elde etmek için Taxol, 2x antifade çözeltisi ve BRB80'i birleştirin.
NOT: Taksol çözeltisini girişten ~ 30 saniye öncesine kadar buz üzerinde tutun, bu noktada çözeltiyi buzdan çıkarın ve RT'ye kadar elinizde ısıtın. Bu, sıcaklığa bağlı bir süreç olan mikrotübül uzantılarının depolimerizasyonunu önleyecektir. - Şırıngaya 10-15 cm yeni boru takın ve taksol çözeltisini boruya çekin.
- Borunun sonunda küçük bir sıvı damlası oluşana kadar şırınga pistonuna hafifçe bastırın. Bu, boru takılıyken mikroakışkan cihaza herhangi bir havanın girmesini önleyecektir.
- Hortumu mikroakışkan cihazın girişine takın.
- Çözeltinin tamamı olmasa da çoğu borudan akana kadar şırınga pistonuna bastırın. Boruda az miktarda sıvı bırakmak, borudan yanlışlıkla hava girmemesini sağlayacaktır.
- 9.2-9.5 adımlarını hızlı bir şekilde art arda iki kez tekrarlayın. Bu durumda aynı boru parçası kullanılabilir.
NOT: Taksol, çözelti içindeki tübülinden de novo mikrotübül çekirdeklenmesini teşvik eder ve bu mikrotübüller, mikroakışkan kanalın yüzeyine inebilir ve sonraki görüntüleme/bükme ile müdahale edebilir. Bu nedenle, taksol çözeltisi, cihazdan mümkün olan en kısa sürede çok fazla serbest tübülini çıkarmak için cihazdan hızlı bir şekilde ve birden çok yinelemede akmalıdır. - Tohumlardan yetiştirilen mikrotübüllerin hala mevcut olduğunu ve cihazda stabilize olduğunu doğrulayın.
10. Stabilize mikrotübül uzantılarının bükülmesi (10 - 15 dk)
NOT: Stabilize edilmiş mikrotübül uzantıları artık bir akış kontrolörü kullanılarak bükülebilir. Burada, çözeltiyi hava geçirmez bir kaynak şişesinden bir akış ölçerden mikroakışkana akıtmak için düzenlenmiş, pozitif basınçlı bir yer değiştirme sistemi (Elveflow OB1 MK3+) kullanıldı. Mevcut akış kontrolörü kurulumunun özelliklerine bağlı olarak, aşağıdaki adımlarda değişiklikler yapılabilir.
- Kaynak şişeyi akış ölçer girişine ve akış ölçer çıkışını mikroakışkan girişine bağlamak için boru kullanarak akış kontrol cihazını ve ilgili ekipmanı üreticiye/sahaya özel protokollere göre kurun, ancak boruyu henüz mikroakışkan cihaza takmayın.
- ~200 μL'lik 10 μM taksol solüsyonunu akış kontrolörü kurulumuna takılabilen bir kaynak şişeye yerleştirin. Bu kurulum, hava geçirmez bir sızdırmazlık oluşturmak için Luer kilit bağlantılarını kullanır.
- Akış kontrol sistemini açın ve havayı çıkarmak için boruyu doldurun. Bu, boru takılıyken mikroakışkan cihaza herhangi bir havanın girmesini önleyecektir.
- Boru, akış ölçerden geçirildikten ve borunun ucunda küçük bir sıvı damlası bulunduktan sonra, akış kontrol sistemini kapatın.
- Hortumu mikroakışkan cihazın girişine bağlayın. Mikrotübül tohumlarını sokmak için kullanılan girişe dik bir giriş kullanın ve ortogonal olarak bükmek için mikrotübül uzantılarını büyütün.
- İstenilen akış hızında veya basınçta akışı başlatarak ve durdurarak uzantıları bükün. 30 mbar'lık bir basınç, 5 sn periyotlu salınımlı akış kullanan bu protokol için standarttır. Bu süre zarfında, tipik olarak 488 nm'de her 0,1 saniyede bir ve 561 nm'de her 10 saniyede bir bükülmeyi görüntüleyin.
NOT: Bu, temel mikrotübül bükme testini tamamlar. Tüm ekipman ve reaktifler, üreticiye/sahaya özel protokollere göre temizlenebilir/atılabilir.
Sonuçlar
Mikroakışkan cihaz tasarım mantığı
Bu çalışmadaki mikroakışkan cihazın tasarımı, geleneksel basit akış hücresi tasarımını oluşturan ve geliştiren birkaç temel özellik (Şekil 2) tarafından yönlendirildi. Dikkat çekici bir şekilde, mikroakışkan cihaz, daha geleneksel akış hücrelerinin47 ~ 10 μL hacminden önemli ölçüde daha küçük olan ~ 160 nL'lik bir iç hacme sahiptir ve saflaştırılmış protein bileşenleri gibi potansiyel olarak değerli reaktiflerin daha kontrollü bir şekilde kullanılmasına izin verir. Mikroakışkan akış kontrolörü iki düzenleyici kanal içerdiğinden, cihaz herhangi bir zamanda yalnızca iki giriş/çıkış portunun basınç kontrolüne sahip olacağı varsayılarak geliştirilmiştir. İstenirse daha fazla basınç kontrollü kanal uygulanabilir.
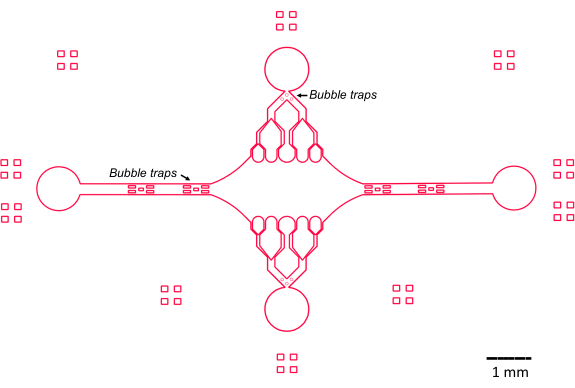
Şekil 2: Mikroakışkan cihaz tasarımının şeması. Çevredeki dikdörtgen işaretler, kanalların çevresini görmede görsel yardım içindir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Merkezi, dikdörtgen cihaz odası, mikrotübül tohumlarının bağlandığı ana görüntüleme alanı olarak işlev görür ve mikrotübül uzantıları bu tohumlardan polimerize edilir. Oda, her iki tarafta bir akış kanalı ile kesişir ve x ekseni boyunca düz kanallar, reaksiyon çözeltisinin hızlı bir şekilde değiştirilmesini kolaylaştırmak için bir giriş ve çıkış görevi görür. Mikrotübül giriş kanalı ayrıca, mikrotübül tohumlarını hazneye sokmak için kullanılır, laminer akışla, tohumun akış yönü boyunca cam yüzeye bağlanmasına neden olur. Dikey (y ekseni) yönde, akış kanalları, öncekitasarımların bazılarına benzer şekilde odaya doğru daha küçük kanallara dallanır 25,28,36,39. Dallanma geometrisi, mikrotübüllerin mekanik özelliklerini incelemek için özellikle uygundur. Mikrotübül tohumlarının oryantasyonuna dik bir yönden bir çözeltinin merkezi odaya akıtılması, normale yakın açılarda akış kaynaklı bükme kuvvetlerine izin verir. Ayrıca, dallanma geometrisinin birçok küçük akış kanalına dahil edilmesi, basit bir tek kanallı akış geometrisi ile elde edilemeyen, merkezi odanın geniş bir alanı üzerinde daha homojen bir kuvvet uygulamasını kolaylaştırır. Bu şekilde, dallanma motifi, görünüşte daha karmaşık olsa da, mikrotübüllere verilen kuvvetin belirlenmesinde genel karmaşıklığı azaltabilir (Şekil 3). Bu tasarım aynı zamanda birden fazla simetri çizgisine sahiptir, bu da kullanım kolaylığı ve çeşitli yönlerden (örneğin, üst ve alt) bükülmeyi değerlendirme fırsatı sağlar.
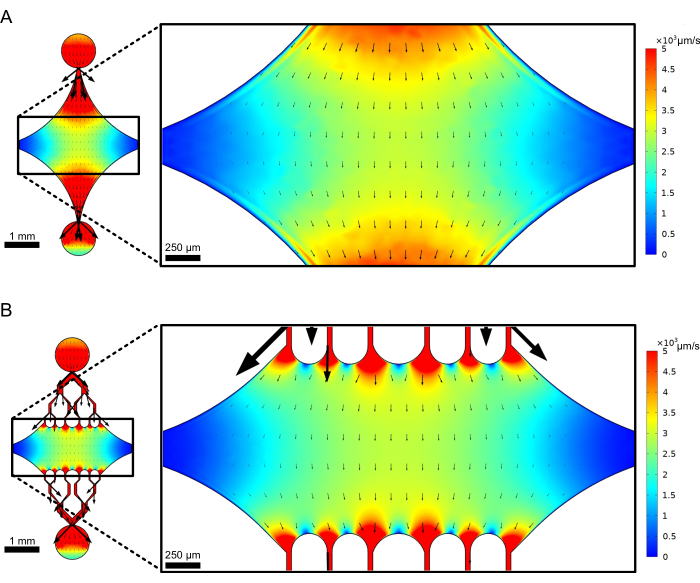
Şekil 3: Bir dallanma motifinin dahil edilmesi, benzer akışın geniş bir alanına neden olur. Kararlı durum akışı altında iki cihaz tasarımının simülasyonları: biri dallanma kanalları olmadan (A) ve diğeri dallanma kanalları (B). Oklar yerel akış yönünü gösterir ve akış büyüklüğü ile orantılıdır. Yüzey renklendirmesi, merkez çizgisi hızını gösterir. Sağdaki resimler, x ekseni boyunca yönlendirilen mikrotübüllerin (gösterilmemiştir) üst porttan ve alt porttan akan bir sıvıdan kaynaklanan bükülme kuvvetlerine maruz kalacağı cihazın yakınlaştırılmış bölümünü göstermektedir. Dallanma kanallarının dahil edilmesi, gerekli reaktif hacmini artırmazken, benzer hız alanlarına maruz kalan göreceli alanı artırır. Bu rakam Rogers'ın (2022)14 izniyle değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Özellikle, cihaz ayrıca hava kabarcıklarının merkezi görüntüleme odasına girmesini önlemek için giriş ve çıkış akış kanallarında bir dizi kabarcık tuzağı uygular. Özellikle, yüzey gerilimi nedeniyle hava kabarcıklarının geçmesini engellemek için akış yoluna mikro sütun dizilerini dahil etmeyi seçtik (Şekil 2)46. Ayrıca, hava sürüklenmesini önlemek için, cihazın içindeki kenarları eğik açılara sahip olmak yerine düzgün eğriler olarak tasarladık. Birlikte ele alındığında, bu tasarım özellikleri hava kabarcığı olasılığını azaltır ve cihazın sağlamlığını artırır.
Mikroakışkan cihaz imalatı
Cihaz master'ını oluşturmak için uygun parametrelerin belirlenmesi bazı optimizasyonlar gerektiriyordu. Daha önce gözlemlendiği gibi, bu fotorezist, fotolitografi adımları50 sırasında ortam aydınlatması ve ısıtma ve soğutma oranları gibi temel çalışma parametrelerine karşı çok hassastır. Örneğin, master ısıtıldıktan sonra çok hızlı bir şekilde soğutulursa, fotorezistte termal çatlaklar oluşabilir. Çatlaklar kanal bütünlüğünü tehlikeye atabileceğinden bu istenmeyen bir durumdur. Çatlaklar, direncin geçiş sıcaklığına (~ 115 ° C) yakın bir sıcaklığa yeniden ısıtılmasıyla çözülebilirken, master'ın sıcak plaka üzerinde ortam sıcaklığına göre soğumasına izin vermenin çatlamayı önlemenin en sağlam yolu olduğunu gördük. Ayrıca, aşırı ortam ışığı, fotorezistin istenmeyen şekilde maruz kalmasına, direncin zayıflamasına ve cihaz özelliklerinin kendilerinin (geliştirmeden sonra yonga plakası üzerinde kalması gereken) geliştirme adımı sırasında kısmi sıyrılmaya maruz kalmasına neden olabilir. Bu nedenle, geliştirme adımının, maruziyet sonrası pişirme ve ortam gece boyunca soğutma adımlarından sonraki gün gerçekleştirilmesini teşvik ediyoruz. Ayrıca, cihaz master'ı kullanılmadığında, zamanla bozulmayı önlemek için karanlık bir alanda saklamanızı veya alüminyum folyoya sarmanızı öneririz. Bu parametreler belirlendikten sonra, fotolitografi işlemi oldukça tekrarlanabilirdi (Şekil 4).
Master oluşturulduktan sonra, master'ın üzerine sıvı PDMS döküldü ve PDMS'nin master'ın özelliklerinin sertleşmesine ve negatif bir iz oluşturmasına izin verildi. PDMS'nin 2-3 mm kalınlığında dökülmesinin, cihazların kolay manipülasyonuna izin verdiğini gördük; buna karşılık, μm aralığında bir kalınlık elde etmek için spin kaplanırsa, PDMS yırtılmaya veya kendi kendine yapışmaya eğilimliydi ve bu da manipülasyonu zorlaştırıyordu. Ayrıca, daha kalın bir PDMS katmanı, borunun bir sızdırmazlık maddesi veya kelepçeye ihtiyaç duymadan giriş/çıkış portlarında kalacağından, borunun daha kolay takılmasını sağlar.
Son olarak, bu biyolojik uygulamalar için geleneksel akış hücresi tahlilleri genellikle bir Piranha çözeltisi (hidrojen peroksit ve sülfürik asit) kullanılarak önceden temizlenmiş ve daha sonra silanize edilmiş cam lameller kullanırken, genişletilmiş plazma temizliği ve IPA yıkama ile muamele edilmiş lamellerin amaçlarımız için uygun olduğunu bulduk47. Tek moleküllü görüntüleme gibi diğer uygulamalar, daha kapsamlı bir kaplama camı işlemi gerektirebilir.

Şekil 4: Fotolitografi işlemi. (A) İstenilen tasarıma sahip maske (cam üzerine kazınmış kromdan yapılmış maske). (B) Termal stres nedeniyle silikon gofret üzerinde fotorezistin hafif çatlaması (oklar birkaç çatlağı vurgular). Bu çatlaklar genellikle tüm gofret boyunca uzanır. (C) Gelişmiş usta. (D) Mikroskop üzerindeki mikroakışkan kurulumu. Bireysel bileşenler yeşil renkle etiketlenmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Mikrotübül büyümesi, stabilizasyonu ve bükülmesi
GMPCPP tarafından yetiştirilen mikrotübül tohumları, mikrotübül uzantılarının polimerize olması için çekirdeklenme bölgeleri olarak işlev görür ve oda sıcaklığında birkaç saat boyunca depolimerizasyona karşı stabildir. Tohumlar, bir anti-rodamin antikoru47 kullanılarak mikroakışkan kanaldaki cam lamele bağlandı. Dinamik mikrotübül uzantıları daha sonra çözünür tübülin (floresan olarak etiketlenmiş ancak rodamin konjuge değil) ve GTP varlığında büyütüldü. Bu şekilde, tohum çekirdeklenme bölgeleri cam lamele tutturuldu, ancak uzantılar değildi. 15 dakikalık uzatma büyüme periyodu sırasında, mikrotübül uzantıları, içsel dinamik kararsızlıkları nedeniyle beklendiği gibi stokastik olarak polimerize ve depolimerize oldu49. Bu büyüme periyodunu takiben, çözeltiden kalan tübülini ortadan kaldırmak ve oluşan mikrotübül uzantılarını stabilize etmek için 10 μM'lik bir Taxol yıkaması gerçekleştirildi. Mikrotübül uzantıları, aksi takdirde tübül tükenmesi üzerine depolimerize olacağından, stabilizasyon anahtardır. Mikrotübül polimerinin bağlanmasına ve stabilize edilmesine ek olarak, Taxol'ün mikrotübül polimer mekaniğini etkilediği ve aksi takdirde doğrusal mikrotübül uzantılarında 51,52,53,54 eğriliğe neden olabileceği gösterilmiştir. Burada gösterilen sonuçlar bu gözlemleri yansıtıyordu; Bununla birlikte, mikrotübül uzantılarının kıvrılması istenmeyen bir durumdur, çünkü bu, bükme sırasında kafes boyunca eşit olmayan kuvvetler verilmesine neden olur. Bu nedenle, eğilme analizi için sadece stabilizasyondan sonra nispeten düz kalan mikrotübüller kullanıldı. Alternatif olarak, ilk büyüme periyodundan sonra, mikrotübül kafesinin büyüyen uçlarında stabil 'kapaklar' oluşturmak ve depolimerizasyonu önlemek için bir tübülin ve GMPCPP çözeltisi (ilk GTP'nin aksine) ile ikincil bir büyüme periyodu kullanılabilir55.
Mikrotübüller daha sonra, sabit bir yukarı akış basıncını korumak için basınç kontrol sistemi kullanılarak tampon çözeltisi içinde akıtılarak büküldü (Şekil 5, Ek Video 1). Bu şekilde, mikrotübüllerin deneyimlediği yerel akışı yaklaşık olarak tahmin edebiliriz. Sıvının üstten içeri ve alt cihaz portundan dışarı akmasıyla, akışın oryantasyonunun tohumlama oryantasyonuna dik olması amaçlanmıştır.
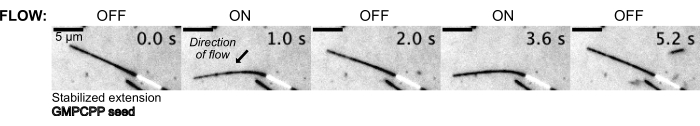
Şekil 5: Mikroakışkan kurulum, stabilize edilmiş mikrotübülleri bükmek için kullanılabilir. Paklitaksel ile stabilizasyondan sonra dinlenme durumundaki mikrotübüller, pulsatil akış sırasında bükülür. 30 mbar'lık sabit bir yukarı akış basıncı akışı yönlendirir (ok, akış yönünü gösterir). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Mikroakışkan cihazda akış profilinin belirlenmesi
Mikroakışkandaki merkez hattı hızı, COMSOL yazılımı (simülasyon yazılımı, Şekil 6A) kullanılarak hesaplamalı olarak simüle edilebilir. Bununla birlikte, mikrotübüller, yüzeyin ~ 100 nm içinde TIRF mikroskobu için cam lamele tutturulur. Bu nedenle, mikrotübülün deneyimlediği hız, 2D simülasyonda tahmin edilenle aynı değildir. Mikrotübüllerin deneyimlediği yerel akışı yaklaşık olarak tahmin etmek için, bir boyutta sıkıştırılamaz bir sıvı akışı için genel Navier-Stokes denklemini kullandık:
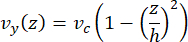
Burada, z cihazdaki mikrotübüllerin yüksekliğidir, h cihazın toplam yüksekliğidir ve vc cihazdaki merkez hattı hızıdır. Sistemin tanımı gereği, z-orijini cihazın merkezidir (Şekil 6B). Bu tanım ve 13 μm'lik bir kanal yüksekliği kullanılarak, mikrotübüllerin yüksekliği z = -6.4 μm olarak tahmin edilir. Bu denklemi çözmek, mikrotübüllerin deneyimlediği yerel sıvı hızı için bir tahmin verir:

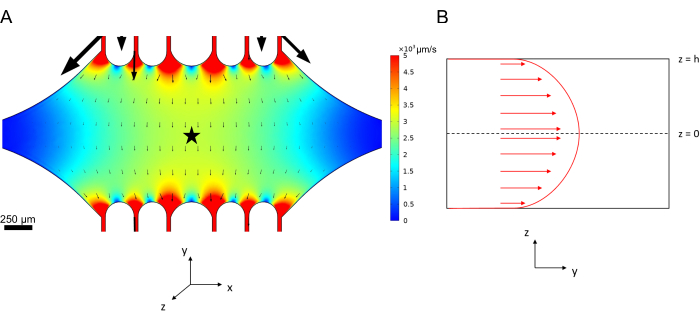
Şekil 6: Cihaza üst porttan giren ve alt porttan çıkan sıvının akışkan akış analizi için sistemin tanımlanması (portlar gösterilmemiştir). (A) Şekil 3B'deki gibi ölçeklendirilmiş merkez hattı hız alanının simülasyonu. Yıldız, panel B'nin ilgilendiği alanı belirtir. (B) Cihazın kesitsel gösterimi. Tam gelişmiş akışkan akış profili, z = 0'da bir merkez çizgisi hızı vc ve duvarlarda kaymaz bir sınır koşulu ile y yönündedir. Bu paneldeki okların, panel A'da gösterilen gerçek hız alanına göre ölçeklendirilmediğini unutmayın. Bu rakam Rogers'ın (2022)14 izniyle değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Simülasyonların ötesinde, akışkan hızı, basıncı korumak yerine hacimsel bir akış hızına dayalı bir akış kontrolörü kullanılarak kontrol edilebilir. Ayrıca, her bir cihazdaki yerel akış hızı, floresan boncuklar dahil edilerek ve hızları izlenerek doğrudan belirlenebilir, böylece numuneden numuneye değişkenlik azaltılır.
Hesaplamalı modelleme ve gradyan gösterimleri
Son olarak, bu cihazı yüksek verimli deneyler için kullanmanın fizibilitesini göstermek için deneylerle birlikte hesaplamalı simülasyonlar gerçekleştirdik. Cihazın simetrisi sayesinde mikrotübülleri birden çok yönde bükme yeteneğinin yanı sıra, simülasyonlar, cihazın hassas gradyanları koruyabildiğini ve birden fazla deneysel koşulun aynı anda araştırılmasını sağladığını gösterdi (Şekil 7A). Çözeltide floresan boya kullanılarak yapılan ön deneyler (bu yayının bir parçası olarak açıkça belirtilmeyen yöntemler), hesaplama tahminleriyle tutarlılık göstermiştir (Şekil 7B). Ayrıca, farklı floresan etiketlerle aynı anda büyüyen mikrotübül uzantıları ile farklı proteinlerin cihazın farklı alanlarında bölünmesini başarıyla gösterdik (Şekil 8). Bildiğimiz kadarıyla, bu, yüksek verimli mikroakışkanların mikrotübül araştırmalarına ilk uygulamasıdır. Bu cihazın bu özelliği, deneysel sağlamlığı artırırken aynı zamanda ihtiyaç duyulan reaktiflerin zamanını ve miktarını azaltmak için kullanılabilir. Örneğin, farklı proteinlerin veya tek tek proteinlerin farklı konsantrasyonlarının mikrotübül mekaniği ve dinamiği üzerindeki etkileri, tek bir cihazda aynı anda aynı anda araştırılabilir.
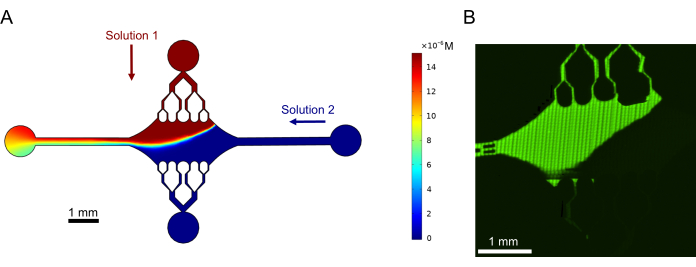
Şekil 7: Gradyan oluşumu. (A) Cihaza aynı giriş basıncında (50 mbar) ve konsantrasyonda (15 μM) giren iki çözeltinin gradyanının simülasyonu. Her çözüm için giriş portları renkli oklarla gösterilir (üst portta bir çözüm ve sağ portta başka bir solüsyon) ve kalan iki port çıkış görevi görür. Isı haritası, en üstteki çözeltinin konsantrasyon profilini gösterir. Kararlı durum t = 5 s'de elde edildi. (B) Üst portta çözelti içinde floresan boya ve sağ portta tampon kullanılarak benzer bir gradyanın deneysel olarak üretilmesi. Görüntü, tüm cihaz alanını çözümlemek için her bir görüş alanının (80 μm × 80 μm) dikilmesiyle oluşturulan bir raster katmandır. Bu rakam Rogers'ın (2022)14 izniyle değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
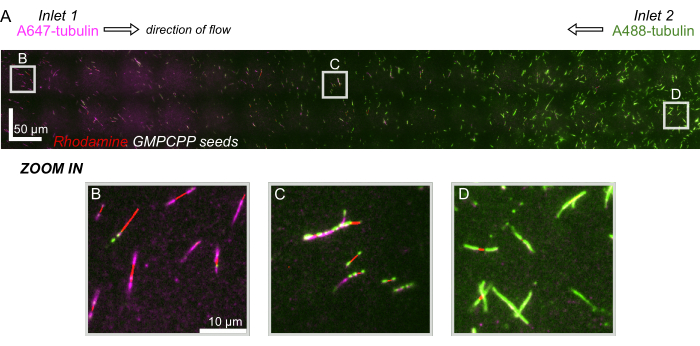
Şekil 8: Mikroakışkan cihazda bir protein gradyanının gösterilmesi. AlexaFluor647 etiketli tübülin (macenta) cihazın giriş 1'inde ve AlexaFluor488 etiketli tübülin (yeşil) cihazın giriş 2'sinde eşit konsantrasyonlarda ve akış hızlarında uçuruldu. Karışım inhibe edilirken stabilize GMPCPP tohumlarından (kırmızı) tübülin polimerizasyonuna izin vermek için akış 90 s'lik artışlarla açılıp kapatıldı. (A) Cihazın tüm uzunluğunu çözmek için görüş alanlarının (80x80 μm) dikilmesiyle oluşturulan büyük ölçekli raster katmanı. Harfler, sonraki panellerde tek tek görüş alanlarının göreli konumunu belirtir. Ölçek çubuğu, X ve Y konumunda 50 μm'dir. (B) Uzantıların ağırlıklı olarak A647 etiketli tübülinden oluştuğu, cihazın 1 numaralı girişine yakın görüş alanı. (C) Cihazın ortasına yakın görüş alanı, uzantıların tahmin edildiği gibi etiketli tübüllerin bir karışımından oluştuğu yer. (D) Uzantıların ağırlıklı olarak A488 etiketli tübülinden oluştuğu, cihazın alt kısmına yakın görüş alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Mikroskop üzerinde mikroakışkanlar deney düzeneği için bir proses akış diyagramı (PFD) Ek Şekil 1'de gösterilmiştir.
Ek Şekil 1: Mikroskop üzerinde mikroakışkanlar deney düzeneği için bir proses akış diyagramı (PFD). Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Video 1. Mikroakışkan kurulum, stabilize mikrotübülleri bükmek için kullanılabilir. Paklitaksel ile stabilizasyondan sonra dinlenme durumundaki mikrotübüller, pulsatil akış sırasında bükülür. 30 mbar'lık sabit bir yukarı akış basıncı, akışı tahrik eder. Video oynatma hızı 10 fps. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 1: Mikroakışkan maske tasarımının bir CAD dosyası. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolün birincil amacı, mikrotübül mekaniğinin in vitro olarak araştırılması için uygun bir mikroakışkan cihaz tasarlamak ve üretmekti. Tasarım, PDMS tabanlı mikroakışkan cihazların içsel faydalarından yararlanma arzusuna dayanırken, aynı zamanda sağlam ve özelleştirilebilir yüksek verimli deneyler sağlayacak özelliklerin bir kombinasyonunu da içeriyordu.
Bu hedefe başarıyla ulaşıldı ve bu sistemin gelecekteki kullanıcıları için temel oluşturabilecek üretim protokolleri ve genel yönergelerle sonuçlandı. Cihaza yedekli kabarcık tuzaklarının dahil edilmesi, hava kabarcıklarının varlığından dolayı protein denatürasyonu olasılığını azaltır. Cihazdaki boruların hala bir miktar sökülüp yeniden takılmasına rağmen, bu kabarcık tuzakları deneysel arıza olasılığını azaltır. Mikroakışkan kurulumunda gelecekteki iyileştirmeler, bir deney sırasında yapılan manuel boru manipülasyonlarının miktarını daha da azaltabilir. Ayrıca, mikroakışkan cihazın otomatik bir akış kontrol yazılımı ile entegrasyonu, manuel hata olasılığını azaltırken deneysel koşulların önemli ölçüde özelleştirilmesine olanak tanır. Cihazın başarılı performansını, cihazı imal ederek ve ardından otomatik, kontrolör tarafından düzenlenen akış kullanarak cihazdaki mikrotübül uzantılarını büyüterek, stabilize ederek ve bükerek gösterdik. Ayrıca, aynı cihaz içinde farklı floresan etiketli tübülin çözeltilerinin bir gradyanını oluşturarak, tek bir cihazda birden fazla koşulun aynı anda çalıştırılabileceğini gösterdik. Hesaplamalı modelleme ve analiz tekniklerinin yardımıyla, sistemimiz eğilme sertliği52,56,57,58,59 gibi mikrotübüllerin biyomekanik özelliklerini araştırabilir ve belirleyebilir.
Gelecekteki potansiyel iyileştirmeler, daha da sağlam bir sistemi ve ilgili deneysel analizi kolaylaştıracaktır. İlk olarak, fotorezist biriktirme, maruz kalma ve pişirme, bazı değişkenlikler gösteren çok önemli parametrelerdi. SPR fotorezistin nispeten uzun özellik boyutları, cihazları bozabilecek termal çatlamayı önlemek için çok kademeli ısıtma ve soğutma gerektiriyordu. Daha ince cihazlar denenirken, bu daha küçük özellik boyutlarının manipülasyonu ile ilgili sorunlar bulduk. Bu kalınlıktaki cihazları SPR fotorezist ile çoğaltmak için ayrıntılara dikkat ve sabır çok önemlidir. Kullanılabilirliğe bağlı olarak bu sorunu çözmek için farklı fotorezistler kullanılabilir.
Birlikte ele alındığında, buradaki mikroakışkan cihaz ve protokol, önceki akış hücresi tahlillerinden daha sağlam, yüksek verimli test yeteneklerine sahip bir dizi deneysel kuruluma izin verir47. Ayrıca, cihazdaki hassas akış profillerini veya konsantrasyon gradyanlarını korumak için akış kontrolörleri kullanılarak deneyler otomatikleştirilebilir ve bu da manuel kullanıcıların doğasında bulunan değişkenliği azaltır. Bu kurulumun gelecekteki potansiyel uygulamaları arasında, mikrotübül ile ilişkili proteinlerin mikrotübül eğilme sertliği, dinamikleri, kafes hasarı ve onarımı üzerindeki etkilerinin yanı sıra mikrotübüllerin ve aktin filamentlerinin biyomekanik etkileşimlerinin araştırılması yer alır 54,60,61,62,63,64,65,66,67,68,69,70. Mikrofabrikasyon, otomatik akış kontrolü ve hesaplamalı modelleme ve analiz tekniklerinin entegrasyonu, hücresel hücre iskeletini in vitro olarak incelemek için uygun çok yönlü bir sistem oluşturur.
Açıklamalar
Yazarların herhangi bir çıkar çatışması yoktur. Yazarlar, metin revizyonu ve redaksiyon için ChatGPT-4o OpenAI'nin kullanımını açıklamaktadır.
Teşekkürler
Bu araştırmanın bir kısmının yürütüldüğü Vanderbilt Nano Ölçekli Bilim ve Mühendislik Enstitüsü (VINSE) tarafından sağlanan destek ve kaynaklar için minnettarız. Bu çalışma kısmen M. Zanic'e (R35 GM1192552) bir NIH NIGMS hibesi ve M. Zanic'e NSF ID 2018661 hibesi ile finanse edildi. M. Rogers, NIH T32 GM08320 hibesinden ve bir VINSE pilot finansman ödülünden destek aldı. L. Richardson, NSF GRFP Hibe No. 1937963 tarafından desteklenmektedir. Yazarlar ayrıca yardımları ve destekleri için Dr. Alice Leach, David Schaffer, Dr. Christina McGahan ve tüm Zanic laboratuvarına teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.6 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mm standard biopsy punch | Integra LifeSciences | 33-31A-P/25 | |
| 100x/1.49 numerical aperture TIRF objective | Nikon | ||
| 22 x 22 mm glass coverslips | ThorLabs | CG15CH | |
| 3" single side polished silicon wafers | University Wafer | 447 | |
| 4" Petri dish | Any brand | ||
| 450 µL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter, Inc. | 345843 | Referred to as 'airfuge tube' in the protocol |
| 488-, 561, and 640-nm solid state lasers | Nikon | ||
| A-95 Fixed-Angle Rotor | Beckman Coulter, Inc. | 347595 | |
| Acetone | Any brand | ||
| Airfuge Air-Driven Ultracentrifuge | Beckman Coulter, Inc. | 347854 | Referred to as 'airfuge' in the protocol |
| Alexa Fluor 488 Microscale Protein Labeling Kit | Thermo Fisher Scientific | A30006 | |
| Aluminum foil | Any brand | ||
| Andor iXon Ultra EM-CCD | Nikon | ||
| Andor NEO sCMOS | Nikon | ||
| AutoCAD | Autodesk | Generic versions can be used | |
| Bovine brain unlabeled tubulin (purified) | N/A | Made in house, but can be purchased | |
| Casein | MilliporeSigma | C7078 | |
| Catalase | MilliporeSigma | C9322 | |
| Clean Dry Air (CDA) (pressurized gas) | Any brand | ||
| Compressed air supply | Any brand | Connects to the microfluidic flow controller | |
| COMSOL Multiphysics software | COMSOL, Inc. | ||
| Custom brass stage adapter | N/A | Made in house to fit our 22 mm x 22 mm coverslips onto the microscope | |
| De-ionized water | Any brand | ||
| Dessicator | Any brand | ||
| D-glucose | MilliporeSigma | G7528 | |
| Dithiothreitol (DTT) | MilliporeSigma | D0632 | |
| EGTA | MilliporeSigma | 324626 | |
| Elveflow Smart Interface (ESI) software | Elveflow | ||
| Flangeless PFA fittings with ETFE ¼”-28 to 1/16” outer diameter ferrules | Darwin Microfluidics | CIL-XP-245X | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack |
| Fluiwell 4-Channel 2 mL Low Pressure | Fluigent | 14002001 | Used to connect the flow control system to the the micrewtubes. Also refered to as 'pressurized reservoir rack' |
| Fume hood | Any brand | ||
| Glucose oxidase | MilliporeSigma | G6125 | |
| GMPCPP | Jena Bioscience | NU-405L | |
| Guanosine triphosphate (GTP) | MilliporeSigma | G8877 | |
| Hot plate | Any brand | ||
| HS-625 high-speed emission filter wheel | Finger Lakes Instrumentation | ||
| ImageJ software | N/A | Open access | |
| Incubator | Any brand | ||
| Isopropyl alcohol | Any brand | ||
| Karl Suss MA-6 mask aligner | SUSS MicroTec | ||
| Magnesium chloride | MilliporeSigma | 1.05833 | |
| MATLAB software | MathWorks | ||
| MEGAPOSIT SPR 220 7.0 photoresist | Dow, Inc. | ||
| Microfluidic Fittings 6-40 to 1/4"-28 Adapters Kit | Darwin Microfluidics | LVF-KFI-08 | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack (Fluiwell rack) |
| Microfluidic Fittings Female Luer Lock Adapter Kit | Darwin Microfluidics | LVF-KFI-04 | Used to connect the syringe to the tubing |
| Microfluidic flow controller | Elveflow | OB1 MK3+ | |
| Microfluidic flow sensor | Elveflow | MFS3 | This flow sensor range is 0-80 μL |
| MICROPOSIT MF-319 developer | Dow, Inc. | ||
| Microscope | Nikon | Eclipse Ti | |
| NIS-Elements software | Nikon | ||
| Nitrogen (pressurized gas) | Any brand | ||
| Objective heater | Tokai Hit | ||
| One-Piece Fingertight 10-32 Coned Fitting for 1/16" OD Tubing | Darwin Microfluidics | CIL-F-120X | Used to connect the syringe to the tubing |
| Paclitaxol (Taxol) | Tocris Bioscience | 1097 | |
| Photolithography masks | N/A | Made by an external party using our designs | |
| PIPES | Thermo Fisher Scientific | 172615000 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Plasma flowmeter system | Harrick Plasma | PDC-FMG | Integrates with plasma cleaner to enable flow control of pressurized gas |
| Plastic bulb pipet | Any brand | ||
| Pluoronic F-127 | MilliporeSigma | P2443 | Referred to as 'poloxomer 407' in the protocol |
| Potassium chloride | Research Products International | P41000 | |
| Saint Gobain Performance Plastics Tube Tygon .020 ID | Thermo Fisher Scientific | 50-206-8921 | Refered to as '1.5 mm tubing' and 'tubing' in the protocol |
| Scalpel | Any brand | ||
| Spin coater | Cost Effective Equipment, LLC. | 200x | This model may be discontinued |
| Standard pipets and tip sets | Any brand | ||
| Standard plastic syringe | Any brand | We used a 10 mL Luer-slip syringe | |
| Sylgard 184 silicone elastomer kit | Dow, Inc. | Referred to as 'PDMS' and 'curing agent' in the protocol | |
| T339 Micrewtube with Lip Seal and Flat Screw Cap | Medline Industried, LP. | T339 | Referred to as 'source vial' in the protocol. We used both 0.5 mL and 1.5 mL sizes |
| TAMRA, SE; 5-(and-6)-Carboxytetramethylrhodamine, Succinimidyl Ester | Invitrogen | C1171 | Referred to as 'TTR' in the protocol |
| Trichloro(1H, 1H, 2H, 2H-perfluorooctyl) silane | MilliporeSigma | 448931 | |
| Trion Phantom RIE ICP | Trion Technology, Inc. | This plasma cleaner is only used in Step 1.1 of the protocol. Another plasma cleaner, like the one used for PDMS bonding, can be used instead; we just prefer the much lower vacuum achievable by this system for cleaning the silicon wafer | |
| TRITC Polyclonal Antibody | Thermo Fisher Scientific | A6397 | Referred to as 'anti-rhodamine antibody' in the protocol |
| Tweezers | Any brand | ||
| Vacuum pump | Any brand |
Referanslar
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Phys Today. 54 (6), 42(2001).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev Mod Phys. 77, 977(2005).
- Beebe, D. J., Mensing, G. A., Walker, G. M. Physics and applications of microfluidics in biology. Annu Rev Biomed Eng. 4, 261-286 (2002).
- Ng, J. M. K., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. Electrophoresis. 23 (20), 3461-3473 (2010).
- Dellaquila, A. Five Short Stories on The History of Microfluidics. , https://www.elveflow.com/microfluidic-reviews/general-microfluidics/history-of-microfluidics/ (2025).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: Microfluidics in drug discovery. Nat Rev Drug Discov. 5 (3), 210-218 (2006).
- Neužil, P., Giselbrecht, S., Länge, K., Huang, T. J., Manz, A. Revisiting lab-on-a-chip technology for drug discovery. Nat Rev Drug Discov. 11 (8), 620-632 (2012).
- Manz, A., Graber, N., Widmer, H. M. Miniaturized total chemical analysis systems: a novel concept for chemical sensing. Sens Actuators B: Chem. 1 (1-6), 244-248 (1990).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Knight, J. Microfluidics: Honey, I shrunk the lab. Nature. 418 (6897), 474-475 (2002).
- Photolithographic fabrication techniques for transistors which are an integral part of a printed circuit. Nall, J. R., Lathrop, J. W. 1957 International Electron Devices Meeting, Washington, DC, USA, , (1957).
- Rogers, M. The design and fabrication of a two-layer microfluidic device for studying microtubules in vitro [Master's Thesis]. , Vanderbilt University. Nashville, TN. (2022).
- Lee, J. B., Choi, K. H., Yoo, K. Innovative SU-8 lithography techniques and their applications. Micromachines. 6 (1), 1-18 (2015).
- Kim, P., et al. Soft lithography for microfluidics: A Review. Biochip J. 2 (1), 1-11 (2008).
- Venkatesan, S. u, Jerald, J., Asokan, P., Prabakaran, R. A Comprehensive Review on Microfluidics Technology and its Applications. Recent Advances in Mechanical Engineering. , Springer. Singapore. 235-245 (2020).
- Minteer, S. Microfluidic Techniques: Reviews and Protocols. , Humana Press. New Jersey. (2006).
- Mitra, S. K., Chakraborty, S. Microfluidics and Nanofluidics Handbook: Fabrication, Implementation, and Applications. , Taylor and Francis Group. Florida. (2016).
- Alberts, B., et al. Molecular Biology of the Cell. , Garland Science. New York. (2014).
- Howard, J. Mechanics of Motor Proteins and the Cytoskeleton. , Springer. Heidelberg. (2001).
- Hawkins, T., Mirigian, M., Selcuk Yasar, M., Ross, J. L. Mechanics of microtubules. J Biomech. 43 (1), 23-30 (2010).
- Gardel, M. L., Kasza, K. E., Brangwynne, C. P., Liu, J., Weitz, D. A. Chapter 19: Mechanical Response of Cytoskeletal Networks. Methods Cell Biol. 89, 487-519 (2008).
- Caporizzo, M. A., Prosser, B. L. The microtubule cytoskeleton in cardiac mechanics and heart failure. Nat Rev Cardiol. 19 (6), 364-378 (2022).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nat Mater. 14 (11), 1156-1163 (2015).
- Chu, S. H., et al. A microfluidic device for in situ fixation and super-resolved mechanosensation studies of primary cilia. Biomicrofluidics. 13 (1), 014105(2019).
- Geisterfer, Z. M., Zhu, D. Y., Mitchison, T. J., Oakey, J., Gatlin, J. C. Microtubule growth rates are sensitive to global and local changes in microtubule plus-end density. Curr Biol. 30 (15), 3016-3023 (2020).
- Schaedel, L., et al. Lattice defects induce microtubule self-renewal. Nat Phys. 15 (8), 830-838 (2019).
- Aher, A., et al. CLASP mediates microtubule repair by restricting lattice damage and regulating tubulin incorporation. Curr Biol. 30 (11), 2175-2183 (2020).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. ELife. 5, e13470(2016).
- Fourniol, F. J., et al. Micropattern-guided assembly of overlapping pairs of dynamic microtubules. Methods Enzymol. 540, 339-360 (2014).
- Vleugel, M., Roth, S., Groenendijk, C. F., Dogterom, M. Reconstitution of basic mitotic spindles in spherical emulsion droplets. J Vis Exp. (114), e54278(2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Mol Biol Cell. 27 (22), 3563-3573 (2016).
- VanDelinder, V., Brener, S., Bachand, G. D. Mechanisms underlying the active self-assembly of microtubule rings and spools. Biomacromolecules. 17 (3), 1048-1056 (2016).
- Roth, S., Gârlea, I. C., Vleugel, M., Mulder, B. M., Dogterom, M. Reconstitution of basic mitotic spindles in cell-like confinement. bioRxiv. , (2019).
- Xu, Z., et al. Microtubules acquire resistance from mechanical breakage through intralumenal acetylation. Science. 356 (6335), 328-332 (2017).
- Fanalista, F., et al. Shape and size control of artificial cells for bottom-up biology. ACS Nano. 13 (5), 5439-5450 (2019).
- Velve-Casquillas, G., Costa, J., Carlier-Grynkorn, F., Mayeux, A., Tran, P. T. A fast microfluidic temperature control device for studying microtubule dynamics in fission yeast. Methods Cell Biol. 97, 185-201 (2010).
- Portran, D., Schaedel, L., Xu, Z., Théry, M., Nachury, M. V. Tubulin acetylation protects long-lived microtubules against mechanical ageing. Nat Cell Biol. 19 (4), 391-398 (2017).
- Huang, Y. M., Uppalapati, M., Hancock, W. O., Jackson, T. N. Microtubule transport, concentration and alignment in enclosed microfluidic channels. Biomed Microdevices. 9 (2), 175-184 (2007).
- Uppalapati, M., Huang, Y., Shastry, S., Jackson, T. N., Hancock, W. O. Microtubule Motors in Microfluidics. Methods in Bioengineering: Microfabrication and Microfluidics. , Artech House Publishers. Boston, MA. (2009).
- Sung, J. H., Shuler, M. L. Prevention of air bubble formation in a microfluidic perfusion cell culture system using a microscale bubble trap. Biomed Microdevices. 11 (4), 731-738 (2009).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360(2019).
- Nakayama, T., et al. Circumventing air bubbles in microfluidic systems and quantitative continuous-flow PCR applications. Anal Bioanal Chem. 386 (5), 1327-1333 (2006).
- Park, S., Cho, H., Kim, J., Han, K. -H. Lateral degassing method for disposable film-chip microfluidic devices. Membranes. 11 (5), 316(2021).
- Pereiro, I., Fomitcheva Khartchenko, A., Petrini, L., Kaigala, G. V. Nip the bubble in the bud: A guide to avoid gas nucleation in microfluidics. Lab Chip. 19 (14), 2296-2314 (2019).
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biol. 95, 221-245 (2010).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: Information from a slowly hydrolyzable analogue, GMPCPP. Mol Biol Cell. 3 (10), 1155-1167 (1992).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bartlett, N. W., Wood, R. J. Comparative analysis of fabrication methods for achieving rounded microchannels in PDMS. J Micromech Microeng. 26 (11), 115013(2016).
- Yang, C. P. H., Horwitz, S. B. Taxol®: The first microtubule stabilizing agent. Int J Mol Sci. 18 (8), 1733(2017).
- Gittes, F., Mickey, B., Nettleton, J., Howard, J. Flexural rigidity of microtubules and actin filaments measured from thermal fluctuations in shape. J Cell Biol. 120 (4), 923-934 (1993).
- VanBuren, V., Cassimeris, L., Odde, D. J. Mechanochemical model of microtubule structure and self-assembly kinetics. Biophys J. 89 (5), 2911-2926 (2005).
- Dye, R. B., Fink, S. P., Williams, R. C. Taxol-induced flexibility of microtubules and its reversal by MAP-2 and Tau. J Biol Chem. 268 (10), 6847-6850 (1993).
- Drechsel, D. N., Kirschnert, M. W. The minimum GTP cap required to stabilize microtubules. Curr Biol. 4 (12), 1053-1061 (1994).
- Wisanpitayakorn, P., Mickolajczyk, K. J., Hancock, W. O., Vidali, L., Tüzel, E. Measurement of the persistence length of cytoskeletal filaments using curvature distributions. Biophys J. 121 (10), 1813-1822 (2022).
- Mickey, B., Howard, J. Rigidity of microtubules is increased by stabilizing agents. J Cell Biol. 130 (4), 909-917 (1995).
- Brangwynne, C. P., et al. Bending dynamics of fluctuating biopolymers probed by automated high-resolution filament tracking. Biophys J. 93 (1), 346-359 (2007).
- Venier, P., Maggs, A. C., Carlier, M. F., Pantaloni, D. Analysis of microtubule rigidity using hydrodynamic flow and thermal fluctuations. J Biol Chem. 269 (18), 13353-13360 (1994).
- Felgner, H., Frank, R., Schliwa, M. Flexural rigidity of microtubules measured with the use of optical tweezers. J Cell Sci. 109 (Pt 2), 509-516 (1996).
- Felgner, H., et al. Domains of neuronal microtubule-associated proteins and flexural rigidity of microtubules. J Cell Biol. 138 (5), 1067-1075 (1997).
- Nishida, K., et al. Effects of three microtubule-associated proteins (MAP2, MAP4, and Tau) on microtubules' physical properties and neurite morphology. Sci Rep. 13, 8870(2023).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Brouhard, G. J., Rice, L. M. Microtubule dynamics: An interplay of biochemistry and mechanics. Nat Rev Mol Cell Biol. 19 (7), 451-463 (2018).
- Lawrence, E. J., Chatterjee, S., Zanic, M. More is different: Reconstituting complexity in microtubule regulation. J Biol Chem. 299 (12), 105398(2023).
- Howard, J., Hyman, A. A. Dynamics and mechanics of the microtubule plus end. Nature. 422 (6933), 753-758 (2003).
- Mehidi, A., Aumeier, C. Regulation of the microtubule network; the shaft matters. Curr Opin Syst Biol. 34, 100457(2023).
- Verhey, K. J., Ohi, R. Causes, costs and consequences of kinesin motors communicating through the microtubule lattice. J Cell Sci. 136 (5), jcs260735(2023).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nat Rev Mol Cell Biol. 20 (1), 38-54 (2019).
- Théry, M., Blanchoin, L. Microtubule self-repair. Curr Opin Cell Biol. 68, 144-154 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır