Method Article
微小管ポリマーメカニクス研究のためのマイクロ流体工学に基づくアプローチの開発
要約
このプロトコルでは、微小管ポリマーの力学を調査するのに適したマイクロ流体デバイスの設計と製造について詳しく説明します。マイクロファブリケーション、自動フロー制御、および計算モデリング技術の合成により、 in vitroでの細胞細胞骨格のプローブに最適な柔軟なシステムが可能になります。
要約
このプロトコルでは、微小管ポリマーの力学を調査するために開発されたマイクロ流体デバイスの設計と製造について説明します。このデザインは、ポリジメチルシロキサン(PDMS)ベースのマイクロ流体デバイスの本質的な利点を活用し、堅牢でカスタマイズ可能なハイスループット実験アプローチを可能にするいくつかの機能を導入しています。開発した装置には、有害な気泡の発生を防ぐための冗長な気泡捕捉機能が組み込まれています。さらに、このデバイスは自動フロー制御システムとインターフェースし、手動の介入を減らし、ハイスループット分析を可能にします。商用シミュレーションソフトウェアは、このシステムを使用した流体輸送をより深く開発し、理解するために利用されています。最後に、デバイスの異なるセクションで異なる蛍光標識を持つ微小管伸長を成長させることにより、単一のデバイス内で複数の実験を同時に行う能力を実証します。全体として、このマイクロ流体フローシステムは、微小管ポリマーの力学を調査するために使用でき、より広範な微小管 in vitro 研究の実験デザインを改善します。マイクロファブリケーション、自動フロー制御、および計算モデリングアプローチの合成により、 in vitroでの細胞細胞骨格のプローブに最適な柔軟なシステムが可能になります。
概要
マイクロ流体工学は、流体流路の複雑な設計と製造により、多くの場合1マイクロリットル未満の微小な流体量を正確に制御することを可能にします1,2。マイクロ流体デバイスの小規模化は、ユニークな工学的現象を引き起こします。つまり、レイノルズ数(流体の流れにおける慣性力と粘性力の比の無次元尺度)は小さく、通常はマイクロ流体工学ではO(10)以下のオーダーであり、マイクロ流体デバイスにおける粘性力の重要性を強調しています。さらに、対流輸送と拡散輸送を比較するペクレ数では、マイクロ流体工学では対流輸送は一般的に無視できることを示しています3,4,5。マイクロ流体工学におけるこの拡散駆動型の層流領域は、正確な流体勾配を維持することにより、単一のデバイスでの並列実験をサポートするため、有利です。
フォトリソグラフィーは、マイクロ流体デバイスを作製するための主要な方法であることに変わりはない6,7,8。簡単に言うと、このプロセスには、マイクロ流体設計の「マスター」エッチングテンプレートを作成することが含まれます(図1)。感光性基板を調製し、マイクロ流体設計のフォトマスクをフォトレジストの領域を選択的に紫外線にさらします。その後のエッチング法により基板が現像され、デザインのレリーフが生成されます。ポリジメチルシロキサン(PDMS)は、多くの場合、マスターにキャストされ、硬化されます。その後、設計のマイナス特性を採用した硬化PDMSをマスターから取り外し、ガラスカバースリップに接着します。この製造プロセス全体は通常1〜2日かかるため、迅速な設計の反復と複数のデバイスの製造が可能になります。ソフトリソグラフィーと微細加工プロセスの詳細なレビューは、他の参考文献1,2,3,10,11,12,13で入手できます。
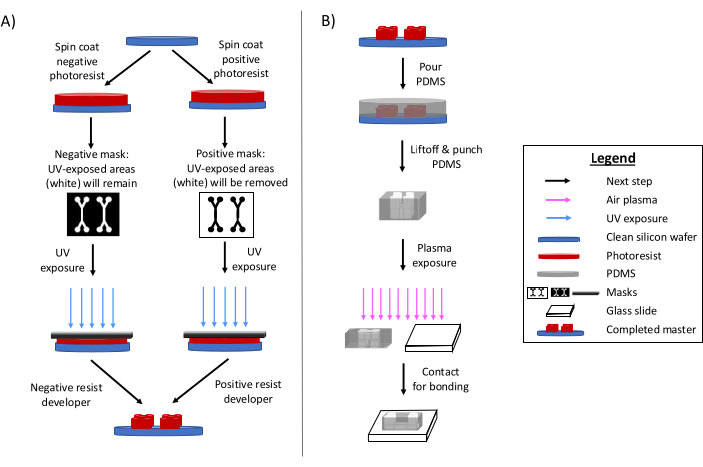
図1:従来のフォトリソグラフィープロセスと微細加工プロセスの概要(A)従来のフォトリソグラフィープロセスと(B)微細加工プロセス。用途や希望するフォトレジストの特性に応じて、ネガ型またはポジ型のフォトレジストを使用することができますが、それらは同じデザインマスターになります。必要なフィーチャ高さやフォトレジストの融解温度などの特性は、適切なフォトレジストの種類を決定するのに役立ちます。この図は、Rogers (2022)14の許可を得て修正されています。この図の拡大版を表示するには、ここをクリックしてください。
マイクロ流体工学の使用は、多くの研究分野で可能性を広げており、最近では生物科学にその影響があります。マイクロ流体工学は、その規模が小さいため、細胞やタンパク質などの限られた貴重なリソースを正確に管理することができます。さらに影響力があるのは、マイクロ流体システムが、基板の剛性の変化、試料への力の行使、さらには電流の統合などの生理学的条件を模倣する調整が可能なことです。さらに、マイクロ流体工学を使用すると、複数の試薬を並行して操作し、システム設計を迅速にプロトタイプ化し、反復的に改良することができます。これらの機能により、ラボのワークフロー全体を、一般に「ラボオンチップ」1,6,9,15,16,17,18,19と呼ばれる単一のデバイスに小型化することができます。
マイクロ流体工学の細胞生物学的応用の1つは、微小管ポリマーの研究です。微小管は、細胞の細胞骨格の必須成分であり、細胞分裂や細胞内貨物輸送などのプロセスにおいて重要な役割を果たしている20,21。細胞骨格の最も硬い要素として、微小管はプレキシガラスに匹敵する弾性率を示します22,23。それらの堅牢な機械的特性は、例えば、心臓の収縮期および拡張期に周期的に曲がったり弛緩したりする心筋細胞の収縮など、さまざまな細胞機能にとって重要である24。マイクロ流体デバイスは、in vitroで微小管とその高次構造の特性を調べるために以前に採用されてきました。実際、マイクロ流体工学は、微小管重合ダイナミクス、微小管-微小管相互作用、および微小管の機械的特性に対する微小管関連タンパク質の影響を調査するために使用されてきました25,26,27,28,29,30,31,32,33,34,35、36、37、38、39、40、41。
マイクロフルイディクスの微小管分野への導入は多くのエキサイティングな発見をもたらしましたが、これらのデバイスを微小管研究に適合させることにはまだ改善の余地があります。この研究では、マイクロ流体デバイスの微小管の研究に根強く残る2つの特定の制限、つまり、通常、マイクロ流体デバイスの手動操作によってもたらされるデバイス内の気泡形成の可能性と、ハイスループットアッセイの低利用について説明します。まず、チューブの抜き差しなどの手動操作により、チャネルに気泡が形成される可能性があります。フローセル内の気泡形成は、気泡がタンパク質を変性させ、微小管ポリマーをせん断し、細胞培養に悪影響を及ぼす可能性があるため、壊滅的である42,43。さらに、デバイスの鋭い角や斜めの角度は、表面の濡れが不均一になり、空気が巻き込まれる可能性が高くなります。気泡の形成、持続性、および影響を減らすために、数多くの技術が開発されてきました。ただし、バブル緩和方法の使用は普遍的ではありません42,43,44,45,46。さらに、マイクロ流体工学を使用する大きな利点の1つは、ハイスループット実験の能力ですが、マイクロ流体工学は微小管研究のスケールアップにはまだ使用されていません。マイクロ流体デバイスは、同じデバイス上で複数の実験条件を並行してテストするように設計できます。例えば、流体グラジエントを使用して、異なる微小管関連タンパク質や薬物の流れを誘導し、同じデバイス内で分割された微小管の特定の領域に標的を絞った送達を可能にすることができます。
ここでは、これらの制限に対処するマイクロ流体デバイスを反復的に設計しました。私たちは、デバイスの製造の段階的なプロトコルを提供し、それにより、より多くの人々が微小管の研究にマイクロ流体技術を採用できるようにします。このデバイス設計には、バブルトラップ機能が組み込まれており、自動フロー制御システムを利用して手動介入を減らすと同時に、デバイス内の溶液の勾配をハイスループット分析に利用できます。要約すると、このマイクロ流体設計の開発は、微小管力学の広範な研究と理解を促進すると同時に、より広範な微小管研究分野にわたる実験設計に貴重な改善を提供することができます。
プロトコル
注:プロトコルのこの部分で詳述されている作業は、ヴァンダービルトナノスケール科学工学研究所(VINSE)のコアクラス100クリーンルームで行われました。湿度/周囲の照明条件によるデバイスの損傷を防ぎ、粒子汚染を防ぐために、適切なガウンとUVフィルタリングされた照明を備えた制御されたクリーンルームが必要です。シリコンウェーハ上のすべての操作は、シリコンウェーハの研磨面を上に向けて行う必要があります。ウェーハを操作するときはピンセットを使用し、傷を防ぐためにウェーハの表面に触れることを最小限に抑えてください。特に指示がない限り、輸送時および一日の終わりには、ウエハースを蓋をしてシャーレに入れてください。
1. フォトリソグラフィー (6 - 8 h)
- 酸素(O2)またはクリーンドライエア(CDA)プラズマを使用して、3インチシリコンウェーハを真空下(理想的には真空圧<5 × 10-5 torr)で5分間プラズマクリーニングします。
- シリコンウェーハをスピンコーターの中央に配置して、フォトレジストを堆積させます。
- SPR 220 7.0フォトレジストをシリコンウェーハの中央に~1〜2mL堆積させます。
注意: フォトレジストは手袋と目の保護具を着用して取り扱い、メーカー/サイト固有のプロトコルに従って廃棄してください。 - シリコンウェーハ上のフォトレジストを、メーカーのスピンカーブに基づいて希望の厚さにスピンコートします。1000 RPMで30秒間回転することにより、~13 μmの厚さの層を生成します。その後、スピンコーターに残ったフォトレジストをアセトンで洗浄し、部位に応じたプロトコルに従って廃棄します。
注:スピンコーティング後、ウェーハがフォトレジストで均一にコーティングされていない場合は、手順1.2〜1.4を繰り返します。コーティングが不均一になるのは、スピンコーター上のウェーハが中心にないこと、フォトレジストの使用量が少なすぎること、および/またはフォトレジストがウェーハの中心に堆積していないことが原因である可能性があります。 - ウェーハ上のフォトレジストにできるだけ触れないようにしながら、シリコンウェーハを70°Cに設定されたホットプレートに移します。
- ホットプレート上でシリコンウェーハをインキュベートし、温度が115°Cに達するまで3〜5分ごとに温度を10°C上げます。
- ホットプレートの電源を切り、シリコンウェーハの温度が65°Cを下回るまで冷まします。
注:加熱と冷却のステップは、この厚さで一般的なフォトレジストの熱亀裂を防ぐためにゆっくりと実行されます。熱亀裂が発生した場合は、通常、シリコンウェーハを再加熱して冷却速度を遅くすることで修正できます。 - 鉗子を使用して、冷却したシリコンウェーハをマスクアライナーに移し、シリコンウェーハと対応するフォトマスクの両方をメーカー/サイト固有のプロトコルに従ってマスクアライナーにロードします。
注: フォトマスクは、AutoCAD で作成された指定されたデザインを使用して、外部の関係者によって製造されました。マスク デザインのレンダリングについては、 補足ファイル 1 を参照してください。 - シリコンウェーハを、メーカー/サイト固有のプロトコルに従って、特定の時間(UVランプの電力に基づく)紫外線(UV)にさらします。このアプリケーションに必要なエネルギーは~400 mJ/cm2で、露光時間は
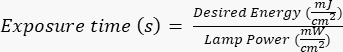 式で計算します。
式で計算します。 - 露光後、マスクアライナーからシリコンウェーハを取り出し、フォトレジストを空気循環により4時間再水和させます。空気の循環を確保するためにペトリ皿の蓋が外れていることを確認してくださいが、微粒子にさらされる可能性が低い場所に皿を置きます。
注:この水分補給時間中に4時間の休憩を取ることができますが、同じ日に手順を続行することをお勧めします。 - 4時間の水分補給後、露出したウェーハを70°Cに設定されたホットプレートに移します。
- ホットプレート上でシリコンウェーハをインキュベートし、温度が115°Cに達するまで3〜5分ごとに温度を10°C上げます。
- ウェーハを115°Cで10分間インキュベートします。
- 露出したウェーハの絶縁「カバー」を作成するには、シャーレの蓋の形をしたアルミホイルのシートを成形します。
- ホットプレートの電源を切り、露出したウェーハをアルミホイルカバーで覆います。ウェーハを一晩中周囲で冷まします。
注:フォトレジストの熱亀裂は、露光後のインキュベーションステップではるかに一般的であるため、一晩でゆっくりと冷却することをお勧めします。これで、製造初日に必要な手順は完了です。翌日に次のセクションに進むことをお勧めします。
2. 開発 (1 - 2 時間)
- 露光したウェーハを現像する準備ができたら、清潔な容器と適切なフォトレジスト現像剤を入手してください。ここでは、MF-319現像液を専用コンテナとともに使用します。
注意: 現像液を手袋と目の保護具で取り扱い、バルクコンテナをセカンダリコンテナに移し、メーカー/サイト固有のプロトコルに従って廃棄してください。 - 露出したウェーハを完全に沈めるのに十分な現像剤を容器に注ぎます(実際の容量は容器によって異なります)。
- 露光したウェーハを現像液に浸し、不要なフォトレジストがすべて溶解するまで待ちます。容器を穏やかに渦巻かせて攪拌すると、デバイス設計以外のウェーハ上に残留フォトレジストがほとんどまたはまったく見えなくなるまで、開発に役立ちます。
注:使用する現像液の量によっては、望ましくないフォトレジストを完全に除去するために、現像液の複数回の交換が必要になる場合があります。 - 現像したウェーハを現像液から取り出し、ウェーハの両面を脱イオン(DI)水で30秒間静かにすすぎます。
- 開発したウェーハを窒素(N2)ガスで乾燥させます。
- 開発したウェーハは、さらに使用する準備ができるまで、乾燥した涼しい環境のペトリ皿に保管します。ペトリ皿をアルミホイルで包み、周囲光への曝露によるフォトレジストの劣化を防ぎます。
注: 必須ではありませんが、同じ日に次のセクションに進むことをお勧めします。
3.シラン化(1〜2時間)
- シリコンウェーハをデシケーターに移します。
- 小さなアルミ容器(またはアルミホイルを容器の形に折りたたんだもの)をデシケーターに入れます。
- トリクロロ(1H、1H、2H、2H-パーフルオロオクチル)シランを1滴(~50μL)ピペットでアルミニウム容器に入れます。
注意: シラン溶液は手袋と目の保護具を着用して取り扱い、製造元/サイト固有のプロトコルに従って廃棄してください。 - デシケーターを閉じて、掃除機をオンにします。
- 乾燥/シラン化が1〜2時間発生するのを待ちます。
- シラン化時間が終了したら、バキュームをオフにして、シラン化したウェーハを回収します。シラン処理されたウェーハは、アルミホイルで包まれたペトリ皿に入れ、乾燥した涼しい環境で、さらに使用する準備ができるまで保管します。
注:シラン化は、ウェーハ上で定期的に繰り返す必要があり、PDMSの薄い層が使用されるデバイスではより頻繁に繰り返す必要がある場合があります。ウェーハからPDMSを取り外すときにPDMSの付着が見られる場合は、ウェーハを再サイレン化する必要がある可能性があり、すべてのPDMSをウェーハから取り外した後、このセクションを繰り返す必要があります。以上で、マイクロ流体デバイスマスターの作成に必要な手順は完了です。マスターは安定しており、必要に応じて後続のセクションを実行できます。
4. PDMS蒸着(1〜2時間)
注:以前の微細加工によるマスターにPDMSが残っている場合は、新しいPDMSを堆積する前に残留PDMSを除去する必要があります。
- はかりで、PDMSと関連する硬化剤を10:1の重量比で容器に計量します。必要な総重量は、目的のPDMSの厚さとペトリ皿のサイズによって異なります。4インチのシャーレの場合、~20 gのPDMSと~2 gの硬化剤を使用すると、2〜3 mmの厚さが得られます。
注意: PDMS溶液は手袋と目の保護具を着用して取り扱い、製造元/サイト固有のプロトコルに従って廃棄してください。 - プラスチックスパチュラまたはその他の適切なツールを使用して、PDMSと硬化剤を容器内で5分間混合します。
- 混合したPDMS容器をデシケーターに移し、脱気します。
- デシケーターを閉じて、掃除機をオンにします。PDMSに気泡が現れ始めます。
- 乾燥/脱気を30分間行います。使用する PDMS の量やコンテナの形状によって、実際の時間は異なる場合があります。一般的なエンドポイントは、PDMS にバブルがほとんどまたはまったく存在しない場合です。
- 脱気後、バキュームをオフにしてPDMS容器を取り出します。
- 混合して脱気したPDMSをペトリ皿のマスターに注ぎます。
- 密閉したシャーレでマスターを65°Cで一晩インキュベートし、PDMSが完全に硬化するまで待ちます。
メモ: これで PDMS の成膜の手順は完了です。PDMSをインキュベーターで一晩硬化させることをお勧めします。その後、PDMS は安定しているため、必要に応じて後続のセクションを実行できます。
5. PDMSデバイスの組み立て(1〜2時間)
- PDMSを硬化させたデバイスマスター、一対の鉗子、手動プランジャー付きの標準的な1.5mm生検パンチ、メス/カミソリの刃を回収します。
注意: ブレードの取り扱いには注意し、自分や他の人に向かって切らないでください。自動格納式または安全ブレードをお勧めします。 - デバイスの特徴の周りで、レイヤーマスターからPDMSの長方形の部分を切り取ります。PDMSの各ピースが両側にある程度のスペースを確保し、デバイスの機能に隣接して良好なボンディング接触を容易にすると同時に、各ピースが22 mm×22 mmのガラスカバースリップに収まるようにします。
注意: PDMSの底面(フィーチャのある面)に触れないようにすることが重要ですので、常にピンセットを使用してPDMSの端を取り扱ってください。さらに、PDMSの機能側を下に向けて表面に置かないでください。使用しないときは、PDMSをフィーチャー面を上にして、必要になるまで密閉容器に保管してください。 - きれいな1.5mmの穴あけパンチを使用して、PDMSのピースに入口と出口の穴を開けます。デバイスのPDMSを、穴あけパンチを損傷する可能性のある硬い表面ではなく、犠牲PDMSの予備層に打ち抜きます。
- 22 mm×22 mmのガラスカバースリップを取り出して、イソプロピルアルコール(IPA)ウェットティッシュで清掃します。
- 22mm×22mmのカバーガラスをCDAプラズマを用いて真空下(圧力0.5Torr)<5分間プラズマ洗浄します。これにより、カバーガラスの破片や有機コーティングが取り除かれます。
- 22 mm×22 mmのガラスカバースリップとPDMSの特徴側をIPAウェットワイプで拭きます。
- PDMS(フィーチャー側を上に向ける)とガラスカバースリップ(以前に洗浄したものと同じ側を上に向ける)の両方をプラズマクリーナーにセットし、CDAプラズマを使用して真空下(圧力<0.5Torr)で30秒間同時にプラズマクリーニングします。
- ガラスカバースリップとPDMSデバイスの両方をプラズマクリーナーから取り外します。フィーチャー側が下を向くようにPDMSを反転させ、ガラスカバースリップの上に置きます。接着を観察し、必要に応じてPDMSを軽く押して、良好な接触を促進します。
- 接着したカバースリップを密閉したペトリ皿に65°Cで3分間インキュベートし、接着を促進します。
注:プラズマボンディングは、ガラスカバースリップの疎水性を変化させ、親水性の表面を生成します。カバーガラスの元の疎水性状態は、室温で約2日間のインキュベーション後に戻ることが逸話的な証拠によって観察されています。プラズマボンディング後2日以内に製造されたデバイスを使用することをお勧めします。これで微細加工のステップは完了です。デバイスには保存期間が設定されていませんが、使用しないときは涼しく乾燥した場所に保管する必要があります。
6. マイクロ流体流路の準備(1時間)
- 組み立てられたマイクロ流体デバイスをクリーンなカスタムステージアダプタ47に固定する。
- シリンジ、Lour-lockアダプターとフィッティングフェルール、および外径1.5 mmの透明チューブ(長さ約15〜20 cm)を取り出します。アダプターを介してチューブをシリンジに接続します。
- さらに3本のチューブをマイクロ流体デバイスの出口に接続し(このチューブは特定の長さである必要はありません)、これらのチューブのもう一方の端を下流の廃バイアルに向けます。
- シリンジを使用して、以下の手順に従って溶液を導入してマイクロ流体デバイスを調製します。溶液の配列と容量は、BRB80緩衝液50μL、抗ローダミン抗体溶液25μL、5分間待機、BRB8050μL、ポロキサマー407(F127)25μL、15分間待機、BRB80を50μLです。例については 、表 1 を参照してください。
- 溶液をそのソースからチューブに引き込みます。
注意: 溶液をシリンジ自体の奥まで引っ張らないでください。溶液はチューブ内にのみ残す必要があります。 - チューブの端に液体の小さな液滴が存在するまで、シリンジプランジャーを静かに押し下げます。これにより、チューブを取り付けたときにマイクロ流体デバイスに空気が入るのを防ぐことができます。
- チューブをマイクロ流体デバイスの入口に取り付けます。
- 溶液のすべてではありませんが、ほとんどの溶液がチューブを通って流れるまで、シリンジプランジャーをゆっくりと押し下げます。チューブに少量の液体を残すと、誤って空気がチューブに押し込まれることがなくなります。これらの移送中にチューブとマイクロ流体チャネルを観察し、気泡を探します。
注意: チューブに気泡が発生した場合は、トラブルシューティングを開始します(気泡が到着する直前にチューブのプラグを抜き、気泡が通過した後にチューブを再度取り付けるなどして、マイクロ流体デバイスに入る前に気泡を取り除くようにしてください)。 - すべての試薬が飛翔するまで、次の試薬に対して手順6.4.1〜6.4.4を繰り返します。ソース試薬の相互汚染を防ぐために、各試薬に新しいインレットチューブが必要になります。最終的なBRB80洗浄が完了すると、デバイスは数分間安定します。入口にBRB80溶液を滴下すると、デバイスの乾燥を防ぐことができます。
- 溶液をそのソースからチューブに引き込みます。
- グアノシン-5'-[(α,β)-メチルノ]三リン酸(GMPCPP)安定化微小管「種子」を標準プロトコルに従って調製します(TTR標識比~25%)47,48。
- 以下の試薬をそれぞれの量(ストック濃度による)で組み合わせて、2倍の使用濃度でイメージング緩衝液(「退色防止」)を調製し、指定された最終濃度が得られます:BRB80に40 mMグルコース、40 μg/mLグルコースオキシダーゼ、16 μg/mLカタラーゼ、0.5 mg/mLカゼイン、50 mM塩化カリウム、および10 mMジチオスレイトール(DTT)を添加します。このイメージングバッファーは、光安定性を延長するために使用されます。例については 、表 2 を参照してください。
- 2倍色褪色防止剤溶液の一部をBRB80で1:1に希釈して、1倍色褪色防止剤の作業溶液を得ます。この退色防止剤を室温(RT)まで温めます。純正の退色防止剤溶液は氷上に保管する必要があります。
| 命令 | 試薬 | 体積希釈 | 洗浄量 | インキュベーション時間 |
| 1 | BRB80 | 該当なし | 50 μL | 該当なし |
| 2 | 抗ローダミン抗体 | BRB80で1:50、よく混ぜる | 25μL | 5分間 |
| 3 | BRB80 | 該当なし | 50 μL | 該当なし |
| 4 | ポロクサマー407(F127) | BRB80の1% | 25μL | 15分 |
| 5 | BRB80 | 該当なし | 50 μL | 該当なし |
表1:マイクロ流体デバイスチャネルの調製順序。
| 容積 | 試薬 | ストック濃度 | 最終濃度 |
| 16μL | D-グルコース | 2メートル | 80 mM |
| 16μL | グルコースオキシダーゼ | 2 mg / mL | 80 μg/mL |
| 16μL | カタラーゼ | 0.8 mg/mL | 32 μg/mL |
| 14 μL | カゼイン | 28 mg/mL | 0.16 mg/mL |
| 8 μL | DTTの | 1メートル | 20 mM |
| 40 μL | 塩化カリウム | 1メートル | 100 mM |
| 290μL | BRB80 | 1倍 | 該当なし |
| 400μL | FINAL(作業濃度の2倍) |
表2:色あせ防止イメージング溶液のレシピ(2倍濃度)。
7. マイクロ流体への微小管シードの導入 (10 - 15 分)
- マイクロ流体デバイスを顕微鏡に接続します。
注:微小管の安定性は温度に依存するため、イメージング実験は35°Cで実施することをお勧めします。 - 10〜15 cmの新しいチューブをシリンジに取り付け、GMPCPP安定化微小管シードの所望の希釈液をチューブに引き込みます。
注:このデバイスでは、~10 nM GMPCPP-微小管シードが最適な濃度でした。 - チューブの端に液体の小さな液滴が存在するまで、シリンジプランジャーを静かに押し下げます。これにより、チューブを取り付けたときにマイクロ流体デバイスに空気が入るのを防ぐことができます。
- チューブをマイクロ流体デバイスの入口に取り付けます。
- 溶液のすべてではありませんが、ほとんどの溶液がチューブを通って流れるまで、シリンジプランジャーをゆっくりと押し下げます。チューブに少量の液体を残すと、誤って空気がチューブに押し込まれることがなくなります。
- インレットチューブをマイクロ流体デバイスとシリンジから取り外し、新しいチューブをシリンジに取り付けます。
- BRB80をチューブに引き込みます。
- 手順7.3〜7.6を繰り返して、結合していない微小管の種子をデバイスから洗い流します。
- 全反射蛍光(TIRF)顕微鏡を使用して、マイクロ流体表面へのシードの付着を観察します。1つの視野内の理想的なシード数は、アプリケーションと視野サイズによって異なりますが、一般的には、80 μm×80 μmの視野あたり~10〜20個のシードが最適です。必要に応じて、目的のシード密度に達するまで手順7.2〜7.9を繰り返します。
注:微小管シード密度のモニタリングには、溶液中にまだ退色防止剤が存在しないため、断続的な短光曝露(100 ms)を使用する必要があります。 - 適切な結合種子密度に達したら、新しいインレットチューブをシリンジに取り付けます。
- 温かい1x退色防止剤をチューブに吸い込み、手順7.3〜7.6を繰り返します。
注:色あせ防止液がデバイス内に入ったため、光安定性が大幅に向上し、デバイスが安定しています。ただし、レーザー光への曝露を最小限に抑えることをお勧めします。
8. 種子からの微小管伸長の成長 (15 - 30 分)
- 蛍光標識チューブリン、非標識チューブリン、2倍退色防止液、グアノシン-5'-三リン酸(GTP)、およびBRB80を組み合わせると、14 μMチューブリンを7%の蛍光標識比で、1倍の作業濃度で退色防止剤、および1 mM GTPを含む最終溶液が得られます。
注:チューブリンの濃度や標識率が異なる場合は、各試薬の容量を調整して、目的の最終濃度と標識比率を達成する必要があります。チューブリン溶液を氷上に置いてから~30秒前まで導入し、その時点で溶液を氷から取り出し、手でRTまで温めます。これにより、温度依存性のプロセスである微小管伸長部の重合が促進されます。実際、微小管の重合は35°Cで行う必要がありますが、他のすべての実験ステップはRTで行うことができます。 - 10〜15 cmの新しいチューブをシリンジに取り付け、チューブ溶液をチューブに引き込みます。
- チューブの端に液体の小さな液滴が存在するまで、シリンジプランジャーを静かに押し下げます。これにより、チューブを取り付けたときにマイクロ流体デバイスに空気が入るのを防ぐことができます。
- チューブをマイクロ流体デバイスの入口に取り付けます。
- 溶液のすべてではありませんが、ほとんどの溶液がチューブを通って流れるまで、シリンジプランジャーをゆっくりと押し下げます。チューブに少量の液体を残すと、誤って空気がチューブに押し込まれることがなくなります。インレットチューブをマイクロ流体デバイスから取り外します。
- 目的の周波数で10〜15分間、またはエクステンションが曲がるのに十分な長さになるまで画像化します。通常、イメージングは、5秒ごとに488 nm、60秒ごとに561 nmで、伸長が少なくとも5〜10 μm(~15分)になるまで実行されます。
注:この濃度のチューブリンでは、微小管は重合と解重合の期間の間で確率的に切り替わる可能性があります。これは予想されることですが、全体として、微小管の伸長部は49伸びます。
9. 微小管伸展の安定化 (10-15分)
- タキソール、2倍退色防止剤溶液、およびBRB80を併用して、10 μMのタキソールと退色防止剤を1倍の使用濃度で含む最終溶液が得られます。
注:導入の~30秒前までタキソール溶液を氷上に置いておき、その時点で溶液を氷から取り出し、手でRTまで温めます。これにより、温度依存性のプロセスである微小管伸長部の解重合が防止されます。 - 10〜15 cmの新しいチューブをシリンジに取り付け、タキソール溶液をチューブに引き込みます。
- チューブの端に液体の小さな液滴が存在するまで、シリンジプランジャーを静かに押し下げます。これにより、チューブを取り付けたときにマイクロ流体デバイスに空気が入るのを防ぐことができます。
- チューブをマイクロ流体デバイスの入口に取り付けます。
- 溶液のほとんど(すべてではない)がチューブを通って流れるまで、シリンジプランジャーを押し下げます。チューブに少量の液体を残すと、誤って空気がチューブに押し込まれることがなくなります。
- 手順9.2〜9.5を2回すばやく続けて繰り返します。この場合、同じチューブを使用できます。
注:タキソールは、溶液中のチューブリンからの de novo 微小管核形成を促進し、これらの微小管はマイクロ流体チャネルの表面に着地し、その後のイメージング/曲げを妨げる可能性があります。このため、タキソール溶液は、デバイス内を迅速かつ複数回繰り返して流れ、デバイスから遊離チューブリンをできるだけ早く除去する必要があります。 - 種子から成長した微小管がまだ存在し、デバイス内で安定化していることを確認します。
10. 安定化微小管伸展の曲げ加工 (10 - 15 分)
注:安定化された微小管伸展部は、フローコントローラーを使用して曲げることができるようになりました。ここでは、調整された正圧変位システム(Elveflow OB1 MK3+)を使用して、気密源バイアルから流量計を通ってマイクロ流体に溶液を流しました。使用可能なフローコントローラーの設定の詳細に応じて、次の手順に変更が加えられる場合があります。
- ソースバイアルを流量計入口に接続し、流量計出口をマイクロ流体入口に接続するチューブを使用して、メーカー/サイト固有のプロトコルごとにフローコントローラーと関連機器を設定しますが、チューブはまだマイクロ流体デバイスに取り付けないでください。
- ~200 μL の 10 μM タキソール溶液を、フローコントローラーのセットアップに取り付けることができるソースバイアルに挿入します。このセットアップでは、ルアーロック接続を使用して気密シールを作成します。
- フロー制御システムをオンにし、チューブをプライミングして空気を取り除きます。これにより、チューブを取り付けたときにマイクロ流体デバイスに空気が入るのを防ぐことができます。
- チューブが流量計を介してプライミングされ、チューブの端に小さな液滴が存在した後、フロー制御システムをオフにします。
- チューブをマイクロ流体デバイスの入口に接続します。微小管の種子を導入し、直交的に曲がるために微小管の延長を成長させるために使用される入口に垂直な入口を使用します。
- 希望の流量または圧力で流れを開始および停止することにより、エクステンションを曲げます。30 mbarの圧力は、5 s周期の振動流を使用するこのプロトコルの標準です。この間の曲げをイメージします (通常は 488 nm で 0.1 秒ごと、561 nm で 10 秒ごと)。
注:これで基本的な微小管曲げアッセイは完了です。すべての機器と試薬は、メーカー/サイト固有のプロトコルに従って洗浄/廃棄できます。
結果
マイクロ流体デバイスの設計根拠
この研究におけるマイクロ流体デバイスの設計は、従来の単純なフローセル設計を構築および改善するいくつかの主要な特徴(図2)によって導かれました。注目すべきは、マイクロ流体デバイスの内部容積が~160nLであり、従来のフローセルの~10μLの容量よりも大幅に小さくなっている47ため、精製されたタンパク質成分などの潜在的に貴重な試薬をより制御して使用できる。マイクロ流体フローコントローラーには2つの調整チャネルが含まれているため、このデバイスは、常に圧力制御を行うのは2つの入口/出口ポートのみを想定して開発されました。必要に応じて、より圧力制御されたチャネルを実装できます。
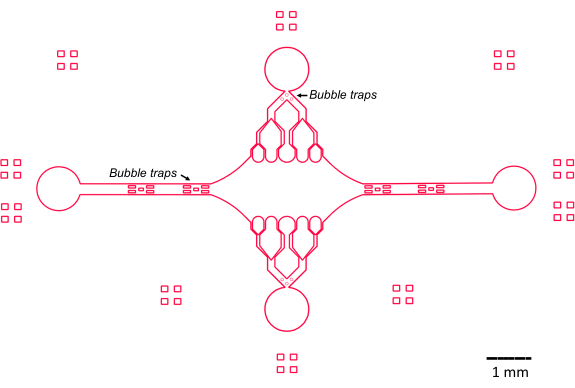
図2:マイクロ流体デバイス設計の概略図。 周辺部の長方形のマーキングは、チャネルの周辺を見るための視覚的な補助用です。 この図の拡大版を表示するには、ここをクリックしてください。
中央の長方形のデバイスチャンバーは、微小管シードが付着し、これらのシードから微小管伸長部が重合される主要なイメージングエリアとして機能します。チャンバーは両側に流路と交差しており、x軸に沿った直線の水路は入口と出口として機能し、反応溶液の迅速な交換を容易にします。微小管入口チャネルは、微小管シードをチャンバーに導入するためにも使用され、層流により、シードは流れの方向に沿ってガラス表面に結合します。垂直(y軸)方向では、流路は、以前の設計25,28,36,39のいくつかと同様に、チャンバーに向かって小さな水路に分岐します。分岐形状は、微小管の機械的特性の研究に特に適しています。微小管シードの向きに垂直な方向から中央チャンバーに溶液を流すことで、ほぼ垂直な角度で流れ誘起曲げ力を得ることができます。さらに、分岐形状を多くの小さな流路に含めることで、単純な単一流路形状では達成できない、中央チャンバーの広い領域でより均質な力の適用が容易になります。このように、分岐モチーフは一見複雑に見えますが、微小管に与えられる力を決定する際の全体的な複雑さを軽減することができます(図3)。また、この設計は複数の対称線を特徴としているため、使いやすく、複数の方向(上面と下面など)からの曲げを評価することができます。
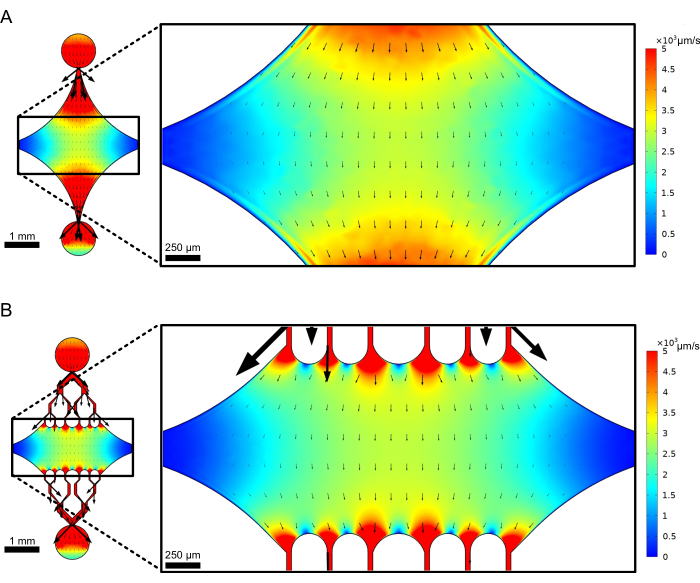
図3:分岐モチーフを含めると、同様の流れの広い領域が得られます。 定常状態の流れ下での 2 つのデバイス設計 (分岐チャネルなし (A) と分岐チャネルを持つデバイス (B)) のシミュレーション。矢印は局所的な流れの方向を示し、流れの大きさに比例します。表面の色は中心線の速度を示します。右の画像は、x軸に沿って配向された微小管(図には示されていません)が、上部ポートを流れて下部ポートから出る流体からの曲げ力を受けるデバイスのズームインセクションを示しています。分岐チャネルを組み込むと、必要な試薬の量を増加させずに、同様の速度フィールドの対象となる相対面積が増加します。この図は、Rogers (2022)14の許可を得て修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
特に、このデバイスは、気泡が中央のイメージングチャンバーに入るのを防ぐために、入口と出口の流路に一連のバブルトラップも実装しています。具体的には、表面張力によって気泡が通過するのを防ぐために、流路内にマイクロピラーの配列を含めることを選択しました(図2)46。さらに、空気の巻き込みを防ぐために、デバイス内部のエッジを斜めの角度ではなく、滑らかな曲線として設計しました。これらの設計上の特徴を組み合わせることで、気泡の可能性が減り、デバイスの堅牢性が向上します。
マイクロ流体デバイス作製
デバイスマスターを作成するための適切なパラメータを決定するには、いくつかの最適化が必要でした。前に観察したように、このフォトレジストは、フォトリソグラフィーステップ50中の周囲照明および加熱および冷却速度などの主要な動作パラメータに非常に敏感である。例えば、加熱後にマスターの冷却が速すぎると、フォトレジストに熱亀裂が発生する可能性があります。これは、亀裂がチャネルの完全性を損なう可能性があるため、望ましくありません。亀裂は、レジストを転移温度(~115°C)に近い温度に再加熱することで解決できますが、マスターをホットプレート上で周囲冷却することが、亀裂を防ぐ最も堅牢な方法であることがわかりました。さらに、過剰な周囲光はフォトレジストの意図しない露光をもたらし、レジストを弱め、現像ステップ中にデバイス機能自体(現像後もウェーハ上に残るべき)が部分的に剥がれ落ちる可能性があります。このため、現像ステップは、露光後のベーキングステップとアンビエントオーバーナイトクーリングステップの翌日に実行することをお勧めします。また、デバイスマスターを使用しないときは、経年劣化を防ぐために、暗い場所に保管するか、アルミホイルで包むことをお勧めします。これらのパラメータが決定されると、フォトリソグラフィープロセスは非常に再現性が高くなりました(図4)。
マスターが作成された後、液体PDMSがマスターの上に鋳造され、PDMSが硬化してマスターの特徴のネガティブインプリントを作成することができました。PDMSを2〜3 mmの厚さで鋳造すると、デバイスの操作が容易になることがわかりました。対照的に、スピンコーティングしてμmの範囲の厚さを達成すると、PDMSは破れや自己接着を起こしやすく、操作が困難になります。さらに、PDMS層が厚いと、シーラントやクランプを必要とせずにチューブが入口/出口ポートに留まるため、チューブの差し込みが容易になります。
最後に、これらの生物学的アプリケーションのための従来のフローセルアッセイでは、ピラニア溶液(過酸化水素と硫酸)を使用して事前に洗浄し、その後シラン化したガラスカバースリップを使用することがよくありますが、拡張プラズマクリーンとIPA洗浄で処理されたカバースリップが私たちの目的に適していることがわかりました47。また、単一分子イメージングなどの他のアプリケーションでは、より広範なカバーガラス処理が必要になる場合があります。

図4:フォトリソグラフィープロセス (A)目的のデザインのマスク(ガラスにクロムをエッチングしたマスク)。(B)熱応力によるシリコンウェーハ上のフォトレジストのわずかな亀裂(矢印はいくつかの亀裂を示しています)。これらの亀裂は、多くの場合、ウェーハ全体に広がっています。(C)開発されたマスター。(D)顕微鏡上のマイクロ流体セットアップ。個々のコンポーネントには緑色でラベルが付けられています。 この図の拡大版を表示するには、ここをクリックしてください。
微小管の成長、安定化、および曲げ
GMPCPPで成長させた微小管シードは、微小管伸長部が重合するための核形成部位として機能し、それ自体は室温で数時間の解重合に対して安定です。種子は、抗ローダミン抗体47を用いて、マイクロ流体チャネルのガラスカバースリップに結合した。次に、動的微小管伸長部を可溶性チューブリン(蛍光標識されているが、ロダミン結合されていない)およびGTPの存在下で成長させました。このようにして、種子核形成部位はガラスカバースリップに付着しましたが、伸長部は付着しませんでした。15分間の伸長成長期間中、微小管伸長は、その固有の動的不安定性49のために予想されたように、確率的に重合および解重合した。この増殖期間の後、10 μMのタキソールウォッシュアウトを実施して、溶液から残っているチューブリンを除去し、形成された微小管伸長を安定化させました。安定化が重要であり、そうしないとチューブリンが枯渇すると微小管の伸長部が解重合します。微小管ポリマーの結合および安定化に加えて、タキソールは微小管ポリマーの力学にも影響を与えることが実証されており、それ以外の点では線形の微小管伸長部51,52,53,54に湾曲を誘導し得る。ここに示す結果は、これらの観察結果を反映しています。しかしながら、微小管伸長部のカールは、曲げ中に格子に沿って不均一な力が与えられる結果となるため、望ましくない。そのため、安定化後も比較的まっすぐに残った微小管のみを曲げ解析に用いました。あるいは、初期成長期間の後、チューブリンおよびGMPCPP溶液(初期GTPとは対照的に)を用いた二次成長期間を使用して、微小管格子の成長端に安定した「キャップ」を作成し、解重合を防止することができる55。
その後、圧力制御システムを用いて緩衝液中を流すことで微小管を曲げ、上流側の圧力を一定に保ちました(図5、 補足動画1)。このようにして、微小管が経験する局所的な流れを近似することができました。上部から流体を流入し、下部の装置ポートから流体を流入させることにより、流れの向きは播種方向に対して垂直になるように意図された。
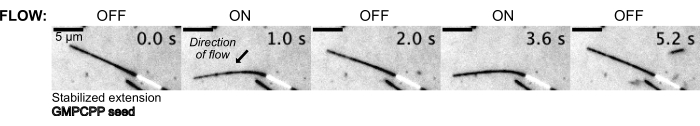
図5:マイクロ流体セットアップは、安定化された微小管を曲げるために使用できます。 パクリタキセルで安定化した後の静止状態にある微小管は、拍動流中に曲がります。30 mbarの一定の上流圧力が流れを駆動します(矢印は流れの方向を示します)。 この図の拡大版を表示するには、ここをクリックしてください。
マイクロ流体デバイスにおける流れプロファイルの決定
マイクロ流体の中心線速度は、COMSOLソフトウェア(シミュレーションソフトウェア、 図6A)を使用して計算でシミュレーションできます。ただし、微小管は、表面から~100 nm以内でTIRF顕微鏡用のガラスカバースリップに取り付けられています。したがって、微小管が経験する速度は、2Dシミュレーションで予測されたものと同じではありません。微小管が経験する局所的な流れを近似するために、1次元の非圧縮性流体の流れについて一般的なNavier-Stokes方程式を使用しました。
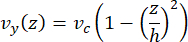
ここで、 z はデバイス内の微小管の高さ、 h はデバイス全体の高さ、 vc はデバイスの中心線速度です。システムの定義では、z原点はデバイスの中心です(図6B)。この定義と13μmのチャネル高さを使用すると、微小管の高さはz = -6.4μmとして近似されます。この方程式を解くと、微小管が経験する局所的な流体速度の推定値が得られます。

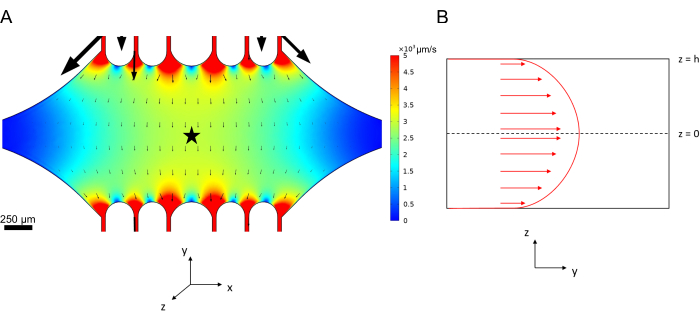
図6:上部ポートからデバイスに入り、下部ポートから出る流体の流体の流れ解析システムの定義(図には示されていません) 。(A) 図3Bのようなスケーリングされた中心線速度場のシミュレーション。Starは、パネルBの関心領域を示す(B)デバイスの断面表現。完全に開発された流体の流れプロファイルは、z = 0 の中心線速度 vc と壁面でのすべりなし境界条件を持つ y 方向にあります。このパネルの矢印は、パネルAに示されている実際の速度フィールドに対してスケーリングされていないことに注意してください。この図は、Rogers (2022)14の許可を得て修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
シミュレーション以外にも、圧力を維持するのではなく、体積流量に基づくフローコントローラーを使用して流体速度を制御することができます。さらに、各デバイスの局所流量は、蛍光ビーズを含め、その速度を監視することで直接決定できるため、サンプル間のばらつきが軽減されます。
計算モデリングと勾配のデモンストレーション
最後に、このデバイスをハイスループット実験に使用する可能性を実証するために、実験と組み合わせて計算シミュレーションを実行しました。このシミュレーションでは、デバイスの対称性により微小管を複数の方向に曲げることができるだけでなく、デバイスが正確な勾配を維持できることが示され、複数の実験条件を同時に調査できることがわかりました(図7A)。溶液中の蛍光色素を使用した予備実験(本書の一部として明示的に記載されていない方法)では、計算予測との一貫性が示されました(図7B)。さらに、異なる蛍光標識を持つ微小管伸長部を同時に成長させることにより、デバイスの異なる領域で異なるタンパク質を分配することに成功しました(図8)。私たちの知る限り、これはハイスループットマイクロ流体工学の微小管研究への最初のアプリケーションです。このデバイスのこの特徴は、必要な試薬の時間と量を削減しながら、実験の堅牢性を向上させるために使用できます。例えば、微小管の力学やダイナミクスに対する異なるタンパク質や個々のタンパク質の異なる濃度の影響を、1つのデバイスで同時に調べることができます。
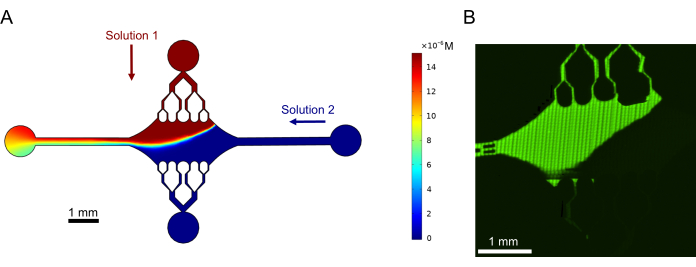
図7:グラジエント形成(A)同じ入口圧力(50 mbar)と濃度(15 μM)でデバイスに入る2つの溶液のグラジエントのシミュレーション。各溶液のインレットポートは色付きの矢印で示され(1つの溶液は上部ポートに、もう1つの溶液は右ポート)、残りの2つのポートは出口として機能します。ヒートマップは、トップ溶液の濃度プロファイルを示しています。(B)トップポートの溶液中の蛍光色素と右ポートのバッファーを使用して、同様のグラジエントを実験的に生成しました。Imageは、各視野(80μm×80μm)をスティッチングしてデバイス領域全体を解像したラスターレイヤーです。この図は、Rogers (2022)14の許可を得て修正されています。この図の拡大版を表示するには、ここをクリックしてください。
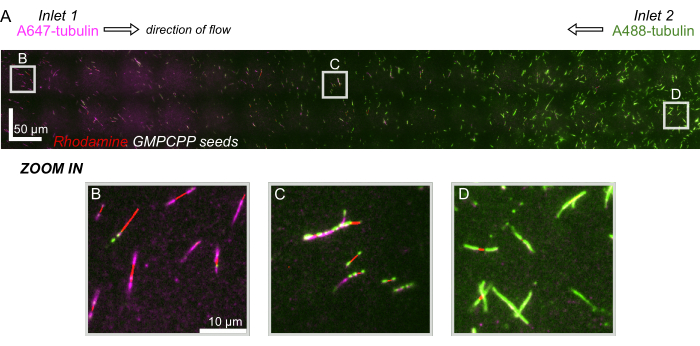
図8:マイクロ流体デバイスにおけるタンパク質グラジエントの実証。 AlexaFluor647標識チューブリン(マゼンタ)をインレット1に、AlexaFluor488標識チューブリン(緑)をインレット2に同じ濃度と流量でインレット2に注入しました。フローは90秒刻みでオン/オフに振動し、安定化されたGMPCPPシード(赤)からのチューブリン重合を可能にし、混合を抑制しました。(A)デバイスの全長を解像するために視野(80x80μm)をステッチして作成した大規模なラスターレイヤー。文字は、後続のパネル内の個々の視野の相対的な位置を示します。スケールバーはX位置とY位置で50μmです。(B)デバイスの入口1付近の視野で、エクステンションは主にA647標識チューブリンで構成されている。(C)デバイスの中央付近の視野で、予測どおり、エクステンションが標識されたチューブリンの混合物で構成されています。(D)デバイスの底部付近の視野で、エクステンションは主にA488標識チューブリンで構成されています。 この図の拡大版を表示するには、ここをクリックしてください。
顕微鏡でのマイクロ流体実験セットアップのプロセスフロー図(PFD)を 補足図1に示します。
補足図1:顕微鏡でのマイクロ流体工学実験セットアップのプロセスフロー図(PFD)。このファイルをダウンロードするには、ここをクリックしてください。
補足ビデオ1。マイクロ流体セットアップは、安定化された微小管を曲げるために使用できます。パクリタキセルで安定化した後の静止状態にある微小管は、拍動流中に曲がります。30 mbarの一定の上流圧力が流れを駆動します。ビデオ再生速度10fps。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル1:マイクロ流体マスク設計のCADファイル。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルの主な目標は、 in vitroでの微小管力学の研究に適したマイクロ流体デバイスを設計および製造することでした。この設計は、PDMSベースのマイクロ流体デバイスの本質的な利点を活用しながら、堅牢でカスタマイズ可能なハイスループット実験を可能にする機能の組み合わせも含みたいという願望に基づいていました。
この目標は成功裏に達成され、このシステムの将来のユーザーの基礎として役立つ製造プロトコルと一般的なガイドラインが生まれました。デバイスに冗長なバブルトラップを含めると、気泡の存在によるタンパク質の変性の可能性が減少します。デバイス内のチューブの抜き差しと再挿入はまだありますが、これらのバブルトラップにより、実験の失敗の可能性が低くなります。マイクロ流体セットアップの将来の改善により、実験中に行われる手動チューブ操作の量がさらに削減される可能性があります。さらに、マイクロ流体デバイスと自動流量制御ソフトウェアの統合により、実験条件の大幅なカスタマイズが可能になり、手動エラーの可能性が減少します。私たちは、デバイスを製造した後、コントローラー制御の自動フローを使用してデバイス内の微小管伸展を成長、安定化、および曲げることにより、デバイスの優れたパフォーマンスを実証しました。さらに、同じデバイス内で異なる蛍光標識チューブリン溶液のグラジエントを確立することにより、1つのデバイスで複数の条件を同時に実行できることを示しました。計算モデリングと解析技術の助けを借りて、当社のシステムは、曲げ剛性52,56,57,58,59などの微小管の生体力学的特性を調査し、決定することができます。
将来の改善の可能性は、さらに堅牢なシステムと関連する実験的分析を促進するでしょう。まず、フォトレジストの堆積、露光、およびベーキングは、ある程度のばらつきを示す重要なパラメータでした。SPRフォトレジストの比較的高い特徴サイズは、デバイスを台無しにする可能性のある熱亀裂を防ぐために、非常に緩やかな加熱と冷却を必要としました。より薄型のデバイスが試みられましたが、これらの小さな機能サイズの操作に問題が見つかりました。細部への注意と忍耐力は、SPRフォトレジストでこの厚さのデバイスを複製するために重要です。この問題を解決するために、入手可能性に応じて、さまざまなフォトレジストを使用できます。
まとめると、ここでのマイクロ流体デバイスとプロトコルにより、以前のフローセルアッセイ47よりも堅牢でハイスループットな試験機能を備えたさまざまな実験セットアップが可能になります。さらに、フローコントローラーを使用して実験を自動化し、デバイス内の正確なフロープロファイルや濃度勾配を維持し、手動ユーザーに固有のばらつきを減らすことができます。このセットアップの将来の潜在的なアプリケーションには、微小管の曲げ剛性、ダイナミクス、格子損傷、および修復に対する微小管関連タンパク質の影響、および微小管とアクチンフィラメントの生体力学的相互作用の調査が含まれます54、60、61、62、63、64、65、66、67、68、69,70。微細加工、自動フロー制御、計算モデリングおよび解析技術の統合により、in vitroでの細胞細胞骨格の研究に適した汎用性の高いシステムが実現します。
開示事項
著者には利益相反はありません。著者は、テキストの改訂と校正にChatGPT-4o OpenAIを使用していることを明らかにしています。
謝辞
この研究の一部が実施されたヴァンダービルトナノスケール科学工学研究所(VINSE)から提供された支援とリソースに感謝しています。この研究は、NIH NIGMSのM. Zanic氏への助成金(R35 GM1192552)とNSF ID 2018661 M. Zanic氏への助成金によって部分的に資金提供されました。M. Rogersは、NIH T32 GM08320助成金とVINSEパイロット資金賞の支援を受けました。L. Richardson は、NSF GRFP Grant No. 1937963 の支援を受けています。また、Alice Leach博士、David Schaffer博士、Christina McGahan博士、そしてZanic研究室全体のご協力とご支援に感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| 0.6 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mm standard biopsy punch | Integra LifeSciences | 33-31A-P/25 | |
| 100x/1.49 numerical aperture TIRF objective | Nikon | ||
| 22 x 22 mm glass coverslips | ThorLabs | CG15CH | |
| 3" single side polished silicon wafers | University Wafer | 447 | |
| 4" Petri dish | Any brand | ||
| 450 µL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter, Inc. | 345843 | Referred to as 'airfuge tube' in the protocol |
| 488-, 561, and 640-nm solid state lasers | Nikon | ||
| A-95 Fixed-Angle Rotor | Beckman Coulter, Inc. | 347595 | |
| Acetone | Any brand | ||
| Airfuge Air-Driven Ultracentrifuge | Beckman Coulter, Inc. | 347854 | Referred to as 'airfuge' in the protocol |
| Alexa Fluor 488 Microscale Protein Labeling Kit | Thermo Fisher Scientific | A30006 | |
| Aluminum foil | Any brand | ||
| Andor iXon Ultra EM-CCD | Nikon | ||
| Andor NEO sCMOS | Nikon | ||
| AutoCAD | Autodesk | Generic versions can be used | |
| Bovine brain unlabeled tubulin (purified) | N/A | Made in house, but can be purchased | |
| Casein | MilliporeSigma | C7078 | |
| Catalase | MilliporeSigma | C9322 | |
| Clean Dry Air (CDA) (pressurized gas) | Any brand | ||
| Compressed air supply | Any brand | Connects to the microfluidic flow controller | |
| COMSOL Multiphysics software | COMSOL, Inc. | ||
| Custom brass stage adapter | N/A | Made in house to fit our 22 mm x 22 mm coverslips onto the microscope | |
| De-ionized water | Any brand | ||
| Dessicator | Any brand | ||
| D-glucose | MilliporeSigma | G7528 | |
| Dithiothreitol (DTT) | MilliporeSigma | D0632 | |
| EGTA | MilliporeSigma | 324626 | |
| Elveflow Smart Interface (ESI) software | Elveflow | ||
| Flangeless PFA fittings with ETFE ¼”-28 to 1/16” outer diameter ferrules | Darwin Microfluidics | CIL-XP-245X | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack |
| Fluiwell 4-Channel 2 mL Low Pressure | Fluigent | 14002001 | Used to connect the flow control system to the the micrewtubes. Also refered to as 'pressurized reservoir rack' |
| Fume hood | Any brand | ||
| Glucose oxidase | MilliporeSigma | G6125 | |
| GMPCPP | Jena Bioscience | NU-405L | |
| Guanosine triphosphate (GTP) | MilliporeSigma | G8877 | |
| Hot plate | Any brand | ||
| HS-625 high-speed emission filter wheel | Finger Lakes Instrumentation | ||
| ImageJ software | N/A | Open access | |
| Incubator | Any brand | ||
| Isopropyl alcohol | Any brand | ||
| Karl Suss MA-6 mask aligner | SUSS MicroTec | ||
| Magnesium chloride | MilliporeSigma | 1.05833 | |
| MATLAB software | MathWorks | ||
| MEGAPOSIT SPR 220 7.0 photoresist | Dow, Inc. | ||
| Microfluidic Fittings 6-40 to 1/4"-28 Adapters Kit | Darwin Microfluidics | LVF-KFI-08 | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack (Fluiwell rack) |
| Microfluidic Fittings Female Luer Lock Adapter Kit | Darwin Microfluidics | LVF-KFI-04 | Used to connect the syringe to the tubing |
| Microfluidic flow controller | Elveflow | OB1 MK3+ | |
| Microfluidic flow sensor | Elveflow | MFS3 | This flow sensor range is 0-80 μL |
| MICROPOSIT MF-319 developer | Dow, Inc. | ||
| Microscope | Nikon | Eclipse Ti | |
| NIS-Elements software | Nikon | ||
| Nitrogen (pressurized gas) | Any brand | ||
| Objective heater | Tokai Hit | ||
| One-Piece Fingertight 10-32 Coned Fitting for 1/16" OD Tubing | Darwin Microfluidics | CIL-F-120X | Used to connect the syringe to the tubing |
| Paclitaxol (Taxol) | Tocris Bioscience | 1097 | |
| Photolithography masks | N/A | Made by an external party using our designs | |
| PIPES | Thermo Fisher Scientific | 172615000 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Plasma flowmeter system | Harrick Plasma | PDC-FMG | Integrates with plasma cleaner to enable flow control of pressurized gas |
| Plastic bulb pipet | Any brand | ||
| Pluoronic F-127 | MilliporeSigma | P2443 | Referred to as 'poloxomer 407' in the protocol |
| Potassium chloride | Research Products International | P41000 | |
| Saint Gobain Performance Plastics Tube Tygon .020 ID | Thermo Fisher Scientific | 50-206-8921 | Refered to as '1.5 mm tubing' and 'tubing' in the protocol |
| Scalpel | Any brand | ||
| Spin coater | Cost Effective Equipment, LLC. | 200x | This model may be discontinued |
| Standard pipets and tip sets | Any brand | ||
| Standard plastic syringe | Any brand | We used a 10 mL Luer-slip syringe | |
| Sylgard 184 silicone elastomer kit | Dow, Inc. | Referred to as 'PDMS' and 'curing agent' in the protocol | |
| T339 Micrewtube with Lip Seal and Flat Screw Cap | Medline Industried, LP. | T339 | Referred to as 'source vial' in the protocol. We used both 0.5 mL and 1.5 mL sizes |
| TAMRA, SE; 5-(and-6)-Carboxytetramethylrhodamine, Succinimidyl Ester | Invitrogen | C1171 | Referred to as 'TTR' in the protocol |
| Trichloro(1H, 1H, 2H, 2H-perfluorooctyl) silane | MilliporeSigma | 448931 | |
| Trion Phantom RIE ICP | Trion Technology, Inc. | This plasma cleaner is only used in Step 1.1 of the protocol. Another plasma cleaner, like the one used for PDMS bonding, can be used instead; we just prefer the much lower vacuum achievable by this system for cleaning the silicon wafer | |
| TRITC Polyclonal Antibody | Thermo Fisher Scientific | A6397 | Referred to as 'anti-rhodamine antibody' in the protocol |
| Tweezers | Any brand | ||
| Vacuum pump | Any brand |
参考文献
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Phys Today. 54 (6), 42(2001).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev Mod Phys. 77, 977(2005).
- Beebe, D. J., Mensing, G. A., Walker, G. M. Physics and applications of microfluidics in biology. Annu Rev Biomed Eng. 4, 261-286 (2002).
- Ng, J. M. K., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. Electrophoresis. 23 (20), 3461-3473 (2010).
- Dellaquila, A. Five Short Stories on The History of Microfluidics. , https://www.elveflow.com/microfluidic-reviews/general-microfluidics/history-of-microfluidics/ (2025).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: Microfluidics in drug discovery. Nat Rev Drug Discov. 5 (3), 210-218 (2006).
- Neužil, P., Giselbrecht, S., Länge, K., Huang, T. J., Manz, A. Revisiting lab-on-a-chip technology for drug discovery. Nat Rev Drug Discov. 11 (8), 620-632 (2012).
- Manz, A., Graber, N., Widmer, H. M. Miniaturized total chemical analysis systems: a novel concept for chemical sensing. Sens Actuators B: Chem. 1 (1-6), 244-248 (1990).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Knight, J. Microfluidics: Honey, I shrunk the lab. Nature. 418 (6897), 474-475 (2002).
- Photolithographic fabrication techniques for transistors which are an integral part of a printed circuit. Nall, J. R., Lathrop, J. W. 1957 International Electron Devices Meeting, Washington, DC, USA, , (1957).
- Rogers, M. The design and fabrication of a two-layer microfluidic device for studying microtubules in vitro [Master's Thesis]. , Vanderbilt University. Nashville, TN. (2022).
- Lee, J. B., Choi, K. H., Yoo, K. Innovative SU-8 lithography techniques and their applications. Micromachines. 6 (1), 1-18 (2015).
- Kim, P., et al. Soft lithography for microfluidics: A Review. Biochip J. 2 (1), 1-11 (2008).
- Venkatesan, S. u, Jerald, J., Asokan, P., Prabakaran, R. A Comprehensive Review on Microfluidics Technology and its Applications. Recent Advances in Mechanical Engineering. , Springer. Singapore. 235-245 (2020).
- Minteer, S. Microfluidic Techniques: Reviews and Protocols. , Humana Press. New Jersey. (2006).
- Mitra, S. K., Chakraborty, S. Microfluidics and Nanofluidics Handbook: Fabrication, Implementation, and Applications. , Taylor and Francis Group. Florida. (2016).
- Alberts, B., et al. Molecular Biology of the Cell. , Garland Science. New York. (2014).
- Howard, J. Mechanics of Motor Proteins and the Cytoskeleton. , Springer. Heidelberg. (2001).
- Hawkins, T., Mirigian, M., Selcuk Yasar, M., Ross, J. L. Mechanics of microtubules. J Biomech. 43 (1), 23-30 (2010).
- Gardel, M. L., Kasza, K. E., Brangwynne, C. P., Liu, J., Weitz, D. A. Chapter 19: Mechanical Response of Cytoskeletal Networks. Methods Cell Biol. 89, 487-519 (2008).
- Caporizzo, M. A., Prosser, B. L. The microtubule cytoskeleton in cardiac mechanics and heart failure. Nat Rev Cardiol. 19 (6), 364-378 (2022).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nat Mater. 14 (11), 1156-1163 (2015).
- Chu, S. H., et al. A microfluidic device for in situ fixation and super-resolved mechanosensation studies of primary cilia. Biomicrofluidics. 13 (1), 014105(2019).
- Geisterfer, Z. M., Zhu, D. Y., Mitchison, T. J., Oakey, J., Gatlin, J. C. Microtubule growth rates are sensitive to global and local changes in microtubule plus-end density. Curr Biol. 30 (15), 3016-3023 (2020).
- Schaedel, L., et al. Lattice defects induce microtubule self-renewal. Nat Phys. 15 (8), 830-838 (2019).
- Aher, A., et al. CLASP mediates microtubule repair by restricting lattice damage and regulating tubulin incorporation. Curr Biol. 30 (11), 2175-2183 (2020).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. ELife. 5, e13470(2016).
- Fourniol, F. J., et al. Micropattern-guided assembly of overlapping pairs of dynamic microtubules. Methods Enzymol. 540, 339-360 (2014).
- Vleugel, M., Roth, S., Groenendijk, C. F., Dogterom, M. Reconstitution of basic mitotic spindles in spherical emulsion droplets. J Vis Exp. (114), e54278(2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Mol Biol Cell. 27 (22), 3563-3573 (2016).
- VanDelinder, V., Brener, S., Bachand, G. D. Mechanisms underlying the active self-assembly of microtubule rings and spools. Biomacromolecules. 17 (3), 1048-1056 (2016).
- Roth, S., Gârlea, I. C., Vleugel, M., Mulder, B. M., Dogterom, M. Reconstitution of basic mitotic spindles in cell-like confinement. bioRxiv. , (2019).
- Xu, Z., et al. Microtubules acquire resistance from mechanical breakage through intralumenal acetylation. Science. 356 (6335), 328-332 (2017).
- Fanalista, F., et al. Shape and size control of artificial cells for bottom-up biology. ACS Nano. 13 (5), 5439-5450 (2019).
- Velve-Casquillas, G., Costa, J., Carlier-Grynkorn, F., Mayeux, A., Tran, P. T. A fast microfluidic temperature control device for studying microtubule dynamics in fission yeast. Methods Cell Biol. 97, 185-201 (2010).
- Portran, D., Schaedel, L., Xu, Z., Théry, M., Nachury, M. V. Tubulin acetylation protects long-lived microtubules against mechanical ageing. Nat Cell Biol. 19 (4), 391-398 (2017).
- Huang, Y. M., Uppalapati, M., Hancock, W. O., Jackson, T. N. Microtubule transport, concentration and alignment in enclosed microfluidic channels. Biomed Microdevices. 9 (2), 175-184 (2007).
- Uppalapati, M., Huang, Y., Shastry, S., Jackson, T. N., Hancock, W. O. Microtubule Motors in Microfluidics. Methods in Bioengineering: Microfabrication and Microfluidics. , Artech House Publishers. Boston, MA. (2009).
- Sung, J. H., Shuler, M. L. Prevention of air bubble formation in a microfluidic perfusion cell culture system using a microscale bubble trap. Biomed Microdevices. 11 (4), 731-738 (2009).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360(2019).
- Nakayama, T., et al. Circumventing air bubbles in microfluidic systems and quantitative continuous-flow PCR applications. Anal Bioanal Chem. 386 (5), 1327-1333 (2006).
- Park, S., Cho, H., Kim, J., Han, K. -H. Lateral degassing method for disposable film-chip microfluidic devices. Membranes. 11 (5), 316(2021).
- Pereiro, I., Fomitcheva Khartchenko, A., Petrini, L., Kaigala, G. V. Nip the bubble in the bud: A guide to avoid gas nucleation in microfluidics. Lab Chip. 19 (14), 2296-2314 (2019).
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biol. 95, 221-245 (2010).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: Information from a slowly hydrolyzable analogue, GMPCPP. Mol Biol Cell. 3 (10), 1155-1167 (1992).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bartlett, N. W., Wood, R. J. Comparative analysis of fabrication methods for achieving rounded microchannels in PDMS. J Micromech Microeng. 26 (11), 115013(2016).
- Yang, C. P. H., Horwitz, S. B. Taxol®: The first microtubule stabilizing agent. Int J Mol Sci. 18 (8), 1733(2017).
- Gittes, F., Mickey, B., Nettleton, J., Howard, J. Flexural rigidity of microtubules and actin filaments measured from thermal fluctuations in shape. J Cell Biol. 120 (4), 923-934 (1993).
- VanBuren, V., Cassimeris, L., Odde, D. J. Mechanochemical model of microtubule structure and self-assembly kinetics. Biophys J. 89 (5), 2911-2926 (2005).
- Dye, R. B., Fink, S. P., Williams, R. C. Taxol-induced flexibility of microtubules and its reversal by MAP-2 and Tau. J Biol Chem. 268 (10), 6847-6850 (1993).
- Drechsel, D. N., Kirschnert, M. W. The minimum GTP cap required to stabilize microtubules. Curr Biol. 4 (12), 1053-1061 (1994).
- Wisanpitayakorn, P., Mickolajczyk, K. J., Hancock, W. O., Vidali, L., Tüzel, E. Measurement of the persistence length of cytoskeletal filaments using curvature distributions. Biophys J. 121 (10), 1813-1822 (2022).
- Mickey, B., Howard, J. Rigidity of microtubules is increased by stabilizing agents. J Cell Biol. 130 (4), 909-917 (1995).
- Brangwynne, C. P., et al. Bending dynamics of fluctuating biopolymers probed by automated high-resolution filament tracking. Biophys J. 93 (1), 346-359 (2007).
- Venier, P., Maggs, A. C., Carlier, M. F., Pantaloni, D. Analysis of microtubule rigidity using hydrodynamic flow and thermal fluctuations. J Biol Chem. 269 (18), 13353-13360 (1994).
- Felgner, H., Frank, R., Schliwa, M. Flexural rigidity of microtubules measured with the use of optical tweezers. J Cell Sci. 109 (Pt 2), 509-516 (1996).
- Felgner, H., et al. Domains of neuronal microtubule-associated proteins and flexural rigidity of microtubules. J Cell Biol. 138 (5), 1067-1075 (1997).
- Nishida, K., et al. Effects of three microtubule-associated proteins (MAP2, MAP4, and Tau) on microtubules' physical properties and neurite morphology. Sci Rep. 13, 8870(2023).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Brouhard, G. J., Rice, L. M. Microtubule dynamics: An interplay of biochemistry and mechanics. Nat Rev Mol Cell Biol. 19 (7), 451-463 (2018).
- Lawrence, E. J., Chatterjee, S., Zanic, M. More is different: Reconstituting complexity in microtubule regulation. J Biol Chem. 299 (12), 105398(2023).
- Howard, J., Hyman, A. A. Dynamics and mechanics of the microtubule plus end. Nature. 422 (6933), 753-758 (2003).
- Mehidi, A., Aumeier, C. Regulation of the microtubule network; the shaft matters. Curr Opin Syst Biol. 34, 100457(2023).
- Verhey, K. J., Ohi, R. Causes, costs and consequences of kinesin motors communicating through the microtubule lattice. J Cell Sci. 136 (5), jcs260735(2023).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nat Rev Mol Cell Biol. 20 (1), 38-54 (2019).
- Théry, M., Blanchoin, L. Microtubule self-repair. Curr Opin Cell Biol. 68, 144-154 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved