Method Article
미세소관 고분자 역학 조사를 위한 미세유체역학 기반 접근법 개발
요약
이 프로토콜은 미세소관 고분자 역학을 조사하는 데 적합한 미세유체 장치의 설계 및 제작에 대해 자세히 설명합니다. 미세 가공, 자동화된 흐름 제어 및 컴퓨터 모델링 기술의 합성은 세포 세포골격을 in vitro 프로빙하는 데 이상적으로 적합한 유연한 시스템을 가능하게 합니다.
초록
이 프로토콜에서는 미세소관 고분자 역학을 조사하기 위해 개발된 미세유체 장치의 설계 및 제작에 대해 설명합니다. 이 설계는 폴리디메틸실록산(PDMS) 기반 미세유체 장치의 본질적인 이점을 활용하고 견고하고 사용자 정의 가능한 고처리량 실험 접근 방식을 가능하게 하는 몇 가지 기능을 도입합니다. 개발된 장치에는 유해한 기포의 발생을 방지하기 위해 이중화 기포 트래핑 기능이 통합되어 있습니다. 또한 이 장치는 자동화된 흐름 제어 시스템과 인터페이스하여 수동 개입을 줄이고 고처리량 분석을 가능하게 합니다. 이 시스템을 사용하여 유체 수송을 더 잘 개발하고 이해하기 위해 상용 시뮬레이션 소프트웨어가 활용됩니다. 마지막으로, 우리는 장치의 여러 섹션에서 뚜렷한 형광 라벨로 미세소관 확장을 성장시켜 단일 장치 내에서 여러 실험을 동시에 수행할 수 있는 능력을 보여줍니다. 전반적으로 이 미세유체 유동 시스템은 미세소관 고분자 역학을 조사하는 데 사용할 수 있으며 더 광범위한 미세소관 in vitro 연구를 위한 실험 설계를 개선합니다. 미세 가공, 자동화된 흐름 제어 및 컴퓨터 모델링 접근 방식의 합성은 세포 세포골격을 in vitro 프로빙하는 데 이상적으로 적합한 유연한 시스템을 가능하게 합니다.
서문
Microfluidics는 유동성 교류 수로1, 2의 복잡한 디자인 그리고 제작에 의해, 아주 작은 유동성 양의, 수시로 1개 미만 액체의 통제를, 가능하게 한다. microfluidic 장치의 작은 규모는 독특한 엔지니어링 현상을 일으킵니다. 즉, 유체 흐름에서 관성력과 점성력 사이의 비율을 무차원으로 측정하는 레이놀즈 수는 일반적으로 미세유체역학에서 O(10) 이하로 작으며, 이는 미세유체 장치에서 점성력의 중요성을 강조합니다. 또한, 대류 수송과 확산 수송을 비교하는 Péclet 수는 대류 수송이 일반적으로 미세 유체 역학에서 무시할 수 있음을 보여줍니다 3,4,5. 미세유체역학(microfluidics)에서 이러한 확산 구동 층류 체제는 정밀한 유체 구배를 유지하여 단일 장치에서 병렬 실험을 지원하기 때문에 유리합니다.
포토리소그래피는 미세유체 소자 6,7,8을 제조하기 위한 주요 방법으로 남아 있습니다. 요컨대, 이 과정에는 미세유체 설계의 '마스터' 에칭 템플릿 생성이 포함됩니다(그림 1). 감광성 기판이 준비되고 미세유체 설계의 포토마스크가 포토레지스트 영역을 자외선에 선택적으로 노출시킵니다. 후속 에칭 방법은 기판을 개발하여 디자인을 완화합니다. 폴리디메틸실록산(PDMS)은 종종 마스터에 주조 및 경화됩니다. 그런 다음 설계의 부정적인 특징을 채택한 경화된 PDMS를 마스터에서 제거하고 유리 커버슬립에 접착합니다. 이 전체 제작 프로세스는 일반적으로 1-2일이 소요되므로 빠른 설계 반복과 여러 장치의 생산이 가능합니다. 소프트 리소그래피 및 미세 가공 공정에 대한 자세한 검토는 다른 참고 문헌 1,2,3,10,11,12,13에서 확인할 수 있습니다.
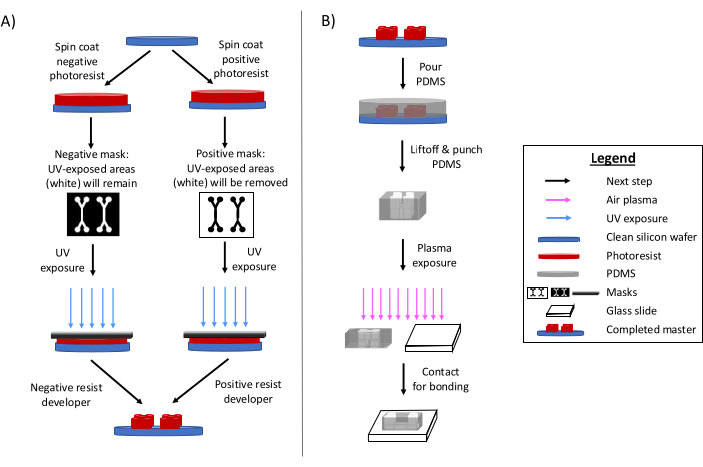
그림 1: 전통적인 포토리소그래피 공정과 미세 가공 공정의 개요. (A) 전통적인 포토리소그래피 공정 및 (B) 미세 가공 공정. 응용 분야와 원하는 포토레지스트 특성에 따라 네거티브 또는 포지티브 포토레지스트를 사용할 수 있지만 동일한 디자인 마스터를 얻을 수 있습니다. 원하는 피처 높이 또는 포토레지스트 용융 온도와 같은 특성은 적절한 포토레지스트 유형을 결정하는 데 도움이 됩니다. 이 그림은 Rogers (2022)14의 허가를 받아 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
미세유체역학(microfluidics)의 사용은 많은 연구 분야에서 가능성을 확장했으며, 가장 최근의 영향은 생물학 분야입니다. 그것의 작은 규모를 감안할 때, microfluidics는 세포나 단백질과 같은 제한적이고 가치 있는 자원의 정확한 관리를 가능하게 합니다. 더욱 영향력 있는 것은 기판 강성의 수정, 시편에 가해지는 힘의 가해, 심지어 전류의 적분과 같은 생리학적 조건을 모방하는 미세유체 시스템의 조정입니다. 또한 미세유체역학을 사용하면 여러 시약을 병렬로 조작할 수 있고 시스템 설계를 신속하게 프로토타입화하고 반복적으로 개선할 수 있습니다. 이러한 기능을 통해 일반적으로 "랩온칩"1,6,9,15,16,17,18,19이라고 하는 단일 장치로 전체 실험실 워크플로우를 소형화할 수 있습니다.
microfluidics의 세포 생물학 응용의 한개는 미세소관 중합체의 수사입니다. 미세소관은 세포의 세포골격의 필수 구성 요소로, 세포 분열 및 세포 내 화물 수송과 같은 과정에서 중요한 역할을 합니다20,21. 세포골격의 가장 단단한 요소인 미세소관은 플렉시글라스22,23에 필적하는 탄성 계수를 나타냅니다. 이들의 견고한 기계적 특성은 예를 들어 심장의 수축기 및 이완기 동안 주기적으로 구부리고 이완되는 심근세포 수축을 포함한 다양한 세포 기능에 매우 중요합니다24. 미세유체 장치는 이전에 시험관 내에서 미세소관의 특성과 고차원 구조를 조사하기 위해 채택되었습니다. 실제로, 미세유체역학은 미세소관 중합 역학, 미세소관-미세소관 상호 작용 및 미세소관 관련 단백질이 미세소관 기계적 특성에 미치는 영향을 조사하는 데 사용되었습니다 25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41.
미세소관 분야에 미세유체역학을 도입하면서 많은 흥미로운 발견이 이루어졌지만, 미세소관 연구를 위해 이러한 장치를 적용하는 것은 여전히 개선의 여지가 있습니다. 이 연구에서는 미세유체 장치에서 미세소관을 연구하는 데 있어 지속되는 두 가지 특정 제한 사항, 즉 일반적으로 미세유체 장치의 수동 조작에 의해 도입되는 장치 내 기포 형성 가능성과 고처리량 분석법의 활용도 부족을 다룹니다. 첫째, 튜빙 연결 및 분리와 같은 수동 조작은 채널에 기포 형성을 도입할 수 있습니다. 플로우 셀 내의 기포 형성은 기포가 단백질을 변성시키고 미세소관 중합체를 전단시키며 세포 배양에 부정적인 영향을 미칠 수 있기 때문에 치명적입니다42,43. 또한 장치의 날카로운 모서리와 비스듬한 각도로 인해 불균일한 표면 습윤이 발생하여 공기 혼입 가능성이 높아집니다. 기포의 형성, 지속성 및 영향을 줄이기 위해 수많은 기술이 개발되었습니다. 그러나 거품 완화 방법의 사용은 보편적이지 않습니다 42,43,44,45,46. 게다가, microfluidics 사용의 중요한 이점의 한개는 높 처리량 실험의 기능이더라도, microfluidics는 아직 microtubule 연구를 확장하기 위하여 이용되지 않았습니다. 미세유체 장치는 동일한 장치에서 여러 실험 조건을 병렬로 테스트하도록 설계할 수 있습니다. 예를 들어, 유체 구배는 서로 다른 미세소관 관련 단백질 또는 약물의 흐름을 지시하는 데 사용할 수 있으며, 이를 통해 동일한 장치 내에서 분할된 미세소관의 특정 영역으로의 표적 전달을 가능하게 할 수 있습니다.
여기에서 우리는 이러한 한계를 해결하는 미세유체 장치를 반복적으로 설계했습니다. 우리는 장치 제작에 대한 단계별 프로토콜을 제공하여 더 많은 청중이 미세소관 연구에 미세유체 기술을 사용할 수 있도록 합니다. 이 장치 설계는 버블 트랩 기능을 통합하고 자동화된 흐름 제어 시스템을 활용하여 수동 개입을 줄이는 동시에 고처리량 분석을 위해 장치에서 솔루션의 기울기를 가능하게 합니다. 요약하면, 이 미세유체 설계의 개발은 미세소관 역학에 대한 광범위한 연구와 이해를 촉진하는 동시에 더 광범위한 미세소관 연구 분야에서 실험 설계에 가치 있는 개선을 제공할 수 있습니다.
프로토콜
참고: 프로토콜의 이 부분에 자세히 설명된 작업은 Vanderbilt Institute of Nanoscale Science and Engineering(VINSE) 코어 클래스 100 클린룸에서 수행되었습니다. 습도/주변 조명 조건으로 인한 장치 손상을 방지하고 미립자 오염을 방지하기 위해 적절한 가운과 UV 필터링 조명을 갖춘 통제된 클린룸이 필요합니다. 실리콘 웨이퍼에 대한 모든 조작은 실리콘 웨이퍼 연마면이 위를 향하도록 하여 수행해야 합니다. 웨이퍼를 조작할 때는 핀셋을 사용하고 웨이퍼 표면의 접촉을 최소화하여 긁힘을 방지하십시오. 웨이퍼는 운송할 때와 달리 지시되지 않는 한 매일 하루가 끝날 때 뚜껑을 덮은 상태로 페트리 접시에 보관하십시오.
1. 포토리소그래피(6 - 8시간)
- 플라즈마는 산소(O2) 또는 깨끗한 건조 공기(CDA) 플라즈마를 사용하여 진공 상태에서 5분 동안 3인치 실리콘 웨이퍼를 청소합니다(이상적으로는 진공 압력 < 5 × 10-5 torr).
- 포토레지스트의 증착을 위해 실리콘 웨이퍼를 스핀 코팅기의 중앙에 놓습니다.
- 실리콘 웨이퍼 중앙에 ~1-2mL의 SPR 220 7.0 포토레지스트를 증착합니다.
주의: 장갑과 보안경으로 포토레지스트를 다루고 제조업체/현장별 프로토콜에 따라 폐기하십시오. - 실리콘 웨이퍼의 포토레지스트를 제조업체 스핀 곡선에 따라 원하는 두께로 스핀 코팅합니다. 1000초 동안 1000RPM으로 회전하여 ~13μm 두께의 층을 생성합니다. 나중에 스핀 코팅기에 남아 있는 감광액을 아세톤으로 세척하고 부위별 프로토콜에 따라 폐기합니다.
참고: 스핀 코팅 후 웨이퍼가 포토레지스트로 균일하게 코팅되지 않은 경우 1.2-1.4단계를 반복합니다. 불균일한 코팅은 스핀 코팅기의 중심이 아닌 웨이퍼, 너무 적은 포토레지스트 사용 및/또는 웨이퍼 중앙에 포토레지스트를 증착하지 않기 때문일 수 있습니다. - 웨이퍼의 포토레지스트를 가능한 한 적게 만지면서 실리콘 웨이퍼를 70°C로 설정된 핫 플레이트로 옮깁니다.
- 핫 플레이트에 실리콘 웨이퍼를 배양하여 온도가 115°C에 도달할 때까지 3-5분마다 10°C씩 온도를 높입니다.
- 핫 플레이트를 끄고 온도가 65°C 미만이 될 때까지 실리콘 웨이퍼를 냉각시킵니다.
알림: 가열 및 냉각 단계는 이 두께에서 흔히 발생하는 포토레지스트의 열 균열을 방지하기 위해 천천히 수행됩니다. 열 균열이 발생하면 일반적으로 실리콘 웨이퍼를 재가열하고 냉각 속도를 늦추어 수정할 수 있습니다. - 겸자를 사용하여 냉각된 실리콘 웨이퍼를 마스크 얼라이너로 옮기고 제조업체/현장별 프로토콜에 따라 실리콘 웨이퍼와 해당 포토마스크를 모두 마스크 얼라이너에 로드합니다.
참고: 포토마스크는 AutoCAD로 제작된 지정된 설계를 사용하여 외부 업체에서 제조했습니다. 마스크 디자인 렌더링에 대해서는 보충 파일 1 을 참조하십시오. - 제조업체/현장별 프로토콜에 따라 실리콘 웨이퍼를 특정 시간(UV 램프의 전력 기준) 동안 자외선(UV) 방사선에 노출시킵니다. 이 응용 프로그램에 원하는 에너지는 ~400mJ/cm2이며 다음 공식
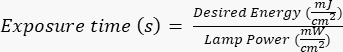 으로 노출 시간을 계산합니다.
으로 노출 시간을 계산합니다. - 노출 후, 마스크 얼라이너에서 실리콘 웨이퍼를 제거하고 공기 순환에 의해 포토레지스트가 4시간 동안 재수화되도록 합니다. 공기 순환을 위해 페트리 접시 뚜껑을 열어 두되 미립자에 노출될 가능성이 없는 장소에 접시를 놓으십시오.
참고: 이 수분 보충 시간 동안 4시간의 휴식을 취할 수 있지만 같은 날에 절차를 계속하는 것이 좋습니다. - 4시간 재수화 후 노출된 웨이퍼를 70°C로 설정된 핫 플레이트로 옮깁니다.
- 핫 플레이트에 실리콘 웨이퍼를 배양하여 온도가 115°C에 도달할 때까지 3-5분마다 10°C씩 온도를 높입니다.
- 웨이퍼를 115°C에서 10분 동안 배양합니다.
- 페트리 접시 뚜껑 모양의 알루미늄 호일 시트를 성형하여 노출된 웨이퍼에 대한 절연 '커버'를 만듭니다.
- 핫 플레이트를 끄고 노출된 웨이퍼를 알루미늄 호일 덮개로 덮습니다. 웨이퍼를 밤새 주변 온도에서 식히십시오.
참고: 포토레지스트의 열 균열은 노출 후 배양 단계에서 훨씬 더 일반적이므로 밤새 천천히 냉각하는 것이 좋습니다. 이것으로 제작 첫날에 필요한 단계가 완료되었습니다. 다음 날 다음 섹션으로 진행하는 것이 좋습니다.
2. 개발 (1 - 2 시간)
- 노출된 웨이퍼를 현상할 준비가 되면 깨끗한 용기와 적절한 포토레지스트 현상액을 구하십시오. 여기서 MF-319 현상액은 전용 컨테이너와 함께 사용됩니다.
주의: 장갑과 보안경으로 현상액을 다루고, 벌크 용기를 보조 용기로 옮기고, 제조업체/현장별 프로토콜에 따라 폐기합니다. - 노출된 웨이퍼가 완전히 잠길 수 있도록 현상액을 용기에 충분히 붓습니다(실제 부피는 용기에 따라 다름).
- 노출된 웨이퍼를 현상액에 담그고 원치 않는 모든 감광액이 용해될 때까지 기다립니다. 용기를 부드럽게 소용돌이치거나 교반하면 장치 설계 이외의 웨이퍼에서 잔류 감광액이 거의 또는 전혀 보이지 않을 때까지 개발에 도움이 됩니다.
참고: 사용된 현상액 솔루션의 양에 따라 원치 않는 감광액을 완전히 제거하기 위해 현상액 솔루션을 여러 번 교체해야 할 수도 있습니다. - 현상 용액에서 현상된 웨이퍼를 제거하고 웨이퍼의 양면을 탈이온수(DI)로 30초 동안 부드럽게 헹굽니다.
- 현상된 웨이퍼를 질소(N2) 가스로 건조시킨다.
- 현상된 웨이퍼를 추가 사용할 준비가 될 때까지 건조하고 서늘한 환경의 페트리 접시에 보관하십시오. 주변광에 대한 노출로 인한 포토레지스트의 열화를 방지하기 위해 페트리 접시를 알루미늄 호일로 싸십시오.
참고: 같은 날에 다음 섹션으로 진행하는 것이 좋지만 필수는 아닙니다.
3. 실란화 (1 - 2 시간)
- 실리콘 웨이퍼를 데시케이터로 옮깁니다.
- 데시케이터에 작은 알루미늄 용기(또는 용기 모양으로 접힌 알루미늄 호일 조각)를 놓습니다.
- 피펫 트리클로로(1H, 1H, 2H, 2H-퍼플루오로옥틸) 실란을 알루미늄 용기에 1방울(~50μL) 떨어뜨립니다.
주의 : 실란 용액을 장갑과 보안경으로 다루고 제조업체/현장별 프로토콜에 따라 폐기하십시오. - 데시케이터를 닫고 진공 청소기를 켭니다.
- 건조/실란화가 1-2시간 동안 발생하도록 합니다.
- 실란화 시간이 끝나면 진공을 끄고 실란화 된 웨이퍼를 회수합니다. 실란화된 웨이퍼를 알루미늄 호일로 감싼 페트리 접시에 담아 건조하고 서늘한 환경에서 계속 사용할 수 있을 때까지 보관하십시오.
참고: 실란화는 웨이퍼에서 주기적으로 반복해야 할 수 있으며 PDMS의 더 얇은 층이 사용되는 장치에서 더 자주 반복해야 할 수 있습니다. 웨이퍼로부터 PDMS를 제거할 때 PDMS 접착이 발견되면, 웨이퍼를 재실란화(re-silanization)해야 할 수 있으며, 모든 PDMS가 웨이퍼로부터 제거된 후에 이 섹션을 반복해야 한다. 이것으로 미세유체 소자 마스터를 만드는 데 필요한 단계가 완료됩니다. 마스터는 안정적이며 원하는 경우 후속 섹션을 실행할 수 있습니다.
4. PDMS 증착 (1 - 2 시간)
참고: 이전 미세 가공으로 인해 마스터에 잔류 PDMS가 있는 경우 새 PDMS를 증착하기 전에 잔류 PDMS를 제거해야 합니다.
- 저울에서 PDMS 및 관련 경화제를 10:1 중량 비율로 용기에 계량합니다. 필요한 총 중량은 원하는 PDMS 두께와 페트리 접시 크기에 따라 달라집니다. 4인치 페트리 접시의 경우 ~20g의 PDMS와 ~2g의 경화제는 2-3mm의 두께를 생성합니다.
주의: PDMS 용액을 장갑과 보안경으로 취급하고 제조업체/현장별 프로토콜에 따라 폐기하십시오. - PDMS와 경화제를 플라스틱 주걱 또는 기타 적절한 도구를 사용하여 용기에 5분 동안 혼합합니다.
- 가스 제거를 위해 혼합된 PDMS 용기를 데시케이터로 옮깁니다.
- 데시케이터를 닫고 진공 청소기를 켭니다. PDMS에 기포가 나타나기 시작합니다.
- 30분 동안 건조/탈기가 발생하도록 합니다. 사용된 PDMS의 양과 용기 모양에 따라 실제 시간이 달라질 수 있습니다. 일반적인 종말점은 PDMS에 버블이 거의 또는 전혀 없는 경우입니다.
- 가스를 제거한 후 진공을 끄고 PDMS 용기를 회수합니다.
- 혼합 및 탈기된 PDMS를 페트리 접시의 마스터에 붓습니다.
- PDMS가 완전히 경화될 수 있도록 65°C의 밀폐된 페트리 접시에서 마스터를 밤새 배양합니다.
참고: 이것으로 PDMS 증착 단계가 완료됩니다. PDMS가 인큐베이터에서 하룻밤 동안 경화되도록 하는 것이 좋습니다. 그러면 PDMS가 안정적이므로 필요할 때 후속 섹션을 실행할 수 있습니다.
5. PDMS 장치 조립(1 - 2시간)
- PDMS를 치료한 장치 마스터, 집게 한 쌍, 수동 플런저를 사용한 표준 1.5mm 생검 펀치, 메스/면도날을 회수합니다.
주의 : 칼날을 조심스럽게 다루고 자신이나 다른 사람을 향해 절단하지 마십시오. 자동 수축 또는 안전 블레이드를 사용하는 것이 좋습니다. - 장치 기능 주변에서 레이어 마스터에서 PDMS의 직사각형 조각을 잘라냅니다. PDMS의 각 조각이 양쪽에 약간의 공간이 있는지 확인하고, 양호한 접착 접촉을 촉진하기 위해 장치 기능 측면에 배치하는 동시에 각 조각이 자체 22mm × 22mm 유리 커버슬립에 맞는지 확인합니다.
참고: PDMS의 하단 표면(피처가 있는 면)을 만지지 않는 것이 중요하므로 항상 핀셋을 사용하여 가장자리를 잡고 PDMS를 처리합니다. 또한 PDMS의 기능 측면을 어떤 표면에도 아래로 향하게 놓지 마십시오. 사용하지 않을 때는 필요할 때까지 PDMS를 기능 면이 위를 향하도록 하여 밀폐된 용기에 보관하십시오. - 깨끗한 1.5mm 구멍 펀치를 사용하여 PDMS 조각의 입구 및 출구 구멍을 펀칭합니다. 구멍 펀치를 손상시킬 수 있는 단단한 표면이 아닌 희생 PDMS의 예비 층에 장치 PDMS를 펀칭합니다.
- 이소프로필 알코올(IPA) 습식 천으로 22mm × 22mm 유리 커버슬립을 꺼내 청소합니다.
- 플라즈마는 CDA 플라즈마를 사용하여 진공 상태(압력 < 22Torr)에서 22mm × 커버슬립을 5분 동안 청소합니다. 이렇게 하면 커버슬립의 파편이나 유기 코팅이 제거됩니다.
- 22mm × 22mm 유리 커버슬립과 PDMS의 특징면을 IPA 습식 와이프로 닦습니다.
- PDMS(특징면이 위를 향함)와 유리 커버슬립(이전에 청소한 것과 동일한 면이 위를 향함)을 플라즈마 클리너에 넣고 CDA 플라즈마를 사용하여 진공(압력 < 0.5Torr) 상태에서 30초 동안 동시에 플라즈마 세척합니다.
- 플라즈마 클리너에서 유리 커버슬립과 PDMS 장치를 모두 제거합니다. PDMS를 반전시켜 특징면이 아래를 향하도록 하고 유리 커버슬립에 놓습니다. 본딩을 관찰하고 양호한 접촉을 촉진하기 위해 필요에 따라 PDMS를 가볍게 누릅니다.
- 본딩을 용이하게 하기 위해 65°C의 밀폐된 페트리 접시에서 3분 동안 본딩된 커버슬립을 배양합니다.
참고: 플라즈마 결합은 유리 커버슬립의 소수성을 변화시켜 친수성 표면을 생성합니다. 일화적 증거를 통해 커버슬립의 원래 소수성 상태가 실온에서 약 2일 동안 배양한 후에 돌아온다는 것이 관찰되었습니다. 플라즈마 본딩 후 2일 이내에 제작된 장치를 사용하는 것이 좋습니다. 이것으로 미세 가공 단계가 완료됩니다. 장치는 유통 기한이 정해져 있지 않지만 사용하지 않을 때는 서늘하고 건조한 곳에 보관해야 합니다.
6. Microfluidic 유동 채널 준비 (1 h)
- 조립된 미세유체 장치를 깨끗한 맞춤형 스테이지 어댑터(47)에 고정합니다.
- 주사기, Lour-lock 어댑터 및 피팅 페룰, 1.5mm 외경의 투명 튜브(약 15-20cm 길이) 조각을 회수합니다. 어댑터를 통해 튜브를 주사기에 연결합니다.
- 미세유체 장치 배출구에 세 개의 튜빙을 더 연결하고(이 튜빙은 특정 길이일 필요는 없음) 이 튜빙의 다른 쪽 끝을 폐기물 바이알 다운스트림으로 보냅니다.
- 주사기를 사용하여 아래 단계에 따라 용액을 도입하여 미세유체 장치를 준비합니다. 용액의 순서와 부피는 BRB80 완충 용액 50μL, 항로다민 항체 용액 25μL, 5분 대기, BRB80 50μL, 폴록사머 407(F127) 25μL, 15분 대기, BRB80 50μL입니다. 예는 표 1 을 참조하십시오.
- 소스에서 용액을 튜브로 끌어옵니다.
참고: 용액을 주사기 자체로 완전히 당기지 마십시오. 용액은 튜브에만 남아 있어야 합니다. - 튜브 끝에 작은 액체 방울이 나타날 때까지 주사기 플런저를 부드럽게 누릅니다. 이렇게 하면 튜브가 부착될 때 미세유체 장치에 공기가 들어가는 것을 방지할 수 있습니다.
- 튜브를 미세유체 장치의 입구에 부착합니다.
- 전부는 아니지만 대부분의 용액이 튜브를 통해 날아갈 때까지 주사기 플런저를 천천히 누릅니다. 튜브에 소량의 액체를 남겨두면 실수로 튜브를 통해 공기가 유입되지 않습니다. 이러한 전달 중에 튜브와 미세유체 채널을 관찰하여 기포를 찾습니다.
알림: 튜브에 기포가 발생하면 문제 해결을 시작하십시오(기포가 도착하기 직전에 튜브의 플러그를 뽑은 다음 기포가 통과한 후 튜브를 다시 부착하여 미세유체 장치에 들어가기 전에 기포를 제거하십시오). - 모든 시약이 통과할 때까지 다음 시약에 대해 6.4.1-6.4.4 단계를 반복합니다. 소스 시약의 교차 오염을 방지하기 위해 각 시약에 대해 새로운 주입 튜브가 필요합니다. 최종 BRB80 세척이 완료되면 장치는 몇 분 동안 안정됩니다. 입구에 BRB80 용액을 떨어뜨리면 장치가 건조되는 것을 방지할 수 있습니다.
- 소스에서 용액을 튜브로 끌어옵니다.
- 표준 프로토콜에 따라 구아노신-5'-[(α,β)-메틸렌]트리포스페이트(GMPCPP)-안정화된 미세소관 '시드'를 준비합니다(TTR 라벨링 비율 ~25%)47,48.
- 지정된 최종 농도를 산출하기 위해 다음 시약을 각각의 양(원료 농도에 따라 다름)으로 결합하여 2배 작업 농도에서 이미징 완충 용액('안티페이드')을 준비합니다: 40mM 포도당, 40μg/mL 포도당 산화효소, 16μg/mL 카탈라아제, 0.5mg/mL 카제인, 50mM 염화칼륨 및 10mM 디티오트레이톨(DTT)이 보충된 BRB80. 이 이미징 버퍼는 광안정성을 연장하는 데 사용됩니다. 예를 들어 표 2 를 참조하십시오.
- 2x antifade 용액의 일부를 BRB80에서 1:1로 희석하여 1x 작동하는 antifade 용액을 생성합니다. 이 페이드 방지를 실온(RT)으로 데우십시오. 스톡 Antifade 용액은 얼음 위에 보관해야 합니다.
| 주문 | 시약 | 부피 희석 | 세척량 | 잠복기 |
| 1 | BRB80 | 해당 사항 없음 | 50 마이크로L | 해당 사항 없음 |
| 2 | 안티 로다민 항체 | BRB80의 1:50, 잘 섞는다 | 25 마이크로L | 5 분 |
| 3 | BRB80 | 해당 사항 없음 | 50 마이크로L | 해당 사항 없음 |
| 4 | 폴록사머 407 (F127) | BRB80에서 1% | 25 마이크로L | 15 분 |
| 5 | BRB80 | 해당 사항 없음 | 50 마이크로L | 해당 사항 없음 |
표 1: 미세유체 장치 채널의 준비 순서.
| 음량 | 시약 | 재고 집중도 | 최종 집중 |
| 16 μL | D-포도당 | 2 미터 | 80 밀리미터미터 |
| 16 μL | 포도당 산화효소 | 2 mg/mL | 80 μg/mL |
| 16 μL | 카탈라아제 | 0.8 mg/mL | 32 μg/mL |
| 14 μL | 카제인 | 28 mg/mL | 0.16 마그네슘 / mL |
| 8 μL | 디티(DTT) | 1 미터 | 20 밀리미터미터 |
| 40 μL | 염화칼륨 | 1 미터 | 100 밀리미터미터 |
| 290 마이크로L | BRB80 | 1배 | 해당 사항 없음 |
| 400 μL | FINAL(2x 작업 농도) |
표 2: Antifade 이미징 용액 레시피(2배 농도).
7. 미세유체에 미세소관 씨앗 소개(10 - 15분)
- 미세유체 장치를 현미경에 연결합니다.
참고: 미세소관 안정성은 온도에 따라 달라지기 때문에 이미징 실험은 35°C에서 수행하는 것이 좋습니다. - 10-15cm의 새 튜브를 주사기에 부착하고 GMPCPP 안정화 미세소관 시드를 원하는 희석액으로 튜브에 끌어들입니다.
참고: 이 장치의 경우 ~10nM GMPCPP-미세소관 씨앗이 최적의 농도였습니다. - 튜브 끝에 작은 액체 방울이 나타날 때까지 주사기 플런저를 부드럽게 누릅니다. 이렇게 하면 튜브가 부착될 때 미세유체 장치에 공기가 들어가는 것을 방지할 수 있습니다.
- 튜브를 미세유체 장치의 입구에 부착합니다.
- 전부는 아니지만 대부분의 용액이 튜브를 통해 날아갈 때까지 주사기 플런저를 천천히 누릅니다. 튜브에 소량의 액체를 남겨두면 실수로 튜브를 통해 공기가 유입되지 않습니다.
- 미세유체 장치와 주사기에서 흡입구 튜브를 분리하고 주사기에 새 튜브 조각을 부착합니다.
- BRB80을 튜브에 끌어들입니다.
- 7.3-7.6단계를 반복하여 장치에서 결합되지 않은 미세소관 씨앗을 씻어냅니다.
- TIRF(Total Internal Reflection Fluorescence) 현미경을 사용하여 미세유체 표면에 씨앗이 부착되는 것을 관찰합니다. 단일 시야각에서 이상적인 시드 수는 응용 프로그램과 시야 크기에 따라 다르지만 일반적으로 80μm × 80μm 시야당 ~10-20개의 시드가 최적입니다. 원하는 종자 밀도에 도달할 때까지 필요에 따라 7.2-7.9단계를 반복합니다.
참고: 미세소관 종자 밀도를 모니터링하려면 용액에 아직 퇴색 방지가 없기 때문에 간헐적인 단광 노출(100ms)을 사용해야 합니다. - 적절한 결합 시드 밀도에 도달하면 새 주입 튜빙 조각을 주사기에 부착합니다.
- 따뜻한 1x 퇴색 방지 용액을 튜브에 넣고 7.3-7.6단계를 반복합니다.
알림: 이제 장치에 페이드 방지 솔루션이 적용되어 광안정성이 크게 향상되고 장치가 안정적입니다. 그러나 여전히 레이저 광선에 대한 노출을 최소화하는 것이 좋습니다.
8. 씨앗에서 미세소관 확장 성장 (15 - 30분)
- 형광 표지된 튜불린, 표지되지 않은 튜불린, 2x 퇴색 방지 용액, 구아노신-5'-삼인산(GTP) 및 BRB80을 결합하여 7% 형광 표지 비율에서 14μM 튜불린, 1x 작업 농도에서 퇴색 방지 및 1mM GTP를 포함하는 최종 용액을 얻을 수 있습니다.
참고: 튜불린의 농도 또는 다른 라벨링 비율을 사용하는 경우 원하는 최종 농도 및 라벨링 비율을 달성하기 위해 각 시약의 부피를 조정해야 합니다. 튜불린 용액을 도입하기 ~30초 전까지 얼음 위에 두었다가 얼음에서 용액을 꺼내 손에 들고 RT로 데웁니다. 이것은 온도에 의존하는 과정인 미세소관 확장의 중합에 도움이 됩니다. 실제로 미세소관 중합은 35°C에서 수행해야 하며 다른 모든 실험 단계는 RT에서 수행할 수 있습니다. - 10-15cm의 새 튜브를 주사기에 부착하고 튜브에 튜불린 용액을 끌어들입니다.
- 튜브 끝에 작은 액체 방울이 나타날 때까지 주사기 플런저를 부드럽게 누릅니다. 이렇게 하면 튜브가 부착될 때 미세유체 장치에 공기가 들어가는 것을 방지할 수 있습니다.
- 튜브를 미세유체 장치의 입구에 부착합니다.
- 전부는 아니지만 대부분의 용액이 튜브를 통해 날아갈 때까지 주사기 플런저를 천천히 누릅니다. 튜브에 소량의 액체를 남겨두면 실수로 튜브를 통해 공기가 유입되지 않습니다. 미세유체 장치에서 주입구 튜브를 분리합니다.
- 10-15분 동안 또는 확장이 구부러질 만큼 충분히 길어질 때까지 원하는 빈도로 이미지를 촬영합니다. 일반적으로 이미징은 확장이 최소 5-10μm(~15분)가 될 때까지 5초마다 488nm에서, 60초마다 561nm에서 수행됩니다.
참고: 이 튜불린 농도에서 미세소관은 중합 기간과 해중합 기간 사이에 확률적으로 전환될 수 있습니다. 이것은 예상할 수 있는 것이지만, 전반적으로 미세소관 확장은49를 연장할 것입니다.
9. 미세소관 확장 안정화 (10-15분)
- 탁솔(Taxol), 2x 안티페이드 용액 및 BRB80을 결합하여 10μM 탁솔(taxol)과 1배 작업 농도에서 페이드 방지를 포함하는 최종 용액을 얻을 수 있습니다.
참고: 도입 ~30초 전까지 탁솔 용액을 얼음 위에 두었다가, 이 시점에서 얼음에서 용액을 꺼내 손으로 데워 RT합니다. 이것은 온도에 의존하는 과정인 미세소관 확장의 해중합을 방지합니다. - 10-15cm의 새 튜브를 주사기에 부착하고 탁솔 용액을 튜브로 끌어들입니다.
- 튜브 끝에 작은 액체 방울이 나타날 때까지 주사기 플런저를 부드럽게 누릅니다. 이렇게 하면 튜브가 부착될 때 미세유체 장치에 공기가 들어가는 것을 방지할 수 있습니다.
- 튜브를 미세유체 장치의 입구에 부착합니다.
- 용액의 전부는 아니지만 대부분이 튜브를 통해 날아갈 때까지 주사기 플런저를 누릅니다. 튜브에 소량의 액체를 남겨두면 실수로 튜브를 통해 공기가 유입되지 않습니다.
- 9.2-9.5단계를 빠르게 연속으로 두 번 반복합니다. 이 경우 동일한 튜빙 조각을 사용할 수 있습니다.
참고: 탁솔(Taxol)은 용액 내 튜불린(tubulin)으로부터 새로운 미세소관 핵형성을 촉진하며, 이러한 미세소관은 미세유체 채널의 표면에 착륙하여 후속 이미징/굽힘을 방해할 수 있습니다. 이 때문에 탁솔 용액은 가능한 한 빨리 장치에서 유리 튜불린을 제거하기 위해 장치를 빠르고 여러 번 반복하여 흐름해야 합니다. - 씨앗에서 자란 미세소관이 여전히 존재하고 장치에 안정화되어 있는지 확인합니다.
10. 굽힘 안정화된 미세소관 확장(10 - 15분)
참고: 안정화된 미세소관 확장은 이제 흐름 컨트롤러를 사용하여 구부릴 수 있습니다. 여기에서는 조절된 양압 변위 시스템(Elveflow OB1 MK3+)을 사용하여 밀폐 소스 바이알에서 유량계를 통해 미세유체로 용액을 흐르게 했습니다. 사용 가능한 유량 컨트롤러 설정의 세부 사항에 따라 다음 단계를 수정할 수 있습니다.
- 제조업체/현장별 프로토콜에 따라 유량 컨트롤러 및 관련 장비를 설정하고, 튜브를 사용하여 소스 바이알을 유량계 입구에 연결하고 유량계 출구를 미세유체 입구에 연결하되 아직 튜브를 미세유체 장치에 부착하지 마십시오.
- ~200 μL의 10 μM 탁솔 용액을 유량 컨트롤러 설정에 부착할 수 있는 소스 바이알에 삽입합니다. 이 설정은 Luer-lock 연결을 사용하여 기밀 밀봉을 만듭니다.
- 흐름 제어 시스템을 켜고 튜브를 프라이밍하여 공기를 제거합니다. 이렇게 하면 튜브가 부착될 때 미세유체 장치에 공기가 들어가는 것을 방지할 수 있습니다.
- 유량계를 통해 튜브를 프라이밍하고 튜브 끝에 작은 유체 방울이 나타나면 흐름 제어 시스템을 끕니다.
- 튜브를 미세유체 장치의 입구에 연결합니다. 미세소관 씨앗을 도입하고 미세소관 확장을 성장시켜 직각으로 구부리는 데 사용되는 주입구에 수직인 주입구를 사용합니다.
- 원하는 유속 또는 압력에서 흐름을 시작 및 중지하여 확장을 구부립니다. 30mbar의 압력은 5초 주기의 진동 흐름을 사용하는 이 프로토콜의 표준입니다. 이 시간 동안의 굽힘을 이미지화하며, 일반적으로 488nm에서 0.1초마다, 561nm에서 10초마다입니다.
참고: 이것으로 기본 미세소관 굽힘 분석이 완료됩니다. 모든 장비 및 시약은 제조업체/현장별 프로토콜에 따라 세척/폐기할 수 있습니다.
결과
미세유체 소자 설계 이론적 근거
이 연구에서 미세유체 장치의 설계는 기존의 단순한 플로우 셀 설계를 기반으로 하고 개선하는 몇 가지 주요 기능(그림 2)에 의해 안내되었습니다. 주목할 점은, 미세유체 소자의 내부 부피는 ~160 nL이며, 이는 보다 전통적인 플로우 셀(47)의 ~10 μL 부피보다 훨씬 작기 때문에 정제된 단백질 성분과 같은 잠재적으로 귀중한 시약을 보다 제어적으로 사용할 수 있습니다. microfluidic 교류 관제사에는 2개의 통제 수로가 포함하기 때문에, 단지 2개의 인레트/출구 항구에는 단지 2개의 인레트/출구 항구에는 어떤 주어진 시간든지 압력 통제가 있을 것이라는 점을 가정하여 개발되었습니다. 원하는 경우 더 많은 압력 제어 채널을 구현할 수 있습니다.
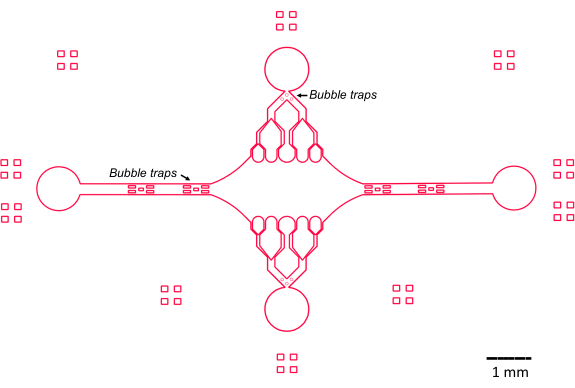
그림 2: 미세유체 장치 설계의 개략도. 주변의 직사각형 표시는 채널의 주변을 보는 데 도움이 되는 시각적 보조 수단입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
중앙의 직사각형 소자 챔버는 미세소관 씨앗이 부착되는 주요 이미징 영역 역할을 하며, 미세소관 확장은 이러한 씨앗에서 중합됩니다. 챔버는 각 측면의 유동 채널에 의해 교차하며, x축을 따라 있는 직선 채널은 반응 용액의 빠른 교환을 용이하게 하는 입구 및 출구 역할을 합니다. 미세소관 입구 채널은 또한 미세소관 시드를 챔버로 도입하는 데 사용되며, 층류는 시드가 흐름 방향을 따라 유리 표면에 결합하도록 합니다. 수직(y축) 방향에서, 흐름 채널은 챔버를 향하는 더 작은 채널로 분기하며, 이는 이전 설계(25,28,36,39)의 일부와 유사합니다. 분기 형상은 미세소관의 기계적 특성을 연구하는 데 특히 적합합니다. 미세소관 씨앗의 방향에 수직인 방향에서 중앙 챔버로 용액을 흐르게 하면 거의 수직 각도에서 흐름으로 유도된 굽힘력이 가능합니다. 또한, 많은 작은 유동 채널을 가진 분기 형상을 포함하면 중앙 챔버의 넓은 영역에 걸쳐 보다 균일한 힘을 적용할 수 있으며, 이는 단순한 단일 채널 유동 형상으로는 달성되지 않습니다. 이러한 방식으로, 분기 모티프는 겉보기에는 더 복잡해 보이지만 미세소관에 가해지는 힘을 결정하는 데 있어 전반적인 복잡성을 줄일 수 있습니다(그림 3). 이 설계는 또한 여러 대칭선을 특징으로 하여 사용이 간편하고 여러 방향(예: 상단 대 하단)에서 굽힘을 평가할 수 있습니다.
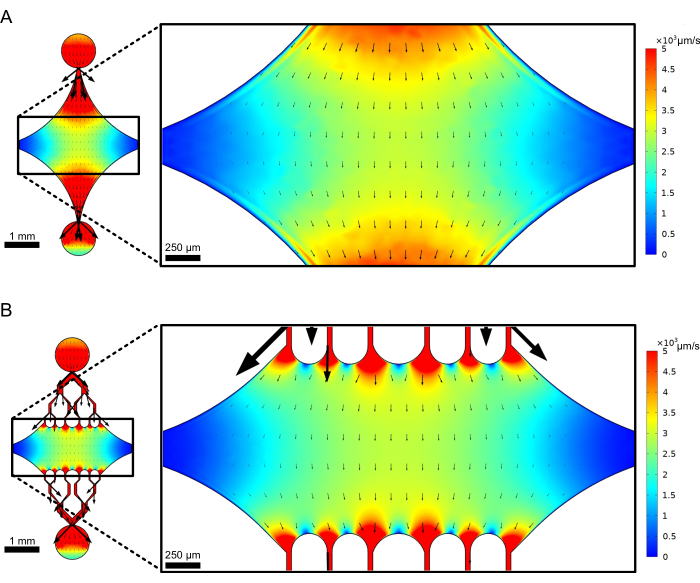
그림 3: 분기 모티프를 포함하면 유사한 흐름의 넓은 영역이 생성됩니다. 정상 상태 흐름에서 두 개의 장치 설계 시뮬레이션: 하나는 분기 채널이 없는 것(A)이고 다른 하나는 분기 채널이 있는 것(B). 화살표는 로컬 흐름 방향을 나타내며 흐름 크기에 비례합니다. 표면 채색은 중심선 속도를 나타냅니다. 오른쪽 이미지는 x축을 따라 배향된 미세소관(표시되지 않음)이 상단 포트에서 흐르고 하단 포트로 나가는 유체의 굽힘력을 받는 장치의 확대된 섹션을 보여줍니다. 분기 채널을 통합하면 유사한 속도 필드에 영향을 받는 상대 면적이 증가하면서 필요한 시약의 부피는 증가하지 않습니다. 이 그림은 Rogers (2022)14의 허가를 받아 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
특히, 이 장치는 공기 방울이 중앙 이미징 챔버로 유입되는 것을 방지하기 위해 입구 및 출구 흐름 채널에 일련의 버블 트랩을 구현합니다. 특히, 표면 장력으로 인해 기포가 지나가는 것을 차단하기 위해 유로 내에 마이크로필러 배열을 포함하기로 결정했습니다(그림 2)46). 또한 공기 유입을 방지하기 위해 장치 내부의 가장자리를 비스듬한 각도가 아닌 부드러운 곡선으로 설계했습니다. 종합하면, 이러한 설계 특징은 기포의 가능성을 줄이고 장치의 견고성을 높입니다.
미세유체 장치 제작
장치 마스터를 만들기 위한 적절한 파라미터를 결정하려면 몇 가지 최적화가 필요했습니다. 앞서 관찰된 바와 같이, 이 포토레지스트는 포토리소그래피 단계(50) 동안의 주변 조명 및 가열 및 냉각 속도와 같은 주요 작동 파라미터에 매우 민감하다. 예를 들어, 가열 후 마스터가 너무 빨리 냉각되면 포토레지스트에서 열 균열이 발생할 수 있습니다. 이는 균열로 인해 채널 무결성이 손상될 수 있으므로 바람직하지 않습니다. 균열은 레지스트를 전이 온도(~115°C)에 가까운 온도로 재가열하여 해결할 수 있지만, 마스터가 핫 플레이트에서 주변 냉각되도록 하는 것이 균열을 방지하는 가장 강력한 방법이라는 것을 발견했습니다. 또한, 과도한 주변광은 포토레지스트의 의도하지 않은 노출을 초래하여 레지스트를 약화시키고 개발 단계에서 장치 피처 자체(개발 후 웨이퍼에 남아 있어야 함)가 부분적으로 벗겨지는 결과를 초래할 수 있습니다. 이러한 이유로 개발 단계는 노출 후 베이킹 및 주변 야간 냉각 단계 다음 날에 수행하는 것이 좋습니다. 또한 장치 마스터를 사용하지 않을 때는 시간이 지남에 따라 성능이 저하되는 것을 방지하기 위해 어두운 곳에 보관하거나 알루미늄 호일로 감싸는 것이 좋습니다. 이러한 매개변수가 결정되면 포토리소그래피 공정의 반복성이 높아졌습니다(그림 4).
마스터가 생성된 후 액체 PDMS를 마스터 위에 주조하여 PDMS가 경화되고 마스터의 특징에 대한 부정적인 각인을 생성할 수 있도록 했습니다. 우리는 PDMS를 2-3mm 두께로 주조하면 장치를 쉽게 조작할 수 있다는 것을 발견했습니다. 대조적으로, μm 범위의 두께를 달성하기 위해 스핀 코팅된 경우 PDMS는 찢어지거나 자체 접착되기 쉬워 조작이 어려웠습니다. 또한 PDMS 층이 더 두꺼워지면 튜브가 실런트나 클램프 없이 입구/출구 포트에 남아 있기 때문에 튜브를 더 쉽게 연결할 수 있습니다.
마지막으로, 이러한 생물학적 응용 분야를 위한 기존의 플로우 셀 분석법은 피라냐 용액(과산화수소 및 황산)을 사용하여 사전 세척한 후 실란화된 유리 커버슬립을 사용하는 경우가 많지만, 확장된 플라즈마 세척 및 IPA 세척으로 처리된 커버슬립이 당사의 목적에 적합하다는 것을 발견했습니다47. 단일 분자 이미징과 같은 다른 응용 분야에는 보다 광범위한 커버 유리 처리가 필요할 수 있습니다.

그림 4: 포토리소그래피 공정. (A) 원하는 디자인의 마스크(유리에 에칭된 크롬으로 만든 마스크). (B) 열 응력으로 인한 실리콘 웨이퍼의 포토레지스트에 약간의 균열이 있음(화살표는 몇 가지 균열을 강조 표시함). 이러한 균열은 종종 전체 웨이퍼에 걸쳐 뻗어 있습니다. (C) 개발된 마스터. (D) 현미경의 미세유체 설정. 개별 구성 요소는 녹색으로 레이블이 지정됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
미세소관의 성장, 안정화 및 절곡
GMPCPP에서 자란 미세소관 씨앗은 미세소관 확장이 중합되기 위한 핵형성 부위 역할을 하며 실온에서 몇 시간 동안 해중합에 대해 안정적입니다. 씨앗은 항 로다민 항체(47)를 사용하여 미세 유체 채널의 유리 커버 슬립에 결합되었다. 그런 다음 동적 미세소관 확장을 용해성 튜불린(soluble tubulin, 형광 표지되지만 로다민 접합은 아님) 및 GTP의 존재 하에서 성장시켰습니다. 이러한 방식으로, 시드 핵형성 부위는 유리 커버슬립에 부착되었지만, 확장은 부착되지 않았다. 15분의 확장 성장 기간 동안, 미세소관 확장은 내재적 동적 불안정성으로 인해 예상대로 확률적으로 중합 및 탈중합되었습니다49. 이러한 성장 기간 이후, 용액에서 잔류 튜불린을 제거하고 형성된 미세소관 확장을 안정화하기 위해 10μM 탁솔 세척을 수행했습니다. 안정화가 중요한데, 그렇지 않으면 미세소관 확장이 튜불린 고갈 시 해중합되기 때문입니다. 미세소관 중합체를 결합하고 안정화하는 것 외에도 Taxol은 미세소관 고분자 역학에 영향을 미치고 선형 미세소관 확장 51,52,53,54에서 곡률을 유도할 수 있는 것으로 입증되었습니다. 여기에 표시된 결과는 이러한 관찰을 반영합니다. 그러나 미세소관 확장의 말림은 굽힘 중에 격자를 따라 전달되는 불균일한 힘을 초래하기 때문에 바람직하지 않습니다. 따라서 안정화 후 상대적으로 직선으로 유지된 미세소관만 굽힘 분석에 사용되었습니다. 대안적으로, 초기 성장 기간 후에, 튜불린 및 GMPCPP 용액(초기 GTP와 반대)을 사용한 2차 성장 기간을 사용하여 미세소관 격자의 성장 말단에 안정적인 '캡'을 생성하고 해중합을 방지할 수 있습니다55.
그런 다음 일정한 업스트림 압력을 유지하기 위해 압력 제어 시스템을 사용하여 버퍼 용액 내부를 흐르게 하여 미세소관을 구부렸습니다(그림 5, 보충 비디오 1). 이런 식으로, 우리는 미세소관이 경험하는 국부적 흐름을 근사화할 수 있었습니다. 유체가 상단에서 하단 장치 포트로 유입되고 외부로 흘러 들어옴으로써 흐름의 방향은 시딩 방향에 수직이되도록 의도되었습니다.
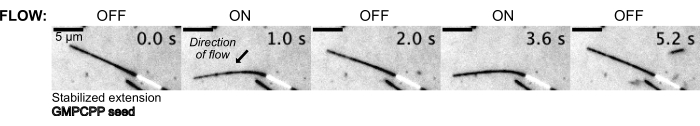
그림 5: 미세유체 설정을 사용하여 안정화된 미세소관을 구부릴 수 있습니다. 파클리탁셀(paclitaxel)로 안정화한 후 휴지 상태의 미세소관은 박동이 흐르는 동안 구부러집니다. 30mbar의 일정한 상류 압력은 흐름을 구동합니다(화살표는 흐름 방향을 나타냄). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
미세유체 장치에서의 흐름 프로파일의 결정
미세유체역학의 중심선 속도는 COMSOL 소프트웨어(시뮬레이션 소프트웨어, 그림 6A)를 사용하여 계산적으로 시뮬레이션할 수 있습니다. 그러나 미세소관은 표면에서 ~100nm 이내의 TIRF 현미경 검사를 위해 유리 커버슬립에 부착됩니다. 따라서 미세소관이 경험하는 속도는 2D 시뮬레이션에서 예측된 속도와 동일하지 않습니다. 미세소관이 경험하는 국소 흐름을 근사화하기 위해 우리는 1차원에서 비압축성 유체 흐름에 대한 일반적인 Navier-Stokes 방정식을 사용했습니다.
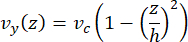
여기서 z 는 장치 내 미세소관의 높이, h 는 장치의 전체 높이, vc 는 장치의 중심선 속도입니다. 시스템의 정의에 따라 z-origin은 장치의 중심입니다(그림 6B). 이 정의와 13μm의 채널 높이를 사용하면 미세소관의 높이는 z = -6.4μm로 근사치됩니다. 이 방정식을 풀면 미세소관이 겪는 국소 유체 속도에 대한 추정치를 얻을 수 있습니다.

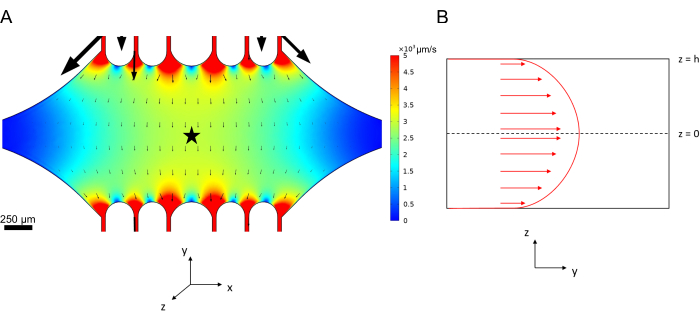
그림 6: 상단 포트에서 장치로 들어가고 하단 포트(포트는 표시되지 않음)에서 나가는 유체의 유체 흐름 분석을 위한 시스템 정의. (A) 그림 3B와 같이 스케일링된 중심선 속도 필드의 시뮬레이션. 별은 패널 B의 관심 영역을 나타냅니다. (B) 장치의 단면 표현. 완전히 개발된 유체 흐름 프로파일은 z = 0에서 중심선 속도 vc 와 벽에서 미끄럼 방지 경계 조건으로 y 방향입니다. 이 패널의 화살표는 패널 A에 표시된 실제 속도 필드에 대해 크기를 조정하지 않습니다. 이 그림은 Rogers (2022)14의 허가를 받아 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
시뮬레이션을 넘어서, 유체 속도는 압력을 유지하는 대신 체적 유량을 기반으로 하는 유량 컨트롤러를 사용하여 제어할 수 있습니다. 또한 각 장치의 국소 유속은 형광 비드를 포함하고 속도를 모니터링하여 직접 결정할 수 있으므로 샘플 간 변동성을 완화할 수 있습니다.
Computational modeling and gradient demonstrations (컴퓨터 모델링 및 그래디언트 시연)
마지막으로, 고처리량 실험에 이 장치를 사용할 수 있는 타당성을 입증하기 위해 실험과 함께 컴퓨터 시뮬레이션을 수행했습니다. 장치의 대칭 덕분에 미세소관을 여러 방향으로 구부릴 수 있는 능력과 함께 시뮬레이션은 장치가 정확한 기울기를 유지할 수 있음을 보여주어 여러 실험 조건을 동시에 조사할 수 있음을 보여주었습니다(그림 7A). 용액에 형광 염료를 사용한 예비 실험(이 간행물의 일부로 명시적으로 언급되지 않은 방법)은 계산 예측과의 일관성을 보여주었습니다(그림 7B). 또한, 우리는 서로 다른 형광 표지를 가진 미세소관 확장을 동시에 성장시킴으로써 장치의 다른 영역에서 서로 다른 단백질의 분할을 성공적으로 입증했습니다(그림 8). 우리가 아는 한, 이것은 미세소관 조사에 대한 고처리량 미세유체역학의 첫 번째 응용입니다. 이 장치의 이 기능은 필요한 시약의 시간과 수량을 줄이는 동시에 실험의 견고성을 개선하는 데 사용할 수 있습니다. 예를 들어, 서로 다른 단백질 또는 개별 단백질의 뚜렷한 농도가 미세소관 역학 및 역학에 미치는 영향을 단일 장치에서 동시에 조사할 수 있습니다.
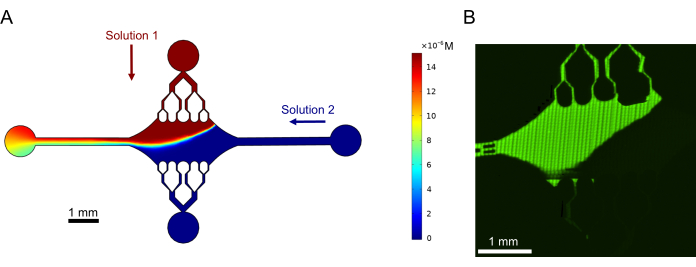
그림 7: 그래디언트 형성. (A) 동일한 입구 압력(50mbar)과 농도(15μM)에서 장치에 유입되는 두 용액의 그래디언트 시뮬레이션. 각 용액의 입구 포트는 색상 화살표(한 솔루션은 상단 포트에, 다른 솔루션은 오른쪽 포트에 있음)로 표시되며 나머지 두 포트는 출구 역할을 합니다. 히트맵은 상단 용액의 농도 프로파일을 보여줍니다. 정상 상태는 t = 5 s에서 달성되었습니다. (B) 상단 포트의 용액에서 형광 염료를 사용하고 오른쪽 포트에서 버퍼를 사용하여 유사한 구배를 실험적으로 생성했습니다. 이미지는 전체 장치 영역을 해결하기 위해 각 시야(80μm × 80μm)를 스티칭하여 만든 래스터 레이어입니다. 이 그림은 Rogers (2022)14의 허가를 받아 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
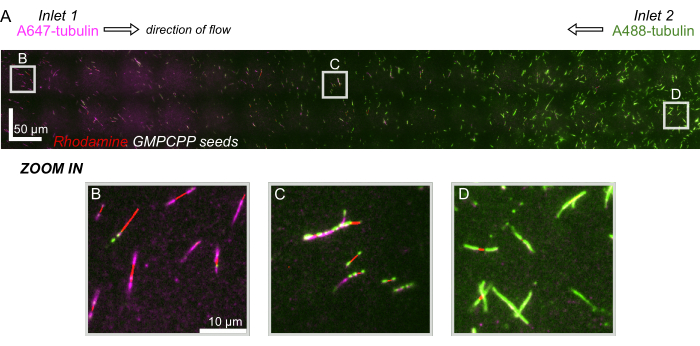
그림 8: microfluidic 장치에 있는 단백질 기온변화도 설명. AlexaFluor647 라벨링 튜불린(마젠타색)은 주입구 1에서, AlexaFluor488 라벨링 튜불린(녹색)은 동일한 농도 및 유속으로 장치의 흡입구 2에서 비행했습니다. 흐름은 혼합을 억제하면서 안정화된 GMPCPP 시드(빨간색)에서 튜불린 중합을 허용하기 위해 90초 단위로 진동했습니다. (A) 장치의 전체 길이를 해결하기 위해 시야각(80x80μm)을 스티칭하여 만든 대규모 래스터 레이어. 문자는 후속 패널에서 개별 시야의 상대적 위치를 지정합니다. 눈금 막대는 X 및 Y 위치에서 50μm입니다. (B) 장치의 입구 1 근처의 시야, 확장은 주로 A647 표지 튜불린으로 구성됩니다. (C) 장치 중앙 부근의 시야, 여기서 확장은 예측한 대로 라벨링된 튜불린의 혼합물로 구성됩니다. (D) 장치 하단 근처의 시야, 확장은 주로 A488 표지 튜불린으로 구성됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
현미경의 미세유체역학 실험 설정을 위한 공정 흐름도(PFD)는 보충 그림 1에 나와 있습니다.
보충 그림 1: 현미경의 미세유체역학 실험 설정을 위한 공정 흐름도(PFD). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 비디오 1. 미세유체 설정은 안정화된 미세소관을 구부리는 데 사용할 수 있습니다. 파클리탁셀(paclitaxel)로 안정화한 후 휴지 상태의 미세소관은 박동이 흐르는 동안 구부러집니다. 30mbar의 일정한 업스트림 압력이 흐름을 구동합니다. 동영상 재생 속도 10fps. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 미세유체 마스크 설계의 CAD 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜의 주요 목표는 시험관 내에서 미세소관 역학 조사에 적합한 미세유체 장치를 설계하고 제작하는 것이었습니다. 이 설계는 PDMS 기반 미세유체 장치의 본질적인 이점을 활용하는 동시에 강력하고 사용자 정의 가능한 고처리량 실험을 가능하게 하는 기능 조합을 포함하려는 욕구를 기반으로 했습니다.
이 목표는 성공적으로 달성되어 이 시스템의 향후 사용자를 위한 기초가 될 수 있는 제조 프로토콜 및 일반 지침이 탄생했습니다. 장치에 중복 버블 트랩을 포함하면 기포의 존재로 인한 단백질 변성 가능성이 줄어듭니다. 여전히 장치에서 튜브의 플러그를 뽑았다가 다시 꽂아야 하지만 이러한 버블 트랩은 실험 실패 가능성을 줄입니다. 미세유체 설정에 대한 향후 개선은 실험 중에 이루어진 수동 튜빙 조작의 양을 더욱 줄일 수 있습니다. 더욱, microfluidic 장치와 자동화된 순서 조절 소프트웨어의 통합은 수동 과실의 가능성을 감소시키고 있는 동안 실험 조건의 뜻깊은 주문화를 허용합니다. 우리는 장치를 제작한 다음 자동 컨트롤러 조절 흐름을 사용하여 장치에서 미세소관 확장을 성장, 안정화 및 구부림으로써 장치의 성공적인 성능을 입증했습니다. 또한, 동일한 장치 내에서 별개의 형광 표지된 튜불린 용액의 기울기를 설정함으로써 단일 장치에서 여러 조건을 동시에 실행할 수 있음을 보여주었습니다. 컴퓨터 모델링 및 분석 기술의 도움을 받아 당사 시스템은 굴곡 강성 52,56,57,58,59와 같은 미세소관의 생체역학적 특성을 조사하고 결정할 수 있습니다.
향후 개선될 가능성은 훨씬 더 강력한 시스템 및 관련 실험 분석을 용이하게 할 것입니다. 첫째, 포토레지스트 증착, 노출 및 베이킹은 약간의 변동성을 보여주는 중요한 매개변수였습니다. SPR 포토레지스트의 상대적으로 높은 피처 크기는 장치를 손상시킬 수 있는 열 균열을 방지하기 위해 매우 점진적인 가열 및 냉각이 필요했습니다. 더 얇은 장치를 시도했지만 이러한 더 작은 기능 크기를 조작하는 데 문제가 있음을 발견했습니다. 세부 사항에 대한 주의와 인내심은 SPR 포토레지스트로 이 두께의 장치를 복제하는 데 매우 중요합니다. 가용성에 따라 이 문제를 해결하기 위해 다른 포토레지스트를 사용할 수 있습니다.
종합하면, 여기의 미세유체 장치 및 프로토콜은 이전 플로우 셀 분석보다 더 강력하고 처리량이 많은 테스트 기능을 갖춘 다양한 실험 설정을 허용합니다47. 또한 유량 컨트롤러를 사용하여 실험을 자동화하여 장치에서 정확한 유량 프로파일 또는 농도 구배를 유지하여 수동 사용자에게 내재된 변동성을 줄일 수 있습니다. 이 설정의 향후 잠재적 응용 분야에는 미세소관 굴곡 강성, 역학, 격자 손상 및 복구에 대한 미세소관 관련 단백질의 영향뿐만 아니라 미세소관과 액틴 필라멘트 54,60,61,62,63,64,65,66,67,68의 생체역학적 상호 작용에 대한 조사가 포함됩니다,69,70. 미세 가공, 자동화된 흐름 제어, 컴퓨터 모델링 및 분석 기술의 통합으로 세포 골격 in vitro 연구에 적합한 다목적 시스템이 만들어집니다.
공개
저자는 이해 상충이 없습니다. 저자는 텍스트 수정 및 교정을 위해 ChatGPT-4o OpenAI를 사용했음을 공개합니다.
감사의 말
이 연구의 일부가 수행된 Vanderbilt Institute of Nanoscale Science and Engineering(VINSE)에서 제공한 지원과 자원에 감사드립니다. 이 연구는 M. Zanic(R35 GM1192552)에 대한 NIH NIGMS 보조금과 M. Zanic에 대한 NSF ID 2018661 보조금을 통해 부분적으로 자금을 지원받았습니다. M. Rogers는 NIH T32 GM08320 보조금과 VINSE 파일럿 자금 지원의 지원을 받았습니다. L. Richardson은 NSF GRFP Grant No. 1937963의 지원을 받습니다. 저자는 또한 Alice Leach 박사, David Schaffer, Christina McGahan 박사 및 Zanic 연구실 전체의 도움과 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.6 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mm standard biopsy punch | Integra LifeSciences | 33-31A-P/25 | |
| 100x/1.49 numerical aperture TIRF objective | Nikon | ||
| 22 x 22 mm glass coverslips | ThorLabs | CG15CH | |
| 3" single side polished silicon wafers | University Wafer | 447 | |
| 4" Petri dish | Any brand | ||
| 450 µL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter, Inc. | 345843 | Referred to as 'airfuge tube' in the protocol |
| 488-, 561, and 640-nm solid state lasers | Nikon | ||
| A-95 Fixed-Angle Rotor | Beckman Coulter, Inc. | 347595 | |
| Acetone | Any brand | ||
| Airfuge Air-Driven Ultracentrifuge | Beckman Coulter, Inc. | 347854 | Referred to as 'airfuge' in the protocol |
| Alexa Fluor 488 Microscale Protein Labeling Kit | Thermo Fisher Scientific | A30006 | |
| Aluminum foil | Any brand | ||
| Andor iXon Ultra EM-CCD | Nikon | ||
| Andor NEO sCMOS | Nikon | ||
| AutoCAD | Autodesk | Generic versions can be used | |
| Bovine brain unlabeled tubulin (purified) | N/A | Made in house, but can be purchased | |
| Casein | MilliporeSigma | C7078 | |
| Catalase | MilliporeSigma | C9322 | |
| Clean Dry Air (CDA) (pressurized gas) | Any brand | ||
| Compressed air supply | Any brand | Connects to the microfluidic flow controller | |
| COMSOL Multiphysics software | COMSOL, Inc. | ||
| Custom brass stage adapter | N/A | Made in house to fit our 22 mm x 22 mm coverslips onto the microscope | |
| De-ionized water | Any brand | ||
| Dessicator | Any brand | ||
| D-glucose | MilliporeSigma | G7528 | |
| Dithiothreitol (DTT) | MilliporeSigma | D0632 | |
| EGTA | MilliporeSigma | 324626 | |
| Elveflow Smart Interface (ESI) software | Elveflow | ||
| Flangeless PFA fittings with ETFE ¼”-28 to 1/16” outer diameter ferrules | Darwin Microfluidics | CIL-XP-245X | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack |
| Fluiwell 4-Channel 2 mL Low Pressure | Fluigent | 14002001 | Used to connect the flow control system to the the micrewtubes. Also refered to as 'pressurized reservoir rack' |
| Fume hood | Any brand | ||
| Glucose oxidase | MilliporeSigma | G6125 | |
| GMPCPP | Jena Bioscience | NU-405L | |
| Guanosine triphosphate (GTP) | MilliporeSigma | G8877 | |
| Hot plate | Any brand | ||
| HS-625 high-speed emission filter wheel | Finger Lakes Instrumentation | ||
| ImageJ software | N/A | Open access | |
| Incubator | Any brand | ||
| Isopropyl alcohol | Any brand | ||
| Karl Suss MA-6 mask aligner | SUSS MicroTec | ||
| Magnesium chloride | MilliporeSigma | 1.05833 | |
| MATLAB software | MathWorks | ||
| MEGAPOSIT SPR 220 7.0 photoresist | Dow, Inc. | ||
| Microfluidic Fittings 6-40 to 1/4"-28 Adapters Kit | Darwin Microfluidics | LVF-KFI-08 | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack (Fluiwell rack) |
| Microfluidic Fittings Female Luer Lock Adapter Kit | Darwin Microfluidics | LVF-KFI-04 | Used to connect the syringe to the tubing |
| Microfluidic flow controller | Elveflow | OB1 MK3+ | |
| Microfluidic flow sensor | Elveflow | MFS3 | This flow sensor range is 0-80 μL |
| MICROPOSIT MF-319 developer | Dow, Inc. | ||
| Microscope | Nikon | Eclipse Ti | |
| NIS-Elements software | Nikon | ||
| Nitrogen (pressurized gas) | Any brand | ||
| Objective heater | Tokai Hit | ||
| One-Piece Fingertight 10-32 Coned Fitting for 1/16" OD Tubing | Darwin Microfluidics | CIL-F-120X | Used to connect the syringe to the tubing |
| Paclitaxol (Taxol) | Tocris Bioscience | 1097 | |
| Photolithography masks | N/A | Made by an external party using our designs | |
| PIPES | Thermo Fisher Scientific | 172615000 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Plasma flowmeter system | Harrick Plasma | PDC-FMG | Integrates with plasma cleaner to enable flow control of pressurized gas |
| Plastic bulb pipet | Any brand | ||
| Pluoronic F-127 | MilliporeSigma | P2443 | Referred to as 'poloxomer 407' in the protocol |
| Potassium chloride | Research Products International | P41000 | |
| Saint Gobain Performance Plastics Tube Tygon .020 ID | Thermo Fisher Scientific | 50-206-8921 | Refered to as '1.5 mm tubing' and 'tubing' in the protocol |
| Scalpel | Any brand | ||
| Spin coater | Cost Effective Equipment, LLC. | 200x | This model may be discontinued |
| Standard pipets and tip sets | Any brand | ||
| Standard plastic syringe | Any brand | We used a 10 mL Luer-slip syringe | |
| Sylgard 184 silicone elastomer kit | Dow, Inc. | Referred to as 'PDMS' and 'curing agent' in the protocol | |
| T339 Micrewtube with Lip Seal and Flat Screw Cap | Medline Industried, LP. | T339 | Referred to as 'source vial' in the protocol. We used both 0.5 mL and 1.5 mL sizes |
| TAMRA, SE; 5-(and-6)-Carboxytetramethylrhodamine, Succinimidyl Ester | Invitrogen | C1171 | Referred to as 'TTR' in the protocol |
| Trichloro(1H, 1H, 2H, 2H-perfluorooctyl) silane | MilliporeSigma | 448931 | |
| Trion Phantom RIE ICP | Trion Technology, Inc. | This plasma cleaner is only used in Step 1.1 of the protocol. Another plasma cleaner, like the one used for PDMS bonding, can be used instead; we just prefer the much lower vacuum achievable by this system for cleaning the silicon wafer | |
| TRITC Polyclonal Antibody | Thermo Fisher Scientific | A6397 | Referred to as 'anti-rhodamine antibody' in the protocol |
| Tweezers | Any brand | ||
| Vacuum pump | Any brand |
참고문헌
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Phys Today. 54 (6), 42(2001).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev Mod Phys. 77, 977(2005).
- Beebe, D. J., Mensing, G. A., Walker, G. M. Physics and applications of microfluidics in biology. Annu Rev Biomed Eng. 4, 261-286 (2002).
- Ng, J. M. K., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. Electrophoresis. 23 (20), 3461-3473 (2010).
- Dellaquila, A. Five Short Stories on The History of Microfluidics. , https://www.elveflow.com/microfluidic-reviews/general-microfluidics/history-of-microfluidics/ (2025).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: Microfluidics in drug discovery. Nat Rev Drug Discov. 5 (3), 210-218 (2006).
- Neužil, P., Giselbrecht, S., Länge, K., Huang, T. J., Manz, A. Revisiting lab-on-a-chip technology for drug discovery. Nat Rev Drug Discov. 11 (8), 620-632 (2012).
- Manz, A., Graber, N., Widmer, H. M. Miniaturized total chemical analysis systems: a novel concept for chemical sensing. Sens Actuators B: Chem. 1 (1-6), 244-248 (1990).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Knight, J. Microfluidics: Honey, I shrunk the lab. Nature. 418 (6897), 474-475 (2002).
- Photolithographic fabrication techniques for transistors which are an integral part of a printed circuit. Nall, J. R., Lathrop, J. W. 1957 International Electron Devices Meeting, Washington, DC, USA, , (1957).
- Rogers, M. The design and fabrication of a two-layer microfluidic device for studying microtubules in vitro [Master's Thesis]. , Vanderbilt University. Nashville, TN. (2022).
- Lee, J. B., Choi, K. H., Yoo, K. Innovative SU-8 lithography techniques and their applications. Micromachines. 6 (1), 1-18 (2015).
- Kim, P., et al. Soft lithography for microfluidics: A Review. Biochip J. 2 (1), 1-11 (2008).
- Venkatesan, S. u, Jerald, J., Asokan, P., Prabakaran, R. A Comprehensive Review on Microfluidics Technology and its Applications. Recent Advances in Mechanical Engineering. , Springer. Singapore. 235-245 (2020).
- Minteer, S. Microfluidic Techniques: Reviews and Protocols. , Humana Press. New Jersey. (2006).
- Mitra, S. K., Chakraborty, S. Microfluidics and Nanofluidics Handbook: Fabrication, Implementation, and Applications. , Taylor and Francis Group. Florida. (2016).
- Alberts, B., et al. Molecular Biology of the Cell. , Garland Science. New York. (2014).
- Howard, J. Mechanics of Motor Proteins and the Cytoskeleton. , Springer. Heidelberg. (2001).
- Hawkins, T., Mirigian, M., Selcuk Yasar, M., Ross, J. L. Mechanics of microtubules. J Biomech. 43 (1), 23-30 (2010).
- Gardel, M. L., Kasza, K. E., Brangwynne, C. P., Liu, J., Weitz, D. A. Chapter 19: Mechanical Response of Cytoskeletal Networks. Methods Cell Biol. 89, 487-519 (2008).
- Caporizzo, M. A., Prosser, B. L. The microtubule cytoskeleton in cardiac mechanics and heart failure. Nat Rev Cardiol. 19 (6), 364-378 (2022).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nat Mater. 14 (11), 1156-1163 (2015).
- Chu, S. H., et al. A microfluidic device for in situ fixation and super-resolved mechanosensation studies of primary cilia. Biomicrofluidics. 13 (1), 014105(2019).
- Geisterfer, Z. M., Zhu, D. Y., Mitchison, T. J., Oakey, J., Gatlin, J. C. Microtubule growth rates are sensitive to global and local changes in microtubule plus-end density. Curr Biol. 30 (15), 3016-3023 (2020).
- Schaedel, L., et al. Lattice defects induce microtubule self-renewal. Nat Phys. 15 (8), 830-838 (2019).
- Aher, A., et al. CLASP mediates microtubule repair by restricting lattice damage and regulating tubulin incorporation. Curr Biol. 30 (11), 2175-2183 (2020).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. ELife. 5, e13470(2016).
- Fourniol, F. J., et al. Micropattern-guided assembly of overlapping pairs of dynamic microtubules. Methods Enzymol. 540, 339-360 (2014).
- Vleugel, M., Roth, S., Groenendijk, C. F., Dogterom, M. Reconstitution of basic mitotic spindles in spherical emulsion droplets. J Vis Exp. (114), e54278(2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Mol Biol Cell. 27 (22), 3563-3573 (2016).
- VanDelinder, V., Brener, S., Bachand, G. D. Mechanisms underlying the active self-assembly of microtubule rings and spools. Biomacromolecules. 17 (3), 1048-1056 (2016).
- Roth, S., Gârlea, I. C., Vleugel, M., Mulder, B. M., Dogterom, M. Reconstitution of basic mitotic spindles in cell-like confinement. bioRxiv. , (2019).
- Xu, Z., et al. Microtubules acquire resistance from mechanical breakage through intralumenal acetylation. Science. 356 (6335), 328-332 (2017).
- Fanalista, F., et al. Shape and size control of artificial cells for bottom-up biology. ACS Nano. 13 (5), 5439-5450 (2019).
- Velve-Casquillas, G., Costa, J., Carlier-Grynkorn, F., Mayeux, A., Tran, P. T. A fast microfluidic temperature control device for studying microtubule dynamics in fission yeast. Methods Cell Biol. 97, 185-201 (2010).
- Portran, D., Schaedel, L., Xu, Z., Théry, M., Nachury, M. V. Tubulin acetylation protects long-lived microtubules against mechanical ageing. Nat Cell Biol. 19 (4), 391-398 (2017).
- Huang, Y. M., Uppalapati, M., Hancock, W. O., Jackson, T. N. Microtubule transport, concentration and alignment in enclosed microfluidic channels. Biomed Microdevices. 9 (2), 175-184 (2007).
- Uppalapati, M., Huang, Y., Shastry, S., Jackson, T. N., Hancock, W. O. Microtubule Motors in Microfluidics. Methods in Bioengineering: Microfabrication and Microfluidics. , Artech House Publishers. Boston, MA. (2009).
- Sung, J. H., Shuler, M. L. Prevention of air bubble formation in a microfluidic perfusion cell culture system using a microscale bubble trap. Biomed Microdevices. 11 (4), 731-738 (2009).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360(2019).
- Nakayama, T., et al. Circumventing air bubbles in microfluidic systems and quantitative continuous-flow PCR applications. Anal Bioanal Chem. 386 (5), 1327-1333 (2006).
- Park, S., Cho, H., Kim, J., Han, K. -H. Lateral degassing method for disposable film-chip microfluidic devices. Membranes. 11 (5), 316(2021).
- Pereiro, I., Fomitcheva Khartchenko, A., Petrini, L., Kaigala, G. V. Nip the bubble in the bud: A guide to avoid gas nucleation in microfluidics. Lab Chip. 19 (14), 2296-2314 (2019).
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biol. 95, 221-245 (2010).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: Information from a slowly hydrolyzable analogue, GMPCPP. Mol Biol Cell. 3 (10), 1155-1167 (1992).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bartlett, N. W., Wood, R. J. Comparative analysis of fabrication methods for achieving rounded microchannels in PDMS. J Micromech Microeng. 26 (11), 115013(2016).
- Yang, C. P. H., Horwitz, S. B. Taxol®: The first microtubule stabilizing agent. Int J Mol Sci. 18 (8), 1733(2017).
- Gittes, F., Mickey, B., Nettleton, J., Howard, J. Flexural rigidity of microtubules and actin filaments measured from thermal fluctuations in shape. J Cell Biol. 120 (4), 923-934 (1993).
- VanBuren, V., Cassimeris, L., Odde, D. J. Mechanochemical model of microtubule structure and self-assembly kinetics. Biophys J. 89 (5), 2911-2926 (2005).
- Dye, R. B., Fink, S. P., Williams, R. C. Taxol-induced flexibility of microtubules and its reversal by MAP-2 and Tau. J Biol Chem. 268 (10), 6847-6850 (1993).
- Drechsel, D. N., Kirschnert, M. W. The minimum GTP cap required to stabilize microtubules. Curr Biol. 4 (12), 1053-1061 (1994).
- Wisanpitayakorn, P., Mickolajczyk, K. J., Hancock, W. O., Vidali, L., Tüzel, E. Measurement of the persistence length of cytoskeletal filaments using curvature distributions. Biophys J. 121 (10), 1813-1822 (2022).
- Mickey, B., Howard, J. Rigidity of microtubules is increased by stabilizing agents. J Cell Biol. 130 (4), 909-917 (1995).
- Brangwynne, C. P., et al. Bending dynamics of fluctuating biopolymers probed by automated high-resolution filament tracking. Biophys J. 93 (1), 346-359 (2007).
- Venier, P., Maggs, A. C., Carlier, M. F., Pantaloni, D. Analysis of microtubule rigidity using hydrodynamic flow and thermal fluctuations. J Biol Chem. 269 (18), 13353-13360 (1994).
- Felgner, H., Frank, R., Schliwa, M. Flexural rigidity of microtubules measured with the use of optical tweezers. J Cell Sci. 109 (Pt 2), 509-516 (1996).
- Felgner, H., et al. Domains of neuronal microtubule-associated proteins and flexural rigidity of microtubules. J Cell Biol. 138 (5), 1067-1075 (1997).
- Nishida, K., et al. Effects of three microtubule-associated proteins (MAP2, MAP4, and Tau) on microtubules' physical properties and neurite morphology. Sci Rep. 13, 8870(2023).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Brouhard, G. J., Rice, L. M. Microtubule dynamics: An interplay of biochemistry and mechanics. Nat Rev Mol Cell Biol. 19 (7), 451-463 (2018).
- Lawrence, E. J., Chatterjee, S., Zanic, M. More is different: Reconstituting complexity in microtubule regulation. J Biol Chem. 299 (12), 105398(2023).
- Howard, J., Hyman, A. A. Dynamics and mechanics of the microtubule plus end. Nature. 422 (6933), 753-758 (2003).
- Mehidi, A., Aumeier, C. Regulation of the microtubule network; the shaft matters. Curr Opin Syst Biol. 34, 100457(2023).
- Verhey, K. J., Ohi, R. Causes, costs and consequences of kinesin motors communicating through the microtubule lattice. J Cell Sci. 136 (5), jcs260735(2023).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nat Rev Mol Cell Biol. 20 (1), 38-54 (2019).
- Théry, M., Blanchoin, L. Microtubule self-repair. Curr Opin Cell Biol. 68, 144-154 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유