Method Article
Sviluppo di un approccio basato sulla microfluidica per lo studio della meccanica dei polimeri dei microtubuli
In questo articolo
Riepilogo
Questo protocollo descrive in dettaglio la progettazione e la fabbricazione di un dispositivo microfluidico adatto per studiare la meccanica dei polimeri dei microtubuli. La sintesi di tecniche di microfabbricazione, controllo automatizzato del flusso e modellazione computazionale consente un sistema flessibile ideale per sondare il citoscheletro cellulare in vitro.
Abstract
In questo protocollo, descriviamo la progettazione e la fabbricazione di un dispositivo microfluidico sviluppato per lo studio della meccanica dei polimeri dei microtubuli. Il design utilizza i vantaggi intrinseci dei dispositivi microfluidici basati su polidimetilsilossano (PDMS) e introduce diverse caratteristiche per consentire un approccio sperimentale robusto e personalizzabile ad alto rendimento. Il dispositivo sviluppato incorpora capacità ridondanti di intrappolamento delle bolle per prevenire la comparsa di bolle d'aria dannose. Inoltre, il dispositivo si interfaccia con un sistema di controllo del flusso automatizzato per ridurre l'intervento manuale e consentire analisi ad alta produttività. Il software di simulazione commerciale viene utilizzato per sviluppare e comprendere meglio il trasporto dei fluidi utilizzando questo sistema. Infine, dimostriamo la capacità di condurre più esperimenti contemporaneamente all'interno di un singolo dispositivo facendo crescere estensioni di microtubuli con etichette fluorescenti distinte in diverse sezioni del dispositivo. Nel complesso, questo sistema di flusso microfluidico può essere utilizzato per sondare la meccanica dei polimeri dei microtubuli e fornisce miglioramenti nella progettazione sperimentale per studi in vitro più ampi sui microtubuli. La sintesi di approcci di microfabbricazione, controllo automatizzato del flusso e modellazione computazionale consente un sistema flessibile ideale per sondare il citoscheletro cellulare in vitro.
Introduzione
La microfluidica consente un controllo preciso di minuscoli volumi di fluido, spesso inferiori a un microlitro, mediante l'intricata progettazione e fabbricazione di canali di flusso del fluido 1,2. La piccola scala dei dispositivi microfluidici dà origine a fenomeni ingegneristici unici. Vale a dire, il numero di Reynolds - una misura adimensionale del rapporto tra forze inerziali e viscose nel flusso di fluidi - è piccolo, tipicamente dell'ordine di O(10) o inferiore in microfluidica, sottolineando l'importanza delle forze viscose nei dispositivi microfluidici. Inoltre, il numero di Péclet, che confronta il trasporto convettivo con quello diffusivo, mostra che il trasporto convettivo è generalmente trascurabile in microfluidica 3,4,5. Questo regime di flusso laminare guidato dalla diffusione in microfluidica è vantaggioso, in quanto supporta esperimenti paralleli su un singolo dispositivo mantenendo gradienti di fluido precisi.
La fotolitografia rimane il metodo principale per la fabbricazione di dispositivi microfluidici 6,7,8. In breve, questo processo prevede la creazione di un modello inciso "master" del progetto microfluidico (Figura 1). Viene preparato un substrato fotosensibile e una fotomaschera del design microfluidico espone selettivamente le aree di fotoresist alle radiazioni ultraviolette. I successivi metodi di incisione sviluppano il substrato, producendo un rilievo del disegno. Il polidimetilsilossano (PDMS) viene spesso colato e polimerizzato sul master. Il PDMS polimerizzato, che adotta le caratteristiche negative del design, viene quindi rimosso dal master e incollato a un vetrino coprioggetti. L'intero processo di fabbricazione richiede in genere 1-2 giorni, consentendo rapide iterazioni di progettazione e la produzione di più dispositivi. Recensioni dettagliate della litografia morbida e dei processi di microfabbricazione sono disponibili in altri riferimenti 1,2,3,10,11,12,13.
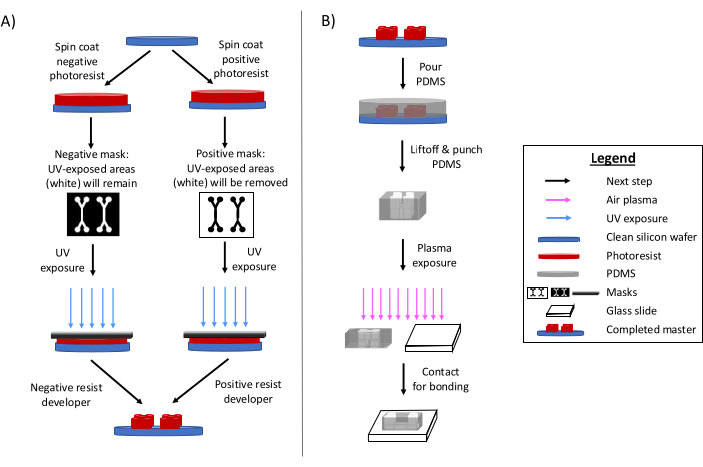
Figura 1: Cenni sul processo di fotolitografia tradizionale e sul processo di microfabbricazione. (A) Processo di fotolitografia tradizionale e (B) processo di microfabbricazione. A seconda dell'applicazione e delle caratteristiche desiderate del fotoresist, è possibile utilizzare un fotoresist negativo o positivo, anche se produrranno lo stesso master di progettazione. Caratteristiche come l'altezza desiderata o la temperatura di fusione del fotoresist aiutano a determinare il tipo di fotoresist appropriato. Questa cifra è stata modificata con il permesso di Rogers (2022)14. Clicca qui per visualizzare una versione più grande di questa figura.
L'uso della microfluidica ha ampliato le possibilità in molti campi di ricerca, con il suo impatto più recente nelle scienze biologiche. Data la sua piccola scala, la microfluidica consente la gestione precisa di risorse limitate e preziose come cellule o proteine. Ancora più incisiva è la capacità dei sistemi microfluidici di imitare le condizioni fisiologiche, come le modifiche nella rigidità del substrato, l'esercizio di forza su un campione e persino l'integrazione della corrente elettrica. Inoltre, l'uso della microfluidica offre la possibilità di manipolare più reagenti in parallelo e di prototipare rapidamente e perfezionare iterativamente i progetti di sistema. Queste caratteristiche consentono la miniaturizzazione di interi flussi di lavoro di laboratorio su un unico dispositivo, comunemente noto come "lab-on-a-chip"1,6,9,15,16,17,18,19.
Una delle applicazioni biologiche cellulari della microfluidica è lo studio dei polimeri dei microtubuli. I microtubuli sono un componente essenziale del citoscheletro della cellula, svolgendo un ruolo vitale in processi come la divisione cellulare e il trasporto intracellulare del carico20,21. Essendo l'elemento più rigido del citoscheletro, i microtubuli presentano un modulo elastico paragonabile a quello del Plexiglass22,23. Le loro robuste proprietà meccaniche sono cruciali per varie funzioni cellulari, tra cui, ad esempio, la contrazione dei cardiomiociti, dove si piegano e si rilassano ciclicamente durante le fasi sistolica e diastolicadel cuore 24. I dispositivi microfluidici sono stati precedentemente adottati per studiare le proprietà dei microtubuli e le loro strutture di ordine superiore in vitro. Infatti, la microfluidica è stata utilizzata per sondare le dinamiche di polimerizzazione dei microtubuli, le interazioni microtubuli-microtubuli e gli effetti delle proteine associate ai microtubuli sulle proprietà meccaniche dei microtubuli 25,26,27,28,29,30,31,32,33,34,35 ,36,37,38,39,40,41.
Sebbene l'introduzione della microfluidica nel campo dei microtubuli abbia portato a molte scoperte entusiasmanti, c'è ancora spazio per migliorare l'adattamento di questi dispositivi per la ricerca sui microtubuli. In questo lavoro, affrontiamo due limitazioni specifiche che persistono nello studio dei microtubuli nei dispositivi microfluidici: il potenziale di formazione di bolle d'aria all'interno del dispositivo, tipicamente introdotto dalla manipolazione manuale dei dispositivi microfluidici, e il sottoutilizzo dei saggi ad alto rendimento. Innanzitutto, le manipolazioni manuali, come l'ostruzione e lo scollegamento dei tubi, possono introdurre la formazione di bolle nei canali. La formazione di bolle d'aria all'interno di una cella a flusso è catastrofica, poiché le bolle d'aria possono denaturare le proteine, tagliare i polimeri dei microtubuli e influenzare negativamente le colture cellulari42,43. Inoltre, gli angoli acuti e gli angoli obliqui nel dispositivo provocano una bagnatura superficiale non uniforme, aumentando la possibilità di trascinamento dell'aria. Numerose tecniche sono state sviluppate per ridurre la formazione, la persistenza e l'impatto delle bolle d'aria; Tuttavia, l'uso di metodi di mitigazione delle bolle non è universale 42,43,44,45,46. Inoltre, sebbene uno dei principali vantaggi dell'utilizzo della microfluidica sia la capacità di sperimentazione ad alto rendimento, la microfluidica non è ancora stata utilizzata per aumentare la ricerca sui microtubuli. I dispositivi microfluidici possono essere progettati per testare più condizioni sperimentali in parallelo sullo stesso dispositivo. Ad esempio, i gradienti di fluido possono essere utilizzati per dirigere il flusso di diverse proteine o farmaci associati ai microtubuli, consentendo la loro somministrazione mirata a regioni specifiche di microtubuli partizionati all'interno dello stesso dispositivo.
In questo caso, abbiamo progettato in modo iterativo un dispositivo microfluidico che affronta queste limitazioni. Forniamo il protocollo passo dopo passo per la fabbricazione del dispositivo, consentendo così a un pubblico più ampio di utilizzare la tecnologia microfluidica nella ricerca sui microtubuli. Il design di questo dispositivo incorpora funzioni di intrappolamento delle bolle e utilizza un sistema di controllo del flusso automatizzato per ridurre l'intervento manuale, consentendo al contempo gradienti di soluzioni nel dispositivo per analisi ad alta produttività. In sintesi, lo sviluppo di questo design microfluidico può facilitare una ricerca e una comprensione più ampie della meccanica dei microtubuli, offrendo al contempo preziosi miglioramenti ai progetti sperimentali nel più ampio campo di ricerca sui microtubuli.
Protocollo
NOTA: Il lavoro descritto in questa parte del protocollo è stato eseguito nella camera bianca di classe 100 del Vanderbilt Institute of Nanoscale Science and Engineering (VINSE). Si desidera una camera bianca controllata con camice appropriato e illuminazione filtrata dai raggi UV per evitare danni al dispositivo dovuti a condizioni di umidità/illuminazione ambientale e per prevenire la contaminazione da particolato. Tutte le manipolazioni sui wafer di silicio devono essere eseguite con il lato lucidato del wafer di silicio rivolto verso l'alto. Utilizzare una pinzetta quando si manipolano i wafer e ridurre al minimo le superfici di contatto del wafer per evitare graffi. Conservare i wafer in piastre di Petri con i coperchi coperti durante il trasporto e alla fine di ogni giornata, se non diversamente indicato.
1. Fotolitografia (6 - 8 ore)
- Pulire al plasma un wafer di silicio da 3" per 5 minuti sotto vuoto (idealmente, la pressione del vuoto < 5 × 10-5 torr) utilizzando ossigeno (O2) o plasma di aria secca pulita (CDA).
- Centrare il wafer di silicio su uno spin coater per la deposizione del fotoresist.
- Depositare ~1-2 mL di fotoresist SPR 220 7.0 al centro del wafer di silicio.
ATTENZIONE: Maneggiare il fotoresist con guanti e protezione per gli occhi e smaltirlo secondo i protocolli specifici del produttore/del sito. - Centrifugare il fotoresist sul wafer di silicio allo spessore desiderato in base alle curve di spin del produttore. Genera strati spessi ~13 μm ruotando a 1000 giri/min per 30 s. Successivamente, pulire il fotoresist residuo sulla centrifuga con acetone e smaltirlo secondo i protocolli specifici del sito.
NOTA: Se dopo la centrifuga, il wafer non è rivestito uniformemente con fotoresist, ripetere i passaggi 1.2-1.4. Un rivestimento non uniforme potrebbe essere dovuto a un wafer non centrato sullo spin coater, all'utilizzo di una quantità insufficiente di fotoresist e/o al mancato deposito del fotoresist al centro del wafer. - Toccando il più possibile il fotoresist sul wafer, trasferire il wafer di silicio su una piastra calda impostata a 70 °C.
- Incubare il wafer di silicio sulla piastra calda, aumentando la temperatura di 10 °C ogni 3-5 minuti fino a raggiungere i 115 °C.
- Spegnere la piastra riscaldante e lasciare raffreddare il wafer di silicone fino a quando la sua temperatura non scende sotto i 65 °C.
NOTA: Le fasi di riscaldamento e raffreddamento vengono eseguite lentamente per evitare cricche termiche del fotoresist, che è comune a questo spessore. Se si verificano crepe termiche, di solito possono essere corrette riscaldando nuovamente il wafer di silicio e rallentando la velocità di raffreddamento. - Utilizzando una pinza, trasferire il wafer di silicone raffreddato in un allineatore di maschere e caricare sia il wafer di silicone che una fotomaschera corrispondente nell'allineatore di mascherina seguendo i protocolli specifici del produttore/sito.
NOTA: le fotomaschere sono state prodotte da una parte esterna utilizzando un progetto specifico, creato con AutoCAD. Vedere File supplementare 1 per il rendering del design della maschera. - Esporre il wafer di silicio alle radiazioni ultraviolette (UV) per un tempo specifico (in base alla potenza della lampada UV) seguendo i protocolli specifici del produttore/del sito. L'energia desiderata per questa applicazione è ~400 mJ/cm2 e calcolare il tempo di esposizione con la formula:
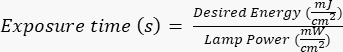 .
. - Dopo l'esposizione, rimuovere il wafer di silicone dall'allineatore della maschera e lasciare che il fotoresist si reidrati per 4 ore mediante circolazione d'aria. Assicurarsi che il coperchio della capsula di Petri sia rimasto aperto per consentire la circolazione dell'aria, ma posizionare la piastra in un'area che difficilmente sarà esposta al particolato.
NOTA: Durante questo periodo di reidratazione è possibile fare una pausa di 4 ore, ma si consiglia di continuare con la procedura lo stesso giorno. - Dopo la reidratazione di 4 ore, trasferire il wafer esposto su una piastra calda impostata a 70 °C.
- Incubare il wafer di silicio sulla piastra calda, aumentando la temperatura di 10 °C ogni 3-5 minuti fino a raggiungere i 115 °C.
- Lasciare incubare il wafer a 115 °C per 10 minuti.
- Crea una "copertura" isolante per il wafer esposto modellando un foglio di foglio di alluminio a forma di coperchio di una capsula di Petri.
- Spegnere la piastra riscaldante e coprire il wafer esposto con il coperchio in foglio di alluminio. Lasciare raffreddare il wafer a temperatura ambiente per una notte.
NOTA: Il cracking termico del fotoresist è molto più comune durante la fase di incubazione post-esposizione, motivo per cui si consiglia un raffreddamento lento durante la notte. In questo modo si completano i passaggi necessari per il primo giorno di fabbricazione. Si consiglia di procedere al tratto successivo il giorno successivo.
2. Sviluppo (1 - 2 h)
- Quando si è pronti per sviluppare il wafer esposto, procurarsi un contenitore pulito e uno sviluppatore di fotoresist appropriato. In questo caso, lo sviluppatore MF-319 viene utilizzato con un contenitore dedicato.
ATTENZIONE: Maneggiare lo sviluppatore con guanti e protezione per gli occhi, trasferire il contenitore sfuso in un contenitore secondario e smaltirlo secondo i protocolli specifici del produttore/sito. - Versare una quantità sufficiente di ossidante nel contenitore per immergere completamente il wafer esposto (il volume effettivo varia in base al contenitore).
- Immergere il wafer esposto nello sviluppatore e attendere che tutto il fotoresist indesiderato sia stato sciolto. Agitare delicatamente il contenitore aiuta lo sviluppo fino a quando il fotoresist residuo non è visibile poco o nessun fotoresist residuo sul wafer diverso dal design del dispositivo.
NOTA: potrebbero essere necessarie più modifiche della soluzione di sviluppo per rimuovere completamente il fotoresist indesiderato, a seconda del volume della soluzione di sviluppo utilizzata. - Rimuovere il wafer sviluppato dalla soluzione di sviluppo e sciacquare delicatamente entrambi i lati del wafer con acqua deionizzata (DI) per 30 s.
- Essiccare il wafer sviluppato con azoto (N2) gassoso.
- Conservare il wafer sviluppato in una capsula di Petri in un ambiente asciutto e fresco fino al momento di un ulteriore utilizzo. Avvolgere la capsula di Petri in un foglio di alluminio per evitare il degrado del fotoresist dovuto all'esposizione alla luce ambientale.
NOTA: Si consiglia, ma non è obbligatorio, di procedere al tratto successivo lo stesso giorno.
3. Silanizzazione (1 - 2 h)
- Trasferire il wafer di silicio in un essiccatore.
- Metti un piccolo contenitore di alluminio (o un pezzo di carta stagnola piegato a forma di contenitore) nell'essiccatore.
- Pipet 1 goccia (~50 μL) di tricloro(1H, 1H, 2H, 2H-perfluoroottil) silano nel contenitore di alluminio.
ATTENZIONE: Maneggiare la soluzione silana con guanti e protezione per gli occhi e smaltirla secondo i protocolli specifici del produttore/del sito. - Chiudere l'essiccatore e accendere l'aspirapolvere.
- Lasciare che l'essiccazione/silanizzazione avvenga per 1-2 ore.
- Al termine del tempo di silanizzazione, spegnere l'aspirapolvere e recuperare il wafer silanizzato. Conservare il wafer silanizzato in una capsula di Petri avvolta in un foglio di alluminio in un ambiente asciutto e fresco fino al momento di un ulteriore utilizzo.
NOTA: Potrebbe essere necessario ripetere periodicamente la silanizzazione sui wafer e più frequentemente sui dispositivi in cui vengono utilizzati strati più sottili di PDMS. Se si nota un'adesione PDMS durante la rimozione del PDMS dal wafer, potrebbe essere necessario ri-silanizzare il wafer e questa sezione deve essere ripetuta una volta che tutto il PDMS è stato rimosso dal wafer. In questo modo vengono completati i passaggi necessari per la creazione di master di dispositivi microfluidici. I master sono stabili e le sezioni successive possono essere eseguite quando lo si desidera.
4. Deposizione PDMS (1 - 2 h)
NOTA: Se sul master sono presenti PDMS residui da una precedente microfabbricazione, il PDMS residuo deve essere rimosso prima di depositare il nuovo PDMS.
- Su una bilancia, pesare in un contenitore PDMS e l'agente indurente associato in un rapporto di peso di 10:1. Il peso totale richiesto varia a seconda dello spessore PDMS desiderato e delle dimensioni della piastra di Petri. Per una piastra di Petri da 4", ~20 g di PDMS e ~2 g di agente indurente produrranno uno spessore di 2-3 mm.
ATTENZIONE: Maneggiare la soluzione PDMS con guanti e protezione per gli occhi e smaltirla secondo i protocolli specifici del produttore/sito. - Mescolare il PDMS e l'agente indurente nel contenitore per 5 minuti utilizzando una spatola di plastica o un altro strumento appropriato.
- Trasferire il contenitore PDMS miscelato in un essiccatore per il degasaggio.
- Chiudere l'essiccatore e accendere l'aspirapolvere. Le bolle d'aria inizieranno ad apparire nel PDMS.
- Lasciare che avvenga l'essiccazione/degasaggio per 30 minuti. A seconda della quantità di PDMS utilizzato e della forma del contenitore, il tempo effettivo può variare; un punto finale generale è quando nel PDMS sono presenti poche o nessuna bolla.
- Dopo il degasaggio, spegnere l'aspirapolvere e recuperare il contenitore PDMS.
- Versare il PDMS miscelato e degasato sul master in una capsula di Petri.
- Incubare il master nella capsula di Petri chiusa a 65 °C per una notte per consentire alla PDMS di polimerizzare completamente.
NOTA: In questo modo vengono completati i passaggi per la deposizione PDMS. Si consiglia di lasciare che il PDMS indurisca in un'incubatrice durante la notte. Il PDMS è quindi stabile, quindi le sezioni successive possono essere eseguite quando lo si desidera.
5. Assemblaggio del dispositivo PDMS (1 - 2 h)
- Recupera i master del dispositivo che hanno polimerizzato il PDMS, un paio di pinze, un punzone per biopsia standard da 1,5 mm con uno stantuffo manuale e un bisturi/lama di rasoio.
ATTENZIONE: Maneggiare la lama con cura e non tagliare mai verso se stessi o gli altri. Si consiglia una lama autoretrattile o di sicurezza. - Intorno alle caratteristiche del dispositivo, ritagliare pezzi rettangolari di PDMS dal layer master. Assicurarsi che ogni pezzo di PDMS abbia un po' di spazio su ciascun lato, fiancheggiando le caratteristiche del dispositivo per facilitare un buon contatto di incollaggio, assicurandosi che ogni pezzo si adatti al proprio vetrino coprioggetti da 22 mm × 22 mm.
NOTA: È importante evitare di toccare la superficie inferiore del PDMS (il lato con le caratteristiche), quindi maneggiare sempre il PDMS per i bordi utilizzando una pinzetta. Inoltre, non posizionare mai il lato della funzione del PDMS rivolto verso il basso su qualsiasi superficie. Quando non è in uso, conservare il PDMS con il lato delle funzioni rivolto verso l'alto in un contenitore chiuso fino al momento del bisogno. - Praticare i fori di ingresso e uscita nei pezzi del PDMS utilizzando un punzone pulito da 1,5 mm. Perforare il PDMS del dispositivo in uno strato di ricambio di PDMS sacrificale piuttosto che in una superficie dura che potrebbe danneggiare il perforatore.
- Recuperare e pulire un vetrino coprioggetti da 22 mm × 22 mm con una salvietta inumidita con alcol isopropilico (IPA).
- Pulire al plasma il vetrino coprioggetti da 22 mm × 22 mm per 5 minuti sotto vuoto (pressione < 0,5 Torr) utilizzando plasma CDA. Questo rimuoverà eventuali detriti o rivestimenti organici sul vetrino coprioggetti.
- Pulire il vetrino coprioggetti da 22 mm × 22 mm e il lato caratteristico del PDMS con un panno inumidito con alcool isopropilico .
- Posizionare sia il PDMS (lato della funzione rivolto verso l'alto) che il vetrino coprioggetto (lo stesso lato rivolto verso l'alto di quello pulito in precedenza) nel pulitore al plasma e pulire il plasma contemporaneamente per 30 secondi sotto vuoto (pressione < 0,5 Torr) utilizzando il plasma CDA.
- Rimuovere sia il vetrino coprioggetti che il dispositivo PDMS dal pulitore al plasma. Capovolgere il PDMS in modo che il lato della funzione sia rivolto verso il basso e posizionarlo sul vetrino coprioggetti. Osservare l'incollaggio e premere leggermente sul PDMS secondo necessità per facilitare un buon contatto.
- Incubare il vetrino coprioggetti incollato in una capsula di Petri chiusa a 65 °C per 3 minuti per facilitare il legame.
NOTA: Il legame al plasma modifica l'idrofobicità del vetrino coprioggetti, generando una superficie idrofila. È stato osservato attraverso prove aneddotiche che lo stato idrofobico originale del vetrino coprioggetti ritorna dopo circa 2 giorni di incubazione a temperatura ambiente. Si consiglia di utilizzare dispositivi fabbricati non prima di 2 giorni dopo l'incollaggio al plasma. Questo completa le fasi di microfabbricazione. I dispositivi non hanno una durata di conservazione prestabilita, ma devono essere conservati in un luogo fresco e asciutto quando non vengono utilizzati.
6. Preparazione del canale di flusso microfluidico (1 ora)
- Fissare un dispositivo microfluidico assemblato in un adattatore per tavolino personalizzato pulito47.
- Recuperare una siringa, un adattatore Lour-lock e una ghiera di raccordo e un pezzo di tubo trasparente di 1,5 mm di diametro esterno (lungo circa 15-20 cm). Collegare il tubo alla siringa tramite l'adattatore.
- Collegare altri tre pezzi di tubo alle uscite del dispositivo microfluidico (questo tubo non deve essere di una lunghezza specifica) e dirigere l'altra estremità di questi tubi in una fiala di scarico a valle.
- Utilizzando la siringa, preparare il dispositivo microfluidico introducendo le soluzioni secondo i passaggi seguenti. La sequenza e il volume delle soluzioni sono i seguenti: 50 μL di soluzione tampone BRB80, 25 μL di soluzione di anticorpi anti-rodamina, attendere 5 minuti, 50 μL di BRB80, 25 μL di poloxamer 407 (F127), attendere 15 minuti e 50 μL di BRB80. Vedere la Tabella 1 per un esempio.
- Aspirare la soluzione dalla sua fonte nel tubo.
NOTA: Non tirare la soluzione fino in fondo nella siringa stessa. La soluzione deve rimanere solo nel tubo. - Premere delicatamente sullo stantuffo della siringa fino a quando non è presente una piccola goccia di liquido all'estremità del tubo. Ciò impedirà all'aria di entrare nel dispositivo microfluidico quando il tubo è collegato.
- Collegare il tubo all'ingresso del dispositivo microfluidico.
- Premere lentamente sullo stantuffo della siringa fino a quando la maggior parte, ma non tutta, della soluzione è volata attraverso il tubo. Lasciare una piccola quantità di liquido nel tubo assicurerà che l'aria non venga inavvertitamente forzata attraverso il tubo. Osservare i tubi e i canali microfluidici durante questi trasferimenti, alla ricerca di eventuali bolle.
NOTA: Se si verificano bolle nel tubo, iniziare la risoluzione dei problemi (provare a rimuovere la bolla prima che entri nel dispositivo microfluidico scollegando il tubo appena prima dell'arrivo della bolla e quindi ricollegando il tubo dopo che la bolla è passata, ecc.). - Ripetere i passaggi 6.4.1-6.4.4 per il reagente successivo fino a quando tutti i reagenti non sono stati trasportati in aria. Sarà necessario un nuovo pezzo di tubo di ingresso per ogni reagente per evitare la contaminazione incrociata dei reagenti di origine. Una volta completato il lavaggio finale del BRB80, il dispositivo è stabile per diversi minuti. Una goccia di soluzione BRB80 sugli ingressi impedirà l'essiccazione del dispositivo.
- Aspirare la soluzione dalla sua fonte nel tubo.
- Preparare "semi" di microtubuli stabilizzati con guanosina-5'-[(α,β)-metileno]trifosfato (GMPCPP) secondo protocolli standard (con un rapporto di marcatura TTR di ~25%)47,48.
- Preparare una soluzione tampone per imaging ("antifade") a una concentrazione di lavoro 2x combinando i seguenti reagenti nelle rispettive quantità (a seconda delle concentrazioni di magazzino) per ottenere le concentrazioni finali specificate: BRB80 integrato con 40 mM di glucosio, 40 μg/mL di glucosio ossidasi, 16 μg/mL di catalasi, 0,5 mg/mL di caseina, 50 mM di cloruro di potassio e 10 mM di ditiotreitolo (DTT). Questo tampone di imaging viene utilizzato per prolungare la fotostabilità. Vedere la Tabella 2 per un esempio.
- Diluire una parte della soluzione antisbiadimento 2x 1:1 in BRB80 per ottenere una soluzione di lavoro 1x di antifade. Scaldare questo antisbiadimento a temperatura ambiente (RT); La soluzione antisbiadimento di riserva deve essere tenuta in ghiaccio.
| Ordine | Reagenti | Diluizione del volume | Volume di lavaggio | Tempo di incubazione |
| 1 | BRB80 | N/A | 50 μl | N/A |
| 2 | Anticorpo anti-rodamina | 1:50 in BRB80, mescolare bene | 25 μl | 5 minuti |
| 3 | BRB80 | N/A | 50 μl | N/A |
| 4 | Poloxamer 407 (F127) | 1% in BRB80 | 25 μl | 15 minuti |
| 5 | BRB80 | N/A | 50 μl | N/A |
Tabella 1: Ordine di preparazione dei canali del dispositivo microfluidico.
| Volume | Reagente | Concentrazione delle azioni | Concentrazione finale |
| 16 μl | D-glucosio | 2 M | 80 mM |
| 16 μl | Glucosio ossidasi | 2 mg/mL | 80 μg/mL |
| 16 μl | Catalasi | 0,8 mg/mL | 32 μg/mL |
| 14 μl | Caseina | 28 mg/mL | 0,16 mg/mL |
| 8 μl | DTT | 1 M | 20 mM |
| 40 μl | Cloruro di potassio | 1 M | 100 mM |
| 290 μl | BRB80 | 1x | N/A |
| 400 μl | FINALE (2x concentrazione di lavoro) |
Tabella 2: Ricetta della soluzione di imaging anti-dissolvenza (concentrazione 2x).
7. Introduzione dei semi dei microtubuli alla microfluidica (10 - 15 min)
- Collegare il dispositivo microfluidico al microscopio.
NOTA: Poiché la stabilità dei microtubuli dipende dalla temperatura, si raccomanda di condurre gli esperimenti di imaging a 35 °C. - Collegare 10-15 cm di nuovo tubo alla siringa e aspirare la diluizione desiderata di semi di microtubuli stabilizzati con GMPCPP nel tubo.
NOTA: Per questo dispositivo, ~10 nM di semi di microtubuli GMPCPP era la concentrazione ottimale. - Premere delicatamente sullo stantuffo della siringa fino a quando non è presente una piccola goccia di liquido all'estremità del tubo. Ciò impedirà all'aria di entrare nel dispositivo microfluidico quando il tubo è collegato.
- Collegare il tubo all'ingresso del dispositivo microfluidico.
- Premere lentamente sullo stantuffo della siringa fino a quando la maggior parte, ma non tutta, della soluzione è volata attraverso il tubo. Lasciare una piccola quantità di liquido nel tubo assicurerà che l'aria non venga inavvertitamente forzata attraverso il tubo.
- Staccare il tubo di ingresso dal dispositivo microfluidico e dalla siringa e collegare un nuovo pezzo di tubo alla siringa.
- Aspirare BRB80 nel tubo.
- Ripetere i passaggi 7.3-7.6 per lavare via i semi di microtubuli non legati dal dispositivo.
- Osservare l'attaccamento dei semi alla superficie microfluidica utilizzando la microscopia a fluorescenza a riflessione interna totale (TIRF). Il numero ideale di semi in un singolo campo visivo varia in base all'applicazione e alle dimensioni del campo visivo, ma in generale, ~10-20 semi per campo visivo di 80 μm × 80 μm sono ottimali. Ripetere i passaggi 7.2-7.9 secondo necessità fino a raggiungere la densità di semina desiderata.
NOTA: Per il monitoraggio della densità del seme dei microtubuli, è necessario utilizzare un'esposizione intermittente alla luce breve (100 ms) poiché non è ancora presente alcun antisbiadimento nella soluzione. - Una volta raggiunta la densità del seme legata appropriata, collegare un nuovo pezzo di tubo di ingresso alla siringa.
- Aspirare 1 soluzione calda antisbiadimento nel tubo e ripetere i passaggi 7.3-7.6.
NOTA: Con la soluzione anti-sbiadimento ora nel dispositivo, la fotostabilità è notevolmente migliorata e il dispositivo è stabile. Tuttavia, si consiglia comunque di ridurre al minimo l'esposizione alla luce laser.
8. Estensioni dei microtubuli in crescita dai semi (15 - 30 min)
- Combinare la tubulina marcata con fluorescenza, la tubulina non marcata, la soluzione antidissolvenza 2x, la guanosina-5'-trifosfato (GTP) e BRB80 per ottenere una soluzione finale contenente 14 μM di tubulina con un rapporto di marcatura fluorescente del 7%, antifade con una concentrazione di lavoro 1x e 1 mM GTP.
NOTA: Se si utilizzano concentrazioni diverse o percentuali di marcatura diverse di tubulina, il volume di ciascun reagente dovrà essere regolato per ottenere la concentrazione finale e il rapporto di marcatura desiderati. Tenere la soluzione di tubulina sul ghiaccio fino a ~30 s prima dell'introduzione, a quel punto, togliere la soluzione dal ghiaccio e scaldarla in mano a RT. Ciò aiuterà nella polimerizzazione delle estensioni dei microtubuli, che è un processo dipendente dalla temperatura. Infatti, la polimerizzazione dei microtubuli dovrebbe essere effettuata a 35 °C, mentre tutte le altre fasi sperimentali possono essere condotte a RT. - Collegare 10-15 cm di nuovo tubo alla siringa e aspirare la soluzione di tubulina nel tubo.
- Premere delicatamente sullo stantuffo della siringa fino a quando non è presente una piccola goccia di liquido all'estremità del tubo. Ciò impedirà all'aria di entrare nel dispositivo microfluidico quando il tubo è collegato.
- Collegare il tubo all'ingresso del dispositivo microfluidico.
- Premere lentamente sullo stantuffo della siringa fino a quando la maggior parte, ma non tutta, della soluzione è volata attraverso il tubo. Lasciare una piccola quantità di liquido nel tubo assicurerà che l'aria non venga inavvertitamente forzata attraverso il tubo. Staccare il tubo di ingresso dal dispositivo microfluidico.
- Immagine alla frequenza desiderata per 10-15 minuti o fino a quando le estensioni non sono abbastanza lunghe da piegarsi. In genere, l'imaging viene eseguito a 488 nm ogni 5 s e a 561 nm ogni 60 s fino a quando le estensioni sono lunghe almeno 5-10 μm (~15 min).
NOTA: A questa concentrazione di tubulina, i microtubuli possono passare stocasticamente tra periodi di polimerizzazione e depolimerizzazione; C'era da aspettarselo, ma nel complesso le estensioni dei microtubuli si allungherannodi 49 anni.
9. Stabilizzazione delle estensioni dei microtubuli (10-15 min)
- Combinare Taxol, 2x soluzione antidissolvenza e BRB80 per ottenere una soluzione finale contenente 10 μM di taxolo e antidissolvenza a una concentrazione di lavoro 1x.
NOTA: Mantenere la soluzione di taxolo sul ghiaccio fino a ~30 s prima dell'introduzione, a quel punto togliere la soluzione dal ghiaccio e scaldarla in mano a RT. Ciò impedirà la depolimerizzazione delle estensioni dei microtubuli, che è un processo dipendente dalla temperatura. - Collegare 10-15 cm di nuovo tubo alla siringa e aspirare la soluzione di taxolo nel tubo.
- Premere delicatamente sullo stantuffo della siringa fino a quando non è presente una piccola goccia di liquido all'estremità del tubo. Ciò impedirà all'aria di entrare nel dispositivo microfluidico quando il tubo è collegato.
- Collegare il tubo all'ingresso del dispositivo microfluidico.
- Premere sullo stantuffo della siringa fino a quando la maggior parte, ma non tutta, della soluzione è passata attraverso il tubo. Lasciare una piccola quantità di liquido nel tubo assicurerà che l'aria non venga inavvertitamente forzata attraverso il tubo.
- Ripetere i passaggi 9.2-9.5 due volte in rapida successione. In questo caso può essere utilizzato lo stesso pezzo di tubo.
NOTA: Il taxolo promuove la nucleazione de novo dei microtubuli dalla tubulina in soluzione e questi microtubuli possono atterrare sulla superficie del canale microfluidico e interferire con il successivo imaging/piegatura. Per questo motivo, la soluzione di taxolo dovrebbe fluire rapidamente attraverso il dispositivo e in più iterazioni per rimuovere la maggior quantità di tubulina libera dal dispositivo il più rapidamente possibile. - Verificare che i microtubuli cresciuti dai semi siano ancora presenti e stabilizzati nel dispositivo.
10. Estensioni dei microtubuli stabilizzate in flessione (10 - 15 min)
NOTA: Le estensioni stabilizzate dei microtubuli possono ora essere piegate utilizzando un regolatore di flusso. In questo caso, è stato utilizzato un sistema di spostamento a pressione positiva regolato (Elveflow OB1 MK3+) per far fluire la soluzione da una fiala ermetica attraverso un flussometro e nella microfluidica. A seconda delle specifiche della configurazione del regolatore di flusso disponibile, è possibile apportare modifiche ai seguenti passaggi.
- Configurare il regolatore di flusso e le apparecchiature associate secondo i protocolli specifici del produttore/sito, utilizzando un tubo per collegare la fiala di origine all'ingresso del flussometro e l'uscita del flussometro all'ingresso microfluidico, ma non collegare ancora il tubo al dispositivo microfluidico.
- Inserire ~200 μl della soluzione di taxolo da 10 μM in una fiala di origine che può essere collegata alla configurazione del regolatore di flusso. Questa configurazione utilizza connessioni Luer-lock per creare una tenuta ermetica.
- Accendere il sistema di controllo del flusso e adescare il tubo per rimuovere l'aria. Ciò impedirà all'aria di entrare nel dispositivo microfluidico quando il tubo è collegato.
- Dopo che il tubo è stato adescato attraverso il flussometro ed è presente una piccola goccia di fluido all'estremità del tubo, spegnere il sistema di controllo del flusso.
- Collegare il tubo all'ingresso del dispositivo microfluidico. Utilizzare un ingresso perpendicolare all'ingresso utilizzato per introdurre i semi dei microtubuli e far crescere le estensioni dei microtubuli in modo da piegare ortogonalmente.
- Piegare le estensioni avviando e arrestando il flusso alla portata o alla pressione desiderata. Una pressione di 30 mbar è lo standard per questo protocollo che utilizza un flusso oscillatorio con periodo di 5 s. Immagina la flessione durante questo periodo, in genere ogni 0,1 s a 488 nm e ogni 10 s a 561 nm.
NOTA: Questo completa il saggio di base di flessione dei microtubuli. Tutte le apparecchiature e i reagenti possono essere puliti/smaltiti secondo i protocolli specifici del produttore/sito.
Risultati
Razionale di progettazione del dispositivo microfluidico
La progettazione del dispositivo microfluidico in questo studio è stata guidata da diverse caratteristiche chiave (Figura 2), che costruiscono e migliorano il tradizionale design semplice della cella a flusso. Da notare che il dispositivo microfluidico ha un volume interno di ~160 nL, significativamente più piccolo del volume di ~10 μL delle celle a flusso più tradizionali47, consentendo un uso più controllato di reagenti potenzialmente preziosi, come i componenti proteici purificati. Poiché il regolatore di flusso microfluidico contiene due canali di regolazione, il dispositivo è stato sviluppato ipotizzando che solo due porte di ingresso/uscita avrebbero avuto il controllo della pressione in un dato momento. Se lo si desidera, è possibile implementare più canali a pressione controllata.
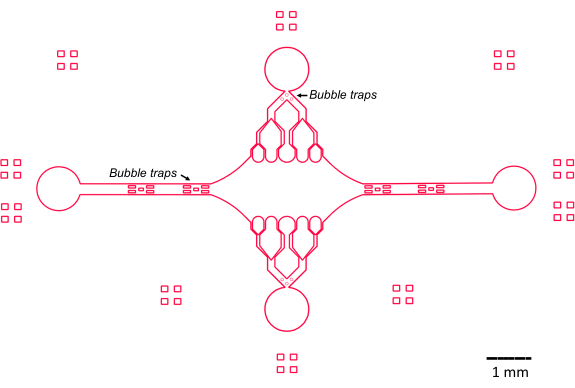
Figura 2: Schema del design del dispositivo microfluidico. I segni rettangolari sulla periferia servono per l'aiuto visivo nel vedere la periferia dei canali. Clicca qui per visualizzare una versione più grande di questa figura.
La camera centrale rettangolare del dispositivo funge da area di imaging principale in cui sono attaccati i semi dei microtubuli e le estensioni dei microtubuli vengono polimerizzate da questi semi. La camera è intersecata da un canale di flusso su ciascun lato, con canali rettilinei lungo l'asse x che fungono da ingresso e uscita per facilitare il rapido scambio della soluzione di reazione. Il canale di ingresso dei microtubuli viene utilizzato anche per introdurre i semi dei microtubuli nella camera, con flusso laminare che fa sì che il seme si leghi alla superficie di vetro lungo la direzione del flusso. Nella direzione perpendicolare (asse y), i canali di flusso si diramano in canali più piccoli verso la camera, in modo simile ad alcuni dei modelli precedenti 25,28,36,39. La geometria ramificata è particolarmente adatta per lo studio delle proprietà meccaniche dei microtubuli. Il flusso di una soluzione nella camera centrale da una direzione perpendicolare all'orientamento dei semi dei microtubuli consente di ottenere forze di flessione indotte dal flusso ad angoli quasi normali. Inoltre, l'inclusione di una geometria di ramificazione con molti canali di flusso più piccoli facilita un'applicazione della forza più omogenea su un'ampia area della camera centrale, che non si ottiene con una semplice geometria di flusso a canale singolo. In questo modo, il motivo ramificato, sebbene apparentemente più complicato, può ridurre la complessità complessiva nel determinare la forza impartita ai microtubuli (Figura 3). Questo design presenta anche più linee di simmetria, consentendo facilità d'uso e l'opportunità di valutare la flessione da diverse direzioni (ad esempio, dall'alto verso il basso).
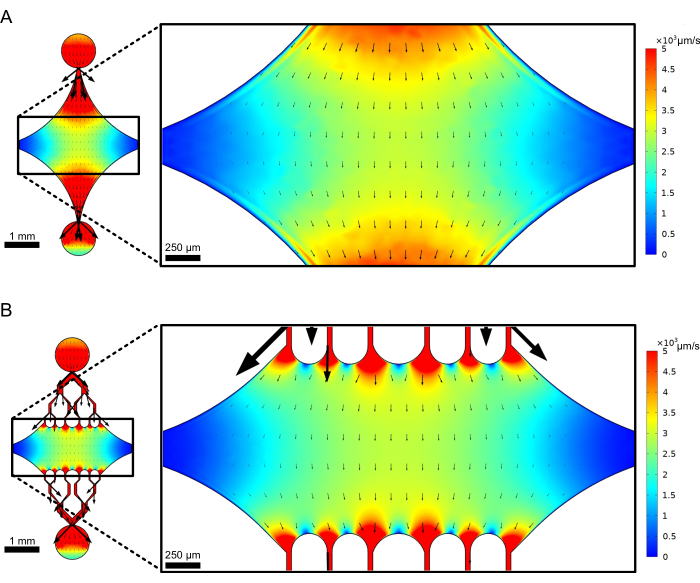
Figura 3: L'inclusione di un motivo ramificato si traduce in un'ampia area di flusso simile. Simulazioni di due progetti di dispositivi in regime di flusso stazionario: uno senza canali di diramazione (A) e uno con canali di diramazione (B). Le frecce indicano la direzione del flusso locale e sono proporzionali all'ampiezza del flusso. La colorazione della superficie denota la velocità della linea centrale. Le immagini a destra mostrano una sezione ingrandita del dispositivo in cui i microtubuli (non mostrati) orientati lungo l'asse x sarebbero soggetti a forze di flessione da un fluido che scorre nella porta superiore e fuori dalla porta inferiore. L'incorporazione di canali ramificati aumenta l'area relativa soggetta a campi di velocità simili senza aumentare il volume di reagente richiesto. Questa cifra è stata modificata con il permesso di Rogers (2022)14. Clicca qui per visualizzare una versione più grande di questa figura.
In particolare, il dispositivo implementa anche una serie di trappole per bolle nei canali di flusso di ingresso e uscita per evitare che le bolle d'aria entrino nella camera di imaging centrale. In particolare, abbiamo scelto di includere matrici di micropilastri all'interno del percorso del flusso per impedire alle bolle d'aria di passare a causa della tensione superficiale (Figura 2)46. Inoltre, per evitare il trascinamento dell'aria, abbiamo progettato i bordi all'interno del dispositivo come curve morbide, invece di avere angoli obliqui. Nel loro insieme, queste caratteristiche di progettazione riducono la possibilità di bolle d'aria e aumentano la robustezza del dispositivo.
Fabbricazione di dispositivi microfluidici
La determinazione dei parametri corretti per la creazione del master di periferica ha richiesto alcune ottimizzazioni. Come osservato in precedenza, questo fotoresist è molto sensibile ai parametri operativi chiave come l'illuminazione ambientale e le velocità di riscaldamento e raffreddamento durante le fasi50 della fotolitografia. Ad esempio, se il master è stato raffreddato troppo rapidamente dopo il riscaldamento, potrebbero svilupparsi crepe termiche nel fotoresist. Questo non è desiderabile, poiché le crepe possono compromettere l'integrità del canale. Mentre le crepe potevano essere risolte riscaldando nuovamente il resist a una temperatura vicina alla sua temperatura di transizione (~115 °C), abbiamo scoperto che consentire al master di raffreddarsi a temperatura ambiente sulla piastra calda era il modo più robusto per prevenire le crepe. Inoltre, l'eccesso di luce ambientale può provocare un'esposizione involontaria del fotoresist, indebolendo il resist e provocando la parziale rimozione delle caratteristiche del dispositivo (che dovrebbero rimanere sul wafer dopo lo sviluppo) durante la fase di sviluppo. Per questo motivo, incoraggiamo l'esecuzione della fase di sviluppo il giorno successivo alla cottura post-esposizione e alle fasi di raffreddamento notturno a temperatura ambiente. Inoltre, ogni volta che il master del dispositivo non è in uso, si consiglia di riporlo in un'area buia o avvolto in un foglio di alluminio per evitare il degrado nel tempo. Una volta determinati questi parametri, il processo di fotolitografia era altamente ripetibile (Figura 4).
Dopo la creazione del master, il PDMS liquido è stato colato sopra il master, consentendo al PDMS di polimerizzare e creare un'impronta negativa delle caratteristiche del master. Abbiamo scoperto che la fusione del PDMS a uno spessore di 2-3 mm consentiva una facile manipolazione dei dispositivi; al contrario, se rivestito in centrifuga per ottenere uno spessore nell'ordine dei μm, il PDMS era soggetto a strappi o autoaderenze, rendendo difficile la manipolazione. Inoltre, uno strato PDMS più spesso consente un più facile inserimento dei tubi, poiché i tubi rimarranno nelle porte di ingresso/uscita senza la necessità di sigillante o morsetto.
Infine, mentre i tradizionali saggi in cella a flusso per queste applicazioni biologiche utilizzano spesso vetrini coprioggetti che sono stati pre-puliti utilizzando una soluzione Piranha (perossido di idrogeno e acido solforico) e poi silanizzati, abbiamo scoperto che i vetrini coprioggetti trattati con una pulizia prolungata al plasma e un lavaggio con IPA erano adatti ai nostri scopi47. Altre applicazioni, come l'imaging a singola molecola, possono richiedere un trattamento più esteso del vetro di copertura.

Figura 4: Processo di fotolitografia. (A) La maschera con il design desiderato (maschera in cromo inciso su vetro). (B) Leggera fessurazione del fotoresist sul wafer di silicio a causa di stress termico (le frecce evidenziano alcune crepe). Queste crepe spesso si estendono su tutto il wafer. (C) Il maestro sviluppato. (D) La configurazione microfluidica al microscopio. I singoli componenti sono etichettati in verde. Clicca qui per visualizzare una versione più grande di questa figura.
Crescita, stabilizzazione e flessione dei microtubuli
I semi di microtubuli coltivati con GMPCPP fungono da siti di nucleazione per la polimerizzazione delle estensioni dei microtubuli e sono essi stessi stabili contro la depolimerizzazione per diverse ore a temperatura ambiente. I semi sono stati legati al vetrino coprioggetto nel canale microfluidico utilizzando un anticorpo anti-rodamina47. Le estensioni dinamiche dei microtubuli sono state quindi coltivate in presenza di tubulina solubile (marcata in fluorescenza ma non coniugata con rodamina) e GTP. In questo modo, i siti di nucleazione del seme sono stati attaccati al vetrino coprioggetti, ma le estensioni no. Durante il periodo di crescita dell'estensione di 15 minuti, le estensioni dei microtubuli si polimerizzavano e depolimerizzavano stocasticamente, come previsto a causa della loro intrinseca instabilità dinamica49. Dopo questo periodo di crescita, è stato effettuato un washout di 10 μM di Taxol per eliminare l'eventuale tubulina residua dalla soluzione e stabilizzare le estensioni dei microtubuli che si erano formate. La stabilizzazione è fondamentale, poiché le estensioni dei microtubuli altrimenti si depolimerizzerebbero in caso di deplezione della tubulina. Oltre a legare e stabilizzare il polimero dei microtubuli, è stato dimostrato che il Taxol influisce anche sulla meccanica dei polimeri dei microtubuli e può indurre curvatura nelle estensioni dei microtubuli altrimenti lineari 51,52,53,54. I risultati qui mostrati riflettono queste osservazioni; Tuttavia, l'arricciamento delle estensioni dei microtubuli è indesiderabile, poiché ciò si traduce in forze irregolari impartite lungo il reticolo durante la flessione. Pertanto, per l'analisi della flessione sono stati utilizzati solo i microtubuli che sono rimasti relativamente dritti dopo la stabilizzazione. In alternativa, dopo il periodo di crescita iniziale, è possibile utilizzare un periodo di crescita secondario con una soluzione di tubulina e GMPCPP (al contrario del GTP iniziale) per creare "cappucci" stabili sulle estremità di crescita del reticolo dei microtubuli e prevenire la depolimerizzazione55.
I microtubuli sono stati quindi piegati scorrendo nella soluzione tampone utilizzando il sistema di controllo della pressione per mantenere una pressione costante a monte (Figura 5, Video supplementare 1). In questo modo, abbiamo potuto approssimare il flusso locale sperimentato dai microtubuli. Facendo fluire il fluido dall'alto e dall'esterno della porta inferiore del dispositivo, l'orientamento del flusso doveva essere perpendicolare all'orientamento della semina.
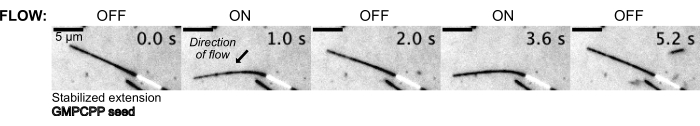
Figura 5: La configurazione microfluidica può essere utilizzata per piegare microtubuli stabilizzati. I microtubuli in uno stato di riposo dopo la stabilizzazione con paclitaxel vengono piegati durante il flusso pulsatile. Una pressione costante a monte di 30 mbar aziona il flusso (la freccia indica la direzione del flusso). Clicca qui per visualizzare una versione più grande di questa figura.
Determinazione del profilo di flusso nel dispositivo microfluidico
La velocità della linea centrale nella microfluidica può essere simulata computazionalmente utilizzando il software COMSOL (software di simulazione, Figura 6A). Tuttavia, i microtubuli sono attaccati al vetrino coprioggetti per la microscopia TIRF entro ~100 nm dalla superficie. Pertanto, la velocità sperimentata dal microtubulo non è la stessa di quella prevista nella simulazione 2D. Per approssimare il flusso locale sperimentato dai microtubuli, abbiamo utilizzato l'equazione generale di Navier-Stokes per un flusso di fluido incomprimibile in una dimensione:
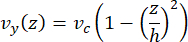
Qui, z è l'altezza dei microtubuli nel dispositivo, h è l'altezza complessiva del dispositivo e vc è la velocità della linea centrale nel dispositivo. Per definizione del sistema, l'origine z è il centro del dispositivo (Figura 6B). Utilizzando questa definizione e un'altezza del canale di 13 μm, l'altezza dei microtubuli è approssimata come z = -6,4 μm. Risolvendo questa equazione si ottiene una stima della velocità locale del fluido sperimentata dai microtubuli:

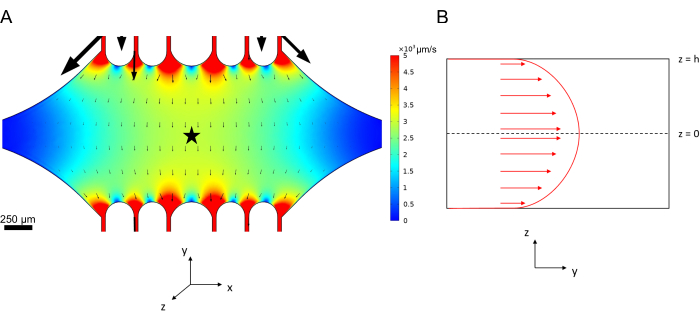
Figura 6: Definizione del sistema per l'analisi del flusso del fluido che entra nel dispositivo dalla porta superiore e ne esce dalla porta inferiore (porte non mostrate). (A) Simulazione del campo di velocità della linea centrale in scala come nella Figura 3B. La stella indica l'area di interesse per il pannello B. (B) Rappresentazione in sezione trasversale del dispositivo. Il profilo del flusso del fluido completamente sviluppato è in direzione y con una velocità centrale vc a z = 0 e una condizione al contorno di non scivolamento alle pareti. Si noti che le frecce in questo pannello non devono essere scalate rispetto al campo di velocità effettivo mostrato nel pannello A. Questa cifra è stata modificata con il permesso di Rogers (2022)14. Clicca qui per visualizzare una versione più grande di questa figura.
Oltre alle simulazioni, la velocità del fluido può essere controllata utilizzando un regolatore di flusso basato su una portata volumetrica anziché mantenere la pressione. Inoltre, la portata locale in ciascun dispositivo può essere determinata direttamente includendo sfere fluorescenti e monitorandone la velocità, alleviando così qualsiasi variabilità da campione a campione.
Modellazione computazionale e dimostrazioni del gradiente
Infine, abbiamo eseguito simulazioni computazionali in combinazione con esperimenti per dimostrare la fattibilità dell'utilizzo di questo dispositivo per esperimenti ad alto rendimento. Oltre alla capacità di piegare i microtubuli in più direzioni grazie alla simmetria del dispositivo, le simulazioni hanno dimostrato che il dispositivo è in grado di mantenere gradienti precisi, consentendo l'indagine simultanea di più condizioni sperimentali (Figura 7A). Esperimenti preliminari (metodi non esplicitamente indicati nell'ambito di questa pubblicazione) utilizzando colorante fluorescente in soluzione hanno dimostrato coerenza con le previsioni computazionali (Figura 7B). Inoltre, abbiamo dimostrato con successo il partizionamento di diverse proteine in diverse aree del dispositivo facendo crescere contemporaneamente estensioni di microtubuli con diverse etichette fluorescenti (Figura 8). Per quanto ne sappiamo, questa è la prima applicazione della microfluidica ad alto rendimento alle indagini sui microtubuli. Questa caratteristica di questo dispositivo può essere utilizzata per ridurre il tempo e le quantità di reagenti necessari, migliorando al contempo la robustezza sperimentale. Ad esempio, gli effetti di diverse proteine o concentrazioni distinte di singole proteine sulla meccanica e la dinamica dei microtubuli possono essere studiati simultaneamente e contemporaneamente in un singolo dispositivo.
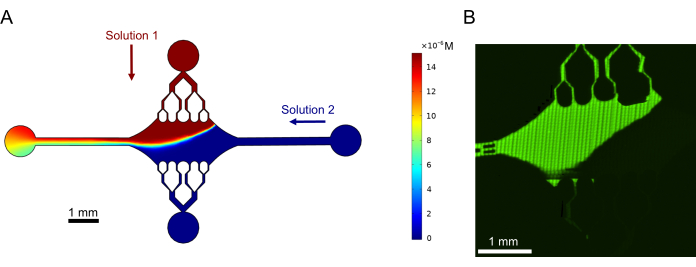
Figura 7: Formazione del gradiente. (A) Simulazione di un gradiente di due soluzioni che entrano nel dispositivo alla stessa pressione di ingresso (50 mbar) e concentrazione (15 μM). Le porte di ingresso per ciascuna soluzione sono indicate con frecce colorate (una soluzione nella porta superiore e un'altra soluzione nella porta destra) e le due porte rimanenti fungono da uscite. La mappa di calore mostra il profilo di concentrazione della soluzione superiore. Lo stato stazionario è stato raggiunto a t = 5 s. (B) Generazione sperimentale di un gradiente simile utilizzando colorante fluorescente in soluzione nella porta superiore e tampone nella porta destra. L'immagine è un livello raster creato unendo ogni campo visivo (80 μm × 80 μm) per risolvere l'intera area del dispositivo. Questa cifra è stata modificata con il permesso di Rogers (2022)14. Clicca qui per visualizzare una versione più grande di questa figura.
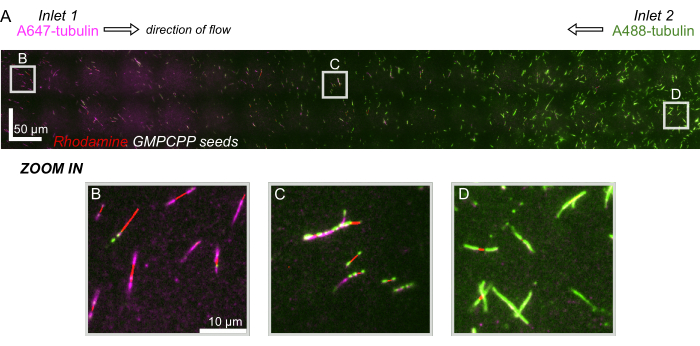
Figura 8: Dimostrazione di un gradiente proteico nel dispositivo microfluidico. La tubulina marcata con AlexaFluor647 (magenta) è stata trasportata nell'ingresso 1 e la tubulina etichettata con AlexaFluor488 (verde) è stata trasportata nell'ingresso 2 del dispositivo a concentrazioni e portate uguali. Il flusso è stato fatto oscillare on/off con incrementi di 90 s per consentire la polimerizzazione della tubulina da semi GMPCPP stabilizzati (rosso) inibendo la miscelazione. (A) Strato raster su larga scala realizzato unendo campi visivi (80x80 μm) per risolvere l'intera lunghezza del dispositivo. Le lettere indicano la posizione relativa dei singoli campi visivi nei pannelli successivi. La barra della scala è di 50 μm in posizione X e Y. (B) Campo visivo vicino all'ingresso 1 del dispositivo, dove le estensioni sono costituite prevalentemente da tubulina marcata con A647. (C) Campo visivo vicino al centro del dispositivo, dove le estensioni sono costituite da una miscela di tubuline marcate, come previsto. (D) Campo visivo vicino alla parte inferiore del dispositivo, dove le estensioni sono costituite prevalentemente da tubulina marcata con A488. Clicca qui per visualizzare una versione più grande di questa figura.
Un diagramma di flusso di processo (PFD) per la configurazione sperimentale di microfluidica su un microscopio è mostrato nella Figura 1 supplementare.
Figura 1 supplementare: Un diagramma di flusso di processo (PFD) per la configurazione sperimentale di microfluidica su un microscopio. Clicca qui per scaricare questo file.
Video supplementare 1. La configurazione microfluidica può essere utilizzata per piegare microtubuli stabilizzati. I microtubuli in uno stato di riposo dopo la stabilizzazione con paclitaxel vengono piegati durante il flusso pulsatile. Una pressione costante a monte di 30 mbar aziona il flusso. Velocità di riproduzione video 10 fps. Clicca qui per scaricare questo file.
File supplementare 1: un file CAD del progetto della maschera microfluidica. Clicca qui per scaricare questo file.
Discussione
L'obiettivo principale di questo protocollo è stato quello di progettare e fabbricare un dispositivo microfluidico adatto allo studio della meccanica dei microtubuli in vitro. Il progetto si è basato sul desiderio di utilizzare i vantaggi intrinseci dei dispositivi microfluidici basati su PDMS, includendo al contempo una combinazione di funzionalità che consentisse una sperimentazione ad alto rendimento robusta e personalizzabile.
Questo obiettivo è stato raggiunto con successo, dando vita a protocolli di fabbricazione e linee guida generali che possono servire come base per i futuri utenti di questo sistema. L'inclusione di trappole a bolle ridondanti nel dispositivo riduce la probabilità di denaturazione delle proteine a causa della presenza di bolle d'aria. Sebbene sia ancora necessario scollegare e ricollegare i tubi nel dispositivo, queste trappole a bolle riducono la probabilità di fallimento sperimentale. I futuri miglioramenti alla configurazione microfluidica potrebbero ridurre ulteriormente la quantità di manipolazioni manuali dei tubi effettuate durante un esperimento. Inoltre, l'integrazione del dispositivo microfluidico con un software di controllo del flusso automatizzato consente una significativa personalizzazione delle condizioni sperimentali, riducendo al contempo la possibilità di errore manuale. Abbiamo dimostrato le prestazioni di successo del dispositivo fabbricando il dispositivo e quindi aumentando, stabilizzando e piegando le estensioni dei microtubuli nel dispositivo utilizzando il flusso automatico regolato dal controller. Inoltre, stabilendo un gradiente di distinte soluzioni di tubulina marcate in fluorescenza all'interno dello stesso dispositivo, abbiamo dimostrato che più condizioni possono essere eseguite contemporaneamente in un singolo dispositivo. Aiutato da tecniche di modellazione e analisi computazionale, il nostro sistema può sondare e determinare le proprietà biomeccaniche dei microtubuli, come la rigidità flessionale 52,56,57,58,59.
Potenziali miglioramenti futuri faciliterebbero un sistema ancora più robusto e l'analisi sperimentale associata. In primo luogo, la deposizione, l'esposizione e la cottura dei fotoresist erano parametri cruciali che dimostravano una certa variabilità. Le dimensioni relativamente elevate del fotoresist SPR richiedevano un riscaldamento e un raffreddamento molto graduali per evitare cricche termiche, che potevano rovinare i dispositivi. Sebbene siano stati tentati dispositivi più sottili, abbiamo riscontrato problemi con la manipolazione di queste dimensioni di funzionalità più piccole. L'attenzione ai dettagli e la pazienza sono fondamentali per replicare dispositivi di questo spessore con fotoresist SPR. Per risolvere questo problema possono essere utilizzati diversi fotoresist, a seconda della disponibilità.
Nel loro insieme, il dispositivo microfluidico e il protocollo consentono una serie di configurazioni sperimentali con capacità di test più robuste e ad alto rendimento rispetto ai precedenti saggi con celle a flusso47. Inoltre, gli esperimenti possono essere automatizzati utilizzando controller di flusso per mantenere profili di flusso o gradienti di concentrazione precisi nel dispositivo, riducendo la variabilità inerente agli utenti manuali. Le potenziali applicazioni future di questa configurazione includono lo studio degli effetti delle proteine associate ai microtubuli sulla rigidità, la dinamica, il danno al reticolo e la riparazione dei microtubuli, nonché le interazioni biomeccaniche dei microtubuli e dei filamenti di actina 54,60,61,62,63,64,65,66,67,68 ,69,70. L'integrazione di tecniche di microfabbricazione, controllo automatizzato del flusso e modellazione e analisi computazionale crea un sistema versatile adatto allo studio del citoscheletro cellulare in vitro.
Divulgazioni
Gli autori non hanno conflitti di interesse. Gli autori rivelano l'uso di ChatGPT-4o OpenAI per la revisione e la correzione di bozze di testi.
Riconoscimenti
Siamo grati per il supporto e le risorse fornite dal Vanderbilt Institute of Nanoscale Science and Engineering (VINSE), dove è stata condotta una parte di questa ricerca. Questo lavoro è stato parzialmente finanziato attraverso una sovvenzione NIH NIGMS a M. Zanic (R35 GM1192552) e NSF ID 2018661 sovvenzione a M. Zanic. M. Rogers ha ricevuto il sostegno della sovvenzione NIH T32 GM08320 e un premio di finanziamento pilota VINSE. L. Richardson è sostenuto dalla sovvenzione NSF GRFP n. 1937963. Gli autori desiderano anche ringraziare la Dott.ssa Alice Leach, David Schaffer, la Dott.ssa Christina McGahan e l'intero laboratorio Zanic per la loro assistenza e supporto.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.6 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mL microcentrifuge tubes (clear) | Any brand | Low retention type is preferred | |
| 1.5 mm standard biopsy punch | Integra LifeSciences | 33-31A-P/25 | |
| 100x/1.49 numerical aperture TIRF objective | Nikon | ||
| 22 x 22 mm glass coverslips | ThorLabs | CG15CH | |
| 3" single side polished silicon wafers | University Wafer | 447 | |
| 4" Petri dish | Any brand | ||
| 450 µL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter, Inc. | 345843 | Referred to as 'airfuge tube' in the protocol |
| 488-, 561, and 640-nm solid state lasers | Nikon | ||
| A-95 Fixed-Angle Rotor | Beckman Coulter, Inc. | 347595 | |
| Acetone | Any brand | ||
| Airfuge Air-Driven Ultracentrifuge | Beckman Coulter, Inc. | 347854 | Referred to as 'airfuge' in the protocol |
| Alexa Fluor 488 Microscale Protein Labeling Kit | Thermo Fisher Scientific | A30006 | |
| Aluminum foil | Any brand | ||
| Andor iXon Ultra EM-CCD | Nikon | ||
| Andor NEO sCMOS | Nikon | ||
| AutoCAD | Autodesk | Generic versions can be used | |
| Bovine brain unlabeled tubulin (purified) | N/A | Made in house, but can be purchased | |
| Casein | MilliporeSigma | C7078 | |
| Catalase | MilliporeSigma | C9322 | |
| Clean Dry Air (CDA) (pressurized gas) | Any brand | ||
| Compressed air supply | Any brand | Connects to the microfluidic flow controller | |
| COMSOL Multiphysics software | COMSOL, Inc. | ||
| Custom brass stage adapter | N/A | Made in house to fit our 22 mm x 22 mm coverslips onto the microscope | |
| De-ionized water | Any brand | ||
| Dessicator | Any brand | ||
| D-glucose | MilliporeSigma | G7528 | |
| Dithiothreitol (DTT) | MilliporeSigma | D0632 | |
| EGTA | MilliporeSigma | 324626 | |
| Elveflow Smart Interface (ESI) software | Elveflow | ||
| Flangeless PFA fittings with ETFE ¼”-28 to 1/16” outer diameter ferrules | Darwin Microfluidics | CIL-XP-245X | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack |
| Fluiwell 4-Channel 2 mL Low Pressure | Fluigent | 14002001 | Used to connect the flow control system to the the micrewtubes. Also refered to as 'pressurized reservoir rack' |
| Fume hood | Any brand | ||
| Glucose oxidase | MilliporeSigma | G6125 | |
| GMPCPP | Jena Bioscience | NU-405L | |
| Guanosine triphosphate (GTP) | MilliporeSigma | G8877 | |
| Hot plate | Any brand | ||
| HS-625 high-speed emission filter wheel | Finger Lakes Instrumentation | ||
| ImageJ software | N/A | Open access | |
| Incubator | Any brand | ||
| Isopropyl alcohol | Any brand | ||
| Karl Suss MA-6 mask aligner | SUSS MicroTec | ||
| Magnesium chloride | MilliporeSigma | 1.05833 | |
| MATLAB software | MathWorks | ||
| MEGAPOSIT SPR 220 7.0 photoresist | Dow, Inc. | ||
| Microfluidic Fittings 6-40 to 1/4"-28 Adapters Kit | Darwin Microfluidics | LVF-KFI-08 | Used to connect the tubing from the micrewtube source vials to the flow sensor via the pressurized reservoir rack (Fluiwell rack) |
| Microfluidic Fittings Female Luer Lock Adapter Kit | Darwin Microfluidics | LVF-KFI-04 | Used to connect the syringe to the tubing |
| Microfluidic flow controller | Elveflow | OB1 MK3+ | |
| Microfluidic flow sensor | Elveflow | MFS3 | This flow sensor range is 0-80 μL |
| MICROPOSIT MF-319 developer | Dow, Inc. | ||
| Microscope | Nikon | Eclipse Ti | |
| NIS-Elements software | Nikon | ||
| Nitrogen (pressurized gas) | Any brand | ||
| Objective heater | Tokai Hit | ||
| One-Piece Fingertight 10-32 Coned Fitting for 1/16" OD Tubing | Darwin Microfluidics | CIL-F-120X | Used to connect the syringe to the tubing |
| Paclitaxol (Taxol) | Tocris Bioscience | 1097 | |
| Photolithography masks | N/A | Made by an external party using our designs | |
| PIPES | Thermo Fisher Scientific | 172615000 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Plasma flowmeter system | Harrick Plasma | PDC-FMG | Integrates with plasma cleaner to enable flow control of pressurized gas |
| Plastic bulb pipet | Any brand | ||
| Pluoronic F-127 | MilliporeSigma | P2443 | Referred to as 'poloxomer 407' in the protocol |
| Potassium chloride | Research Products International | P41000 | |
| Saint Gobain Performance Plastics Tube Tygon .020 ID | Thermo Fisher Scientific | 50-206-8921 | Refered to as '1.5 mm tubing' and 'tubing' in the protocol |
| Scalpel | Any brand | ||
| Spin coater | Cost Effective Equipment, LLC. | 200x | This model may be discontinued |
| Standard pipets and tip sets | Any brand | ||
| Standard plastic syringe | Any brand | We used a 10 mL Luer-slip syringe | |
| Sylgard 184 silicone elastomer kit | Dow, Inc. | Referred to as 'PDMS' and 'curing agent' in the protocol | |
| T339 Micrewtube with Lip Seal and Flat Screw Cap | Medline Industried, LP. | T339 | Referred to as 'source vial' in the protocol. We used both 0.5 mL and 1.5 mL sizes |
| TAMRA, SE; 5-(and-6)-Carboxytetramethylrhodamine, Succinimidyl Ester | Invitrogen | C1171 | Referred to as 'TTR' in the protocol |
| Trichloro(1H, 1H, 2H, 2H-perfluorooctyl) silane | MilliporeSigma | 448931 | |
| Trion Phantom RIE ICP | Trion Technology, Inc. | This plasma cleaner is only used in Step 1.1 of the protocol. Another plasma cleaner, like the one used for PDMS bonding, can be used instead; we just prefer the much lower vacuum achievable by this system for cleaning the silicon wafer | |
| TRITC Polyclonal Antibody | Thermo Fisher Scientific | A6397 | Referred to as 'anti-rhodamine antibody' in the protocol |
| Tweezers | Any brand | ||
| Vacuum pump | Any brand |
Riferimenti
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Phys Today. 54 (6), 42(2001).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev Mod Phys. 77, 977(2005).
- Beebe, D. J., Mensing, G. A., Walker, G. M. Physics and applications of microfluidics in biology. Annu Rev Biomed Eng. 4, 261-286 (2002).
- Ng, J. M. K., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. Electrophoresis. 23 (20), 3461-3473 (2010).
- Dellaquila, A. Five Short Stories on The History of Microfluidics. , https://www.elveflow.com/microfluidic-reviews/general-microfluidics/history-of-microfluidics/ (2025).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: Microfluidics in drug discovery. Nat Rev Drug Discov. 5 (3), 210-218 (2006).
- Neužil, P., Giselbrecht, S., Länge, K., Huang, T. J., Manz, A. Revisiting lab-on-a-chip technology for drug discovery. Nat Rev Drug Discov. 11 (8), 620-632 (2012).
- Manz, A., Graber, N., Widmer, H. M. Miniaturized total chemical analysis systems: a novel concept for chemical sensing. Sens Actuators B: Chem. 1 (1-6), 244-248 (1990).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Knight, J. Microfluidics: Honey, I shrunk the lab. Nature. 418 (6897), 474-475 (2002).
- Photolithographic fabrication techniques for transistors which are an integral part of a printed circuit. Nall, J. R., Lathrop, J. W. 1957 International Electron Devices Meeting, Washington, DC, USA, , (1957).
- Rogers, M. The design and fabrication of a two-layer microfluidic device for studying microtubules in vitro [Master's Thesis]. , Vanderbilt University. Nashville, TN. (2022).
- Lee, J. B., Choi, K. H., Yoo, K. Innovative SU-8 lithography techniques and their applications. Micromachines. 6 (1), 1-18 (2015).
- Kim, P., et al. Soft lithography for microfluidics: A Review. Biochip J. 2 (1), 1-11 (2008).
- Venkatesan, S. u, Jerald, J., Asokan, P., Prabakaran, R. A Comprehensive Review on Microfluidics Technology and its Applications. Recent Advances in Mechanical Engineering. , Springer. Singapore. 235-245 (2020).
- Minteer, S. Microfluidic Techniques: Reviews and Protocols. , Humana Press. New Jersey. (2006).
- Mitra, S. K., Chakraborty, S. Microfluidics and Nanofluidics Handbook: Fabrication, Implementation, and Applications. , Taylor and Francis Group. Florida. (2016).
- Alberts, B., et al. Molecular Biology of the Cell. , Garland Science. New York. (2014).
- Howard, J. Mechanics of Motor Proteins and the Cytoskeleton. , Springer. Heidelberg. (2001).
- Hawkins, T., Mirigian, M., Selcuk Yasar, M., Ross, J. L. Mechanics of microtubules. J Biomech. 43 (1), 23-30 (2010).
- Gardel, M. L., Kasza, K. E., Brangwynne, C. P., Liu, J., Weitz, D. A. Chapter 19: Mechanical Response of Cytoskeletal Networks. Methods Cell Biol. 89, 487-519 (2008).
- Caporizzo, M. A., Prosser, B. L. The microtubule cytoskeleton in cardiac mechanics and heart failure. Nat Rev Cardiol. 19 (6), 364-378 (2022).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nat Mater. 14 (11), 1156-1163 (2015).
- Chu, S. H., et al. A microfluidic device for in situ fixation and super-resolved mechanosensation studies of primary cilia. Biomicrofluidics. 13 (1), 014105(2019).
- Geisterfer, Z. M., Zhu, D. Y., Mitchison, T. J., Oakey, J., Gatlin, J. C. Microtubule growth rates are sensitive to global and local changes in microtubule plus-end density. Curr Biol. 30 (15), 3016-3023 (2020).
- Schaedel, L., et al. Lattice defects induce microtubule self-renewal. Nat Phys. 15 (8), 830-838 (2019).
- Aher, A., et al. CLASP mediates microtubule repair by restricting lattice damage and regulating tubulin incorporation. Curr Biol. 30 (11), 2175-2183 (2020).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. ELife. 5, e13470(2016).
- Fourniol, F. J., et al. Micropattern-guided assembly of overlapping pairs of dynamic microtubules. Methods Enzymol. 540, 339-360 (2014).
- Vleugel, M., Roth, S., Groenendijk, C. F., Dogterom, M. Reconstitution of basic mitotic spindles in spherical emulsion droplets. J Vis Exp. (114), e54278(2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Mol Biol Cell. 27 (22), 3563-3573 (2016).
- VanDelinder, V., Brener, S., Bachand, G. D. Mechanisms underlying the active self-assembly of microtubule rings and spools. Biomacromolecules. 17 (3), 1048-1056 (2016).
- Roth, S., Gârlea, I. C., Vleugel, M., Mulder, B. M., Dogterom, M. Reconstitution of basic mitotic spindles in cell-like confinement. bioRxiv. , (2019).
- Xu, Z., et al. Microtubules acquire resistance from mechanical breakage through intralumenal acetylation. Science. 356 (6335), 328-332 (2017).
- Fanalista, F., et al. Shape and size control of artificial cells for bottom-up biology. ACS Nano. 13 (5), 5439-5450 (2019).
- Velve-Casquillas, G., Costa, J., Carlier-Grynkorn, F., Mayeux, A., Tran, P. T. A fast microfluidic temperature control device for studying microtubule dynamics in fission yeast. Methods Cell Biol. 97, 185-201 (2010).
- Portran, D., Schaedel, L., Xu, Z., Théry, M., Nachury, M. V. Tubulin acetylation protects long-lived microtubules against mechanical ageing. Nat Cell Biol. 19 (4), 391-398 (2017).
- Huang, Y. M., Uppalapati, M., Hancock, W. O., Jackson, T. N. Microtubule transport, concentration and alignment in enclosed microfluidic channels. Biomed Microdevices. 9 (2), 175-184 (2007).
- Uppalapati, M., Huang, Y., Shastry, S., Jackson, T. N., Hancock, W. O. Microtubule Motors in Microfluidics. Methods in Bioengineering: Microfabrication and Microfluidics. , Artech House Publishers. Boston, MA. (2009).
- Sung, J. H., Shuler, M. L. Prevention of air bubble formation in a microfluidic perfusion cell culture system using a microscale bubble trap. Biomed Microdevices. 11 (4), 731-738 (2009).
- Williams, M. J., et al. A low-cost, rapidly integrated debubbler (RID) module for microfluidic cell culture applications. Micromachines. 10 (6), 360(2019).
- Nakayama, T., et al. Circumventing air bubbles in microfluidic systems and quantitative continuous-flow PCR applications. Anal Bioanal Chem. 386 (5), 1327-1333 (2006).
- Park, S., Cho, H., Kim, J., Han, K. -H. Lateral degassing method for disposable film-chip microfluidic devices. Membranes. 11 (5), 316(2021).
- Pereiro, I., Fomitcheva Khartchenko, A., Petrini, L., Kaigala, G. V. Nip the bubble in the bud: A guide to avoid gas nucleation in microfluidics. Lab Chip. 19 (14), 2296-2314 (2019).
- Gell, C., et al. Microtubule dynamics reconstituted in vitro and imaged by single-molecule fluorescence microscopy. Methods in Cell Biol. 95, 221-245 (2010).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: Information from a slowly hydrolyzable analogue, GMPCPP. Mol Biol Cell. 3 (10), 1155-1167 (1992).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bartlett, N. W., Wood, R. J. Comparative analysis of fabrication methods for achieving rounded microchannels in PDMS. J Micromech Microeng. 26 (11), 115013(2016).
- Yang, C. P. H., Horwitz, S. B. Taxol®: The first microtubule stabilizing agent. Int J Mol Sci. 18 (8), 1733(2017).
- Gittes, F., Mickey, B., Nettleton, J., Howard, J. Flexural rigidity of microtubules and actin filaments measured from thermal fluctuations in shape. J Cell Biol. 120 (4), 923-934 (1993).
- VanBuren, V., Cassimeris, L., Odde, D. J. Mechanochemical model of microtubule structure and self-assembly kinetics. Biophys J. 89 (5), 2911-2926 (2005).
- Dye, R. B., Fink, S. P., Williams, R. C. Taxol-induced flexibility of microtubules and its reversal by MAP-2 and Tau. J Biol Chem. 268 (10), 6847-6850 (1993).
- Drechsel, D. N., Kirschnert, M. W. The minimum GTP cap required to stabilize microtubules. Curr Biol. 4 (12), 1053-1061 (1994).
- Wisanpitayakorn, P., Mickolajczyk, K. J., Hancock, W. O., Vidali, L., Tüzel, E. Measurement of the persistence length of cytoskeletal filaments using curvature distributions. Biophys J. 121 (10), 1813-1822 (2022).
- Mickey, B., Howard, J. Rigidity of microtubules is increased by stabilizing agents. J Cell Biol. 130 (4), 909-917 (1995).
- Brangwynne, C. P., et al. Bending dynamics of fluctuating biopolymers probed by automated high-resolution filament tracking. Biophys J. 93 (1), 346-359 (2007).
- Venier, P., Maggs, A. C., Carlier, M. F., Pantaloni, D. Analysis of microtubule rigidity using hydrodynamic flow and thermal fluctuations. J Biol Chem. 269 (18), 13353-13360 (1994).
- Felgner, H., Frank, R., Schliwa, M. Flexural rigidity of microtubules measured with the use of optical tweezers. J Cell Sci. 109 (Pt 2), 509-516 (1996).
- Felgner, H., et al. Domains of neuronal microtubule-associated proteins and flexural rigidity of microtubules. J Cell Biol. 138 (5), 1067-1075 (1997).
- Nishida, K., et al. Effects of three microtubule-associated proteins (MAP2, MAP4, and Tau) on microtubules' physical properties and neurite morphology. Sci Rep. 13, 8870(2023).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Brouhard, G. J., Rice, L. M. Microtubule dynamics: An interplay of biochemistry and mechanics. Nat Rev Mol Cell Biol. 19 (7), 451-463 (2018).
- Lawrence, E. J., Chatterjee, S., Zanic, M. More is different: Reconstituting complexity in microtubule regulation. J Biol Chem. 299 (12), 105398(2023).
- Howard, J., Hyman, A. A. Dynamics and mechanics of the microtubule plus end. Nature. 422 (6933), 753-758 (2003).
- Mehidi, A., Aumeier, C. Regulation of the microtubule network; the shaft matters. Curr Opin Syst Biol. 34, 100457(2023).
- Verhey, K. J., Ohi, R. Causes, costs and consequences of kinesin motors communicating through the microtubule lattice. J Cell Sci. 136 (5), jcs260735(2023).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nat Rev Mol Cell Biol. 20 (1), 38-54 (2019).
- Théry, M., Blanchoin, L. Microtubule self-repair. Curr Opin Cell Biol. 68, 144-154 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon