Method Article
再生的成年斑马鱼尾鳍在吗啉代入体内电穿孔
摘要
我们描述了一个方法,有条件击倒目标蛋白的表达,在成年斑马鱼的鳍再生。这项技术涉及微注射和反义寡核苷酸进入鳍组织,它允许测试鳍再生,伤口愈合,芽基形成和再生产物,包括在不同阶段的蛋白质的作用吗啉代电穿孔。
摘要
某些物种的有尾类和硬骨鱼可以再生自己的组织。斑马鱼已成为一种广泛使用的模型来研究成人的心脏,视网膜,脊髓3,视神经4,感觉毛细胞,鳍6,组织,如自发再生。
斑马鱼的鳍是一种相对简单的附属物,很容易被操纵到研究在epimorphic再生多个阶段。经典,鳍再生的特点是由三个不同的阶段:创面愈合,芽基形成,和鳍的产物。后截去鱼翅的一部分,周围的上皮细胞增殖和迁移的伤口。在33°C时,此过程中发生截肢后的六小时内(HPA, 图1B)6,7。其次,从不同的谱系(如骨骼,血液,神经胶质细胞,成纤维细胞)的基本细胞重新进入细胞周期,以形成一个增殖芽,W类型改为覆表皮细胞继续增殖( 图1D)8。生长发生的胚细胞近端重新纳入各自的谱系分化形成新的组织( 图1E)8。根据截肢的水平,充分再生完成后,在一个星期到一个月。
大量的基因家族,包括WNT,Hox基因,FGF,MSX,维甲酸,SHH,缺口,BMP,和激活素-β的一个基因,表达上调的鳍再生9-16期间的特定阶段。然而,这些基因编码的蛋白质和再生过程中的角色已经难以评估,除非特定蛋白质抑制剂存在13,温度敏感突变体的存在,或转基因动物(无论是过度的野生型蛋白或占主导地位负蛋白)产生的7,12。我们develoPED反向遗传技术,快速,方便地测试鳍再生过程中的任何基因的功能。
吗啉代寡核苷酸被广泛用于研究斑马鱼, 爪蟾 ,鸡,和鼠标的发展17-19期间的特定蛋白质的损失。吗啉代碱基互补的RNA序列,要么块前体mRNA剪接或mRNA的翻译。我们描述了一种方法,能够有效地引入到斑马鱼鳍再生击倒的目标蛋白表达的荧光标记的反义吗啉代。吗啉是微注射到每个芽再生斑马鱼尾鳍,并把周围的细胞电穿孔。荧光提供负责electroporate啉和形象化吗啉在翅片组织的。
该协议允许有条件的蛋白质击倒审查再生鳍生长过程中的特定蛋白质的作用。在探讨TheN,我们描述了这种方法可以如何适应研究特定蛋白质的作用,在伤口愈合或原基形成,以及胚形成过程中的细胞迁移的潜在标记。
研究方案
1。重悬吗啉
- 到100μL无核酸酶水稀释300纳米荧光标记啉,使约3毫米的解决方案。吗啉溶液分装成多个石蜡密封离心管中,并在室温和避光储存。
- 以确定确切的吗啉浓度,稀释在95μL的0.1 N的盐酸吗啉溶液5μL(或水)作为空白。设置上与水的空白,在265 nm的分光光度计基线,然后确定稀释的吗啉溶液的读数。待定常数乘以稀释倍数啉吸收,以确定在ng /μl的浓度。啉常数的计算公式为:
吗啉常数=啉X 1000/molar吸收的分子量。
吗啉的分子量和摩尔吸光可以发现"寡属性"表提供的产品。除以啉浓度,ng /μl的分子量确定以毫米为单位的浓度,稀释吗啉,如有必要,工作浓度,一般为1.2毫米。
2。鳍截肢
- 麻醉成年斑马鱼在,要么Tricaine或2 - 苯氧乙醇在1.0毫克/毫升水箱。
- 使用无菌手术刀或刀片第一lepidotrichial分支点近端截肢的鳍。这项工作应在相同的近端/远端对每个动物的位置(例如7鳍腰带从远端的骨段)。要点:确保削减完美动物的前/后平面垂直。角度的削减将导致不平衡鳍的鳍背,腹部分生长。
- 鱼坦克。我们通常鱼保持在33°C到提高再生率。根据实验设计,WAIT 0-2天截肢后翅再生(DPA)开始前引进的吗啉。替代方法在下面的讨论,讨论。
3。吗啉注射液
- 前一天注射吗啉,使注塑板( 图2)。确保切出一个缺口,在一端的好,这有助于稳定的显微注射过程中的鱼。
- 2 DPA,准备微注射器具及吗啉的解决方案。
- 稀释的荧光标记啉适当浓度(推荐1.2毫米起)和地方在65℃水浴5分钟。
- 使用微量注射一针拔拉玻璃针。
- 加载啉针(注:无论你回来填充或前加载你的针,将决定你是否加载第一针,或削减尖端而定)。
- 在削减了针的尖端ñ角。
- 按照您的微喷射系统的方向,注入约5 NL啉的泡沫,每次注射。啉量较大,可能会破坏组织。
- 麻醉注射板鱼和地方。删除所有多余的液体和东方的针到适当的位置,只是远端骨线( 图3)。使用显微镜和显微注射仪适合吗啉注射液(见表的特定试剂),由前至后翅注入吗啉, 如图3所示。从后至前注射会导致鳍组织在注射推出,是非常困难的。
- 针轻轻插入到再生的组织,只是远端每个骨射线(标有"1",在图3)和远端推,直到位于胚(标有"2",在图3)。要小心,不要推针通过EN轮胎的鳍。当针正确定位,注入吗啉(即点击一次)。在1.2毫米,出现荧光标记的吗啉溶液的黄绿色,即使在正常光线条件下。每次注射,一个黄色的"噗"吗啉溶液可以可视化,这有助于本地化注射到胚。约75 NL(10-15点击)吗啉溶液应注射每骨射线。暂停〜1秒之间人次。我们只注入背侧,使用电,只有控制腹。另外,可以重复使用这一整个过程控制啉翅腹面的一半。
4。电,对吗啉
- 紧随注射吗啉,从微注射器具注射板。填写麻醉液注射板鱼,直到被淹没。水位线下的电。 <李> 3毫米直径的铂金板钳电极(CUY 650-P3镊子,保得国际)定位脉冲约一个半翅。小心不要触摸电极鳍组织。为了确保电极不接触鳍组织,在其背侧旋转的鱼和直视下电中线。
- Electroporate都背,腹(控制一个非特定的电效应)使用1 CUY21广场,波Electroporator(保得国际公司)双方的鳍。擦拭后,每个电潮湿KimWipe,以消除任何可能形成的泡沫电极。如果他们不删除,迷你负责建立,这将吸引组织向电极。应设置连续十50毫秒脉冲的电参数,在15至五1秒脉冲之间的停顿。
- 将玻片或培养皿和快速的图像鳍鱼,确保到n大手,背/腹方向。翌日,该图像将被用于再生分析。鱼返回到坦克。
5。分析
- 如果目标蛋白表达下调被撞倒在适当的鳍再生,显着的差异之间的鳍背,腹部分应该是很明显的后1天,电( 图5B)。
- 在3 DPA,另取每条鱼的鳍的图片,并匹配相应的2 DPA( 图5B)这个图片。在动物之间的鳍色素沉着模式的自然变化将使你正确识别个别鱼。
- 使用NIH图像,追踪2的背部和腹部的一半( 图5B)政治部和3 DPA领域。
- 要确定面积背侧与腹侧使用下列公式:%(背3dpa -背2dpa的 )/(腹3dpa -腹侧2dpa)×100 =%面积
6。代表结果
- 我们始终检测鳍生长在3 DPA,或24 HPE(小时后电)。荧光标记的吗啉在这个时候,应该在目前的鳍背一半( 参考图1和图6A)。看到一些尾随截肢的水平,这是正常的。
- 与控制吗啉代( 图6B)注射和电穿孔的鳍背,腹两侧之间不应该有差异。
- 如果实验啉目标鳍生长必需的蛋白质,背侧和腹侧双方之间的巨大差异,应遵守( 图6C)。
- 如果电极在电鳍感动,该组织将出现褐色(在外观上几乎烧毁)和坏死。
"SRC ="/ files/ftp_upload/3632/3632fig1.jpg"/>
图1。鳍再生过程中发生的各种事件的示意图。每个事件的相关时间以小时后截肢(HPA)和对应的水箱温度33°C。
图2。注塑板,这是由琼脂糖和包含一个小以及期间举行的注射吗啉鱼的示意图。
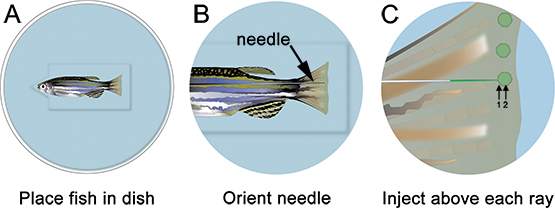
图3。鱼菜头鱼在缺口啉显微注射示意图。A.将切出井,这将有助于鱼保持稳定。B.在低倍率,安排针,使靠近鳍的再生组织。 在更高的放大倍率,注入啉远端各骨的鳍条(即在每个芽)。针应该进入只是远端骨射线(1),组织,然后继续胚(2)的位置。注:在原理图中的绿色圆圈,只是为了显示注射的位置。吗啉绿色/黄色"噗",每次注射后,可以简单的可视化;然而,这并不存在,如示意图所示。
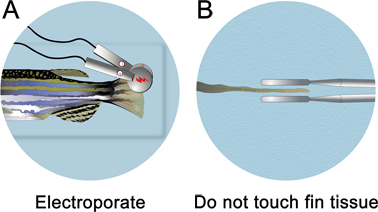
图4。鳍电原理图。A.显微注射后,放置在培养皿全麻醉的鱼和electroporate背,腹部分。确保不碰鱼翅组织。电极应放在〜1毫米的组织。
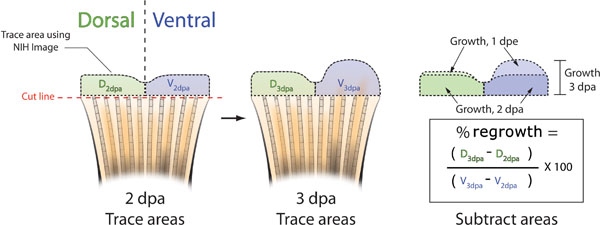
。A.以政治部,无论之前或之后立即啉注射和电鳍鱼的每个图片。跟踪背(绿色)和腹侧(蓝色),NIH图像(黑色虚线)B.使用3 DPA鳍半再生组织,采取其他各鳍的图片,并再次追踪的背,腹地区再生利用NIH图像。减去2 DPA在3 DPA对于背部和腹部的富人总再生的再生领域。 %背侧与腹侧重新生长面积,可以计算公式:((四3dpa - D 2 DPA)/(五3dpa - 2dpa至五))×100。百分之抑制= 100 - %的面积。
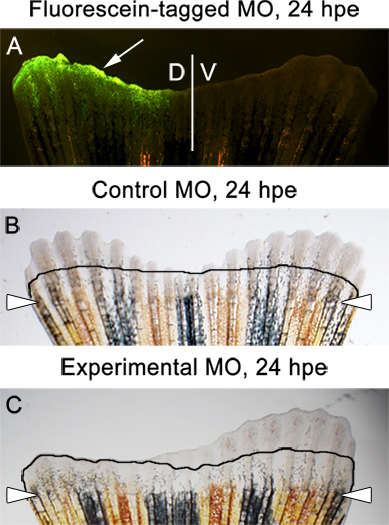
预计图6。结果。A.控制啉荧光素标记的荧光图像显示在鳍背一半,24小时后电(HPE)。明视图像的注射与控制啉电穿孔的鳍背半。图像显示的背部和腹部的鳍,24 HPE半等于再生。背半的实验吗啉,注射和电穿孔翅片C.明视的形象。图像显示背/注射侧抑制再生。行显示的金额在2 DPA,紧接啉注射和电再生。
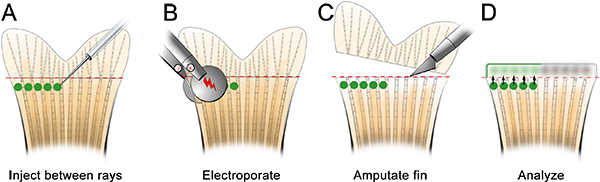
图7。交替注入和电在伤口愈合和胚形成过程涉及到目标蛋白的示意图。A.注入啉彼此之间骨鳍条上的鳍背一半。Electroporate按正常吗啉。C.截肢鳍立即注射部位近端(〜1骨段)。荧光标记啉可以观察在伤口上皮细胞和胚在24 HPE。
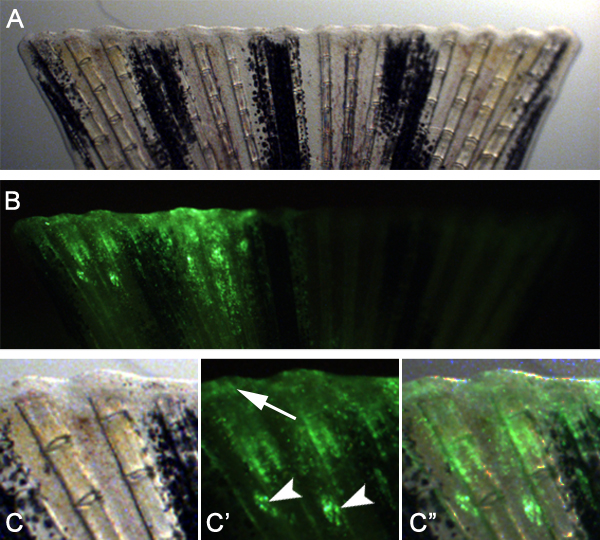
B.图8。使用的技术为目标伤口上皮细胞和胚形成。明视在24百帕鳍控制啉注射,电穿孔立即截肢前的形象。鳍的荧光图像显示在面板A.注意注入一半的鳍背,显示了良好的再生组织中摄取的吗啉。 C - C"的高倍在面板中显示的鳍背一半,A和B注射部位往往仍清晰可见(箭头)但许多有针对性的细胞迁移参与创面上皮细胞和胚形成(箭头)。
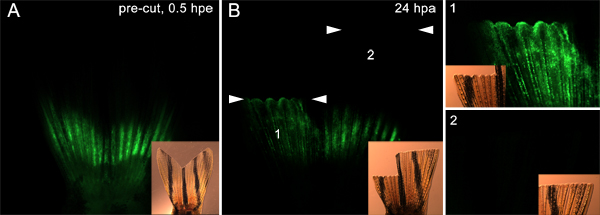
图9。利用这一技术来针对细胞迁移到形成胚。A.荧光灯和明显示鳍注入,背,腹部分啉电穿孔的插图图像。在两架飞机的鳍,然后截肢。背半立即被切断,远端注射部位,那里的腹侧被削减一半9-10远端注射部位的骨段。B.在24百帕,荧光灯和明插图图像表明,吗啉已迁移到背再生(1),而不是腹重生(2),这表明仅在细胞立即截止站点近端参加原基形成。两套白色箭头显示每个截肢飞机。板上标明的最右边的图像显示更高的放大倍率视图的鳍背,腹部分,分别为1和2。
参考图1。一个视频共聚焦Z-Stack的一个区域对应的胚在鳍控制啉注射和电穿孔的位置。 24 HPE图像。由于单个荧光分子不能显示,不是所有的吗啉可以可视化或量化。然而,这些图片给一些吸收不同程度的细胞,从单个点状点,吗啉荧光充满整个细胞,可以在可视化的想法。在静止图像上,方向显示。比例尺:25微米。
讨论
在这里,我们描述了一个利益有条件击倒蛋白质功能强大的亏损在成年斑马鱼的鳍再生的方法。这项技术已用于研究间隙连接蛋白基因,信号受体,转录因子,小分子RNA在再生鳍的产物16,20-22。
我们预计,这种技术也可以用来研究基因伤口愈合和原基形成需要适应技术。例如,我们注入和控制啉之间的骨鳍条上的鳍背一半的空间电穿孔前截肢( 图7)。然后,我们立即注射平面远端截肢的鳍。 24百帕,我们观察到啉靶细胞迁移远端形成的伤口上皮细胞和胚( 图8),表明在这些早期阶段的再生细胞也可以TARG的eted。
该技术具有几个显着的局限性。例如,从荧光标记的荧光不坚持免疫组化,这使得它不可能关联啉金额在细胞中存在一个特定的细胞表型(即细胞增殖)以下的固定和处理。此外,我们已经无法坚持实现再生尾鳍质粒电,虽然前一组报告成功的DNA电成鳍组织23。最后,我们注意到,吗啉是只〜48小时后电21日 ,禁止使用这种技术,在其目前的形式参与新类型的细胞分化的基因测试有效。额外的测试和修改程序,可能会克服目前的局限性。
此外,它是可能的,这种技术可以用来测试从底层组织的胚细胞迁移的蛋白质参与。例如,我们分为两个鳍两侧( 如图7),截肢前控制啉注射和电穿孔。然后,我们截肢鳍立即注射平面远端背侧半,我们被截肢的腹鳍更远端。在24百帕,背侧啉阳性细胞已迁移从注射部位覆盖创面上皮细胞及胚。然而,这不是腹侧方的情况( 图9)。这支持的想法,只有截肢平面的基础细胞参与的再生反应。这些数据还表明,假设为细胞迁移所需的蛋白质,可以使用这种技术进行测试。
披露声明
我们什么都没有透露。
致谢
作者想感谢斑马鱼研究人员对他们的关心和维护的斑马鱼的Freimann生命科学中心和中心。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| CUY21-EDIT或CUY21-SC方波electroporator的 | 保得国际 | CUY21EDIT或CUY21SC | 这两个单位的工作此协议 |
| 直径3毫米桨电极 | 保得国际 | CUY 650-P3的 | |
| 吗啉 | GeneTools,LLC | 吗啉应该可以定制您感兴趣的蛋白质 | |
| 2 - 苯氧乙醇 | 西格玛 | 77861-1L | 麻醉;稀1:1000鱼制水过程中,安乐死1:500 |
| 微-injecti在泵 | 世界精密仪器 | PV830气动PicoPump | 可用于许多不同的显微注射系统 |
| 微型机械手 | 世界精密仪器 | MMJR | 右手(左手MMJL) |
| 微注射针头,外径1.0毫米 | 世界精密仪器 | 1B100F-4 | 这些都是高硼硅玻璃毛细管,拉成针 |
| 持针器 | 世界精密仪器 | 5430 - ALL | 微型喷嘴套件;确保插入1.0毫米的吸管垫片 |
| 针拔 | 萨特 | 的P-97 | 其他微量/针车夫也应努力 |
| 显微镜 | 莱卡,尼康,Zeis小号 | 根据制造商数目不同 | 任何20X光学体视显微镜和工作能力与显微操作 |
参考文献
- Poss, K. D. Getting to the heart of regeneration in zebrafish. Semin. Cell Dev. Biol. 18, 36-45 (2007).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. J. Neurobiol. 44, 289-307 (2000).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. J. Comp. Neurol. 377, 577-595 (1997).
- Becker, C. G., Becker, T. Repellent guidance of regenerating optic axons by chondroitin sulfate glycosaminoglycans in zebrafish. J. Neurosci. 22, 842-853 (2002).
- Lopez-Schier, H., Hudspeth, A. J. A two-step mechanism underlies the planar polarization of regenerating sensory hair cells. Proc. Natl. Acad. Sci. U.S.A. 103, 18615-1820 (2006).
- Johnson, S. L., Weston, J. A. Temperature-sensitive mutations that cause stage-specific defects in Zebrafish fin regeneration. Genetics. 141, 1583-1595 (1995).
- Nechiporuk, A., Poss, K. D., Johnson, S. L., Keating, M. T. Positional cloning of a temperature-sensitive mutant emmental reveals a role for sly1 during cell proliferation in zebrafish fin regeneration. Dev. Biol. 258, 291-306 (2003).
- Tu, S., Johnson, S. L. Fate restriction in the growing and regenerating zebrafish fin. Dev. Cell. 20, 725-732 (2011).
- Geraudie, J., Ferretti, P. Correlation between RA-induced apoptosis and patterning defects in regenerating fins and limbs. Int. J. Dev. Biol. 41, 529-532 (1997).
- Jazwinska, A., Badakov, R., Keating, M. T. Activin-betaA signaling is required for zebrafish fin regeneration. Curr. Biol. 17, 1390-1395 (2007).
- Laforest, L., Brown, C. W., Poleo, G., Geraudie, J., Tada, M., Ekker, M., Akimenko, M. A. Involvement of the sonic hedgehog, patched 1 and bmp2 genes in patterning of the zebrafish dermal fin rays. Development. 125, 4175-4178 (1998).
- Lee, Y., Grill, S., Sanchez, A., Murphy-Ryan, M., Poss, K. D. Fgf signaling instructs position-dependent growth rate during zebrafish fin regeneration. Development. 132, 5173-5183 (2005).
- Poss, K. D., Shen, J., Nechiporuk, A., McMahon, G., Thisse, B., Thisse, C., Keating, M. T. Roles for Fgf signaling during zebrafish fin regeneration. Dev. Biol. 222, 347-358 (2000).
- Raya, A., Koth, C. M., Buscher, D., Kawakami, Y., Itoh, T., Raya, R. M., Sternik, G., Tsai, H. J., Rodriguez-Esteban, C., Izpisua-Belmonte, J. C. Activation of Notch signaling pathway precedes heart regeneration in zebrafish. Proc. Natl. Acad. Sci. U.S.A. 100, 11889-11895 (2003).
- Smith, A., Avaron, F., Guay, D., Padhi, B. K., Akimenko, M. A. Inhibition of BMP signaling during zebrafish fin regeneration disrupts fin growth and scleroblasts differentiation and function. Dev Biol. 299, 438-454 (2006).
- Thummel, R., Li, L., Tanase, C., Sarras, M. P., Godwin, A. R. Differences in expression pattern and function between zebrafish hoxc13 orthologs: recruitment of Hoxc13b into an early embryonic role. Dev. Biol. 274, 318-333 (2004).
- Coonrod, S. A., Bolling, L. C., Wright, P. W., Visconti, P. E., Herr, J. C. A morpholino phenocopy of the mouse mos mutation. Genesis. 30, 198-200 (2001).
- Heasman, J., Kofron, M., Wylie, C. Beta-catenin signaling activity dissected in the early Xenopus embryo: a novel antisense approach. Dev. Biol. 222, 124-134 (2000).
- Nasevicius, A., Ekker, S. C. Effective targeted gene knockdown in zebrafish. Nat. Genet. 26, 216-2120 (2000).
- Hoptak-Solga, A. D., Nielsen, S., Jain, I., Thummel, R., Hyde, D. R., Iovine, M. K. Connexin43 (GJA1) is required in the population of dividing cells during fin regeneration. Dev. Biol. 317, 541-548 (2008).
- Thummel, R., Bai, S., Sarras, M. P., Song, P., McDermott, J., Brewer, J., Perry, M., Zhang, X., Hyde, D. R., Godwin, A. R. Inhibition of zebrafish fin regeneration using in vivo electroporation of morpholinos against fgfr1 and msxb. Dev. Dyn. 235, 336-346 (2006).
- Yin, V. P., Thomson, J. M., Thummel, R., Hyde, D. R., Hammond, S. M., Poss, K. D. Fgf-dependent depletion of microRNA-133 promotes appendage regeneration in zebrafish. Genes Dev. 22, 728-733 (2008).
- Tawk, M., Tuil, D., Torrente, Y., Vriz, S., Paulin, D. High-efficiency gene transfer into adult fish: a new tool to study fin regeneration. Genesis. 32, 27-31 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。