Method Article
In elettroporazione in vivo di Morpholinos nella Adult Regenerating Zebrafish Tail Fin
In questo articolo
Riepilogo
Noi descriviamo un metodo per abbattere condizionale l'espressione di una proteina bersaglio durante la rigenerazione adulto pinna zebrafish. Questa tecnica comporta micro-iniezione e electroporating Morpholinos oligonucleotide antisenso nel tessuto pinna, che consente di testare il ruolo della proteina in varie fasi di rigenerazione pinna, tra la guarigione della ferita, la formazione blastema, e escrescenza rigenerativa.
Abstract
Alcune specie di urodeli e pesce teleosteo possono rigenerare i loro tessuti. Zebrafish sono diventate un modello ampiamente usato per studiare la rigenerazione spontanea di tessuti adulti, come il cuore 1, 2 retina, midollo spinale 3, 4 nervo ottico, cellule sensoriali 5, e alette 6.
La pinna zebrafish è un'appendice relativamente semplice che può essere facilmente manipolato per studiare le fasi più nella rigenerazione epimorphic. Classicamente, la rigenerazione della pinna è stata caratterizzata da tre fasi distinte: la guarigione della ferita, formazione blastema e outgrowth pinna. Dopo amputare parte della pinna, l'epitelio circostante prolifera e migra sulla ferita. Al 33 ° C, questo processo si verifica entro sei ore post-amputazione (hpa, Figura 1B) 6,7. Successivamente, le cellule sottostanti da stirpi diverse (es. ossa, sangue, glia, fibroblasti) rientrare nel ciclo cellulare per formare un blastema proliferativa, wsebbene il epidermide sovrastante continua a proliferare (Figura 1D) 8. Escrescenza si verifica come cellule prossimali al blastema ri-differenziano nei loro rispettivi lignaggi per formare nuovo tessuto (Figura 1E) 8. A seconda del livello di amputazione, rigenerazione completa viene completato in una settimana per un mese.
L'espressione di un gran numero di famiglie di geni, tra cui WNT, Hox, FGF, MSX, acido retinoico, shh, tacca, bmp, e activina A-beta geni, è up-regolato durante le fasi specifiche di rigenerazione fin 9-16. Tuttavia, il ruolo di questi geni e loro proteine codificate durante la rigenerazione è stato difficile da valutare, a meno che un inibitore specifico per la proteina esiste 13, un sensibile alla temperatura esiste mutante o un animale transgenico (o sovraespressione della proteina wild-type o dominante -negativo proteina) è stato generato 7,12. Abbiamo sviped una tecnica di genetica inversa per testare rapidamente e facilmente la funzione di ogni gene durante la rigenerazione della pinna.
Morpholino oligonucleotidi sono ampiamente utilizzati per studiare la perdita di proteine specifiche durante zebrafish, Xenopus, pulcino, e lo sviluppo topo 17-19. Morpholinos coppia di basi con una sequenza complementare a RNA o pre-mRNA splicing blocco o traduzione dell'mRNA. Descriviamo un metodo efficiente per introdurre fluoresceina-etichettato antisenso Morpholinos in rigeneranti alette zebrafish per knockdown espressione della proteina bersaglio. Il morfolino è micro-iniettata in ogni blastema della pinna rigenerante zebrafish coda e elettroporate nelle cellule circostanti. Fluoresceina fornisce la carica per la elettroporare morfolino e per visualizzare il morfolino nel tessuto pinna.
Questo protocollo permette atterramento condizionale proteine per esaminare il ruolo di specifiche proteine nel corso escrescenza fin rigenerativa. Nel Discussion, si descrive come questo approccio può essere adattato per studiare il ruolo di specifiche proteine durante la guarigione di ferite o formazione blastema, nonché un potenziale marcatore di migrazione cellulare durante la formazione blastema.
Protocollo
1. Risospendere Morpholino
- Diluire 300 Nm di fluoresceina-tagged morfolino in 100 microlitri di acqua priva di nucleasi di fare una soluzione circa 3 mM. La soluzione morfolino viene frazionato in più paraffina sigillati tubi da microcentrifuga e conservato a temperatura ambiente e al riparo dalla luce.
- Per determinare la concentrazione esatta morfolino, diluire 5 pl di soluzione di morfolino (o acqua come bianco) in 95 pl di 0,1 N HCl. Impostare una linea di base su uno spettrofotometro a 265 nm con il bianco acqua e quindi determinare la lettura della soluzione diluita morfolino. Moltiplicare l'assorbanza morfolino dalla sua costante determinata e per il fattore di diluizione per determinare la concentrazione in ng / pl. La costante morfolino viene calcolato come:
Morfolino costante = peso molecolare della assorbanza X morfolino 1000/molar.
Il peso molecolare e assorbanza molare per il morfolino si trova sul "Oligo "foglio Proprietà fornito con il prodotto. Dividere la concentrazione morfolino, in ng / pl, dal peso molecolare per determinare la concentrazione in mM. Diluire il morfolino, se necessario, ad una concentrazione operativa, tipicamente 1,2 mM.
2. Fin Amputazione
- Anestetizzare zebrafish adulto sia in Tricaine o 2-fenossietanolo di 1,0 mg / ml in acqua serbatoio.
- Amputare la pinna con una lama sterile bisturi o rasoio prossimale al primo punto lepidotrichial ramificazione. Questo dovrebbe essere fatto allo stesso prossimale / distale posizione su ogni singolo animale (ad esempio 7 segmenti ossei distali dalla cintura fin). IMPORTANTE: assicuratevi di tagliare perfettamente perpendicolare alla anteriore / posteriore piano dell'animale. Tagli angolari si tradurrà nella crescita fin irregolare delle due metà dorsali e ventrali della pinna.
- Ritorna il pesce ad un serbatoio. Noi di solito mantenere il pesce a 33 ° C per aumentare il tasso di rigenerazione. A seconda del disegno sperimentale, wait 0-2 giorni dopo l'amputazione (dpa) per la rigenerazione fin iniziare prima di introdurre il morfolino. Approcci alternativi sono discussi nella discussione, al di sotto.
3. Morfolino iniezione
- Il giorno prima di iniettare il morfolino, effettuare una piastra di iniezione (Figura 2). Assicurarsi per tagliare una tacca ad una estremità del pozzo, che contribuisce a stabilizzare il pesce per la procedura microiniezione.
- A 2 dpa, preparare la micro-iniezione di apparati e soluzioni morfolino.
- Diluire la fluoresceina tag morfolino alla concentrazione adeguata (consigliamo di iniziare con 1,2 mm) e mettere in un bagno di acqua a 65 ° C, per 5 minuti.
- Estrarre l'ago di vetro per la micro-iniezione con un estrattore ago.
- Caricare l'ago con il morfolino (nota: a seconda che si tratti di back-front-fill o caricare l'ago dovrà stabilire se si carica il primo ago, o tagliare la prima punta).
- Tagliare la punta fuori l'ago con unn angolo.
- Seguire le istruzioni del vostro micro-sistema di iniezione per iniettare uno circa 5 nl bolla di morfolino per iniezione. Grandi volumi di morfolino potrebbe distruggere il tessuto.
- Anestetizzare il pesce e posto sulla piastra di iniezione. Rimuovere tutto il liquido in eccesso e orientare l'ago nella posizione appropriata, appena distale al raggio osseo (Figura 3). Utilizzando un microscopio e apparato microiniezione appropriato per morfolino iniettabili (cfr. tabella di reagenti specifici), iniettare il morfolino nella pinna da anteriore a posteriore, come mostrato nella Figura 3. Iniettando da posteriore al anteriore causa il tessuto pinna per arrotolare durante l'iniezione ed è molto difficile.
- Inserire l'ago delicatamente nel tessuto rigenerativa, appena distale ad ogni raggio ossea (contrassegnata con "1" in figura 3) e spingere distalmente fino situato nel blastema (contrassegnata con "2" in figura 3). Fare attenzione a non spingere l'ago attraverso la enfin pneumatico. Quando l'ago è correttamente localizzata, iniettare il morfolino (cioè cliccare una sola volta). A 1,2 mm, la soluzione di fluoresceina-tagged morfolino appare giallo-verde, anche in condizioni di luce normali. Per ogni iniezione, un giallo "soffio" di soluzione morfolino possono essere visualizzati, che aiuta a localizzare l'iniezione al blastema. Circa il 75 nl (10-15 clicks) di soluzione morfolino deve essere iniettato per ray ossea. Pause ~ 1 sec tra un clic. Abbiamo solo iniettare il lato dorsale, utilizzando il ventrale come elettroporazione solo controllo. In alternativa, si potrebbe ripetere questa procedura intero utilizzando un morfolino controllo sulla metà ventrale della pinna.
4. Elettroporazione della morfolino
- Immediatamente dopo l'iniezione del morfolino, rimuovere la piastra di iniezione dal micro-iniezione apparato. Riempire la piastra pozzo di iniezione con la soluzione anestesia finché il pesce è sommerso. L'elettroporazione è eseguita sotto la linea di galleggiamento.
- di 3 mm di diametro dell'elettrodo di platino piastra pinzetta (Cuy 650-P3 pinzette, Protech International) localizza gli impulsi a circa metà della pinna. Fare attenzione a non toccare gli elettrodi al tessuto pinna. Per assicurarsi che gli elettrodi non toccare il tessuto pinna, ruotare il pesce sul lato dorsale e guarda dritto verso il basso la linea mediana per l'elettroporazione.
- Elettroporare sia la dorsale e ventrale (per il controllo per un non-specifici effetti elettroporazione) i lati della pinna utilizzando una squadra CUY21 Onda Elettroporatore (Protech International, Inc.). Pulire gli elettrodi con una Kimwipe umido dopo ogni elettroporazione per eliminare eventuali bolle che possono essersi formate. Se non vengono rimossi, una mini-carica si accumula, che attirerà il tessuto verso l'elettrodo. I parametri di elettroporazione deve essere impostato a dieci impulsi consecutivi 50 msec, a 15 V con una pausa di 1 sec tra gli impulsi.
- Mettere il pesce su un vetrino o una scatola Petri e rapidamente l'immagine della pinna, avendo cura di nOTE l'orientamento dorsale / ventrale. Questa immagine viene utilizzata per l'analisi ricrescita il giorno successivo. Ritorna il pesce al serbatoio.
5. Analisi
- Se la proteina mirata che è stata abbattuta nel espressione è necessario per la rigenerazione fin corretta, una differenza enorme tra le due metà dorsali e ventrali della pinna dovrebbe essere evidente 1 giorno post-elettroporazione (Figura 5B).
- A 3 dpa, scattare un'altra foto della pinna di ogni pesce e abbinare questa immagine con l'immagine corrispondente 2 dpa (Figura 5B). La variazione naturale del modello di pinna pigmentazione tra gli animali vi permetterà di identificare correttamente i singoli pesci.
- Utilizzando immagini NIH, tracciare le 2 aree dpa e 3 dpa di entrambe le metà dorsale e ventrale (Figura 5B).
- Per determinare l'area% di utilizzo rispetto dorsale ventrale la seguente formula: (dorsali 3dpa - dorsali 2dpa) / (ventrale 3dpa - 2dpa ventrale) X 100 = area%
6. Risultati rappresentativi
- Abbiamo sempre saggio per outgrowth fin a 3 hpe dpa, o 24 (ore dopo la elettroporazione). A questo punto, la fluoresceina-etichettato morfolino dovrebbe essere presente nella metà dorsale della pinna (supplementare Figura 1 e Figura 6A). È normale vedere qualche finali fino al livello di amputazione.
- Non ci dovrebbe essere differenza tra i lati dorsale e ventrale nella pinna iniettato e elettroporate con il Morpholinos controllo (Figura 6B).
- Se il morfolino sperimentale destinato a una proteina essenziale per la pinna escrescenza, una differenza drammatica tra i lati dorsale e ventrale deve osservare (Figura 6C).
- Se l'elettrodo ha toccato la pinna durante elettroporazione, il tessuto apparirà marrone (quasi bruciato in apparenza) e necrotico.
"Src =" / files/ftp_upload/3632/3632fig1.jpg "/>
Figura 1. Schematica dei vari eventi che si verificano durante la rigenerazione della pinna. I tempi alla base di ogni evento sono indicati in ore post-amputazione (hpa) e corrispondono ad una temperatura del serbatoio di 33 ° C.
Figura 2. A. Schematica della piastra di iniezione, che è fatto di agarosio e contiene un pozzetto per tenere il pesce durante microiniezione del morfolino.
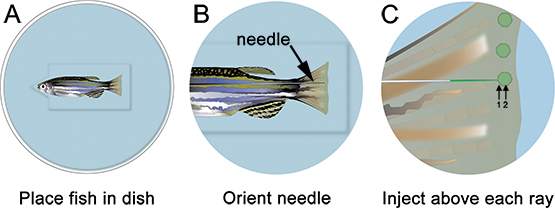
Figura 3. Schema di microiniezione morfolino. A. Inserire il pesce nel piatto con la testa del pesce nella tacca tagliato fuori dal pozzo, che aiuterà il pesce resta stabile. B. A basso ingrandimento, disporre l'ago in modo che è vicino al tessuto rigenerazione della pinna. C. ng A maggiore ingrandimento, iniettare il distale per ogni raggio fin ossea (cioè in ogni blastema) morfolino. L'ago deve entrare nel tessuto appena distale al raggio ossea (1), e poi proseguire fino alla posizione del blastema (2). Nota: i cerchi verdi nello schema servono solo per mostrare la posizione di iniezione. Il morfolino può brevemente essere visualizzato come una giallo / verde "sfoglia" dopo ogni iniezione, tuttavia, questo non persistono come mostrato nello schema.
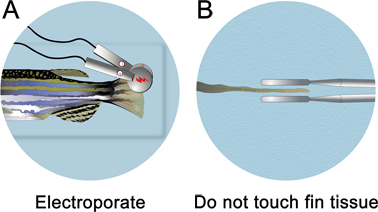
Figura 4. Schema di elettroporazione pinna. A. In seguito a microiniezione, mettere il pesce in una capsula di Petri piena di anestesia e elettroporare entrambe le parti dorsali e ventrali. B. Assicurarsi di non toccare il tessuto pinna. Elettrodi deve essere posto ~ 1 mm dal tessuto.
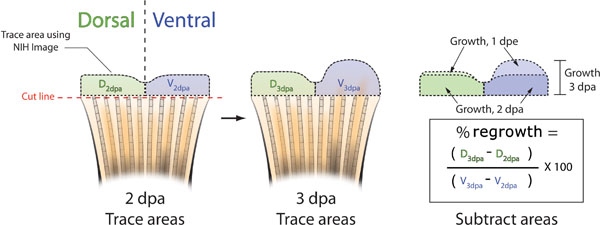
Figura 5. Schema dei metodi utilizzati per calcolare l'inibizione fin escrescenza. A. Scatta una foto della pinna di ogni pesce a 2 dpa, o immediatamente prima o dopo l'iniezione morfolino ed elettroporazione. Tracciare la tessuti rigenerabili sia della dorsale (verde) e ventrale (blu) metà della pinna con NIH Image, (linee nere tratteggiate). B. A 3 dpa, scattare un'altra foto di ciascuna aletta e di nuovo risalire le zone dorsale e ventrale di ricrescita usando l'immagine NIH. C. Sottrarre la zona di ricrescita a 2 dpa dalla ricrescita totale a 3 DPA sia per i ricchi dorsale e ventrale. L'area percentuale di dorsale rispetto ventrale ricrescita può essere calcolata utilizzando la formula: ((D 3dpa - D DPA 2) / (V 3dpa - 2dpa V)) X 100. Percentuale di inibizione = 100 - Area per cento.
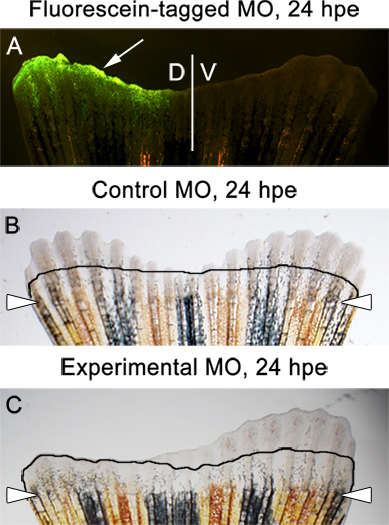
Esempi Figura 6. Di attesarisultati. immagine A. fluorescente che mostra una fluoresceina-tag controllo morfolino nella metà dorsale della pinna, 24 ore post-elettroporazione (hpe). B. immagine Brightfield di una pinna che è stato iniettato e elettroporata con un morfolino controllo nella metà dorsale . L'immagine mostra la ricrescita parità di entrambe le parti dorsali e ventrali di una pinna, 24 hpe. C. Brightfield immagine di una pinna che è stato iniettato e elettroporate con un morfolino sperimentale nella metà dorsale. L'immagine mostra inibizione della ricrescita sulla dorsale / iniettato lato. La linea mostra la quantità di ricrescita a 2 dpa, immediatamente prima dell'iniezione morfolino ed elettroporazione.
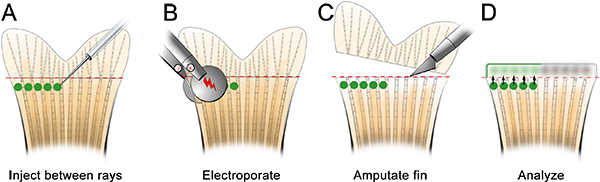
Figura 7. Schema di un'iniezione alternativo e procedura di elettroporazione alle proteine bersaglio coinvolti nella guarigione delle ferite e la formazione di blastema. A. Iniettare il morfolinotra ciascun raggio aletta ossea sul mezzo dorsale della pinna. B. elettroporare la morfolino come al solito. C. amputazione della pinna immediatamente prossimale (~ 1 segmento osseo) al sito di iniezione. D. La fluoresceina-morfolino etichettato può essere osservato nell'epitelio delle ferite e blastema a 24 hpe.
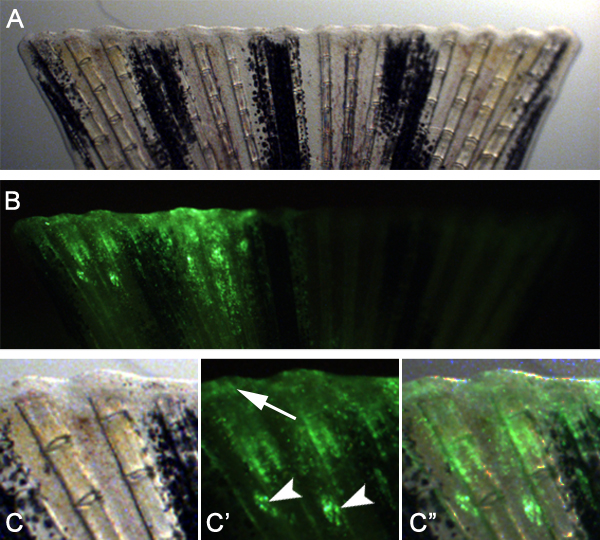
Figura 8. Utilizzando la tecnica di indirizzare l'epitelio della ferita e la formazione blastema. A. Brightfield immagine di una pinna a 24 hpa che è stato iniettato e elettroporate con un morfolino controllo immediatamente prima dell'amputazione. B. immagine fluorescente di pinna mostrato nella nota pannello A. che il mezzo iniettato dorsale della pinna mostra l'assorbimento bene della morfolino nel tessuto rigenerativa. C -. C "ingrandimento superiore della metà dorsale della pinna mostrato in pannelli A e B. I siti di iniezione sono spesso ancora visibili (frecce), Ma molte cellule bersaglio sono migrati a partecipare nell'epitelio delle ferite e la formazione di blastema (freccia).
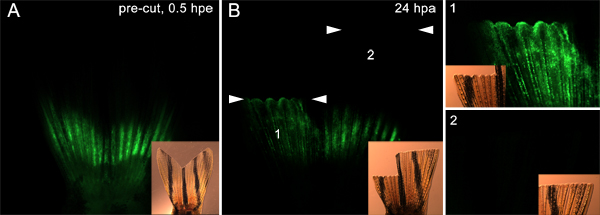
Figura 9. Utilizzando la tecnica per colpire le cellule che migrano per formare l'. Blastema A. fluorescente e le immagini che mostrano brightfield incasso una pinna iniettato e elettroporate con morfolino su entrambe le metà dorsale e ventrale. La pinna è stata poi amputata a due piani. La parte dorsale è stata tagliata immediatamente distale ai siti di iniezione, dove, come la metà ventrale è stata tagliata 9-10 segmenti ossei distali ai siti di iniezione. B. A 24 anni hpa, le immagini fluorescenti e brightfield incasso dimostrano che morfolino sia migrata alla dorsale rigenerare (1), ma non rigenerato ventrale (2), indicando che solo la cella immediatamente prossimale al sito di taglio partecipare alla formazione blastema. Le due serie di frecce bianche indicano il livello di ogni amputazioneaereo. Pannelli segnato 1 e 2 all'estrema destra dell'immagine mostra una vista ingrandimento maggiore delle due metà dorsali e ventrali della pinna, rispettivamente.
Supplementare Figura 1. Un video di un microscopio confocale z-pila di una regione corrispondente alla posizione di un blastoma in una pinna iniettato e elettroporata con un morfolino controllo. L'immagine è stata scattata a 24 hpe. Poiché una singola molecola fluoresceina non può essere visualizzata, non tutto il morfolino può essere visualizzata o quantificati. Tuttavia, queste immagini danno un'idea dei vari gradi di assorbimento che possono essere visualizzati nelle cellule, da singoli punti puntata, alle cellule intere piene di morfolino fluorescente. Sul fermo immagine, l'orientamento viene mostrato. Scale bar: 25 micron.
Discussione
Qui, descriviamo un potente perdita di funzione di approccio al condizionale proteine atterramento di interesse durante la rigenerazione della pinna in zebrafish adulto. Questa tecnica è stata utilizzata per studiare i geni giunzioni gap, segnalando recettori, fattori di trascrizione, e microRNA durante escrescenza pinna rigenerativa 16, 20-22.
Prevediamo che questa tecnica può anche essere usato per studiare geni necessari per la guarigione della ferita e formazione blastema adattando la tecnica. Ad esempio, abbiamo iniettato ed elettroporati uno morfolino controllo nello spazio tra i raggi della pinna ossee sulla metà dorsale della pinna prima amputazione (Figura 7). Abbiamo poi amputata la pinna immediatamente distale al piano di iniezione. 24 hpa, abbiamo osservato che le morfolino-targeting cellule erano migrate distalmente per formare sia l'epitelio ferita e blastema (Figura 8), indicando che le cellule durante queste prime fasi di rigenerazione possono anche essere Targeted.
La tecnica ha alcune limitazioni notevoli. Ad esempio, fluorescenza dal tag fluoresceina non persistono fissazione seguente e trattamento per immunoistochimica, che rende possibile correlare un particolare fenotipo cellulare (cioè la proliferazione cellulare) con la quantità di morfolino presente in una cellula. Inoltre, siamo stati in grado di raggiungere sempre l'elettroporazione di plasmidi nella rigenerazione della pinna caudale, anche se un gruppo precedente ha fatto segnalare l'elettroporazione di successo di DNA nel tessuto fin 23. Infine, abbiamo notato che il morfolino è efficace solo per ~ 48 ore dopo l'elettroporazione 21, che vieta utilizzando questa tecnica nella sua forma attuale per testare i geni coinvolti nella differenziazione dei tipi di cellule nuove. Ulteriori test e modifica del procedimento può superare queste limitazioni attuali.
Inoltre, è possibile che questa tecnica può essere utilizzatatestare proteine coinvolte nella migrazione cellulare dal tessuto sottostante al blastema. Ad esempio, abbiamo iniettato ed elettroporati un controllo morfolino in entrambi i lati della pinna (come descritto nella Figura 7) prima amputazione. Abbiamo poi amputato metà dorsale della pinna immediatamente distale al piano di iniezione e amputato la pinna ventrale molto più distalmente. A 24 hpa, i morfolino cellule positive sul lato dorsale erano migrati dal sito di iniezione per l'epitelio sovrastante ferita e blastema. Tuttavia, ciò non è avvenuto sul lato ventrale (Figura 9). Questo supporta l'idea che solo le cellule che stanno alla base del piano di amputazione partecipare alla risposta rigenerativa. Questi dati suggeriscono inoltre ipotizzato che le proteine devono essere richiesti per la migrazione delle cellule potrebbe essere testati utilizzando questa tecnica.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare la vita Freimann Science Center e il Centro per il personale di ricerca Zebrafish per la loro cura e manutenzione del zebrafish.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| CUY21-EDIT o CUY21-SC Square wave elettroporatore | Protech internazionale | CUY21EDIT o CUY21SC | Entrambe le unità lavorare per questo protocollo |
| 3 mm di diametro paddle elettrodi | Protech internazionale | Cuy 650-P3 | |
| Morfolino | GeneTools, LLC | Morfolino devono essere progettati su misura per la vostra proteina di interesse | |
| 2-Phenoxyethanol | Sigma | 77.861-1L | Anestesia, diluito 1:1000 in acqua i pesci sistema per la procedura, 1:500 per l'eutanasia |
| Micro-injectisulla pompa | Mondo Strumenti di precisione | PV830 pneumatico PicoPump | Molti sistemi microiniezione differenti potrebbero essere utilizzati |
| Micro-manipolatore | Mondo Strumenti di precisione | MMJR | Mano destra (MMJL per mancini) |
| Micro-iniezione aghi, 1,0 mm di diametro esterno | Mondo Strumenti di precisione | 1B100F-4 | Questi sono in vetro borosilicato capillari, tirato in un ago |
| Porta aghi | Mondo Strumenti di precisione | 5430-ALL | Nozzle Kit Pico, assicurarsi di incasso del 1,0 millimetri pipetta guarnizione |
| Needle puller | Sutter | P-97 | Altri micropipette / ago estrattori dovrebbe funzionare anche |
| Microscopio | Leica, Nikon, Zeiss | Numero varia a seconda del produttore | Qualsiasi stereomicroscopio con ottica 20X e la possibilità di lavorare con micromanipolatori |
Riferimenti
- Poss, K. D. Getting to the heart of regeneration in zebrafish. Semin. Cell Dev. Biol. 18, 36-45 (2007).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. J. Neurobiol. 44, 289-307 (2000).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. J. Comp. Neurol. 377, 577-595 (1997).
- Becker, C. G., Becker, T. Repellent guidance of regenerating optic axons by chondroitin sulfate glycosaminoglycans in zebrafish. J. Neurosci. 22, 842-853 (2002).
- Lopez-Schier, H., Hudspeth, A. J. A two-step mechanism underlies the planar polarization of regenerating sensory hair cells. Proc. Natl. Acad. Sci. U.S.A. 103, 18615-1820 (2006).
- Johnson, S. L., Weston, J. A. Temperature-sensitive mutations that cause stage-specific defects in Zebrafish fin regeneration. Genetics. 141, 1583-1595 (1995).
- Nechiporuk, A., Poss, K. D., Johnson, S. L., Keating, M. T. Positional cloning of a temperature-sensitive mutant emmental reveals a role for sly1 during cell proliferation in zebrafish fin regeneration. Dev. Biol. 258, 291-306 (2003).
- Tu, S., Johnson, S. L. Fate restriction in the growing and regenerating zebrafish fin. Dev. Cell. 20, 725-732 (2011).
- Geraudie, J., Ferretti, P. Correlation between RA-induced apoptosis and patterning defects in regenerating fins and limbs. Int. J. Dev. Biol. 41, 529-532 (1997).
- Jazwinska, A., Badakov, R., Keating, M. T. Activin-betaA signaling is required for zebrafish fin regeneration. Curr. Biol. 17, 1390-1395 (2007).
- Laforest, L., Brown, C. W., Poleo, G., Geraudie, J., Tada, M., Ekker, M., Akimenko, M. A. Involvement of the sonic hedgehog, patched 1 and bmp2 genes in patterning of the zebrafish dermal fin rays. Development. 125, 4175-4178 (1998).
- Lee, Y., Grill, S., Sanchez, A., Murphy-Ryan, M., Poss, K. D. Fgf signaling instructs position-dependent growth rate during zebrafish fin regeneration. Development. 132, 5173-5183 (2005).
- Poss, K. D., Shen, J., Nechiporuk, A., McMahon, G., Thisse, B., Thisse, C., Keating, M. T. Roles for Fgf signaling during zebrafish fin regeneration. Dev. Biol. 222, 347-358 (2000).
- Raya, A., Koth, C. M., Buscher, D., Kawakami, Y., Itoh, T., Raya, R. M., Sternik, G., Tsai, H. J., Rodriguez-Esteban, C., Izpisua-Belmonte, J. C. Activation of Notch signaling pathway precedes heart regeneration in zebrafish. Proc. Natl. Acad. Sci. U.S.A. 100, 11889-11895 (2003).
- Smith, A., Avaron, F., Guay, D., Padhi, B. K., Akimenko, M. A. Inhibition of BMP signaling during zebrafish fin regeneration disrupts fin growth and scleroblasts differentiation and function. Dev Biol. 299, 438-454 (2006).
- Thummel, R., Li, L., Tanase, C., Sarras, M. P., Godwin, A. R. Differences in expression pattern and function between zebrafish hoxc13 orthologs: recruitment of Hoxc13b into an early embryonic role. Dev. Biol. 274, 318-333 (2004).
- Coonrod, S. A., Bolling, L. C., Wright, P. W., Visconti, P. E., Herr, J. C. A morpholino phenocopy of the mouse mos mutation. Genesis. 30, 198-200 (2001).
- Heasman, J., Kofron, M., Wylie, C. Beta-catenin signaling activity dissected in the early Xenopus embryo: a novel antisense approach. Dev. Biol. 222, 124-134 (2000).
- Nasevicius, A., Ekker, S. C. Effective targeted gene knockdown in zebrafish. Nat. Genet. 26, 216-2120 (2000).
- Hoptak-Solga, A. D., Nielsen, S., Jain, I., Thummel, R., Hyde, D. R., Iovine, M. K. Connexin43 (GJA1) is required in the population of dividing cells during fin regeneration. Dev. Biol. 317, 541-548 (2008).
- Thummel, R., Bai, S., Sarras, M. P., Song, P., McDermott, J., Brewer, J., Perry, M., Zhang, X., Hyde, D. R., Godwin, A. R. Inhibition of zebrafish fin regeneration using in vivo electroporation of morpholinos against fgfr1 and msxb. Dev. Dyn. 235, 336-346 (2006).
- Yin, V. P., Thomson, J. M., Thummel, R., Hyde, D. R., Hammond, S. M., Poss, K. D. Fgf-dependent depletion of microRNA-133 promotes appendage regeneration in zebrafish. Genes Dev. 22, 728-733 (2008).
- Tawk, M., Tuil, D., Torrente, Y., Vriz, S., Paulin, D. High-efficiency gene transfer into adult fish: a new tool to study fin regeneration. Genesis. 32, 27-31 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon