Method Article
Na eletroporação in vivo de Morpholinos no Adulto Regeneração Zebrafish Cauda Fin
Neste Artigo
Resumo
Nós descrevemos um método para condicionalmente knockdown a expressão de uma proteína alvo durante a regeneração do adulto peixe-zebra barbatana. Esta técnica envolve a micro-injecção e electroporating morpholinos oligonucleótido anti-sentido para o tecido da aleta, o que permite testar o papel da proteína em vários estágios de regeneração da barbatana, incluindo a cicatrização de feridas, a formação de blastema, e excrescência regenerativo.
Resumo
Certas espécies de peixes teleósteos urodeles e pode regenerar seus tecidos. Zebrafish tornaram-se um modelo largamente utilizado para estudar a regeneração espontânea de tecidos adultos, tais como o coração 1, 2 retina, a espinal medula 3, 4 nervo óptico, as células pilosas sensitivas 5, e as aletas 6.
A barbatana peixe-zebra é um apêndice relativamente simples, que é facilmente manipulado para estudar múltiplos estágios na regeneração epimórfica. Classicamente, a regeneração da nadadeira foi caracterizada por três fases distintas: cicatrização, a formação do blastema e conseqüência fin. Após amputando parte da barbatana, o epitélio circundante prolifera e migra sobre a ferida. A 33 ° C, este processo ocorre dentro de seis horas após a amputação-(hPa, Figura 1B) 6,7. Em seguida, as células subjacentes a partir de diferentes linhagens (ex. óssea, sangue, células gliais, fibroblastos) voltar a entrar no ciclo celular para formar uma blastema proliferativa, wnquanto a epiderme sobrejacente continua a proliferar (Figura 1D) 8. Excrescência ocorre como células proximais ao blastema re-se diferenciar em suas linhagens respectivas para formar novo tecido (Figura 1E) 8. Dependendo do nível da amputação, a regeneração completa é completada em uma semana a um mês.
A expressão de um grande número de famílias de genes, incluindo Wnt, hox, FGF, MSX, ácido retinóico, shh, entalhe, BMP, e activina A-beta genes, é sobre-regulada durante fases específicas do fin regeneração 9-16. No entanto, os papéis de esses genes e suas proteínas codificadas durante a regeneração tem sido difícil de avaliar, a menos que um inibidor específico para a proteína existe 13, um mutante sensível à temperatura existe ou um animal transgénico (quer superexpressão da proteína do tipo selvagem ou um dominante -negativa de proteína) foi gerado 7,12. Nós desenped uma técnica genética reversa de forma rápida e facilmente testar a função de qualquer gene durante a regeneração fin.
Oligonucleotídeos morfolino são amplamente utilizados para estudar a perda de proteínas específicas durante o peixe-zebra, Xenopus, pintinho, eo desenvolvimento do mouse 17-19. Morpholinos pares de bases com uma sequência de RNA complementar ou bloco de splicing pré-mRNA ou a tradução do mRNA. Nós descrevemos um método para introduzir de forma eficiente de fluoresceína-etiquetados com anti-sentido morpholinos em aletas regeneração peixe-zebra para expressão knockdown da proteína alvo. O micro-morfolino é injetado em cada blastema da nadadeira em regeneração da cauda do peixe-zebra e electroporados nas células vizinhas. Fluoresceína fornece a carga para a electroporate morfolino e para visualizar o morfolino no tecido barbatana.
Este protocolo permite knockdown proteína condicional para examinar o papel de proteínas específicas durante conseqüência fin regenerativa. No Discussion, nós descrevemos como esta abordagem pode ser adaptado para estudar o papel das proteínas específicas durante a cicatrização de feridas ou formação de blastema, bem como um marcador potencial de migração celular durante a formação do blastema.
Protocolo
1. Ressuspender Morfolino
- Diluir 300 nM de fluoresceína-etiquetados com morfolino em 100 uL de nuclease livre de água para fazer uma solução a cerca de 3 mM. A solução é morfolino aliquotadas em vários tubos de microcentrífuga de parafina-selados e armazenados à temperatura ambiente e ao abrigo da luz.
- Para determinar a concentração exacta morfolino, diluir 5 uL de solução de morfolino (ou água como um branco) em 95 ul de 0,1 N de HCl. Definir uma linha de base num espectrofotómetro a 265 nm com o ensaio em branco de água e, então, determinar a leitura da solução diluída morfolino. Multiplicar a absorvância morfolino por sua constante determinada e pelo factor de diluição para determinar a concentração em ng / uL. A constante morfolino é calculada como:
Morfolino constante = peso molecular da absorvância morfolino 1000/molar X.
O peso molecular ea absorvância molar para o morfolino pode ser encontrada no "Oligo Propriedades folha "fornecido com o produto. Dividir a concentração morfolino, em ng / ul, pelo peso molecular para determinar a concentração em mM. Diluir o morfolino, se necessário, para uma concentração de trabalho, tipicamente 1,2 mM.
2. Amputação Fin
- Anestesiar peixe-zebra adulto em qualquer tricaina ou 2-fenoxietanol a 1,0 mg / ml em água do tanque.
- Amputar a nadadeira utilizando uma lâmina de bisturi estéril ou navalha proximal ao ponto lepidotrichial primeira ramificação. Isto deve ser feito no local proximal / distal mesmo em cada animal (por exemplo, 7 segmentos ósseos distais do cinto fin). Importante: certificar-se para cortar perfeitamente perpendicular ao plano anterior / posterior do animal. Cortes inclinados irá resultar em excrescência fin desigual das metades dorsal e ventral da barbatana.
- Retornar o peixe para um tanque. Nós tipicamente manter o peixe a 33 ° C para aumentar a taxa de regeneração. Dependendo do desenho experimental, wait 0-2 dias após a amputação (dpa) para a regeneração da nadadeira para começar antes de introduzir o morfolino. Abordagens alternativas são discutidos na discussão, abaixo.
3. Morfolino Injeção
- No dia anterior à injecção do morfolino, fazer uma placa de injecção (Figura 2). Assegure-se para cortar um entalhe a uma extremidade do poço, que ajuda a estabilizar o peixe para o procedimento de microinjecção.
- Às 2 DPA, preparar o aparelho de injecção de micro-e uma solução de morfolino.
- Dilui-se a fluoresceína morfolino-etiquetados com a concentração adequada (recomendam começando com 1,2 mM) e colocar num banho de água 65 ° C, durante 5 minutos.
- Puxar a agulha de vidro para a injecção de micro-utilizando um extractor de agulha.
- Coloque a agulha com a morfolino (nota: dependendo se você back-preenchimento ou front-carregar a agulha irá determinar se você carregar a primeira agulha, ou cortar a primeira dica).
- Corte a ponta fora a agulha em umângulo n.
- Siga as instruções do seu sistema de injeção de micro-injetar uma bolha aproximadamente 5 nl de morfolino por injeção. Volumes maiores de morfolino poderia interromper o tecido.
- Anestesiar o peixe e coloque na placa de injeção. Remover o excesso de líquido e orientar a agulha para o local apropriado, tal distai ao raio óssea (Figura 3). Usando um microscópio e aparelho apropriado para microinjecção morfolino injecções (ver Tabela de reagentes específicos), injectar a morfolino na aleta de anterior para posterior, como mostrado na Figura 3. A injeção de posterior para anterior faz com que o tecido fin de arregaçar durante a injeção e é muito difícil.
- Inserir a agulha suavemente o tecido regenerativo, apenas distal para cada raio ósseo (marcado com "1" na Figura 3) e empurre distalmente até localizado no blastema (marcado "2" na Figura 3). Tenha cuidado para não empurrar a agulha através da enfin de pneus. Quando a agulha estiver corretamente localizada, injetar o morfolino (ou seja, clique uma vez). No 1,2 mM, a fluoresceína-etiquetados com solução morfolino aparece amarelo-verde, mesmo em condições normais de luz. Com cada injecção, um "puff" amarelo da solução de morfolino podem ser visualizados, o que ajuda a localizar a injecção para o blastema. Cerca de 75 nl (10-15 cliques) de solução morfolino deve ser injetado por raios ósseos. Pausa ~ 1 seg entre os cliques. Nós só injetar o lado dorsal, usando o ventral como eletroporação somente controle. Alternativamente, pode-se repetir este procedimento inteiro usando um morfolino controlo sobre a meia ventral da barbatana.
4. Electroporação do morfolino
- Imediatamente após a injecção da morfolino, remover a placa de injecção a partir do aparelho de injecção de micro-. Encher a placa de injecção bem com a solução de anestesia até que o peixe é submerso. A electroporação é realizada sob a linha de água.
- A 3 mm de diâmetro platina eléctrodo pinça placa (cuy 650-P3 Pinças, Protech International) localiza os pulsos para aproximadamente metade da barbatana. Tenha cuidado para não tocar nos eletrodos no tecido fin. Para garantir que os eletrodos não tocam o tecido fin, gire o peixe de lado dorsal e olhar diretamente para baixo da linha mediana para a eletroporação.
- Electroporate tanto o dorsal e ventral (para controlar por alguns efeitos não específicos electroporação) nos lados da barbatana, utilizando um CUY21 quadrado de onda Electroporator (Protech International, Inc.). Limpe os eletrodos com uma Kimwipe úmido após cada eletroporação para remover quaisquer bolhas que possam ter formado. Se eles não são removidos, um mini-carga se acumula, o que irá atrair o tecido na direção do eletrodo. Os parâmetros de eletroporação deve ser ajustado para 10 consecutivo 50 ms pulsos, a 15 V com uma pausa de 1 seg entre os pulsos.
- Coloque o peixe sobre uma lâmina de vidro ou placas de Petri e rapidamente a imagem da barbatana, certificando-se de nota a orientação dorsal / ventral. Esta imagem vai ser utilizado para a análise de recrescimento no dia seguinte. Retornar o peixe para o tanque.
5. Análise
- Se a proteína alvo que foi batido para baixo na expressão é necessária para a regeneração da barbatana adequada, uma diferença dramática entre as metades dorsal e ventral da barbatana deve ser evidente um dia pós electroporação-(Figura 5B).
- Às 3 da dpa, tirar outra foto da barbatana de cada peixe e igualar-se esta imagem com a imagem 2 correspondente dpa (Figura 5B). A variação natural no padrão de pigmentação fin entre os animais lhe permitirá identificar corretamente peixe.
- Usando NIH Image, traçar as 2 e 3 DPA DPA áreas de ambas as metades dorsal e ventral (Figura 5B).
- Para determinar a área% da utilização dorsal contra ventral a seguinte fórmula: (dorsais 3dpa - dorsais 2dpa) / (Ventral 3dpa - 2dpa ventral) X 100 =% de área
6. Os resultados representativos
- Nós sempre ensaio de crescimento fin de 3 HPE dpa, ou 24 (horas eletroporação post). Neste momento, o morfolino fluoresceína-etiquetados deve estar presente na metade dorsal da barbatana (Suplementar Figura 1 e Figura 6A). É normal ver alguns de fuga para baixo para o nível da amputação.
- Não deve haver diferença entre os lados dorsais e ventrais da barbatana injectado e electroporado com o morpholinos controle (Figura 6B).
- Se o morfolino experimental visa uma proteína essencial para a excrescência da aleta, uma diferença dramática entre os lados dorsais e ventrais devem ser observados (Figura 6C).
- Se o eletrodo tocou a fin durante a eletroporação, o tecido vai aparecer marrom (quase queimada na aparência) e necróticas.
"Src =" / files/ftp_upload/3632/3632fig1.jpg "/>
Figura 1. Esquemática dos vários eventos que ocorrem durante a regeneração da barbatana. Os tempos de subjacente para cada evento são dadas em horas pós-amputação (HPA) e correspondem a uma temperatura do tanque de 33 ° C.
Figura 2. A. Esquemática da placa de injecção, que é feita a partir de agarose e contém um pequeno poço para segurar o peixe durante microinjecção do morfolino.
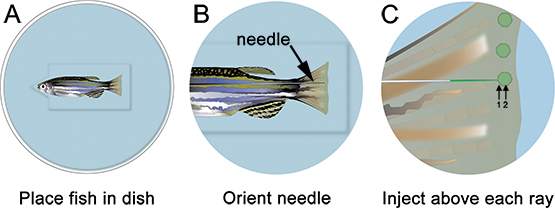
Figura 3. Esquemática da microinjeção morfolino. A. Coloque o peixe no prato com a cabeça do peixe no entalhe corte fora do poço, o que ajudará o peixe ficar estável. B. Já no pequeno aumento, mandar a agulha para que que está perto do tecido de regeneração da barbatana. C. No maior ampliação, injetar o morfolino distal a cada raio da nadadeira óssea (ou seja, em cada blastema). A agulha deve entrar no tecido distai à raios óssea (1), e, em seguida, passe para a localização do blastema (2). Nota: os círculos verdes na esquemática são apenas para mostrar o local da injecção. O morfolino podem brevemente ser visualizado como um verde / amarelo "puff" após cada injecção, no entanto, isso não persistem como mostrado no esquema.
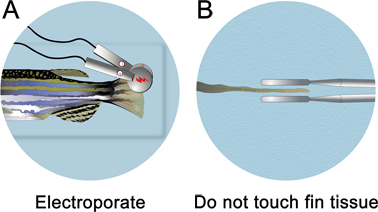
Figura 4. Esquemática da eletroporação fin. A. Após a microinjeção, coloque o peixe em um prato de Petri cheia de anestesia e electroporate ambas as metades dorsal e ventral. B. Certifique-se de não tocar no tecido fin. Os eléctrodos devem ser colocados ~ 1 mm a partir do tecido.
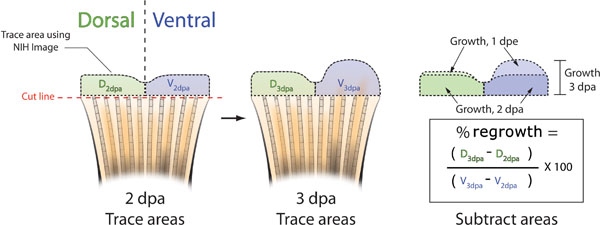
Figura 5. Esquemática dos métodos utilizados para calcular a inibição conseqüência fin. A. Tire uma foto da barbatana de cada peixe em 2 dpa, a injeção de morfolino ou imediatamente antes ou depois e eletroporação. Trace o tecido regenerativo de ambos dorsal do (verde) e ventral (azul) metades do fin usando NIH Image, (preto linhas tracejadas). B. Aos 3 dpa, tirar outra foto de cada aleta e novamente traçar as áreas dorsal e ventral de rebrota utilizando imagem NIH. C. Subtrair da área de rebrota de 2 dpa da rebrota total em 3 dpa tanto para os ricos dorsal e ventral. A área por cento de dorsal contra ventral re-crescimento pode ser calculada utilizando a fórmula: ((D 3dpa - D 2 DPA) / (V 3dpa - V 2dpa)) X 100. A percentagem de inibição = 100 - Área percentual.
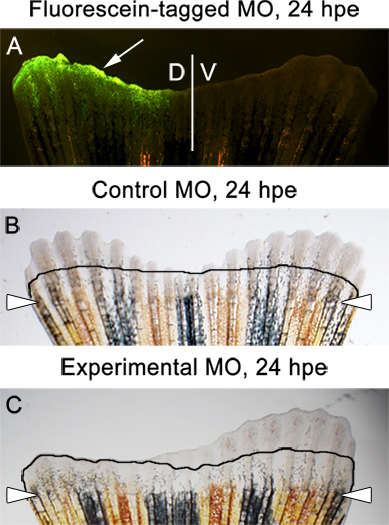
A Figura 6. Exemplos de esperadoresultados. A. imagem fluorescente mostrando uma fluoresceína marcados controle morfolino na metade dorsal da nadadeira, 24 horas após a eletroporação (HPE). B. Brightfield imagem de uma barbatana que foi injetado e com uma electroporados morfolino controle na metade dorsal . A imagem mostra recrescimento igual de ambos os metades dorsal e ventral de uma aleta, 24 HPE. C. imagem Brightfield de uma aleta que foi injectado e electroporado com um morfolino experimental na metade dorsal. A imagem mostra a inibição da rebrota no lado dorsal / injetado. A linha mostra a quantidade de recrescimento em 2 DPA, imediatamente antes da injecção morfolino e electroporação.
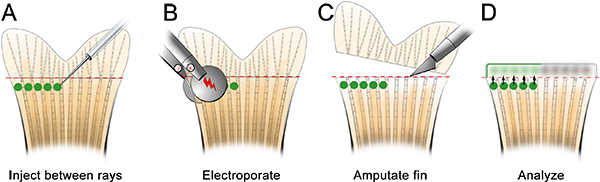
Figura 7. Esquemático de uma injecção alternativo e procedimento de electroporação para proteínas alvo envolvido na cicatrização de feridas e formação de blastema. A. Injectar a morfolinoentre cada raio fin ósseo na metade dorsal da barbatana. B. Electroporate o morfolino como por normal. C. amputar a fin imediatamente proximal (~ 1 segmento ósseo) para o local de injecção. D. A fluoresceína-etiquetados com morfolino pode ser observado no epitélio da ferida e blastema em 24 HPE.
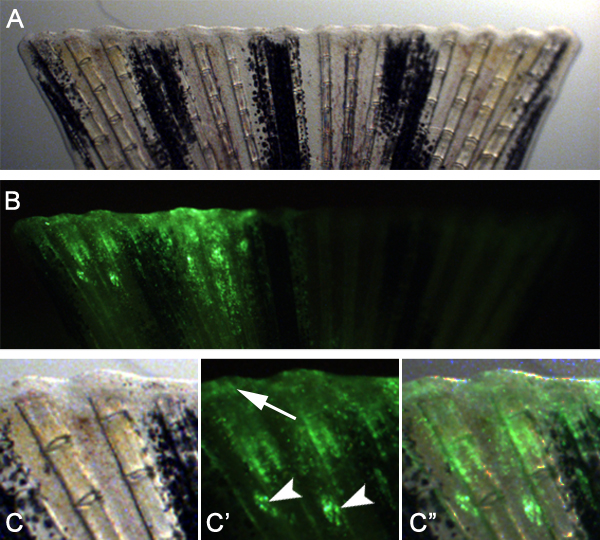
Figura 8. Usando a técnica para atingir o epitélio da ferida e formação blastema. A. Brightfield imagem de uma barbatana de 24 hpa que foi injetado e com uma electroporados morfolino controle imediatamente antes da amputação. Imagem B. fluorescente de fin mostrado no painel Nota A. que a meia injectado dorsal da barbatana mostra boa captação do morfolino no tecido regenerativo. C - C "ampliação Superior da metade dorsal da nadadeira mostrado nos painéis A e B. Os locais de injecção são muitas vezes ainda visível (setas)., Mas muitas células-alvo ter migrado para participar no epitélio da ferida e formação blastema (seta).
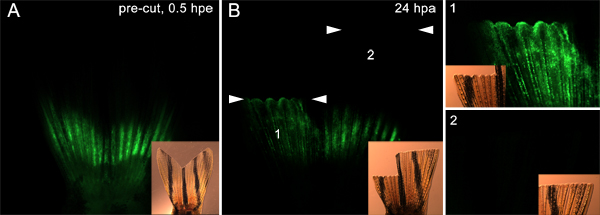
A Figura 9. Utilizando a técnica para direccionar células que migram para formar o blastema. A. fluorescente e as imagens de campo claro inset mostrando uma barbatana injectado e electroporado com morfolino em ambas as metades dorsal e ventral. A aleta foi então amputado em dois planos. A metade dorsal foi cortado imediatamente distal aos locais de injeção, enquanto que a metade ventral foi cortado 9-10 segmentos ósseos distais aos locais de injecção. B. Aos 24 hpa, as imagens fluorescentes e brightfield inset mostram que morfolino migrou para o dorsal regenerar (1), mas não o regenerado ventral (2), indicando que apenas a célula imediatamente proximal ao local de corte participam na formação blastema. Os dois conjuntos de pontas de seta brancas mostram o nível de cada amputaçãoavião. Painéis marcado 1 e 2 mais à direita da imagem mostram uma vista maior ampliação das metades dorsal e ventral da barbatana, respectivamente.
Suplementar Figura 1. Um vídeo de um confocal z pilha de uma região correspondente à localização de um blastema em uma aleta injectado e electroporado com um morfolino controlo. A imagem foi tirada em 24 de HPE. Uma vez que uma molécula de fluoresceína único não pode ser visualizada, nem todo o morfolino pode ser visualizado ou quantificado. No entanto, essas imagens dão uma idéia dos diferentes graus de absorção que podem ser visualizados em células individuais, a partir de pontos puntiformes, para células inteiras cheias de morfolino fluorescente. Na imagem ainda, a orientação é mostrado. Barra de escala: 25 microns.
Discussão
Aqui, descrevemos uma abordagem perda de função poderosa para proteínas condicionalmente knockdown de interesse durante a regeneração da nadadeira em zebrafish adulto. Esta técnica tem sido utilizada para estudar os genes junções, sinalizando receptores, fatores de transcrição e microRNAs durante conseqüência fin regenerativo 16, 20-22.
Prevemos que esta técnica pode também ser usado para estudar genes necessários para a cicatrização de feridas e formação blastema através da adaptação da técnica. Por exemplo, podemos injectar e electroporado um morfolino controlo no espaço entre os raios da aleta ósseas na metade dorsal da barbatana antes da amputação (Figura 7). Em seguida, amputado da barbatana imediatamente distal ao plano de injecção. 24 hPa, observou-se que as células morfolino-alvo tinham migrado distalmente para formar tanto epitélio da ferida e blastema (Figura 8), indicando que as células durante estas fases iniciais de regeneração pode também ser Targeted.
A técnica tem algumas limitações notáveis. Por exemplo, a fluorescência a partir da marca de fluoresceína não persiste a seguir fixação e de processamento para imuno-histoquímica, o que torna impossível para correlacionar um fenótipo celular particular (isto é, proliferação celular) com a quantidade de morfolino presente numa célula. Além disso, têm sido incapazes de atingir o consistentemente electroporação de plasmídeos para a barbatana da cauda de regeneração, embora um grupo anterior fez relatam a electroporação bem sucedida de DNA em fin tecido 23. Finalmente, observamos que o morfolino só é eficaz para ~ 48 horas de eletroporação pós 21, que proíbe o uso desta técnica na sua forma actual para testar genes envolvidos na diferenciação de tipos de células novas. Testes adicionais e modificação do procedimento pode ultrapassar estas limitações actuais.
Além disso, é possível que esta técnica pode ser utilizadapara testar proteínas envolvidas na migração de células do tecido subjacente ao blastema. Por exemplo, podemos injectar e electroporado um controlo morfolino em ambos os lados da barbatana (como descrito na Figura 7) antes da amputação. Em seguida, amputada na metade dorsal da nadadeira imediatamente distal ao plano de injecção e que amputar a nadadeira ventral muito mais distal. Aos 24 hPa, as células morfolino-positivos no lado dorsal tinha migrado a partir do local de injecção para o epitélio da ferida sobrejacente e blastema. No entanto, esse não era o caso no lado ventral (Figura 9). Isso apóia a idéia de que apenas as células que sustentam o plano de amputação participam da resposta regenerativa. Estes dados também sugerem que as proteínas hipótese de ser necessário para a migração de células pode ser testada usando esta técnica.
Divulgações
Não temos nada a divulgar.
Agradecimentos
Os autores gostariam de agradecer à Vida Freimann Science Center e Center for Research Zebrafish pessoal para seu cuidado e manutenção do peixe-zebra.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| CUY21-EDIT ou CUY21-SC onda quadrada electroporator | Protech Internacional | CUY21EDIT ou CUY21SC | Ambas as unidades funcionam para este protocolo |
| 3 mm de remo eletrodos de diâmetro | Protech Internacional | Cuy 650-P3 | |
| Morfolino | GeneTools, LLC | Morfolino devem ser projetados para a sua proteína de interesse | |
| 2-fenoxietanol | Sigma | 77861-1L | Anestesia; diluído 1:1000 em água do sistema de peixe para o procedimento, 1:500 para eutanásia |
| Micro-injectina bomba | Instrumentos de precisão do mundo | PV830 pneumático PicoPump | Muitos sistemas de microinjecção diferentes poderia ser usado |
| Micro-manipulador | Instrumentos de precisão do mundo | MMJR | Destro (MMJL para canhotos) |
| A micro-injecção agulhas, 1,0 mm de diâmetro externo | Instrumentos de precisão do mundo | 1B100F-4 | Estes são de borossilicato capilares de vidro, puxado para dentro de uma agulha |
| Suporte de agulha | Instrumentos de precisão do mundo | 5430-ALL | Kit Pico do Bico, certifique-se de inserir a 1,0 milímetros pipeta junta |
| Agulha extrator | Sutter | P-97 | Outros micropipeta / agulha puxadores também deve funcionar |
| Microscópio | Leica, Nikon, Zeiss | Número varia dependendo do fabricante | Qualquer estereomicroscópio com 20X óptica ea capacidade de trabalhar com micromanipuladores |
Referências
- Poss, K. D. Getting to the heart of regeneration in zebrafish. Semin. Cell Dev. Biol. 18, 36-45 (2007).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. J. Neurobiol. 44, 289-307 (2000).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. J. Comp. Neurol. 377, 577-595 (1997).
- Becker, C. G., Becker, T. Repellent guidance of regenerating optic axons by chondroitin sulfate glycosaminoglycans in zebrafish. J. Neurosci. 22, 842-853 (2002).
- Lopez-Schier, H., Hudspeth, A. J. A two-step mechanism underlies the planar polarization of regenerating sensory hair cells. Proc. Natl. Acad. Sci. U.S.A. 103, 18615-1820 (2006).
- Johnson, S. L., Weston, J. A. Temperature-sensitive mutations that cause stage-specific defects in Zebrafish fin regeneration. Genetics. 141, 1583-1595 (1995).
- Nechiporuk, A., Poss, K. D., Johnson, S. L., Keating, M. T. Positional cloning of a temperature-sensitive mutant emmental reveals a role for sly1 during cell proliferation in zebrafish fin regeneration. Dev. Biol. 258, 291-306 (2003).
- Tu, S., Johnson, S. L. Fate restriction in the growing and regenerating zebrafish fin. Dev. Cell. 20, 725-732 (2011).
- Geraudie, J., Ferretti, P. Correlation between RA-induced apoptosis and patterning defects in regenerating fins and limbs. Int. J. Dev. Biol. 41, 529-532 (1997).
- Jazwinska, A., Badakov, R., Keating, M. T. Activin-betaA signaling is required for zebrafish fin regeneration. Curr. Biol. 17, 1390-1395 (2007).
- Laforest, L., Brown, C. W., Poleo, G., Geraudie, J., Tada, M., Ekker, M., Akimenko, M. A. Involvement of the sonic hedgehog, patched 1 and bmp2 genes in patterning of the zebrafish dermal fin rays. Development. 125, 4175-4178 (1998).
- Lee, Y., Grill, S., Sanchez, A., Murphy-Ryan, M., Poss, K. D. Fgf signaling instructs position-dependent growth rate during zebrafish fin regeneration. Development. 132, 5173-5183 (2005).
- Poss, K. D., Shen, J., Nechiporuk, A., McMahon, G., Thisse, B., Thisse, C., Keating, M. T. Roles for Fgf signaling during zebrafish fin regeneration. Dev. Biol. 222, 347-358 (2000).
- Raya, A., Koth, C. M., Buscher, D., Kawakami, Y., Itoh, T., Raya, R. M., Sternik, G., Tsai, H. J., Rodriguez-Esteban, C., Izpisua-Belmonte, J. C. Activation of Notch signaling pathway precedes heart regeneration in zebrafish. Proc. Natl. Acad. Sci. U.S.A. 100, 11889-11895 (2003).
- Smith, A., Avaron, F., Guay, D., Padhi, B. K., Akimenko, M. A. Inhibition of BMP signaling during zebrafish fin regeneration disrupts fin growth and scleroblasts differentiation and function. Dev Biol. 299, 438-454 (2006).
- Thummel, R., Li, L., Tanase, C., Sarras, M. P., Godwin, A. R. Differences in expression pattern and function between zebrafish hoxc13 orthologs: recruitment of Hoxc13b into an early embryonic role. Dev. Biol. 274, 318-333 (2004).
- Coonrod, S. A., Bolling, L. C., Wright, P. W., Visconti, P. E., Herr, J. C. A morpholino phenocopy of the mouse mos mutation. Genesis. 30, 198-200 (2001).
- Heasman, J., Kofron, M., Wylie, C. Beta-catenin signaling activity dissected in the early Xenopus embryo: a novel antisense approach. Dev. Biol. 222, 124-134 (2000).
- Nasevicius, A., Ekker, S. C. Effective targeted gene knockdown in zebrafish. Nat. Genet. 26, 216-2120 (2000).
- Hoptak-Solga, A. D., Nielsen, S., Jain, I., Thummel, R., Hyde, D. R., Iovine, M. K. Connexin43 (GJA1) is required in the population of dividing cells during fin regeneration. Dev. Biol. 317, 541-548 (2008).
- Thummel, R., Bai, S., Sarras, M. P., Song, P., McDermott, J., Brewer, J., Perry, M., Zhang, X., Hyde, D. R., Godwin, A. R. Inhibition of zebrafish fin regeneration using in vivo electroporation of morpholinos against fgfr1 and msxb. Dev. Dyn. 235, 336-346 (2006).
- Yin, V. P., Thomson, J. M., Thummel, R., Hyde, D. R., Hammond, S. M., Poss, K. D. Fgf-dependent depletion of microRNA-133 promotes appendage regeneration in zebrafish. Genes Dev. 22, 728-733 (2008).
- Tawk, M., Tuil, D., Torrente, Y., Vriz, S., Paulin, D. High-efficiency gene transfer into adult fish: a new tool to study fin regeneration. Genesis. 32, 27-31 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados