Method Article
En electroporación in vivo de Morpholinos en la regeneración de adultos de pez cebra Aleta de cola
En este artículo
Resumen
Se describe un método para derribar condicionalmente la expresión de una proteína diana durante la regeneración de la aleta del pez cebra adulto. Esta técnica implica la inyección de micro y electroporación morfolinos antisentido de oligonucleótidos en el tejido de la aleta, que permite probar el papel de la proteína en varias etapas de regeneración de la aleta, incluyendo la curación de heridas, la formación blastema, y consecuencia regenerativa.
Resumen
Ciertas especies de urodelos y peces teleósteos pueden regenerar sus tejidos. Zebrafish se han convertido en un modelo ampliamente utilizado para estudiar la regeneración espontánea de los tejidos adultos, tales como el corazón 1, 2 retina, la médula espinal 3, el nervio óptico 4, las células sensoriales del cabello 5, 6 y las aletas.
La aleta de pez cebra es un apéndice relativamente simple que es fácil de manipular para el estudio de múltiples etapas en la regeneración epimorfica. Clásicamente, la regeneración de la aleta se caracteriza por tres fases distintas: la curación de heridas, la formación del blastema, y la consecuencia de la aleta. Después de amputar parte de la aleta, el epitelio que rodea prolifera y migra sobre la herida. A los 33 ° C, este proceso ocurre dentro de seis horas después de la amputación (HPA, Figura 1B) 6,7. A continuación, las células subyacentes de los diferentes linajes (por ejemplo los huesos, la sangre, células gliales, fibroblastos) vuelva a entrar en el ciclo celular para formar una proliferativa blastema, wientras la epidermis suprayacente continúa a proliferar (Figura 1D) 8. Se produce como consecuencia de las células proximales del blastema volver a diferenciarse en sus respectivos linajes para formar nuevo tejido (Figura 1 E) 8. Dependiendo del nivel de la amputación, la regeneración completa se completa en una semana a un mes.
La expresión de un gran número de familias de genes, incluyendo genes Hox Wnt, FGF, MSX, el ácido retinoico, shh, de primera clase, bmp y activina-beta genes A, está regulado en etapas específicas de la aleta de la regeneración de 9-16. Sin embargo, las funciones de estos genes y sus proteínas codificadas durante la regeneración han sido difíciles de evaluar, a menos que un inhibidor específico de la proteína existe 13, un mutante sensible a la temperatura existe o un animal transgénico (ya sea que sobreexpresan la proteína de tipo salvaje o una dominante -negativo proteína) se generó 7,12. Hemos desaped una técnica de genética inversa para probar rápida y fácilmente la función de cualquier gen durante la regeneración de la aleta.
Oligonucleótidos Morpholino son ampliamente utilizados para estudiar la pérdida de proteínas específicas en el pez cebra, Xenopus, pollo, y el desarrollo del ratón 17-19. Morpholinos pares de bases con una secuencia de ARN complementaria a cualquiera de los bloques de pre-ARNm de empalme o traducción del mRNA. Se describe un método para introducir de manera eficiente marcados con fluoresceína antisentido morfolinos en la regeneración de las aletas de pez cebra a la expresión de caída de la proteína diana. El morfolino se micro-inyectada en cada uno de blastema de regeneración de la aleta del pez cebra cola y electroporación en las células circundantes. Fluoresceína ofrece el cargo a la electroporar morfolino y para visualizar el morfolino en el tejido de la aleta.
Este protocolo permite la precipitación de proteínas condicional para examinar el papel de proteínas específicas durante el crecimiento de la aleta regenerativa. En el Discussion, se describe cómo este enfoque puede ser adaptado para estudiar el papel de las proteínas específicas durante la curación de heridas o la formación de blastema, así como un marcador potencial de migración de las células durante la formación del blastema.
Protocolo
1. Volver a suspender Morpholino
- Diluir 300 nM de fluoresceína-etiquetados morfolino en 100 l de agua libre de nucleasa para hacer una solución mM aproximadamente 3. La solución morfolino se repartió en alícuotas en tubos de microcentrífuga múltiples sellados en parafina y se almacena a temperatura ambiente y lejos de la luz.
- Para determinar la concentración exacta morfolino, diluir 5 l de solución morfolino (o agua como un espacio en blanco) en 95 l de 0,1 N HCl. Establecer una línea de base en un espectrofotómetro a 265 nm con el blanco de agua y luego determinar la lectura de la solución diluida de morfolino. Multiplicar la absorbancia morfolino por su constante determinada y por el factor de dilución para determinar la concentración en ng / l. La constante morfolino se calcula como:
Morfolino constante = peso molecular de la absorbancia X morfolino 1000/molar.
El peso molecular y coeficiente de absorción molar para el morfolino se puede encontrar en el "Oligo Propiedades "hoja proporcionada con el producto. Dividir la concentración morfolino, en ng / l, por el peso molecular para determinar la concentración en mM. Diluir el morfolino, si es necesario, a una concentración de trabajo, típicamente 1,2 mM.
2. Fin de amputación
- Anestesie pez cebra adulto en cualquiera tricaína o 2-fenoxietanol a 1,0 mg / ml en agua del tanque.
- Amputar la aleta utilizando una cuchilla de escalpelo estéril u hoja de afeitar proximal a la primera punto lepidotrichial ramificación. Esto debe hacerse en la misma proximal / distal localización en cada animal (por ejemplo, 7 segmentos óseos distales de la cintura de la aleta). IMPORTANTE: asegúrese de cortar perfectamente perpendicular al plano anterior / posterior del animal. Los cortes en ángulo dará lugar a consecuencia de la aleta desigual de las mitades dorsal y ventral de la aleta.
- Volver a los peces a un tanque. Por lo general mantener el pescado a 33 ° C para aumentar la tasa de regeneración. Dependiendo del diseño experimental, wait 0-2 días después de la amputación (dpa) para la regeneración de la aleta para comenzar antes de introducir el morfolino. Enfoques alternativos se discuten en la discusión, a continuación.
3. Morpholino inyección
- El día antes de inyectar el morfolino, hacer una placa de inyección (Figura 2). Asegúrese de cortar una muesca en un extremo del pozo, lo que ayuda a estabilizar el pescado para el procedimiento de microinyección.
- A las 2 de dpa, preparar el aparato de inyección de micro-y la solución de morfolino.
- Diluir el marcados con fluoresceína morfolino a la concentración adecuada (se recomienda a partir de 1,2 mM) y colóquelo en un baño María a 65 ° C el agua, durante 5 minutos.
- Tire de la aguja de vidrio para la inyección de micro-utilizando un extractor de la aguja.
- Coloque la aguja con el morfolino (nota: en función de si hace una copia de relleno o de carga frontal, la aguja se determinará si se carga la primera aguja, o cortar la punta de la primera).
- Corte la punta de la aguja en unn ángulo.
- Siga las instrucciones de su sistema de micro-inyección para inyectar una burbuja de aproximadamente el 5 nl de morfolino por inyección. Los mayores volúmenes de morfolino podría alterar el tejido.
- Anestesiar el pescado y colóquelo en la placa de la inyección. Retire todo el exceso de líquido y orientar la aguja en el lugar apropiado, justo por debajo de la raya ósea (Figura 3). Utilizando un microscopio y un aparato apropiado para microinyección morfolino inyecciones (véase la Tabla de los reactivos específicos), inyectar el morfolino en la aleta de delante a atrás, como se muestra en la Figura 3. La inyección de atrás hacia delante hace que el tejido de la aleta para enrollar durante la inyección y es muy difícil.
- Inserte la aguja suavemente en el tejido regenerativo, justo por debajo de cada rayo ósea (marcado "1" en la Figura 3) y empuje hacia distal hasta el situado en el blastema ("2" en la Figura 3). Tenga cuidado de no empujar la aguja a través de la en-aleta neumático. Cuando la aguja está correctamente localizado, inyectar el morfolino (es decir, haga clic una sola vez). De 1,2 mm, el marcados con fluoresceína morfolino solución aparece de color amarillo-verde, incluso en condiciones normales de luz. Con cada inyección, un amarillo "bocanada" de solución morfolino puede ser visualizado, que ayuda a localizar la inyección para el blastema. Aproximadamente el 75 nl (10-15 clics) de la solución de morfolino debe inyectarse por rayos ósea. Pausa ~ 1 segundo entre los clics. Sólo se inyectan en la cara dorsal, ventral, con la electroporación de sólo control. Alternativamente, se podría repetir este procedimiento entero usando un morfolino control en el medio ventral de la aleta.
4. La electroporación de los morfo-
- Inmediatamente después de la inyección de la morfolino, retirar la placa de inyección desde el aparato de inyección de micro-. Completa la placa de pozo de inyección con la solución de anestesia hasta que el pescado se sumerge. La electroporación se lleva a cabo bajo la línea de agua.
- Un platino 3 mm de diámetro de la placa de electrodo pinza (CUY 650-P3 pinzas, Protech Internacional) se localizan los pulsos a aproximadamente la mitad de la aleta. Tenga cuidado de no tocar los electrodos en el tejido de la aleta. Para asegurarse de que los electrodos no se tocan el tejido de la aleta, girar el pescado en su parte dorsal y mirar hacia abajo de la línea media de la electroporación.
- Electroporar tanto la dorsal y ventral (para el control de algunos efectos no específicos de electroporación) lados de la aleta con una onda cuadrada CUY21 Electroporador (Protech International, Inc.). Limpie los electrodos con un KIMWIPE húmedo después de cada electroporación para eliminar las burbujas que puedan haberse formado. Si no se retiran, un mini-carga se acumula, lo que atraerá a los tejidos hacia el electrodo. Los parámetros de electroporación se debe establecer en diez impulsos consecutivos 50 mseg, a 15 V con una pausa de 1 seg entre impulsos.
- Coloque el pescado sobre un portaobjetos de vidrio o placa de Petri y rápidamente la imagen de la aleta, asegurándose de que nover la orientación dorsal / ventral. Esta imagen se utiliza para el análisis recrecimiento en el día siguiente. Volver a los peces en el tanque.
5. Análisis
- Si la proteína blanco que fue derribado en la expresión es necesaria para la regeneración de la aleta adecuada, una gran diferencia entre las mitades dorsal y ventral de la aleta debe ser evidente un día después de la electroporación (Figura 5B).
- A las 3 de dpa, tomar otra foto de la aleta de cada uno de los peces y hacer coincidir la imagen con la que corresponde la imagen 2 dpa (Figura 5B). La variación natural en el patrón de pigmentación de la aleta entre los animales le permitirá identificar correctamente a los peces.
- Usando la imagen del NIH, trazar las zonas 2 y 3 dpa dpa de las dos mitades de los dorsales y ventrales (Figura 5b).
- Para determinar el área% del uso de dorsal ventral versus la fórmula siguiente: (dorsales 3dPA - dorsales 2dpa) / (ventral 3dPA - 2dpa ventral) X 100 =% de superficie
6. Los resultados representativos
- Siempre ensayo para la extensión de la aleta a las 3 hpe dpa, o 24 (horas después de la electroporación). En este momento, el morfolino marcados con fluoresceína debe estar presente en el medio dorsal de la aleta (Figura Suplementario 1 y Figura 6A). Es normal ver algunos trasero hasta el nivel de la amputación.
- No debería haber ninguna diferencia entre las partes dorsal y ventral de la aleta inyectado y electroporación con los morfolinos de control (Figura 6B).
- Si el grupo experimental morfolino dirige una proteína esencial para la extensión de la aleta, una gran diferencia entre las partes dorsal y ventral se observó (Figura 6C).
- Si el electrodo tocado la aleta durante la electroporación, el tejido aparecerá marrón (casi quemado en apariencia) y necrótico.
"Src =" / files/ftp_upload/3632/3632fig1.jpg "/>
Figura 1. Esquema de los diferentes eventos que se producen durante la regeneración de la aleta. Los tiempos que subyacen en cada caso se dan en la hora posterior a la amputación (HPA) y corresponden a una temperatura del tanque de 33 ° C.
Figura 2. A. Esquema de la placa de inyección, que está hecho de agarosa y contiene una pequeña bien para mantener el pescado durante la microinyección del morfolino.
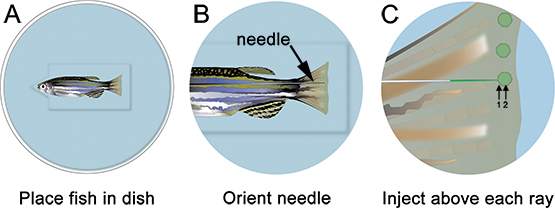
Figura 3. Esquema de microinyección morfolino. A. Coloque el pescado en el plato con la cabeza de los peces en la muesca del pozo, lo que ayudará a los peces se mantienen estables. B. A menor aumento, arreglar la aguja de modo que que está cerca de la regeneración de tejido de la aleta. C. ng A mayor aumento, inyectar el distal a cada rayo de la aleta ósea (es decir, en cada uno de blastema) morfolino. La aguja debe entrar en el tejido distal al rayo ósea (1), y luego continuar a la ubicación de la blastema (2). Nota: los círculos verdes en el esquema sólo se pretende mostrar la ubicación de la inyección. El morfolino brevemente puede ser visualizado como una verde / amarillo "bocanada" después de cada inyección, sin embargo, esto no persiste como se muestra en el esquema.
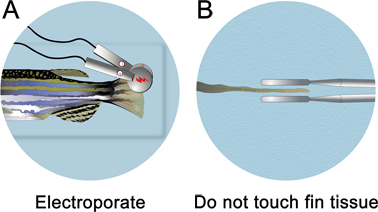
Figura 4. Esquema de la electroporación de la aleta. A. Tras la microinyección, coloque el pescado en una placa de Petri completa de la anestesia y electroporar tanto las mitades dorsal y ventral. B. Asegúrese de no tocar el tejido de la aleta. Los electrodos se colocan ~ 1 mm del tejido.
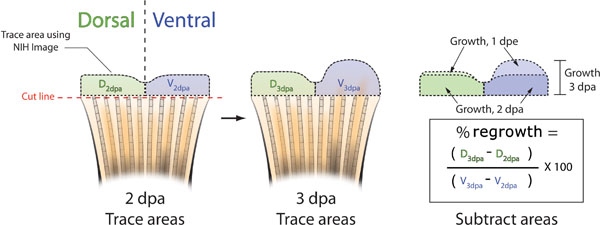
Figura 5. Esquema de los métodos utilizados para calcular la inhibición de la aleta consecuencia. A. Tome una fotografía de la aleta de cada uno de los peces a las 2 de dpa, ya sea inmediatamente antes o después de la inyección morfolino y electroporación. Trace el tejido regenerativo, tanto de la dorsal (verde) y ventral (azul) mitades de la aleta con NIH Image, (líneas negras discontinuas). B. A las 3 de dpa, tomar otra fotografía de cada aleta y otra vez trazar las áreas dorsal y ventral de rebrote con NIH Image. C. Restar el área de nuevo crecimiento en dos DPA de la regeneración total en tres dpa, tanto para los que tienen dorsal y ventral. El porcentaje de área de dorsal ventral versus re-crecimiento se puede calcular usando la fórmula: ((D 3dPA - D dpa 2) / (V 3dPA - V 2dpa)) X 100. Porcentaje de inhibición = 100 - por ciento de área.
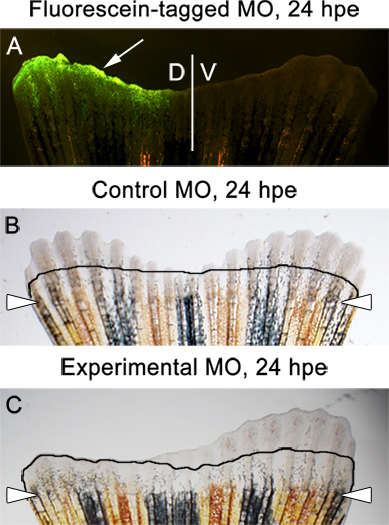
Figura 6. Ejemplos de esperalos resultados. imagen A. fluorescente que muestra un marcados con fluoresceína de control morfolino en el medio dorsal de la aleta, 24 horas después de la electroporación (HPE). B. Brightfield imagen de una aleta que se inyectó y electroporación con un morfolino control en el medio dorsal . La imagen muestra el nuevo crecimiento igual de ambas las mitades dorsal y ventral de la aleta, de 24 años HPE. C. imagen de campo claro de una aleta que se inyecta y la electroporación con un morfolino experimental en la mitad dorsal. La imagen muestra la inhibición de la regeneración en el lado dorsal / inyectado. La línea muestra la cantidad de nuevo crecimiento en dos dpa, inmediatamente antes de la inyección morfolino y electroporación.
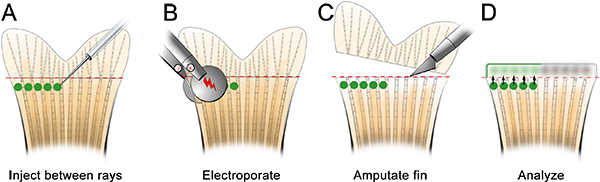
Figura 7. Esquema de una inyección alterna y procedimiento de electroporación de proteínas diana implicados en la cicatrización de heridas y la formación del blastema. A. Inyecte el morfolinoentre cada radio de la aleta de hueso en la parte dorsal de la aleta. B. electroporar los morfo-como de costumbre. C. amputar la aleta inmediatamente proximal (~ 1 segmento óseo) en el sitio de la inyección. D. La marcados con fluoresceína morfolino se puede observar en el epitelio de la herida y la blastema a las 24 HPE.
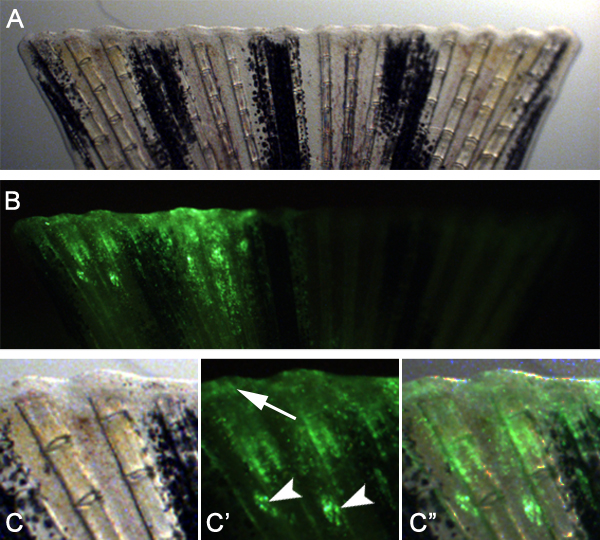
Figura 8. Utilizando la técnica para apuntar epitelio herida y la formación de blastema. A. imagen Brightfield de una aleta en 24 hPa que se inyectó y electroporación con un morfolino control inmediatamente antes de la amputación. Imagen B. fluorescente de la aleta se muestra en el panel A. Nota que el medio inyectado dorsal de la aleta muestra buena captación de la morfolino en el tejido regenerativo. C -. C "aumento mayor de la mitad de la aleta dorsal muestran en los paneles A y B. Los puntos de inyección a menudo son todavía visibles (puntas de flecha), Pero muchas células diana han migrado a participar en el epitelio y la formación de la herida blastema (flecha).
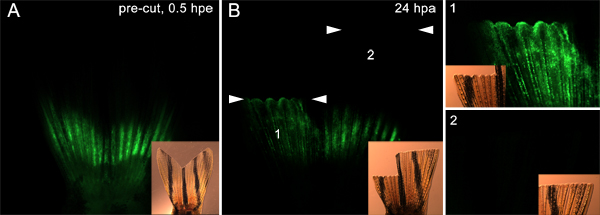
Figura 9. Utilizando la técnica a células diana que migran para formar el blastema. A. fluorescente y las imágenes insertadas campo claro que muestran una aleta inyectado y electroporación con morfolino en ambas las mitades dorsal y ventral. La aleta fue amputada luego en dos planos. La mitad dorsal se cortó inmediatamente distal a los sitios de inyección, en tanto que la mitad ventral fue cortada 9-10 segmentos óseos distales a los sitios de inyección. B. A los 24 hPa, las imágenes en los recuadros fluorescentes y muestran que el campo claro morfolino ha migrado a la dorsal regenerar (1), pero no el regenerado ventral (2), lo que indica que sólo la celda inmediatamente proximal al sitio de corte participar en la formación de blastema. Los dos conjuntos de puntas de flechas blancas muestran el nivel de cada una amputaciónplano. Los paneles marcados 1 y 2 en el extremo derecho de la imagen muestran una vista mayor aumento de las mitades dorsal y ventral de la aleta, respectivamente.
Suplementario Figura 1. Un video de un confocal z pila de una región correspondiente a la ubicación de un blastema en una aleta inyectado y electroporación con un morfolino de control. La imagen fue tomada a las 24 HPE. Puesto que una molécula de fluoresceína solo no puede ser visualizada, no todo el morfolino puede ser visualizado o cuantificado. Sin embargo, estas imágenes dan una idea de los diferentes grados de absorción que pueden ser visualizados en celdas individuales, a partir de puntos puntiformes, a células enteras llenas de fluorescentes morfolino. En la imagen fija, la orientación se muestra. Barra de escala: 25 micras.
Discusión
A continuación, describimos un poderoso pérdida de la función de acercamiento a las proteínas de derribo condicional de interés durante la regeneración de la aleta de pez cebra adulto. Esta técnica se ha utilizado para estudiar los genes de las uniones, la señalización de receptores, factores de transcripción, y microRNAs durante el crecimiento de la aleta de regeneración 16, 20-22.
Se anticipa que esta técnica podría utilizarse también para estudiar los genes necesarios para la curación de heridas y la formación de blastema mediante la adaptación de la técnica. Por ejemplo, se inyecta y electroporación un morfolino control en el espacio entre los radios de las aletas óseas en el medio dorsal de la aleta antes de la amputación (Figura 7). A continuación, amputado la aleta inmediatamente distal al plano de la inyección. 24 hPa, se observó que las células morfolino-destinatarios habían migrado distalmente para formar tanto el epitelio herida y blastema (Figura 8), lo que indica que las células durante las primeras etapas de regeneración también se puede Targpuestó.
La técnica tiene algunas limitaciones notables. Por ejemplo, la fluorescencia de la etiqueta fluoresceína no persiste posterior a la fijación y el procesamiento de inmunohistoquímica, lo que hace imposible para correlacionar un fenotipo particular celular (es decir, la proliferación de células) con la cantidad de morfolino presente en una célula. Además, hemos podido lograr consistentemente la electroporación de plásmidos en la aleta de la cola de regeneración, aunque un grupo anterior hizo reportar la electroporación con éxito de ADN en el tejido de la aleta 23. Por último, hemos observado que el morfolino sólo es efectiva durante aproximadamente 48 horas después de la electroporación 21, que prohíbe el uso de esta técnica en su forma actual para probar los genes implicados en la diferenciación de los tipos de células nuevas. Las pruebas adicionales y la modificación del procedimiento puede superar estas limitaciones actuales.
Además, es posible que esta técnica podría ser usadapara probar proteínas implicadas en la migración de células del tejido subyacente a la blastema. Por ejemplo, se inyecta y electroporación un control morfolino en ambos lados de la aleta (como se describe en la Figura 7) antes de la amputación. A continuación, el amputado media dorsal de la aleta inmediatamente distal al plano de inyección y amputado la aleta ventral mucho más distalmente. A los 24 hPa, las células morfolino-positivos en el lado dorsal habían emigrado desde el sitio de la inyección en el epitelio que recubre la herida y la blastema. Sin embargo, que no era el caso en el lado ventral (Figura 9). Esto apoya la idea de que sólo las células que son la base del plano de la amputación participar en la respuesta regenerativa. Estos datos también sugieren que las proteínas de la hipótesis de que se requiere para la migración celular podría ponerse a prueba utilizando esta técnica.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Los autores desean agradecer a la vida Freimann Science Center y el Centro de Investigación para el personal de pez cebra para su cuidado y mantenimiento del pez cebra.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| CUY21-EDIT o CUY21-SC de onda cuadrada electroporador | Protech Internacional | CUY21EDIT o CUY21SC | Ambas unidades funcionan para este protocolo |
| De 3 mm de diámetro electrodos de paletas | Protech Internacional | CUY 650-P3 | |
| Morpholino | GeneTools, LLC | Morpholino se diseñan a medida para su proteína de interés | |
| 2-fenoxietanol | Sigma | 77861-1L | Anestesia, diluido 1:1000 en los peces de agua sistema para el procedimiento, 1:500 para la eutanasia |
| Micro-Injectien la bomba | World Precision Instruments | PV830 neumático PicoPump | Muchos sistemas de microinyección diferentes podrían ser utilizados |
| Micromanipulador | World Precision Instruments | MMJR | Diestro (MMJL para zurdos) |
| Micro-inyección agujas, 1,0 mm de diámetro exterior | World Precision Instruments | 1B100F-4 | Se trata de vidrio de borosilicato capilares, tirado en una aguja |
| Portaagujas | World Precision Instruments | 5430-ALL | Kit de Pico boquilla, asegúrese de que la inserción de la pipeta de 1,0 mm de junta |
| Aguja extractor | Sutter | P-97 | Otros micropipeta / aguja extractores también se debe trabajar |
| Microscopio | Leica, Nikon, Zeiss | Número varía dependiendo del fabricante | Cualquier microscopio estereoscópico con 20X óptico y la capacidad de trabajar con micromanipulador |
Referencias
- Poss, K. D. Getting to the heart of regeneration in zebrafish. Semin. Cell Dev. Biol. 18, 36-45 (2007).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. J. Neurobiol. 44, 289-307 (2000).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. J. Comp. Neurol. 377, 577-595 (1997).
- Becker, C. G., Becker, T. Repellent guidance of regenerating optic axons by chondroitin sulfate glycosaminoglycans in zebrafish. J. Neurosci. 22, 842-853 (2002).
- Lopez-Schier, H., Hudspeth, A. J. A two-step mechanism underlies the planar polarization of regenerating sensory hair cells. Proc. Natl. Acad. Sci. U.S.A. 103, 18615-1820 (2006).
- Johnson, S. L., Weston, J. A. Temperature-sensitive mutations that cause stage-specific defects in Zebrafish fin regeneration. Genetics. 141, 1583-1595 (1995).
- Nechiporuk, A., Poss, K. D., Johnson, S. L., Keating, M. T. Positional cloning of a temperature-sensitive mutant emmental reveals a role for sly1 during cell proliferation in zebrafish fin regeneration. Dev. Biol. 258, 291-306 (2003).
- Tu, S., Johnson, S. L. Fate restriction in the growing and regenerating zebrafish fin. Dev. Cell. 20, 725-732 (2011).
- Geraudie, J., Ferretti, P. Correlation between RA-induced apoptosis and patterning defects in regenerating fins and limbs. Int. J. Dev. Biol. 41, 529-532 (1997).
- Jazwinska, A., Badakov, R., Keating, M. T. Activin-betaA signaling is required for zebrafish fin regeneration. Curr. Biol. 17, 1390-1395 (2007).
- Laforest, L., Brown, C. W., Poleo, G., Geraudie, J., Tada, M., Ekker, M., Akimenko, M. A. Involvement of the sonic hedgehog, patched 1 and bmp2 genes in patterning of the zebrafish dermal fin rays. Development. 125, 4175-4178 (1998).
- Lee, Y., Grill, S., Sanchez, A., Murphy-Ryan, M., Poss, K. D. Fgf signaling instructs position-dependent growth rate during zebrafish fin regeneration. Development. 132, 5173-5183 (2005).
- Poss, K. D., Shen, J., Nechiporuk, A., McMahon, G., Thisse, B., Thisse, C., Keating, M. T. Roles for Fgf signaling during zebrafish fin regeneration. Dev. Biol. 222, 347-358 (2000).
- Raya, A., Koth, C. M., Buscher, D., Kawakami, Y., Itoh, T., Raya, R. M., Sternik, G., Tsai, H. J., Rodriguez-Esteban, C., Izpisua-Belmonte, J. C. Activation of Notch signaling pathway precedes heart regeneration in zebrafish. Proc. Natl. Acad. Sci. U.S.A. 100, 11889-11895 (2003).
- Smith, A., Avaron, F., Guay, D., Padhi, B. K., Akimenko, M. A. Inhibition of BMP signaling during zebrafish fin regeneration disrupts fin growth and scleroblasts differentiation and function. Dev Biol. 299, 438-454 (2006).
- Thummel, R., Li, L., Tanase, C., Sarras, M. P., Godwin, A. R. Differences in expression pattern and function between zebrafish hoxc13 orthologs: recruitment of Hoxc13b into an early embryonic role. Dev. Biol. 274, 318-333 (2004).
- Coonrod, S. A., Bolling, L. C., Wright, P. W., Visconti, P. E., Herr, J. C. A morpholino phenocopy of the mouse mos mutation. Genesis. 30, 198-200 (2001).
- Heasman, J., Kofron, M., Wylie, C. Beta-catenin signaling activity dissected in the early Xenopus embryo: a novel antisense approach. Dev. Biol. 222, 124-134 (2000).
- Nasevicius, A., Ekker, S. C. Effective targeted gene knockdown in zebrafish. Nat. Genet. 26, 216-2120 (2000).
- Hoptak-Solga, A. D., Nielsen, S., Jain, I., Thummel, R., Hyde, D. R., Iovine, M. K. Connexin43 (GJA1) is required in the population of dividing cells during fin regeneration. Dev. Biol. 317, 541-548 (2008).
- Thummel, R., Bai, S., Sarras, M. P., Song, P., McDermott, J., Brewer, J., Perry, M., Zhang, X., Hyde, D. R., Godwin, A. R. Inhibition of zebrafish fin regeneration using in vivo electroporation of morpholinos against fgfr1 and msxb. Dev. Dyn. 235, 336-346 (2006).
- Yin, V. P., Thomson, J. M., Thummel, R., Hyde, D. R., Hammond, S. M., Poss, K. D. Fgf-dependent depletion of microRNA-133 promotes appendage regeneration in zebrafish. Genes Dev. 22, 728-733 (2008).
- Tawk, M., Tuil, D., Torrente, Y., Vriz, S., Paulin, D. High-efficiency gene transfer into adult fish: a new tool to study fin regeneration. Genesis. 32, 27-31 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados