Method Article
В естественных условиях электропорации Morpholinos в Восстанавливающий взрослых данио рерио хвостового плавника
В этой статье
Резюме
Мы описываем метод условно нокдаун выражение белка-мишени во взрослой регенерации плавников рыбок данио. Этот метод включает в себя микро-инъекций и electroporating morpholinos антисмысловых олигонуклеотидов в плавник ткани, которая позволяет тестировать роль белка в различных стадиях регенерации плавников, в том числе заживление ран, образование бластемы и регенеративной результат.
Аннотация
Certain species of urodeles and teleost fish can regenerate their tissues. Zebrafish have become a widely used model to study the spontaneous regeneration of adult tissues, such as the heart1, retina2, spinal cord3, optic nerve4, sensory hair cells5, and fins6.
The zebrafish fin is a relatively simple appendage that is easily manipulated to study multiple stages in epimorphic regeneration. Classically, fin regeneration was characterized by three distinct stages: wound healing, blastema formation, and fin outgrowth. After amputating part of the fin, the surrounding epithelium proliferates and migrates over the wound. At 33 °C, this process occurs within six hours post-amputation (hpa, Figure 1B)6,7. Next, underlying cells from different lineages (ex. bone, blood, glia, fibroblast) re-enter the cell cycle to form a proliferative blastema, while the overlying epidermis continues to proliferate (Figure 1D)8. Outgrowth occurs as cells proximal to the blastema re-differentiate into their respective lineages to form new tissue (Figure 1E)8. Depending on the level of the amputation, full regeneration is completed in a week to a month.
The expression of a large number of gene families, including wnt, hox, fgf, msx, retinoic acid, shh, notch, bmp, and activin-betaA genes, is up-regulated during specific stages of fin regeneration9-16. However, the roles of these genes and their encoded proteins during regeneration have been difficult to assess, unless a specific inhibitor for the protein exists13, a temperature-sensitive mutant exists or a transgenic animal (either overexpressing the wild-type protein or a dominant-negative protein) was generated7,12. We developed a reverse genetic technique to quickly and easily test the function of any gene during fin regeneration.
Morpholino oligonucleotides are widely used to study loss of specific proteins during zebrafish, Xenopus, chick, and mouse development17-19. Morpholinos basepair with a complementary RNA sequence to either block pre-mRNA splicing or mRNA translation. We describe a method to efficiently introduce fluorescein-tagged antisense morpholinos into regenerating zebrafish fins to knockdown expression of the target protein. The morpholino is micro-injected into each blastema of the regenerating zebrafish tail fin and electroporated into the surrounding cells. Fluorescein provides the charge to electroporate the morpholino and to visualize the morpholino in the fin tissue.
This protocol permits conditional protein knockdown to examine the role of specific proteins during regenerative fin outgrowth. In the Discussion, we describe how this approach can be adapted to study the role of specific proteins during wound healing or blastema formation, as well as a potential marker of cell migration during blastema formation.
протокол
1. Ресуспендируйте морфолино
- Развести 300 нМ флуоресцеина с метками морфолино в 100 мкл нуклеазы без воды, чтобы сделать примерно 3 мМ раствора. Решение морфолино в аликвоты на несколько парафина запаянных пробирках микроцентрифужных и хранить при комнатной температуре, вдали от света.
- Для определения точной концентрации морфолино, разведите 5 мкл раствора морфолино (или воды, как пустой) в 95 мкл 0,1 N HCl. Установка базовой на спектрофотометре при 265 нм с водой пустой, а затем определить показания раствором морфолино. Умножьте поглощения морфолино ее определяется постоянным и коэффициент разбавления для определения концентрации в нг / мкл. Постоянное морфолино рассчитывается как:
Морфолино постоянной = молекулярная масса поглощения морфолино X 1000/molar.
Молекулярной массы и молярного поглощения для морфолино можно найти "Oligo Свойства "лист поставляемые вместе с продуктом. Разделите концентрации морфолино, в нг / мл, от молекулярного веса для определения концентрации в мм. Развести морфолино, при необходимости, рабочей концентрации, как правило, 1,2 мм.
2. Fin Ампутация
- Обезболить взрослых данио либо Tricaine или 2-феноксиэтанол 1,0 мг / мл в резервуар для воды.
- Ампутировать плавник помощью стерильного скальпеля или лезвия проксимальнее первого lepidotrichial точке ветвления. Это должно быть сделано в то же проксимальных / дистального места на каждого животного (например, 7 костных сегментов дистальнее плавник пояса). ВАЖНО: не забудьте вырезать совершенно перпендикулярно передней / задней плоскости животного. Угловой сокращения могут привести к неравномерному результат плавник спинной и брюшной половины плавника.
- Вернуть рыбу в резервуар. Как правило, мы поддерживать рыбы на 33 ° C увеличить скорость регенерации. В зависимости от эксперимента, соайт 0-2 дней после ампутации (ДПА) для регенерации плавников начала до введения морфолино. Альтернативные подходы обсуждаются в обсуждение, ниже.
3. Морфолино инъекций
- За день до приема инъекционных морфолино, сделать инъекцию пластины (рис. 2). Убедитесь в том, чтобы вырезать выемку на одном конце хорошо, что помогает стабилизировать рыб микроинъекции процедуры.
- В 2 часа сна, подготовить микро-инъекции аппарата и морфолино решение.
- Развести флуоресцеина с метками морфолино к соответствующей концентрации (рекомендую начинать с 1,2 мм) и место в 65 ° С на водяной бане в течение 5 минут.
- Потяните стекло иглы для микро-инъекции с помощью иглы съемника.
- Загрузите иглы с морфолино (обратите внимание: в зависимости от того, обратно заполнения или с передней загрузкой иглу, станут ли вы загружаете иглы первым, или вырезать наконечник первым).
- Отрежьте кончик иглы вн углом.
- Следуйте указаниям вашего микро-система впрыска вводить около 5 NL пузырь морфолино на инъекцию. Большие объемы морфолино могут нарушить ткань.
- Обезболить рыбы и место инъекции пластины. Удалите все излишки жидкости и ориентироваться иглу в нужное место, просто дистального костных лучей (рис. 3). С помощью микроскопа и микроинъекции аппарат подходит для морфолино инъекции (см. таблицу специфических реагентов), вводят в морфолино плавник спереди назад, как показано на рисунке 3. Потребители инъекционных от задней к передней вызывает плавник ткани свернуть во время инъекции и очень сложно.
- Вставьте иглу осторожно в регенеративных тканей, только дистальнее каждый костных лучей (с пометкой «1» на рисунке 3) и нажмите дистально пока находится в бластемы (с пометкой "2" на рисунке 3). Будьте осторожны, чтобы не нажать на иглу через аншины плавника. Когда игла правильно локализованы, придать морфолино (например, нажмите один раз). На 1,2 мм, флуоресцеин с метками морфолино решение становится желто-зеленым, даже при нормальном освещении. С каждой инъекцией, желтый "слоеный" решения морфолино могут быть визуализированы, которая помогает локализовать инъекции бластемы. Около 75 NL (10-15 кликов) решения морфолино следует вводить в костных лучей. Пауза ~ 1 сек между нажатиями. Мы только вводить спинной стороны, используя брюшной как электропорация только для контроля. Кроме того, можно повторить всю эту процедуру, используя контроль морфолино на вентральной половины плавника.
4. Электропорации морфолино
- Сразу же после введения морфолино, удалите инъекции пластину с микро-инъекции аппарата. Заполните введения пластины и с анестезией решение, пока рыба под водой. Электропорации проводится под ватерлинией.
- 3 мм платиновую пластинку пинцет электрода (СиУ 650-P3 пинцет, Protech International) локализует импульсов примерно половина плавника. Будьте осторожны и не прикасайтесь к электродам, на плавник ткани. Для того, чтобы электроды не прикасайтесь к ткани плавников, поверните рыбу на спинной стороне и смотреть прямо вниз по средней линии для электропорации.
- Electroporate как спинной и брюшной (для контроля за неспецифическую электропорации эффект) стороны ребра помощью CUY21 площади волна электропоратора (Protech International, Inc.) Протрите электроды влажной KimWipe после каждого электропорации для удаления пузырей, которые могут быть сформированы. Если они не удаляются, мини-заряд накапливается, который будет привлекать ткани к электроду. Электропорации параметры должны быть установлены в десяти последовательных импульсов 50 мс, при 15 V с 1 сек пауза между импульсами.
- Поместите рыбу на предметное стекло или чашку Петри и быстро изображение плавника, убедившись, что яОТЕ спинного / вентральной ориентацией. Этот образ будет использован для отрастания анализ на следующий день. Вернуть рыбу в баке.
5. Анализ
- Если целевой белок, который был сбит в выражении необходим для правильной регенерации плавников, резкое различие между спинной и брюшной половины ребра должны быть очевидны 1 день после электропорации (рис. 5В).
- В 3 часа сна, принять другую картину ребра каждой рыбы и совпадает этот образ с соответствующим 2 сна изображение (рис. 5В). Естественные вариации в структуре плавник пигментации между животными позволит вам правильно определить отдельные рыбы.
- Использование NIH Image, проследить 2 и 3 сна сна областях как спинной и брюшной половины (рис. 5В).
- Для определения% площади по сравнению с вентральной спинной использовать следующую формулу: (спинного 3dpa - спинного 2dpa) / (брюшной 3dpa - Брюшной 2dpa) х 100 =% площади
6. Представитель Результаты
- Мы всегда тест для плавник результат на 3 сна, или 24 ВПО (часов после электропорации). В это время, флуоресцеин с метками морфолино должны присутствовать в спинной половине плавника (Справочная рис. 1 и 6А). Это нормально, чтобы увидеть некоторые задней до уровня ампутации.
- Там должно быть никакой разницы между спинной и брюшной сторон в ребро вводят и электропорации с контролем morpholinos (рис. 6Б).
- Если экспериментальные морфолино цели существенно белка плавник результат, резкое различие между спинной и брюшной сторон должны быть соблюдены (рис. 6).
- Если электрод коснулся плавником при электропорации, ткань появится коричневый (почти сожжен по внешнему виду) и некротические.
"SRC =" / files/ftp_upload/3632/3632fig1.jpg "/>
Рисунок 1. Схема различных событий, которые происходят во время регенерации плавников. , Лежащих в основе раз для каждого события указаны в часах после ампутации (HPA) и соответствующие танк температуре 33 ° C.
Рисунок 2. А. Схема введения пластины, которые сделаны из агарозы и содержит небольшое хорошо держать рыбу во время микроинъекции морфолино.
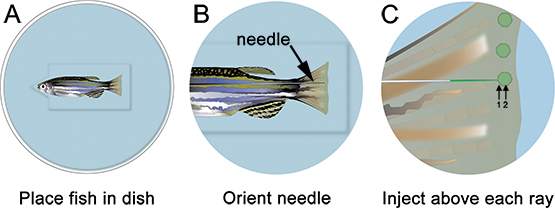
Рисунок 3. Схема микроинъекции морфолино. А. Место рыбы в блюдо с головой рыбы в паз вырезать из скважины, которая поможет рыбы остаются стабильными. В. На малом увеличении, устроить так, чтобы игла она близка к регенерирующей ткани ребра. C. При большем увеличении, придать морфолино дистальнее каждый костных лучей плавника (т.е. в каждом бластемы). Игла должна войти в ткань только дистального костных лучей (1), а затем продолжить расположение бластемы (2). Примечание: зеленые круги на схеме предназначены только показать расположение инъекций. Морфолино можно кратко представить в виде зеленой / желтой "слоеные" после каждой инъекции, однако это не сохраняется, как показано на схеме.
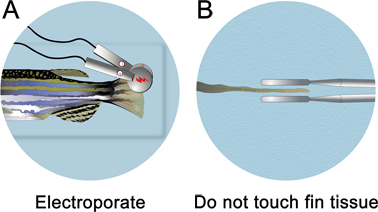
Рисунок 4. Схема плавник электропорации. А. После микроинъекции, поместите рыбу в чашке Петри полной анестезии и electroporate как спинной и брюшной части. B. Убедитесь в том, чтобы не задеть плавником ткани. Электроды должны быть размещены около 1 мм из ткани.
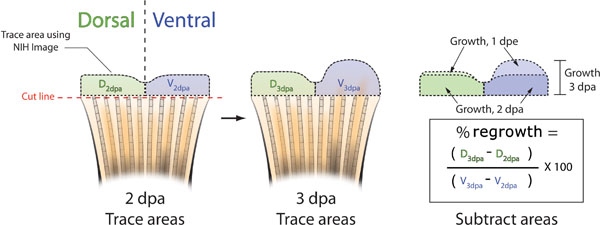
Рисунок 5. Схема методов расчета торможение плавник результат. А. Сфотографируйте плавник каждой рыбы на 2 сна, либо непосредственно до или после морфолино инъекции и электропорации. Проследите регенеративных тканей и спинного (зеленый) и вентральной (синий) половинки плавник с помощью NIH Image (черный пунктир). B. В 3 сна, съемки другой фотографии каждого ребра и вновь проследить спинной и брюшной области отрастания с помощью NIH Image. С. Вычтите области отрастание на 2 сна от общего подроста на 3 сна и для спинной и брюшной имущих. Процент области спины по сравнению с вентральной возобновления роста можно рассчитать по формуле: ((D 3dpa - D 2 DPA) / (V 3dpa - V 2dpa)) X 100. Процент ингибирования = 100 - Процент района.
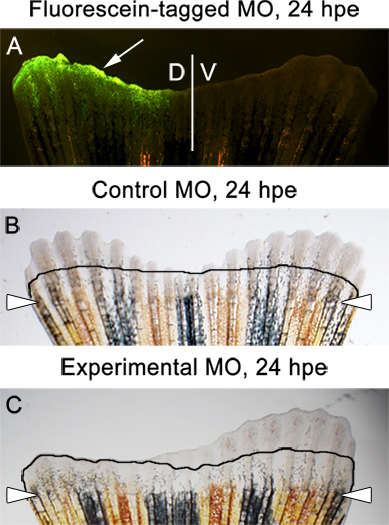
Рисунок 6. Примеры ожидаетсярезультаты. А. Флуоресцентные изображение, показывающее флуоресцеина с меткой контроль морфолино в спинной половине плавник, 24 часов после электропорации (ВПО). B. светлое изображение плавника, который был введен и электропорации с контролем морфолино в спинной 1/2 . На изображении показан равный отрастания как спинной и брюшной половины плавника, 24 ВПО. С. светлое изображение плавника, который был введен и электропорации с экспериментальными морфолино в спинной половине. На рисунке показано ингибирование подроста на спине / впрыском стороны. Линия показывает количество подроста на 2 сна, непосредственно перед морфолино инъекции и электропорации.
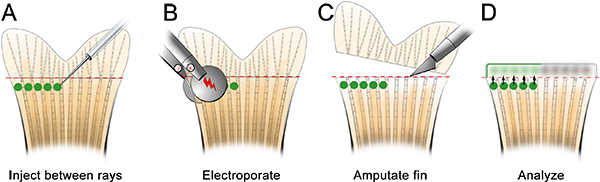
Рисунок 7. Схема альтернативного инъекции и электропорации процедура целевых белков, участвующих в заживлении ран и образование бластемы. А. Вводите морфолиномежду собой костных лучей плавников на спине половина плавника. Б. Electroporate морфолино как в норме. С. ампутировать плавник немедленно проксимальных (~ 1 костных сегментов) в месте инъекции. D. флуоресцеина с метками морфолино можно наблюдать в эпителии раны и бластемы 24 ВПО.
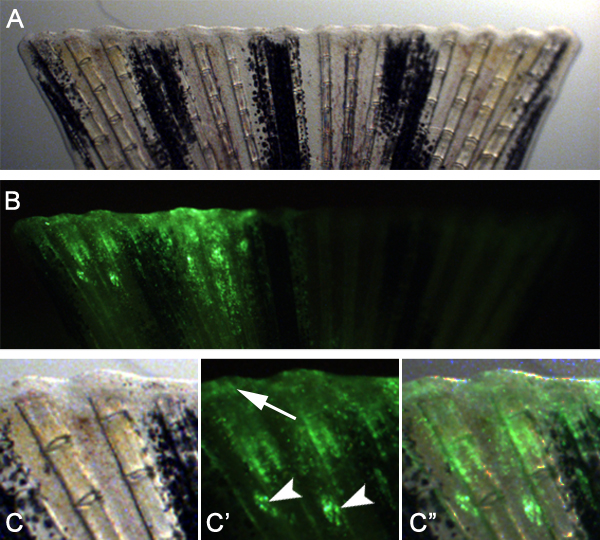
Рисунок 8. Используя технику целевой эпителия раны и формирования бластемы. А. светлое изображение плавника на 24 гПа, что вводили и электропорации с контролем морфолино непосредственно перед ампутацией. Б. флуоресцентное изображение плавника показано в примечании группы А. что введенный спинной половине плавник показывает хорошие поглощения морфолино в регенеративных тканей. C -. С "Высшее увеличение спинной половине плавник показано на панели и Б. для инъекции, часто еще видны (наконечники стрел), Но многие целевые клетки мигрировали к участию в эпителии раны и формирования бластемы (стрелка).
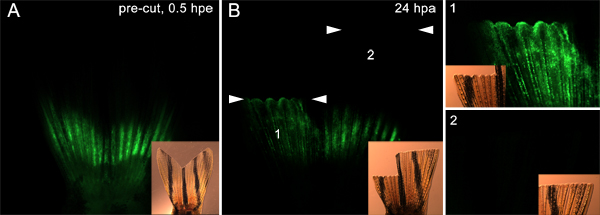
Рисунок 9. Используя технику к клеткам-мишеням, которые мигрируют для формирования бластемы. А. Флуоресцентные и светлого вставка изображения, показывающие плавник вводят и электропорации с морфолино как на спинной и брюшной части. Плавник затем ампутировали в двух плоскостях. Спинной половину сократить сразу дистальнее места инъекций, где, как брюшной половину сократить 9-10 костных сегментов дистальнее инъекции. B. На 24 гПа, люминесцентные и светлого вставка изображения показывают, что морфолино перешла в спинной регенерации (1), но не брюшной регенерата (2), о том, что только клетки сразу проксимальнее разреза сайта участвуют в формировании бластемы. Два комплекта белой стрелки показывают, что уровень каждого ампутацииплоскости. Панели обозначены цифрами 1 и 2 на правой части изображения имеют более высокий увеличение вид на спинной и брюшной половины плавника, соответственно.
Справочная рисунке 1. видео конфокальной Z-Stack от области, соответствующей расположению бластемы в ребра и вводят электропорации с контролем морфолино. Снимок был сделан в 24 ВПО. С одной молекулы флуоресцеин не могут быть визуализированы, не все морфолино могут быть визуализированы или количественно. Тем не менее, эти образы дают некоторое представление о той или иной степени поглощения, которые могут быть визуализированы в клетках, из отдельных точек, точечный, по всей клетки полны люминесцентные морфолино. На неподвижных изображений, ориентация показана. Шкала бар: 25 мкм.
Обсуждение
Здесь мы описываем мощный потерей функции подход к условно нокдаун белка интересов в ходе регенерации плавников у взрослых рыбок данио. Этот метод был использован для изучения генов разрыв соединения, сигнализация рецепторы, транскрипционные факторы, и микроРНК в регенеративный продукт плавник 16, 20-22.
Мы ожидаем, что этот метод может также быть использована для изучения генов, необходимых для заживления ран и образование бластемы путем адаптации метода. Например, мы ввели и электропорации контроль морфолино в пространство между костными лучами плавников на спине половина плавника до ампутации (рис. 7). Затем мы ампутировали плавник сразу дистальнее плоскости инжекции. 24 гПа, мы обнаружили, что морфолино-клеток-мишеней мигрировали дистально для формирования и эпителия раны и бластемы (рис. 8), указывая, что эти клетки во время ранних стадиях восстановления может быть Таргeted.
Техника имеет несколько заметных ограничений. Например, флуоресценция из тега флуоресцеин не сохраняется после записи и обработки данных для иммуногистохимии, что делает невозможным связать определенный клеточный фенотип (т.е. клеточной пролиферации) с количеством морфолино присутствует в клетке. Кроме того, мы не смогли последовательно достижения электропорации плазмид в хвостовой плавник регенерации, хотя предыдущая группа сделала доклад успешного электропорации ДНК в ткани плавников 23. Наконец, мы отметили, что морфолино действует только в течение ~ 48 часов после электропорации 21, который запрещает использование этого метода в его нынешнем виде для тестирования генов, участвующих в дифференциации новых типов клеток. Дополнительное тестирование и изменение процедуры могут преодолеть эти текущие ограничения.
Кроме того, не исключено, что этот метод может быть использованпроверить белки, участвующие в миграции клеток от основной ткани бластемы. Например, мы ввели и электропорации контроль морфолино в обе стороны ребра (как показано на рис 7) до ампутации. Затем мы ампутировали половину спинного плавника сразу дистальнее плоскости инжекции и мы ампутировали брюшного плавника более дистально. На 24 гПа, морфолино-положительных клеток на спинной стороне, мигрировавших из места инъекции в эпителии вышележащих раны и бластемы. Однако это было не так на брюшной стороне (рис. 9). Это подтверждает идею, что только те ячейки, которые лежат в плоскости ампутации участие в восстановительной реакции. Эти данные также показывают, что белки, гипотетически могут потребоваться для миграции клеток могут быть проверены с помощью этой техники.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить жизни Freimann научного центра и Центра научных работников данио рерио их уходу и содержанию рыбок данио.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| CUY21-EDIT или CUY21-SC прямоугольный электропоратора | Protech Международного | CUY21EDIT или CUY21SC | Оба устройства работают на этом протоколе |
| 3 мм, диаметр электродов весло | Protech Международного | СиУ 650-P3 | |
| Морфолино | GeneTools, ООО | Морфолино следует специально предназначенные для вашего белок | |
| 2-феноксиэтанол | Сигма | 77861-1L | Анестезия, разбавленного 1:1000 в воде рыба системы для процедуры, 1:500 для эвтаназии |
| Micro-injectiна насос | Инструменты Всемирной Precision | PV830 пневматический PicoPump | Много различных систем микроинъекции могут быть использованы |
| Micro-манипулятор | Инструменты Всемирной Precision | MMJR | Правой рукой (MMJL для левшей) |
| Micro-инъекционной иглы, 1,0 мм, внешний диаметр | Инструменты Всемирной Precision | 1B100F-4 | Это боросиликатного стекла капилляров, втягивается в иглу |
| Иглодержатель | Инструменты Всемирной Precision | 5430-ВСЕ | Пико насадка комплект, убедитесь, что на вставке 1,0 мм пипетки прокладки |
| Иглы съемник | Саттер | P-97 | Другие микропипетки / игла Съемники должны работать |
| Микроскоп | Leica, Nikon, Zeisс | Количество варьируется в зависимости от производителя | Любой стереомикроскоп с 20-кратным оптики и умение работать с микроманипуляторов |
Ссылки
- Poss, K. D. Getting to the heart of regeneration in zebrafish. Semin. Cell Dev. Biol. 18, 36-45 (2007).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. J. Neurobiol. 44, 289-307 (2000).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. J. Comp. Neurol. 377, 577-595 (1997).
- Becker, C. G., Becker, T. Repellent guidance of regenerating optic axons by chondroitin sulfate glycosaminoglycans in zebrafish. J. Neurosci. 22, 842-853 (2002).
- Lopez-Schier, H., Hudspeth, A. J. A two-step mechanism underlies the planar polarization of regenerating sensory hair cells. Proc. Natl. Acad. Sci. U.S.A. 103, 18615-1820 (2006).
- Johnson, S. L., Weston, J. A. Temperature-sensitive mutations that cause stage-specific defects in Zebrafish fin regeneration. Genetics. 141, 1583-1595 (1995).
- Nechiporuk, A., Poss, K. D., Johnson, S. L., Keating, M. T. Positional cloning of a temperature-sensitive mutant emmental reveals a role for sly1 during cell proliferation in zebrafish fin regeneration. Dev. Biol. 258, 291-306 (2003).
- Tu, S., Johnson, S. L. Fate restriction in the growing and regenerating zebrafish fin. Dev. Cell. 20, 725-732 (2011).
- Geraudie, J., Ferretti, P. Correlation between RA-induced apoptosis and patterning defects in regenerating fins and limbs. Int. J. Dev. Biol. 41, 529-532 (1997).
- Jazwinska, A., Badakov, R., Keating, M. T. Activin-betaA signaling is required for zebrafish fin regeneration. Curr. Biol. 17, 1390-1395 (2007).
- Laforest, L., Brown, C. W., Poleo, G., Geraudie, J., Tada, M., Ekker, M., Akimenko, M. A. Involvement of the sonic hedgehog, patched 1 and bmp2 genes in patterning of the zebrafish dermal fin rays. Development. 125, 4175-4178 (1998).
- Lee, Y., Grill, S., Sanchez, A., Murphy-Ryan, M., Poss, K. D. Fgf signaling instructs position-dependent growth rate during zebrafish fin regeneration. Development. 132, 5173-5183 (2005).
- Poss, K. D., Shen, J., Nechiporuk, A., McMahon, G., Thisse, B., Thisse, C., Keating, M. T. Roles for Fgf signaling during zebrafish fin regeneration. Dev. Biol. 222, 347-358 (2000).
- Raya, A., Koth, C. M., Buscher, D., Kawakami, Y., Itoh, T., Raya, R. M., Sternik, G., Tsai, H. J., Rodriguez-Esteban, C., Izpisua-Belmonte, J. C. Activation of Notch signaling pathway precedes heart regeneration in zebrafish. Proc. Natl. Acad. Sci. U.S.A. 100, 11889-11895 (2003).
- Smith, A., Avaron, F., Guay, D., Padhi, B. K., Akimenko, M. A. Inhibition of BMP signaling during zebrafish fin regeneration disrupts fin growth and scleroblasts differentiation and function. Dev Biol. 299, 438-454 (2006).
- Thummel, R., Li, L., Tanase, C., Sarras, M. P., Godwin, A. R. Differences in expression pattern and function between zebrafish hoxc13 orthologs: recruitment of Hoxc13b into an early embryonic role. Dev. Biol. 274, 318-333 (2004).
- Coonrod, S. A., Bolling, L. C., Wright, P. W., Visconti, P. E., Herr, J. C. A morpholino phenocopy of the mouse mos mutation. Genesis. 30, 198-200 (2001).
- Heasman, J., Kofron, M., Wylie, C. Beta-catenin signaling activity dissected in the early Xenopus embryo: a novel antisense approach. Dev. Biol. 222, 124-134 (2000).
- Nasevicius, A., Ekker, S. C. Effective targeted gene knockdown in zebrafish. Nat. Genet. 26, 216-2120 (2000).
- Hoptak-Solga, A. D., Nielsen, S., Jain, I., Thummel, R., Hyde, D. R., Iovine, M. K. Connexin43 (GJA1) is required in the population of dividing cells during fin regeneration. Dev. Biol. 317, 541-548 (2008).
- Thummel, R., Bai, S., Sarras, M. P., Song, P., McDermott, J., Brewer, J., Perry, M., Zhang, X., Hyde, D. R., Godwin, A. R. Inhibition of zebrafish fin regeneration using in vivo electroporation of morpholinos against fgfr1 and msxb. Dev. Dyn. 235, 336-346 (2006).
- Yin, V. P., Thomson, J. M., Thummel, R., Hyde, D. R., Hammond, S. M., Poss, K. D. Fgf-dependent depletion of microRNA-133 promotes appendage regeneration in zebrafish. Genes Dev. 22, 728-733 (2008).
- Tawk, M., Tuil, D., Torrente, Y., Vriz, S., Paulin, D. High-efficiency gene transfer into adult fish: a new tool to study fin regeneration. Genesis. 32, 27-31 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены