Method Article
リジェネアダルトゼブラフィッシュテールフィンにMorpholinos の in vivoエレクトロポレーションで
要約
我々は条件付きで大人のゼブラフィッシュヒレ再生時の標的タンパク質の発現をノックダウンする方法を説明します。この手法は、マイクロ注入と創傷治癒、芽の形成、再生伸長を含むフィン再生の様々な段階におけるタンパク質の役割をテストすることができ、フィン組織にアンチセンスオリゴヌクレオチドmorpholinosをelectroporatingが含まれます。
要約
urodelesと硬骨魚の特定の種がその組織を再生成することができます。ゼブラフィッシュは、このような心1、網膜2脊髄3、視神経4、感覚有毛細胞5、フィン6として、成体組織の自発的な再生を研究するために広く使われているモデルとなっています。
ゼブラフィッシュフィンを簡単に付加形成に複数の段階を研究するために操作される比較的単純な付属品です。創傷治癒、芽の形成、およびフィンの伸長:古典的には、フィンの再生は、3つの異なる段階で特徴付けられた。フィンの一部を切断するした後、周囲の上皮は増殖および創傷を介して移行されます。 33℃で、このプロセスは、6,7(HPA、 図1B)6時間後に切断以内に発生します。別の系統から、次の、基礎となる細胞(例:骨、血、グリア、線維芽細胞)の増殖芽を形成するために細胞周期を再入力し、Wを覆う表皮は( 図1D)8 を増殖し続けてhile。芽の基部の細胞が新たな組織( 図1E)8 を形成するために、それぞれの系統に再分化するように副産物が発生します。切断のレベルに応じて、完全な再生は月に一週間で完了します。
Wntシグナル、HOX、FGF、MSX、レチノイン酸、SHH、ノッチ、BMP、およびアクチビン-β遺伝子を含む遺伝子ファミリー、多数の式は、フィンの再生9-16特定の段階でアップレギュレートされています。しかし、再生時にこれらの遺伝子とその符号化されたタンパク質の役割は、タンパク質に特異的な阻害剤が13存在しない限り、野生型タンパク質または支配を、温度感受性変異体が存在するか、またはトランスジェニック動物(いずれかを過剰発現し、評価することは困難であった陰性蛋白質)は7,12を生成されました。我々develoPED迅速かつ容易にフィン再生中の任意の遺伝子の機能をテストするための逆遺伝学的手法。
モルフォリノオリゴヌクレオチドは、広くゼブラフィッシュ、 アフリカツメガエル 、ニワトリ、マウス開発17から19の間に特定のタンパク質の損失を勉強するために使用されます。ブロックはpre-mRNAのスプライシングやmRNAの翻訳のいずれかに相補的なRNA配列を持つMorpholinosの塩基対。我々は効率的に標的タンパク質のノックダウン式に再生ゼブラフィッシュフィンにフルオレセイン-タグセンスmorpholinosを導入する方法について説明します。モルホリノは再生ゼブラフィッシュテールフィンの各芽にマイクロ注入し、周囲の細胞にエレクトロポレーションされています。フルオレセインは、モルホリノをエレクトロポし、フィン組織のモルホリノを可視化するために電荷を提供します。
このプロトコルは、回生フィンの伸長中に特定のタンパク質の役割を調べるために、条件付きタンパク質のノックダウンを可能にします。 Discussioでnは、我々は、このアプローチは、創傷治癒や芽の形成と同様に、芽の形成時の細胞移動の潜在的なマーカーの間に特定のタンパク質の役割を研究するために適応させることができる方法について説明します。
プロトコル
1。再懸濁し、モルホリノ
- 約3 mM溶液を作るためにヌクレアーゼ·フリー水100μlのにフルオレセイン-タグモルホリノ300 nMの希釈します。モルホリノソリューションは、複数のパラフィン封止マイクロチューブに分注し、室温で保存され、光源から離れています。
- 正確なモルホリノ濃度を決定するために、0.1 N HClを95μlにモルホリノ溶液(または水空白など)の5μlを希釈する。水ブランクと265 nmでの分光光度計のベースラインを設定してから、希釈モルホリノソリューションのリーディングを決定します。 ng /μLの濃度を決定するために、その決定される定数で、希釈因子によるモルホリノ吸光度を乗算します。モルホリノ定数は次のように計算されます
モルホリノ定数モルホリノX 1000/molarの吸光度=分子量。
モルホリノの分子量とモル吸光度 "を見つけることができます製品に付属のオリゴのプロパティ "シートが。mMの濃度を決定するために分子量によって、ng /μLの。モルホリノを希釈し、必要に応じて、作業濃度に、通常は1.2 mmで、モルホリノ濃度を分割します。
2。フィンの切断
- Tricaineまたは水槽の水の1.0 mg / mlの2 - フェノキシエタノールのいずれかで大人のゼブラフィッシュを麻酔。
- 第一lepidotrichial分岐点に近接し、滅菌メスまたはカミソリ刃を用いてフィンを切断。これは、各動物の同じ遠/近の場所(例えば7セグメント骨フィンガードルから遠位)で行われる必要があります。重要:動物の後方/前方平面に完全に垂直に切断することを確認してください。斜めカットは、フィンの背側と腹側の半分の不均一なフィンの突起になります。
- タンクに魚を返します。我々は一般的に33で魚を維持°C再生率を増加させる。 W、実験デザインに応じてモルホリノを導入する前に開始するためにフィン再生のためのAIT 0から2日後に切断(DPA)。代替アプローチは、下記のディスカッションで議論されています。
3。モルホリノ注入
- 前のモルホリノを注入するの日は、注入プレート( 図2)を作る。マイクロインジェクションの手順のために魚を安定化させるだけでなく、次のいずれかの端にノッチをカットすることを確認します。
- DPA 2に、マイクロインジェクション装置及びモルホリノ溶液を調製。
- 5分間、適切な濃度(1.2 mMの始まることをお勧めします)と65°Cの水浴中で場所にフルオレセイン-タグモルホリノ希釈します。
- ニードルプラーを用いたマイクロインジェクション用ガラス針を引き抜きます。
- モルホリノがで針をロードする(注:お使いの針は、針が最初にロードする、または最初の先端を切るかどうかを判断しますあなたのバックフィルまたはフロントロードするかどうかによって異なります)。
- で、針の先端をカットオフn個の角。
- 注射当たりモルホリノの約5 NLのバブルを注入するために、マイクロインジェクションシステムの指示に従ってください。モルホリノの大きなボリュームには、組織を混乱させる可能性があります。
- 注入プレートの魚と場所を麻酔。すべての余分な液体と適切な場所に東洋の針を、骨の線( 図3)だけ遠位を削除します。モルホリノ注射(特異的試薬の表を参照)に適した顕微鏡とマイクロインジェクション装置を用いて、 図3に示すように、後部に前方からフィンにモルホリノを注入します。注入時にロールアップする後部から前部の原因にフィン組織を注入し、非常に困難です。
- それぞれの骨の線にちょうど遠位再生組織( 図3の"1"とマークされた)にそっと針を挿入して、芽( 図3の"2"とマークされた)に配置されるまで、遠位に押します。バスを介して針を押してしないように注意してくださいタイヤのフィン。針が正しくローカライズされている場合、(つまり1時間をクリックします)モルホリノを注入します。 1.2 mMとなるように、フルオレセイン-タグモルホリノソリューションは、さらに通常の光条件下で、黄緑色に表示されます。それぞれの注射で、モルホリノ液の黄色の "パフ"が可視化することができ、これは、芽に注射をローカライズするのに役立ちます。モルホリノ液の約75 NL(10-15クリック)は、骨の線ごとに注入する必要があります。一時停止〜クリックの間に1秒。私たちは、エレクトロポレーション専用コントロールとして腹を使用して、背側を注入します。あるいは、一つはフィンの腹側半分に制御モルホリノを使用して、この手順全体を繰り返すことができます。
4。モルホリノのエレクトロポレーション
- 直ちにモルホリノの注入後に、マイクロインジェクション装置から注入プレートを取り外します。魚が水没するまで、麻酔液でも注入プレートをご記入ください。エレクトロポレーションは、水行の下に実行されます。
- 3 mm径の白金板をピンセット電極(CUY 650-P3ピンセット、テック·インターナショナル)は、フィンの半分程度にパルスを局在化する。フィン組織に電極に触れないよう注意してください。電極がフィンの組織に触れていないことを確認するには、その背側の魚を回転させるとストレートエレクトロポレーションのための正中線を見下ろす。
- 背と腹の両方をエレクトロポCUY21方形波エレクトロ(テック·インターナショナル株式会社)を使用して、フィンの側面(非特定のエレクトロポレーションの効果を制御する)。に形成されている可能性のある気泡を除去するために、各エレクトロポレーション後の湿ったキムワイプで電極を拭いてください。それらが削除されていない場合は、ミニ電荷が蓄積され、電極に向かって組織を誘致れる。エレクトロポレーションパラメータは、パルス間の1秒の一時停止と15 Vで、10個の連続した50ミリ秒のパルスに設定する必要があります。
- nに確認しながら、フィンをスライドガラスまたはペトリ皿に魚を置き、すぐに画像背側/腹側方向をOTE。このイメージは、次の日に再生分析のために使用されます。タンクに魚を返します。
5。分析
- 式の中でノックダウンされた標的タンパク質は、適切なフィンの再生に必要な場合は、フィンの背側と腹側の半分の間に劇的な違いが明らかでなければなりません1日後にエレクトロポレーション( 図5B)。
- DPA 3では、それぞれの魚のひれの別の写真を撮ると、対応する2 DPAの画像( 図5B)でこのイメージを一致させます。動物の間にフィンの色素沈着パターンの自然な変動は、あなたが正しく、個々の魚を識別することができます。
- NIH Imageを使用して、両方の背側と腹側の半分( 図5B)の2 DPAと3 DPAエリアをトレースします。
- ( -背2dpa背3dpa)/(3dpa腹。 -背腹対の使用%の面積は次式を決定するには腹2dpa)X 100 =%の面積
6。代表的な結果
- 我々は常にDPA 3でフィンの伸長のためのアッセイ、または24 HPE(時間後にエレクトロポレーション)。この時点では、フルオレセイン-タグモルホリノはフィンの背側半分( 補足図1および図6A)で存在しなければならない。それはいくつかの切断のレベルにまで、後続するのは正常です。
- コントロールmorpholinos( 図6B)を注入し、エレクトロポレーションフィンの背腹両面に違いはありません。
- 実験的なモルホリノはフィンの伸長に不可欠なタンパク質をターゲットにしている場合、背側と腹側との間の劇的な違いは、( 図6C)観察されるべきである。
- 電極は、エレクトロポレーション中にフィンに触れた場合、組織は茶色(ほとんど外観に焼け)や壊死を表示されます。
"SRC =" / files/ftp_upload/3632/3632fig1.jpg "/>
図1。フィンの再生時に発生する各種イベントの模式図。各イベントの基礎となる時間が時間後に切断で与えられる(HPA)と33のタンクの温度に対応してい℃に
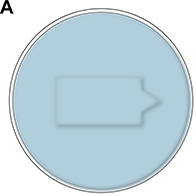
図2。A.アガロースから作られ、モルホリノのマイクロインジェクションの間に魚を保持するための小さな井戸を含んでいる注入プレートの模式図。
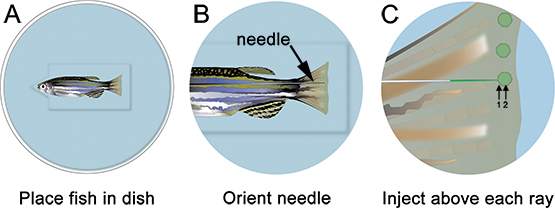
図3。モルホリノインジェクションの模式図。A.は場所ノッチの魚の頭と皿の中で魚が魚が安定した滞在を助けるだけでなく、外のカット。B.低倍率では、針を配置しているので、それはフィンの再生組織が 近くにあります。C. 高倍率では、各骨のフィン線(各芽内)から遠位モルホリノを注入します。針が骨の線(1)〜だけ遠位組織を入力して、芽(2)の場所に継続すべきである。注:回路図にある緑色の円が唯一の注射の場所を表示することになっています。モルホリノは、簡単に各注射後黄色/緑色の "パフ"として視覚化することができます。回路図に示すように、しかし、これは保持されません。
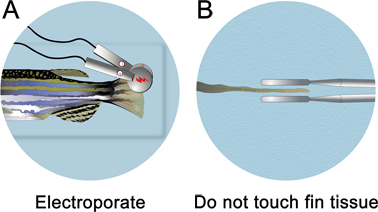
図4。フィンエレクトロポレーションの模式図。A.以下のマイクロインジェクション、麻酔の完全なペトリ皿に魚を置き、背側と腹側の両方の半分をエレクトロポ。B.はフィン組織には手を触れないようにしてください。電極は、組織から〜1ミリメートルを配置する必要があります。
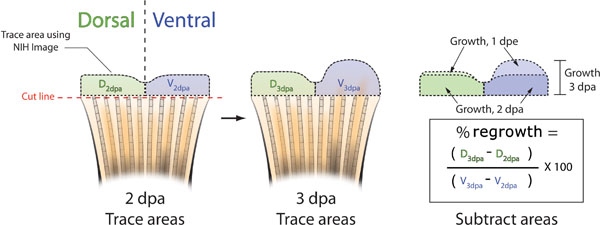
図5フィンの伸長阻害を計算するために使用される方法の回路図。A.は直ちにモルホリノ注入とエレクトロポレーションの前または後に、DPA 2でそれぞれの魚のひれの写真を撮る。背側(緑)とNIH Imageを用いたフィンの腹側(青)の半分、(黒破線)の両方の再生組織をトレースします。B.は、DPA 3では、各フィンの別の写真を撮影して、再度背腹の領域をトレースするNIH Imageを用いて再生する。C.は、背腹両方持てる3 DPAでの合計再生から2 DPAでの再生の面積を減算します。背対腹再成長のパーセントの面積を式を用いて計算することができます:((D 3dpa - D DPA 2)/(V 3dpa - V 2dpa))X 100。 %阻害= 100 - パーセントエリア。
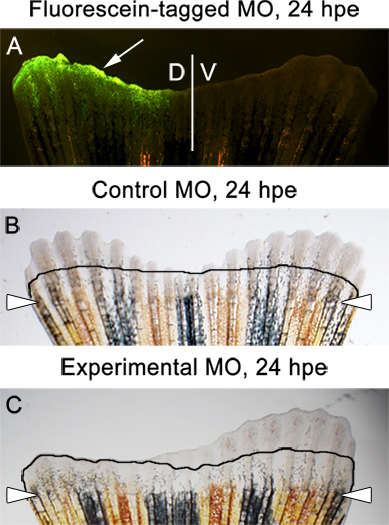
図6期待の例成果。フィンの背側半分にフルオレセイン-タグ制御モルホリノ、24時間後にエレクトロポレーション(HPE)を示すA.蛍光画像。背側半分に制御モルホリノを注入し、エレクトロポレーションされたフィンのB.明視野像。イメージは、フィンの背側と腹側の半分の両方の同じ再生、背側半分に実験的なモルホリノを注入し、エレクトロポレーションされたフィンの24 HPE℃ で明視野像を示す。イメージは、注入/背側の再生の阻害を示す。行は、モルホリノ注入、エレクトロ〜2 DPA、直前に再生量を示しています。
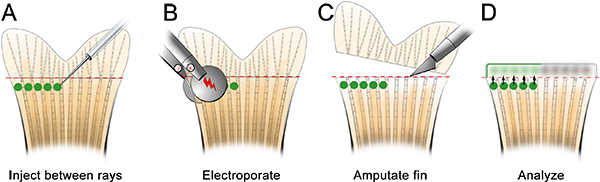
図7は創傷治癒や芽の形成に関与する標的タンパク質への代替注入、エレクトロポレーション手順の模式図。A.は、モルホリノを注入フィンの背側半分の各骨のフィン線の間に。B.は、通常どおりモルホリノをエレクトロポ。C.は、注射部位に(〜1骨質のセグメント)すぐに近フィンを切断。D.フルオレセインタグ付きモルホリノを観察することができる24 HPEでの創傷上皮と芽インチ
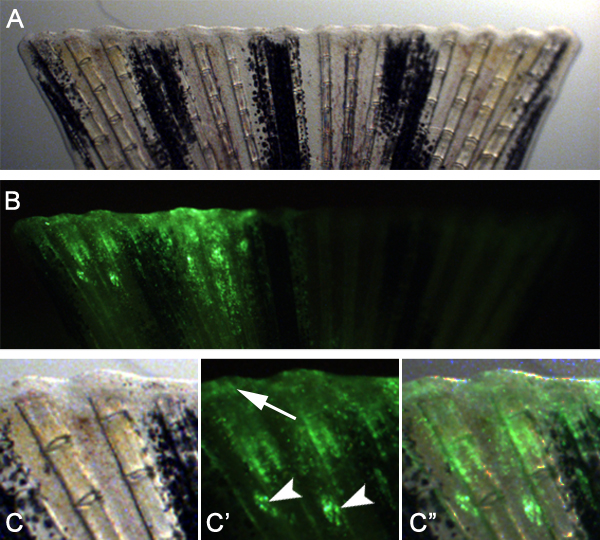
図8。傷上皮と芽の形成を対象とする技術を使用します。直前に切断に制御モルホリノを注入し、エレクトロポレートした24 hPaでフィンのA.明視野像。パネルA.注に示すように、フィンのB.蛍光画像フィンの注入された背側半分には、再生組織におけるモルホリノの良い摂取を示している。 C - パネルに示すように、フィンの背側半分のC "高倍率AとBの注射部位は、多くの場合、まだ表示されている(矢頭)しかし、多くの標的細胞は、創傷の上皮芽の形成(矢印)に参加するために移行しています。
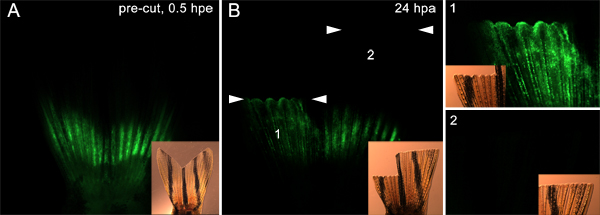
図9。芽。A.蛍光と背側と腹側半分の両方で注入し、モルホリノでエレクトロフィンを示す明視野はめ込み画像を形成するために移行する細胞を標的とする技術を使用します。フィンは、2つの平面で切断されました。背側半分は腹側半分は注射部位から遠位の9月10日骨のセグメントをカットされた場所として、注射部位のすぐ遠位切断した。B.は 24 hPaで、蛍光と明視野はめ込み画像は、モルホリノ背側に移行したことを示す(1)を再生成ではなく、腹側を再生成、(2)切断部位のすぐ近位のみ細胞が芽の形成に関与することを示しています。白い矢印の2つのセットは、それぞれの切断のレベルを表示する飛行機。パネルは、それぞれ、フィンの背側と腹側の半分の高倍率のビューを表示する画像の右端に1と2をマーク。
補足図1。注入と制御モルホリノでエレクトロフィンの芽の位置に対応する領域の焦点Z-スタックのビデオ。画像は24 HPEで撮影された。単一のフルオレセイン分子を可視化することができないので、すべてではないモルホリノの可視化や定量化することができます。ただし、これらのイメージは、個々の点状のドットから、蛍光モルホリノの完全な全体の細胞に、細胞内で可視化することができる吸収の度合いのいくつかのアイデアを与える。静止画では、方向が示されています。スケールバー:25ミクロンである。
ディスカッション
ここでは、成体ゼブラフィッシュのヒレ再生時に興味のある条件付きでノックダウンのタンパク質への強力な機能喪失のアプローチを説明します。この手法は、回生フィン伸長16、20-22の間にギャップ結合遺伝子、シグナル伝達受容体、転写因子、およびマイクロRNAを研究するために使用されています。
我々は、この技術はまた技術を適応することによって創傷治癒と芽の形成に必要な遺伝子を研究するために使用できることを期待しています。例えば、我々は注入し、前に切断します( 図7)フィンの背側半分に骨の鰭の間の空間に制御モルホリノをエレクトロポレーション。次に、射出面に直ちに遠位フィンを切断。 24 HPAは、再生のこれらの初期段階で細胞もターグできることを示し、モルホリノ標的細胞が傷上皮と芽( 図8)の両方を形成するために、遠位に移行したことを観察しeted。
テクニックはいくつか注目すべき制限があります。例えば、フルオレセインタグからの蛍光は、それが不可能な細胞内に存在するモルホリノの量と特定の細胞の表現型(すなわち、細胞増殖)と相関することができる免疫組織化学について、次の固定および処理を保持していません。前のグループは、フィンの組織23にDNAの正常なエレクトロポレーションを報告しましたが、加えて、我々は、一貫して再生尾びれにプラスミドのエレクトロポレーションを達成することができませんでした。最後に、我々はモルホリノだけ新しい細胞型の分化に関与する遺伝子をテストするために、現在の形でこのテクニックを使用して禁止している〜48時間後にエレクトロ21日に有効であることを指摘している。手順の追加のテストおよび修正は、これらの現在の限界を克服することができます。
また、この手法が使用される可能性がある基本的な組織からの芽への細胞遊走に関与するタンパク質をテストすることができます。たとえば、我々は、注入され、切断する前にフィンの両側( 図7参照)に制御モルホリノをエレクトロポレーション。次に、射出面に直ちに遠位フィンの背側半分を切断し、我々ははるかに遠位に腹びれを切断。 24 hPaで、背側モルホリノ-陽性細胞は注射部位から覆う傷上皮と芽に移行しました。しかし、それは腹側( 図9)のケースではなかった。これは、切断面を貫く唯一の細胞は再生応答に関与するという考えをサポートしています。これらのデータはまた、細胞移動に必要であることが仮説を立てたタンパク質は、この手法を使ってテストすることが示唆された。
開示事項
我々は、開示することは何もありません。
謝辞
著者らは、ゼブラフィッシュの彼らのケアとメンテナンスのためにゼブラフィッシュの研究スタッフがFreimannライフサイエンスセンター、センターに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| CUY21-EDITまたはCUY21-SC方形波エレクトロ | テックインターナショナル | CUY21EDITまたはCUY21SC | 両方のユニットは、このプロトコルのために働く |
| 3 mm径のパドル電極 | テックインターナショナル | CUY 650-P3 | |
| モルホリノ | GeneTools、LLC | モルホリノは、目的のタンパク質にカスタム設計する必要があります | |
| 2 - フェノキシエタノール | シグマ | 77861-1L | 麻酔、手順については、魚系の水で希釈1:1000、安楽死のために1:500 |
| マイクロinjectiポンプの | 世界の精密機器 | PV830空気圧PicoPump | 多くの異なるマイクロインジェクションシステムが使用することができる。 |
| マイクロマニピュレータ | 世界の精密機器 | MMJR | 右利き(左利きのためのMMJL) |
| マイクロ注射針、外径1.0ミリメートル | 世界の精密機器 | 1B100F-4 | これらは、針に引き込まホウケイ酸ガラス毛細管であり、 |
| ニードルホルダー | 世界の精密機器 | 5430-ALL | ピコノズルキット、はめ込み1.0ミリメートルピペットガスケットに確認してください |
| ニードルプラー | サッター | P-97 | 他のマイクロピペット/針引き手でも動作するはずです |
| 顕微鏡 | ライカ、ニコン、ツァイスの | 数はメーカーによって異なります | 20X光学を持つ任意の実体顕微鏡とマニピュレーターを操作する能力 |
参考文献
- Poss, K. D. Getting to the heart of regeneration in zebrafish. Semin. Cell Dev. Biol. 18, 36-45 (2007).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. J. Neurobiol. 44, 289-307 (2000).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. J. Comp. Neurol. 377, 577-595 (1997).
- Becker, C. G., Becker, T. Repellent guidance of regenerating optic axons by chondroitin sulfate glycosaminoglycans in zebrafish. J. Neurosci. 22, 842-853 (2002).
- Lopez-Schier, H., Hudspeth, A. J. A two-step mechanism underlies the planar polarization of regenerating sensory hair cells. Proc. Natl. Acad. Sci. U.S.A. 103, 18615-1820 (2006).
- Johnson, S. L., Weston, J. A. Temperature-sensitive mutations that cause stage-specific defects in Zebrafish fin regeneration. Genetics. 141, 1583-1595 (1995).
- Nechiporuk, A., Poss, K. D., Johnson, S. L., Keating, M. T. Positional cloning of a temperature-sensitive mutant emmental reveals a role for sly1 during cell proliferation in zebrafish fin regeneration. Dev. Biol. 258, 291-306 (2003).
- Tu, S., Johnson, S. L. Fate restriction in the growing and regenerating zebrafish fin. Dev. Cell. 20, 725-732 (2011).
- Geraudie, J., Ferretti, P. Correlation between RA-induced apoptosis and patterning defects in regenerating fins and limbs. Int. J. Dev. Biol. 41, 529-532 (1997).
- Jazwinska, A., Badakov, R., Keating, M. T. Activin-betaA signaling is required for zebrafish fin regeneration. Curr. Biol. 17, 1390-1395 (2007).
- Laforest, L., Brown, C. W., Poleo, G., Geraudie, J., Tada, M., Ekker, M., Akimenko, M. A. Involvement of the sonic hedgehog, patched 1 and bmp2 genes in patterning of the zebrafish dermal fin rays. Development. 125, 4175-4178 (1998).
- Lee, Y., Grill, S., Sanchez, A., Murphy-Ryan, M., Poss, K. D. Fgf signaling instructs position-dependent growth rate during zebrafish fin regeneration. Development. 132, 5173-5183 (2005).
- Poss, K. D., Shen, J., Nechiporuk, A., McMahon, G., Thisse, B., Thisse, C., Keating, M. T. Roles for Fgf signaling during zebrafish fin regeneration. Dev. Biol. 222, 347-358 (2000).
- Raya, A., Koth, C. M., Buscher, D., Kawakami, Y., Itoh, T., Raya, R. M., Sternik, G., Tsai, H. J., Rodriguez-Esteban, C., Izpisua-Belmonte, J. C. Activation of Notch signaling pathway precedes heart regeneration in zebrafish. Proc. Natl. Acad. Sci. U.S.A. 100, 11889-11895 (2003).
- Smith, A., Avaron, F., Guay, D., Padhi, B. K., Akimenko, M. A. Inhibition of BMP signaling during zebrafish fin regeneration disrupts fin growth and scleroblasts differentiation and function. Dev Biol. 299, 438-454 (2006).
- Thummel, R., Li, L., Tanase, C., Sarras, M. P., Godwin, A. R. Differences in expression pattern and function between zebrafish hoxc13 orthologs: recruitment of Hoxc13b into an early embryonic role. Dev. Biol. 274, 318-333 (2004).
- Coonrod, S. A., Bolling, L. C., Wright, P. W., Visconti, P. E., Herr, J. C. A morpholino phenocopy of the mouse mos mutation. Genesis. 30, 198-200 (2001).
- Heasman, J., Kofron, M., Wylie, C. Beta-catenin signaling activity dissected in the early Xenopus embryo: a novel antisense approach. Dev. Biol. 222, 124-134 (2000).
- Nasevicius, A., Ekker, S. C. Effective targeted gene knockdown in zebrafish. Nat. Genet. 26, 216-2120 (2000).
- Hoptak-Solga, A. D., Nielsen, S., Jain, I., Thummel, R., Hyde, D. R., Iovine, M. K. Connexin43 (GJA1) is required in the population of dividing cells during fin regeneration. Dev. Biol. 317, 541-548 (2008).
- Thummel, R., Bai, S., Sarras, M. P., Song, P., McDermott, J., Brewer, J., Perry, M., Zhang, X., Hyde, D. R., Godwin, A. R. Inhibition of zebrafish fin regeneration using in vivo electroporation of morpholinos against fgfr1 and msxb. Dev. Dyn. 235, 336-346 (2006).
- Yin, V. P., Thomson, J. M., Thummel, R., Hyde, D. R., Hammond, S. M., Poss, K. D. Fgf-dependent depletion of microRNA-133 promotes appendage regeneration in zebrafish. Genes Dev. 22, 728-733 (2008).
- Tawk, M., Tuil, D., Torrente, Y., Vriz, S., Paulin, D. High-efficiency gene transfer into adult fish: a new tool to study fin regeneration. Genesis. 32, 27-31 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved