Method Article
Yenileyici Yetişkin Zebra balığı Tail Fin içine Morpholinos in vivo olarak Elektroporasyon
Bu Makalede
Özet
Biz, koşullu yetişkin zebrabalıkları fin rejenerasyon sırasında bir hedef protein ifadesini demonte için bir yöntem açıklanmaktadır. Bu teknik, mikro-enjeksiyon ve yara iyileşmesi, blastem oluşumu ve rejeneratif akıbet de dahil olmak üzere yüzgeç yenilenmesi çeşitli aşamalarında, proteinin rolünü test verir fin dokuya antisens oligonükleotid morpholinos electroporating içerir.
Özet
Urodeles ve teleost balık Belli türler kendi dokularını yenilemek olabilir. Zebra balığı, kalp 1, retina 2, omurilik 3, optik sinir 4, duyusal kıl hücreleri 5, 6 ve yüzgeçleri gibi yetişkin dokuların spontan rejenerasyon incelemek için yaygın olarak kullanılan bir modeli haline gelmiştir.
Zebra balığı yüzgeci kolayca epimorphic rejenerasyon çoklu aşamalar okumak için manipüle edilir nispeten basit bir apendiks olduğunu. Yara iyileşmesi, blastem oluşumu ve fin akıbet: Klasik olarak, yüzgeç yenilenmesi üç farklı aşamaları ile karakterize edildi. Fin parçası amputating sonra, çevredeki epitel çoğalan ve yara üzerinde geçirir. 33 ° C'de, bu süreç 6,7 (hpa, Şekil 1B) altı saat sonrası amputasyon içinde oluşur. Farklı soy (örneğin kemik, kan, glia, fibroblast) dan sonra, altta yatan hücreleri yeniden girin hücre döngüsü proliferatif blastem, w oluşturmak içinörten epidermis (Şekil 1D) 8 çoğalmaya devam Hile. Blastem proksimalinde hücrelerin yeni doku (Şekil 1E) 8 oluşturmak için kendi soy içine yeniden ayrım olarak akıbet oluşur. Amputasyon seviyesine bağlı olarak, tam bir yenilenme, bir ay bir hafta içinde tamamlanıyor.
Wnt, HOX, FGF, msx, retinoik asit, şşş, çentik, bmp ve aktivin-beta A genleri içeren gen ailelerinin çok sayıda, ifadesi yüzgeç yenilenmesi 9-16 belirli aşamalarında up-regüle olduğunu. Proteini için özel bir inhibitörü 13 bulunmadığı sürece Bununla birlikte, rejenerasyon esnasında bu genlerin ve bunların kodlanmış proteinlerin rolleri, değerlendirmek için zor olmuştur, bir ısıya duyarlı mutant mevcut ya da bir transjenik hayvanların (ya da aşırı vahşi tip proteini veya bir baskın -negatif protein) 7,12 oluşturulmuştur. Biz developed ters genetik tekniği hızlı ve kolay bir yüzgeç yenilenmesi sırasında herhangi bir genin işlevini test etmek.
Morfolino oligonükleotidler yaygın zebrabalıkları, Xenopus, civciv, fare ve gelişimi 17-19 sırasında spesifik proteinlerin kaybı incelemek için kullanılır. Blok pre-mRNA veya mRNA raptetme için iki tamamlayıcı bir RNA sekansı olan Morpholinos basepair. Biz verimli hedef proteinin Knockdown ifade yenileyici zebrabalıkları yüzgeçleri içine floresein etiketli antisens morpholinos tanıtmak için bir metodu tanımlar. Morfolino yenileyici zebrabalıkları kuyruk yüzgecinin her blastem içine mikro-enjeksiyon ve çevresindeki hücrelerin içine electroporated edilir. Floresein morfolino electroporate ve fin dokuda morfolino görselleştirme şarj sağlar.
Bu protokol rejeneratif fin akıbet sırasında spesifik proteinlerin rolünü incelemek için koşullu protein devirme izin verir. Discussio yılından, bu yaklaşım, yara iyileşmesi veya blastem oluşumu gibi blastem oluşumu esnasında hücre göçü potansiyel bir belirteç içerisinde özel proteinlerin bir rol incelemek için adapte edilebilir açıklanmıştır.
Protokol
1. Pastör pipetiyle morfolino
- Yaklaşık 3 mM çözümü için nükleaz ücretsiz su 100 ul içine floresein etiketli morfolino 300 nM sulandırınız. Morfolino çözeltisi birden parafin-sızdırmaz mikrosantrifüj tüpler içine bölünüp, oda sıcaklığında ve ışıktan uzak saklanır.
- Kesin morfolino konsantrasyonunu belirlemek için, 0.1 N HCI içinde 95 ul içerisinde morfolino çözeltisi 5 ul (ya da boş bir şekilde su) seyreltik. Su boş olan 265 nm'de spektrofotometre bir başlangıç ayarlayın ve daha sonra seyreltilmiş morfolino çözüm okuma belirler. Ul / ng konsantrasyonunu belirlemek için kendi sabit tarafından belirlenir ve seyreltme faktörü ile morfolino absorbans çarpın. Morfolino sabit olarak hesaplanır:
Morfolino sabit morfolino X 1000/molar absorbans = molekül ağırlığı.
Morfolino için moleküler ağırlığa ve molar absorbans "bulunabilirÜrün ile sağlanan Oligo Properties "levha. MM konsantrasyonunu belirlemek için moleküler ağırlık itibariyle, ul / ng. Morfolino seyreltilir, gerekli ise, çalışan bir konsantrasyonu için, tipik olarak 1.2 mM, morfolino konsantrasyonu bölünür.
2. Fin Amputasyon
- Tricaine veya tank su içinde 1.0 mg / ml 2-fenoksietanol birinde yetişkin zebrabalıkları uyutmak.
- İlk lepidotrichial dallanma noktasına proksimal steril bir bistüri veya jilet kullanarak fin organını. Bu her hayvan aynı distal / proksimal yerde (fin kuşak gelen distal örneğin 7 kemikli parça) yapılmalıdır. ÖNEMLİ: hayvanın anterior / posterior düzlemine mükemmel dik olarak kesilmiş emin olun. Açılı kesim yüzgecinin dorsal ve ventral yarısı dengesiz fin akıbet neden olacaktır.
- Bir tank için balık dönün. Bu tipik olarak 33 de balık muhafaza ° C'ye dönüşüm oranını artırmak için. W, deney tasarımı bağlı olarakfin yenilenme ait 0-2 gün sonrası amputasyon (dpa) morfolino tanıtan önce başlamak. Alternatif yaklaşımlar altında, Tartışma tartışılmıştır.
3. Morfolino Enjeksiyon
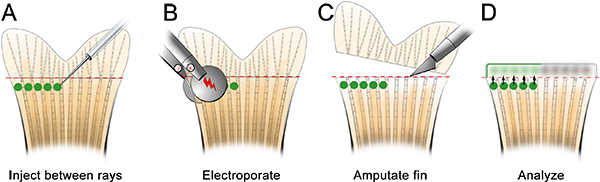
- Önce morfolino enjekte gün, bir enjeksiyon plakası (Şekil 2) olun. Mikroenjeksiyon işlemi için balık stabilize yardımcı olur iyi, bir ucunda bir çentik kesip emin olun.
- 2 dpa anda, mikro-enjeksiyon cihazı ve morfolino solüsyon hazırlanır.
- 5 dakika için, uygun konsantrasyonu (1.2 mM ile başlayan öneririz) ve 65 ° C su banyosunda yere floresein etiketli morfolino sulandırınız.
- Bir iğne kullanılarak çekme mikrokontrolör enjeksiyon için cam iğne çıkarın.
- Morfolino ile iğne yükleyin (not: Eğer iğne iğne ilk yüklemek, ya da ilk ucu kesilmiş olup olmadığını belirlemek size geri dolgu veya ön yük olmasına bağlı olarak).
- Bir de iğne ucu kapalı Kesn açısı.
- Enjeksiyon başına morfolino bir yaklaşık 5 nl kabarcığı enjekte etmek için mikro-enjeksiyon sistemi yönergeleri izleyin. Morfolino daha hacimli doku bozabilir.
- Enjeksiyon plaka üzerinde balık ve yer uyutmak. Tüm fazla sıvı ve uygun konuma yönlendirmek iğne, kemik ışını (Şekil 3) hemen distalinde çıkarın. Morfolino enjeksiyonlar (Spesifik Reaktifler Tablo bakınız) için uygun bir mikroskop ve mikroenjeksiyon aparatı kullanarak, Şekil 3'te gösterildiği gibi, arka üzere ön gelen kanat içine enjekte morfolino. Posteriordan anteriora enjekte fin doku enjeksiyonu sırasında rulo neden olur ve çok zordur.
- Her kemik ray hemen distalinde yenileyen dokuların, (Şekil 3 "1" işaretli) içine hafifçe iğne takın ve (Şekil 3 "2" işaretli) blastem yer kadar distale itmek. Tr ile iğne itmek için dikkatli olunlastik fin. İğne doğru lokalize, (yani bir kez tıklayın) morfolino enjekte edin. 1.2 mM, floresein etiketli morfolino çözüm bile normal ışık koşullarında, sarı-yeşil görünür. Her enjeksiyon ile, morfolino çözeltisi sarı bir "puf" görüntülenmiştir olabilir, ki blastem için enjeksiyon lokalize yardımcı olur. Morfolino çözüm yaklaşık 75 nl (10-15 tıklama) kemik ray başına enjekte edilmelidir. Duraklat ~ tıklamalar arasında 1 sn. Biz elektroporasyon sadece kontrol olarak ventral kullanarak, sırt tarafında sadece enjekte. Alternatif olarak, bir fin ventral yarısında bir kontrol morfolino kullanarak tüm bu işlemi tekrarlayın olabilir.
4. Morfolino ve Elektroporasyon
- Hemen morfolino enjeksiyonu takiben, mikro-enjeksiyon aparatı ile enjeksiyon plakasını çıkarın. Balık daldırılmış kadar anestezi çözeltisi ile iyi püskürtme plakası doldurun. Elektroporasyon su hattı altında yapılır.
- A 3 mm çapında platin plak cımbız elektrot (CUY 650-P3 cımbız, Protech International) fin yaklaşık bir buçuk katı kadar darbe lokalize. Fin dokuya elektrotlar dokunmamaya dikkat edin. Elektrotlar fin doku temas etmediğinden emin olmak için, onun sırt tarafında balık döndürmek ve düz elektroporasyon için orta hatta aşağı bakmak.
- Electroporate hem dorsal ve ventral yüzgeç kenarlarında bir CUY21 Kare Dalga Elektroporatör (Protech International, Inc) kullanarak (non-spesifik elektroporasyon etkisini kontrol etmek için). Birikmiş olabilecek kabarcıklarını çıkarmak için her elektroporasyon sonra nemli bir KimWipe ile elektrotları siliniz. Onlar kaldırılmaz ise, bir mini-şarj kurar, elektrot doğru doku çekecek olan. Elektroporasyon parametreleri darbeler arasında 1 sn duraklama ile 15 V, peş peşe on 50 ms darbe olarak ayarlanması gerekir.
- N dikkat ederek, bir cam slayt veya Petri tabağına balık ve hızlı görüntü fin yerleştirindorsal / ventral yönelim OT. Bu resim ertesi gün büyütme analizi için kullanılacaktır. Tanka balık dönün.
5.. Analiz
- Ifade yıkıldığında hedef proteinin düzgün yüzgeç yenilenmesi için gerekli ise, fin dorsal ve ventral yarısı arasında dramatik bir fark açık olmalıdır 1 gün sonrası elektroporasyon (Şekil 5B).
- 3 dpa, her balığın yüzgeci Başka bir resim çekmek ve ilgili 2 dpa görüntü (Şekil 5B) ile bu görüntüyü maç. Hayvanlar arasındaki fin pigmentasyon desende doğal varyasyon doğru bireysel balık tanımanızı sağlayacak.
- NIH Image kullanarak, hem dorsal ve ventral yarısı (Şekil 5B) ve 2 dpa ve 3 dpa alanlarını izleyebilecek.
- Dorsal karşılık ventral kullanılması, aşağıdaki formül ile% bölgeyi belirlemek için: (- dorsal 2dpa dorsal 3dpa) / (3dpa ventral - Ventral 2dpa) X 100 =% alanı
6. Temsilcisi Sonuçlar
- 3 dpa, veya 24 HPE (saat sonrası elektroporasyon) de fin akıbet için Biz her zaman tayini. Bu zamanda, floresein-etiketli morfolino fin dorsal yarısı (Ek Şekil 1 ve Şekil 6A) mevcut olması gerekir. Bazı amputasyon seviyesinin aşağı eğik görmek normaldir.
- Enjekte edilir ve denetim morpholinos (Şekil 6B) ile electroporated FIN dorsal ve ventral tarafı arasında fark yok olması gerekir.
- Deneysel morfolino fin akıbet için önemli bir protein hedefliyorsa, dorsal ve ventral taraf arasında dramatik bir fark (Şekil 6C) dikkat edilmelidir.
- Elektrot elektroporasyon sırasında fin dokundu ise, doku kahverengi (neredeyse görünüm yakılarak) ve nekrotik görünecektir.
"Src =" / files/ftp_upload/3632/3632fig1.jpg "/>
Şekil 1. Yüzgeç yenilenmesi sırasında meydana gelen çeşitli olayların şematik. Her olay için altta yatan kez saat sonrası amputasyon (hpa) verilen ve 33 bir tank sıcaklığı karşılık ° C olan
Şekil 2. A. Agaroz yapılmış ve morfolino mikroenjeksiyonu sırasında balığın tutmak için de, küçük bir içerir enjeksiyon plakası, şematik.
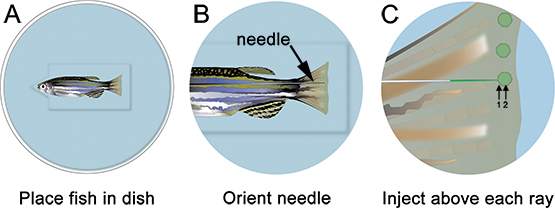
Şekil 3. Morfolino mikroenjeksiyon şematik. A. Yeri çentik içinde balık kafası ile yemekte balık balık stabil kalmanıza yardımcı olacak iyi, kesilmiş. B. Küçük büyütmede, iğne düzenlemek, böylece Bu yüzgecinin yenileyici doku yakındır. C. , her kemik fin ray (her blastem yani) distalinde morfolino enjekte edin. Iğne kemik ışını (1) hemen distalinde doku girin ve ardından blastem (2) konumunu devam etmelidir. Not: Şemada yeşil çevrelerde sadece enjeksiyon yerini göstermek içindir. Kısaca, her morfolino enjeksiyonu takiben bir sarı / yeşil "puf" olarak görüntülenmiştir olabilir; şematik olarak gösterildiği gibi, ancak, bu devam etmez.
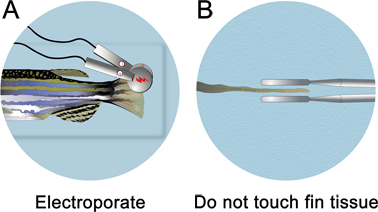
Şekil 4. Fin elektroporasyon şematik. A. mikroenjeksiyon, anestezi dolu bir Petri kabındaki balık yerleştirin ve dorsal ve ventral yarıya hem electroporate. B. fin doku dokunmayın emin olun. Elektrotlar dokudan ~ 1 mm yerleştirilmelidir.
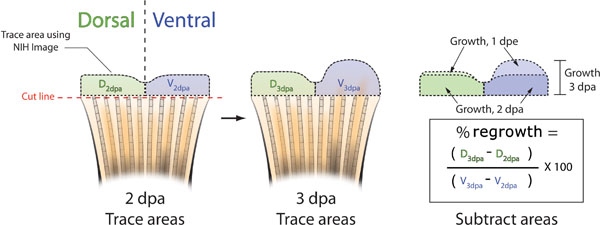
Şekil 5. Fin üremeyi inhibe hesaplamak için kullanılan yöntemler şematik. A. 2 dpa hemen önce veya sonra morfolino enjeksiyon ve elektroporasyon her balık yüzgeci Bir resim çekin. Dorsal (yeşil) ve 3 dpa anda NIH Image (siyah kesik çizgiler). B. kullanarak fin ventral (mavi) yarısı hem yenileyen dokuların Trace, her yüzgecinin Başka bir resim çekmek ve tekrar dorsal ve ventral bölgelerde iz NIH Image kullanarak yeniden büyüme. C. dorsal ve ventral gerekenler hem de 3 dpa de toplam büyütme 2 dpa de yeniden büyüme alanı çıkarın. Dorsal karşı yeniden büyüme ventral ve yüzde alanı formül kullanılarak hesaplanabilir: ((D 3dpa - D dpa 2) / (V 3dpa - V 2dpa)) X 100. Yüzde inhibisyon = 100 - Yüzde Alan.
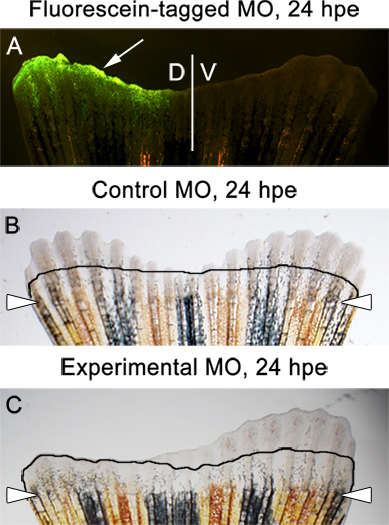
Beklenen Şekil 6. Örneklersonuçlar. fin dorsal yarısında floresein etiketli kontrolü morfolino gösteren A. Floresan görüntü, dorsal yarısında enjekte edilir ve bir kontrol morfolino ile electroporated bir yüzgecinin 24 saat sonrası elektroporasyon (HPE). B. aydınlık görüntü . Görüntü bir yüzgeç, 24 HPE dorsal ve ventral yarısı iki eşit büyütme gösterir. Dorsal yarısında deneysel bir morfolino enjeksiyonu ve electroporated bir yüzgeç C. aydınlık görüntü. Görüntü enjekte / sırt tarafında yeniden büyüme inhibisyonu gösterir. Çizgi morfolino enjeksiyon ve elektroporasyon 2 dpa, hemen önce de yeniden büyüme miktarını gösterir.
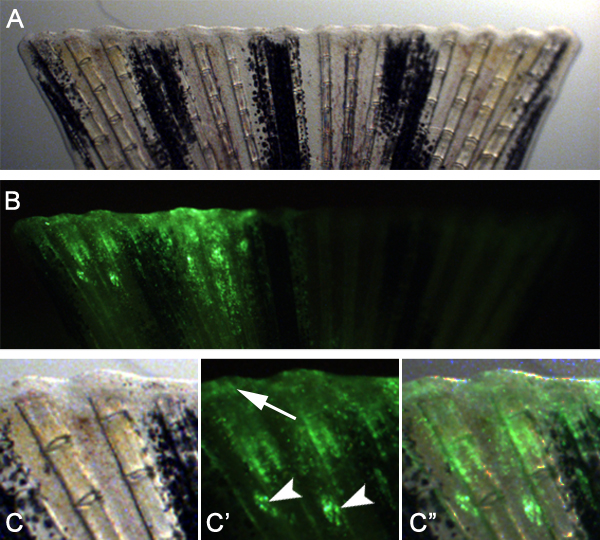
Şekil 7. Yara iyileşmesi ve blastem oluşumunda yer alan hedef proteinlere alternatif bir enjeksiyon ve elektroporasyon prosedürü şematik. A. morfolino enjekteyüzgecinin dorsal yarısında her kemik fin ray arasında. B. Normal başına morfolino Electroporate. C. enjeksiyon sitesine (~ 1 kemik segment) hemen proksimal fin organını. D. floresein etiketli morfolino görülebilir 24 HPE yara epitel ve blastem içinde.
Yüzgecinin hemen önce amputasyon için enjekte edilir ve bir kontrol morfolino ile electroporated edildi 24 hpa bir fin Şekil 8. Yara epitel ve blastem oluşumu hedef tekniği kullanarak. A. aydınlık görüntü. B. Floresan görüntü paneli A. Not gösterilir yüzgecinin enjekte dorsal yarısı rejeneratif doku morfolino iyi alımını gösterir. C -. Panelleri gösterilen fin dorsal yarısı C "Yükseköğretim büyütme A ve B enjeksiyon siteler genellikle hala görülebilir (ok), Ancak birçok hedeflenen hücreler yara epitel ve blastem formasyonu (ok) katılmak üzere göç etmiştir.
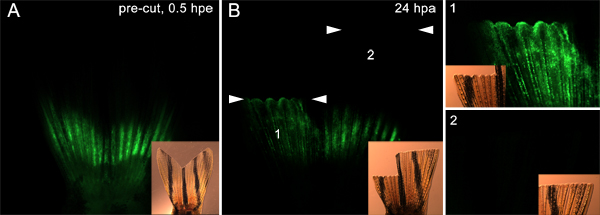
Şekil 9. Blastem. A. Floresan ve dorsal ve ventral yarıya hem enjekte ve morfolino ile electroporated bir yüzgeç gösteren aydınlık içerlek görüntüleri oluşturmak için göç hücreleri hedef tekniği kullanarak. Fin sonra iki uçak da ampute edildi. Dorsal yarısı ventral yarısında enjeksiyon sitelere distal 9-10 kemik segmentleri kesme nerede gibi, enjeksiyon sitelere hemen distalinde kesildi. B. 24 hpa anda, floresan ve aydınlık inset görüntüleri morfolino dorsal göç ettiğini gösteriyor (1), ancak ventral regenerate (2), kesme sitenin hemen proksimal tek hücre formasyonu blastem katılma belirten olmayan rejenere. Beyaz ok uçları ve iki set amputasyon seviyesini gösterirdüzlemi. Paneller sırasıyla yüzgecinin dorsal ve ventral yarıya daha yüksek bir büyütme gösteren resmin sağında 1 ve 2 olarak işaretlenmiş.
Ek Şekil 1. enjekte edilir ve bir kontrol morfolino ile electroporated bir yüzgeç bir blastem yerini karşılık gelen bir bölge konfokal z-yığının bir video. Resim 24 HPE çekilmiştir. Tek bir floresein molekül görüntülenebilmekte olamaz yana, tüm morfolino ve görselleştirilmiş sayısal veya yazılı olabilir. Ancak, bu görüntülerin floresan morfolino dolu tüm hücreleri tek tek noktasal nokta hücreleri, içinde görüntülenebilmekte alımını değişen derecelerde bir fikir vermek. Hareketsiz görüntü üzerinde yönlendirme gösterilir. Ölçek çubuğu: 25 mikron.
Tartışmalar
Burada, yetişkin zebrabalıkları içinde yüzgeç yenilenmesi sırasında ilgi şartlı Knockdown proteinlerine güçlü bir kayıp fonksiyon-yaklaşımını sunduk. Bu teknik, rejeneratif fin akıbet 16, 20-22 sırasında reseptörleri, transkripsiyon faktörleri ve microRNA sinyalizasyon, gap junction genlerin incelemek için kullanılmıştır.
Bu teknik aynı zamanda teknik uyarlayarak yara iyileşmesi ve blastem oluşumu için gerekli genleri çalışmak için kullanılabileceğini tahmin ediyoruz. Örneğin, enjekte ve (Şekil 7) önce amputasyon yüzgecinin dorsal yarısında kemik yüzgeç ışını arasındaki boşlukta bir kontrol morfolino electroporated. Daha sonra enjeksiyon düzlemine hemen distalinde fin ampute. 24 hpa, biz rejenerasyon bu erken aşamalarında hücreler de Targ edilebilir belirten morfolino hedefli hücreleri yara epitel ve blastem (Şekil 8) hem de oluşturmak için distale göç ettiği görülmektediryönetişimi.
Tekniği birkaç önemli sınırlamalar vardır. Örneğin, floresein etiketinden floresans imkansız bir hücrede mevcut morfolino miktarı ile belirli bir hücresel fenotip (yani hücre çoğalması) ilişkilendirmek için yapar immünhistokimya için aşağıdaki tespit ve işleme devam etmez. Bir önceki grup yüzgeci doku 23 içine DNA başarılı elektroporasyon rapor yaptı rağmen ek olarak, biz, sürekli yenilenme kuyruk içine plazmidlerin elektroporasyon ulaşmak mümkün olmuştur. Son olarak, morfolino ~ 48 saat yeni hücre türlerinin farklılaşma ilgili genler test etmek için şu anki haliyle bu tekniği kullanarak yasaklamaktadır yazılan elektroporasyon 21, sadece etkili olduğunu kaydetti var. Prosedürün Ek test ve modifikasyon bu mevcut sınırlamalar üstesinden gelebilir.
Buna ek olarak, bu yöntem kullanılabilir olması mümkündüraltta yatan doku blastem için hücre göçü ile ilgili proteinleri test etmek. Örneğin, enjekte edilir ve amputasyon öncesinde kanatçık arasında her iki tarafta (Şekil 7'de tarif) içine bir kontrol morfolino electroporated. Daha sonra enjeksiyon düzlemine hemen distalinde dorsal yüzgeç yarısı kesilmiş ve biz çok daha distale ventral fin ampute. 24 hpa anda, sırt tarafında morfolino-pozitif hücreler enjeksiyon yerinden yara örten epitel ve blastem göç etmişti. Bununla birlikte, bu ventral tarafı (Şekil 9) üzerinde söz konusu değildi. Bu amputasyon uçağın altında yatan yalnızca hücrelerin rejeneratif yanıtı katılma fikrini desteklemektedir. Bu veriler aynı zamanda hücre göçü için gerekli olduğu varsayılan proteinler bu tekniği kullanarak test edilebileceğini düşündürmektedir.
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
Yazarlar zebrabalıkları onların bakım ve onarım için Zebra balığı Araştırma personel için Freimann Yaşam Bilim Merkezi ve Merkezi teşekkür etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| CUY21-EDIT veya CUY21-SC Kare dalga elektroporatörün | Protech Uluslararası | CUY21EDIT ya CUY21SC | Her iki ünite de bu protokol için çalışmak |
| 3 mm çaplı kürek elektrotlar | Protech Uluslararası | CUY 650-P3 | |
| Morfolino | GeneTools, LLC | Morfolino ilgi protein için özel dizayn edilmelidir | |
| 2-Fenoksietanol | Sigma | 77.861-1L | Anestezi; prosedür için balık sistemi suda seyreltik 1:1000, ötenazi için 1:500 |
| Mikro-Injectipompa | Dünya Hassas Aletler | PV830 Pnömatik PicoPump | Pek çok farklı mikroenjeksiyon sistemleri kullanılabilir |
| Mikro-manipülatör | Dünya Hassas Aletler | MMJR | Sağ elini kullanan (solak için MMJL) |
| Mikro-enjeksiyon iğneleri, dış çapı 1.0 mm | Dünya Hassas Aletler | 1B100F-4 | Bu bir iğne içine çekti borosilikat cam kılcal vardır |
| İğne tutucu | Dünya Hassas Aletler | 5430-ALL | Pico Nozul Kiti; inset 1.0 mm pipet conta emin olun |
| İğne çektirmesi | Sutter | P-97 | Diğer mikropipet / İğne çekiciler de çalışması gerekir |
| Mikroskop | Leica, Nikon, Zeisss | Sayı üreticisine bağlı olarak değişir | 20X optik ile herhangi bir stereomikroskop ve mikromanipülatörler ile çalışma yeteneği |
Referanslar
- Poss, K. D. Getting to the heart of regeneration in zebrafish. Semin. Cell Dev. Biol. 18, 36-45 (2007).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. J. Neurobiol. 44, 289-307 (2000).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. J. Comp. Neurol. 377, 577-595 (1997).
- Becker, C. G., Becker, T. Repellent guidance of regenerating optic axons by chondroitin sulfate glycosaminoglycans in zebrafish. J. Neurosci. 22, 842-853 (2002).
- Lopez-Schier, H., Hudspeth, A. J. A two-step mechanism underlies the planar polarization of regenerating sensory hair cells. Proc. Natl. Acad. Sci. U.S.A. 103, 18615-1820 (2006).
- Johnson, S. L., Weston, J. A. Temperature-sensitive mutations that cause stage-specific defects in Zebrafish fin regeneration. Genetics. 141, 1583-1595 (1995).
- Nechiporuk, A., Poss, K. D., Johnson, S. L., Keating, M. T. Positional cloning of a temperature-sensitive mutant emmental reveals a role for sly1 during cell proliferation in zebrafish fin regeneration. Dev. Biol. 258, 291-306 (2003).
- Tu, S., Johnson, S. L. Fate restriction in the growing and regenerating zebrafish fin. Dev. Cell. 20, 725-732 (2011).
- Geraudie, J., Ferretti, P. Correlation between RA-induced apoptosis and patterning defects in regenerating fins and limbs. Int. J. Dev. Biol. 41, 529-532 (1997).
- Jazwinska, A., Badakov, R., Keating, M. T. Activin-betaA signaling is required for zebrafish fin regeneration. Curr. Biol. 17, 1390-1395 (2007).
- Laforest, L., Brown, C. W., Poleo, G., Geraudie, J., Tada, M., Ekker, M., Akimenko, M. A. Involvement of the sonic hedgehog, patched 1 and bmp2 genes in patterning of the zebrafish dermal fin rays. Development. 125, 4175-4178 (1998).
- Lee, Y., Grill, S., Sanchez, A., Murphy-Ryan, M., Poss, K. D. Fgf signaling instructs position-dependent growth rate during zebrafish fin regeneration. Development. 132, 5173-5183 (2005).
- Poss, K. D., Shen, J., Nechiporuk, A., McMahon, G., Thisse, B., Thisse, C., Keating, M. T. Roles for Fgf signaling during zebrafish fin regeneration. Dev. Biol. 222, 347-358 (2000).
- Raya, A., Koth, C. M., Buscher, D., Kawakami, Y., Itoh, T., Raya, R. M., Sternik, G., Tsai, H. J., Rodriguez-Esteban, C., Izpisua-Belmonte, J. C. Activation of Notch signaling pathway precedes heart regeneration in zebrafish. Proc. Natl. Acad. Sci. U.S.A. 100, 11889-11895 (2003).
- Smith, A., Avaron, F., Guay, D., Padhi, B. K., Akimenko, M. A. Inhibition of BMP signaling during zebrafish fin regeneration disrupts fin growth and scleroblasts differentiation and function. Dev Biol. 299, 438-454 (2006).
- Thummel, R., Li, L., Tanase, C., Sarras, M. P., Godwin, A. R. Differences in expression pattern and function between zebrafish hoxc13 orthologs: recruitment of Hoxc13b into an early embryonic role. Dev. Biol. 274, 318-333 (2004).
- Coonrod, S. A., Bolling, L. C., Wright, P. W., Visconti, P. E., Herr, J. C. A morpholino phenocopy of the mouse mos mutation. Genesis. 30, 198-200 (2001).
- Heasman, J., Kofron, M., Wylie, C. Beta-catenin signaling activity dissected in the early Xenopus embryo: a novel antisense approach. Dev. Biol. 222, 124-134 (2000).
- Nasevicius, A., Ekker, S. C. Effective targeted gene knockdown in zebrafish. Nat. Genet. 26, 216-2120 (2000).
- Hoptak-Solga, A. D., Nielsen, S., Jain, I., Thummel, R., Hyde, D. R., Iovine, M. K. Connexin43 (GJA1) is required in the population of dividing cells during fin regeneration. Dev. Biol. 317, 541-548 (2008).
- Thummel, R., Bai, S., Sarras, M. P., Song, P., McDermott, J., Brewer, J., Perry, M., Zhang, X., Hyde, D. R., Godwin, A. R. Inhibition of zebrafish fin regeneration using in vivo electroporation of morpholinos against fgfr1 and msxb. Dev. Dyn. 235, 336-346 (2006).
- Yin, V. P., Thomson, J. M., Thummel, R., Hyde, D. R., Hammond, S. M., Poss, K. D. Fgf-dependent depletion of microRNA-133 promotes appendage regeneration in zebrafish. Genes Dev. 22, 728-733 (2008).
- Tawk, M., Tuil, D., Torrente, Y., Vriz, S., Paulin, D. High-efficiency gene transfer into adult fish: a new tool to study fin regeneration. Genesis. 32, 27-31 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır