Method Article
In-vivo-Elektroporation von Morpholinos in das Regenerations Adult Zebrafisch Leitwerk
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Verfahren zur bedingten Knockdown die Expression eines Zielproteins im Erwachsenenalter Zebrafisch Flossenregeneration. Diese Technik beinhaltet Mikrospritzvorrichtung und Elektroporation Antisense-Oligonukleotid in Morpholinos Flossengewebes das Testen des Proteins Rolle in verschiedenen Stadien der Flossenregeneration, einschließlich Wundheilung, Blastembildung und regenerative Auswachsen ermöglicht.
Zusammenfassung
Bestimmte Arten von Urodelen und Knochenfische regenerieren kann ihren Geweben. Zebrafisch haben zu einem weit verbreiteten Modell, um die spontane Regeneration der adulten Geweben wie Herz 1, Retina 2, Rückenmark 3, Sehnerv 4, sensorischer Haarzellen 5 und Rippen 6 zu untersuchen.
Der Zebrafisch Rippe ist eine relativ einfache Ansatz, die leicht manipuliert wird, um mehrere Stufen in epimorphe Regeneration zu studieren. Wundheilung, Blastembildung und Flosse Auswuchs: Klassischerweise wurde fin Regeneration durch drei Phasen gekennzeichnet. Nach Amputation Teil der Flosse, wuchert das umgebende Epithel und wandert über die Wunde. Bei 33 ° C, tritt dieser Prozess innerhalb von sechs Stunden nach der Amputation (hPa, 1B) 6,7. Als nächstes zugrunde liegenden Zellen aus verschiedenen Linien (z. B. Knochen, Blut, Gliazellen, Fibroblasten) Wiedereinstieg in den Zellzyklus zu einem proliferativen Blastem, während die darüber liegende Epidermis weiter zu vermehren (1D) 8. Auswuchs tritt als Zellen proximal zu dem Blastem in ihre jeweiligen Linien neu zu differenzieren, um neues Gewebe (1E) 8 zu bilden. Abhängig von der Höhe der Amputation, wird die volle Regeneration in einer Woche bis zu einem Monat abgeschlossen.
Die Expression einer großen Anzahl von Gen-Familien, darunter wnt, Hox-, FGF, MSX, Retinsäure, sch, Kerbe, BMP und Aktivin A-beta-Gene, ist hochreguliert während bestimmter Phasen der Regeneration fin 16.09. Allerdings haben die Rolle dieser Gene und ihren codierten Proteinen während der Regeneration schwierig zu beurteilen, wenn ein spezifischer Inhibitor für das Protein existiert 13, eine temperaturempfindliche Mutante besteht, oder ein transgenes Tier (entweder Überexpression des Wildtyp-Proteins oder eine dominant -negatives Protein) wurde 7,12 erzeugt. Wir entwiped ein Reverse genetische Technik, um schnell und einfach testen Sie die Funktion eines Gens während der Finne Regeneration.
Morpholino-Oligonukleotide werden häufig verwendet, um den Verlust von spezifischen Proteinen während der Zebrafisch, Xenopus, Huhn und Maus Entwicklung 17-19 studieren. Morpholinos Basenpaar mit einem komplementären RNA-Sequenz entweder Block-prä-mRNA-Splicing oder mRNA-Translation. Wir beschreiben ein Verfahren zur effizienten Einführung Fluorescein-markierten Antisense-Morpholino in Regenerieren Zebrafisch Rippen den Zuschlag Expression des Zielproteins. Der Morpholino wird in jede Blastem der regenerierenden Zebrafisch Schwanzflosse Mikro-Injektion und Elektroporation in die umliegenden Zellen. Fluorescein liefert die Ladung zu den Morpholino elektroporieren und die Morpholino im Flossengewebes visualisieren.
Dieses Protokoll erlaubt bedingten Protein Knockdown, um die Rolle von spezifischen Proteinen während der regenerativen fin Auswuchs zu untersuchen. In der Discussion beschreiben wir, wie dieser Ansatz angepasst werden, um die Rolle von spezifischen Proteinen während der Wundheilung oder Blastembildung, sowie ein potentieller Marker für Zellmigration in Blastembildung zu untersuchen.
Protokoll
1. Resuspendieren Morpholino
- Verdünnen von 300 nM Fluorescein-markierten Morpholino in 100 ul Nuklease-freies Wasser zu einer etwa 3 mM Lösung zu machen. Der Morpholino-Lösung wird in mehrere Paraffin versiegelt Mikrozentrifugenröhrchen aliquotiert und bei Raumtemperatur gelagert und lichtgeschützt aufbewahren.
- Um die genaue Konzentration bestimmen, Morpholino, verdünnen 5 ul der Morpholino-Lösung (oder Wasser als Blindprobe) in 95 ul 0,1 N HCl. Stellen Sie eine Grundlinie auf einem Spektrophotometer bei 265 nm mit dem Wasser leer, und dann bestimmen, das Lesen der verdünnten Lösung Morpholino. Multiplizieren Sie den Morpholino-Absorption bestimmt durch seine konstante und mit dem Verdünnungsfaktor, um die Konzentration in ng / ul bestimmen. Das Morpholino konstanten wird wie folgt berechnet:
Morpholino konstant = Molekulargewicht der Morpholino-X 1000/molar Absorption.
Das Molekulargewicht und molarer Extinktion für die Morpholino können auf dem "gefunden werdenOligo-Eigenschaften "Blatt mit dem Produkt geliefert. Teilen Sie den Morpholino-Konzentration in ng / ul, durch das Molekulargewicht, um die Konzentration in mM zu bestimmen. Verdünnen Sie die Morpholino, falls notwendig, zu einer funktionierenden Konzentration, in der Regel 1,2 mm.
2. Fin Amputation
- Anesthetize erwachsenen Zebrafisch entweder Tricaine oder 2-Phenoxyethanol 1,0 mg / ml Wasser in dem Tank.
- Amputieren die Rippe mit einem sterilen Skalpell oder Rasierklinge proximal zu dem ersten Verzweigungspunkt lepidotrichial. Dies sollte in der gleichen proximal / distalen Position auf jedem Tier (z. B. 7 Knochensegmente distal von der Rippe Gürtel) durchgeführt werden. WICHTIG: achten Sie darauf, perfekt senkrecht geschnitten, um den anterioren / posterioren Ebene des Tieres. Winkelschnitte wird in unebenem fin Auswuchs der dorsalen und ventralen Hälften der Flosse führen.
- Bringen Sie den Fisch mit einem Tank. Wir pflegen in der Regel die Fische bei 33 ° C, um die Regeneration zu erhöhen. Je nach experimentellem Design, wAIT 0-2 Tage nach der Amputation (dpa) Flosse für Regeneration, um vor der Einführung des Morpholino beginnen. Alternative Ansätze sind in der Diskussion besprochen, unten.
3. Morpholino Injektion
- Der Tag vor dem Einspritzen des Morpholino, machen eine Injektion Platte (Abbildung 2). Achten Sie darauf, ausgeschnitten eine Kerbe an einem Ende des Brunnens, die Stabilisierung der Fisch für die Mikroinjektion Prozedur hilft.
- Bei 2 dpa, bereiten Sie das Mikro-Einspritzvorrichtung und Morpholino-Lösung.
- Verdünnen Sie die Fluorescein-markierten Morpholino auf die richtige Konzentration (empfehlen, beginnend mit 1,2 mM) und in einem 65 ° C warmes Wasserbad, für 5 Minuten.
- Ziehen Sie die Nadel aus Glas für die Mikro-Injektion mit einer Nadel Abzieher.
- Legen Sie die Nadel mit der Morpholino (Hinweis: je nachdem, ob Sie Back-Füllung oder laden Sie Ihre Front-Nadel wird entscheiden, ob Sie die Nadel zuerst laden, oder schneiden Sie die Spitze zuerst).
- Schneiden Sie die Spitze vor der Nadel in einemn Winkel.
- Befolgen Sie die Anweisungen Ihres Mikro-Einspritzsystem, um eine etwa 5 nl Blase der Morpholino pro Injektion zu injizieren. Größere Mengen von Morpholino könnte stören das Gewebe.
- Betäuben die Fische und auf Injektion Platte. Entfernen Sie das gesamte überschüssige Flüssigkeit und richten Sie die Nadel an die entsprechende Stelle, knapp distal des knöchernen ray (Abbildung 3). Mit Hilfe eines Mikroskops und Mikroinjektion Apparat geeignet für Morpholino-Injektionen (siehe Tabelle der spezifischen Reagenzien), injizieren die Morpholino in die Flosse von vorne nach hinten, wie in Abbildung 3 dargestellt. Die Injektion von hinten nach vorne bewirkt, dass der Finne Gewebe aufzurollen während der Injektion und ist sehr schwierig.
- Führen Sie die Nadel vorsichtig in das regenerative Gewebe, genau distal zu jedem knöchernen ray (mit "1" in Abbildung 3) und schieben, bis distal im Blastem befindet ("2" in Abbildung 3). Achten Sie darauf, die Nadel durch die Push-enReifen fin. Wenn die Nadel korrekt lokalisiert ist, spritzen sie den Morpholino (dh klicken Sie auf eine Zeit). Bei 1,2 mm, wird das Fluorescein-markierte Morpholino Lösung gelb-grün, selbst bei normalen Lichtverhältnissen. Mit jeder Injektion, ein gelbes "puff" von Morpholino-Lösung visualisiert werden können, hilft die Lokalisierung der Injektion zu dem Blastem. Etwa 75 nl (10-15 Klicks) von Morpholino-Lösung sollte pro knöchernen ray injiziert werden. ~ 1 Sek. Pause zwischen zwei Klicks. Wir injizieren nur die Rückenseite, mit dem ventralen wie Elektroporation, nur Kontrolle. Alternativ könnte man wiederholen Sie diese ganze Prozedur mit einem Morpholino Kontrolle auf der ventralen Hälfte der Flosse.
4. Die Elektroporation der Morpholino
- Unmittelbar nach der Injektion der Morpholino, entfernen Sie die Injektion Platte aus dem Mikro-Injektionsgeräts. Füllen Sie die Injektion Platte gut mit der Anästhesie-Lösung, bis der Fisch unter Wasser. Die Elektroporation wird unter der Wasserlinie durchgeführt.
- Ein 3 mm Durchmesser Platinplatte Pinzette Elektrode (650-P3 CUY Pinzette, Protech International) lokalisiert die Impulse, um etwa die Hälfte der Flosse. Achten Sie darauf, die Elektroden an der Flosse Gewebe berühren. Um sicherzustellen, dass die Elektroden nicht berühren fin Gewebe, drehen Sie den Fisch auf seiner dorsalen Seite und schauen Sie geradeaus auf der Mittellinie für die Elektroporation.
- Elektroporieren sowohl die dorsalen und ventralen Seiten der Finne mit einem CUY21 Square Wave Electroporator (Protech International, Inc.) (für eine nicht-spezifische Effekte zu steuern Elektroporation). Wischen Sie die Elektroden mit einem feuchten Kimwipe nach jeder Elektroporation, um alle Blasen, die sich gebildet haben können, zu entfernen. Wenn sie nicht entfernt werden, ein Mini-Ladung aufbaut, die anzieht das Gewebe in Richtung der Elektrode. Die Elektroporation Parameter sollten auf zehn aufeinander folgenden Pulsen von 50 ms eingestellt werden, bei 15 V mit einer 1 sec Pause zwischen den Impulsen.
- Den Fisch auf einen Objektträger oder eine Petrischale und schnell Bild der Flosse, und achten Sie auf note der dorsal / ventral Orientierung. Dieses Bild wird für das Nachwachsen Analyse am nächsten Tag verwendet werden. Bringen Sie den Fisch in den Tank.
5. Analyse
- Wenn das Zielprotein, die in Expression wurde geklopft für die richtige Finne Regeneration erforderlich ist, sollte ein dramatischer Unterschied zwischen den dorsalen und ventralen Hälften der Flosse klar sein, 1 Tag nach der Elektroporation (Abbildung 5B).
- Bei 3 dpa, nehmen Sie ein anderes Bild von der Flosse eines jeden Fisch und die Zuordnung dieses Bild mit den entsprechenden 2 dpa-Bild (Abbildung 5B). Die natürlichen Schwankungen in der Seitenflosse Pigmentierung Muster zwischen Tieren können Sie korrekt zu identifizieren einzelnen Fische.
- Mit NIH Image, verfolgen Sie die 2 und 3 dpa dpa Bereiche sowohl der dorsalen und ventralen Hälften (5B).
- Um% Bereich des dorsalen gegen die ventrale Verwendung folgender Formel bestimmen: (- Dorsal Dorsal 2dpa 3DPA) / (Ventrale 3DPA - Ventrale 2dpa) x 100 =%-Bereich
6. Repräsentative Ergebnisse
- Wir haben immer Assay zur Flosse Auswuchs bei 3 dpa, oder 24 HPE (Stunden nach der Elektroporation). Zu diesem Zeitpunkt sollte die Fluorescein-markiertem Morpholino vorhanden sein in der dorsalen Hälfte der Lamelle (Supplemental 1 und 6A). Es ist normal, um zu sehen, einige nachgestellte bis auf die Ebene der Amputation.
- Es sollte kein Unterschied zwischen den dorsalen und ventralen Seiten in der Seitenflosse injiziert und durch Elektroporation mit der Steuerung Morpholinos (6B) sein.
- Wenn die experimentellen Morpholino zielt ein essentielles Protein für Flosse Auswuchs, sollte ein dramatischer Unterschied zwischen den dorsalen und ventralen Seiten beobachtet werden (Abbildung 6c).
- Wenn die Elektrode berührt die Flosse bei der Elektroporation, wird das Gewebe erscheinen braun (fast in Erscheinung verbrannt) und nekrotisch.
"Src =" / files/ftp_upload/3632/3632fig1.jpg "/>
Abbildung 1. Schematische Darstellung der verschiedenen Ereignisse, die während fin Regeneration auftreten. Die zugrunde liegenden Zeiten für jedes Ereignis in Stunden nach der Amputation (HPA) angegeben und entsprechen einem Tank Temperatur von 33 ° C.
Abbildung 2. A. Schematische Darstellung der Einspritzplatte, die aus Agarose hergestellt ist und enthält eine kleine, gut, um den Fisch während des Mikroinjektion Morpholino halten.
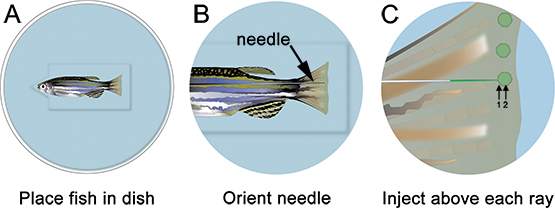
Abbildung 3. Schematische Darstellung der Morpholino Mikroinjektion. A. Legen Sie den Fisch in die Schüssel mit dem Kopf des Fisches in der Kerbe ausgeschnitten des Brunnens, die helfen, die Fische bleiben stabil wird. B. Bei geringer Vergrößerung, ordnen Sie die Nadel, so dass es ist in der Nähe des regenerierende Gewebe der Rippe. C Bei höherer Vergrößerung, spritzen sie den Morpholino distalen jedem knochigen Fin Ray (dh in jedem Blastem). Die Nadel sollte in das Gewebe direkt distal des knöchernen ray (1), und dann weiter zu dem Ort des Blastem (2). Hinweis: Die grünen Punkte im Schaltplan sind nur dazu gedacht, um den Ort der Injektion zu zeigen. Der Morpholino kann kurz visualisiert werden als grün / gelb "puff" nach jeder Injektion, jedoch ist diese nicht fortbestehen wie in der schematischen gezeigt.
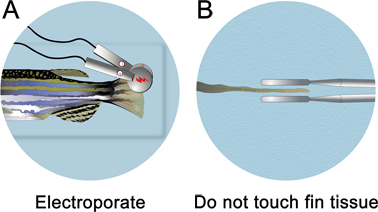
Abbildung 4. Schematische Darstellung der Finne Elektroporation. A. Nach Mikroinjektion, legen Sie den Fisch in einer Petrischale voller Anästhesie und elektroporieren sowohl die dorsale und ventrale Hälften. B. Achten Sie darauf, nicht berühren fin Gewebe. Die Elektroden sollten ~ 1 mm von dem Gewebe platziert werden.
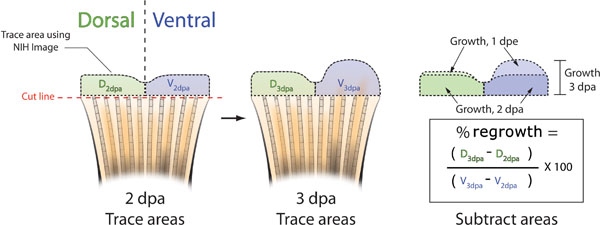
Abbildung 5. Schematische Darstellung der Methoden zur Flosse Auswuchs Hemmung zu berechnen. A. Nehmen Sie ein Bild von der Flosse eines jeden Fisch bei 2 dpa, entweder unmittelbar vor oder nach Morpholino-Injektion und Elektroporation. Verfolgen Sie die regenerierbaren Gewebes sowohl der dorsale (grün) und ventralen (blau) Hälften der Flosse mit NIH Image, (schwarz gestrichelte Linien). B. Bei 3 dpa, nehmen Sie ein anderes Bild von jeder Rippe und wieder verfolgen die dorsalen und ventralen Bereichen von Nachwachsen mit NIH Image. C. Subtrahieren Sie die Fläche des erneuten Wachstums bei 2 dpa vom Gesamtbetrag Nachwachsen bei 3 dpa sowohl für die dorsalen und ventralen haves. Der Bereich der dorsalen Prozent gegenüber ventralen Nachwachsen kann mit folgender Formel berechnet werden: ((D 3DPA - D 2 dpa) / (V 3DPA - V 2dpa)) x 100. Prozent Hemmung = 100 - Prozent Area.
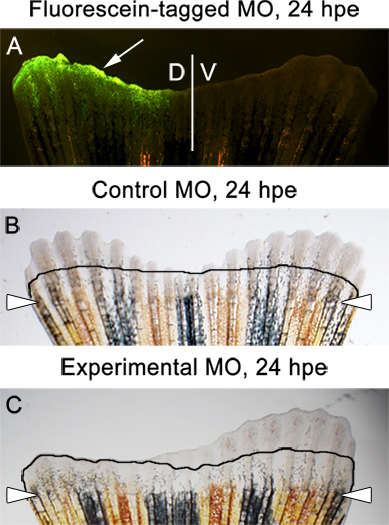
6. Beispiele für erwarteteErgebnisse. A. Fluoreszenzbild, die eine Fluorescein-markierten Kontroll-Mor in der dorsalen Hälfte der Rippe, 24 Stunden nach der Elektroporation (HPE). B. Hellfeldaufnahme einer Rippe, die injiziert und wurde durch Elektroporation mit einem Kontroll-Mor in der dorsalen Hälfte . Das Bild zeigt gleich das Nachwachsen der beiden dorsalen und ventralen Hälften einer Flosse, 24 HPE. C. Hellfeldaufnahme einer Flosse, die injiziert und mit einem experimentellen Morpholino in der dorsalen Hälfte wurde elektroporiert. Das Bild zeigt die Hemmung des erneuten Wachstums auf der dorsalen / injizierte Seite. Die Linie zeigt die Menge an Nachwachsen bei 2 dpa, unmittelbar vor der Morpholino-Injektion und Elektroporation.
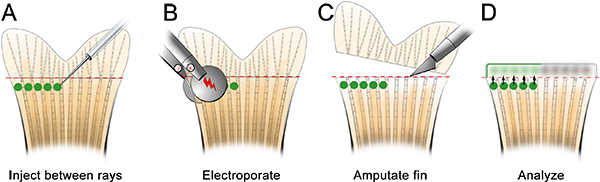
Abbildung 7. Schematische Darstellung einer alternativen Injektion und Elektroporation Verfahren zur Target-Proteine bei der Wundheilung und Blastembildung beteiligt. A. Spritzen Sie die Morpholinozwischen den einzelnen knöchernen Fin Ray auf der dorsalen Hälfte der Flosse. B. elektroporieren die Morpholino wie normal. C. amputieren die Flosse unmittelbar proximal (~ 1 knöchernen Segment) an der Injektionsstelle. D. Die Fluorescein-markierten Morpholino beobachtet werden kann Wunde in Epithel und Blastem bei 24 HPE.
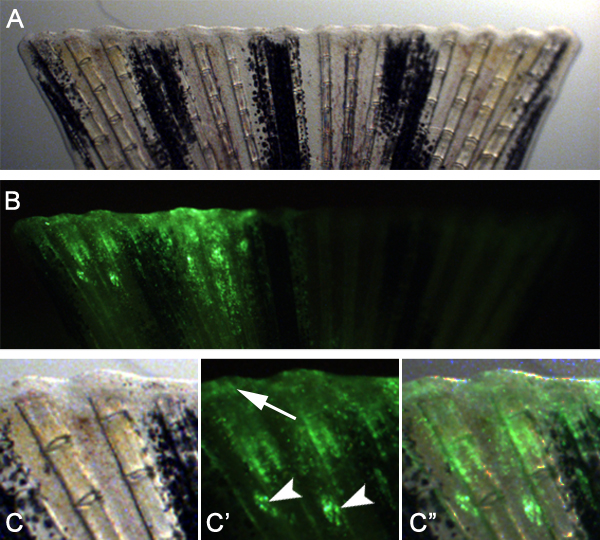
Abbildung 8. Mit der Technik zur Wunde Epithel und Blastembildung zielen. A. Hellfeldaufnahme einer Flosse bei 24 hPa, die injiziert und wurde durch Elektroporation mit einer Kontrollgruppe Morpholino unmittelbar vor der Amputation. B. Fluoreszenzbild von Flosse in Panel A. Hinweis gezeigt dass das injizierte dorsalen Hälfte der Flosse zeigt eine gute Aufnahme der Morpholino in der regenerierbaren Gewebes. C -. C "Höhere Vergrößerung des dorsalen Hälfte der Flosse in Panels gezeigt A und B. Die Injektionsstellen sind oft noch sichtbar (Pfeilspitzen), Aber viele Zielzellen migriert haben, um in Epithel und Wunde Blastembildung (Pfeil) zu beteiligen.
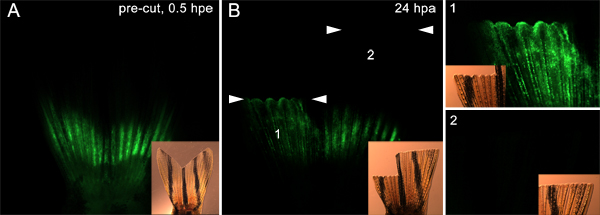
Abbildung 9. Mit der Technik, um Zellen, die das Blastem. A. Fluoreszenz und Hellfeld eingefügten Bilder zeigen eine Flosse injiziert und elektroporiert mit Morpholino sowohl auf der dorsalen und ventralen Hälften bilden die Migration anzusprechen. Der Finne wurde dann bei zwei Ebenen amputiert. Die dorsale Hälfte reduziert wurde unmittelbar distal der Injektionsstelle, wo, wie das ventrale Hälfte 9-10 knöchernen Segmenten distal der Injektionsstelle wurde geschnitten. B. Bei 24 hPa, zeigen die Fluoreszenz-und Hellfeld eingefügten Bilder, die Morpholino wurde zum dorsalen migriert regenerieren (1), aber nicht die ventrale regenerieren (2), was anzeigt, dass nur die Zelle unmittelbar proximal zu dem Schnitt Seite auf Blastembildung teilnehmen. Die beiden weißen Pfeile zeigen den Pegel jedes AmputationEbene. Panels mit 1 und 2 auf der rechten Seite des Bildes zeigen eine höhere Vergrößerung Blick auf die dorsale und ventrale Hälften der Flosse, beziehungsweise.
Zusätzliche 1. Ein Video eines konfokalen z-Stapel einem Bereich entsprechend der Position eines Blastem einer Rippe injiziert und mit einer Steuerung elektroporiert Morpholino ist. Das Bild wurde bei 24 HPE übernommen. Da eine einzelne Fluoresceinmoleküls nicht visualisiert werden können, können nicht alle der Morpholino visualisiert oder quantifiziert. Allerdings geben diese Bilder einen Eindruck von den verschiedenen Graden der Aufnahme, die sichtbar gemacht werden kann in den Zellen, aus einzelnen punktförmigen Punkte, um ganze Zellen voll von fluoreszierenden Morpholino. Auf dem Standbild, wird die Orientierung gezeigt. Maßstab: 25 Mikron.
Diskussion
Hier beschreiben wir eine leistungsstarke loss-of-function-Ansatz bedingt Knockdown Proteine von Interesse während der Finne Regeneration in adulten Zebrafisch. Diese Technik wurde verwendet, um Gene zu studieren Gap Junction-, Signal-Rezeptoren, Transkriptionsfaktoren, und microRNAs während regenerative fin Auswuchs 16, 20-22.
Wir erwarten, dass diese Technik auch verwendet werden, um Gene für die Wundheilung und Blastembildung durch Anpassung der Technik erforderlich zu untersuchen. Zum Beispiel, injizierten wir elektroporiert und eine Kontrolle Morpholino in den Raum zwischen den knöchernen Flossenstrahlen auf der dorsalen Hälfte der Finne vor der Amputation (Abbildung 7). Wir haben dann die Flosse unmittelbar distal der Injektion Flugzeug amputiert. 24 hPa, beobachteten wir, dass die Morpholino-Zielzellen hatte distal, um sowohl die Wunde Epithel und Blastem (Abbildung 8) bilden migriert, was darauf hinweist, dass die Zellen während dieser frühen Phasen der Regeneration kann auch TargETED.
Die Technik hat ein paar bemerkenswerte Einschränkungen. Zum Beispiel ist die Fluoreszenz von Fluorescein-nicht beibehalten folgenden Fixierung und Verarbeitung für die Immunhistochemie, die es unmöglich, eine bestimmte zelluläre Phänotyp (dh Zell-Proliferation) mit der Menge an Morpholino in einer Zelle korreliert ist. Darüber hinaus ist es nicht gelungen, dauerhaft die Elektroporation von Plasmiden in der Regeneration Heckflosse, obwohl eine vorherige Gruppe auch taten die erfolgreiche Elektroporation von DNA in Flossengewebes 23. Schließlich haben wir festgestellt, dass die Morpholino nur wirksam für ~ 48 Stunden nach der Elektroporation 21, die mit dieser Technik in seiner jetzigen Form für die Prüfung Gene bei der Differenzierung von neuen Zelltypen beteiligt ist untersagt. Zusätzliche Tests und Modifikation des Verfahrens, kann überwunden werden diese aktuellen Einschränkungen.
Darüber hinaus ist es möglich, dass diese Technik verwendet werden könntenan Proteine der Zellwanderung vom darunter liegenden Gewebe zum Blastem beteiligt zu testen. Zum Beispiel, injizierten wir und Elektroporation ein Steuersignal Morpholino in beide Seiten der Rippe (wie in 7 beschrieben) vor der Amputation. Wir haben dann die dorsale Hälfte der Finne unmittelbar distal der Injektion Flugzeug amputiert und wir amputiert die Bauchflosse viel mehr distal. Bei 24 hPa, hatten die Morpholino-positive Zellen auf der Rückenseite von der Injektionsstelle, um die darüber liegende Epithel und Wunde Blastem migriert. Das war jedoch nicht der Fall ist auf der Bauchseite (Abbildung 9). Dies stützt die Idee, dass nur die Zellen, die die Amputation Ebene zugrunde liegen, in der regenerative Reaktion teilnehmen. Diese Daten legen nahe, dass auch Proteine für die Hypothese aufgestellt, um die Zellwanderung erforderlich getestet werden konnte mit Hilfe dieser Technik werden.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Die Autoren möchten die Freimann Life Science Center und Center for Zebrafisch-Forschung Mitarbeiter danken für ihre Pflege und Wartung des Zebrafisch.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| CUY21-Edit oder CUY21-SC Rechtecksignal Elektroporator | Protech International | CUY21EDIT oder CUY21SC | Beide Geräte arbeiten nach diesem Protokoll |
| 3 mm Durchmesser Paddle-Elektroden | Protech International | CUY 650-P3 | |
| Morpholino | GeneTools, LLC | Morpholino sollte kundenspezifisch angefertigt, um Ihre Protein von Interesse sein | |
| 2-Phenoxyethanol | Sigma | 77.861-1L | Anästhesie; verdünnten 1:1000 in Fisch System Wasser für Verfahren, 1:500 für Sterbehilfe |
| Micro-injectian der Pumpe | World Precision Instruments | PV830 Pneumatische PicoPump | Viele verschiedene Systeme Mikroinjektion verwendet werden könnten |
| Micro-Manipulator | World Precision Instruments | MMJR | Rechtshänder (MMJL für Linkshänder) |
| Micro-Injektionsnadeln, 1,0 mm Außendurchmesser | World Precision Instruments | 1B100F-4 | Dies sind Borosilikatglas Kapillaren, in eine Nadel gezogen |
| Nadelhalter | World Precision Instruments | 5430-ALL | Pico Düsensatz, stellen Sie sicher, Inset der Pipette 1,0 mm Dichtung |
| Nadel-Abzieher | Sutter | P-97 | Andere Mikropipette / Nadel Abzieher sollte auch funktionieren |
| Mikroskop | Leica, Nikon, Zeiss | Anzahl variiert je nach Hersteller | Jede Stereomikroskop mit 20X-Optik und die Fähigkeit, mit Mikromanipulatoren arbeiten |
Referenzen
- Poss, K. D. Getting to the heart of regeneration in zebrafish. Semin. Cell Dev. Biol. 18, 36-45 (2007).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. J. Neurobiol. 44, 289-307 (2000).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. J. Comp. Neurol. 377, 577-595 (1997).
- Becker, C. G., Becker, T. Repellent guidance of regenerating optic axons by chondroitin sulfate glycosaminoglycans in zebrafish. J. Neurosci. 22, 842-853 (2002).
- Lopez-Schier, H., Hudspeth, A. J. A two-step mechanism underlies the planar polarization of regenerating sensory hair cells. Proc. Natl. Acad. Sci. U.S.A. 103, 18615-1820 (2006).
- Johnson, S. L., Weston, J. A. Temperature-sensitive mutations that cause stage-specific defects in Zebrafish fin regeneration. Genetics. 141, 1583-1595 (1995).
- Nechiporuk, A., Poss, K. D., Johnson, S. L., Keating, M. T. Positional cloning of a temperature-sensitive mutant emmental reveals a role for sly1 during cell proliferation in zebrafish fin regeneration. Dev. Biol. 258, 291-306 (2003).
- Tu, S., Johnson, S. L. Fate restriction in the growing and regenerating zebrafish fin. Dev. Cell. 20, 725-732 (2011).
- Geraudie, J., Ferretti, P. Correlation between RA-induced apoptosis and patterning defects in regenerating fins and limbs. Int. J. Dev. Biol. 41, 529-532 (1997).
- Jazwinska, A., Badakov, R., Keating, M. T. Activin-betaA signaling is required for zebrafish fin regeneration. Curr. Biol. 17, 1390-1395 (2007).
- Laforest, L., Brown, C. W., Poleo, G., Geraudie, J., Tada, M., Ekker, M., Akimenko, M. A. Involvement of the sonic hedgehog, patched 1 and bmp2 genes in patterning of the zebrafish dermal fin rays. Development. 125, 4175-4178 (1998).
- Lee, Y., Grill, S., Sanchez, A., Murphy-Ryan, M., Poss, K. D. Fgf signaling instructs position-dependent growth rate during zebrafish fin regeneration. Development. 132, 5173-5183 (2005).
- Poss, K. D., Shen, J., Nechiporuk, A., McMahon, G., Thisse, B., Thisse, C., Keating, M. T. Roles for Fgf signaling during zebrafish fin regeneration. Dev. Biol. 222, 347-358 (2000).
- Raya, A., Koth, C. M., Buscher, D., Kawakami, Y., Itoh, T., Raya, R. M., Sternik, G., Tsai, H. J., Rodriguez-Esteban, C., Izpisua-Belmonte, J. C. Activation of Notch signaling pathway precedes heart regeneration in zebrafish. Proc. Natl. Acad. Sci. U.S.A. 100, 11889-11895 (2003).
- Smith, A., Avaron, F., Guay, D., Padhi, B. K., Akimenko, M. A. Inhibition of BMP signaling during zebrafish fin regeneration disrupts fin growth and scleroblasts differentiation and function. Dev Biol. 299, 438-454 (2006).
- Thummel, R., Li, L., Tanase, C., Sarras, M. P., Godwin, A. R. Differences in expression pattern and function between zebrafish hoxc13 orthologs: recruitment of Hoxc13b into an early embryonic role. Dev. Biol. 274, 318-333 (2004).
- Coonrod, S. A., Bolling, L. C., Wright, P. W., Visconti, P. E., Herr, J. C. A morpholino phenocopy of the mouse mos mutation. Genesis. 30, 198-200 (2001).
- Heasman, J., Kofron, M., Wylie, C. Beta-catenin signaling activity dissected in the early Xenopus embryo: a novel antisense approach. Dev. Biol. 222, 124-134 (2000).
- Nasevicius, A., Ekker, S. C. Effective targeted gene knockdown in zebrafish. Nat. Genet. 26, 216-2120 (2000).
- Hoptak-Solga, A. D., Nielsen, S., Jain, I., Thummel, R., Hyde, D. R., Iovine, M. K. Connexin43 (GJA1) is required in the population of dividing cells during fin regeneration. Dev. Biol. 317, 541-548 (2008).
- Thummel, R., Bai, S., Sarras, M. P., Song, P., McDermott, J., Brewer, J., Perry, M., Zhang, X., Hyde, D. R., Godwin, A. R. Inhibition of zebrafish fin regeneration using in vivo electroporation of morpholinos against fgfr1 and msxb. Dev. Dyn. 235, 336-346 (2006).
- Yin, V. P., Thomson, J. M., Thummel, R., Hyde, D. R., Hammond, S. M., Poss, K. D. Fgf-dependent depletion of microRNA-133 promotes appendage regeneration in zebrafish. Genes Dev. 22, 728-733 (2008).
- Tawk, M., Tuil, D., Torrente, Y., Vriz, S., Paulin, D. High-efficiency gene transfer into adult fish: a new tool to study fin regeneration. Genesis. 32, 27-31 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten