Method Article
协议用于实现
* 这些作者具有相同的贡献
Erratum Notice
摘要
这次为期五天的协议列出了所有步骤,设备,以及用于创建和运行基于一个有效的内源性大肠杆菌从头TX-TL无细胞表达系统必要的补充软件。用试剂,该协议需要8个小时或更短设置一个反应,收集和处理数据。
摘要
理想的无细胞表达系统在理论上可以模拟体内细胞的环境中以受控的体外平台1,这是用于表达的蛋白质和基因的电路以控制的方式,以及用于提供原型环境为合成生物学有用的。2,3为了实现后者的目标,即保持无细胞表达系统的内源性大肠杆菌转录转译机制能够更准确地反映体内细胞动力学比那些基于T7 RNA聚合酶转录。我们描述一个高效的内源性大肠杆菌的准备和执行基于大肠杆菌转录-翻译(TX-TL)无细胞可在98%的成本降低到类似的商业系统产生的蛋白质为T7为基础的系统等量表达系统。4,5缓冲器和细胞粗提液的制备方法描述,以及一个执行三级管TX-TL反应。整个协议需要五天的时间准备,并产生足够的材料多达3000单一反应在一种制剂。一旦准备,每个反应根据需要从建立到数据收集和分析8小时。调控和外源性转录到E的机制大肠杆菌 ,如lac /四面体阻遏和T7 RNA聚合酶,可以进行补充。6内源性质,例如mRNA和DNA的降解率,也可以进行调整。7该TX-TL无细胞表达系统已被证明对于大规模的电路组装,探索生物现象,和蛋白质的两个T7和内源性启动子下表达。6,8陪同数学模型可供选择。9,10由此产生的系统在合成生物学作为一个原型环境的独特应用,或“TX- TL生物分子实验电路板。“
引言
无细胞表达技术始于20世纪50年代作为纯粹的平移,推动年后用T7噬菌体的DNA为包括转录-翻译机制。11,12从那时起,已经作出许多努力来优化创作的细胞粗提液(或E大肠杆菌 S30提取物)。13,14这些优化包括通过ATP的再生或应变修改延长无细胞蛋白质合成,减少协议的时间和成本。15-17另类无细胞表达系统存在的替代原油的使用再造成分细胞提取物的表达。5两个细胞粗提液和重建方法已被开发用于商业用途。
与合成生物学的出现,为充分表征的平台的需要增加,以测试和快速工程化生物模块和电路。18,19此平台必须是多功能,良好的特点,简单的操作,并专注于用户提供的组件。尽管正在开发一个半世纪前,基于大肠杆菌无细胞系统大肠杆菌本质上共享这些要求,因为它们是一个简化的细胞过程的体外表示无生长和代谢的复杂性。此外,所有来自于大肠杆菌体内工作的基础知识大肠杆菌容易适用于E。大肠杆菌无细胞系统。
虽然无细胞表达系统可以具有应用在合成生物学,迄今大多数无细胞表达系统的目标一直是蛋白质和代谢物的产率最大化。这是通过使用由T7启动子驱动序列的T7噬菌体的转录来实现的。20虽然表达是高效且健壮的,这些系统成为一个高度专业化的目的。细胞的调节方法是有限的,目标DNA模板必须是重新设计,包括T7启动子,和某些序列,如核糖体复合物不能被转录和组装。21,22现有的无细胞表达系统是无法维持高产量,同时保持内源性调控机制,对于合成生物学所必需的灵活性。
我们已经开发出一种内源性E。它保留蛋白的表达由先前的系统中表现出的效率,而且通过允许增加额外的多功能性大肠杆菌无细胞表达系统中表达和基于内源性和外源性(T7或其他)的机制调节。这里所描述的协议最初是根据木川等人(2004)和Liu 等人 (2005年),但具有显著修改。它利用的Mg-和K-谷氨酸以上的Mg-和K-醋酸为提高效率,消除2 -巯基乙醇,并用珠打浆机裂解细胞。17,23,24微珠打浆被选择过均质化,基于压力的方法,或超声处理,由于其较低的成本和可比较的收率,以竞争系统23 3 -磷酸甘油酸(3-PGA)作为能量源,因为它被发现时相比,磷酸肌酸,得到优良的蛋白质的产率和磷酸烯醇丙酮酸。4,25我们的系统可以使用一个sigma70基于启动子与λ噬菌体运营商或T7-启动子驱动,从其他类似的商业系统的产量产生高达报告蛋白的0.75毫克/毫升。4,6五天须出示所有必需的试剂( 图1)。此外,它提供了一个降低98%的成本相比同类商业无细胞系统-材料成本是$ 0.11每10μl反应体系,其中上升0.26美元与劳动包括:( 图2)。
研究方案
1。细胞粗提液的制备
制备粗细胞提取物三天需要两个人才能有效地进行。该协议在功能上由三部分组成:培养生长(步骤1.1到步骤1.11),细胞裂解(步骤1.12到步骤1.37),并提取澄清(步骤1.38到步骤1.52)。据介绍分成了方便天。理想的提取物可以产生自质粒的pbest-OR-OR-PR-UTR1-deGFP-T500(Addgene#40019),并且具有与蛋白质的27-30毫克/毫升的细胞粗提液的浓度。4 0.75毫克/毫升deGFP的然而,提取特征各不相同批次。以下几招提供足够约3,000单一反应(6毫升细胞粗提液)。如果按比例缩小,它是推荐使用不低于这里给出的值的1/6。由于时间的限制,扩大规模,不推荐。
第1天
- 准备细菌培养基,CULTURE板,和媒体的补充在表1中所描述的。见补充材料1的食谱。
- 从-80°C连胜BL21-Rosetta2应变到的2xYT + P +厘米琼脂平板上,孵育至少15小时,在37℃或直至菌落随时可见注:氯霉素(厘米)用于选择一个质粒在BL21-Rosetta2应变编码罕见的tRNA。
2天
- 制备缓冲液和如表2中所描述的补充。见补充材料1的食谱。
- 准备和消毒要求3天的材料,包括:6×4升锥形瓶中,用铝箔盖(高温高压),4×1升的无菌离心瓶,漏斗(高温高压)100克0.1毫米的玻璃珠(高温高压),2煸条(高温高压),1升和500毫升的量筒(高温高压),2×1升烧杯(灭菌),3毫升注射器用18G的针头(无菌),佛罗里达州2-3燕麦浮标,2-3 10K截留分子量透析盒(无菌),比色皿。
- 准备微型文化1。加4毫升的2xYT + P介质和4微升厘米至12毫升无菌培养管和预温至37℃,持续30分钟。
- 接种微型文化1从的2xYT + P +厘米琼脂平板上菌落。孵育在220rpm,37℃下8小时。
- 7小时30分钟后,准备小型的文化2。加入50mL的2×YT + P介质和50μl厘米到无菌的250ml锥形烧瓶中,并预温至37℃,持续30分钟。
- 接种微型培养2用100μl微型培养1的孵育在220rpm,37℃下8小时。
3天
- 称取四个空无菌50毫升猎鹰管和质量记录表3。冰浴猎鹰管,这些将在步骤1.18在以后使用。
- 7小时30分钟步1.8后,准备最后的细菌培养基。使用无菌1升的量筒,转让660毫升的2xYT + P媒体的我NTO每6 4升锥形瓶中,并预温至37℃30分注:4 L或更大锥形瓶中被推荐为适当的通风。
- 添加6.6毫升微型文化2成每4升锥形瓶中。孵育在220rpm,37℃,直至培养物达到1.5〜2.0,在600 nm处的OD(对应于对数中期生长阶段)。定期检查与外径1:10文化稀释精度这一步应该不会超过3小时- 3小时45分钟;在快速中旬对数生长期和收集是提取物质量的关键。
- 紧接在生长后,在4℃下均匀地传输所有培养物分成四个1升离心瓶,离心以5000×g离心12分钟以沉淀细菌细胞。
- 而离心,完整S30A缓冲区准备将4毫升1 M DTT至2升先前准备S30A的。混合和保持缓冲区冰上。
- 当离心结束后,完全从步骤1.12由德卡除去上清液nting和印迹的离心瓶上的无菌纸巾。
- 加入200毫升S30A缓冲在4℃下,以每四个离心瓶中,并用力摇动瓶子直到沉淀完全无剩余的团块溶解 。在4℃下离心4瓶在5,000 g下12分钟
- 完全被调迁和印迹的离心瓶在无菌纸巾上一步收集上清。
- 重复步骤1.15和1.16。
- 加40毫升S30A缓冲在4℃下,以每离心瓶中。 。传输每个粒料和S30A组合成一个冷冻Falcon试管中的1.9) 注:此步骤是为了将颗粒传送到一个较小的容器。
- 离心Falcon管在2000克8分钟,在4°C。用倾析法除去上清液。
- 再离心Falcon管在2000克2分钟,在4°C。通过吸管彻底去除残留的上清液。置于冰上。
- 权衡的F我们的Falcon管与球团和质量记录表3。计算粒料的质量,需要S30A缓冲容积,并且基于表3中的特定的公式需要珠子质量。
- 粒料的正确装载和珠击是使提取物的质量的关键,是最具挑战性的步骤。所以建议尝试之前查看视频。未能避免气泡和均匀分布珠会导致低效的提取物。
- 加的S30A缓冲在表3中计算出的各Falcon管中,涡量直至均匀,并返回到冰上。
- 同时保持其它Falcon管在冰上,间歇地在3等份,每等份使用总珠的1/3为30秒加珠单一的Falcon管中。另外的珠子各等份后,旋涡。将猎鹰管涡步骤和最终的旋涡后的冰。经过去年等分加入, 确保珠均匀地分布。应形成稠膏。
- 通过使用无菌刀片以创建一个3-4毫米开幕切断结束时编制有5毫升(体积)的枪头。拨移液管至2ml 注意:不同的移液管套和提示提供不同量的吸力,可能不足以拉动和释放厚珠细胞溶液; 1毫升移液管尖端结尾去除可以代替使用。
- 置于冰上20珠跳动管。
- 验证细胞珠液高粘度改性用移液管。它应该是粘稠的几乎退出枪头喷射过程中的点。如果太粘,按照步骤1.25重新调整的枪头。如果没有足够的粘性,珠可以在( 球团质量* 0.05)为单位加入,以( 球团质量* 5.1)最大质量。以后每加珠,涡旋30秒,并返回到冰上。请参阅图3a为粘度的演示。
- 使用改性的移液管从Falcon管中除去珠 - 细胞溶液中,并转移到一个无菌的珠跳动管,填充它四分之三满与胎圈芯的解决方案。在柜台微型离心旋转极其短暂(1秒),以去除气泡而不再分配珠。参见图3b-D为珠跳动管装静止图像。
- 完成添加珠的细胞溶液以形成一个凹弯月面。
- 添加一个非常小降珠细胞溶液到珠跳动管帽内, 小心不要妨碍罩外唇,否则,珠管跳动不会关闭sufficientl年。点选在平坦表面上的盖子,并确认有在盖的底部没有气泡 。
- 盖住珠跳动管与来自前面步骤的珠跳动帽。手助理珠跳动。如果做得正确, 瓶盖应严格密封,无气泡建议立即进行删除d是可见的,而且很少(如果有的话)珠芯解决方案应该溢出。重新加载过程中,如果气泡是可见的或盖没有完全关闭。
- 从步骤1.24,其余珠细胞溶液涡猎鹰管,以确保均匀分布的珠子。重复步骤1.28到1.31,直到猎鹰管是空的,然后重复,每增加猎鹰管的步骤1.24到1.31。
- 进行步骤1.33到1.38同时进行 。已起飞助理填充珠击败来自1.31试管置于冰上。曾有两位充满珠跳动管已收集并一直在冰上至少一分钟,珠开始跳动。
- 打了一个管30秒,46转。置于冰上倒挂,持续30秒,而击败其他管。
- 重复前面的步骤,使得每个充满珠跳动管已被击败1分钟总。
- 重复步骤1.33〜1.35,直到8填充珠跳动管(或离心机可以容纳的最大数量)HAVE被处理。然后,在15毫升猎鹰( 图3e)构建过滤装置。添加一个新的珠跳动帽,平板部分面朝上,以15毫升猎鹰的底部。然后,从加工珠跳动管, 按微层析柱去除瓶盖牢牢地处理上珠跳动管的末端,直到完全密封 。折断微层析柱洗脱结束,并把微层析柱,洗脱结束了,进入空珠钉珠管。将这个复杂的分为15毫升猎鹰。重复所有8填充珠跳动管;保持在冰上完成时。
- 8离心机过滤设备,猎鹰管不封顶,在6000×g离心5分钟,在4°C至提取物和沉淀物从珠中分离出来。
- 验证每个珠子跳动管已经产生可行的提取物 。适当敲打提取不会浑浊,沉淀将有两个不同的层。抛弃一切浑浊管,并从非浑浊管转移上清我NTO个人1.75毫升微离心管中, 同时尽可能少的丸粒可能。置于冰上,直到所有的珠跳动管已被处理。参见图3f一个比较正确与不正确地处理珠跳动管。
- 从前面的步骤以12,000 g在4℃下10分钟的离心微量离心管
- 传输颗粒的上清液进入用吸管,巩固500微升到一个新的珠跳动空管珠跳动管。
- 孵育前一步骤, 以除去珠跳动的上限 ,以220rpm,37℃下80分钟。这个步骤消化使用过程中胎边卷边过程中释放的内源性外切核酸酶其余的核酸,并且可以由站立在胎圈跳动管在组织培养管中进行。
- 准备透析材料。完整S30B缓冲液配制中加入2毫升1 M DTT至2升先前准备S30B的。混合,并加入900毫升成每两个STerile 1升烧杯中。加无菌磁力搅拌器在每个烧杯中,保持在4℃下
- 步1.41后, 提取应该看看混浊 。合并提取液用1.5毫升分装在1.75毫升微离心管中,并离心12000克10分钟,在4℃下
- 用移液管,巩固沉淀的上清液进入冰15毫升猎鹰管,并加盖管和反相拌匀。 节省10微升上清液冰上步骤1.47。
- 确定提取物中产生的总金额,并通过浸没在S30B,持续2分钟,假设2.5毫升提取的每个磁带盒水合物的10K MWCO透析盒所需的数量。
- 加载磁带用2.5ml提取物。每个烧杯中可能需要长达2盒;透析,搅拌,在4℃下3小时注:盒部分负载是可以接受的。透析增加蛋白产量。
- 在上一步中,表征蛋白质提取物浓度用Bradford法,使用提取物保存在步骤1.44。见参考文献2的细节。
- 透析完成后,加入1.5ml 1.75 ml微量离心管等分提取物。离心机以12,000 g 10分钟,在4℃下一种粒料将形成在管的底部。
- 巩固上层清液从上一步中吹打成冰15毫升猎鹰管。通过反相5至10倍同质化。
- 基于通过布拉德福德在步骤1.47确定的浓度,确定提取物的量分装成单个1.75毫升管。 每个单独的管应该有一个体积与810-900毫克总蛋白。提取应该有一个总蛋白浓度大于27毫克/毫升。这个步骤需要协助进行方便 注:低于30毫克/毫升的等分试样萃取入30μl的等分试样,并且规模如果浓度越高,例如,提取物等分试样在28毫克/毫升以30微升,并且等分试样提取物在32mg / ml的28.1微升。
- 分装提取物下面的步骤1.50,注意避免气泡。闪冻提取物在液氮注:等份,气泡可以通过以10000×g于4℃离心30秒去除
- 删除使用一个过滤器从液氮管,并立即储存于-80°C. 安全:戴防护眼镜;提取液管的上限可能由于液态氮和室温温差脱落 。
2。氨基酸溶液的制备
氨基酸溶液应在散装准备。以下几招利用RTS氨基酸采样的一个完整的工具包,提供足够约11,000单反应。如果缩减,建议使用不低于一半的试剂盒。每个氨基酸的股票被供给在1.5毫升,168毫,除了亮氨酸在140毫。氨基酸溶液的最终组成为:亮氨酸,5 mM时,所有其他氨基酸,6毫米。这是4倍工作浓度。
- 从-20℃取出所有20种氨基酸,并在室温下解冻。一旦解冻,涡直到氨基酸溶解,如果有必要培养在37℃。后的氨基酸被溶解后,将所有氨基酸在冰上除了天冬酰胺,苯丙氨酸,和Cys,这是在室温下保存。半胱氨酸可能无法完全溶解 。
- 在冰上,加上12毫升无菌水的无菌50毫升Falcon管中。
- 加入1.5ml每种氨基酸的顺序如下 ,注意每次加入后旋涡振荡猎鹰管,并保持解决方案上冰:丙氨酸,精氨酸,天冬酰胺,天冬氨酸,谷氨酰胺,谷氨酸,甘氨酸,他,法兰西岛大区,赖氨酸,见了,苯丙氨酸,临,丝氨酸,苏氨酸,缬氨酸,色氨酸,酪氨酸,亮氨酸,半胱氨酸。半胱氨酸可以添加一个暂停。 添加后,旋涡,直到解决方案是比较明确的,如果有必要培养在37℃。半胱氨酸可能无法完全溶解 。
- 分装氨基酸溶液到50支一每26微升冰。在每管500微升冰分装的其余部分。 26微升等份,将用于校准提取物,而500微升等分将用于制备缓冲, 虽然分装,涡主要股票经常以避免悬挂分配不均 。
- 在液氮中,并储存在-80°C. 安全闪光冻结等分:戴防护眼镜;提取液管的上限可能由于液态氮和室温温差脱落 。
- 可选:开展新制造的氨基酸溶液对先前作出氨基酸溶液的活性测定。
3。能源溶液的制备
能源解决方案既用于校准的粗细胞提取物和用于创建缓冲区,并应在批量制备。以下几招提供足够的约10000单反应。如果缩减,这是recommeNDED使用不低于这里给出的值的1/24。由于能源解决方案是一个显著货币成本,初次使用者可能要准备在1/24的规模。能源解决方案的最终组成是:HEPES pH值8 700毫米,三磷酸腺苷21毫米,GTP 21毫米,CTP 12.6毫米,超五类12.6毫米,tRNA的2.8毫克/毫升,辅酶A 3.64毫米,NAD 4.62毫米,cAMP的10.5毫米,亚叶酸0.95毫米,亚精胺14毫米,3-PGA的420毫米。这是14倍的工作浓度。如果需要的话,在表4中的每个单独的产品可以储存在-80℃以备后用。
- 从-80℃取出所有的化学品在表4中,-20℃,或4℃至室温30分钟。
- 如表4中所述制备的储备溶液。见补充材料1的食谱。置于冰上所有解决方案的准备之后。
- 在15毫升猎鹰管, 按以下顺序添加,注意每次加入后旋涡振荡猎鹰管,并保持解决方案ØÑ冰:3.6×2 M羟乙基,144μl水,1.39毫升核苷酸混合物,576微升50毫克/毫升的tRNA,576微升65毫米辅酶A,276微升175毫米的NAD,170微升650毫米的cAMP,288微升33.9毫米甲酰四氢叶酸,144微升1M的亚精胺和3.09毫升1.4 M 3-PGA。
- 分装的能源解决方案为50个管在每个7微升冰。在每管150微升冰分装的其余部分。 7微升等分试样,将用于校准提取物,而150微升的等分试样,将用于制备缓冲液中。 虽然等分,涡流主要股票频繁 。
- 在液氮中,并储存在-80°C. 安全闪光冻结等分:戴防护眼镜;提取液管的上限可能由于液态氮和室温温差脱落 。
- 可选:开展对先前作出的能源解决方案新制定的能源解决方案的活性测定。
4。缓冲液配制
BUFFER准备要求完成粗细胞提取物制剂,氨基酸溶液的制备,能源溶液的制备。 每个缓冲区是唯一的一个批次的细胞粗提液 。 MG-谷氨酸,谷氨酸钾,和DTT(按顺序)进行了优化,在本节中,产生的反应与表达的最高水平。以下协议利用一个预先写好的模板,TXTL_e(模板)_calibration_JoVE.xlsx( 参考文献3),来校正预先制备的粗细胞提取物和制备缓冲液中。然而,人们也可以校准粗细胞提取物和通过手动优化的Mg-谷氨酸盐,谷氨酸钾,和DTT和设置缓冲,使得随着提取液,它是一个总反应体积的75%缓冲液制备无模板。如果手动校准,最终的反应条件下可以在步骤5中找到。
- 完成“常规数据”的形式。
- 解冻在冰上的100mM的Mg-谷氨酸(4℃),3M K-谷氨酸(4℃),6mM的氨基酸溶液(26μL,-80℃),能源解决方案(7微升,-80℃),100 mM的DTT(-20℃),阳性对照DNA(-20°C),40%的PEG- 8000(4℃),细胞粗提液(-80°C)和水(4℃) 注:使用1 nM的工作浓度的pbest-OR-OR-PR-UTR1-deGFP-T500(Addgene质粒40019)为阳性对照(激发波长485nm,发射525纳米),或产生高信号强度的另一个参考。4
- 预备七10.5微升反应,检测范围为4-10 mm附加的Mg-谷氨酸,通过等分股票的Mg-谷氨酸的量设置成单独的微量离心管中。注意:虽然10.5微升反应初始准备,最终反应为10μL。
- 准备主结构为根据模板中显示“的Mg-谷氨酸校准”,增加一个额外的80毫米的K-谷氨酸。保持在冰上, 涡流增加每个项目的后 注:这里和在模板中给出的值是除了Mg的谷氨酸盐,谷氨酸钾,和DTT存在于用来使细胞粗提液的S30B缓冲器的量。
- 加入预混到含Mg-谷氨酸样品,并准备反应。参见步骤5.10至5.13的详细说明。
- 运行反应在29℃下,无论是在孵化器或平板阅读器。
- 由最终表达水平和蛋白表达( 图4a)的最大速率确定最佳的Mg-谷氨酸浓度注:运行时具体取决于实验,但通常持续不到8小时。
- 根据K-谷氨酸重复步骤4.2至4.7的“K-谷氨酸校准”设置的Mg-谷氨酸含量对那些在步骤4.7中找到。
- 在数码地面电视重复步骤4.2至4.7「德勤校准“设置的Mg-谷氨酸含量对那些在步骤4.7和K-谷氨酸含量对那些在步骤4.8中找到图注:我们发现,加入DTT没有显著影响最终表达水平。
- 使用在校准发现下“缓冲组合物”,以确定缓冲器的要制备的组合物的值。基于粗制细胞提取物的生成量,一个主混合物的配方生产用于缓冲器的设定量。
- 在冰上预混液配方中列出解冻等分。一旦解冻,准备主结构, 每增加一个项目后,保持在冰和涡旋 。
- 根据等分试样的金额入账“缓冲区组成。”闪光冻结缓冲管在液氮中, 虽然分装,涡主要股票频繁 。
- 删除使用一个过滤器从液氮管,并立即储存于-80°C. 安全:戴防护眼镜;提取液管的上限可能由于液态氮和室温温差脱落 。
5。一个TX-TL反应的实验执行
最终的反应条件是:8.9-9.9毫克/毫升prote的在(从原油中提取物),4.5毫米,10.5毫米,镁谷氨酸,40-160毫米的K-谷氨酸,0.33-3.33 mM的DTT,1.5 mM的每个氨基酸除亮氨酸,1.25毫亮氨酸,50毫米的HEPES,1.5 mM的ATP和GTP,0.9毫米的CTP和UTP,0.2毫克/毫升的tRNA,0.26毫米辅酶A,0.33 mM的NAD,0.75毫米的cAMP,0.068毫亚叶酸,1 mM的亚精胺,30毫米3-PGA,2%的PEG-8000。 一个基本的TX -TL反应有3份(管):细胞粗提液,缓冲液和DNA。的比例为:75%缓冲液和提取物,25%的DNA 反应可以在体积变化 ,我们用10微升按照惯例,以尽量减少反应体积中,使在384孔板上运行。更大的卷需要搅拌适当的氧。以下协议利用一个预先写好的模板,TXTL_JoVE.xlsx( 参考文献4)中,进行10微升反应。 紫色条表示用户输入的值,并在蓝色物品表明额外的试剂添加到反应中 。但是,我们也可以进行反应机智木模板按照上面概述的反应条件进行。
- 完成“常规数据”的形式。
- 在“预混准备,”从步骤4.1插入提取物的百分比值到紫色的盒子。
- 使用“预混准备”(行10-17)和“DNA上下游”(行19-50)节设计实验,在硅片 。一般来说,常量可以被放入“预混准备”一节,而变量可以被放入“DNA上下游”部分。 最小化每个实验样本,以避免样品挥发和实验开始时间偏差 。参见图6的示例设置。
- 在“预混准备,”添加试剂如诱导剂或蛋白质,这会在所有样品中恒定的浓度。与第14行开始,填写蓝色阴影区域,保持一种试剂到每一行。单位是相对比例。
- 在“DNA上下游,”增加的DNA将样品SPECIFIC。样品ID#1和#2对应于阳性和阴性对照。样品ID#3及以上的用户可修改的DNA,股票浓度以ng /μL,长度在碱基对,在纳米所需的最终浓度,并重复(10微升反应)。自动计算股票的DNA,以达到所需的最终浓度的量。 ,在该行的款项总额为10.5 * n,其中n是重复的次数注意:虽然最终反应体积为10微升,该计算假设每个反应10.5微升的总体积,以占容积移液过程中丢失。
- 在“DNA上下游,”添加试剂或额外的DNA,其将样品具体到蓝色列。在纳米股票的DNA浓度可以在“DNA上下游,”来计算,而样品特定试剂需要基于10.5 * n个反应总体积的手工计算。所输入的体积减去了同一行的水量。
- 删除所需的NUMBE缓冲液,细胞粗提液,并在正压控制的从-20℃或-80℃下管“管解冻”的r和在冰上融化。
- 准备DNA样本。对于每个样品编号,等分列所示的DNA,水,按照“DNA上下游”部分到微离心管中,在室温下用户提供的项目注:为避免样品损失,最近校准的移液管,低粘移液器吸头和微型离心管建议。
- 当从步骤5.7管解冻,准备主结构包括缓冲,提取和基于橙色阴影框中的任何全球用户提供项目, 每增加一个项目后,保持在冰和涡旋 注:提取物是极其粘性。等分试样与泡沫可以通过以10000×g于4℃离心30秒去除
- 添加主结构下的“DNA上下游”(O列)橙色单元格显示为每一个DNA样本量,并保持在室温下TURE。 把这个作为反应起始时间 。
- 涡流每个样品中,并以10,000 xg离心30秒,在室温下,以降低任何残留的样品,并减少气泡。
- 如果进行微离心管中反应,直接孵化,在29°C。否则,移液管加入10μl样品至384孔板注意:在体积大于10μl的反应可能需要搅拌充氧。
- 离心机板上,在4000×g离心30秒,在室温下,以降低任何残留的样品,并减少气泡。后来封板,以防止蒸发。
- 在29°C。 注意运行反应:运行时间取决于试验,但通常在8小时持久。
结果
我们已经提出了五天的协议,用于基于TX-TL无细胞表达系统中的内源性大肠杆菌的准备。细胞粗提液和缓冲液- -用于创建试剂样品时间轴可以在图1中可以找到。一旦创建,这些都可以保存在-80℃可保存一年。创建试剂后,实验装置和执行可以在不到8小时来完成。
此外,我们优化了TX-TL无细胞表达系统表达的条件。其他用户提供的补充,如缓冲区或DNA溶液,应事先标定的毒性。例如,处理的质粒的不同方法由于盐含量会导致不同的表达。我们还测试了的Tris-氯洗脱缓冲液对反应效率( 图5)的效果。
的细胞粗提液的校准,参照步骤4.1至4.9的示例中,示出在图4a中。在一般情况下,我们的实验表明,该细胞粗提液是最敏感的Mg-谷氨酸水平,其次是谷氨酸钾水平。为了证明无细胞表达系统,我们构建和测试基于四环素压制一个负反馈回路26( 图6)。在无细胞表达系统,带或不带ATC相同的电路运行显示deGFP记者八小时后表达的7倍终点的表达变化。虽然这个实验并不需要全球诱导或阻遏,如有必要,他们可以按“主混音准备。”加
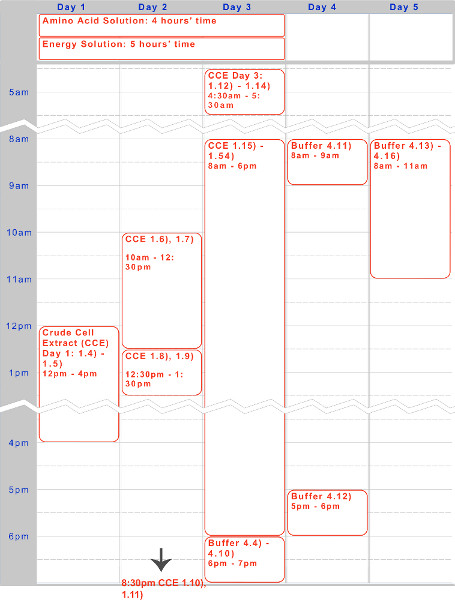
图1。时间轴细胞粗提液,氨基酸溶液,和能源解决方案的准备。为期五天的timelin e表示该协议的典型执行上面给出,过夜孵育和白天的工作步骤进行了优化。
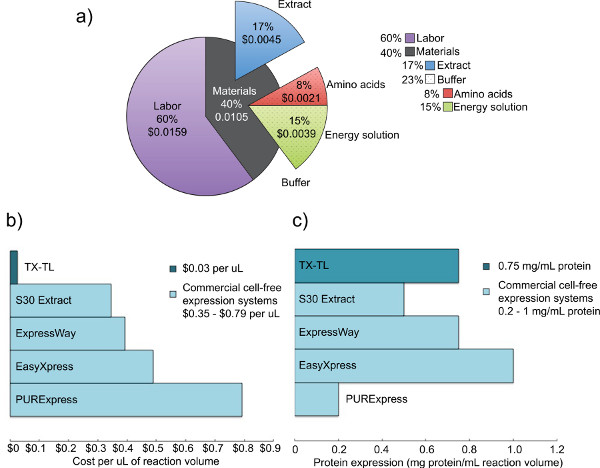
图2。成本和竞争的细胞粗提物的表达分析。一)击穿的TX-TL无细胞表达系统的人工和材料的费用。根据试剂的成本,2012年12月,和14元每小时的劳动力成本。 二)TX-TL无细胞表达系统成本与其他商业系统的比较。成本每微升细分,虽然反应体积可能会有所不同每包。C的 TX-TL无细胞表达系统的产量与其他商业系统)的比较。蛋白表达产量由制造商标准确定。/ 50762fig2large.jpg“目标=”_blank“>点击这里查看大图。

图3。加载中珠跳动管和处理。一)细胞珠液粘度正确的示范。 B)珠跳动管装入前快速桌面离心细胞珠的解决方案将有一个粘度取决于许多因素,包括S30A缓冲区添加量,添加的量珠,和时间花在冰上。离心去除加载过程中积累的泡沫。 三)台式离心后的气泡浮出水面。气泡的大小会有所不同的,他们可以用枪头D为弹出或删除)完全填充珠跳动管封盖之前。形成于珠跳动吨一个弯月形宇部,和盖有足够的覆盖,并造成少量的过满。 五)正确装入过滤装置。这些可重复使用正确与不正确地处理珠跳动管。F)的比较。左边的管子是一个良好的节拍管 - 它设有一个小型和精心描绘的顶层,而且非常透明的上清液。右边的管子是最理想的,基于更大的,朦胧的第二层和朦胧的上清液上。管是最理想的不应该进行额外的处理。
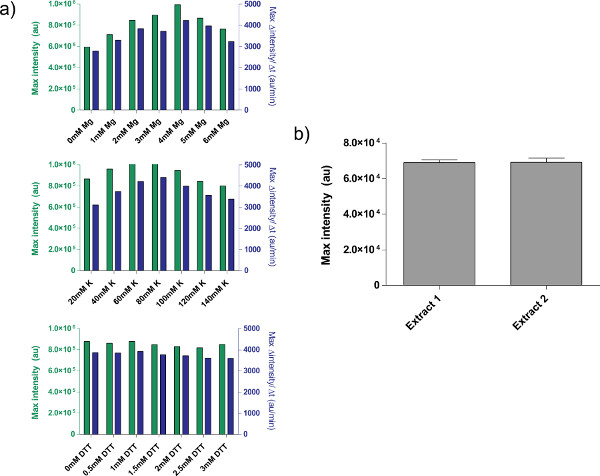
图4。粗提物制剂特性。一)典型的校准曲线为细胞粗提液。粗提取物进行校准,以获得更多的Mg-谷氨酸盐,谷氨酸钾,和DTT的水平,按该顺序。显示的是端点fluorescencË后8小时,以及蛋白生产的基础上有12分钟的移动平均线的最大速率。基于这些情节,额外的Mg-谷氨酸可接受的范围是4毫米,谷氨酸钾是60-80毫米,和DTT是0-3毫米。需要注意的是每一个粗提物需要进行独立校准的这三个变量。 二)从提取物制剂的变化。编制日期不同的两个粗提物端点荧光显示,误差线是从1在不同的日子三名独立运行的标准偏差。 点击这里查看大图 。
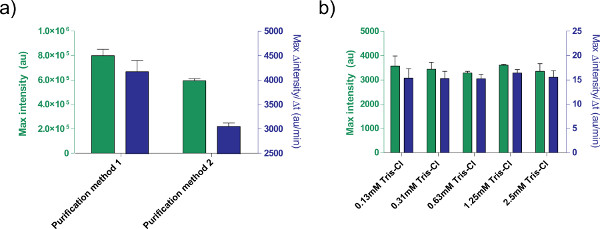
图5。对影响表达效率的DNA溶液。两种不同的纯化)的比较方法处理的质粒。 1纳米的pbest-OR-OR-PR-UTR1-deGFP-T500时,采用只有一个QIAprep离心微量制备试剂盒(纯化方法1)或后处理,用QIA快速PCR纯化试剂盒制备的(纯化方法2)。示出的是8小时,以及蛋白质产量的基础上在12分钟的移动平均最大比率后端点荧光。误差棒是从1在不同的日子四个独立运行的标准偏差。洗脱缓冲液b)对 (的Tris-Cl计)。不同浓度的Tris-氯进行比较的基础上的1纳米的pbest-OR-OR-PR-UTR1-deGFP-T500的表达的无细胞表达反应。给定浓度在反应的最终浓度的Tris-氯;用洗脱缓冲液是10毫摩尔Tris-CL。误差棒是从1在不同的日子三名独立运行的标准偏差。 点击这里查看大图 。
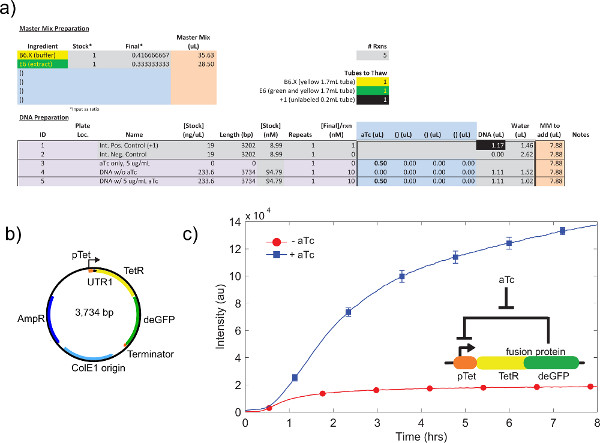
图6。一个负反馈回路的采样TX-TL运行。 a)样品无细胞反应执行的设置。 “上”与负反馈回路的“关闭”状态,与阳性和阴性对照。 二)负反馈回路的质粒图谱。 三)代表结果的测试。数据反映了实验中a)和b)中,与阴性对照组相减信号。显示在插入基因电路。误差棒是从1在不同的日子三名独立运行的标准偏差。 点击这里查看大图 。
| 名称 | 浓度 | 量 | 消毒 | 笔记 |
| 氯霉素(厘米) | 34毫克/毫升在乙醇中 | 1毫升 | 过滤消毒(0.22微米) | 可以保存在-20℃下以备后用较大的体积进行。 |
| 的2×YT + P +厘米琼脂平板 | 31克/ L的2×YT,40 mM磷酸氢二钾,22 mM磷酸钾一元,34微克/毫升氯霉素 | 1板 | 高压灭菌器 | |
| 的2×YT + P媒体 | 31克/ L的2×YT,40 mM磷酸氢二钾,22 mM磷酸钾一元 | 4升 | 高压灭菌器 |
表1中。试剂的细胞粗提液协议的第1天。
| 名称 | 浓度 | 量 | 消毒 | 笔记 |
| Tris碱 | 2M的 | 250毫升 | 过滤消毒(0.22微米)或高压灭菌器 | 可在室温下保存。 |
| DTT | 1个月 | 6毫升 | 过滤消毒(0.22微米) | 可以制成较大的体积,并存储于-20℃以备后用。 |
| S30A缓冲区 | 14毫米的Mg-谷氨酸盐,60mM的K-谷氨酸的50mM Tris,pH值7.7 | 2升 | 高压灭菌器 | 至pH值达到7.7,滴定用乙酸。加入DTT至2毫米的最终浓度使用前。贮存于4℃。 |
| S30B缓冲 | 14毫米镁-谷氨酸,60毫米的K-谷氨酸,〜5毫米的Tris,pH值8.2 | 2升 | 高压灭菌器 | 为了达到pH值为8.2,滴定2M三。加入DTT至1 mM的终浓度使用前。贮存于4℃。 |
表2。试剂为细胞粗提液协议的第2天。
| 鹘 | ||||
| 1 | 2 | 3 | 4 | |
| 空50毫升猎鹰(G) | ||||
| 50毫升猎鹰颗粒(G) | ||||
| 颗粒质量(50毫升猎鹰与沉淀-空50毫升猎鹰)(G) | ||||
| S30A缓冲区量增加(颗粒质量* 0.9)(毫升) | ||||
| 珠总质量增加(颗粒质量* 5.0)(G) | ||||
表3。 S30A缓冲区和珠质量计算器,用于细胞粗提液协议的第3天。
| 名称 | 浓度 | 量 | 消毒 | 笔记 |
| HEPES | 2 M,pH值8 | 4毫升 | 无 | 为了达到pH值为8,滴定用KOH。 |
| 核苷酸混合物 | 156毫摩尔ATP和GTP,94毫米的CTP和UTP,pH值7.5 | 1.5毫升 | 无 | 为了达到pH为7.5,滴定用KOH。 |
| 氨酰tRNA | 50毫克/毫升 | 600微升 | 无 | |
| 辅酶A | 65毫米 | 600微升 | 无 | |
| NAD | 175毫米,pH值7.5-8 | 300微升 | 无 | 为了达到PH值7.5-8,滴定用Tris在2 M。 |
| 腺苷 | 650毫米,pH值为8 | 200微升 | 无 | 为了达到pH值为8,用滴定三在2 M。 |
| 亚叶酸 | 33.9毫 | 300微升 | 无 | 虽然只有300微升是必要的,配方中补充是1.15毫升。 |
| 亚精胺 | 1个月 | 150微升 | 无 | 储存在4℃下,加热至37°C至融化。 |
| 3-PGA | 1.4 M,pH值7.5 | 3.2毫升 | 无 | 以达到pH为7.5,滴定用Tris于2 M。 |
表4。试剂的能源解决方案的协议做准备。
参考文献1。食谱的项目。
氯霉素,34毫克/毫升:准备0.51克氯霉素加乙醇至15ml。过滤消毒(0.22微米)等分至1ml管,于-20℃供以后使用商店。
的2xYT + P +厘米琼脂板:准备1.24克的2xYT,1.6毫升磷酸氢二钾溶液@ 1 M,0.88毫升磷酸二氢钾溶液@ 1米,0.6克琼脂和水至40ml。高压灭菌。放冷至50℃,加入40微升厘米。分装25毫升成100×15毫米培养皿中,放凉了一个小时。
的2xYT + P介质:准备124克的2xYT,160毫升磷酸氢二钾溶液@ 1 M,88毫升磷酸二氢钾溶液@ 1 M和水为4L Aliqu加时赛出到2×1.88 L和0.24 L。高压灭菌。
Tris碱,2M:准备60.57克Tris碱和水至250 mL。消毒,储存在室温下以备后用。
DTT,M:准备2.31 克DTT和水至15ml。过滤消毒(0.22微米),分装至1 ml离心管,于-20℃以备后用商店。
S30A缓冲区:准备10.88克的Mg-谷氨酸和24.39克谷氨酸钾50毫升的Tris在2M,乙酸(pH值7.7),和水2升高压釜中,在4℃下储存,加入4 mL 1 M DTT使用前。
S30B缓冲区:准备10.88克的Mg-谷氨酸和24.39克谷氨酸钾,三为2米(pH值8.2),和水2升高压釜中,在4℃下储存,加2毫升的1摩尔使用前DTT。
HEPES:准备1.91克HEPES(分子量238.21),KOH(pH为8),和水到4ml。
氨酰tRNA:准备30毫克的tRNA和水至600μL。
辅酶A:准备30毫克辅酶A(分子量767.53)和水至600μL。
NAD加入 34.83毫克的NAD(MW 663.43),三在2 M(至pH 7.5-8)和水到300微升。 (加入27微升的Tris中的2 M来使溶液至pH 7.5-8)。
营:新增42.80毫克的cAMP(MW 329.22),三为2米(至pH为8),和水至200μL。 (加入73微升的Tris中的2 M来使溶液至pH为8)。
亚叶酸(33.9毫米):为20毫克固体亚叶酸钙盐(分子量511.5),加1.15毫升水。
亚精胺:准备23.55微升亚精胺(分子量145.25)和水至150μL。在室温在37°C短暂熔化后准备
3-PGA:添加1.03克3-PGA(分子量230.02)的液,Tris在2米(pH为7.5)和水至320毫升(添加1.73的Tris中的溶液在2 M来使溶液pH为7.5)。
NucleotIDE混合:加入145毫克的三磷酸腺苷二钾盐二水(619.4兆瓦),133毫克的GTP二钠盐(MW 567.14),79.4毫克CTP二钠盐(分子量563.16),82.6毫克的类UTP三钠盐二水(分子量586.12) ,氢氧化钾的15%稀释液(pH为7.5),以及水至1.5毫升(加入353微升的KOH在15%稀释,使溶液pH为7.5)。
补充材料2。 Bradford法。
- 从4℃取出布拉德福德剂,并设置在室温下。
- 制备50微升BSA标准在1毫克/毫升和0.1毫克/毫升。
- 准备40微升20倍稀释提取物从步骤1.47。
- 加入800μl水至7比色皿。
- 制备标准比色皿为0毫克/毫升,1毫克/毫升(10微升0.1毫克/毫升BSA),2毫克/毫升(20微升0.1毫克/毫升BSA),4毫克/毫升(4微升1毫克/毫升BSA) ,6毫克/毫升(6微升1毫克/毫升BSA)。
- 准备实验皿2微升的样品和4微升的样品。
- 加入200μl布拉德福德剂到每个试管混匀B井Ÿ移液。在室温下孵育至少10分钟。
- 制作标准曲线使用比色皿从步骤6.5外径595纳米。拒绝标准曲线如果r 2 <0.95。
- 确定提取物浓度使用比色皿从步骤6.6外径595纳米。
补充材料3。缓冲校准电子表格。
见TXTL_e(模板)_calibration_JoVE.xlsx 。
补充材料4。无细胞表达运行电子表格。
讨论
内源性大肠杆菌根据这里所描述TX-TL无细胞表达系统是一个易于运行三级管反应,可以采取少于八个小时,从成立到数据收集。创建的所有试剂的过程中,需要五天的时间总量(与仅一天显著劳动力需求),但产生的粗提取物为3000和反应缓冲液,使试剂为10,000的反应( 图1)。此外,粗提物和缓冲,使试剂可保持稳定至少1年,在-80°C,使一个准备的多种用途4。在$ 0.11每10μl反应体系(0.26美元包括劳动力),成本比同类低98%商业系统( 图2)。
然而,也有一些未解决的限制,该系统。每个细胞粗提取物制剂的端效率可以根据用户的能力和对环境条件的变化,虽然吨YPICAL产量变化是在5-10%之间( 图4b)。因此,批与批之间的变化在两个端点表达和表达动力学是可以预料的。这些变化可能会保持,直到提取物充分的特点,或直至提取物创作是完全自动化的。如果无细胞表达系统用于进行敏感的定量实验中,最好是用相同批次的细胞粗提液上运行的所有实验。从一个单一的细胞粗提液批次,约3000反应中,产率应该是足够的典型实验课程。虽然我们怀疑的变化可以通过扩大和自动化的程序进行删除,这样的尝试会涉及到大量的资源投入。
另外,虽然终点的表达水平是相当容易确定,更多的工作需要在理解动力学固有的无细胞系统来完成。它是已知的,这两个资源competition和资源限制会影响表达动态。例如,有限的内生西格玛70可导致饱和制度与增加DNA模板制备表达谱类似于核苷酸或氨基酸的耗竭。9,27然而,动力学没有被完全理解,利用该系统。对于收益率的纯增加,优化可以通过机器学习的方法来完成。资源竞争和限制28问题可以通过数学模型实验数据处理验证。
这里提出的协议是为BL21-Rosetta2菌株进行了优化,但推广到其他E。大肠杆菌菌株。修改在BL21-Rosetta2,如除去编码基因Lon蛋白酶和另外的基因编码稀有tRNA的的,允许的最大的蛋白质生产。我们已经尝试了协议,与其他两个菌株提取物-只有BL21和BL21一个淘汰赛的trxA安ð发现少了50%蛋白产量。我们假设单产使用其他菌株时同样减少。在参数,如开关的2×YT培养基为LB和其他丰富的肉汤等变化,导致减少蛋白质产量。
利用内源性和外源性转录-翻译机械和调控机制的无细胞表达系统中有两种蛋白质和代谢物的表达和在合成生物学广泛的应用,而是被限制在T7调节电路3,29,人们可以设想产生复杂的生物分子在使用本机E的 组合使用者可控制的设定大肠杆菌的启动子和外源转录和调控机制。无细胞分裂和代谢的局限性,可变性在合成电路如repressilator或在代谢工程化途径,如那些生产青蒿素可以减少或更好的理解。30,31我们甲肝e一起使用的这些优点来实现基因开关,以及理解σ因子封存9,32这样的技术还可以形成的“最小”或“人造”的细胞骨干-小的,良好表征的和自足的体现单位提取物。33,34
最终,我们预期这种内源性的无细胞表达系统的直接用途为合成生物学原型环境。绰号“TX-TL生物分子实验电路板”的无细胞表达系统提供了一个可控制的环境下,合成电路最终目的地是在体内表达可以进行几轮原型-测试的基础质粒,线性的,或化学原料合成的DNA周期,其次通过分析和快速修改。原型回合可以通过目前正在开发预测的数学模型来辅助。通过消除克隆和体内操纵非最终电路,我们预计工程师neering周期时间将减少,而不是当前周的标准为1-3天。
披露声明
作者宣称,他们有没有竞争的财务权益。
致谢
我们感谢Jongmin金,丹西耶戈尔 - 加斯金斯,阿努Thubagere,和杨诺为协助精简协议,克莱尔和陈李巴克利在项目的早期阶段帮助。这种材料是基于由美国国防高级研究计划局(DARPA / MTO)的部分资助生活铸造程序,合同编号HR0011-12-C-0065(DARPA / CMO.ZZS也支持由加州大学洛杉矶分校/加州理工学院医学科学家的工作培训项目奖学金和由国防部,科学研究,国防科学与工程研究生(NDSEG)奖学金,32 CFR 168A的空军办公室。本文件所载的观点和结论是那些作者的,不应该被解释为代表正式的政策,不论是明示的国防高级研究计划局和美国政府或暗示的保证。
材料
| Name | Company | Catalog Number | Comments |
| 2xYT | MP biomedicals | 3012-032 | |
| 3-PGA | Sigma-Aldrich | P8877 | |
| ATP | Sigma-Aldrich | A8937 | |
| Bacto-agar | BD Diagnostics | 214010 | |
| Bead-beating tubes (polypropylene microvials) | BioSpec | 522S | |
| Beads, 0.1mm dia. | BioSpec | 11079101 | |
| BL21 Rosetta 2 E. coli strain | Novagen | 71402 | |
| Bradford BSA Protein Assay Kit | Bio-rad | 500-0201 | |
| cAMP | Sigma-Aldrich | A9501 | |
| Chloramphenicol | Sigma-Aldrich | C1919 | |
| CoA | Sigma-Aldrich | C4282 | |
| CTP | USB | 14121 | |
| Cuvettes, 1.5ml | Fisher | 14-955-127 | |
| DTT | Sigma-Aldrich | D0632 | |
| Folinic acid | Sigma-Aldrich | F7878 | |
| GTP | USB | 16800 | |
| HEPES | Sigma-Aldrich | H6147 | |
| K-glutamate | Sigma-Aldrich | G1149 | |
| Mg-glutamate | Sigma-Aldrich | 49605 | |
| Micro Bio-Spin Chromatography Columns | Bio-Rad | 732-6204 | |
| NAD | Sigma-Aldrich | N6522 | |
| Nunc 384-well optical bottom plates | Thermo-Scientific | 142761 | |
| Nunc sealing tape | Thermo-Scientific | 232701 | |
| PEG-8000 | Promega | V3011 | |
| Potassium phosphate dibasic solution | Sigma-Aldrich | P8584 | |
| Potassium phosphate monobasic solution | Sigma-Aldrich | P8709 | |
| RTS Amino Acid Sampler | 5 Prime | 2401530 | |
| Slide-A-Lyzer Dialysis Cassettes, 10k MWCO (Kit) | Thermo-Scientific | 66382 | |
| Spermidine | Sigma-Aldrich | 85558 | |
| Tris base | Fischer | BP1521 | |
| tRNA (from E. coli) | Roche Applied Science | MRE600 | |
| UTP | USB | 23160 | |
| 1L Centrifuge Bottle | Beckman-Coulter | A98813 | This is specific for Avanti J-series; obtain equivalent size for centrifuge in use. |
| 4L Erlenmeyer Flask | Kimble Chase | 26500-4000 | |
| Avanti J-26XP Centrifuge | Beckman-Coulter | 393127 | Or 1L-capable centrifuge equivalent. |
| Forma 480 Orbital Shaker | Thermo Scientific | 480 | Or chest-size 6x4L shaker equivalent. |
| JLA-8.1000 Rotor | Beckman-Coulter | 363688 | Or 1L-capable, 5000 x g rotor equivalent for centrifuge. |
| Mini-Beadbeater-1 | BioSpec | 3110BX | |
| Supplemental Material 1. Recipes for Items. Chloramphenicol, 34 mg/ml: Prepare 0.51 g chloramphenicol and add ethanol to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. 2xYT+P+Cm agar plate: Prepare 1.24 g 2xYT, 1.6 ml potassium phosphate dibasic solution @ 1 M, 0.88 ml potassium phosphate monobasic solution @ 1 M, 0.6 g agar, and water to 40 ml. Autoclave. Let cool to 50 °C and add 40 μl Cm. Aliquot 25 ml into a 100x15 mm petri dish, and let cool for an hour. 2xYT+P media: Prepare 124 g 2xYT, 160 ml potassium phosphate dibasic solution @1 M, 88 ml potassium phosphate monobasic solution @ 1 M, and water to 4 L. Aliquot out into 2x1.88 L and 0.24 L. Autoclave. Tris base, 2 M: Prepare 60.57 g Tris base and water to 250 ml. Sterilize, store at RT for later use. DTT, 1 M: Prepare 2.31 g DTT and water to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. S30A buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, 50 ml Tris at 2M, acetic acid (to pH 7.7), and water to 2 L. Autoclave, store at 4 °C, add 4 ml 1 M DTT before use. S30B buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, Tris at 2 M (to pH 8.2), and water to 2 L. Autoclave, store at 4 °C, add 2 ml 1 M DTT before use. HEPES: Prepare 1.91 g HEPES (MW 238.21), KOH (to pH 8), and water to 4 ml. tRNA: Prepare 30 mg of tRNA and water to 600 μl. CoA: Prepare 30 mg of CoA (MW 767.53) and water to 600 μl. NAD: Add 34.83 mg of NAD (MW 663.43), Tris at 2 M (to pH 7.5-8), and water to 300 μl. (Add 27 μl of Tris at 2 M to bring the solution to pH 7.5-8). cAMP: Add 42.80 mg of cAMP (MW 329.22), Tris at 2 M (to pH 8), and water to 200 μl. (Add 73 μl of Tris at 2 M to bring the solution to pH 8). Folinic Acid (33.9 mM): To 20 mg of solid folinic acid calcium salt (MW 511.5), add 1.15 ml water. Spermidine: Prepare 23.55 μl of spermidine (MW 145.25) and water to 150 μl. Prepare at room temperature after melting briefly at 37 °C. 3-PGA: Add 1.03 g of 3-PGA (MW 230.02), Tris at 2 M (to pH 7.5), and water to 3.2 ml. (Add 1.73 ml of Tris at 2 M to bring the solution to pH 7.5). Nucleotide Mix: Add 145 mg of ATP dipotassium salt dihydrate (MW 619.4), 133 mg of GTP disodium salt (MW 567.14), 79.4 mg of CTP disodium salt dihydrate (MW 563.16), 82.6 mg of UTP trisodium salt dihydrate (MW 586.12), KOH at 15% dilution (to pH 7.5), and water to 1.5 ml. (Add 353 μl of KOH at 15% dilution to bring the solution to pH 7.5). Supplemental Material 2. Bradford Assay.
See TXTL_e(template)_calibration_JoVE.xlsx. Supplemental Material 4. Cell-free expression run spreadsheet. See TXTL _JoVE.xlsx. | |||
参考文献
- Noireaux, V., Bar-Ziv, R., Libchaber, A. Principles of cell-free genetic circuit assembly. Proceedings of the National Academy of Sciences of the United States of America. 100, 12672-12677 (2003).
- He, M. Y., He, Y. Z., Luo, Q., Wang, M. R. From DNA to protein: No living cells required. Process Biochem. 46, 615-620 (2011).
- Forster, A. C., Church, G. M. Synthetic biology projects in vitro. Genome Res. 17, 1-6 (1101).
- Shin, J., Noireaux, V. Efficient cell-free expression with the endogenous E. Coli RNA polymerase and sigma factor 70. Journal of biological engineering. 4, 8 (2010).
- Shimizu, Y., et al. Cell-free translation reconstituted with purified components. Nat Biotechnol. 19, 751-755 (2001).
- Shin, J., Noireaux, V. An E. coli Cell-Free Expression Toolbox: Application to Synthetic Gene Circuits and Artificial Cells. Acs Synth Biol. 1, 29-41 (2012).
- Shin, J., Noireaux, V. Study of messenger RNA inactivation and protein degradation in an Escherichia coli cell-free expression system. Journal of biological engineering. 4, 9 (2010).
- Shin, J., Jardine, P., Noireaux, V. Genome Replication, Synthesis, and Assembly of the Bacteriophage T7 in a Single Cell-Free Reaction. Acs Synth Biol. 1, 408-413 (2012).
- Siegal-Gaskins, D., Noireaux, V., Murray, R. M., Pao, L., Abramovitch, D. Biomolecular resource utilization in elementary cell-free gene circuits. , 1531-1536 (2013).
- Karzbrun, E., Shin, J., Bar-Ziv, R. H., Noireaux, V. Coarse-grained dynamics of protein synthesis in a cell-free system. Physical review letters. 106, 048104 (2011).
- Hoagland, M. B., Stephenson, M. L., Scott, J. F., Hecht, L. I., Zamecnik, P. C. Soluble Ribonucleic Acid Intermediate in Protein Synthesis. J Biol Chem. 231, 241-257 (1958).
- Wood, W. B., Berg, P. Effect of Enzymatically Synthesized Ribonucleic Acid on Amino Acid Incorporation by a Soluble Protein-Ribosome System from Escherichia Coli. Proceedings of the National Academy of Sciences of the United States of America. 48, 94 (1962).
- Zubay, G. In-Vitro Synthesis of Protein in Microbial Systems. Annu Rev Genet. 7, 267-287 (1973).
- Pratt, J. M., Hames, B. D., Higgins, S. J. . Transcription and Translation: A Practical Approach. , 179-209 (1984).
- Kim, H. C., Kim, D. M. Methods for energizing cell-free protein synthesis. Journal of bioscience and bioengineering. 108, 1-4 (2009).
- Michel-Reydellet, N., Calhoun, K., Swartz, J. Amino acid stabilization for cell-free protein synthesis by modification of the Escherichia coli genome. Metabolic engineering. 6, 197-203 (2004).
- Liu, D. V., Zawada, J. F., Swartz, J. R. Streamlining Escherichia coli S30 extract preparation for economical cell-free protein synthesis. Biotechnology progress. 21, 460-465 (2005).
- Andrianantoandro, E., Basu, S., Karig, D. K., Weiss, R. Synthetic biology: new engineering rules for an emerging discipline. Molecular systems biology. 2, 2006.0028 (2006).
- Kwok, R. Five hard truths for synthetic biology. Nature. 463, 288-290 (2010).
- Tabor, S., Richardson, C. C. A bacteriophage T7 RNA polymerase/promoter system for controlled exclusive expression of specific genes. Proceedings of the National Academy of Sciences of the United States of America. 82, 1074-1078 (1985).
- Lewicki, B. T., Margus, T., Remme, J., Nierhaus, K. H. Coupling of rRNA transcription and ribosomal assembly in vivo. Formation of active ribosomal subunits in Escherichia coli requires transcription of rRNA genes by host RNA polymerase which cannot be replaced by bacteriophage T7 RNA polymerase. Journal of molecular biology. 231, 581-593 (1993).
- Iskakova, M. B., Szaflarski, W., Dreyfus, M., Remme, J., Nierhaus, K. H. Troubleshooting coupled in vitro transcription-translation system derived from Escherichia coli cells: synthesis of high-yield fully active proteins. Nucleic acids research. 34, e135 (2006).
- Kigawa, T., et al. Preparation of Escherichia coli cell extract for highly productive cell-free protein expression. Journal of structural and. 5, 63-68 (2004).
- Matsuda, T., et al. Improving cell-free protein synthesis for stable-isotope labeling. Journal of biomolecular. NMR. 37, 225-229 (2007).
- Sitaraman, K., et al. A novel cell-free protein synthesis system. Journal of biotechnology. 110, 257-263 (2004).
- Becskei, A., Serrano, L. Engineering stability in gene networks by autoregulation. Nature. 405, 590-593 (2000).
- Maeda, H., Fujita, N., Ishihama, A. Competition among seven Escherichia coli sigma subunits: relative binding affinities to the core RNA polymerase. Nucleic acids research. 28, 3497-3503 (2000).
- Caschera, F., et al. Coping with complexity: machine learning optimization of cell-free protein synthesis. Biotechnology and bioengineering. 108, 2218-2228 (2011).
- Hodgman, C. E., Jewett, M. C. Cell-free synthetic biology: thinking outside the cell. Metabolic engineering. 14, 261-269 (2012).
- Elowitz, M. B., Leibler, S. A synthetic oscillatory network of transcriptional regulators. Nature. 403, 335-338 (2000).
- Tsuruta, H., et al. High-level production of amorpha-4,11-diene, a precursor of the antimalarial agent artemisinin, in Escherichia coli. Plos One. 4, e4489 (2009).
- Gardner, T. S., Cantor, C. R., Collins, J. J. Construction of a genetic toggle switch in Escherichia coli. Nature. 403, 339-342 (2000).
- Jewett, M. C., Forster, A. C. Update on designing and building minimal cells. Current opinion in biotechnology. 21, 697-703 (2010).
- Noireaux, V., Libchaber, A. A vesicle bioreactor as a step toward an artificial cell assembly. Proceedings of the National Academy of Sciences of the United States of America. 101, 17669-17674 (2004).
Erratum
Formal Correction: Erratum: Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology
Posted by JoVE Editors on 1/01/1970. Citeable Link.
A correction to Figure 5's legend has been made for the article Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology. Method 1 and method 2 have been switched.Z
The figure legend was update from:
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 1) or post-processed with a QiaQuick PCR purification kit (Purification method 2).
to
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 2) or post-processed with a QiaQuick PCR purification kit (Purification method 1).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。