Method Article
Bir uygulama için Protokoller
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Erratum Notice
Özet
Bu beş günlük protokolü bütün adımlar, ekipman, ve esaslı etkili endojen Escherichia coli sıfırdan TX-TL hücre serbest ifade sistemi oluşturmak ve çalıştırmak için gerekli ek yazılım özetliyor. Reaktif ile protokol 8 kurulumu için saat veya daha az bir tepki toplamak ve işlem verileri alır.
Özet
Ideal hücresiz ifade sistemleri, teorik olarak, bir in vitro platform kontrol edilir. 1 Bu, kontrollü bir şekilde proteinler ve genetik devreleri ifade hem de sentetik biyoloji için bir prototip bir ortam temin etmek için kullanışlıdır. 2,3 bir in vivo hücre ortamı taklit İkinci amaca ulaşmak için, korumak hücresiz ifade sistemleri, endojen Escherichia coli transkripsiyon için mekanizmalar daha doğru bir T7 RNA polimeraz transkripsiyonuna dayanan daha in vivo hücre dinamiklerini yansıtmak mümkün bulunmaktadır. Biz verimli bir endojen E. hazırlanmasını ve yürütülmesini tarif Benzer ticari sistemler için% 98 maliyet azaltma T7 bazlı sistemleri gibi protein eşdeğer miktarlarda üretmek coli göre transkripsiyon için (TX-TL) hücre içermeyen sentezleme sistemi. 4,5 tampon ve ham hücre ekstresinin hazırlanması vardır Bir yürütülmesi, hem de tarifÜç tüp TX-TL reaksiyonu. Tüm protokol hazırlamak için beş gün sürer ve bir hazırlık 3000'e kadar tek reaksiyonlar için yeterli malzeme verir. Hazırlandıktan sonra, her reaksiyon veri toplama ve analiz için kurulum 8 saat altında sürer. E. düzenleme ve transkripsiyon dışsal Mekanizmaları E. coli, örneğin, lak / tet baskılayıcılar ve T7 RNA polimeraz gibi, takviye edilebilir. mRNA ve DNA yıkımı oranları gibi 6 endojen özellikleri de ayarlanabilir. 7 TX-TL hücresiz sentezleme sistemi için gösterilmiştir geniş ölçek devre montaj, biyolojik olguları keşfetmek, hem T7-ve endojen yararlanıcı altında proteinlerin ifadesi. 6,8 Refakatçi matematiksel modelleri mevcuttur. 9,10 çıkan sistem bir prototip ortamı olarak sentetik biyoloji benzersiz uygulamaları vardır, ya da "TX- TL Biyomoleküler breadboard. "
Giriş
Hücre içermeyen ifade teknolojisi T7 bakteriyofaj DNA kullanılarak bağlanmış transkripsiyon-çeviri mekanizmaları kapsayacak şekilde yıl sonra ilerleyen, tamamen öteleme gibi 1950'li yıllarda başladı. 11,12 O zamandan bu yana, sayısız çalışmalar ham hücre ekstresinin oluşturma (veya E optimize etmek için yapılmıştır . coli S30 ekstresi). 13,14 Bu optimizasyonlar ATP yenilenmesi veya zorlanma modifikasyonlar sayesinde hücre serbest protein sentezini uzatan, ve protokol süresini ve maliyetini azaltmak sayılabilir. 15-17 Alternatif hücre-özgür ifade sistemlerin var olduğunu ham petrol yerine kullanılması yeniden bileşenler ifadesi için hücre ekstresi. 5'te ham hücre ekstraktı ve yeniden oluşturma yöntemleri, her ikisi de ticari kullanım için geliştirilmiştir.
Sentetik biyoloji ile birlikte, mühendislik biyolojik modülleri ve devreleri test ve ifade etmek, iyi karakterize platformu için artan bir ihtiyaç vardır. 18,19 Bu platform olmalıçok yönlü, iyi karakterize, işlemek için basit ve kullanıcı tarafından sağlanan bileşenleri üzerinde duruldu. Yarım yüzyıl önce geliştirilmiş olmasına rağmen, hücre içermeyen sistemler E. dayalı Bu büyüme ve metabolizmasını karmaşıklığı olmadan hücresel süreçlerin vitro temsil basitleştirilmiş olarak coli özünde, bu gereksinimleri paylaşmaktadır. Ayrıca, E. in vivo çalışmalarında gelen temel bilginin tüm E. coli kolayca uygulanır coli hücre içermeyen sistemler.
Hücresiz ekspresyon sistemleri en hücresiz ifade sistemleri hedef bugüne kadar, sentetik biyoloji uygulamaları olabilir, ancak protein ve metabolit verim en üst düzeye çıkartılması olmuştur. Bu T7 promotörler ile tahrik dizilerinin T7 bakteriyofaj transkripsiyonunu kullanılarak gerçekleştirilir. 20 sentezleme etkili ve sağlam olmakla birlikte, bu sistemler bir çok özel bir amaca hizmet eder. Hücre düzenleme yöntemleri sınırlı, hedef DNA şablonları olmalıT7 promotörleri dahil yeniden yapılandırılmış ve bu ribozomal kompleksleri gibi bazı dizileri transkripsiyonu ve monte edilemez. 21,22 Mevcut hücre içermeyen ifade sistemleri endojen düzenleyici mekanizmalar, sentetik biyoloji için gerekli bir çok yönlülük koruyarak yüksek verim koruyamazlar.
Bu endojen bir E. geliştirdik Önceki sistemler tarafından gösterilen protein ifade etkinliğini korur, fakat sağlayarak ek yönlülük ekler coli hücre içermeyen ifade sistemi ifade ve (T7 ya da diğer) mekanizmalar iç ve dış iki göre düzenleme. Burada açıklanan protokol, ilk. Kigawa et al göre (2004) Liu et al. (2005), fakat önemli değişiklikler vardır. Bu, verimlilik artışı için Mg ve K-asetat üzerinde Mg-ve K-glutamat kullanır 2-merkaptoetanol kaldırır ve bir boncuk-çırpıcı kullanarak hücreleri lyses. 17,23,24 Boncuk-dayak homojenizasyon üzerinde seçilir,nedeniyle rekabet sistemlerine daha düşük maliyet ve benzer verimler basınç dayalı yöntemler, ya da sonikasyon. 23 3-fosfogliserik asit (3-PGA) bu kreatin fosfat ile karşılaştırıldığında daha üstün protein verimleri verdiği bulunmuştur olarak enerji kaynağı olarak kullanılır ve fosfoenolpiruvat. 4,25 Bizim sistemi ya da lamda-faj operatörleri ile bir sigma70 tabanlı bir promoter ya da başka ticari sistemlerinden verim benzer bir T7 promotörü tahrikli kullanılarak raportör protein 0.75 mg / ml 'ye kadar üretebilir. 4,6 beş gün gerekli tüm reaktifleri (Şekil 1) üretimi için gerekmektedir. Ayrıca, benzer ticari, hücre içermeyen sistemlere göre% 98 maliyet tasarrufu sağlar - malzeme maliyetleri işçilik (Şekil 2) dahil $ ile 0.26 arasında yükselir 10 ul reaksiyon başına 0,11 $ vardır.
Protokol
1.. Ham hücre ekstresi hazırlanması
Üç gün boyunca ham hücre ekstresinin hazırlanması verimli yapmak için iki kişi gerekir. Kültür büyüme (adım 1.1 1.11 adım), hücre parçalama (1,37 adım adım 1.12) ve açıklama (adım 1.38 1.52 adım) ayıklamak: Protokol işlevsel üç bölümden oluşmaktadır. Bu rahatlık için günde ayrılmıştır sunulmuştur. İdeal özü plasmid pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 (Addgene # 40019) ve proteinin, 27-30 mg / ml arasında bir ham hücre ekstresi konsantrasyonuna sahiptir. 4 ila deGFP 0.75 mg / ml üretebilen Ancak , özü özellikleri partiden diğer partiye göre değişir. Aşağıdaki tarifi yaklaşık 3.000 tek reaksiyonların (6 ml ham hücre ekstresi) için yeterli sağlar. Aşağı ölçeklendirme, o daha az Burada verilen değerlerin 1/6 daha kullanılması önerilir. Zaman kısıtlamaları nedeniyle, ölçeklendirme tavsiye edilmez.
Gün 1
- Hazırlayın bakteriyel kültür ortamı, kültürTure plaka ve ortam ek olarak, Tablo 1 'de tarif edilen. Tarifler için Ek Maddesi 1 Bkz.
- . Streak BL21-Rosetta2 bir 2xYT + P + Cm agar plakası üzerine -80 ° C, gerilme ve 37 ° C'de ya da koloniler kolayca görebilir kadar en az 15 saat boyunca inkübe Not: Kloramfenikol (Cm) bir plasmid için seçmek için kullanılır BL21-Rosetta2 suşunda nadir tRNAs kodlayan.
2. Gün
- Tamponlar ve Tablo 2'de tarif edildiği gibi ek hazırlayın. Tarifler için Ek Maddesi 1 Bkz.
- De dahil olmak üzere, 3 gün için gerekli malzeme hazırlama ve sterilize: alüminyum folyo kapağı (otoklav) ile 6 x 4 L Erlenmeyer şişelerinde, 4 x 1 L steril santrifüj şişeleri, huni (otoklavlanmış), 0.1 mm cam boncuklar ve 100 g (otoklavlanmış), 2 karışmaya-çubuklar (otoklav), 1 L ve 500 ml silindir (otoklavlanmış), (otoklav) 2 x 1 L bardak, 18 G iğne (steril) ile 3 ml şırınga içinde, 2-3 fl mezunyulaf şamandıralar, 2-3 10k MWCO diyaliz kasetleri (steril), küvetler.
- Mini kültürü 1 hazırlayın. 12 ml steril kültür tüpü ve ön ısıtma, 30 dakika boyunca 37 ° C ila + P 2xYT medyanın 4 ml Cm ve 4 ul ekleyin.
- 2xYT + P + Cm agar plağından bir koloni ile mini kültürü 1 aşılamak. , 220 rpm'de 8 saat boyunca 37 ° C'de inkübe edin.
- 7 saat ve 30 dakika sonra, mini-kültür 2 hazırlar. 30 dakika boyunca bir steril 250 ml Erlenmeyer şişesi ve önceden sıcak 37 ° C ile + P 2xYT ortamı 50 ml Cm ve 50 ul ekle.
- Mini-kültür, 100 ul 1 mini-2 kültür aşılamak ve 8 saat süre ile, 220 rpm'de 37 ° C'de inkübe edin.
3. Gün
- Tablo 3'de dört boş steril 50 ml Falcon tüpler ve kayıt kitle tartılır. Buz üzerinde Falcon tüpleri Chill, bunlar, daha sonra adım 1.18 kullanılacaktır.
- Adım 1.8 sonra 7 saat ve 30 dakika, son bakteriyel kültür ortamı hazırlamak. Steril 1 L kullanılarak silindir, transfer 2xYT + P medyanın 660 ml mezun i. 30 dakika Not altı 4 L Erlenmeyer şişelerinde ve önceden 37 ° C sıcak arasında her nBu: 4 L ya da daha büyük bir Erlenmeyer flasks uygun havalandırma için tavsiye edilir.
- Her bir 4 L Erlenmeyer şişesi içine mini kültürünün 2 6.6 ml ilave edilir. Kültür (orta log büyüme fazına karşılık gelen) 600 nm'de 1,5-2,0 OD'ye ulaşana kadar 220 rpm'de, 37 ° C'de inkübe edin. Doğruluk için 1:10 kültür seyreltme ile periyodik OD Giriş Bu adım, en fazla 3 saat sürer - 3 saat 45 dakika;. Hızlı orta-log aşamasında büyüme ve tahsilat özü kalitesi için önemlidir.
- Hemen büyüme sonrasında, bakteriyel hücreler pelet 4 ° C'de 12 dakika boyunca 5000 x g'de santrifüj dört adet 1 L şişe ve santrifüj içine eşit olarak tüm kültürleri aktarın.
- 1 M DTT, daha önce hazırlanmış 2 S30A L kadar 4 ml ilave etmek suretiyle, tam S30A tampon hazırlık santrifüj iken. Mix ve buz üzerinde tampon korumak.
- Santrifüj bittiğinde, tamamen decadan adım 1.12 'den süpernatant kaldırmaknting ve steril bir kağıt havlu üzerinde kurutma santrifüj şişeleri.
- Dört santrifüj şişelerinin her birine 4 ° C'de S30A tampon 200 ml ilave edilir, ve pelet tamamen hiçbir kalan topaklar ile eriyebilir hale gelinceye kadar kuvvetlice şişe çalkalanır. 4 ° C'de 12 dakika boyunca 5,000 g'de santrifüj dört şişe
- Tamamen steril bir kağıt havlu üzerine boşaltılması ve santrifüj şişeleri blot önceki aşama süpernatant kaldırmak.
- Tekrar 1.15 ve 1.16 adımları.
- Her bir santrifüj şişeye, 4 ° C de 40 ml tampon ekleme S30A. .), 1.9 'dan soğutulmuş bir Falcon tüpüne her bir pelet ve S30A kombinasyonu transfer Not: Bu adım, daha küçük bir kap içine granül transfer etmektir.
- 4 ° C 'de 8 dakika boyunca 2000 g'de santrifüj Falcon tüpleri Boşaltılarak süpernatantı.
- Yeniden santrifüj Falcon tüpleri 2 dakika boyunca 2000 g'de, 4 ° C'de Tamamen pipetle kalan süpernatant kaldırmak. Buz üzerinde tutmak.
- F tartılırTablo 3 pelet ve rekor kitle ile Falcon tüpler. Pellet kütle, gerekli S30A tampon hacmi ve Tablo 3'teki özel formüllere göre gerekli boncuk kütlesi hesaplayın.
- Pelet doğru yükleme ve boncuk dayak kalite özü hale getirmek için önemlidir ve en zor bir adımdır. Bu denemeden önce videoyu yorumlayan tavsiye edilir. Hava kabarcıklarını önlemek ve eşit boncuk dağıtmak için başarısızlık verimsiz özü neden olur.
- Homojen olana kadar her bir Falcon tüpü, girdaba Tablo 3'te hesaplanan S30A tampon miktarını ekleyin ve buz geri dönün.
- Buz üzerinde diğer Falcon tüpleri tutarken, 30 saniye için, boncuk her kısım ilave edildikten sonra. Üç aliko, toplam boncuk 1/3 kullanılarak her tek Falcon tüpüne aralıklı girdap boncuk ekleyin. Vorteks adımlar ve son vorteks sonra arasında buz üzerinde Falcon tüpü yerleştirin. Son kısım ilave edildikten sonra sağlamakboncuklar eşit dağıtılır. Kalın bir macun oluşturulmalıdır.
- 3-4 mm açıklık oluşturmak için steril bir jilet kullanarak ucunu keserek bir 5 ml (hacim) pipet hazırlayın. 2 ml pipet Dial Not: Farklı pipet setleri ve uçlarına çekme ve kalın boncuk hücre çözeltisi serbest bırakmak için yeterli olmayabilir emme farklı miktarlarda bulunur ve çıkarıldı ucu olan bir 1 ml pipet ucu yerine kullanılabilir..
- Buz üzerinde 20 boncuk yenerek tüpleri yerleştirin.
- Modifiye pipet kullanarak hücre-boncuk çözeltinin viskozitesi yüksek doğrulayın. Bu ancak ejeksiyon sırasında pipet çıkan noktasına viskoz olmalıdır. Çok viskoz ise, 1,25 aşamasına göre pipet yeniden ayarlayın. Yeterli viskoz Değilse, boncukları (topak kütle * 5.1), maksimum kütlesine (pelet kütlesinin * 0.05) artışlarla ilave edilebilir. Boncuklar, 30 saniye boyunca girdaplı her bir ilave edildikten sonra ve buz geri dönün. Viskozite bir gösteri için Şekil 3a bakınız.
- Modifiye pipet kullanarak Falcon tüp boncuk-hücreli çözüm çıkarın ve steril bir boncuk-yenerek tüp içine aktarın, o boncuk-hücre çözümü ile tam üç çeyrek dolum. Boncuk dağıtarak olmadan hava kabarcıklarını çıkarmak için karşı bir mini santrifüj son derece kısa bir süre (1s) Spin. Boncuk-dayak tüp yükleme hareketsiz görüntüler için Şekil 3b-d bakın.
- Bir içbükey meniski oluşturacak boncuk hücre çözümü eklemeyi bitirmek.
- Başlığın dış dudak engellememesi için dikkatli olmak, boncuk-dayak boru başlığın iç üzerine boncuk hücre solüsyon çok küçük bir damla ekleme, aksi halde, boncuk dayak boru olmaz yakın sufficientl y. Düz bir yüzeye kapağını dokunun ve kapağın altındaki herhangi bir hava kabarcığı olduğunu doğrulayın.
- Bir önceki aşamada elde edilen boncuk yenerek kap ile boncuk yenerek tüp Cap. Boncuk dayak için asistan el. Eğer doğru yapılırsa, kapağı sıkıca hava kabarcıkları omuz, sızdırmaz olmalıdırgörünür olurdu ve küçük (varsa) boncuk-hücre çözümü taşması gerekir. Hava kabarcıkları görünür ya da kapak yok tamamen kapatmak değilse yükleme işlemini yineler.
- Kalan boncuk-hücre çözümü ile adım 1.24 dan vorteks Falcon tüp boncuk dağılımını sağlamak. Falcon tüp boşalana kadar tekrarlayın 1,28-1,31 adımları; sonra her ek Falcon tüp için 1.31 1.24 adımları tekrarlayın.
- Davranış aynı anda 1,33-1,38 adımları. Asistan take boncuk-yenerek 1,31 tüpleri ve buz üzerinde yer doldurdu. Iki dolu boncuk dayak borular toplanmıştır ve en az bir dakika boyunca buz üzerinde olmuştur sonra, boncuk dayak başlar.
- 46 rpm'de 30 saniye için, bir tüp bitirin. Diğer boru dayak ise 30 saniye boyunca ters buz üzerine yerleştirin.
- Her dolu boncuk-yenerek tube 1 dk toplam yendi olmuştur böyle bir önceki adımı tekrarlayın.
- Tekrar 8 dolu boncuk yenerek tüpleri (veya santrifüj tutabilir maksimum miktarı) h kadar 1,33-1,35 adımlarıişlendikten ave. Daha sonra, 15 ml Falcon (Şekil 3e) filtre düzeneği oluştururlar. 15 ml Falcon altına, yeni bir boncuk-yenerek kapağı, düz parçası yüzü kadar ekleyin. Tamamen kapalı kadar sonra, sıkıca işlenmiş boncuk-yenerek borunun ucuna işlenmiş boncuk-yenerek tüp ve basın mikro-kromatografi kolonu kapağını kaldırın. Mikro kromatografi sütununun elüsyonu ucundan takılır, ve mikro-kromatografi kolonu yer elüsyon boş boncuk boncuk tüp içine, aşağı doğru sona. 15 ml Falcon içine bu karmaşık yerleştirin. 8 dolu boncuk-yenerek tüpler için tekrarlayın; tamamlandığında buz üzerinde tutmak.
- Santrifüj 8 filtre cihazları, Falcon tüpü kapağını açıp, boncuk özü ve pelet ayırmak için 4 ° C'de 5 dakika boyunca 6,000 g'de.
- Doğrulayın her boncuk yenerek tüp uygulanabilir özü üretti. Düzgün yenmek özü bulanık olmayacak, ve topak, iki farklı tabaka olacaktır. Tüm bulanık tüpler atmak ve olmayan bulanık tüplerin süpernatant aktarmak imümkün olduğu kadar az topak alma nBu tek 1.75 ml mikro santrifüj tüpleri,. Tüm boncuk-yenerek tüpleri işlendikten kadar buz üzerinde tutmak. Bir doğru vs yanlış işlenmiş boncuk yenerek tüp karşılaştıran 3f Şekil bakın.
- 4 ° C'de 10 dakika boyunca 12,000 g'da santrifüj önceki aşama mikro santrifüj tüplerine
- Transferi pelet içermeyen yeni bir boncuk-yenerek tüp içine 500 ul konsolide, bir pipet kullanarak boş boncuk yenerek tüpler içine yüzer.
- 220 rpm'de çıkarıldı boncuk-kapaklar yenerek, 80 dakika boyunca 37 ° C, daha önce adım inkübe edin. Bu adım, boncuk boncuk işlemi sırasında açığa çıkan endojen ayıran eksonükleazları kullanılarak nükleik asitleri kalan sindirir ve bir doku kültürü tüpüne boncuk dayak tüp ayakta yapılabilir.
- Diyaliz malzemeleri hazırlayın. 1 M DTT, daha önce hazırlanmış 2 S30B L 2 ml eklenerek tam S30B tampon hazırlanması. Mix ve iki st her birine 900 ml ekleyin1 L beherleri erile. Her bir deney kabı içine steril manyetik karıştırıcı ekleme; 4 ° C'de tutun
- Adım 1.41 sonra, ekstrakt bulanık bakmak gerekir. 1.75 ml mikro santrifüj tüplerine 1.5 ml alikota özü birleştirin ve 4 ° C'de 10 dakika boyunca 12.000 g'de santrifüj
- Bir pipet kullanarak, buz üzerinde 15 ml Falcon tüplerine içermeyen topak süpernatantı birleştirmek ve boru ve çevrilmesini kapatma ile iyice karıştırın. Aşama 1,47 boyunca buz üzerinde yüzer 10 ul kaydedin.
- Üretilen ekstresi toplam miktarını belirlemek ve kaset başına özü 2.5 ml varsayarak, 2 dakika boyunca S30B in batırmak suretiyle 10k MWCO diyaliz kasetlerinin gerekli sayıda hidrat.
- Ekstresi 2.5 ml kasetleri yerleştirin. Her kabı 2 kasetleri kadar sürebilir; dialyze, karıştırma, 3 saat Not için 4 ° C'de: kasetlerinin kısmi yükleme kabul edilebilir.. Diyaliz protein üretimi verimini artırır.
- Önceki adım sırasında, özüt proteini karakterizeAdım 1.44 kaydedilmiş ekstraktı kullanılarak bir Bradford tahlili ile konsantrasyon,. Ayrıntılar için Ek Maddesi 2 Bkz.
- Diyaliz 1.75 ml mikro santrifüj tüplerine 1.5 ml, tam kısım özü sonra. 4 ° C'de 10 dakika boyunca 12,000 g'da santrifüj Bir pelet tüpün altındaki oluşturacaktır.
- Buz üzerinde bir 15 ml Falcon tüpü içine pipetle önceki aşama temiz bir süpernatan birleştirin. 5-10x ters çevirerek homojenize.
- Adım 1.47 Bradford ile tespit konsantrasyonuna bağlı olarak, her bir 1.75 ml tüplere kana özü miktarının belirlenmesi. Her bir tüp, toplam proteinin 810-900 mg bir hacme sahip olmalıdır. Özü 27 mg / ml 'den daha büyük olan bir toplam protein konsantrasyonuna sahip olmalıdır. Örneğin, 30 ul 28 mg / ml 'de bir alikot özü, ve kısım ekstre 32 ° C'de; konsantrasyonu yüksek ise kısım 30 ul alikolar halinde 30 mg / ml' nin altında özü ve ölçek:. Bu adım amaca Not yapmak için yardıma ihtiyacı28.1 ul mg / ml.
- Kabarcıklarını önlemek için özen adım 1.50 aşağıdaki aliquot özü. Sıvı nitrojen içinde dondurularak-Flaş özü Not:. Kabarcıkları ile alikoları, 4 ° C sıcaklıkta 30 saniye boyunca 10,000 x g'de santrifüj ile kaldırılabilir
- Bir süzgeç kullanarak sıvı azot tüpleri çıkarın ve hemen -80 ° C Güvenlik saklamayın: koruyucu gözlük giyin; özü tüplerin kapakları nedeniyle sıvı azot ve oda sıcaklığı arasındaki sıcaklık farkı kapalı gelebilir.
2. Amino Asit Çözüm Hazırlığı
Amino Asit Çözeltisi toplu olarak hazırlanmalıdır. Aşağıdaki tarifi yaklaşık 11.000 tek reaksiyonlar için yeterli tedarik, RTS Amino Asit Sampler tam bir seti kullanır. Aşağı ölçekleme ise, hiçbir az yarım kiti kullanımı tavsiye edilir. Stokta her bir amino asit 140 mM'de lösin haricinde, 1.5 mi, 168 mM 'de verilir. Amino asit çözeltisinin nihai bileşimi:lösin, 5 mM, diğer tüm amino asitlerin, 6 mM. Bu 4x çalışıyor konsantrasyondur.
- -20 ° C ila 20 amino asitler çıkarın ve oda sıcaklığında eritin. Bir kere çözülmüş, girdap amino asitler, gerektiğinde çözülür, 37 ° C'de inkübe kadar. Amino asitler eritilir sonra, oda sıcaklığında tutulur, Asn, Phe ve Cys haricinde, buz üzerinde, bütün amino asitleri koydu. Cys tamamen çözülür olmayabilir.
- Buz üzerinde, steril bir 50 ml Falcon tüpüne steril suyun 12 ml.
- Her eklemeden sonra Falcon tüp vorteks ve buz üzerinde bir çözüm sağlayacak şekilde özenle, 1,5 aşağıdaki sırayla her bir amino asit ml ekle: Ala, Arg, Asn, Asp, Gln, Glu, Giy, His, ile, Lys, Met, Phe, Pro, Ser, Thr, Val, Trp, Tyr, Leu, Cys. Cys ilave edildikten sonra, girdap çözelti oluşana dek, gerekirse 37 ° C'de kuluçka, nispeten açıktır. Bir süspansiyon olarak ilave edilebilir. Cys tamamen çözülür olmayabilir.
- 50 tüplerinde içine kısım Amino Asit ÇözeltisiBuz üzerinde 26 ul, her. Buz üzerinde tüp başına 500 ul kalan kısım. 500 ul alikotları tampon hazırlanması için kullanılacak ise aliquoting, girdap ana stok süspansiyonu sık sık eşit dağılımını önlemek için olsa da 26 ul alikotları., Özü kalibre edilmesi için kullanılacaktır.
- -80 ° C Güvenlik sıvı azot ve mağaza flaş dondurma tümbölenleri: koruyucu gözlük giyin; özü tüplerin kapakları nedeniyle sıvı azot ve oda sıcaklığı arasındaki sıcaklık farkı kapalı gelebilir.
- İsteğe bağlı: Önceden yapılan Amino Asit Çözümleri karşı yeni yapılmış Amino Asit Çözüm bir aktivite deneyi Davranış.
3. Enerji Çözüm Hazırlığı
Enerji Çözümü ham hücre ekstresi kalibre edilmesi için ve bir tampon oluşturmak için her ikisi de kullanılır ve toplu olarak hazırlanmalıdır. Aşağıdaki tarifi yaklaşık 10000 tek reaksiyonlar için yeterince sağlamaktadır. Aşağı ölçeklendirme, bu üzerinde öneriliraz Burada verilen değerler 1/24 'den kullanmak nded. Energy Solution önemli bir parasal maliyet olarak, ilk kez kullananlar 1/24 ölçekte hazırlamak isteyebilirsiniz. Enerji Çözüm sonuç kompozisyonu: HEPES pH 8 700 mM, 21 mM ATP, GTP 21 mM, CTP 12.6 mM, UTP 12.6 mM, tRNA 2.8 mg / ml, 3.64 mM CoA, NAD 4.62 mM, cAMP 10.5 mM, folinik asit 0.95 mM, Spermedine 14 mM, 3-PGA 420 mM. Bu 14x çalışıyor konsantrasyondur. Arzu edildiği takdirde, Tablo 4 'de, her bir madde daha sonra kullanılmak üzere -80 ° C'de muhafaza edilebilir.
- -80 ° C ila Tablo 4 'de tüm kimyasal kaldır, -20, 30 dakika boyunca oda sıcaklığına kadar bir sıcaklıkta, ya da 4 ° C.
- Tablo 4 'de tarif edildiği gibi stok çözelti hazırlayın. Tarifler için Ek Maddesi 1 Bkz. Hazırlandıktan sonra buz üzerinde tüm çözümleri yerleştirin.
- Bir 15 ml Falcon tüpü, her bir ilaveden sonra Falcon tüp vorteks dikkat ederek, aşağıdaki sırada ekleyin ve o çözüm tutmayan ice: 3.6 ml 2 M HEPES, 144 ul su, 1.39 ml nükleotid karışımı, 576 ul 50 mg / ml tRNA, 576 ul 65 mM CoA, 276 ul 175 mM NAD, 170 ul 650 mM cAMP, 288 ul 33,9 mM folinik asit , 144 ul 1 M spermidin, ve 3.09 ml 1.4 M 3-PGA.
- Buz üzerinde 7 ul her biri 50 tüpleri içine kısım enerji çözümü. Buz üzerinde tüp başına 150 ul kalan kısım. 150 | il tam bölünen miktarları, tampon hazırlanması için kullanılacak ise 7 ul alikotları aliquoting, girdap ana stok da sık sık., Özü kalibre edilmesi için kullanılacaktır.
- -80 ° C Güvenlik sıvı azot ve mağaza flaş dondurma tümbölenleri: koruyucu gözlük giyin; özü tüplerin kapakları nedeniyle sıvı azot ve oda sıcaklığı arasındaki sıcaklık farkı kapalı gelebilir.
- İsteğe bağlı: Önceden yapılan Enerji Çözümleri karşı yeni yapılan Enerji Çözümü bir aktivite deneyi Davranış.
4. Tampon hazırlanması
Buffer Hazırlama Hazırlama, Amino Asit Çözeltisi Hazırlama ve Enerji Çözümü Hazırlık Özü Ham Cell tamamlanmasını gerektirir. Her bir tampon ham hücre ekstresi toplu özgüdür. Mg-glutamat, K-glutamat ve DTT (bu sırayla) ifade yüksek seviyeleri ile tepkimeye girmesi için bu bölümde optimize edilmiştir. Aşağıdaki protokol, önceden hazırlanan ham hücre özü ve kalibre tamponu hazırlamak için bir ön yazılı şablonu, TXTL_e (şablon) _calibration_JoVE.xlsx (İlave Maddesi 3), kullanmaktadır. Ancak, bir de ham hücre ekstresi kalibre ve özü ile birlikte, toplam bir reaksiyon hacminin% 75 olduğu el Mg-glutamat, K-glutamat ve DTT optimize ve bu tür tampon kurarak şablon olmadan tampon hazırlayabilirsiniz. El ile kalibre ise, son reaksiyon koşulları aşama 5'te bulunabilir.
- "Genel Bilgiler" formunu doldurun.
- Buz 100 mM Mg-glutamat (4 ° C), 3 M K-glutamat (4 ° C) üzerine, çözülme, 6mM Amino asit çözeltisi (26 ml, -80 ° C), Energy Solution (7 ml, -80 ° C), 100 mM DTT (-20 ° C) pozitif kontrol DNA (-20 ° C),% 40 PEG- . 8000 (4 ° C), ham hücre ekstraktı (-80 ° C) ve su (4 ° C) Not: 1 nM çalışma konsantrasyonu pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 (Addgene plazmid 40019) pozitif kontrol (eksitasyon 485 nm, emisyon 525 nm), ya da yüksek sinyal yoğunluğu üreten bir referans için. 4
- Tek mikro-santrifüj tüplerine stok Mg-glutamat set miktarlarda aliquoting tarafından, 4-10 mM ek Mg-glutamat bir dizi test, yedi 10.5 ul reaksiyonlar hazırlayın. Not: 10.5 ul reaksiyonları başlangıçta hazırlanmış olmasına rağmen, son reaksiyon 10 ul.
- K-glutamat ekstra 80 mm ekleyerek, "Mg-glutamat kalibrasyon" altında şablonda gösterildiği gibi ana karışımı hazırlayın. Her öğenin eklenmesinden sonra buz ve vorteks devam Not:. Burada ve şablonda verilen değerleriMg-glutamat, K-glutamat ve ham hücre özü yapmak için kullanılan S30B DTT tampon maddesi içinde mevcut olan miktarlarda ilave olarak.
- Mg-glutamat içeren örnekler için ana karışımı ekleyin ve reaksiyonları hazırlamak. Adımları ayrıntılı talimatlar için 5,10-5,13 bakın.
- Bir kuluçka makinesi ya da bir levha okuyucu içinde ya da, 29 ° C 'de reaksiyon çalıştırın.
- . Uç-sentezleme seviyesi ve protein ekspresyonu (Şekil 4a) arasında maksimum oranı ile uygun Mg-glutamat konsantrasyonunun belirlenmesi Not: çalışma zamanlarının deneye ancak tipik olarak son 8 saat altında bağlı olarak değişiklik gösterebilir.
- Tekrar adımda 4.7 bulunanlara Mg-glutamat düzeylerini ayarlama ", K-glutamat kalibrasyon" altında K-glutamat için 4,2-4,7 adımları.
- Tekrarlayın Adım 4.8 'de bulunanlar adım 4.7 ve K-glutamat düzeyleri bulunan kişilerce Mg-glutamat düzeylerini ayarlama ", DTT kalibrasyon" adı altında DTT için 4,2-4,7 adımları Not:. Biz DTT önemli ölçüde uç-etkilemez ilave bulduk ekspresyon seviyeleri.
- Kullanımhazırlanacak tampon bileşimini belirlemek için "Tampon kompozisyon" başlığı altında bulunabilir kalibrasyon değerleri. Üretilen ham hücre ekstresi miktarına göre, bir ana karışım tarifi tampon bir miktar için üretilir.
- Buz üzerinde ana karışımı tarifi listelenen alikotları çözülme. Bir kere çözülmüş, her öğenin eklenmesinden sonra buz ve vorteks tutarak, ana karışımı hazırlayın.
- Miktarına göre Tümbölen altında belirtilen "Tampon kompozisyon." Flaş-freeze tampon sıvı azot içinde tüpler. Aliquoting, girdap ana stok ederken sık sık.
- Bir süzgeç kullanarak sıvı azot tüpleri çıkarın ve hemen -80 ° C Güvenlik saklamayın: koruyucu gözlük giyin; özü tüplerin kapakları nedeniyle sıvı azot ve oda sıcaklığı arasındaki sıcaklık farkı kapalı gelebilir.
5. Bir TX-TL Reaksiyonu Deneysel Yürütme
Nihai tepkime koşulları şunlardır: 8,9-9,9 mg / ml protelösin, 1.25 mM lösin, 50 mM HEPES, 1.5 mM ATP ve dışında (ham ekstreden) içinde, 4.5 mM-10,5 mM Mg-glutamat, 40-160 mM K-glutamat, 0,33-3,33 mM DTT, 1.5 mM her bir amino asit GTP, CTP ve 0.9 mM UTP, 0.2 mg / ml tRNA, 0.26 mM CoA, 0.33 mM NAD, 0.75 mM cAMP, 0.068 mM folinik asit, 1 mM spermidin, 30 mM 3-PGA,% 2 PEG-8000. temel TX ham hücre ekstresi, tampon ve DNA:-TL reaksiyon 3 parça (tüpler) sahiptir. Oranı:% 75 tampon ve özü,% 25 DNA reaksiyonlar hacim olarak değişebilir, ve reaksiyon hacmini en aza indirmek ve bir 384-oyuklu bir plaka içerisinde çalışmasını sağlamak için geleneksel olarak 10 ul kullanın.. Daha büyük miktarlar için uygun bir oksijen ajitasyon gerektirir. Aşağıdaki protokol 10 ul tepki yapmak için, önceden yazılı şablonu, TXTL_JoVE.xlsx (Ek Malzeme 4) kullanır. Mor kalemler kullanıcı girişi değerlerini gösterir ve mavi öğeleri reaksiyonuna eklemek için ek reaktifler göstermektedir. Bununla birlikte, bir de, bir reaksiyon wit yapabilirlerhout yukarıda özetlenen reaksiyon şartlarını takip ederek şablonu.
- "Genel Bilgiler" formunu doldurun.
- Altında "Master Mix Hazırlama," mor kutunun içine adım 4.1 özü yüzde değerini yerleştirin.
- "Master Mix Hazırlık" (satır 10-17) ve "DNA Hazırlık" (satırlar 19-50) bölümleri kullanarak siliko Denemenizi tasarlayın. Değişkenler "DNA Hazırlama" bölümünde konabilir sırasında Genel, sabitler, "Master Mix Hazırlama" bölümünde içine konabilir. Örnek buharlaşmasını ve deneysel başlangıç zamanı yanlılığı önlemek için deneme başına örnekleri en aza indirin. Bir örnek kurulum için Şekil 6'ya bakın.
- Altında, "Master Mix Preparasyon," sabit bir konsantrasyonda bütün örneklerde gidecek bu tip teşvik ya da proteinler gibi reaktifler, ekleyin. Arka arkaya 14 ile başlayarak, her hat için bir reaktif tutarak, mavi gölgeli alanları doldurun. Birimler göreli oranlarıdır.
- Altında "DNA Hazırlanması," örnek Şartname olacak DNA eklemekic. Örnek pozitif ve negatif kontroller için et # 1 ve # 2 tekabül sırasıyla. Örnek et yukarıda # 3 ve kullanıcı tarafından değiştirilebilir DNA, ng / ul stok konsantrasyonu, baz çiftli uzunluğu nM olarak arzu edilen nihai konsantrasyonu, ve (10 ul reaksiyonlar) tekrarlarıdır. Arzu edilen nihai konsantrasyona ulaşmak için hazır DNA miktarı, otomatik olarak hesaplanır. . N tekrarların sayısı 10.5 * n, için satır toplamları için toplam Not: Nihai reaksiyon hacmi 10 ul olsa da, hesaplamalar reaksiyon başına 10.5 ul toplam hacim varsayalım, pipetleme sırasında kayıp hacim hesaba.
- Altında "DNA Hazırlanması," reaktifler veya mavi sütununa örnek özgü olacak ek DNA ekleyin. Örneği, özel reaktifler 10.5 * n bir toplam reaksiyon hacmi dayalı manuel hesaplama gerektiren süre nM stok DNA konsantrasyonları "DNA Hazırlanması," altında hesaplanabilir. Girilen hacimleri aynı satırda su hacmi dışarı çıkarılır.
- Gerekli numbe Kaldır-20 ° C veya -80 ° C den tampon maddesi, ham hücre özü ve kapsamında pozitif kontrol tüpleri "çözülme Tüpler," r ve buz üzerinde eritin.
- DNA örnekleri hazırlayın. Her örnek kimliği, kısım dışarı için belirtilen DNA, su, ve oda sıcaklığında bir mikro santrifüj tüpüne "DNA Hazırlama" bölümünde, kullanıcı başına sağlanan öğeler Not:. Örnek kaybını önlemek için, son zamanlarda pipetlerini ve düşük-sopa kalibre pipet uçları ve mikro-santrifüj tüpleri tavsiye edilir.
- Adım 5.7 tüpler çözülmüş, her öğenin eklenmesinden sonra buz ve vorteks üzerinde tutarak, tampon, özü, ve turuncu-gölgeli kutular dayalı herhangi bir global kullanıcı tarafından sağlanan maddeden oluşan ana karışımı hazırlamak Not:. Özü derece olduğunu viskoz. Kabarcıklar alikotları, 4 ° C'de 30 saniye boyunca 10,000 x g'de santrifüj ile kaldırılabilir
- Her DNA örneği için "DNA Hazırlama" (sütun O) altında turuncu hücrelerinde belirtilen ana karışımı miktarını ekleyin ve oda sıcaklışında tutmakTure. reaksiyon başlangıç zamanı olarak davranın.
- Vortex her bir örnek ve kalan örnek çökertmek için ve kabarcıklar azaltmak için, oda sıcaklığında 30 saniye boyunca 10,000 x g'de santrifüj.
- Mikro santrifüj tüplerine reaksiyonu yapılması halinde, 29 ° C 'de, doğrudan inkübe . Aksi takdirde, bir 384-oyuklu bir plakaya pipet örnek 10 ul Not: 10 ul daha büyük hacimli reaksiyonlar oksijen için ajitasyon gerektirebilir.
- Herhangi bir artık örnek çökertmek için ve kabarcıklar azaltmak için, oda sıcaklığında 30 saniye boyunca 4000 x g'de santrifüjleyin plakası. Buharlaşmasını önlemek için daha sonra plaka mühür.
- 29 ° C Not Run tepki: Runtimes deneye bağlı olarak ancak genellikle 8 saat altında son değişir.
Sonuçlar
Biz, TX-TL hücresiz sentezleme sistemi tabanlı bir endojen Escherichia coli hazırlanması için, beş gün protokol sundu. Ham hücre özütü ve tampon - - reaktiflerin yaratmak için örnek bir zaman çizelgesi, Şekil 1 de bulunabilir. Oluşturulduktan sonra, bu bir yıla kadar -80 ° C'de muhafaza edilebilir. Reaktif oluşturulduktan sonra, deney setup ve yürütme az 8 saat içerisinde yapılabilir.
Buna ek olarak, TX-TL hücresiz ekspresyon sisteminde ekspresyonu koşulları optimize edilmiştir. Bu tür tampon çözeltiler ya da DNA gibi diğer kullanıcı tarafından sağlanan ilave, daha önce toksisite için kalibre edilmelidir. Örneğin, işleme plazmidlerin değişik yöntemleri nedeniyle tuz içeriği için farklı tanımına neden olur. Ayrıca, reaksiyon verimliliği üzerinde Tris-Cl elüsyon tamponu etkisini (Şekil 5) test edilmiştir.
4.9 adım 4.1 atıfta ham hücre ekstraktı kalibrasyon, bir örnek gösterilmektedirŞekil 4a. Genelde, deneyler ham hücre ekstraktı K-glutamat seviyeleri, ardından Mg-glutamat seviyeleri, en hassas olduğunu göstermektedir. Hücre içermeyen ifade sistemini göstermek için, biz tet tahakküme dayalı bir negatif geri besleme döngüsü. 26. (Şekil 6) inşa ve test edilmiş. Hücre içermeyen sentezleme sisteminde, ve ATC olmadan aynı devre çalıştırma ifade sekiz saat sonra deGFP raportör bir 7-kat uç-nokta ifade değişimi göstermektedir. Bu "Master Mix Terkip." Altında ilave edilebilir gerekirse, bu deney, genel uyarıcıları veya baskılayıcılar gerektirmez, ancak
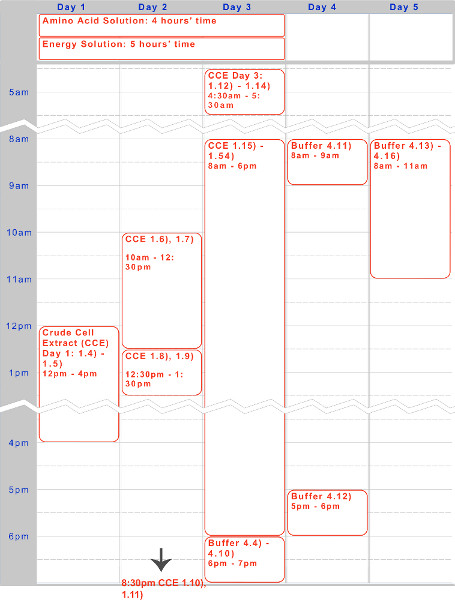
Şekil 1. Ham hücre özü, amino asit çözeltisi, ve enerji çözelti hazırlanması için zaman çizelgesi. Beş günlük bir timelin Protokolün tipik yürütülmesi için e gece boyunca ve gündüz inkubasyon çalışma adımları için optimize edilmiş, yukarıda verilmiştir.
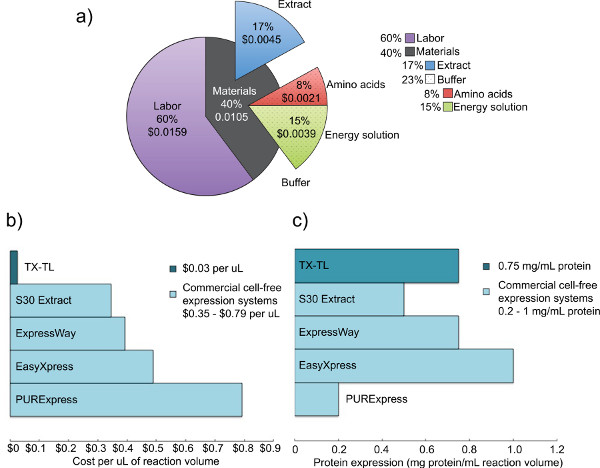
Şekil 2. Maliyet ve ham hücre ekstreleri rekabet ekspresyon analizi. a) TX-TL hücresiz sentezleme sistemi emek ve malzeme maliyetlerini Dağılımı. Aralık 2012 gibi reaktiflerin maliyetleri, ve saat başına 14 $ işçilik maliyetleri dayalı. B) diğer ticari sistemleri vs TX-TL hücre serbest ifade sistemi maliyetlerinin karşılaştırması. Reaksiyon hacimleri kit başına. C diğer ticari sistemleri vs TX-TL hücre serbest ifade sistemi verim) Karşılaştırma değişebilir ancak maliyetleri, ul başına aşağı kırılmış. Protein ifadesi verim üretici standartlar tarafından belirlenir./ 50762fig2large.jpg "target =" _blank "> büyük rakam görmek için buraya tıklayın.

Şekil 3,. Bir boncuk-dayak tüp yükleme ve işleme. a) Hücre-boncuk çözeltisi doğru viskozite gösterilmesi. Hücre-boncuk çözüm buz üzerinde harcanan eklendi S30A tampon miktarı, katma boncuk miktarı ve süresi dahil birçok faktöre bağlı bir viskoziteye sahip olacaktır. B) boncuk-yenerek tüp yükleniyor hızlı masaüstü santrifüj önce. Santrifüj yükleme sırasında biriken kabarcıklar kaldırır. C) masaüstü santrifüj sonra yüzey Bubbles. Kabarcıkların boyutu değişir,. Onlar bir pipet d kullanarak attı veya kaldırılabilir) Tamamen dolu boncuk-yenerek tüp kapatma önce. Bir menisküs boncuk yenerek t oluşturulurube ve kapak). e doldurlama Doğru yüklü filtre cihazı, az miktarda kapak ve neden yeterli bulunmuyor. Bu doğru vs yanlış işlenmiş boncuk-yenerek tüp. F) Karşılaştırma tekrar edilebilir. Soldaki tüpü iyi dövmek tüp - bu küçük ve iyi belirlenmiş üst tabaka, ve çok net süpernatant sahiptir. Sağdaki tüp daha büyük, puslu ikinci tabaka ve puslu yüzer göre suboptimaldir. Suboptimaldi Tüpler ek işleme tabi olmamalıdır.
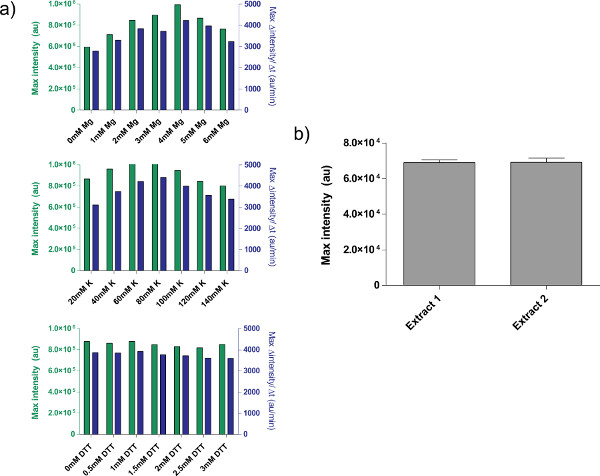
Şekil 4. Ham ekstrakt preparatların özellikleri. a) ham hücre ekstresi için tipik kalibrasyon araziler. Ham ekstrakt, bu sırayla ilave Mg-glutamat, K-glutamat ve DTT seviyeleri için kalibre edilir. Son nokta fluorescenc gösterilmektedire 8 saat, hem de 12 dakikalık bir hareketli ortalama göre protein üretiminin maksimum hızı sonra. Bu araziler göre, ek Mg-glutamat, kabul edilebilir bir aralığı K-glutamat 60-80 mM, 4 mM ve DTT, 0-3 mM'dir. Her ham özü bu üç değişkenler için bağımsız kalibre edilmesi gerektiğini unutmayın. B) özü hazırlıkları sapmalar. Farklı tarihlerde hazırlanan iki ham ekstrelerinin Endpoint floresan gösterilir; hata çubukları farklı günde, üç bağımsız çalışan 1 standart sapma vardır. büyük rakam görmek için buraya tıklayın .
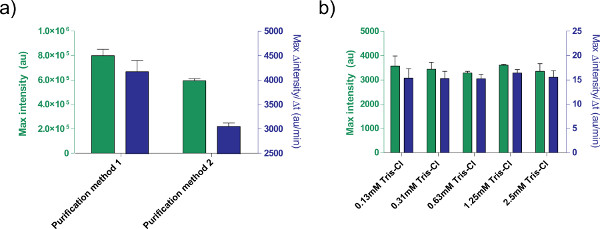
Şekil 5,. Ifade verimliliği DNA çözeltisi etkisi. iki farklı saflaştırma a) Karşılaştırmaplazmidleri işleme yöntemleri. PBEST-OR2-OR1-Pr-UTR1-deGFP-T500 1 nM sadece bir QIAprep Spin Miniprep Kiti (saflaştırma, yöntem 1) ya da bir QIAquick PCR saflaştırma kiti ile post-işlem kullanılarak hazırlanır (saflaştırma, yöntem 2). 8 saat, hem de 12 dakikalık bir hareketli ortalama göre protein üretiminin maksimum hızı sonra uç floresan gösterilmiştir. Hata çubukları, farklı günlerde dört bağımsız çalışan 1 standart sapma değerleridir. Elüsyon tamponu b) etkisi (Tris-Cl). Tris-Cl farklı konsantrasyonları pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 1 nM ekspresyonuna göre hücresiz bir sentezleme reaksiyonu karşılaştırılmaktadır. Verilen konsantrasyonlar reaksiyonunda Tris-CI içinde nihai konsantrasyonlar olarak, kullanılan yıkama tamponu 10 mM Tris-Cl. Hata çubukları farklı günlerde üç bağımsız çalışan 1 standart sapma vardır. büyük rakam görmek için buraya tıklayın .
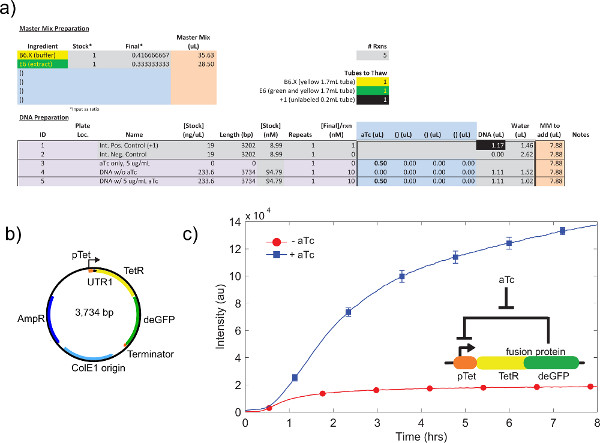
Şekil 6,. Negatif geri besleme döngüsü örnek TX-TL çalıştırın. a) Örnek hücresiz yürütme reaksiyonu kurulumu. Vs negatif geri besleme döngüsü "off" devlet, pozitif ve negatif kontroller ile. B) negatif geri besleme döngüsü plazmid haritası. C) Temsilcisi sonuçları "konulu" Testleri. Veriler deney in yansıtan) ve b), negatif kontrol ile sinyalinden çıkartılmaktadır. Genetik devre insert gösterilmiştir. Hata çubukları farklı günlerde üç bağımsız çalışan 1 standart sapma vardır. büyük rakam görmek için buraya tıklayın .
| Isim | Konsantrasyon | Miktar | Sterilizasyon | Notlar |
| Kloramfenikol (Cm) | Etanol içinde 34 mg / ml | 1 mi | Filtre sterilize (0.22 uM) | Daha sonra kullanılmak üzere -20 ° C'de saklanır büyük hacimlerde yapılabilir. |
| 2xYT + P + Cm agar | 31 g / L 2xYT, 40 mM potasyum fosfat dibazik, 22 mM potasyum fosfat monobazik, 34 ug / ml kloramfenikol | 1 tabak | Otoklav | |
| 2xYT + P medya | 31 g / L 2xYT, 40 mM potasyum fosfat dibazik, 22 mM potasyum fosfat monobazik | 4 L | Otoklav |
Tablo 1. Ham hücre ekstresi protokol 1 gün için ayıraçlar.
| Isim | Konsantrasyon | Miktar | Sterilizasyon | Notlar |
| Tris baz | 2 M | 250 ml | Filtre sterilize (0.22 uM) ya da otoklav | Oda sıcaklığında saklanabilir. |
| DTT | 1 M | 6 mi | Filtre sterilize (0.22 uM) | Büyük hacimli olarak yapılmış ve daha sonra kullanılmak üzere -20 ° C'de muhafaza edilebilir. |
| S30A tampon | 14 mM Mg-glutamat, 60 mM K-glutamat, 50 mM Tris, pH 7.7 | 2 L | Otoklav | PH 7.7 ulaşmak için, asetik asit ile titre edilir. Kullanımdan hemen önce 2 mM nihai konsantrasyon için DTT ekleyin. 4 ° C'de saklayın |
| S30B tampon | 14 mM Mg-glutamat, 60 mM K-glutamat, ~ 5 mM Tris, pH 8.2 | 2 L | Otoklav | PH 8.2 ulaşmak için 2M ile titreTris. Kullanımdan hemen önce, 1 mM DTT nihai konsantrasyon için ekleyin. 4 ° C'de saklayın |
Tablo 2. Ham hücre ekstresi protokol 2 gün için ayıraçlar.
| Şahin | ||||
| 1 | 2 | 3 | 4 | |
| Boş 50 ml Falcon (g) | ||||
| Pelet 50 ml Falcon (g) | ||||
| Pellet kütlesi (50 mi pelet Falcon - boş 50 ml Falcon) (g) | ||||
| Eklemek için S30A tampon hacmi (pelet kütle * 0.9) (ml) | ||||
| Eklemek için boncuk toplam kütlesi (topak kütle * 5.0) (g) | ||||
Tablo 3. Ham Hücre Özü protokolü 3 gün boyunca S30A tampon ve boncuk kitle hesap makinesi,.
| Isim | Konsantrasyon | Miktar | Sterilizasyon | Notlar |
| Hepes | 2 M, pH 8 | 4 mi | Hiçbiri | PH 8 ulaşmak için, KOH ile titre. |
| Nükleotid Mix | 156 mM ATP ve GTP, 94 mM CTP ve UTP, pH 7.5 | 1.5 mi | Hiçbiri | PH 7.5 ulaşmak için, KOH ile titre. |
| tRNA | 50 mg / ml | 600 ul | Hiçbiri | |
| CoA | 65 mM | 600 ul | Hiçbiri | |
| NAD | 175 mM, pH 7.5-8 | 300 ul | Hiçbiri | PH 7.5-8 ulaşmak için, 2 M de Tris ile titre |
| cAMP | 650 mM, pH 8 | 200 ul | Hiçbiri | PH 8 ulaşmak için, 2 M de Tris ile titre |
| Folinik Asit | 33.9 mM | 300 ul | Hiçbiri | Sadece 300 ul gerekli olmasına rağmen, ilgili ilave bilgiler reçete 1.15 ml içindir. |
| Spermidin | 1 M | 150 ul | Hiçbiri | 4 ° C'de saklayın, ısı 37 ° C erime. |
| 3-PGA | 1.4 M, pH 7.5 | 3.2 ml | Hiçbiri | PH 7.5 ulaşmak için, 2 M de Tris ile titre |
Tablo 4. Enerji Çözümü protokol hazırlamak için Reaktifler.
Ek Malzeme 1. Öğeler için tarifler.
Kloramfenikol, 34 mg / ml: 0.51 g kloramfenikol hazırlayın ve 15 ml etanol ekleyin. Filtre sterilize (0.22 uM), 1 ml tüpler, daha sonra kullanılmak üzere -20 ° C'de saklamak için alikosu.
2xYT + P + Cm agar plakası: 1.24 g 2XYT, 1 M 1.6 mi, potasyum fosfat dibazik çözeltisi, 40 ml, 1 M 0,88 ml potasyum fosfat monobazik çözeltisi, 0.6 g agar ve su hazırlayın. Otoklav. 50 ° C'ye soğuması ve 40 ul Cm ekleyin. Tümbölen 25 100 x 15 mm Petri kabı içine ml, ve bir saat boyunca soğumaya bırakın.
2xYT + P medya: 124 g 2xYT, 1 M 160 ml potasyum fosfat dibasic çözümü, 4 L. Aliqu 1 M, ve su @ 88 ml potasyum fosfat monobasik çözüm hazırlayın2 x 1.88 L ve 0.24 L. otoklav içine ot.
Tris baz, 2 M: 250 ml olacak şekilde 60.57 g Tris baz ve su hazırlayın. Daha sonra kullanılmak üzere oda sıcaklığında, depolama sterilize edin.
DTT, 1 M: 15 ml 2.31 g DTT ve su hazırlayın. Filtre sterilize (0.22 uM), 1 ml tüpler, daha sonra kullanılmak üzere -20 ° C'de saklamak için alikosu.
S30A tamponu: 10.88 g Mg-glutamat ve 24,39 g K-glutamat, 2M, (pH 7.7), asetik asit, 50 ml Tris hazırlayın ve su 2 L. Otoklav için, 4 ° C de saklamak, 4 ml 1 M DTT eklemek Kullanmadan önce.
S30B tamponu: 10.88 g Mg-glutamat ve 24.39 g K-glutamat, 2 M Tris (pH 8.2) hazırlayın ve su 2 L. Otoklav, 4 ° C'de mağaza, kullanımdan önce 2 ml 1 M DTT ekleyin.
HEPES: 1.91 g HEPES (MW 238,21), KOH (pH 8'e) hazırlayın ve su için 4 ml.
tRNA: 600 ul 30 tRNA mg ve su hazırlayın.
CoA: 600 ul 30 CoA (MW 767,53) mg ve su hazırlayın.
NAD: 300 ul (pH 7.5-8 kadar) NAD 34.83 mg (MW 663,43), 2 M Tris ekleyin ve su. (PH 7.5-8 için çözüm getirmek için 2 M de Tris 27 ul ekleyin).
cAMP: 200 ul 42,80 cAMP mg (MW 329,22), 2 M (pH 8'e) ile Tris, ve su eklenir. (PH 8 için çözüm getirmek için 2 M de Tris 73 ul ekleyin).
Folinik asit (33.9 mM): katı folinik asit kalsiyum tuzunun (MW 511.5) 20 mg, 1.15 mi su eklenir.
Spermidin: 150 ul 23.55 spermidin ul (MW 145.25) ve su hazırlayın. 37 ° C'de kısa bir süre sonra, erime oda sıcaklığında hazırlanması
3-PGA: 3.2 ml 1.03 3-PGA (MW 230,02) g, (pH 7.5), 2 M Tris, ve su eklenir. (PH 7.5 çözüm getirmek için 2 M de Tris 1,73 ml ekleyin).
Nükleotidlerinide Mix: ATP dipotasyum tuzu dihidrat, 145 mg (MW 619,4), GTP disodyum tuzu 133 mg (MW 567,14), CTP disodyum tuzu dihidrat, 79.4 mg (MW 563,16), UTP trisodyum tuzu dihidrat, 82.6 mg (MW 586,12) ilave , 1.5 ml% 15 seyreltme (pH 7.5), ve su da KOH. (PH 7.5 çözüm getirmek için% 15 seyreltmede KOH 353 ul).
Ek Maddesi 2. Bradford Deneyi.
- 4 ° C ile Bradford maddesi çıkarın ve oda sıcaklığında ayarlayın.
- 1 mg / ml ve 0.1 mg / ml 'de 50 ul BSA standardı hazırlayın.
- Adım 1.47 ekstrenin 40 ul 20x seyreltme hazırlayın.
- 7 küvetler 800 ul su ekleyin.
- 0 mg / ml, 1 mg / ml (10 ul 0.1 mg / ml BSA), 2 mg / ml (20 ul 0.1 mg / ml BSA), 4 mg / ml (4 ul 1 mg / ml BSA) standart küvetler hazırlanması , 6 mg / ml (6 ul 1 mg / ml BSA).
- Örnek 2 ul ve örnek 4 ul deney küvetler için hazırlayın.
- Her küvete Bradford maddenin 200 ul ekleyin ve iyice karıştırın by pipetleme. En az 10 dakika boyunca oda sıcaklığında inkübe edin.
- Adım 6.5 küvetler kullanılarak OD 595 nm de standart eğri üretin. Standart eğri reddetmek ise r 2 <0.95.
- Adım 6.6 küvetler kullanılarak OD 595 nm de ekstrakt konsantrasyonu belirleyin.
Ek Maddesi 3. Kalibrasyon tablonuzu Tampon.
TXTL_e (şablon) _calibration_JoVE.xlsx bakın .
Ek Malzeme 4. Hücre içermeyen ifade elektronik tablo çalıştırın.
Tartışmalar
Burada anlatılan endojen Escherichia coli tabanlı TX-TL hücre-özgür ifade sistem veri toplama kurmak daha az sekiz saat sürebilir kolay bir vadede üç tüp tepkidir. Tüm reaktifler oluşturma işlemi beş günlük süre toplam (sadece bir günde önemli emek şartlarına) gerektirir, ancak 3000 reaksiyonlar için ham özü üreten ve tampon verme 10000 reaksiyonları için reaktif (Şekil 1). Ayrıca, ham öz ve tampon verme reaktif bir hazırlama birden fazla kullanım için izin veren, -80 ° C de en az 1 yıl boyunca stabildir. 4, 10 ul reaksiyon başına 0,11 $ (işçilik dahil 0,26 $) olarak, maliyeti karşılaştırılabilir% 98'den daha düşüktür ticari sistemler (Şekil 2).
Bazı çözülmemiş sınırlamalar sisteme Bununla birlikte, var. Her bir ham hücre özütü hazırlama nihai verim, kullanıcı, yeterlilik ve çevre koşullarına göre değişebilir, ancak typical verim varyasyon% 5-10 (Şekil 4b) arasındadır. Bunun bir sonucu olarak, her iki uç noktası ifade ve ifade dinamikleri partiden partiye değişkenlik beklenemez. Özü oluşturma tam otomatik kadar özü tam olarak karakterize kadar veya bu varyasyonlar büyük olasılıkla kalacaktır. Hücre içermeyen sentezleme sistemi hassas bir kantitatif deneyler için kullanılan, bu ham hücre ekstresinin aynı toplu tüm deneyler çalıştırmak için tavsiye edilir. Tek bir ham hücre ekstraktı toplu, yaklaşık 3000 reaksiyonlar verimi tipik bir deney sahaları için yeterli olmalıdır. Biz varyasyon ölçeklendirme ve prosedürü otomatik silinebilir şüphelenmesine rağmen, bu tür girişimler önemli bir kaynak yatırımı içerecektir.
Uç-nokta temsil seviyelerini belirlemek üzere oldukça kolay olmasına rağmen, ayrıca, daha fazla iş hücre içermeyen bir sistem için esas anlayış dinamikleri yapılması gerekmektedir. Bilindiği gibi iki kaynak competition ve kaynak sınırlaması ifade dinamiklerini etkileyebilir. Örneğin, belirli endojen sigma 70. 9,27 Bununla birlikte, tam dinamik sistem kullanmak için anlaşılması gerekmez artan DNA şablonu nükleotid ya da amino asit tükenmesi edilene benzer bir ekspresyon profili üreten bir doyurulması rejimi neden olabilir. Verim saf artar, optimizasyon makine-öğrenme yaklaşımları ile yapılabilir. Kaynak rekabeti sınırlama ve 28 Sorular deneysel veriler kullanılarak doğrulandı matematiksel modellerle ele alınabilir.
Burada sunulan protokolü BL21-Rosetta2 suşu için optimize edilmiş, ancak diğer E. genellenebilir olduğunu coli suşları. Bu tür gen kodlayan boylam proteaz ve nadir tRNAs kodlayan genlerin ilavesinin giderilmesi gibi BL21-Rosetta2 modifikasyonlar, maksimum protein üretimi için izin verir. Biz diğer iki ekstresi suşları ile protokol çalıştılar - sadece BL21 ve BL21 trxA nakavt-and% 50 daha az protein verimi bulundu. Biz diğer suşları kullanırken verimleri benzer azalttığını varsayımında. Örneğin LB ve diğer zengin bakteri kültürü için 2xYT büyüme ortamını değiştirme gibi parametreler, diğer değişiklikler, azalmış protein verimle sonuçlandı.
Endojen ve eksojen transkripsiyon-çeviri makine ve regülasyon mekanizmalarını hem kullanan hücre-özgür ifade sistemleri protein ve metaboliti ifade hem de ve sentetik biyoloji geniş uygulamalar var. Yerine T7-regüle devreleri sınırlı olmak, bir karmaşık biyomoleküllerin üretiminde tasavvur edebilir 3,29 yerli E. bir karışımını kullanarak bir kullanıcı tarafından kontrol ortamda coli hızlandırıcılar ve dışsal olarak verilen transkripsiyon ve regülasyon mekanizmaları. Hücre bölünmesi ve metabolizma sınırlama olmaksızın, bu tür repressilator ya da bu üretim artemisinin gibi metabolik mühendislik yollarındaki gibi sentetik devrelerinde değişkenlik azalır ya da daha iyi anlaşılabilir. 30,31 Biz havE genetik anahtarları uygulamak için, yanı sıra sigma faktörü haciz anlamak için bu avantajları kullanılır 9,32 Bu teknoloji aynı zamanda "minimal" veya "yapay" hücrelerin omurgasını oluşturabilir -. küçük, iyi karakterize ve kendine yeterli somutlaşan birimleri özü. 33,34
Sonuçta, biz sentetik biyoloji için bir prototip ortamı olarak bu endojen hücre içermeyen ifade sisteminin derhal kullanımlar tahmin. Temel plazmiti, doğrusal ya da kimyasal olarak sentezlenmiş DNA üzerinde test döngüleri, bunu takiben-- takma "TX-TL biyomoleküler deneyleri," hücre sentezleme sistemi içermeyen prototipleme mermi geçirebilmektedir sentetik devre sonunda in vivo ifadesi için tahsis edilmiş bir kontrol ortamı sağlar analizi ve hızlı bir modifikasyonu ile. Prototip mermi şu anda geliştirilmekte olan akıllı matematiksel modellerle destekli olabilir. Klonlama ve non-son devreler için vivo manipülasyon kaldırarak, biz engi tahmindisliği döngü süreleri yerine geçerli haftalık standart 1-3 gün azaltılmalıdır.
Açıklamalar
Yazarlar, hiçbir rakip mali çıkarlarını olmadığını beyan ederim.
Teşekkürler
Biz projenin erken aşamalarında yardım için Jongmin Kim, Dan Siegal-Gaskins, Anu Thubagere ve protokol düzene yardım için Enoch Yeung, ve Clare Chen ve Barclay Lee teşekkür ederim. Bu malzeme Yaşam Dökümü programı, sözleşme numarası HR0011-12-C-0065 (DARPA / CMO.ZZS da UCLA / Caltech Tıp Scientist tarafından desteklenen Savunma İleri Araştırma Projeleri Ajansı (DARPA / MTO) tarafından kısmen desteklenen çalışma üzerine kuruludur Eğitim Programı dostluk ve bir DoD, Bilimsel Araştırma, Milli Savunma Bilimi ve Mühendisliği Yüksek Lisans (NDSEG) Bursu, 32 CFR 168A Hava Kuvvetleri Ofisi., bu belgede yer alan görüş ve sonuçlar yazarlara aittir ve temsil olarak yorumlanmaması gerektiğini resmen politikaları, açıkça veya ima, Savunma İleri Araştırma Projeleri Ajansı veya ABD Hükümeti.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2xYT | MP biomedicals | 3012-032 | |
| 3-PGA | Sigma-Aldrich | P8877 | |
| ATP | Sigma-Aldrich | A8937 | |
| Bacto-agar | BD Diagnostics | 214010 | |
| Bead-beating tubes (polypropylene microvials) | BioSpec | 522S | |
| Beads, 0.1mm dia. | BioSpec | 11079101 | |
| BL21 Rosetta 2 E. coli strain | Novagen | 71402 | |
| Bradford BSA Protein Assay Kit | Bio-rad | 500-0201 | |
| cAMP | Sigma-Aldrich | A9501 | |
| Chloramphenicol | Sigma-Aldrich | C1919 | |
| CoA | Sigma-Aldrich | C4282 | |
| CTP | USB | 14121 | |
| Cuvettes, 1.5ml | Fisher | 14-955-127 | |
| DTT | Sigma-Aldrich | D0632 | |
| Folinic acid | Sigma-Aldrich | F7878 | |
| GTP | USB | 16800 | |
| HEPES | Sigma-Aldrich | H6147 | |
| K-glutamate | Sigma-Aldrich | G1149 | |
| Mg-glutamate | Sigma-Aldrich | 49605 | |
| Micro Bio-Spin Chromatography Columns | Bio-Rad | 732-6204 | |
| NAD | Sigma-Aldrich | N6522 | |
| Nunc 384-well optical bottom plates | Thermo-Scientific | 142761 | |
| Nunc sealing tape | Thermo-Scientific | 232701 | |
| PEG-8000 | Promega | V3011 | |
| Potassium phosphate dibasic solution | Sigma-Aldrich | P8584 | |
| Potassium phosphate monobasic solution | Sigma-Aldrich | P8709 | |
| RTS Amino Acid Sampler | 5 Prime | 2401530 | |
| Slide-A-Lyzer Dialysis Cassettes, 10k MWCO (Kit) | Thermo-Scientific | 66382 | |
| Spermidine | Sigma-Aldrich | 85558 | |
| Tris base | Fischer | BP1521 | |
| tRNA (from E. coli) | Roche Applied Science | MRE600 | |
| UTP | USB | 23160 | |
| 1L Centrifuge Bottle | Beckman-Coulter | A98813 | This is specific for Avanti J-series; obtain equivalent size for centrifuge in use. |
| 4L Erlenmeyer Flask | Kimble Chase | 26500-4000 | |
| Avanti J-26XP Centrifuge | Beckman-Coulter | 393127 | Or 1L-capable centrifuge equivalent. |
| Forma 480 Orbital Shaker | Thermo Scientific | 480 | Or chest-size 6x4L shaker equivalent. |
| JLA-8.1000 Rotor | Beckman-Coulter | 363688 | Or 1L-capable, 5000 x g rotor equivalent for centrifuge. |
| Mini-Beadbeater-1 | BioSpec | 3110BX | |
| Supplemental Material 1. Recipes for Items. Chloramphenicol, 34 mg/ml: Prepare 0.51 g chloramphenicol and add ethanol to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. 2xYT+P+Cm agar plate: Prepare 1.24 g 2xYT, 1.6 ml potassium phosphate dibasic solution @ 1 M, 0.88 ml potassium phosphate monobasic solution @ 1 M, 0.6 g agar, and water to 40 ml. Autoclave. Let cool to 50 °C and add 40 μl Cm. Aliquot 25 ml into a 100x15 mm petri dish, and let cool for an hour. 2xYT+P media: Prepare 124 g 2xYT, 160 ml potassium phosphate dibasic solution @1 M, 88 ml potassium phosphate monobasic solution @ 1 M, and water to 4 L. Aliquot out into 2x1.88 L and 0.24 L. Autoclave. Tris base, 2 M: Prepare 60.57 g Tris base and water to 250 ml. Sterilize, store at RT for later use. DTT, 1 M: Prepare 2.31 g DTT and water to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. S30A buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, 50 ml Tris at 2M, acetic acid (to pH 7.7), and water to 2 L. Autoclave, store at 4 °C, add 4 ml 1 M DTT before use. S30B buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, Tris at 2 M (to pH 8.2), and water to 2 L. Autoclave, store at 4 °C, add 2 ml 1 M DTT before use. HEPES: Prepare 1.91 g HEPES (MW 238.21), KOH (to pH 8), and water to 4 ml. tRNA: Prepare 30 mg of tRNA and water to 600 μl. CoA: Prepare 30 mg of CoA (MW 767.53) and water to 600 μl. NAD: Add 34.83 mg of NAD (MW 663.43), Tris at 2 M (to pH 7.5-8), and water to 300 μl. (Add 27 μl of Tris at 2 M to bring the solution to pH 7.5-8). cAMP: Add 42.80 mg of cAMP (MW 329.22), Tris at 2 M (to pH 8), and water to 200 μl. (Add 73 μl of Tris at 2 M to bring the solution to pH 8). Folinic Acid (33.9 mM): To 20 mg of solid folinic acid calcium salt (MW 511.5), add 1.15 ml water. Spermidine: Prepare 23.55 μl of spermidine (MW 145.25) and water to 150 μl. Prepare at room temperature after melting briefly at 37 °C. 3-PGA: Add 1.03 g of 3-PGA (MW 230.02), Tris at 2 M (to pH 7.5), and water to 3.2 ml. (Add 1.73 ml of Tris at 2 M to bring the solution to pH 7.5). Nucleotide Mix: Add 145 mg of ATP dipotassium salt dihydrate (MW 619.4), 133 mg of GTP disodium salt (MW 567.14), 79.4 mg of CTP disodium salt dihydrate (MW 563.16), 82.6 mg of UTP trisodium salt dihydrate (MW 586.12), KOH at 15% dilution (to pH 7.5), and water to 1.5 ml. (Add 353 μl of KOH at 15% dilution to bring the solution to pH 7.5). Supplemental Material 2. Bradford Assay.
See TXTL_e(template)_calibration_JoVE.xlsx. Supplemental Material 4. Cell-free expression run spreadsheet. See TXTL _JoVE.xlsx. | |||
Referanslar
- Noireaux, V., Bar-Ziv, R., Libchaber, A. Principles of cell-free genetic circuit assembly. Proceedings of the National Academy of Sciences of the United States of America. 100, 12672-12677 (2003).
- He, M. Y., He, Y. Z., Luo, Q., Wang, M. R. From DNA to protein: No living cells required. Process Biochem. 46, 615-620 (2011).
- Forster, A. C., Church, G. M. Synthetic biology projects in vitro. Genome Res. 17, 1-6 (1101).
- Shin, J., Noireaux, V. Efficient cell-free expression with the endogenous E. Coli RNA polymerase and sigma factor 70. Journal of biological engineering. 4, 8 (2010).
- Shimizu, Y., et al. Cell-free translation reconstituted with purified components. Nat Biotechnol. 19, 751-755 (2001).
- Shin, J., Noireaux, V. An E. coli Cell-Free Expression Toolbox: Application to Synthetic Gene Circuits and Artificial Cells. Acs Synth Biol. 1, 29-41 (2012).
- Shin, J., Noireaux, V. Study of messenger RNA inactivation and protein degradation in an Escherichia coli cell-free expression system. Journal of biological engineering. 4, 9 (2010).
- Shin, J., Jardine, P., Noireaux, V. Genome Replication, Synthesis, and Assembly of the Bacteriophage T7 in a Single Cell-Free Reaction. Acs Synth Biol. 1, 408-413 (2012).
- Siegal-Gaskins, D., Noireaux, V., Murray, R. M., Pao, L., Abramovitch, D. Biomolecular resource utilization in elementary cell-free gene circuits. , 1531-1536 (2013).
- Karzbrun, E., Shin, J., Bar-Ziv, R. H., Noireaux, V. Coarse-grained dynamics of protein synthesis in a cell-free system. Physical review letters. 106, 048104 (2011).
- Hoagland, M. B., Stephenson, M. L., Scott, J. F., Hecht, L. I., Zamecnik, P. C. Soluble Ribonucleic Acid Intermediate in Protein Synthesis. J Biol Chem. 231, 241-257 (1958).
- Wood, W. B., Berg, P. Effect of Enzymatically Synthesized Ribonucleic Acid on Amino Acid Incorporation by a Soluble Protein-Ribosome System from Escherichia Coli. Proceedings of the National Academy of Sciences of the United States of America. 48, 94 (1962).
- Zubay, G. In-Vitro Synthesis of Protein in Microbial Systems. Annu Rev Genet. 7, 267-287 (1973).
- Pratt, J. M., Hames, B. D., Higgins, S. J. . Transcription and Translation: A Practical Approach. , 179-209 (1984).
- Kim, H. C., Kim, D. M. Methods for energizing cell-free protein synthesis. Journal of bioscience and bioengineering. 108, 1-4 (2009).
- Michel-Reydellet, N., Calhoun, K., Swartz, J. Amino acid stabilization for cell-free protein synthesis by modification of the Escherichia coli genome. Metabolic engineering. 6, 197-203 (2004).
- Liu, D. V., Zawada, J. F., Swartz, J. R. Streamlining Escherichia coli S30 extract preparation for economical cell-free protein synthesis. Biotechnology progress. 21, 460-465 (2005).
- Andrianantoandro, E., Basu, S., Karig, D. K., Weiss, R. Synthetic biology: new engineering rules for an emerging discipline. Molecular systems biology. 2, 2006.0028 (2006).
- Kwok, R. Five hard truths for synthetic biology. Nature. 463, 288-290 (2010).
- Tabor, S., Richardson, C. C. A bacteriophage T7 RNA polymerase/promoter system for controlled exclusive expression of specific genes. Proceedings of the National Academy of Sciences of the United States of America. 82, 1074-1078 (1985).
- Lewicki, B. T., Margus, T., Remme, J., Nierhaus, K. H. Coupling of rRNA transcription and ribosomal assembly in vivo. Formation of active ribosomal subunits in Escherichia coli requires transcription of rRNA genes by host RNA polymerase which cannot be replaced by bacteriophage T7 RNA polymerase. Journal of molecular biology. 231, 581-593 (1993).
- Iskakova, M. B., Szaflarski, W., Dreyfus, M., Remme, J., Nierhaus, K. H. Troubleshooting coupled in vitro transcription-translation system derived from Escherichia coli cells: synthesis of high-yield fully active proteins. Nucleic acids research. 34, e135 (2006).
- Kigawa, T., et al. Preparation of Escherichia coli cell extract for highly productive cell-free protein expression. Journal of structural and. 5, 63-68 (2004).
- Matsuda, T., et al. Improving cell-free protein synthesis for stable-isotope labeling. Journal of biomolecular. NMR. 37, 225-229 (2007).
- Sitaraman, K., et al. A novel cell-free protein synthesis system. Journal of biotechnology. 110, 257-263 (2004).
- Becskei, A., Serrano, L. Engineering stability in gene networks by autoregulation. Nature. 405, 590-593 (2000).
- Maeda, H., Fujita, N., Ishihama, A. Competition among seven Escherichia coli sigma subunits: relative binding affinities to the core RNA polymerase. Nucleic acids research. 28, 3497-3503 (2000).
- Caschera, F., et al. Coping with complexity: machine learning optimization of cell-free protein synthesis. Biotechnology and bioengineering. 108, 2218-2228 (2011).
- Hodgman, C. E., Jewett, M. C. Cell-free synthetic biology: thinking outside the cell. Metabolic engineering. 14, 261-269 (2012).
- Elowitz, M. B., Leibler, S. A synthetic oscillatory network of transcriptional regulators. Nature. 403, 335-338 (2000).
- Tsuruta, H., et al. High-level production of amorpha-4,11-diene, a precursor of the antimalarial agent artemisinin, in Escherichia coli. Plos One. 4, e4489 (2009).
- Gardner, T. S., Cantor, C. R., Collins, J. J. Construction of a genetic toggle switch in Escherichia coli. Nature. 403, 339-342 (2000).
- Jewett, M. C., Forster, A. C. Update on designing and building minimal cells. Current opinion in biotechnology. 21, 697-703 (2010).
- Noireaux, V., Libchaber, A. A vesicle bioreactor as a step toward an artificial cell assembly. Proceedings of the National Academy of Sciences of the United States of America. 101, 17669-17674 (2004).
Erratum
Formal Correction: Erratum: Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology
Posted by JoVE Editors on 1/01/1970. Citeable Link.
A correction to Figure 5's legend has been made for the article Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology. Method 1 and method 2 have been switched.Z
The figure legend was update from:
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 1) or post-processed with a QiaQuick PCR purification kit (Purification method 2).
to
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 2) or post-processed with a QiaQuick PCR purification kit (Purification method 1).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır