Method Article
구현을위한 프로토콜
* 이 저자들은 동등하게 기여했습니다
Erratum Notice
요약
이 5 일간의 프로토콜은 모든 단계, 장비 및 기반의 효율적인 내생 대장균 처음부터 TX-TL의 무 세포 발현 시스템을 구축 및 실행에 필요한 추가 소프트웨어를 설명합니다. 시약, 프로토콜은 8 셋업 시간 이하의 반응, 수집, 및 프로세스 데이터를 걸린다.
초록
이상적인 무 세포 발현 시스템은 이론적으로 시험관 플랫폼 제어. 1이 통제 된 방식으로 단백질과 유전자 회로를 표현뿐만 아니라, 합성 생물학에 대한 프로토 타이핑 환경을 제공하는 데 유용합니다. 2,3에서 생체 세포 환경을 에뮬레이션 할 수 있습니다 후자의 목적을 달성하기 위해, 보존 무 세포 발현 시스템은 내인성 대장균 전사 - 번역 메커니즘은 더 정확하게 T7 RNA 폴리머 라제 전사에 기초하여보다 생체 세포 역학을 반영 할 수있다. 우리는 효율적인 내인성 E.의 준비 및 실행을 서술 유사한 상용 시스템에 대한 98 %의 비용 절감에 T7 기반 시스템과 같은 단백질의 상당 금액을 생산할 수있는 대장균을 기반으로 전사 - 번역 (TX-TL) 무 세포 발현 시스템. 4,5 버퍼와 원유 세포 추출물의 준비가 의 실행뿐만 아니라, 기재된세 관 TX-TL 반응. 전체 프로토콜을 준비하는 데는 약 5 일이 소요됩니다 한 준비에 최대 3000 단일 반응에 대한 충분한 정보를 얻을 수 있습니다. 일단 준비, 각 반응은 데이터 수집 및 분석 설정에서 8 시간에서 걸립니다. E.에 대한 규제와 전사 외인성의 메커니즘 대장균이 같은 락 / TET의 억제 자와 T7 RNA 중합 효소로 보충 할 수있다. 이러한 mRNA와 DNA의 분해 속도와 같은 6 내생의 속성을,도 조정할 수 있습니다. 7 TX-TL의 무 세포 발현 시스템이 시연 한 대형 규모의 회로 조립, 생물학적 현상을 탐구하고, 모두 T7과 내생 발기인에서 단백질의 발현. 6,8 동반자 수학적 모델을 사용할 수 있습니다. 9,10 결과 시스템은 프로토 타입 환경으로 합성 생물학의 고유 한 응용 프로그램을 가지고, 또는 "TX- TL의 생명 브레드. "
서문
세포 자유로운 표현 기술은 T7 박테리오파지 DNA를 사용하여 결합 전사 - 번역의 메커니즘을 포함하는 년 후 발전, 순수하게 번역으로 1950 년에 시작되었다. 11, 12, 그 이후로, 수많은 노력은 원유 세포 추출물의 창조 (또는 E를 최적화되었습니다 . 대장균 S30 추출물). (13, 14) 이러한 최적화는 ATP 재생 또는 변형 수정을 통해 세포 단백질 합성을 연장하고, 프로토콜의 시간과 비용을 줄일 수 있습니다. 15-17 대체 무 세포 발현 시스템이 존재하는 원유 대신에 사용 재구성 구성 요소 표현 세포 추출물. 5 조 세포 추출물과 재구성 방법은 모두 상업적 목적으로 개발되었다.
합성 생물학의 출현과 함께, 설계 생물학적 모듈과 회로를 테스트하고 표현할 수있는 잘 특성화 플랫폼을위한 증가 필요가있다. 18, 19이 플랫폼이어야합니다다목적 잘 특징, 조작이 간단하고, 사용자가 제공 한 구성 요소에 초점을 맞추었다. 반세기 이전의 개발에도 불구하고, 세포가없는 시스템은 E.에 근거 그들은 성장과 신진 대사의 복잡성없이 세포 프로세스의 체외 표현의 단순화로 대장균은 본질적으로, 이러한 요구 사항을 공유 할 수 있습니다. 또한, E.에 생체 내 작품에서 기초 지식의 모든 대장균 E.에 쉽게 적용 대장균 세포없는 시스템.
무 세포 발현 시스템은 대부분의 무 세포 발현 시스템의 목표를 지금까지 합성 생물학에 응용 프로그램이있을 수 있지만 단백질과 대사 산물의 수율을 극대화하고있다. 이것은 T7 프로모터에 의해 구동 시퀀스의 T7 박테리오파지의 전사를 사용하여 수행됩니다. 20 표현이 효율적이고 강력하지만, 이러한 시스템은 고도로 전문화 된 목적을 제공하고 있습니다. 셀 규제 방법이 제한되어 대상 DNA 템플릿을해야합니다T7 프로모터를 포함하도록 재 설계하고, 이러한 리보솜 단지 특정 시퀀스가 전사 및 조립 할 수 없습니다. (21, 22) 기존의 무 세포 발현 시스템은 내생 규정하는 기계, 합성 생물학에 필요한 기능성을 유지하면서 높은 수율을 유지할 수 없습니다.
우리는 내생 E.을 개발했습니다 이전 시스템에 의해 입증 단백질 발현의 효율성을 유지하지만 있도록하여 추가 기능성을 추가 대장균 세포 표현의 자유의 시스템 표현과 (T7 또는 기타) 메커니즘 내인성 및 외인성 양에 따라 조절. 여기에 설명 된 프로토콜은 원래. Kigawa 등을 기준으로 (2004 년)와 리우 등. (2005), 그러나 중요한 수정을 가지고 있습니다. 그것은 효율성 향상을위한 마그네슘과 K-아세테이트 mg 이상 및 K-글루탐산을 활용 2 - 머 캅토 에탄올을 제거하고, 비드 비터를 사용하여 세포를 lyses. 17,23,24 비드 박동이 균질화를 통해 선택,때문에 경쟁 시스템의 낮은 비용과 유사한 수율에 압력 기반의 방법, 또는 초음파는. 23 3 phosphoglyceric 산 (3-PGA는)이 크레아틴 인산에 비해 우수한 단백질 수율을 제공하는 것으로 확인되었을 때 에너지 원으로 사용된다 포스. 4,25 우리의 시스템은 하나 람다 파지 사업자와 sigma70 기반의 발기인 또는 다른 상용 시스템에서 수익률과 유사한 T7 중심의 프로모터를 사용하여 기자 단백질의 0.75 ㎎ / ㎖을 생성 할 수 있습니다. 4,6 다섯 일 필요한 모든 시약 (그림 1)를 생성해야합니다. 또한, 비교 광고 셀없는 시스템에 비해 98 %의 비용 절감을 제공합니다 - 재료 비용 노동 (그림 2)를 포함으로 $ 0.26로 상승하는 10 ㎕의 반응 당 $ 0.11이다.
프로토콜
1. 원유 세포 추출 준비
3 일 동안 원유 세포 추출물을 준비 효율적으로 수행하기 위해 두 사람이 필요합니다. 문화 증가율 (1.1 단계 1.11 단계), 세포 용해 (1.37 단계로 단계 1.12), 및 설명을한다 (단계 1.38 1.52 단계로) 추출 : 프로토콜은 기능적으로 세 부분으로 구성되어 있습니다. 그것은 편의를 위해 일으로 나누어 제공됩니다. 이상적인 추출물은 플라스미드 pBEST-OR2-OR1-PR-UTR1-deGFP-T500 (Addgene 번호 40019), 단백질의 27 ~ 30 ㎎ / ㎖ 사이의 원유 세포 추출물의 농도가. 4에서 deGFP 0.75 ㎎ / ㎖를 생성 할 수있다 그러나 추출 특성은 배치에서 배치에 따라 다릅니다. 다음 조리법은 약 3,000 단일 반응 (6 ㎖의 원유 세포 추출물)에 대한 충분한을 제공합니다. 축소하는 경우에는 더 적은 여기에 주어진 값의 1 / 6 이상을 사용하지 않는 것이 좋습니다. 시간 제약으로 인해, 스케일링은 사용하지 않는 것이 좋습니다.
1 일
- 준비 세균 배양 배지, 막진짜야 판, 미디어 보충은 표 1에 설명했다. 조리법에 대한 보충 자료 1을 참조하십시오.
- . 행진 BL21-Rosetta2의 2xYT + P + 센티미터 한천 판에 -80 ° C에서 긴장과 37 ° C 또는 식민지가 쉽게 볼 수 있습니다 때까지 적어도 15 시간 동안 배양 주 : 클로람페니콜 (센티미터)를 플라스미드에 선택하는 데 사용됩니다 BL21-Rosetta2 변형 드문 된 tRNA를 인코딩.
2 일
- 버퍼 및 표 2에 설명 된대로 보충 교재를 준비합니다. 조리법에 대한 보충 자료 1을 참조하십시오.
- 를 포함하여 3 일에 필요한 자료를 준비하고 살균 : 알루미늄 호일 커버 (멸균) 6 × 4 L 삼각 플라스크, 4 x 1 L 멸균 원심 분리기 병, 깔때기 (멸균)는, 0.1 mm 유리 구슬 100 G (멸균), 2 볶음 바 (멸균), 1 L와 500 ㎖의 실린더 (멸균), (멸균) 2 x 1 L 비이커, 18 G 바늘 (멸균) 3 ML의 주사기 2 ~ 3 플로리다 졸업귀리 부표 2-3 10K MWCO 투석 카세트 (멸균), 큐벳.
- 미니 문화 1을 준비합니다. 12 ㎖의 멸균 문화 튜브 및 사전 따뜻한 30 분 동안 37 ° C에에 2xYT + P 미디어 4 ㎖와 센티미터의 4 μl를 추가합니다.
- 2xYT + P + 센티미터 한천 플레이트에서 식민지와 미니 문화 1을 접종한다. , 220 rpm에서 8 시간 동안 37 ° C에서 알을 품다.
- 7 시간 30 분 후, 미니 문화 2를 준비합니다. 30 분 동안 멸균 250 ㎖의 삼각 플라스크 및 사전 따뜻한 37 ° C에에 2xYT + P 미디어 50 ㎖와 센티미터의 50 μl를 추가합니다.
- 미니 문화 1의 100 μL와 미니 문화 2를 접종하고 8 시간 동안 220 rpm에서 37 ° C를 품어.
3 일
- 표 3에 네 개의 빈 멸균 50 ML 팔콘 튜브 및 기록 질량의 무게를 측정. 얼음에 팔콘 튜브를 차리고,이 이후 단계 1.18에서 사용됩니다.
- 단계 1.8 후 7 시간 30 분, 최종 세균 배양 배지를 준비합니다. 멸균 된 1 L를 사용하여 실린더, 전송에게 2xYT + P 미디어의 660 ML 졸업 I. 30 분 주 여섯 4 L 삼각 플라스크 및 사전 따뜻한 37 ° C까지의 각 NTO : 4 L 이상 삼각 플라스크 적절한 통풍을 권장합니다.
- 각 4 L의 삼각 플라스크에 미니 문화 (2)의 6.6 ML을 추가합니다. 문화 (중간 로그 성장 단계에 해당) 600 nm에서 1.5 ~ 2.0의 OD에 도달 할 때까지 220 rpm으로, 37 ° C에서 알을 품다. 정확도 1:10 문화 희석 주기적으로 OD 확인이 단계는 더 이상 3 이상의 시간을 소요 - 3 시간 45 분;. 빠른 중반 로그 단계에서 성장과 수집 추출물의 품질에 대한 중요합니다.
- 즉시 성장 후, 박테리아 세포 펠렛 4 ° C에서 12 분 동안 5,000 XG에서 네 개의 1 L의 원심 분리기 병 및 원심 분리기에 균등하게 문화를 전송합니다.
- 1 M DTT 이전에 준비 S30A의 2 L에 4 ㎖를 추가하여, 전체 S30A 버퍼 준비를 원심 분리하는 동안. 혼합하고 얼음에 버퍼를 유지한다.
- 원심 분리가 완료되면 완전히 데카에 의해 단계 1.12에서 뜨는을 제거nting 및 멸균 종이 타월에 원심 분리기 병을 모래 바닥.
- 네 개의 원심 분리기 병의 각 4 ° C에서 S30A 버퍼의 200 ML을 추가하고, 펠릿이 완전히없는 나머지 덩어리로 용해 될 때까지 적극적으로 병을 흔들어. 4 ℃에서 12 분 5,000 g에서 네 병을 원심 분리기
- 완전 멸균 종이 타월에 원심 분리기 병을 디캔팅 및 내듯 이전 단계에서 뜨는을 제거합니다.
- 반복은 1.15와 1.16를 반복합니다.
- 각각의 원심 분리기 병에 4 ° C에서 40 ㎖ S30A 버퍼를 추가합니다. .) 1.9에서 냉장 팔콘 튜브에 각각의 펠렛 및 S30A 조합을 이동 참고 :이 단계는 작은 용기에 알약을 전송하는 것입니다.
- 4 ℃에서 8 분 2,000 g에서 팔콘 튜브를 원심 분리기 경사 분리하여 상층 액을 제거합니다.
- 다시 원심 분리기 팔콘 튜브 2 분 2,000 g로 4 ℃에서 완전히 피펫에 의해 잔류 뜨는을 제거합니다. 얼음에 보관하십시오.
- F의 무게를표 3의 펠릿 기록 질량을 가진 우리의 팔콘 튜브. 펠렛 질량 필요 S30A 버퍼 볼륨, 및 표 3의 구체적인 수식에 따라 필요한 비즈의 질량을 계산한다.
- 펠릿의 올바른 로딩 및 구슬 치는 품질 추출물을 만들기 위해 중요하며, 가장 어려운 단계입니다. 그것은 전에 비디오를 검토하는 것이 좋습니다. 공기 방울을 방지하고 균일하게 구슬을 배포하지 않으면 비효율적 추출물 발생합니다.
- 동질 때까지 각 팔콘 튜브, 소용돌이에 표 3에서 계산 S30A 버퍼의 양을 추가하고 얼음으로 돌아갑니다.
- 얼음에 다른 팔콘 튜브를 유지하면서, 30 초, 구슬 각각의 분취 량을 첨가 한 후. 세 분량 씩, 총 구슬의 1 / 3을 사용하여 각 단일 팔콘 튜브에 간헐적으로 소용돌이 구슬을 추가합니다. 소용돌이 단계 및 최종 소용돌이 후 사이의 얼음에 팔콘 튜브를 놓습니다. 최종 분취 량을 첨가 한 후, 확인구슬이 균일하게 분포되어있다. 두꺼운 붙여 넣기를 형성해야한다.
- 3-4 밀리미터 구멍을 만드 멸균 면도날을 사용하여 끝을 절단하여 5 ㎖ (양) 피펫 팁을 준비합니다. 2 ㎖에 피펫 다이얼 참고 : 다른 피펫 세트 및 팁 당기 두꺼운 비드 셀 솔루션을 출시하기에 충분하지 않을 수 있습니다 흡입 서로 다른 양의를 제공한다; 제거 끝 1 ㎖ 피펫 팁 대신에 사용할 수 있습니다..
- 얼음에 20 비드 박동 튜브를 놓습니다.
- 수정 피펫을 사용하여 세포 비드 용액의 점도를 확인합니다. 그것은 거의 배출되어 피펫 팁을 종료 지점으로 점성이 있어야한다. 너무 점성 경우, 1.25 단계를 따라 피펫 팁을 다시 조정합니다. 충분한 점성없는 경우, 비드 (펠렛 질량 * 5.1)의 최대 질량 (펠렛 질량 * 0.05) 단위로 첨가 할 수있다. 구슬, 30 초 동안 소용돌이 각각 첨가 한 후 얼음으로 돌아갑니다. 점도의 데모를위한 그림 3a를 참조하십시오.
- 수정 피펫을 사용하여 팔콘 튜브에서 비드 셀 솔루션을 제거하고 멸균 비드를 제패 한 튜브로 전송하고, 그것을 비드 셀 솔루션으로 가득 차있는 3 분기를 작성합니다. 구슬을 재분배하지 않고 공기 방울을 제거하기 위해 카운터 미니 원심 분리기에 매우 짧게 (1 초)를 스핀. 비드 박동 튜브 로딩의 스틸 이미지도 3B-D를 참조하십시오.
- 오목 메 니스 커스를 형성하기 위해 비드 세포 용액을 첨가 마무리.
- 캡의 외부 입술을 방해하지 않도록주의되고, 비드를 제패 관 뚜껑의 안쪽에 구슬 셀 솔루션의 매우 작은 방울을 추가 할 수 있으며, 그렇지 않을 경우, 비드를 제패 한 관은 안 닫혀 sufficientl y를 입력합니다. 평평한 표면에 모자를 눌러 캡의 바닥에 기포가 없는지 확인합니다.
- 이전 단계의 비드를 제패 한 모자와 구슬 제패 관 모자. 구슬 치는 조수에 손을. 제대로하면, 뚜껑은 단단히 공기 방울이 말아야 밀봉한다볼 수 D, 작은 (있는 경우) 비드 셀 솔루션은 범람한다. 기포가 보이거나 뚜껑이 완전히 닫히지 않는 경우로드 프로세스를 다시 실행.
- 나머지 비드 셀 솔루션 단계 1.24에서 소용돌이 팔콘 튜브 구슬의 고른 분포를 보장합니다. 팔콘 튜브가 빌 때까지 반복 1.31에 1.28 단계를 반복 한 다음 각 추가 팔콘 튜브에 대해 1.31로 1.24 단계를 반복합니다.
- 행동 동시에 1.38에 1.33 단계를 반복합니다. 조수 포획은 구슬 제패 1.31에서 튜브를 얼음에 자리를 채웠다. 두 못 구슬 제패 튜브 수집 된 적어도 1 분 동안 얼음에되고 나면, 구슬 박동을 시작한다.
- 46 rpm에서 30 초 동안 하나의 튜브를 이겼다. 다른 튜브를 치면서 30 초 동안 거꾸로 얼음에 놓습니다.
- 해 각 비드를 제패 한 튜브 1 분 총 이길되었는지 등의 단계를 반복합니다.
- 반복 8 못 비드 박동 튜브 (또는 원심 분리기가 보유 할 수있는 최대 금액) H까지 1.35 1.33 단계처리 번가. 그 후, 15 ML 팔콘 (그림 3E)에서 필터 장치를 구성합니다. 15 ML 팔콘의 바닥에, 새로운 비드를 제패 한 모자, 평면 부분의면이 위로를 추가합니다. 완전히 밀봉 할 때까지 제대로 처리 비드를 제패 한 튜브의 끝에 처리 비드를 제패 한 튜브를 눌러 마이크로 크로마토 그래피 컬럼에서 마개를 제거합니다. 마이크로 크로마토 그래피 컬럼의 용출 끝을 스냅, 마이크로 크로마토 그래피 컬럼을 배치, 용출 빈 구슬 구슬로 장식 관에, 아래로 종료. 15 ML 팔콘에이 단지를 배치합니다. 8 못 비드를 제패 한 관을 반복; 완료되면 얼음 계속.
- 원심 분리기 8 필터 장치, 팔콘 튜브 세척제, 구슬에서 추출물과 펠렛을 분리하는 4 ° C에서 5 분 6,000 g로.
- 확인 각 비드 박동 관은 가능한 추출물을 생산하고있다. 제대로 이길 추출물은 혼탁하지 않을 것이며, 펠릿은 두 가지 층이있을 것이다. 모든 혼탁 튜브를 폐기, 비 혼탁 튜브에서 뜨는을 전송 전가능한 한 작은 펠릿 복용 n을 1.75 ㎖의 개별 마이크로 원심 분리기 튜브. 모든 비드를 제패 한 튜브가 처리 될 때까지 얼음에 보관하십시오. 제대로 대를 잘못 처리 비드 박동 관을 비교 (3f)와 그림을 참조하십시오.
- 4 ℃에서 10 분간 12,000 g로 이전 단계에서 원심 분리기 마이크로 원심 분리기 튜브
- 전송 펠릿없는 새로운 비드를 제패 한 튜브에 500 μl를 통합, 피펫을 사용하여 빈 비드 박동 튜브에 뜨는.
- 220 rpm에서 제거 비드를 제패 한 모자, 80 분 동안 37 ° C에서와 이전 단계를 품어. 이 단계는 구슬 구슬로 장식 과정에서 발표 내생 exonucleases를 사용하여 핵산 나머지 소화하고, 조직 문화 튜브에 비드를 제패 한 튜브를 서서 할 수 있습니다.
- 투석 재료를 준비합니다. 1 M DTT 이전에 준비 S30B 2 L에 2 ㎖를 추가하여 완벽한 S30B 버퍼 준비. 혼합 두 세인트에 각각 900 mL를 넣고1 L의 비커 erile. 각 비커에 멸균 자석 교반기를 추가, 4 ℃에서 보관
- 단계 1.41 후 추출물은 혼탁 보일 것입니다. 1.75 ML 마이크로 원심 분리기 튜브에 1.5 ㎖를 분취으로 추출물을 통합하고, 4 ℃에서 10 분 12000 g로 원심 분리기
- 피펫을 사용하여 얼음에 15 ML 팔콘 튜브에 펠릿 상등액을 통합하고, 튜브와 반전을 상한으로 잘 섞는다. 단계 1.47 얼음에 뜨는의 10 μl를 저장합니다.
- 생산 추출물의 총 금액을 결정하고, 카세트 당 추출물의 2.5 ml의 가정, 2 분 동안 S30B에 담근다에 의해 10K MWCO 투석 카세트 필요한 수의 수화.
- 추출물의 2.5 ml의 카세트를 넣습니다. 각 비커 2 카세트까지 걸릴 수 있습니다 dialyze, 교반, 3 시간 주 4 ° C에서 : 카세트 부분 로딩이 허용됩니다.. 투석은 단백질 생산 수율을 증가시킨다.
- 이전 단계 동안 추출물 단백질을 특성화단계 1.44에 저장 추출물을 사용하여 브래드 포드 분석과 농도,. 자세한 내용은 보충 자료 2를 참조하십시오.
- 투석은 1.75 ML 마이크로 원심 분리기 튜브의 1.5 ML로, 전체 나누어지는 추출물 후. 4 ℃에서 10 분간 12,000 g에서 원심 분리기 펠릿은 관의 하단에 형성 할 것이다.
- 얼음에 15 ML 팔콘 튜브에 피펫으로 이전 단계에서 상등액을 통합 할 수 있습니다. 5-10X를 반전시킴으로써 균질화.
- 단계 1.47 브래드 퍼드에 의해 결정 농도에 따라 각각 1.75 ML 튜브로 나누어지는하기 위해 추출물의 양을 결정합니다. 각 개인 튜브는 총 단백질의 810-900 밀리그램과 볼륨이 있어야합니다. 추출물 27 ㎎ / ㎖보다 큰 총 단백질 농도가 있어야합니다. 예를 들어, 30 ㎕의 28 ㎎ / ㎖에서 나누어지는 추출물, 그리고 나누어지는 추출물 (32)에서, 농도가 높은 경우 나누어지는 30 μL 씩 분주으로 30 ㎎ / ㎖ 이하 추출물 및 규모 :.이 단계는 적당하게 주를 수행하기 위해 도움이 필요합니다28.1 μL로 ㎎ / ㎖.
- 거품을 피하기 위해 돌보는 단계 1.50 다음 나누어지는 추출물,. 액체 질소에 플래시 동결 추출물 참고 :. 거품을 분주하여 4 ℃에서 30 초 동안 10,000 XG에서 원심 분리하여 제거 할 수 있습니다
- 여과기를 사용하여 액체 질소에서 튜브를 제거하고 즉시 -80 ° C. 안전에 저장 : 보호 안경을 착용, 추출 튜브의 캡으로 인해 액체 질소와 실내 온도 사이의 온도 차이에 벗겨지는 경우가 있습니다.
2. 아미노산 솔루션 준비
아미노산 솔루션은 대량으로 준비되어야한다. 다음 조리법은 약 11,000 하나의 반응에 충분히 공급, RTS 아미노산 샘플러 중 하나 가득 차있는 장비를 사용합니다. 축소하는 경우에는 더 적은 절반 이상이 키트를 사용하는 것이 좋습니다. 주식의 각 아미노산은 140 ㎜로 류신을 제외하고, 1.5 ㎖, 168 ㎜로 공급된다. 아미노산 솔루션의 최종 구성은 다음과 같습니다류신, 5 mM의 다른 모든 아미노산, 6 개 mm. 이것은 4X 작업 농도이다.
- -20 ° C에서 20 아미노산을 제거하고 실온에서 해동. 일단 해동, 소용돌이 아미노산, 용해 필요한 경우 37 ° C에서 배양 할 때까지. 아미노산에 용해 된 후, 실온에서 보관에서 Asn, Phe가 한 개의 Cys를 제외한 모든 얼음에 아미노산 등을 넣어. CYS 완전히 용해되지 않을 수 있습니다.
- 얼음에서 멸균 50 ML 팔콘 튜브에 멸균 12 ML을 추가합니다.
- 각 추가 후에 팔콘 튜브 와동하고 얼음에 솔루션을 유지하기 위해주의하면서 1.5 다음과 같은 순서로 각 아미노산의 ML을 추가합니다 : 알라,의 Arg, 아스파라긴, ASP, 올리고 펩타이드, 글루,의 Gly, 자신, 일,리스, 만나, 반페, 프로 빼앗아,의 Thr, 발, Trp의, 티르, 레우, Cys이고. CYS을 첨가 한 후, 소용돌이가 해결 될 때까지 필요한 경우 37 ° C에서 배양, 상대적으로 분명하다. 현탁액으로 추가 할 수 있습니다. CYS 완전히 용해되지 않을 수 있습니다.
- 50 관에서 나누어지는 아미노산 솔루션얼음에 26 ㎕를 각. 얼음에 튜브 당 500 μL에서 나머지 부분을 나누어지는. 500 ㎕의 분취 량은 버퍼의 제조에 사용되는 반면 분취, 와류는 메인 콘텐츠가 자주 현탁액의 불균등 분포를 피하는 동안 26 μl의 분취 량., 추출물을 교정에 사용된다.
- -80 ° C. 안전에서 액체 질소와 저장소에 플래시 동결 분주 : 보호 안경을 착용, 추출 튜브의 캡으로 인해 액체 질소와 실내 온도 사이의 온도 차이에 벗겨지는 경우가 있습니다.
- 선택 사항 : 이전에 만든 아미노산 솔루션에 대한 새로 만든 아미노산 용액의 활동 분석을 실시한다.
3. 에너지 솔루션 준비
에너지 솔루션은 원유 세포 추출물을 교정하기위한 버퍼를 만들기 위해 모두 사용되며, 대량으로 준비를해야합니다. 다음 조리법은 약 10000 하나의 반응에 충분히 공급한다. 다운 스케일링하는 경우이다 추천!덜 여기에 주어진 값의 1 / 24 이상을 사용하지에 nded. 에너지 솔루션은 상당한 금전적 비용이기 때문에, 처음 사용자는 1 / 24 규모로 준비 할 수 있습니다. 에너지 솔루션의 최종 구성은 다음과 같습니다 HEPES pH를 8 700 밀리미터, ATP 21 밀리미터, GTP 21 밀리미터, CTP 12.6 밀리미터, UTP 12.6 밀리미터, tRNA가 2.8 ㎎ / ㎖, CoA를 3.64 밀리미터, NAD 4.62 mm의 캠프 10.5 밀리미터, 엽산 0.95 밀리미터, 스퍼 미딘 14 밀리미터, 3-PGA 420 밀리미터. 이것은 작업 14X 농도이다. 원하는 경우, 표 4의 각 항목은 나중에 사용하기 위해 -80 ° C에 저장할 수 있습니다.
- -80 ° C에서 표 4에있는 모든 화학 물질을 제거, -20에서 30 분 동안 실온 C, 4 ° C °.
- 표 4에 설명 된대로 주식 솔루션을 준비합니다. 조리법에 대한 보충 자료 1을 참조하십시오. 준비 후 얼음에 대한 모든 솔루션을 놓습니다.
- 15 ㎖의 팔콘 튜브에서, 각각의 첨가 후 팔콘 튜브를 와동주의하면서 다음의 순서에 추가하고 O 해법을 유지N 얼음 : 3.6 ml의 2 M HEPES, 144 ㎕의 물, 1.39 ㎖의 염기 혼합, 576 ㎕의 50 ㎎ / ㎖의 tRNA, 576 ㎕의 65 mM의 CoA를, 276 ㎕의 175 mM의 NAD, 170 ㎕의 650 mM의 캠프, 288 ㎕의 33.9 밀리미터 Folinic 산 144 ㎕의 1 M 스퍼 미딘 및 3.09 ml의 1.4 M 3-PGA.
- 얼음에 12 ㎕를 각 50 튜브로 나누어지는 에너지 솔루션. 얼음에 튜브 당 150 μL에서 나머지 부분을 나누어지는. 150 μL 씩 분주 버퍼의 제조에 사용됩니다 동안 7 ㎕의 분취 량 분취, 소용돌이 주요 재고가 종종 있습니다., 추출물을 교정하는 데 사용됩니다.
- -80 ° C. 안전에서 액체 질소와 저장소에 플래시 동결 분주 : 보호 안경을 착용, 추출 튜브의 캡으로 인해 액체 질소와 실내 온도 사이의 온도 차이에 벗겨지는 경우가 있습니다.
- 선택 사항 : 이전에 만든 에너지 솔루션에 대한 새로 만든 에너지 솔루션의 활동 분석을 실시한다.
4. 버퍼 준비
버피FER 준비 준비, 아미노산 용액의 제조 및 에너지 솔루션 준비를 추출 원유 세포의 완성이 필요합니다. 각 버퍼가 원유 세포 추출물의 배치에 고유합니다. MG-글루타민산 염, K-글루타민산 및 DTT는 (순서대로) 표정의 최대 수준의 반응을 생산하는이 섹션에 최적화되어 있습니다. 다음 프로토콜은 미리 준비 원유 세포 추출물을 측정하고 버퍼를 준비하는 미리 작성된 템플릿, TXTL_e (템플릿) _calibration_JoVE.xlsx (보충 자료 3)를 사용합니다. 그러나, 하나는 조 세포 추출물을 교정하고 추출물과 함께, 그것을 전체 반응 부피의 75 %임을 수동의 Mg-글루타메이트, K-글루타메이트, 및 DTT의 최적화와 같은 버퍼를 설정하여 템플릿 않고 버퍼를 준비 할 수있다. 수동 교정하면 최종 반응 조건은 단계 5에서 발견 될 수있다.
- "일반 자료"양식을 작성합니다.
- 얼음 100 밀리미터 밀리그램 - 글루탐산 (4 ℃), 3 M K-글루타민산 (4 ° C)에 해동, 6mM의 아미노산 용액 (26 ㎕를, -80 ° C), 에너지 솔루션 (7 μL, -80 ° C), 100 mM의 DTT (-20 ° C), 양성 대조군의 DNA (-20 ° C), 40 % PEG- . 8000 (4 ° C), 원유 세포 추출물 (-80 ° C), 물 (4 ℃) 참고 : 사용 1 nM의 작업 농도 pBEST-OR2-OR1-PR-UTR1-deGFP-T500 (Addgene 플라스미드 40019) 양성 대조군 (여기 485 nm의 방출 파장 525 nm), 또는 고 신호 강도를 생산하는 다른 참조하십시오. 4
- 개별 마이크로 원심 분리기 튜브 스톡의 Mg-글루타민산의 설정 금액을 분취하여, 4-10 mm 별도의 Mg-글루타민산의 범위를 테스트 일곱 10.5 ㎕의 반응을 준비합니다. 주 : 10.5 μL 반응이 초기에 제조되어 있지만, 최종 반응은 10 μL이다.
- K-글루타민산의 추가 80 mM의 추가 ", 마그네슘 - 글루타민산 보정"의 서식에 표시된 마스터 믹스를 준비합니다. 각 항목의 첨가 한 후 얼음과 소용돌이에 계속 참고 :. 여기 템플릿에 주어진 값은마그네슘 - 글루타메이트, K-글루타메이트, 및 조 세포 추출물을 확인하는 데 사용 S30B 버퍼 DTT 존재 량 이외에.
- 마그네슘 - 글루타민산 염을 포함하는 샘플을 마스터 믹스를 추가하고 반응을 준비합니다. 단계 자세한 설명은 5.13에 5.10를 참조하십시오.
- 인큐베이터 또는 플레이트 리더에 하나, 29 ° C에서 반응을 실행합니다.
- . 최종 발현 및 단백질 발현 (그림 4a)의 최대 속도에 의해 최적의 Mg-글루타민산 농도를 결정 참고 : 런타임은 실험에 있지만, 일반적으로 마지막 8 시간에서 따라 다릅니다.
- 반복 단계 4.7에서 발견에 마그네슘 - 글루타민산 염 수준을 설정하는 "K-글루타민산 교정"에서 K-글루타민산 4.7 4.2 단계를 반복합니다.
- 반복 단계 4.8에서 발견 된 것과 단계 4.7 및 K-글루타민산 염 수준에있는 사람들에게 마그네슘 - 글루타민산 염 수준을 설정 ", DTT 보정"의 DTT 4.7 4.2 단계 참고 :. 우리는 DTT는 크게 말을에 영향을주지 않습니다 추가 한 발견 발현 수준.
- 용도준비하는 버퍼의 구성을 결정하는 "버퍼 구성"에서 교정에있는 값. 생성 된 조 질의 세포 추출물의 양을 기준으로, 마스터 믹스 제조법은 버퍼 량 세트에 대해 생성된다.
- 얼음에 마스터 믹스 레시피에 나와있는 분량 씩 해동. 일단 해동, 각 항목의 첨가 한 후 얼음과 소용돌이로 교반을 유지, 마스터 믹스를 준비합니다.
- 양으로 나누어지는이 아래에 명시된 "버퍼 조성입니다." 플래시 동결 버퍼 액체 질소 튜브. 분취, 소용돌이 주요 재고가 종종 있습니다.
- 여과기를 사용하여 액체 질소에서 튜브를 제거하고 즉시 -80 ° C. 안전에 저장 : 보호 안경을 착용, 추출 튜브의 캡으로 인해 액체 질소와 실내 온도 사이의 온도 차이에 벗겨지는 경우가 있습니다.
5. TX-TL 반응 실험 실행
최종 반응 조건은 다음과 같습니다 : 8.9-9.9 ㎎ / ㎖의 PROTE류신, 1.25 mM의 류신, 50 mM의 HEPES, 1.5 mM의 ATP와 제외 (조 추출물에서)에서, 4.5 mm의 10.5 밀리미터 밀리그램 - 글루타민산, 40-160 밀리미터 K-글루타민산, 0.33-3.33 mM의 DTT, 1.5 mM의 각 아미노산 GTP, 0.9 mM의 CTP 및 UTP, 0.2 ㎎ / ㎖의 tRNA, 0.26 mM의 CoA를, 0.33 mM의 NAD, 0.75 mM의 캠프, 0.068 mM의 엽산, 1 ㎜의 스퍼 미딘, 30 mM의 3-PGA, 2 % PEG-8000. 기본 TX 원유 세포 추출물, 버퍼, 및 DNA :-TL 반응은 3 부분 (튜브)가 있습니다. 비율은 : 75 % 버퍼와 키스, 25 %의 DNA 반응 볼륨에 변화 할 수있다, 우리는 반응 부피를 최소화하고 384 - 웰 플레이트에서 실행 가능하도록 규칙 10 μl를 사용합니다.. 큰 볼륨은 적절한 산소에 대한 교반이 필요합니다. 다음 프로토콜은 10 ㎕의 반응을 수행하기 위해, 미리 작성된 템플릿, TXTL_JoVE.xlsx (보충 자료 4)를 사용합니다. 보라색의 항목은 사용자가 입력 값을 표시하고 파란색의 항목이 반응에 추가하기위한 추가 시약을 나타냅니다. 그러나, 하나는 반응 재치를 수행 할 수호우 트 위에 설명 된 반응 조건을 수행하여 템플릿.
- "일반 자료"양식을 작성합니다.
- 에서 "마스터 믹스 준비,"보라색 상자로 단계 4.1에서 추출 비율 값을 삽입합니다.
- "마스터 믹스 준비"(행 10-17) 및 "DNA 준비"(행 19-50) 섹션을 사용하여 실리의 실험을 디자인합니다. 변수는 "DNA 준비 사항"란에 투입 할 수 있지만 일반적으로 상수는, "마스터 믹스 준비 사항"란에 투입 할 수 있습니다. 샘플 증발 실험 시작 시간 바이어스를 피하기 위해 실험 당 샘플을 최소화합니다. 샘플 설정을위한 그림 6을 참조하십시오.
- 에서 "마스터 믹스 준비,"일정한 농도로 모든 샘플에 갈 것 같은 유도 물질 또는 단백질과 같은 시약을 추가합니다. 행 (14)을 시작으로, 각 행에 하나의 시약을 유지, 파란색 음영 지역을 입력하세요. 단위는 상대적인 비율이다.
- 에서 "DNA 준비,"샘플 specif로 될 것입니다 DNA를 추가IC. 샘플 긍정적이고 부정적인 컨트롤에 ID를 # 1과 # 2에 대응, 각각. 샘플 ID는 위의 # 3는 사용자가 수정할 DNA를 들어, NG / μL 재고 농도, 염기쌍 길이, nm의에서 원하는 최종 농도, 및 (10 μL 반응의) 반복합니다. 원하는 최종 농도에 도달하는 콘텐츠의 DNA의 양을 자동으로 계산된다. . n은 반복 수이다 10.5 × N에 로우 합 걸쳐 전체 주 : 최종 반응 부피가 10 μL이지만 계산이 반응 당 10.5 μL의 총 부피를 가정 피펫 중에 손실 체적을 고려하여.
- 에서 "DNA 준비,"시약 또는 파란색 열에 샘플을 특정 할 수있는 추가 DNA를 추가합니다. 샘플 특정 시약 10.5 * n의 총 반응 부피에 따라 수동 계산을 필요로하는 동안 nM의 스톡 DNA 농도는 "DNA 준비"에서 계산 될 수있다. 입력 볼륨은 같은 행의 수분 볼륨의 감산됩니다.
- 필요한 번호 18를 제거-20 ° C 또는 -80 ° C에서 버퍼, 원유 세포 추출물과에서 양성 대조군의 관 "해동 관"의 R과 얼음에 해동.
- DNA 샘플을 준비합니다. 각각의 샘플 ID, 나누어지는 밖으로 들어 지정된 DNA, 물, 실온에서 마이크로 원심 분리기 튜브에 "DNA 준비 사항"당 사용자가 제공 한 참고 :. 샘플의 손실을 방지하기 위해, 최근에 피펫 낮은 스틱을 교정 피펫 팁과 마이크로 원심 분리기 튜브를 권장합니다.
- 단계 5.7에서 튜브를 해동하는 경우, 각 항목의 첨가 한 후 얼음과 소용돌이로 교반에 유지, 버퍼, 추출 및 오렌지 회색 상자에 기반한 글로벌 사용자가 제공 한 항목으로 구성된 마스터 믹스를 준비합니다 :. 추출은 매우입니다 점성. 거품 분취 량은 4 ℃에서 30 초 동안 10,000 XG에서 원심 분리하여 제거 할 수 있습니다
- 각 DNA 샘플에 "DNA 준비"(열 O)에서 오렌지 세포에 표시된 마스터 믹스의 양을 추가하고, 실내 온도에서 보관진짜야. 반응 시작 시간으로이 작업을 처리합니다.
- 소용돌이 각각의 샘플을, 그리고 남아있는 샘플을 가지고 거품을 줄이기 위해 실온에서 30 초 동안 10,000 XG에 원심 분리기.
- 마이크로 원심 분리기 튜브의 반응을 수행하는 경우, 29 ° C에서 직접 배양 . 그렇지 않으면, 384 - 웰 플레이트에 피펫 샘플 10 ㎕를 참고 : 10 μL보다 큰 볼륨의 반응은 산소에 대한 동요가 필요할 수 있습니다.
- 남아있는 샘플을 가지고 거품을 줄이기 위해 실온에서 30 초 동안 4,000 XG에 원심 분리기 판. 증발을 방지하기 위해, 그 후 플레이트를 밀봉.
- 29 ° C. 주에서 실행 반응 : 런타임이 실험에 따라서는 있지만, 일반적으로 8 시간에서 마지막으로 다릅니다.
결과
우리는 TX-TL 무 세포 발현 시스템을 기반으로 내인성 대장균의 제조 오일 프로토콜을 제시 하였다. 조 질의 세포 추출물 및 버퍼 - - 시약을 생성하기위한 샘플 타임 라인은도 1에서 찾을 수있다. 일단 생성되면, 이들은 1 년까지 -80 ° C에 저장할 수 있습니다. 시약을 만든 후, 실험 설정 및 실행은보다 8 시간에 수행 할 수 있습니다.
또, TX-TL의 무 세포 발현 시스템의 발현 조건을 최적화. 이러한 버퍼 또는 DNA 솔루션과 같은 다른 사용자가 제공 한 추가는, 미리 독성 교정해야한다. 예를 들어, 처리 플라스미드의 다른 방법으로 인해 염 함량에 다른 표정을 초래할. 우리는 또한 반응 효율에 트리스로-C1 용출 버퍼의 효과 (그림 5)를 테스트했다.
4.9 단계 4.1 참조 원유 세포 추출물 교정의 예는, 표시됩니다그림 4a에서. 일반적으로, 우리의 실험은 원유 세포 추출물이 K-글루타민산 수준 다음의 Mg-글루타민산 염 수준에 가장 민감하다는 것을 보여줍니다. 무 세포 발현 시스템을 설명하기 위해, 우리는 TET의 억압에 따라 음의 피드백 루프. 26 (그림 6)를 건설하고 시험했다. 무 세포 발현 시스템에서,과 및 ATC없이 동일한 회로 실행 표현 8 시간 후 deGFP 기자의 7 배 엔드 포인트의 표정 변화를 보여줍니다. 그들은 "마스터 믹스 준비."에 추가 할 수 있습니다 필요한 경우이 실험은, 세계 유도 또는 억제 자이 필요하지 않지만
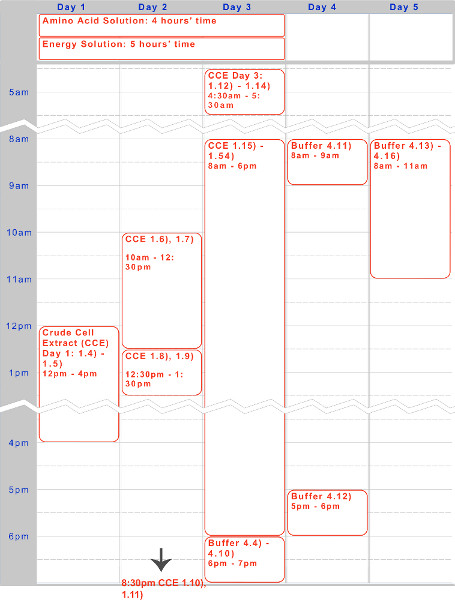
그림 1. 조 질의 세포 추출물, 아미노산 용액, 에너지 용액 제조를위한 타임 라인. 5 일간 timelin 프로토콜의 일반적인 실행을위한 전자 밤새 배양 및 주간 작업 단계에 최적화 된, 위 주어진다.
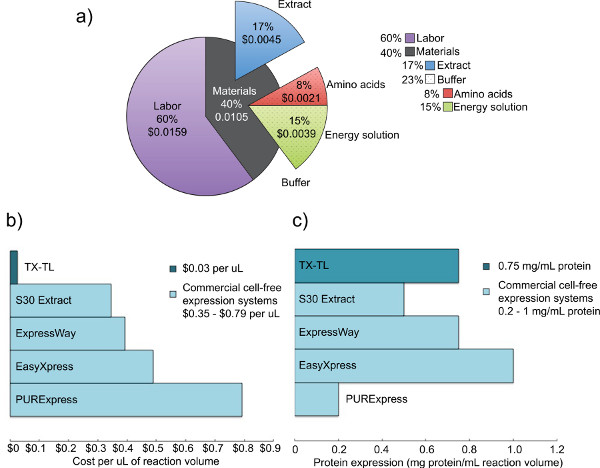
그림 2. 비용 및 원유 세포 추출물을 경쟁의 발현 분석. ) TX-TL의 무 세포 발현 시스템의 노동과 재료 비용의 고장. 2012년 12월의 같은 시약의 비용, 시간 당 $ 14 노동 비용을 기준으로합니다. 나) 기타 상용 시스템 대 TX-TL 세포 표현의 자유의 시스템 비용의 비교. 반응 볼륨이 키트 당. C 다른 상용 시스템 대 TX-TL의 무 세포 발현 시스템 수율) 비교 될 수 있지만 비용은 μL 당 분류됩니다. 단백질 발현 수율은 제조사 기준에 의해 결정./ 50762fig2large.jpg "대상 ="_blank "> 큰 그림을 보려면 여기를 클릭하십시오.

그림 3. 비드 박동 튜브의 로딩 및 처리. ) 셀 비드 솔루션의 정확한 점도의 데모. 휴대 구슬 솔루션은 얼음에 소요되는 추가 S30A 버퍼의 양, 추가 구슬의 양, 시간 등의 여러 요인에 따라 점도있을 것입니다. B) 비드를 제패 한 튜브의 로딩 빠른 탁상 원심 분리 전에. 원심 분리로드하는 동안 축적 된 거품을 제거합니다. C) 탁상 원심 분리 후 부상 거품. 거품의 크기는 다를 것이다. 그들은 피펫 팁 D를 사용하여 팝 또는 제거 할 수 있습니다) 완전히 채워 비드를 제패 한 관을 씌우는 전에. 메 니스 커스가 비드 박동 t 형성된다우베 및 모자). 전자를 너무 많이 넣다 올바르게로드 필터 장치를 적은 양을 커버 일으킬 정도로 있습니다. 이 올바르게 대를 잘못 처리 비드를 제패 한 튜브. F) 비교를 재사용 할 수 있습니다. 왼쪽의 관은 잘 비트 튜브 - 그것은 작고 잘 묘사 꼭대기 층, 매우 명확 상층 액을 갖추고 있습니다. 좌측 관은 클수록 불투명 층과 제 흐릿한 상등액을 기반으로, 차선이다. 차선 있습니다 튜브는 계속 처리 할 수 없습니다.
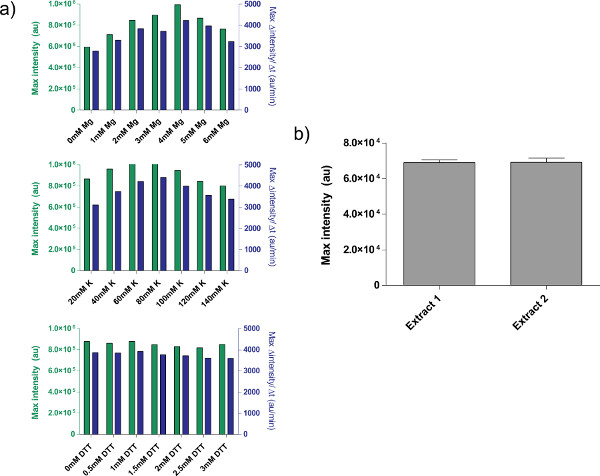
그림 4. 조 추출물 제제의 속성. ) 원유 세포 추출물에 대한 일반적인 교정 플롯. 조 추출물은이 순서대로, 추가의 Mg-글루타메이트, K-글루타메이트, 및 DTT 농도에 대해 교정된다. 엔드 포인트 fluorescenc은 표시E 8 시간뿐만 아니라, 12 분 이동 평균에 기초하여 단백질 생산의 최대 비율 후. 이러한 플롯에 기초하여, 추가의 Mg-글루타메이트의 허용 범위는 K-글루타메이트가 60-80 ㎜ 인, 4 mm로하고, DTT는 0-3 ㎜이다. 모든 조 추출물이 세 변수에 독립적으로 보정해야합니다. B) 추출물 제제의 변화. 다른 날짜에 준비 두 원유 추출물의 엔드 포인트 형광 표시되고, 오차 막대는 서로 다른 일에 세 개의 독립적 인 실행에서 1 표준 편차이다. 큰 그림을 보려면 여기를 클릭하십시오 .
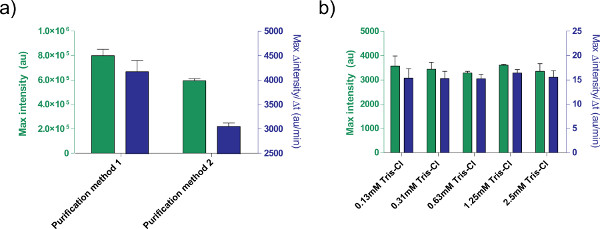
그림 5. 발현 효율에 DNA 용액의 효과. 두 개의 서로 다른 정화의) 비교플라스미드를 처리하기위한 방법. pBEST-OR2-OR1-PR-UTR1-deGFP-T500의 1 nM의는 QiaPrep 스핀 미니 프렙 키트 (정화 방법 1) 또는 제품, QIAquick PCR 정제 키트와 후 처리하여 제조한다 (정화 방법 2). 8 시간뿐만 아니라, 12 분의 이동 평균에 기초하여 단백질 생산의 최대 속도 후의 끝점 형광 도시된다. 오차 막대는 서로 다른 일에 4 개의 독립적 인 실행에서 1 표준 편차이다. 용출 버퍼의 B) 효과 (트리스로-C1). 트리스로-C1의 다른 농도 pBEST-OR2-OR1-PR-UTR1-deGFP-T500의 1 ㎚의 식을 기반으로 세포 표현의 자유 반응에 비교된다. 주어진 농도는 반응 트리스로-C1의 최종 농도이며 사용 용출 완충액은 10 mM 트리스-Cl 인. 오차 막대는 서로 다른 일에 세 개의 독립적 인 실행에서 1 표준 편차이다. 큰 그림을 보려면 여기를 클릭하십시오 .
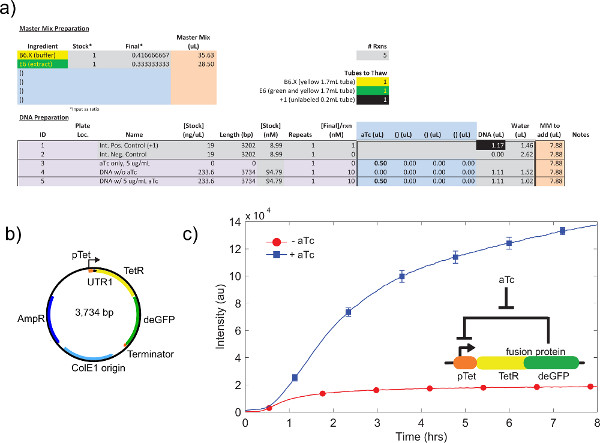
그림 6. 음의 피드백 루프의 샘플 TX-TL 실행. a) 샘플 무 세포 실행 반응 셋업. 대 음의 피드백 루프의 "오프"상태, 양성 및 음성 컨트롤. b)는 음의 피드백 루프의 플라스미드지도. C) 대표 결과 "에"테스트합니다. 데이터에서 실험을 반영)와 b), 음성 대조군과 신호에서 제외. 유전자 회로는 삽입에 표시됩니다. 오차 막대는 서로 다른 일에 세 개의 독립적 인 실행에서 1 표준 편차이다. 큰 그림을 보려면 여기를 클릭하십시오 .
| 이름 | 집중 | 양 | 살균 | 주의 사항 |
| 클로람페니콜 (CM) | 에탄올에 34 ㎎ / ㎖ | 1 ㎖ | 소독 필터 (0.22 μM) | 나중에 사용하기 위해 -20 ° C에 저장 더 큰 볼륨을 만들 수 있습니다. |
| 2xYT + P + 센티미터 한천 플레이트 | 31g / L 2xYT, 40 mM의 인산 칼륨 이염, 22 mM의 인산 칼륨 일 염기성, 34 ㎍ / ㎖의 클로람페니콜 | 1 판 | 압력솥 | |
| 2xYT + P 미디어 | 31g / L 2xYT, 40 mM의 인산 칼륨 이염, 22 mM의 인산 칼륨 일 염기성 | 4 L | 압력솥 |
표 1. 원유 세포 추출 프로토콜의 1 일 용 시약.
| 이름 | 집중 | 양 | 살균 | 주의 사항 |
| 트리스베이스 | 2 M | 250 ㎖의 | 소독 필터 (0.22 μM) 또는 오토 클레이브 | 상온에서 저장할 수 있습니다. |
| DTT | 1 M | 6 ML | 소독 필터 (0.22 μM) | 큰 볼륨을 만들어 나중에 사용하기 위해 -20 ° C에 저장할 수 있습니다. |
| S30A 버퍼 | 14 밀리미터 밀리그램 - 글루타민산, 60 mM의 K-글루타민산, 50 MM 트리스, 산도 7.7 | 2 L | 압력솥 | pH가 7.7에 도달하기 위해, 아세트산으로 적정한다. 사용 직전에 2 mM의 최종 농도 DTT를 추가합니다. 4 ℃에서 보관 |
| S30B 버퍼 | 14 밀리미터 밀리그램 - 글루타민산, 60 mM의 K-글루타민산 ~ 5 MM 트리스, 산도 8.2 | 2 L | 압력솥 | pH가 8.2에 도달하기 위해, 2M으로 적정트리스. 사용 직전에 1 mM의 최종 농도 DTT를 추가합니다. 4 ℃에서 보관 |
표 2. 원유 세포 추출 프로토콜의 하루 2 용 시약.
| 매 | ||||
| 1 | 2 | 3 | 4 | |
| 빈 50 ML 팔콘 (G) | ||||
| 펠렛 50 ML 팔콘 (G) | ||||
| 펠렛 대용량 (50 ㎖ 펠릿와 팔콘 - 빈 50 ML 팔콘) (G) | ||||
| 추가 S30A 버퍼 볼륨 (펠렛 질량 * 0.9) (ML) | ||||
| 추가 할 수있는 구슬의 총 질량 (펠렛 질량 * 5.0) (G) | ||||
표 3. 원유 세포 추출 프로토콜의 일 3 S30A 버퍼와 구슬의 질량 계산기.
| 이름 | 집중 | 양 | 살균 | 주의 사항 |
| HEPES | 2 M, pH가 8 | 4 ML | 없음 | pH가 8에 도달하기 위해, KOH로 적정한다. |
| 염기 혼합 | 156 mM의 ATP와 GTP, 94 mM의 CTP 및 UTP, pH를 7.5 | 1.5 ML | 없음 | pH가 7.5에 도달하기 위해, KOH로 적정한다. |
| tRNA의 | 50 ㎎ / ㎖ | 600 μL | 없음 | |
| CoA를 | 65 mM의 | 600 μL | 없음 | |
| NAD | 175 밀리미터, pH가 7.5 ~ | 300 μL | 없음 | pH가 7.5에 도달하려면 2 M.에서 트리스으로 적정 |
| 캠프 | 650 밀리미터, pH가 8 | 200 μL | 없음 | pH가 8에 도달하려면 2 M.에서 트리스으로 적정 |
| 엽산 | 33.9 밀리미터 | 300 μL | 없음 | 만 300 μL이 필요하지만, 보충의 조리법은 1.15 ㎖를위한 것입니다. |
| 스퍼 미딘 | 1 M | 150 μL | 없음 | 4 ° C에서 보관은 열 37 ° C에서 녹는. |
| 3-PGA | 1.4 M, pH를 7.5 | 3.2 ML | 없음 | pH가 7.5에 도달하려면 2 M.에서 트리스으로 적정 |
표 4. 에너지 솔루션 프로토콜을 준비하는 시약.
보충 자료 1. 항목의 조리법.
클로람페니콜, 34 ㎎ / ㎖ : 0.51 g의 클로람페니콜을 준비하고 15 ㎖의 에탄올을 추가합니다. 소독 필터 (0.22 μM), 1 ㎖ 튜브, 나중에 사용하기 위해 -20 ° C에서 저장소로 나누어지는.
2xYT + P + 센티미터 한천 플레이트 : 1.24 g 2xYT, 1 M @ 1.6 ml의 인산 칼륨 용액 40 ㎖에 1 M @ 0.88 ㎖의 칼륨 인산 용액, 0.6 g 한천, 물을 준비합니다. 오토 클레이브. 50 ° C로 냉각시켜 40 μL 센티미터를 추가합니다. 나누어지는 25 100 × 15mm 페트리 접시에 ML, 1 시간 동안 식힌다.
2xYT + P 미디어 : 124g 2xYT, 1 M @ 160 ㎖의 인산 칼륨 용액, 4 L. Aliqu 1 M, 물 @ 88 ㎖를 1 인산 칼륨 용액을 준비2 × 1.88 L 0.24 L. 오토 클레이브 속으로 해주 마.
트리스베이스, 2 개의 M이 : 250 ml로 60.57 g 트리스베이스와 물을 준비합니다. 나중에 사용하기 위해 실온에서 저장을 소독.
DTT, 1 M : 15 ml로 2.31 g의 DTT와 물을 준비합니다. 소독 필터 (0.22 μM), 1 ㎖ 튜브, 나중에 사용하기 위해 -20 ° C에서 저장소로 나누어지는.
S30A 버퍼 : 10.88 g의 Mg-글루타민산과 24.39 g의 K-글루타민산, 2M, (산도 7.7), 아세트산 50 ㎖의 트리스를 준비, 물 2 L. 오토 클레이브에, 4 ° C에서 저장, 4 ML 1 M DTT를 추가 사용하기 전에.
S30B 버퍼 : 10.88 g의 Mg-글루타민산과 24.39 g의 K-글루타민산, 2 M의 트리스 (산도 8.2)를 준비하고, 물 2 L. 오토 클레이브에, 4 ° C에서 보관, 사용하기 전에 2 ㎖ 1 M DTT를 추가합니다.
HEPES : 1.91 g HEPES (MW 238.21), KOH (산도 8)를 준비하고, 물 4 ㎖를합니다.
tRNA의 600 μL에 30의 tRNA의 MG와 물을 준비합니다.
CoA를 600 ㎕의 30 CoA를 (MW 767.53)의 MG와 물을 준비합니다.
NAD : 300 μL에 (산도 7.5에) NAD의 34.83 밀리그램 (MW 663.43), 2 M에서 트리스를 추가, 물. (산도 7.5에 대한 해결책을 가지고 2 M에서 트리스의 27 μl를 추가합니다).
캠프 : 200 μL에 42.80 캠프의 MG (MW 329.22), 2 M (산도 8)에서 트리스, 물을 추가합니다. (산도 8에 대한 해결책을 가지고 2 M에서 트리스의 73 μl를 추가합니다).
엽산 (33.9 mM)을 : 고체 엽산 칼슘 염 (MW 511.5)의 20 밀리그램, 1.15 ㎖의 물을 추가합니다.
스퍼 미딘 : 150 μL에 23.55 스퍼 미딘 ㎕의 (MW 145.25)과 물을 준비합니다. 37 ° C에서 간단히 녹여 상온에서 준비
3-PGA : 3.2 ml로 1.03 3-PGA (MW 230.02)의 G, (산도 7.5) 2 M에서 트리스, 물을 추가합니다. (산도 7.5에 대한 해결책을 가지고 2 M에서 트리스의 1.73 ML을 추가합니다).
NucleotIDE 믹스 : ATP 칼륨 염 수화물의 145 밀리그램 (MW 619.4), GTP의 나트륨 염 133 MG (MW 567.14), CTP 나트륨 염 수화물의 79.4 MG (MW 563.16), UTP의 삼 나트륨 염 수화물의 82.6 MG (MW 586.12)을 추가 1.5 ㎖의 15 % 희석 (산도 7.5), 물에 KOH. (산도 7.5에 대한 해결책을 가지고 15 %의 희석에 KOH의 353 μl를 추가합니다).
보충 자료 2. 브래드 분석.
- 4 ° C에서 브래드 에이전트를 제거하고 실온에서 설정합니다.
- 1 ㎎ / ㎖에서 0.1 ㎎ / ㎖에서 50 ㎕의 BSA 표준을 준비합니다.
- 단계 1.47에서 추출의 40 μl를 20 배 희석을 준비합니다.
- 7 큐벳에 800 ㎕의 물을 추가합니다.
- 0 ㎎ / ㎖, 1 ㎎ / ㎖ (10 ㎕를 0.1 ㎎ / ㎖ BSA), 2 ㎎ / ㎖ (20 ㎕를 0.1 ㎎ / ㎖ BSA), 4 ㎎ / ㎖ (4 ㎕를 1 ㎎ / ㎖ BSA)에 대한 표준 큐벳 준비 6 ㎎ / ㎖ (10 ㎕를 1 ㎎ / ㎖ BSA).
- 샘플 2 μL 샘플의 4 μL를위한 실험 큐벳을 준비합니다.
- 각 베트 브래드 포드 제 200 μl를 추가하고 B를 잘 섞는다Y 피펫. 적어도 10 분 동안 실온에서 배양한다.
- 단계 6.5에서 큐벳을 사용하여 OD 595 nm에서 표준 곡선을 생성합니다. 표준 곡선을 거절하는 경우에 R 2 <0.95.
- 단계 6.6에서 큐벳을 사용하여 OD 595 nm에서 추출물의 농도를 결정합니다.
보충 자료 3. 교정 스프레드 시트를 버퍼.
TXTL_e (템플릿) _calibration_JoVE.xlsx를 참조하십시오 .
보충 자료 4. 세포 표현의 자유는 스프레드 시트를 실행합니다.
토론
여기에 설명 된 내생 대장균 기반 TX-TL 무 세포 발현 시스템은 데이터 수집에 설정에서 여덟 개 미만의 시간이 걸릴 수 있습니다 쉬운 실행 세 튜브 반응이다. 모든 시약을 만드는 과정은 오일의 시간 합계 (하루 만에 상당한 노동 요구 사항)를 필요로하지만, 3000 반응에 조 추출물을 생산하고 버퍼 만들기 만 반응 시약 (그림 1). 또한, 조 추출물 및 버퍼 결정 시약 한 준비의 여러 사용을 허용, -80 ° C에서 1 년 이상 안정적이다. 4를 10 ㎕의 반응 당 $ 0.11 (노동을 포함하여 $ 0.26)에서, 비용은 비교 98 % 감소 상용 시스템 (그림 2).
몇 가지 해결되지 않은 제한 사항이 시스템에, 그러나,이 있습니다. 각 조 세포 추출물 제제의 단부 효율, 사용자 능력에, 환경 조건에 따라 달라질 수 있지만 typical 수율의 변화는 5 ~ 10 % (그림 4B) 사이에있다. 결과적으로, 두 종점 발현 및 발현 역학 뱃치 간 변이가 예상하여야한다. 추출물의 생성이 완전 자동화 될 때까지 추출이 완전히 특징이나 될 때까지 이러한 변화는 가능성이 남아 있습니다. 무 세포 발현 시스템은 민감한 정량 실험을 수행하는 데 사용되는 경우, 조 세포 추출물의 동일한 배치로 모든 실험을 실행하는 것이 바람직하다. 하나의 원유 세포 추출물 배치, 약 3000 반응의 수율은 일반적인 실험 과정에 대한 충분합니다. 우리는 편차가 스케일링 및 절차를 자동화함으로써 제거 될 수있다 의심하지만, 이러한 시도들은 상당한 자원 투자를 수반한다.
종점 발현 수준을 결정하게 합리적 쉽지만 또한, 많은 작업이 무 세포계 본질적인 이해 역학에서 수행 될 필요가있다. 그것은 알려져 그 자원 competitio 모두n 및 자원 제한은 표현의 역학 관계에 영향을 미칠 수 있습니다. 예를 들어, 제한된 내인성 시그마 70. 9,27하지만, 역학 시스템을 충분히 활용하는 것으로 이해되지 않아도 증가 DNA 템플릿은 뉴클레오티드 또는 아미노산 고갈 된 것과 유사한 발현 양상을 생산하는 포화 정권 초래할 수있다. 수율의 순수한 증가를 위해, 최적화 기계 학습 방법에 의해 수행 할 수 있습니다. 자원 경쟁과 제한의 28 문제는 실험 데이터를 사용하여 확인 수학적 모델에 의해 해결 될 수있다.
여기에 제시된 프로토콜은 BL21-Rosetta2 변형에 최적화 된, 그러나 다른 E.에 일반화입니다 대장균의 변종. 이러한 유전자 부호화 LON 프로테아제 희귀 된 tRNA를 코딩하는 유전자의 첨가의 제거와 같은 BL21-Rosetta2의 변형은, 최대한의 단백질 생산을 허용한다. 우리는 다른 두 개의 추출 균주 프로토콜을 시도했다 - 만 BL21과 BL21 trxA의 녹아웃을D는 50 % 미만의 단백질 수율을 발견했다. 우리는 다른 균주를 사용하는 경우 수익률이 유사하게 감소한다는 가설을 세웠다. 이러한 LB 및 기타 풍부한 국물에 2xYT 성장 매체를 전환과 같은 매개 변수, 다른 변화는 감소 단백질 수율에 성공.
내인성 및 외인성 전사 - 번역 기계 및 규제 메커니즘을 모두 활용 한 무 세포 발현 시스템은 단백질과 대사 산물의 표현 모두에서 합성 생물학의 다양한 응용 프로그램이 있습니다. 대신 T7 조절 회로에 한정되는 것이, 하나는 복잡한 생체 분자를 생산하는 구상 할 수 3,29 E. 고유의 혼합을 사용하여 사용자 환경에서 제어 가능한 대장균의 발기인 및 외생 적 공급 전사 및 규제 메커니즘. 세포 분열과 신진 대사의 제한없이, 이러한 repressilator 또는 그 생산 아르테 미시 닌으로 대사 공학 경로에서 같은 합성 회로의 변동성이 감소하거나 더 잘 이해 될 수있다. (30, 31) 우리는 근래전자는 유전 적 스위치를 구현하기 위해,뿐만 아니라 시그마 인자 격리을 이해하는 이러한 장점을 이용 9,32 이러한 기술은 또한 "최소한의"또는 "인공"세포의 골격 형성 할 수있다 -. 작은, 잘 특성화와의 자급 자족 내재 단위 추출물. 33, 34
궁극적으로, 우리는 합성 생물학의 프로토 타입 환경 등이 내인성 무 세포 발현 시스템의 즉각적인 사용을 기대하고 있습니다. 기본 플라스미드, 선형, 또는 화학적으로 synthetized DNA에 대한 검사의주기, 다음 - 별명 "TX-TL 생명 브레드,"무 세포 발현 시스템은 프로토 타입의 라운드를받을 수 합성 회로가 궁극적으로 생체 내 발현을 대상으로 제어 환경을 제공합니다 분석과 신속한 수정에 의해. 프로토 타이핑 라운드 현재 개발되고 예측 수학적 모델에 의해 도움을받을 수 있습니다. 복제 비 최종 회로에 대한 생체 조작에서 제거함으로써, 우리는 공학부 예상니어링 사이클 시간 대신 현재 주 '기준 1-3 일로 단축된다.
공개
저자는 더 경쟁 재정적 이익이 없다는 것을 선언합니다.
감사의 말
우리는 프로젝트의 초기 단계에서 지원을 Jongmin 김, 댄 Siegal-Gaskins, 아누 Thubagere 및 프로토콜을 간소화 도움 에녹 영, 클레어 첸과 바클레이 리 감사합니다. 이 물질은 생활 파운드리 프로그램, 계약 번호 HR0011-12-C-0065 (DARPA / CMO.ZZS 또한 UCLA / Caltech의 의료 과학자 지원하는 방위 고등 연구 계획국 (DARPA / MTO)에 의해 부분적으로 지원 작업을 기반으로합니다 교육 프로그램의 교제에 의해 국방부, 과학 연구, 국방 과학 및 공학 대학원 (NDSEG) 원정대, 32 CFR의 168A의 공군 사무실은.이 문서에 포함 된 전망과 결론은 저자의 사람입니다과은 대표로 해석 할 수 없습니다 공식적으로 정책을 명시 적 또는 묵시적, 방위 고등 연구 프로젝트 기관 또는 미국 정부의.
자료
| Name | Company | Catalog Number | Comments |
| 2xYT | MP biomedicals | 3012-032 | |
| 3-PGA | Sigma-Aldrich | P8877 | |
| ATP | Sigma-Aldrich | A8937 | |
| Bacto-agar | BD Diagnostics | 214010 | |
| Bead-beating tubes (polypropylene microvials) | BioSpec | 522S | |
| Beads, 0.1mm dia. | BioSpec | 11079101 | |
| BL21 Rosetta 2 E. coli strain | Novagen | 71402 | |
| Bradford BSA Protein Assay Kit | Bio-rad | 500-0201 | |
| cAMP | Sigma-Aldrich | A9501 | |
| Chloramphenicol | Sigma-Aldrich | C1919 | |
| CoA | Sigma-Aldrich | C4282 | |
| CTP | USB | 14121 | |
| Cuvettes, 1.5ml | Fisher | 14-955-127 | |
| DTT | Sigma-Aldrich | D0632 | |
| Folinic acid | Sigma-Aldrich | F7878 | |
| GTP | USB | 16800 | |
| HEPES | Sigma-Aldrich | H6147 | |
| K-glutamate | Sigma-Aldrich | G1149 | |
| Mg-glutamate | Sigma-Aldrich | 49605 | |
| Micro Bio-Spin Chromatography Columns | Bio-Rad | 732-6204 | |
| NAD | Sigma-Aldrich | N6522 | |
| Nunc 384-well optical bottom plates | Thermo-Scientific | 142761 | |
| Nunc sealing tape | Thermo-Scientific | 232701 | |
| PEG-8000 | Promega | V3011 | |
| Potassium phosphate dibasic solution | Sigma-Aldrich | P8584 | |
| Potassium phosphate monobasic solution | Sigma-Aldrich | P8709 | |
| RTS Amino Acid Sampler | 5 Prime | 2401530 | |
| Slide-A-Lyzer Dialysis Cassettes, 10k MWCO (Kit) | Thermo-Scientific | 66382 | |
| Spermidine | Sigma-Aldrich | 85558 | |
| Tris base | Fischer | BP1521 | |
| tRNA (from E. coli) | Roche Applied Science | MRE600 | |
| UTP | USB | 23160 | |
| 1L Centrifuge Bottle | Beckman-Coulter | A98813 | This is specific for Avanti J-series; obtain equivalent size for centrifuge in use. |
| 4L Erlenmeyer Flask | Kimble Chase | 26500-4000 | |
| Avanti J-26XP Centrifuge | Beckman-Coulter | 393127 | Or 1L-capable centrifuge equivalent. |
| Forma 480 Orbital Shaker | Thermo Scientific | 480 | Or chest-size 6x4L shaker equivalent. |
| JLA-8.1000 Rotor | Beckman-Coulter | 363688 | Or 1L-capable, 5000 x g rotor equivalent for centrifuge. |
| Mini-Beadbeater-1 | BioSpec | 3110BX | |
| Supplemental Material 1. Recipes for Items. Chloramphenicol, 34 mg/ml: Prepare 0.51 g chloramphenicol and add ethanol to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. 2xYT+P+Cm agar plate: Prepare 1.24 g 2xYT, 1.6 ml potassium phosphate dibasic solution @ 1 M, 0.88 ml potassium phosphate monobasic solution @ 1 M, 0.6 g agar, and water to 40 ml. Autoclave. Let cool to 50 °C and add 40 μl Cm. Aliquot 25 ml into a 100x15 mm petri dish, and let cool for an hour. 2xYT+P media: Prepare 124 g 2xYT, 160 ml potassium phosphate dibasic solution @1 M, 88 ml potassium phosphate monobasic solution @ 1 M, and water to 4 L. Aliquot out into 2x1.88 L and 0.24 L. Autoclave. Tris base, 2 M: Prepare 60.57 g Tris base and water to 250 ml. Sterilize, store at RT for later use. DTT, 1 M: Prepare 2.31 g DTT and water to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. S30A buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, 50 ml Tris at 2M, acetic acid (to pH 7.7), and water to 2 L. Autoclave, store at 4 °C, add 4 ml 1 M DTT before use. S30B buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, Tris at 2 M (to pH 8.2), and water to 2 L. Autoclave, store at 4 °C, add 2 ml 1 M DTT before use. HEPES: Prepare 1.91 g HEPES (MW 238.21), KOH (to pH 8), and water to 4 ml. tRNA: Prepare 30 mg of tRNA and water to 600 μl. CoA: Prepare 30 mg of CoA (MW 767.53) and water to 600 μl. NAD: Add 34.83 mg of NAD (MW 663.43), Tris at 2 M (to pH 7.5-8), and water to 300 μl. (Add 27 μl of Tris at 2 M to bring the solution to pH 7.5-8). cAMP: Add 42.80 mg of cAMP (MW 329.22), Tris at 2 M (to pH 8), and water to 200 μl. (Add 73 μl of Tris at 2 M to bring the solution to pH 8). Folinic Acid (33.9 mM): To 20 mg of solid folinic acid calcium salt (MW 511.5), add 1.15 ml water. Spermidine: Prepare 23.55 μl of spermidine (MW 145.25) and water to 150 μl. Prepare at room temperature after melting briefly at 37 °C. 3-PGA: Add 1.03 g of 3-PGA (MW 230.02), Tris at 2 M (to pH 7.5), and water to 3.2 ml. (Add 1.73 ml of Tris at 2 M to bring the solution to pH 7.5). Nucleotide Mix: Add 145 mg of ATP dipotassium salt dihydrate (MW 619.4), 133 mg of GTP disodium salt (MW 567.14), 79.4 mg of CTP disodium salt dihydrate (MW 563.16), 82.6 mg of UTP trisodium salt dihydrate (MW 586.12), KOH at 15% dilution (to pH 7.5), and water to 1.5 ml. (Add 353 μl of KOH at 15% dilution to bring the solution to pH 7.5). Supplemental Material 2. Bradford Assay.
See TXTL_e(template)_calibration_JoVE.xlsx. Supplemental Material 4. Cell-free expression run spreadsheet. See TXTL _JoVE.xlsx. | |||
참고문헌
- Noireaux, V., Bar-Ziv, R., Libchaber, A. Principles of cell-free genetic circuit assembly. Proceedings of the National Academy of Sciences of the United States of America. 100, 12672-12677 (2003).
- He, M. Y., He, Y. Z., Luo, Q., Wang, M. R. From DNA to protein: No living cells required. Process Biochem. 46, 615-620 (2011).
- Forster, A. C., Church, G. M. Synthetic biology projects in vitro. Genome Res. 17, 1-6 (1101).
- Shin, J., Noireaux, V. Efficient cell-free expression with the endogenous E. Coli RNA polymerase and sigma factor 70. Journal of biological engineering. 4, 8 (2010).
- Shimizu, Y., et al. Cell-free translation reconstituted with purified components. Nat Biotechnol. 19, 751-755 (2001).
- Shin, J., Noireaux, V. An E. coli Cell-Free Expression Toolbox: Application to Synthetic Gene Circuits and Artificial Cells. Acs Synth Biol. 1, 29-41 (2012).
- Shin, J., Noireaux, V. Study of messenger RNA inactivation and protein degradation in an Escherichia coli cell-free expression system. Journal of biological engineering. 4, 9 (2010).
- Shin, J., Jardine, P., Noireaux, V. Genome Replication, Synthesis, and Assembly of the Bacteriophage T7 in a Single Cell-Free Reaction. Acs Synth Biol. 1, 408-413 (2012).
- Siegal-Gaskins, D., Noireaux, V., Murray, R. M., Pao, L., Abramovitch, D. Biomolecular resource utilization in elementary cell-free gene circuits. , 1531-1536 (2013).
- Karzbrun, E., Shin, J., Bar-Ziv, R. H., Noireaux, V. Coarse-grained dynamics of protein synthesis in a cell-free system. Physical review letters. 106, 048104 (2011).
- Hoagland, M. B., Stephenson, M. L., Scott, J. F., Hecht, L. I., Zamecnik, P. C. Soluble Ribonucleic Acid Intermediate in Protein Synthesis. J Biol Chem. 231, 241-257 (1958).
- Wood, W. B., Berg, P. Effect of Enzymatically Synthesized Ribonucleic Acid on Amino Acid Incorporation by a Soluble Protein-Ribosome System from Escherichia Coli. Proceedings of the National Academy of Sciences of the United States of America. 48, 94 (1962).
- Zubay, G. In-Vitro Synthesis of Protein in Microbial Systems. Annu Rev Genet. 7, 267-287 (1973).
- Pratt, J. M., Hames, B. D., Higgins, S. J. . Transcription and Translation: A Practical Approach. , 179-209 (1984).
- Kim, H. C., Kim, D. M. Methods for energizing cell-free protein synthesis. Journal of bioscience and bioengineering. 108, 1-4 (2009).
- Michel-Reydellet, N., Calhoun, K., Swartz, J. Amino acid stabilization for cell-free protein synthesis by modification of the Escherichia coli genome. Metabolic engineering. 6, 197-203 (2004).
- Liu, D. V., Zawada, J. F., Swartz, J. R. Streamlining Escherichia coli S30 extract preparation for economical cell-free protein synthesis. Biotechnology progress. 21, 460-465 (2005).
- Andrianantoandro, E., Basu, S., Karig, D. K., Weiss, R. Synthetic biology: new engineering rules for an emerging discipline. Molecular systems biology. 2, 2006.0028 (2006).
- Kwok, R. Five hard truths for synthetic biology. Nature. 463, 288-290 (2010).
- Tabor, S., Richardson, C. C. A bacteriophage T7 RNA polymerase/promoter system for controlled exclusive expression of specific genes. Proceedings of the National Academy of Sciences of the United States of America. 82, 1074-1078 (1985).
- Lewicki, B. T., Margus, T., Remme, J., Nierhaus, K. H. Coupling of rRNA transcription and ribosomal assembly in vivo. Formation of active ribosomal subunits in Escherichia coli requires transcription of rRNA genes by host RNA polymerase which cannot be replaced by bacteriophage T7 RNA polymerase. Journal of molecular biology. 231, 581-593 (1993).
- Iskakova, M. B., Szaflarski, W., Dreyfus, M., Remme, J., Nierhaus, K. H. Troubleshooting coupled in vitro transcription-translation system derived from Escherichia coli cells: synthesis of high-yield fully active proteins. Nucleic acids research. 34, e135 (2006).
- Kigawa, T., et al. Preparation of Escherichia coli cell extract for highly productive cell-free protein expression. Journal of structural and. 5, 63-68 (2004).
- Matsuda, T., et al. Improving cell-free protein synthesis for stable-isotope labeling. Journal of biomolecular. NMR. 37, 225-229 (2007).
- Sitaraman, K., et al. A novel cell-free protein synthesis system. Journal of biotechnology. 110, 257-263 (2004).
- Becskei, A., Serrano, L. Engineering stability in gene networks by autoregulation. Nature. 405, 590-593 (2000).
- Maeda, H., Fujita, N., Ishihama, A. Competition among seven Escherichia coli sigma subunits: relative binding affinities to the core RNA polymerase. Nucleic acids research. 28, 3497-3503 (2000).
- Caschera, F., et al. Coping with complexity: machine learning optimization of cell-free protein synthesis. Biotechnology and bioengineering. 108, 2218-2228 (2011).
- Hodgman, C. E., Jewett, M. C. Cell-free synthetic biology: thinking outside the cell. Metabolic engineering. 14, 261-269 (2012).
- Elowitz, M. B., Leibler, S. A synthetic oscillatory network of transcriptional regulators. Nature. 403, 335-338 (2000).
- Tsuruta, H., et al. High-level production of amorpha-4,11-diene, a precursor of the antimalarial agent artemisinin, in Escherichia coli. Plos One. 4, e4489 (2009).
- Gardner, T. S., Cantor, C. R., Collins, J. J. Construction of a genetic toggle switch in Escherichia coli. Nature. 403, 339-342 (2000).
- Jewett, M. C., Forster, A. C. Update on designing and building minimal cells. Current opinion in biotechnology. 21, 697-703 (2010).
- Noireaux, V., Libchaber, A. A vesicle bioreactor as a step toward an artificial cell assembly. Proceedings of the National Academy of Sciences of the United States of America. 101, 17669-17674 (2004).
Erratum
Formal Correction: Erratum: Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology
Posted by JoVE Editors on 1/01/1970. Citeable Link.
A correction to Figure 5's legend has been made for the article Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology. Method 1 and method 2 have been switched.Z
The figure legend was update from:
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 1) or post-processed with a QiaQuick PCR purification kit (Purification method 2).
to
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 2) or post-processed with a QiaQuick PCR purification kit (Purification method 1).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유