Method Article
実装するためのプロトコル
* これらの著者は同等に貢献しました
Erratum Notice
要約
この5日間のプロトコルは、すべての手順、機器、およびベースの効率的な内在大腸菌ゼロからTX-TLの無細胞発現系を作成し、実行するために必要な追加ソフトウェアの概要を説明します。試薬を用いて、プロトコルは8セットアップ時間以下の反応、収集、およびプロセスデータをとる。
要約
理想的な無細胞発現系は、理論的には体外プラットフォームでも、管理環境下でのin vivo細胞環境をエミュレートすることができます。1これは制御された方法でタンパク質や遺伝子回路を表現するためだけでなく、合成生物学のためのプロトタイピング環境を提供するのに有用である。2,3後者の目的を達成するために、保存する無細胞発現系は、内在大腸菌転写翻訳機構はより正確にT7 RNAポリメラーゼ転写に基づくものよりインビボ細胞動態を反映することができる。我々は、効率的な内因性Eの準備と実行を記述する同じような商用システムへの98%のコスト削減にT7ベースのシステムのようなタンパク質の等量を生成することができ、大腸菌ベースの転写-翻訳(TX-TL)の無細胞発現系。4,5バッファと粗細胞抽出物の調製であるの実行だけでなく、記載され3チューブTX-TL反応。プロトコル全体を準備するために5日かかると1準備で最大3000の単一反応のための十分な材料が得られます。準備された後、各反応は、データ収集と分析のセットアップから8時間の下になります。 Eに規制および転写外因性のメカニズムこのようなラック/ tetリプレッサーおよびT7 RNAポリメラーゼのような大腸菌を 、補充することができる。例えば、mRNAおよびDNAの分解速度などの6内因性特性をも調整することができる。7 TX-TL無細胞発現系は、大について実証されている規模回路組立、生物学的現象を探求し、両方のT7-と内因性プロモーターの下でタンパク質の発現。6,8付随数学モデルが用意されています。9,10結果のシステムは、プロトタイピング環境のような合成生物学のユニークなアプリケーションを持っている、または「TX- TL生体分子ブレッドボード。 "
概要
無細胞発現技術は、T7バクテリオファージDNAを用いて、結合された転写翻訳機構を包含する年後に進んで、純粋に並進として1950年に始まった。11,12それ以来、数々の努力が粗細胞抽出物の作成 (またはEを最適化するために行われてきた大腸菌 S30抽出物)。13,14これらの最適化は、ATPの再生又は歪みの修正を介して無細胞タンパク質合成を延長し、プロトコルの時間とコストを低減することが挙げられる。15-17代替の無細胞発現系が存在し、その粗製の代わりに使用する再構成成分発現のための細胞抽出物。5粗細胞抽出物および再構成の両方の方法は、商業用に開発されてきた。
合成生物学の出現により、生物学的なモジュール、および回路設計のテストと表現する十分に特徴付けられたプラットフォーム用の増加が必要とされている。18,19このプラットフォームは、である必要があります、汎用性の高い、十分に特徴付けられ、操作が簡単で、ユーザが指定するコンポーネントに焦点を当てた。半世紀以前に開発されているにもかかわらず、無細胞系は、 大腸菌に基づく彼らは成長と代謝の複雑ずに細胞プロセスのインビトロでの表現に簡略化されているように大腸菌は、本質的に、これらの要件を共有しています。さらに、E.上の生体内作業での基礎知識のすべて大腸菌は、大腸菌に容易に適用されます大腸菌無細胞系。
無細胞発現系は、ほとんどの無細胞発現系の目標を現在までに、合成生物学での用途を持つことができますが、タンパク質や代謝物収量の最大化されています。これは、T7プロモーターによって駆動される配列のT7バクテリオファージ転写を用いることによって達成される。20発現が、 効率的かつ堅牢であるが、これらのシステムは高度に特殊目的を果たす。細胞調節方法は限られている、標的DNAテンプレートは、でなければならないT7プロモーターを含むように再設計し、リボソーム複合体のような特定の配列が転写され、組み立てることができない。21,22既存の無細胞発現系は、内因性の調節機構、合成生物学のために必要な汎用性を維持しながら高い収率を維持することができない。
私たちは、内因性Eを開発しました従来のシステムで実証タンパク質発現の効率を維持しますが、内因性および外因性(T7または他の)メカニズムの両方に基づく発現および調節を可能にすることにより、追加の融通性を付加した大腸菌無細胞発現系。ここで説明するプロトコルは、もともと。木川らもとにして(2004)、Liu ら (2005)が、有意な修飾を有している。それは、効率向上のためのMg-およびK-アセテート上でのMg-およびK-グルタミン酸を利用し、2 -メルカプトエタノールを除去し、ビーズビーターを用いて細胞を溶解する。17,23,24ビーズ-鼓動が均質化を介して選択され、圧力ベースの方法、又はによる競合システムに対するその低コストと同等の収率を超音波処理23 3 -ホスホグリセリン酸(3-PGA)がクレアチンリン酸と比較した場合に優れたタンパク質収量を与えることが見出されたように、エネルギー源として使用され、ホスホエノールピルビン酸。4,25私たちのシステムは、他の商用システムからの収量と同様ラムダファージ事業者とシグマ70ベースのプロモーターまたはT7駆動のプロモーターのいずれかを使用して、レポータータンパク質の0.75 mg / mlの最大生成することができます。4,6 5日すべての必要な試薬( 図1)を生成するために必要とされる。また、同等の商用無細胞系に比べて98%のコスト削減を提供します-材料費が( 図2)に含ま労働で0.26ドルに上昇し10μL反応あたり0.11ドルである。
プロトコル
1。粗細胞抽出物の調製
3日間にわたり、粗細胞抽出物を調製することは効率的に実施するために2人を必要とします 。プロトコルは、機能的に3つの部分で構成され培養増殖(1.11〜ステップ1.1)、細胞溶解(1.37をステップステップ1.12)、および明確化(1.52をステップステップ1.38)を解凍します。これは、便宜上日間に分けて提示されている。理想的な抽出物は、プラスミドpBEST-OR-OR 1-PR-UTR1-deGFP-T500(Addgene番号40019)、およびタンパク質の27〜30 mg / mlの間の粗細胞抽出物濃度を有している。4からdeGFPの0.75 mg / mlのを生成することができたが、抽出特性は、バッチからバッチごとに異なる。以下のレシピは約3,000、単一の反応(6ミリリットル細胞粗抽出液)のために十分に供給します。スケールダウンした場合、それは劣らず、ここで指定した値の1/6以下で使用しないことをお勧めします。時間的制約により、スケールアップすることはお勧めしません。
1日目
- 細菌培養液を準備し、文化TUREプレートと、培地補充物、表1に記載したように。レシピの補足資料1を参照してください。
- 。ストリークBL21-Rosetta2のの2×YT + P + Cmに寒天プレートに-80℃〜ひずみと37℃で、またはコロニーが容易に見えるようになるまで、少なくとも15時間インキュベート注:クロラムフェニコール(CMは)プラスミドを選択するために使用されているBL21-Rosetta2株では珍しいのtRNAをコードする。
2日目
- 表2に記載のような緩衝液やサプリメントを準備します。レシピの補足資料1を参照してください。
- を含めて、3日目に必要な材料を準備し、殺菌:アルミホイルカバー(オートクレーブ処理)と6×4 L三角フラスコ、4×1 Lの滅菌遠心ボトル、漏斗(オートクレーブ処理)は、0.1ミリメートルのガラスビーズ100グラム(オートクレーブ処理)、2炒めバー(オートクレーブ処理)、1リットルと500ミリリットルのシリンダー(オートクレーブ処理)、(オートクレーブ処理)2×1 Lビーカー、18 G針(滅菌)で3ミリリットルの注射器、2〜3 FL卒業オート麦ブイ、2〜3 10K MWCO透析カセット(滅菌)、キュベット。
- ミニ文化1を準備します。 30分間37℃にする2×YT + Pメディアと4 12ミリリットルセンチμlの無菌培養チューブと事前暖かいの4ミリリットルを追加します。
- の2×YT + P + Cmに寒天プレートからコロニーをミニ文化1に接種。 8時間220 rpmで、37℃でインキュベートする。
- 7時間と30分後に、ミニ文化2を用意。 30分間37℃の無菌250ミリリットルの三角フラスコと事前温めるの2×YT + PメディアとCmの50μLの50ミリリットルを追加します。
- ミニ文化1100μlのミニ文化2に接種し、8時間、220 rpmで37℃でインキュベートする。
3日目
- 表3の4の空の滅菌50ミリリットルファルコンチューブとレコード質量を量る。氷上でファルコンチューブを冷やし、これらは続いて、ステップ1.18において使用されるであろう。
- ステップ1.8の後に7時間と30分、最終的な細菌培養培地を準備。無菌1リットルのメスシリンダーに使用して、の2×YT + Pメディアiの660ミリリットルを転送37℃〜6 4のL三角フラスコと事前暖かいの各30分間NTO 注4 L以上三角フラスコは、適切エアレーションをお勧めします。
- 各4Lの三角フラスコにミニ文化2の6.6ミリリットルを追加します。培養物は、(中間対数増殖期に相当)600nmで1.5〜2.0のODに達するまで、220rpmで、37℃でインキュベートする。 。 対数期中期の間に急速な成長とコレクションはエキスの品質のために重要である。3時間45分-精度1:10培養希釈液を用いて定期的にODをチェックして、このステップはせいぜい3時間を取る必要があります。
- すぐに成長した後、細菌細胞をペレット化し、4℃で12分間5000×gで4 1Lの遠心ボトルや遠心分離機に均等にすべての文化を転送する。
- 1 M DTT予め調製S30Aの2 Lの4を添加することにより、完全なS30A緩衝液調製物を遠心分離している。混合し、氷の上にバッファを維持する。
- 遠心分離が完了すると、完全にデカでステップ1.12から上清を除去ntingし、滅菌ペーパータオルの上遠心ボトルブロッティング。
- 4遠心ボトルのそれぞれに4℃でS30Aの緩衝液200 mLを加え、 ペレットが完全に無い残りの塊で可溶化するまで激しくボトルを振る。 4℃で12分間5000グラムで4ボトルを遠心分離
- 完全無菌ペーパータオルの上遠心ボトルをデカントし、ブロッティングにより、前のステップからの上清を除去します。
- 繰り返して1.15と1.16を繰り返します。
- 各遠心分離ボトルに4℃で40ミリリットルS30Aバッファーを追加します。 。)1.9から冷やしたファルコンチューブに各ペレットとS30Aの組み合わせを転送注:この手順では、より小さな容器にペレットを転送することです。
- 4℃で8分間、2,000 gでファルコンチューブを遠心分離するデカントにより上清を除去します。
- 遠心分離機 - 再ファルコンチューブを4℃で2分間2,000 gで完全にピペットで残留上清を除去。氷の上においてください。
- Fの重さ表3のペレットとレコード質量とのファルコンチューブ。ペレット質量、必要なS30Aのバッファ量、および表3の具体的な式に基づいて必要なビーズの質量を計算します。
- ペレットの正しいロードとビーズビーティング、品質エキスを作るために重要であり、最も困難なステップです。これは、しようとする前に、ビデオを見直すことをお勧めします。気泡を避け、均一にビーズを分散しないと、非効率的な抽出をもたらす。
- 均一になるまで、各ファルコンチューブ、渦に表3で計算S30Aバッファの量を追加し、氷に戻ります。
- 30秒間ボルテックス、 各総ビーズの1/3を用いて、3つのアリコートに単一ファルコンチューブに間欠的にビーズを加える。ビーズの各アリコートを添加した後、氷上で他のファルコンチューブに保ちつつ。渦ステップ間と最終ボルテックスした後、氷上でファルコンチューブを配置します。最後のアリコートを添加した後、 確実にビーズが均一に分布している。濃厚なペーストを形成する必要がある。
- 3〜4ミリメートルの開口部を作成するために、滅菌カミソリの刃を使用して端をカットして5ミリリットル(ボリューム)ピペットチップを準備します。 2mlまでピペットをダイヤル注:異なるピペットセットと先端がプル厚いビード細胞溶液を放出するのに十分でないかもしれない吸引の異なる量を提供し、除去端で1mlピペットチップを代わりに使用することができる。
- 氷上で20ビーズビーティングチューブを配置します。
- 修正されたピペットを用いて細胞 - ビーズ溶液の粘度が高いことを確認します。それはほとんど排出中ピペットチップを終了点までの粘性である必要があります。粘度が高すぎる場合は、1.25のステップに応じてピペットチップを再調整。十分に粘稠ではない場合、ビーズは、( ペレット塊* 5.1)の最大質量( ペレット質量* 0.05)の増分で添加することができる。ビーズの各添加後、30秒間ボルテックスし、氷上に戻ります。粘度のデモンストレーションのための図3aを参照してください。
- 修正されたピペットを用いファルコンチューブからビーズ細胞溶液を外し、無菌ビーズビーティングチューブに移す、それをビーズ細胞溶液との完全な四分の三を埋める。ビーズを再分配することなく、気泡を除去するためにカウンターミニ遠心機に極めて短時間(1秒)をスピン。ビーズ破っチューブ搭載の静止画像については、図3B-Dを参照してください。
- 凹メニスカスを形成するために、ビーズ細胞溶液の追加を終了。
- キャップの外側の縁を妨げないように注意しながら 、ビーズ破っチューブキャップの内 側にビーズ細胞溶液の非常に小さなドロップを追加し、そうでなければ、ビード打ちチューブが近いsufficientl y としません。平らな面にキャップをタップして、 キャップの底に気泡がないことを確認してください 。
- 前のステップからのビーズ破っキャップをビーズビーティングチューブにキャップ。ビーズビーティングのアシスタントに手。正しく行われた場合は、 キャップをしっかりと気泡がshoul、密封されるべきである表示さD、およびほとんど(もしあれば)ビーズ細胞液がオーバーフローする必要があります。気泡が表示されているか、キャップが完全に閉じない場合は、ロード処理をやり直す。
- ビーズの均一な分布を保証するために、残りのビーズ - 細胞溶液と工程1.24から渦ファルコンチューブ。ファルコンチューブが空になるまで繰り返して1.31に1.28を繰り返し、そして繰り返して、各追加Falconチューブ用に1.31に1.24を繰り返します。
- 行為は、同時に1.38に1.33を繰り返します 。氷上で1.31と場所からアシスタントテイク埋めビーズ破っチューブを持っている。 2満たされたビーズ破っ管が収集されているし、少なくとも1分間氷上にされると、ビーズ打撃を開始します。
- 46 rpmで30秒間1のチューブを破った。他方のチューブを破っながら30秒間氷上で逆さまに置きます。
- 各満たされたビーズ破っ管が1分、合計でビートされているように、前の手順を繰り返します。
- 繰り返します8満たされたビーズビーティングチューブ(または遠心分離機が保持できる最大量)Hまで1.35まで1.33ステップ処理されていAVE。次いで、15mlのファルコン( 図3e)からフィルタ装置を構成する。 15ミリリットルファルコンの底に、新しいビーズ破っキャップ、フラット部分のフェイスアップを追加します。 完全に密閉する まで 、 しっかりと処理されたビーズ鼓動チューブの端部に処理されたビーズ暴行チューブを押しマイクロクロマトグラフィーカラムからキャップを取り外します。マイクロクロマトグラフィーカラムの溶出端をスナップ、およびマイクロクロマトグラフィーカラムを配置し、溶出は空のビーズビーズ管に、ダウン終了。 15ミリリットルファルコンにこの複雑に配置します。全8埋めビーズ打つ管について、この手順を繰り返し、完了すると、氷上に保つ。
- ビーズから抽出し、ペレットを分離するため、4℃で5分間6000グラムで遠心8のフィルタ装置、ファルコンチューブキャップを外し、。
- 各ビーズ·ビーティング管が実行可能なエキスを生産していることを確認します 。きちんとビート抽出物は濁っできなくなり、ペレットを2つの別個の層を持つことになります。私はすべての濁ったチューブを破棄し、非濁ったチューブから上清を転送個々の1.75ミリリットルのマイクロ遠心管NTO、 可能な限り少ないペレットを取る 。すべてのビーズビーティング管が処理されるまで氷上で保管してください。正しく対間違って処理されたビーズビーティングチューブを比較3fは図を参照してください。
- 4℃で10分間12,000 gで、前のステップからの遠心微量遠心管
- ピペットを使用して、空のビーズビーティングチューブに転送ペレットを含まない上清を 、新しいビーズ破っチューブに500μlのを統合。
- 80分間220回転、37℃で、 削除ビーズ破っキャップで 、前の手順をインキュベートする。この工程は、ビーズビーディング工程中に放出され、内因性エキソヌクレアーゼを用いて核酸を残りの消化、および組織培養チューブ中のビーズ拍動チューブを起立することによって行うことができる。
- 透析材料を準備します。 1 M DTT予め調製S30Bの2 Lの2 mlを添加することにより、完全なS30B緩衝製剤。混合し、2番目のそれぞれに900ミリリットルを追加1Lのビーカーerile。各ビーカーに、無菌磁気攪拌機を追加し、4℃で保管し
- ステップ1.41の後、 抽出物は、濁っているはずです 。 1.75ミリリットルマイクロ遠心管中で1.5ミリリットルのアリコートにエキスを統合し、4℃で10分間12000グラムで遠心
- ピペットを用いて、氷上で15ミリリットルファルコンチューブにペレットを含まない上清を統合し 、チューブをキャップし、反転させてよく混ぜます。 ステップ1.47氷上で10μlの上清を保存します 。
- 生産抽出物の総量を決定し、カセットにつき、抜粋の2.5ミリリットルを仮定して、2分間S30Bに浸すことにより10K MWCO透析カセットの必要な数を水和。
- 抽出液2.5ミリリットルとカセットをロードします。各ビーカーに2カセットかかることがあります。透析、3時間、4℃で、攪拌しながら注意:カセットの部分負荷が許容される。透析は、タンパク質産生の収率を増加させる。
- 前のステップの間に、タンパク質抽出物を特徴づけるステップ1.44で保存された抽出液を用いてBradfordアッセイで濃度。詳細については、 補足資料2を参照してください。
- 透析は1.75ミリリットルマイクロ遠心管中で1.5ミリリットルによって分量エキス、完了した後。 4℃で10分間12,000 gで遠心分離ペレットは、チューブの底部に形成される。
- 氷上で15ミリリットルファルコンチューブにピペッティングして、前のステップから透明な上澄みを統合。 5〜10倍を反転させることにより均質化する。
- ステップ1.47においてブラッドフォードによって決定された濃度に基づいて、個々の1.75ミリリットルチューブにアリコートに抽出物の量を決定します。 個々のチューブは、全タンパク質の810から900 mgのボリュームを持っている必要があります。抽出物は、27 mg / mlのより高い総タンパク質濃度を持っている必要があります。 例えば、30μlの28 mg / mlので分量エキス、および分量エキス32で、濃度が高ければアリコート30μlのアリコートに30 mg / mlの以下の抽出、およびスケール: この手順では、便宜的に 注意を 行うための支援を必要とする28.1μLによるmg / mlの。
- 気泡を避けるように注意しながらステップ1.50以下の分量の抽出物。液体窒素中でフラッシュ凍結抽出注:泡アリコートを4℃で30秒間、10,000×gで遠心分離することにより除去することができる
- ストレーナーを用いて液体窒素からチューブを外し、すぐに-80℃に安全で格納します。保護メガネを着用して、抽出管のキャップは、液体窒素と室温との温度差に外れがあります 。
2。アミノ酸溶液の調製
アミノ酸溶液を大量に準備する必要があります。以下のレシピは、約11,000の単一反応のために十分な供給、RTSアミノ酸サンプラーの1フルキットを利用しています。スケールダウンした場合、それが無いの半分以下のキットを使用することをお勧めします。在庫の各アミノ酸は、140 mMのロイシンを除いて、1.5ミリリットル、168ミリモルで供給される。アミノ酸溶液の最終組成は次の通りである:ロイシン、5mMの他のすべてのアミノ酸、6 mMの。これは、4×作業濃度である。
- -20°Cから20アミノ酸すべてを削除し、室温で解凍する。一度解凍したアミノ酸まで、渦は、必要に応じて、37℃でインキュベートし、溶解する。アミノ酸が溶解した後、 室温に保持されているのAsn、Pheであり、およびCysを除く氷上で全てのアミノ酸を置く。 Cysが完全に溶解しないことがあります 。
- 氷の上に、滅菌した50ミリリットルファルコンチューブに滅菌水12ミリリットルを追加します。
- 各添加後ファルコンチューブをボルテックスし、氷上で溶液を準備しておくように注意しながら、 次の順序で各アミノ酸の1.5ミリリットルを追加します。アラ、アルギニン、アスパラギン、アスパラギン、グルタミン、グルタミン酸、グリシン、彼の、イル、リジン、会ったのPhe、Proは、セリン、スレオニン、ヴァル、トリプトファン、チロシン、レイ、システイン。 Cysが付加した後、渦が溶液になるまで、必要に応じて、37℃でインキュベートし、比較的明確である 。懸濁液として添加することができる。 Cysが完全に溶解しないことがあります 。
- 50チューブに一定分量アミノ酸ソリューションで氷上で26μlをそれぞれ。氷上でチューブあたり500μLの残りを分取。 頻繁に 26μlのアリコートを500μlのアリコートを緩衝液を調製するために使用され、一方アリコートいるが 、抽出物を較正するために使用される、主渦ストック懸濁液の不均一な分布を回避する 。
- -80℃の安全で液体窒素とストア内のフラッシュフリーズ分量:保護メガネを着用して、抽出管のキャップは、液体窒素と室温との温度差に外れがあります 。
- オプション:以前に作られたアミノ酸·ソリューションに対して、新たに作られアミノ酸液の活性アッセイを実施する。
3。エネルギーソリューションの準備
エネルギーソリューションは、粗細胞抽出物を較正するための、バッファを作成するための両方に使用され、大量に調製すべきである。以下のレシピは、約10000の単一反応のために十分に供給します。スケールダウンした場合、それはrecommeです劣らず、ここで指定した値の1/24以上を使用しないことnded。エネルギーソリューションが重要な金銭的コストであるので、初めてのユーザーは、1/24スケールで準備することができます。エネルギーソリューションの最終組成は、HEPES pHは8 700 mMのATP 21 mMの、GTP 21 mMの、CTP 12.6 mMのUTP 12.6 mMの、tRNAの2.8 mg / mlの、CoAの3.64 mMの、NAD 4.62 mMのキャンプ10.5mmで、フォリン酸0.95 mMのスペルミジン14 mMの3-PGA 420 mMの。これは、14倍作業濃度である。所望であれば、 表4のそれぞれの個々の項目は、後で使用するために-80℃で保存することができる。
- -80°Cから表4のすべての化学物質を除去、-20、30分間室温にCまたは4゜C°。
- 表4で説明したようにストック溶液を準備します。レシピの補足資料1を参照してください。調製後氷上ですべてのソリューションを配置します。
- 15ミリリットルファルコンチューブに、各添加後ファルコンチューブをボルテックスに注意しながら、 以下の順序で追加およびoソリューションを維持するN氷:3.6ミリリットル、2M HEPES、144μlの水、1.39ミリリットルヌクレオチド混合物、576μlの50 mg / mlのtRNAを、576μlの65 mMのCoAを、276μlの175 mMのNAD、170μlの650 mMのcAMPを、288μlの33.9 mMのフォリン酸、144μlの1 Mスペルミジン、および3.09ミリリットルの1.4M 3-PGA。
- 氷上7μlのそれぞれで50のチューブに一定分量エネルギーソリューション。氷上でチューブあたり150μLの残りを分取。 150μlのアリコートを緩衝液を調製するために使用され、一方7μlのアリコートを分注、渦メイン在庫ながら頻繁に 、抽出物を較正するために使用される。
- -80℃の安全で液体窒素とストア内のフラッシュフリーズ分量:保護メガネを着用して、抽出管のキャップは、液体窒素と室温との温度差に外れがあります 。
- オプション:以前に行ったエネルギーソリューションに対する新た作らエネルギーソリューションの活性アッセイを実施する。
4。バッファの準備
BUFFER準備粗細胞抽出物の準備、アミノ酸溶液の調製、およびエネルギーソリューションの準備が完了したことを必要とします。 各バッファは、粗細胞抽出物のバッチに固有のものである 。 MG-グルタミン酸、K-グルタミン酸、およびDTTは(この順番で)式の最大レベルとの反応を生成するには、このセクションの最適化されています。以下のプロトコルは、事前に書かれたテンプレート、TXTL_e(テンプレート)_calibration_JoVE.xlsx( 補足資料3)、事前に調製した粗細胞抽出物を校正し、バッファを準備するために利用します。しかし、一つはまた、粗細胞抽出物を較正し、手動でのMg-グルタミン酸、K-グルタミン酸、およびDTTを最適化し、抽出物と一緒に、それは総反応容量の75%であるようなバッファを設定することでテンプレートなしのバッファを準備することができる。手動で校正する場合は、最終的な反応条件は、ステップ5に記載されています。
- 「一般データ」フォームに入力します。
- 氷の100mMのMg-グルタミン酸(4°C)、3 M K-グルタミン酸(4°C)、6上の融解mMのアミノ酸液(26μL、-80℃)、エネルギーソリューション(7μL、-80℃)、100のDTT(-20℃)で、ポジティブコントロールDNA(-20℃)で、40%のPEG- 8000(4℃)、粗細胞抽出液(-80℃)、水(4℃)(注)を使用し1 nMの使用濃度pBEST-OR-OR 1-PR-UTR1-deGFP-T500(Addgeneプラスミド40019)陽性対照(励起485 nm、発光525 nm)を、又は高信号強度を生成するために別の参照 図4
- 個々のマイクロ遠心分離管に株式のMg-グルタミン酸のセット量を小分けすることにより、4月10日mMの追加のMg-グルタミン酸の範囲をテストして、7 10.5μLの反応を準備します。注:10.5μLの反応が最初に製造されていますが、最終的な反応は、10μLです。
- K-グルタミン酸の余分な80ミリメートル追加」のMg-グルタミン酸キャリブレーション」の下のテンプレートに示されるように、マスターミックスを調製する。 各項目を加えた後 、氷とボルテックスに保つ注意:ここに、テンプレートで指定された値は次のとおりです。のMg-グルタミン酸、K-グルタミン酸、粗細胞抽出物を作製するために使用S30B緩衝液中のDTTの存在量に加えて。
- Mgをグルタミン酸を含むサンプルにマスターミックスを追加し、反応を準備します。手順詳細な手順については、5.13に5.10を参照してください。
- インキュベーターやプレートリーダーのいずれかで、29℃で反応を行う。
- エンド発現レベルおよびタンパク質発現( 図4a)の最大速度によって最適のMg-グルタミン酸濃度を測定注:ランタイムは、実験に応じて異なりますが、通常8時間の下の最後の。
- 繰り返しますが、ステップ4.7に見られるものとのMg-グルタミン酸レベルの設定」、K-グルタミン酸キャリブレーション」の下で、K-グルタミン酸4.2 4.7を繰り返します。
- 繰り返しますが、ステップ4.8に見られるものとステップ4.7とK-グルタミン酸のレベルに見られるものとのMg-グルタミン酸レベルの設定」を、DTTのキャリブレーション」の下に、DTTのために4.7に4.2を繰り返し注意:我々は、DTTが大幅にエンドツーエンドの影響はありません追加することを見出した発現レベル。
- 使用調製するためのバッファの組成を決定するために「バッファ組成物」の下で、キャリブレーションで検出された値。産粗細胞抽出物の量に基づいて、マスターミックスレシピは、バッファの設定量のために生成される。
- 氷上のマスターミックスレシピに記載されている分量を解凍する。解凍した後は、 各項目を加えた後 、氷とボルテックスに保ち、マスターミックスを調製する。
- 下に記載された金額によって一定分量「バッファー組成。 "液体窒素中でフラッシュ凍結バッファチューブ。 頻繁に、渦の主要な株式を小分けしながら 。
- ストレーナーを用いて液体窒素からチューブを外し、すぐに-80℃に安全で格納します。保護メガネを着用して、抽出管のキャップは、液体窒素と室温との温度差に外れがあります 。
5。 TX-TL反応の実験的実行
最終的な反応条件は以下のとおりです。8.9から9.9 mg / mlのproteロイシン、1.25 mMのロイシン、50のHEPES、1.5mMのATP及び除いて(粗抽出液からの)中で、4.5 MM-10.5mmでのMg-グルタミン酸、40〜160のK-グルタミン酸、0.33から3.33のDTT、1.5 mMの各アミノ酸GTP、0.9mMのCTPおよびUTP、0.2 mg / mlのtRNAを、0.26 mMのCoAを、0.33 mMのNAD、0.75ミリモルのcAMP、0.068 mMのフォリン酸、1mMスペルミジン、30 mMの3-PGA、2%のPEG-8000。 基本的なテキサス州粗細胞抽出物、緩衝液、およびDNA:-TL反応は、3部(管)を有する 。比は、75%のバッファとエキス、25%のDNAの反応は、音量を変えることができる 、と私たちは反応容量を最小限に抑え、384ウェルプレート内で実行可能にするために慣習的に10μlを使用する。より大きなボリュームが適切な酸素のための攪拌を必要とする。以下のプロトコルは、10μlの反応を行い、事前に書かれたテンプレート、TXTL_JoVE.xlsx( 補足資料4)を利用する。 紫色の項目は、ユーザーの入力値を示しており、青色の項目は、反応に追加する追加の試薬 を示している 。しかし、1はまた、反応のウィットを行うことができる上記で概説した反応条件に従うことによって、テンプレートホウト。
- 「一般データ」フォームに入力します。
- 下の「マスターミックスの準備、「紫色の箱にステップ4.1から抽出パーセント値を挿入します。
- 「マスターミックス準備」(行10から17)と「DNAの準備」(行19-50)のセクションを使用してin silicoであなたの実験を設計します。変数は「DNAの準備"セクションに入れることができますが、一般的に、定数は、「マスターミックスの準備」セクションに入れることができます。 サンプルの蒸発濃縮およびサンプル、実験開始時間の偏りを避けるために、実験ごとのサンプルを最小限に抑えます。サンプルのセットアップについては、図6を参照してください。
- 下の「マスターミックスの準備、「一定の濃度で、全てのサンプルで行くような誘導物質やタンパク質などの試薬を加える。行14からは、青い影の部分を記入し、各ラインに1試薬を保つ。単位は相対比である。
- 下の「DNAの準備、「サンプルspecifなり、DNAを追加IC。試料を陽性および陰性対照に対するIDが#1、#2に対応、それぞれサンプルIDは上記の#3とは、ユーザーが変更可能なDNAについては、NG /μL中のストック濃度、塩基対の長さ、nM単位所望の最終濃度、および(10μlの反応の)繰り返しである。所望の最終濃度に到達するまでのストックDNAの量が自動的に算出される。 nは繰り返しの数であることに注意してください 10.5行の和での合計* nは、:最終反応容量は10μlのですが、計算がピペッティングの際に失われたボリュームを考慮して、反応あたり10.5μLの総容量を想定しています。
- 下の「DNAの準備、「青の列に特定のサンプルになります試薬または追加のDNAを追加します。検体特異的試薬は、10.5×nの総反応体積に基づいて、手動計算を必要とするnMのストックDNA濃度」は、DNAの調製」で算出することができる。入力されたボリュームは、同じ行の水量から減算される。
- 必要なnumbeを削除-20℃または-80℃〜からバッファ、粗細胞抽出物、および下の陽性対照の試験管 "解凍チューブ」のRとを氷上で溶かす。
- DNAサンプルを準備します。室温での各サンプルのID、マイクロ遠心管に分量外指示されたDNAは、水、および「DNAの準備」セクションごとにユーザーが指定したアイテムを、のための注意:サンプルの損失を避けるために、最近ではキャリブレーションピペットと低スティックピペットチップおよびマイクロ遠心管を推奨します。
- ステップ5.7からの管が解凍されている場合、 各項目を加えた後 、氷とボルテックスに保ち、バッファ、エキス、オレンジ-影の箱に基づいて任意のグローバルユーザーが指定した項目からなるマスターミックスを調製注:抽出は非常にある粘性。泡アリコートを4℃で30秒間万×gで遠心分離により除去することができる
- 各DNAサンプルに「DNAの準備」(列0)の下で、オレンジ色のセルに示されたマスターミックスの量を追加し、部屋の温度に保つTURE。 反応開始時間として扱う 。
- 渦それぞれのサンプル、および残留サンプルをダウンさせると、気泡を減少させるために室温で30秒間万×gで遠心分離します。
- 微量遠心管で反応を行う場合は、29℃で直接インキュベートそうでなければ、384ウェルプレートにピペット10μlのサンプル注:10μLより大きいボリュームでの反応は、酸素化のための攪拌が必要な場合があります。
- 残留サンプルをダウンさせると、気泡を減少させるために室温で30秒間、4,000×gで遠心分離プレート。蒸発を防ぐために、その後のプレートをシール。
- 29℃(注)で動作反応:ランタイムが実験に応じますが、通常8時間の下の最後異なります。
結果
我々は、TX-TL無細胞発現系ベースの内在大腸菌の調製のための5日間のプロトコルを提示している。粗細胞抽出物及びバッファー- -試薬を作成するためのサンプルのタイムラインは、 図1に見ることができる。一度作成、これらは最大1年間-80℃で保存することができる。試薬を作成した後、実験および実行未満8時間で行うことができる。
加えて、我々はTX-TL無細胞発現系の発現条件を最適化した。このようなバッファやDNA溶液など、他のユーザーが提供する追加は、事前に毒性を校正する必要があります。例えば、処理するプラスミドの異なる方法が塩分による異なる発現をもたらす。また、反応効率( 図5)上のトリス-Cl溶出緩衝液の効果を試験した。
4.9ステップ4.1を参照して、粗細胞抽出物のキャリブレーションの一例を示したが、図4aの 。一般的には、我々の実験は、粗細胞抽出物をK-グルタメートのレベル、続いてのMg-グルタメートのレベルに最も敏感であることを示している。無細胞発現系を実証するために、我々 のtet抑制に基づいて、負のフィードバックループを構築し、試験した26( 図6)。無細胞発現系においては、ATCとない同じサーキット走行式の8時間後にdeGFPレポーターの7倍の終点の発現変化を示す。彼らは「マスターミックス調製」の下に追加することができ、必要であれば、この実験では、グローバルなインデューサーまたはリプレッサーを必要としませんが
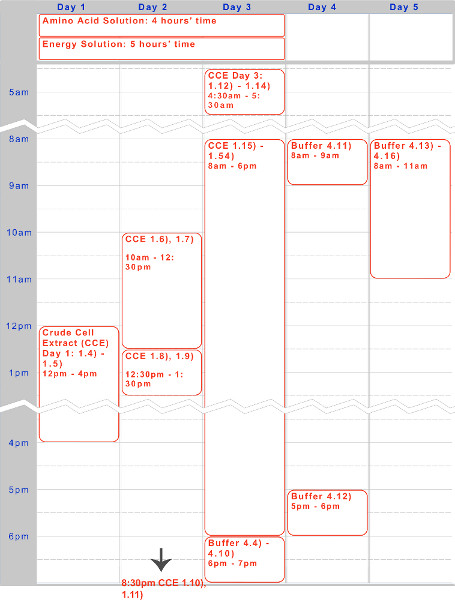
図1。粗細胞抽出物、アミノ酸溶液、およびエネルギー溶液調製のためのタイムライン。五日timelinプロトコルの典型的な実行のためのEは、上記の一晩のインキュベーション、昼間の作業工程に最適化されています。
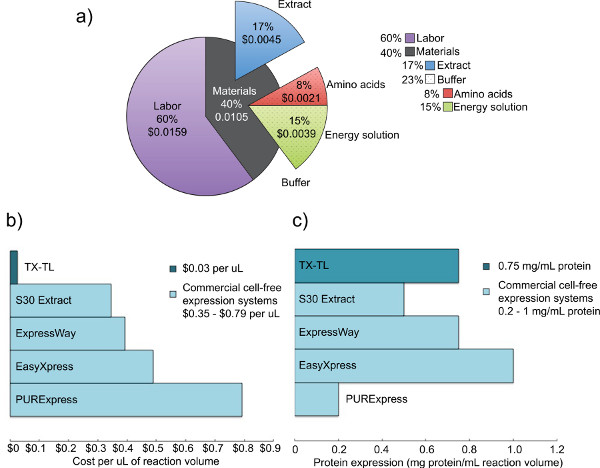
図2。コストと粗細胞抽出物を、競合の発現解析。 A)TX-TLの無細胞発現系の労働力と材料費の内訳。 2012年12月のような試薬のコスト、時間あたり14ドルの人件費に基づく。b)その他の商用システム対TX-TLの無細胞発現システムコストの比較。反応体積は、他の商用システム対TX-TLの無細胞発現系収量のキットあたり。C)の比較を異なるがコストは、1μl当たり分解される。タンパク質発現収率は、メーカー基準で判断した。/ 50762fig2large.jpg "ターゲット=" _blank ">大きな画像を見るにはここをクリックしてください。

図3。ビーズビーティング管のロードと処理。 a)細胞-ビーズ溶液の正確な粘度の実証。細胞-ビーズ溶液を氷に費やさ添加S30A緩衝液の量は、添加ビーズの量、および時間を含む多くの要因に依存する粘度を有する。b)のビーズ拍動チューブのローディング迅速な卓上遠心分離し。遠心分離はロード中に蓄積された気泡を除去します。C)卓上遠心分離後浮上した気泡。気泡の大きさ変化するであろう;それらはピペットチップを用いて表示または非表示を除去することができるd)は完全にキャッピング前にビーズ拍動チューブを満たした。メニスカスがビーズ破っTが形成されている宇部、キャップを入れすぎため、少量をカバーし、引き起こすのに十分されています。E)が正しくロードされたフィルタ装置。これらは、正常対正常に処理ビーズビーティング管。f)の比較を再利用することができる。左のチューブは、よくビート管である - それは小さな、よく描かトップ層、そして非常に透明な上澄みを提供しています。右のチューブが大きく、かすんで第二層とかすんで上澄みに基づいて、最適ではないです。次善のあるチューブは、追加の処理を受けるべきではありません。
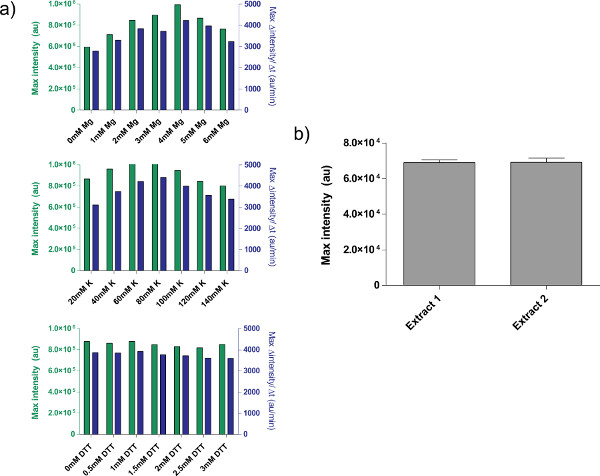
図4。粗抽出物製剤の性質。 a)は、粗細胞抽出物のための典型的な較正プロット。粗抽出物を、この順序で、追加のMg-グルタミン酸、K-グルタミン酸、およびDTTレベルに対して較正される。エンドポイントが示されているfluorescenc8時間後、電子だけでなく、12分間の移動平均に基づいてタンパク質生産の最大速度。これらのプロットに基づいて、追加のマグネシウム - グルタミン酸の許容範囲は、K-グルタミン酸は60〜80 mMである、4mMのであり、DTTは0-3 mMである。すべての粗抽出物は、これら三つの変数ごとに独立してキャリブレーションする必要があることに注意してください。B)の抽出物調製物からの変化。異なる日に調製した2つの粗抽出物のエンドポイント蛍光が示されており、エラーバーは、別の日に3の独立した実行からの1標準偏差である。 大きな画像を見るにはここをクリックしてください 。
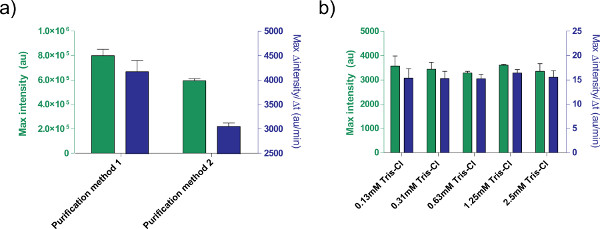
図5。発現効率にDNA溶液の効果。二つの異なる精製のa)の比較プラスミドを処理するための方法。 pBEST-OR2-OR1-PR-UTR1-deGFP-T500のみをQIAprepを使用して調製される1nMのは、ミニプレップキット(精製法1)をスピンまたはキアクイックPCR精製キット(精製法2)を用いて、後処理。 8時間後、ならびに12分の移動平均に基づいて、タンパク質産生の最大速度後のエンドポイント蛍光を示している。エラーバーは、別の日には4つの独立したランからの1標準偏差である。溶出緩衝液のb)の影響(トリス-Cl)。トリス-Clの異なる濃度pBEST-OR2-OR1-PR-UTR1-deGFP-T500の1 nMでの発現に基づく無細胞発現反応において比較される。所与の濃度は、反応におけるトリス-Clの最終濃度であり、使用される溶出緩衝液は、10mMトリス-Clである。エラーバーは、別の日に3の独立した実行からの1標準偏差である。 大きな画像を見るにはここをクリックしてください 。
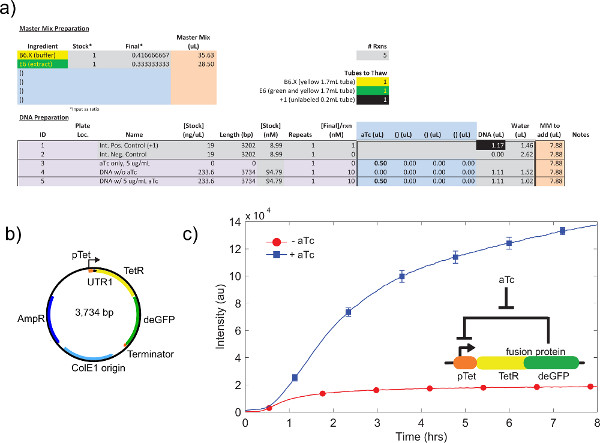
図6。負帰還ループのサンプルTX-TLラン。 a)は、試料の無細胞反応の実行のセットアップ。陽性および陰性対照と負帰還ループの対「オフ」、「オン」状態の試験、負帰還ループのb)のプラスミドマップ。c)の代表的な結果。データは、実験内を反映)およびb)、ネガティブコントロールと信号から減算される。遺伝回路が挿入に示す。エラーバーは、別の日に3の独立した実行からの1標準偏差である。 大きな画像を見るにはここをクリックしてください 。
| 名前 | 濃度 | 額 | 殺菌 | 注釈 |
| クロラムフェニコール(CM) | エタノールに34 mg / mlの | 1ミリリットル | 濾過滅菌(0.22μM) | 後で使用するために-20°Cで保存し、より大量に製造することができる。 |
| の2×YT + P + Cmに寒天平板 | 31グラム/ Lの2×YT、40 mMリン酸カリウム二塩基、22 mMのリン酸二水素カリウム、34μg/ mlのクロラムフェニコール | 1プレート | オートクレーブ | |
| の2×YT + Pメディア | 31グラム/ Lの2×YT、40 mMリン酸カリウム二塩基、22 mMのリン酸二水素カリウム | 4 L | オートクレーブ |
表1。粗細胞抽出プロトコルの1日目のための試薬 。
| 名前 | 濃度 | 額 | 殺菌 | 注釈 |
| トリス塩基 | 2男 | 250ミリリットル | 濾過滅菌(0.22μM)またはオートクレーブ | 室温で保存することができる。 |
| DTT | 1男 | 6ミリリットル | 濾過滅菌(0.22μM) | より大きな体積で行われ、後で使用するために-20℃で保存することができる。 |
| S30Aバッファ | 14 mMのグルタミン酸塩のMg、60mMのK-グルタミン酸、50mMトリス、pH7.7の | 2 L | オートクレーブ | pHが7.7に到達するために、酢酸で滴定する。使用直前に2 mMの最終濃度になるようにDTTを追加します。 4℃で保存する |
| S30Bバッファ | 14 mMのMgをグルタミン酸、60のK-グルタミン酸、〜5 mMトリス、pHは8.2 | 2 L | オートクレーブ | pHが8.2に到達するために、2Mで滴定トリス。使用直前に1 mMの最終濃度になるようにDTTを追加します。 4℃で保存する |
表2。粗細胞抽出プロトコルの2日目のための試薬 。
| ファルコン | ||||
| 1 | 2 | 3 | 4 | |
| 空の50mlファルコン(g)の | ||||
| ペレットで50mlのファルコン(g)を | ||||
| ペレット塊(ペレットと50ミリリットルファルコン-空の50ミリリットルファルコン)(G) | ||||
| (* 0.9をペレット質量)を追加するS30Aバッファ容量(ml) | ||||
| 追加するビーズの総質量(ペレット質量* 5.0)(G) | ||||
表3。粗細胞抽出プロトコルの3日目のためS30Aバッファとビードマス計算、。
| 名前 | 濃度 | 額 | 殺菌 | 注釈 |
| HEPES | 2 M、pHを8 | 4ミリリットル | なし | pHが8に到達するには、KOHで滴定する。 |
| ヌクレオチドミックス | 156のATPとGTP、94 mMのCTPおよびUTP、pH7.5の | 1.5ミリリットル | なし | pHが7.5に到達するには、KOHで滴定する。 |
| tRNAの | 50 mg / mlの | 600μL | なし | |
| CoAを | 65 mMの | 600μL | なし | |
| NAD | 175 mMの、pHが7.5〜8 | 300μL | なし | pHが7.5〜8に到達するには、2メートルのトリスで滴定 |
| のcAMP | 650 mMの、pHを8 | 200μL | なし | pHが8に到達するには、2メートルのトリスで滴定 |
| フォリン酸 | 33.9 mMの | 300μL | なし | わずか300μLが必要とされていますが、補足的なレシピは、1.15ミリリットルのためである。 |
| スペルミジン | 1男 | 150μL | なし | 4℃でのストアは、熱37℃に溶融する。 |
| 3-PGA | 1.4 M、pHは7.5 | 3.2ミリリットル | なし | pHが7.5に到達するには、2メートルのトリスで滴定 |
表4。エネルギーソリューションプロトコルの準備をするための試薬 。
補足資料1。アイテムのレシピ。
クロラムフェニコール、34 mg / mlの:0.51グラムのクロラムフェニコールを準備し、15ミリリットルにエタノールを加える。濾過滅菌(0.22μM)、1ミリリットルチューブ、後で使用するために-20℃で保存する分量。
の2×YT + P + Cmに寒天プレート:1.24グラムの2×YT、40ミリリットルの1M、0.6グラム寒天と水@ 1M、0.88ミリリットルリン酸二水素カリウム水溶液@ 1.6ミリリットルのリン酸カリウム、二塩基性溶液を調製する。オートクレーブ。 50℃まで冷ますと40μlのCmを追加します。 100×15ミリメートルペトリ皿に分量25ミリリットルを、そして時間冷ます。
の2×YT + Pメディア:124グラムの2×YT、1 M @ 160ミリリットルのリン酸カリウム、二塩基性水溶液、4 L. Aliquに1M、および水@ 88ミリリットルリン酸二水素カリウム溶液を調製2×1.88 Lおよび0.24 L·オートクレーブ中に出otの。
トリスベース、2 M:250ミリリットルに60.57グラムトリス塩基と水を準備します。殺菌、後で使用するために、室温で保管してください。
DTT、1 M:15ミリリットルに2.31 グラムのDTT及び水を準備します。濾過滅菌(0.22μM)、1ミリリットルチューブ、後で使用するために-20℃で保存する分量。
S30Aバッファ:10.88グラムのMg-グルタミン酸及び24.39グラムのK-グルタミン酸、2M、(pHが7.7まで)を酢酸で50ミリリットルのトリスを用意し、水2 L·オートクレーブに、4℃で保存し、4ミリリットルの1M DTTを追加使用前に。
S30Bバッファ:10.88グラムのMg-グルタミン酸及び24.39グラムのK-グルタミン酸、2 Mでのトリス(pH 8.2)を準備し、水2 L·オートクレーブに、4℃で保存し、使用前に2ミリリットルの1M DTTを追加します。
HEPES:4ミリリットルに1.91グラムのHEPES(MW 238.21)、KOH(pHを8まで)、および水を準備します。
のtRNA:600μlに30 tRNAのMgと水を準備します。
CoAを:600μlに30 CoAのMG(MW 767.53)と水を準備します。
NAD:300μlに、NAD(MW 663.43)、2 M(pHは7.5〜8)でのトリス、水34.83ミリグラムを追加します。 (pHは7.5〜8の解決策をもたらすために、2Mのトリスの27μLを追加)。
のcAMP:200μlに42.80 cAMPのMG(MW 329.22)、2 M(pH8まで)のトリス、および水を加える。 (pHを8にソリューションをもたらすために、2Mのトリスの73μLを追加)。
フォリン酸(33.9ミリ):固体フォリン酸カルシウム塩(MW 511.5)の20 mgの1.15 mlの水を加える。
スペルミジン:150μlに23.55スペルミジンμL(MW 145.25)と水を準備します。 37℃で簡単に溶融後、室温で準備
3-PGA:3.2ミリリットルに1.03 3-PGA(MW 230.02)のG、2 M(pH値7.5)でのトリス、および水を加える。 (pH7.5に解決を持ってくることを、2Mのトリスの1.73ミリリットルを追加します)。
NucleotIDEミックス:、ATP二カリウム塩二水和物(分子量619.4)の145ミリグラムを追加GTP二ナトリウム塩(分子量567.14)の133ミリグラム、CTP二ナトリウム塩二水和物(分子量563.16)の79.4 mgの、UTP三ナトリウム塩二水和物(分子量586.12)の82.6 mgの1.5 mlの15%希釈液(pH 7.5)、および水でKOH。 (pH7.5に解決を持ってくることを15%の希釈でKOHを353μl加え)。
補足資料2。ブラッドフォードアッセイ。
- 4℃からブラッド剤を除去し、室温で設定してください。
- 1 mg / mlの時と0.1ミリグラム/ mlで50μlのBSA標準を準備します。
- ステップ1.47からの抽出物40μlの20X希釈液を調製。
- 7キュベットに800μlの水を加える。
- 0 mg / mlの、1 mg / mlの(10μL0.1 mg / mlのBSA)、2 mg / mlの(20μL0.1 mg / mlのBSA)、4 mg / mlの(4μL1 mg / mlのBSA)の標準的なキュベットを準備、6 mg / mlの(6μL1 mg / mlのBSA)。
- サンプルとサンプルの4μlに2μlのための実験キュベットを準備します。
- 各キュベットにブラッド·エージェントの200μLを加え、よく混ぜるBYペッティング。少なくとも10分間室温でインキュベートする。
- ステップ6.5からキュベットを使用して、OD 595 nmでの標準曲線を生成します。標準曲線を拒否した場合R 2 <0.95。
- ステップ6.6からキュベットを使用して、OD 595 nmでエキス濃度を決定します。
補足資料3。キャリブレーションシートをバッファリングする。
TXTL_e(テンプレート)_calibration_JoVE.xlsxを参照してください 。
補足資料4。無細胞発現は、スプレッドシートを実行します。
ディスカッション
ここで説明する内在大腸菌ベースTX-TL無細胞発現系は、データ収集まで設定からわずか8時間かかることが簡単に実行3管の反応である。すべての試薬 を作成するプロセスは、5日間の時間の合計(一日だけに大きな労力が要求される)を必要としますが、3000反応に粗抽出物を生成し、バッファ意思万反応のための試薬 ( 図1)。さらに、粗抽出物およびバッファ意思試薬は1準備の複数の用途を可能にし、-80℃で少なくとも1年間安定している。4を 10μlの反応あたり0.11ドル(労働を含む0.26ドル)で、コストが同等の98%以上低い商用システム( 図2)。
いくつかの未解決の制限は、システムに、しかし、存在する。各粗細胞抽出物調製の端効率は、ユーザの習熟度に、環境条件に基づいて変化し得るもののトンypical収量の変動を5〜10%( 図4b)の間にある。その結果、両方のエンドポイントでの発現および発現動態におけるバッチ間変動性が予想される。抽出液の作成が完全に自動化されるまで、抽出物を完全に特徴づけされるまで、またはこれらの変化は、おそらく残ります。無細胞発現系が敏感な定量的な実験を行うために使用する場合は、粗細胞抽出物の同じバッチですべての実験を実行することをお勧めします。シングル粗細胞抽出物のバッチからの収率、約3000の反応は、典型的な実験のコースで十分です。我々は変化がスケールアップし、処理を自動化することにより除去することができる疑いがあるが、このような試みは、実質的な資源投資を伴うだろう。
エンドポイントの発現レベルを決定するために合理的に容易であるが、さらに、より多くの作業が無細胞系に固有の理解の動態で行われる必要がある。ことが知られているリソースの両方competitionおよびリソース制限が発現動態に影響を与えることができる。例えば、限られた内因性のシグマ70が増大DNAテンプレートは、ヌクレオチドまたはアミノ酸枯渇のものと類似の発現プロファイルを生成して飽和レジームをもたらすことができる。9,27が、動力学は完全にシステムを利用すると理解されるべきではない。収率の純粋な増大のために、最適化は、機械学習の手法によって行うことができる。リソース競合限定の28の質問は、実験データを用いて検証数学的モデルによって対処することができる。
ここで紹介するプロトコルは、BL21-Rosetta2株に最適化されたが、他のEに一般化されている大腸菌株 。このような遺伝子をコードする経度プロテアーゼおよび稀なtRNAをコードする遺伝子の付加の除去などBL21-Rosetta2における修飾は、最大のタンパク質産生を可能にする。我々は2つの他の抽出株とプロトコルを試みている-だけBL21およびBL21 のTrxAノックアウト -ANをDは50%少ないタンパク質収量を発見した。私たちは、他の株を使用する際に歩留まりが同様に減少すると仮定した。例えば、LB及びその他のリッチブロスのための2×YT増殖培地を切り替えるなどのパラメータにおける他の変化は、減少したタンパク質収量をもたらした。
内因性および外因性の転写-翻訳機構と制御機構の両方を利用する無細胞発現系は、タンパク質および代謝産物発現の両方において、合成生物学の広い用途を有する。代わりT7-調節回路に限定されるもので、一つは、複雑な生体分子を産生想定することができる3,29ネイティブEのミックスを使用して、ユーザ制御可能な設定で大腸菌プロモーターおよび外因的に供給転写および規制のメカニズム。細胞分裂および代謝の制限なしに、そのようなアルテミシニンの製造業者などrepressilator合成回路内または代謝の変動操作された経路を減少またはより良く理解することができる。30,31私たちは海Eは、遺伝子スイッチを実装するだけでなく、シグマ因子の隔離を理解するために、これらの利点を使用9,32このような技術は、「最小」または「人工」のセルのバックボーンを形成することができます- 。小さな、十分に特徴づけられたとの自給自足型身体ユニットエキス。33,34
最終的には、合成生物学のためのプロトタイピング環境として、この内因性の無細胞発現系の即時利用を期待しています。基本的なプラスミド、線形、または化学的に合成さDNA上のテストのサイクル、続く-の愛称「TX-TL生体分子ブレッドボード、「無細胞発現系は、プロトタイピングのラウンドを受けることができる合成回路は、最終的にはin vivo発現宛て制御可能な環境を提供します分析と迅速な修飾による。プロトタイピングのラウンドは、現在開発中の予測数学モデルによって支援することができます。非最終回路のためのクローニングおよびインビボ操作を除去することにより、我々は縁起を予想エンジニアリングサイクル時間ではなく、現在の週の標準1-3日に短縮される。
開示事項
著者は、彼らが競合する経済的利益を持っていないことを宣言します。
謝辞
私たちは、プロジェクトの初期段階での支援をJongminキム、ダン·シーガル·ガスキンズ、アヌThubagere、およびプロトコルを効率化支援のためのエノクヨン、そしてクレアチェンとバークレーリーに感謝します。この材料は、米国防総省の国防高等研究計画庁(DARPA /受注生産)生活ファウンドリプログラム、契約番号HR0011-12-C-0065(DARPA / CMO.ZZSもUCLA /カリフォルニア工科大学医学者によってサポートされていることによって部分的にサポートされる作業に基づいています国防総省、空軍科学研究局、国防科学工学専攻(NDSEG)フェローシップ、32のCFR 168Aによるトレーニングプログラムの親睦と。本書に記載されているビューと結論は著者のものであると表現するものと解釈すべきではない米国防総省の国防高等研究計画庁や米国政府の正式の政策、いずれか明示または黙示、。
資料
| Name | Company | Catalog Number | Comments |
| 2xYT | MP biomedicals | 3012-032 | |
| 3-PGA | Sigma-Aldrich | P8877 | |
| ATP | Sigma-Aldrich | A8937 | |
| Bacto-agar | BD Diagnostics | 214010 | |
| Bead-beating tubes (polypropylene microvials) | BioSpec | 522S | |
| Beads, 0.1mm dia. | BioSpec | 11079101 | |
| BL21 Rosetta 2 E. coli strain | Novagen | 71402 | |
| Bradford BSA Protein Assay Kit | Bio-rad | 500-0201 | |
| cAMP | Sigma-Aldrich | A9501 | |
| Chloramphenicol | Sigma-Aldrich | C1919 | |
| CoA | Sigma-Aldrich | C4282 | |
| CTP | USB | 14121 | |
| Cuvettes, 1.5ml | Fisher | 14-955-127 | |
| DTT | Sigma-Aldrich | D0632 | |
| Folinic acid | Sigma-Aldrich | F7878 | |
| GTP | USB | 16800 | |
| HEPES | Sigma-Aldrich | H6147 | |
| K-glutamate | Sigma-Aldrich | G1149 | |
| Mg-glutamate | Sigma-Aldrich | 49605 | |
| Micro Bio-Spin Chromatography Columns | Bio-Rad | 732-6204 | |
| NAD | Sigma-Aldrich | N6522 | |
| Nunc 384-well optical bottom plates | Thermo-Scientific | 142761 | |
| Nunc sealing tape | Thermo-Scientific | 232701 | |
| PEG-8000 | Promega | V3011 | |
| Potassium phosphate dibasic solution | Sigma-Aldrich | P8584 | |
| Potassium phosphate monobasic solution | Sigma-Aldrich | P8709 | |
| RTS Amino Acid Sampler | 5 Prime | 2401530 | |
| Slide-A-Lyzer Dialysis Cassettes, 10k MWCO (Kit) | Thermo-Scientific | 66382 | |
| Spermidine | Sigma-Aldrich | 85558 | |
| Tris base | Fischer | BP1521 | |
| tRNA (from E. coli) | Roche Applied Science | MRE600 | |
| UTP | USB | 23160 | |
| 1L Centrifuge Bottle | Beckman-Coulter | A98813 | This is specific for Avanti J-series; obtain equivalent size for centrifuge in use. |
| 4L Erlenmeyer Flask | Kimble Chase | 26500-4000 | |
| Avanti J-26XP Centrifuge | Beckman-Coulter | 393127 | Or 1L-capable centrifuge equivalent. |
| Forma 480 Orbital Shaker | Thermo Scientific | 480 | Or chest-size 6x4L shaker equivalent. |
| JLA-8.1000 Rotor | Beckman-Coulter | 363688 | Or 1L-capable, 5000 x g rotor equivalent for centrifuge. |
| Mini-Beadbeater-1 | BioSpec | 3110BX | |
| Supplemental Material 1. Recipes for Items. Chloramphenicol, 34 mg/ml: Prepare 0.51 g chloramphenicol and add ethanol to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. 2xYT+P+Cm agar plate: Prepare 1.24 g 2xYT, 1.6 ml potassium phosphate dibasic solution @ 1 M, 0.88 ml potassium phosphate monobasic solution @ 1 M, 0.6 g agar, and water to 40 ml. Autoclave. Let cool to 50 °C and add 40 μl Cm. Aliquot 25 ml into a 100x15 mm petri dish, and let cool for an hour. 2xYT+P media: Prepare 124 g 2xYT, 160 ml potassium phosphate dibasic solution @1 M, 88 ml potassium phosphate monobasic solution @ 1 M, and water to 4 L. Aliquot out into 2x1.88 L and 0.24 L. Autoclave. Tris base, 2 M: Prepare 60.57 g Tris base and water to 250 ml. Sterilize, store at RT for later use. DTT, 1 M: Prepare 2.31 g DTT and water to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. S30A buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, 50 ml Tris at 2M, acetic acid (to pH 7.7), and water to 2 L. Autoclave, store at 4 °C, add 4 ml 1 M DTT before use. S30B buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, Tris at 2 M (to pH 8.2), and water to 2 L. Autoclave, store at 4 °C, add 2 ml 1 M DTT before use. HEPES: Prepare 1.91 g HEPES (MW 238.21), KOH (to pH 8), and water to 4 ml. tRNA: Prepare 30 mg of tRNA and water to 600 μl. CoA: Prepare 30 mg of CoA (MW 767.53) and water to 600 μl. NAD: Add 34.83 mg of NAD (MW 663.43), Tris at 2 M (to pH 7.5-8), and water to 300 μl. (Add 27 μl of Tris at 2 M to bring the solution to pH 7.5-8). cAMP: Add 42.80 mg of cAMP (MW 329.22), Tris at 2 M (to pH 8), and water to 200 μl. (Add 73 μl of Tris at 2 M to bring the solution to pH 8). Folinic Acid (33.9 mM): To 20 mg of solid folinic acid calcium salt (MW 511.5), add 1.15 ml water. Spermidine: Prepare 23.55 μl of spermidine (MW 145.25) and water to 150 μl. Prepare at room temperature after melting briefly at 37 °C. 3-PGA: Add 1.03 g of 3-PGA (MW 230.02), Tris at 2 M (to pH 7.5), and water to 3.2 ml. (Add 1.73 ml of Tris at 2 M to bring the solution to pH 7.5). Nucleotide Mix: Add 145 mg of ATP dipotassium salt dihydrate (MW 619.4), 133 mg of GTP disodium salt (MW 567.14), 79.4 mg of CTP disodium salt dihydrate (MW 563.16), 82.6 mg of UTP trisodium salt dihydrate (MW 586.12), KOH at 15% dilution (to pH 7.5), and water to 1.5 ml. (Add 353 μl of KOH at 15% dilution to bring the solution to pH 7.5). Supplemental Material 2. Bradford Assay.
See TXTL_e(template)_calibration_JoVE.xlsx. Supplemental Material 4. Cell-free expression run spreadsheet. See TXTL _JoVE.xlsx. | |||
参考文献
- Noireaux, V., Bar-Ziv, R., Libchaber, A. Principles of cell-free genetic circuit assembly. Proceedings of the National Academy of Sciences of the United States of America. 100, 12672-12677 (2003).
- He, M. Y., He, Y. Z., Luo, Q., Wang, M. R. From DNA to protein: No living cells required. Process Biochem. 46, 615-620 (2011).
- Forster, A. C., Church, G. M. Synthetic biology projects in vitro. Genome Res. 17, 1-6 (1101).
- Shin, J., Noireaux, V. Efficient cell-free expression with the endogenous E. Coli RNA polymerase and sigma factor 70. Journal of biological engineering. 4, 8 (2010).
- Shimizu, Y., et al. Cell-free translation reconstituted with purified components. Nat Biotechnol. 19, 751-755 (2001).
- Shin, J., Noireaux, V. An E. coli Cell-Free Expression Toolbox: Application to Synthetic Gene Circuits and Artificial Cells. Acs Synth Biol. 1, 29-41 (2012).
- Shin, J., Noireaux, V. Study of messenger RNA inactivation and protein degradation in an Escherichia coli cell-free expression system. Journal of biological engineering. 4, 9 (2010).
- Shin, J., Jardine, P., Noireaux, V. Genome Replication, Synthesis, and Assembly of the Bacteriophage T7 in a Single Cell-Free Reaction. Acs Synth Biol. 1, 408-413 (2012).
- Siegal-Gaskins, D., Noireaux, V., Murray, R. M., Pao, L., Abramovitch, D. Biomolecular resource utilization in elementary cell-free gene circuits. , 1531-1536 (2013).
- Karzbrun, E., Shin, J., Bar-Ziv, R. H., Noireaux, V. Coarse-grained dynamics of protein synthesis in a cell-free system. Physical review letters. 106, 048104 (2011).
- Hoagland, M. B., Stephenson, M. L., Scott, J. F., Hecht, L. I., Zamecnik, P. C. Soluble Ribonucleic Acid Intermediate in Protein Synthesis. J Biol Chem. 231, 241-257 (1958).
- Wood, W. B., Berg, P. Effect of Enzymatically Synthesized Ribonucleic Acid on Amino Acid Incorporation by a Soluble Protein-Ribosome System from Escherichia Coli. Proceedings of the National Academy of Sciences of the United States of America. 48, 94 (1962).
- Zubay, G. In-Vitro Synthesis of Protein in Microbial Systems. Annu Rev Genet. 7, 267-287 (1973).
- Pratt, J. M., Hames, B. D., Higgins, S. J. . Transcription and Translation: A Practical Approach. , 179-209 (1984).
- Kim, H. C., Kim, D. M. Methods for energizing cell-free protein synthesis. Journal of bioscience and bioengineering. 108, 1-4 (2009).
- Michel-Reydellet, N., Calhoun, K., Swartz, J. Amino acid stabilization for cell-free protein synthesis by modification of the Escherichia coli genome. Metabolic engineering. 6, 197-203 (2004).
- Liu, D. V., Zawada, J. F., Swartz, J. R. Streamlining Escherichia coli S30 extract preparation for economical cell-free protein synthesis. Biotechnology progress. 21, 460-465 (2005).
- Andrianantoandro, E., Basu, S., Karig, D. K., Weiss, R. Synthetic biology: new engineering rules for an emerging discipline. Molecular systems biology. 2, 2006.0028 (2006).
- Kwok, R. Five hard truths for synthetic biology. Nature. 463, 288-290 (2010).
- Tabor, S., Richardson, C. C. A bacteriophage T7 RNA polymerase/promoter system for controlled exclusive expression of specific genes. Proceedings of the National Academy of Sciences of the United States of America. 82, 1074-1078 (1985).
- Lewicki, B. T., Margus, T., Remme, J., Nierhaus, K. H. Coupling of rRNA transcription and ribosomal assembly in vivo. Formation of active ribosomal subunits in Escherichia coli requires transcription of rRNA genes by host RNA polymerase which cannot be replaced by bacteriophage T7 RNA polymerase. Journal of molecular biology. 231, 581-593 (1993).
- Iskakova, M. B., Szaflarski, W., Dreyfus, M., Remme, J., Nierhaus, K. H. Troubleshooting coupled in vitro transcription-translation system derived from Escherichia coli cells: synthesis of high-yield fully active proteins. Nucleic acids research. 34, e135 (2006).
- Kigawa, T., et al. Preparation of Escherichia coli cell extract for highly productive cell-free protein expression. Journal of structural and. 5, 63-68 (2004).
- Matsuda, T., et al. Improving cell-free protein synthesis for stable-isotope labeling. Journal of biomolecular. NMR. 37, 225-229 (2007).
- Sitaraman, K., et al. A novel cell-free protein synthesis system. Journal of biotechnology. 110, 257-263 (2004).
- Becskei, A., Serrano, L. Engineering stability in gene networks by autoregulation. Nature. 405, 590-593 (2000).
- Maeda, H., Fujita, N., Ishihama, A. Competition among seven Escherichia coli sigma subunits: relative binding affinities to the core RNA polymerase. Nucleic acids research. 28, 3497-3503 (2000).
- Caschera, F., et al. Coping with complexity: machine learning optimization of cell-free protein synthesis. Biotechnology and bioengineering. 108, 2218-2228 (2011).
- Hodgman, C. E., Jewett, M. C. Cell-free synthetic biology: thinking outside the cell. Metabolic engineering. 14, 261-269 (2012).
- Elowitz, M. B., Leibler, S. A synthetic oscillatory network of transcriptional regulators. Nature. 403, 335-338 (2000).
- Tsuruta, H., et al. High-level production of amorpha-4,11-diene, a precursor of the antimalarial agent artemisinin, in Escherichia coli. Plos One. 4, e4489 (2009).
- Gardner, T. S., Cantor, C. R., Collins, J. J. Construction of a genetic toggle switch in Escherichia coli. Nature. 403, 339-342 (2000).
- Jewett, M. C., Forster, A. C. Update on designing and building minimal cells. Current opinion in biotechnology. 21, 697-703 (2010).
- Noireaux, V., Libchaber, A. A vesicle bioreactor as a step toward an artificial cell assembly. Proceedings of the National Academy of Sciences of the United States of America. 101, 17669-17674 (2004).
Erratum
Formal Correction: Erratum: Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology
Posted by JoVE Editors on 1/01/1970. Citeable Link.
A correction to Figure 5's legend has been made for the article Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology. Method 1 and method 2 have been switched.Z
The figure legend was update from:
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 1) or post-processed with a QiaQuick PCR purification kit (Purification method 2).
to
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 2) or post-processed with a QiaQuick PCR purification kit (Purification method 1).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved