Method Article
Протоколы для Реализация
* Эти авторы внесли равный вклад
В этой статье
Erratum Notice
Резюме
Этот пятидневный протокол описывает все шаги, оборудование и дополнительное программное обеспечение, необходимое для создания и запуска эффективной эндогенного Escherichia TX-TL бесклеточный системы выражение с нуля палочка основе. С реагентов, протокол занимает 8 часов или меньше в настройки реакции, сбора и обработки данных.
Аннотация
Идеальные системы экспрессии бесклеточные теоретически может эмулировать сотовой среды в естественных условиях в контролируемой в платформе пробирке. 1 Это полезно для экспрессии белков и генетических схем в управляемом режиме, а также для обеспечения среды прототипирования для синтетической биологии. 2,3 Для достижения последней цели, системы экспрессии бесклеточные, сохраняющие механизмы транскрипции-трансляции эндогенной кишечная палочка в состоянии более точно отражать в естественных клеточных динамику, чем те, которые основаны на Т7 РНК-полимеразы транскрипции. Опишем подготовку и выполнение эффективного эндогенного Е. на основе палочки транскрипция-перевод (TX-TL) бесклеточный система экспрессии, которые могут производить эквивалентные количества белка в виде систем T7-основанных на снижение себестоимости в 98% от аналогичных коммерческих систем. 4,5 Подготовка буферов и неочищенного экстракта клеток являются описано, а также выполнениятри трубки TX-TL реакция. Весь протокол занимает пять дней, чтобы подготовить и дает достаточно материала для до 3000 отдельных реакций в одном препарате. После приготовления, каждая реакция берет под 8 часов от установки до сбора и анализа данных. Механизмы регуляции и транскрипции экзогенной к Е. палочка, такие как лак / Tet репрессоров и РНК-полимеразы Т7, может быть дополнена. 6 Эндогенные свойства, такие как мРНК и темпов деградации ДНК, также могут быть скорректированы. 7 система экспрессии бесклеточной TX-TL была продемонстрирована для больших сборка масштаб схемы, исследуя биологическую явления, и выражение белков под обеими T7-и эндогенных промоутеров. 6,8 Сопровождающие математические модели доступны. 9,10 Полученная система обладает уникальными приложений в синтетической биологии как среды прототипирования, или "TX- TL биомолекулярных макет ".
Введение
Технология выражение Cell-Free началось в 1950-х годах как чисто поступательное, продвижение годами позже, чтобы охватить сочетании механизмов транскрипции-трансляции с использованием бактериофага Т7 ДНК. 11,12 тех пор, многочисленные усилия были приложены, чтобы оптимизировать создание неочищенного экстракта клеток (или E . Экстракт палочка S30). 13,14 Эти оптимизации включают продление синтез белка бесклеточной через регенерация АТФ или модификаций деформации, а также сокращения времени протокола и стоимость. существуют 15-17 Альтернативные системы экспрессии бесклеточные, что использование восстановленного компоненты вместо нефти Экстракт клеток для экспрессии. 5 Оба неочищенного клеточного экстракта и методы восстанавливающие были разработаны для коммерческого использования.
С появлением синтетической биологии, есть повышенная потребность в хорошо характеризуется платформы для тестирования и выразить инженерных биологических модулей и цепей. 18,19 Эта платформа должна бытьуниверсальный, хорошо характеризуется, просто манипулировать, и сосредоточился на поставляемыми пользователем компонентов. Несмотря разрабатывается на полвека раньше, системы бесклеточные на основе Е. палочка неразрывно поделиться этим требованиям, так как они дают упрощенное экстракорпоральное представления клеточных процессов без сложности роста и обмена веществ. Кроме того, все фундаментальных знаний, от в естественных условиях работы на Е. палочка относится легко Е. бесклеточные системы палочки.
Хотя системы экспрессии бесклеточные может иметь приложения в синтетической биологии, на сегодняшний день цель большинства систем экспрессии бесклеточных была максимизация белка и выходом метаболита. Это достигается с помощью бактериофага Т7 транскрипцию последовательностей, управляемых T7 промоутеров. 20 Хотя выражение является эффективным и надежным, эти системы служат узкоспециализированные цели. Методы регуляции клеточного ограничены, шаблоны ДНК-мишени должны бытьреинжиниринга включить Т7 промоутеров, и некоторые последовательности, такие как рибосомных комплексов не может быть переписана и собран. 21,22 Существующие системы экспрессии бесклеточные не в состоянии поддерживать высокие урожаи при сохранении эндогенные регуляторные механизмы, универсальность, необходимую для синтетической биологии.
Мы разработали эндогенный E. палочка система экспрессии бесклеточной, который сохраняет эффективность экспрессии белка продемонстрировано в предыдущих системах, но добавляет дополнительную гибкость, позволяя выражение и регулирование на основе как эндогенные, так и экзогенные (T7 или другие механизмы). Протокол, описанный здесь, изначально основанное на Kigawa соавт. (2004) и Лю и др.. (2005), но имеет значительные изменения. Он использует Mg-и K-глутамат над Mg-и K-ацетата для повышения эффективности, снимает 2-меркаптоэтанола, и лизирует клетки, используя шарик-колотушку. 17,23,24 бисера избиение выбирается по гомогенизации,Методы давления на основе, или обработка ультразвуком из-за его низкой стоимости и сравнимыми выходами к конкурирующих систем. 23 3-фосфоглицериновая кислоты (3-PGA) используется в качестве источника энергии, как было установлено, чтобы дать превосходные выходы белка по сравнению с креатинфосфата и фосфоенолпируват. 4,25 Наша система может производить до 0,75 мг / мл репортера белка с использованием либо промотор sigma70 основе с лямбда-фага операторов или Т7-приводом промотор, похожий на выходами из других коммерческих систем. 4,6 Пять дней обязаны производить все необходимые реагенты (рис. 1). Кроме того, он обеспечивает снижение затрат на 98% по сравнению с сопоставимым коммерческих бесклеточных систем - материальные затраты $ 0.11 за 10 реакции мкл, которая поднимается до $ 0,26 с труда включены (рис. 2).
протокол
1. Сырая сотовый Экстракт Подготовка
Подготовка неочищенного клеточного экстракта в течение трех дней требуется два человека, чтобы провести эффективно. Протокол функционально состоит из трех частей: роста культуры (шаг 1.1 к шагу 1,11), для лизиса клеток (стадия 1.12 к шагу 1,37), и извлечь разъяснения (шаг 1,38 к шагу 1,52). Она представлена делится на дни для удобства. Идеально экстракт может производить 0,75 мг / мл deGFP из плазмиды pBEST-OR 2-OR1-Пр-UTR1-deGFP-T500 (Addgene # 40019) и имеет концентрацию неочищенного клеточного экстракта между 27-30 мг / мл белка. 4 Однако , экстракт характеристики изменяются от партии к партии. Следующий рецепт поставляет достаточно для примерно 3000 отдельных реакций (6 мл неочищенного клеточного экстракта). Если сворачивают, рекомендуется использовать не менее 1/6 от значений, приведенных здесь. Из-за нехватки времени, расширения не рекомендуется.
День 1
- Подготовка бактериальная культура СМИ, культуры пластины, и медиа-добавки, как описано в таблице 1. См. дополнительные материалы 1 для рецептов.
- . Подряд BL21-Rosetta2 штамм от -80 ° С на агаровой пластинке 2xYT + P + см и инкубируют в течение по крайней мере 15 часов при 37 ° С или до колонии легко различимы Примечание: хлорамфеникол (см) используется для выбора для плазмиды кодирования редкие тРНК в штамме BL21-Rosetta2.
День 2
- Подготовка буферов и дополнения, как описано в таблице 2. См. дополнительные материалы 1 для рецептов.
- Подготовка и стерилизовать материалы, необходимые для 3-й день, в том числе: 6 х 4 л колбы Эрленмейера с крышкой из фольги алюминия (автоклавного), 4 х 1 L стерильные бутылки центрифуги, воронка (автоклавного), 100 г 0,1 мм стеклянные бусы (автоклавного), 2 перемешать-бары (в автоклаве), 1 л и 500 мл мерный цилиндр (автоклавного), 2 х 1 L стаканы (автоклавного), 3 мл шприц с 18 г хвои (стерильные), 2-3 этовсяные буи, 2-3 10k MWCO диализа кассеты (стерильные), кюветы.
- Подготовка мини-культуру 1. Добавить 4 мл 2xYT + P СМИ и 4 мкл Ст к 12 мл стерильной пробирке культуры и предварительно теплой до 37 ° С в течение 30 мин.
- Привить мини-культуру 1 с колонией от 2xYT + P + Ст агаром. Инкубировать при 220 оборотах в минуту, 37 ° С в течение 8 часов.
- 7 ч. и 30 мин спустя, подготовить мини-культуру 2. Добавьте 50 мл 2xYT + P СМИ и 50 мкл Ст в стерильную колбу Эрленмейера на 250 мл и предварительно теплой до 37 ° С в течение 30 мин.
- Инокулировать мини-культуры 2 100 мкл культуры мини-1 и инкубируют при 220 оборотах в минуту, 37 ° С в течение 8 часов.
День 3
- Взвесьте четыре пустые стерильные 50 мл Сокол труб и записывать массу в таблице 3. Охладить пробирки Фалкон на льду; они будут впоследствии используемый на стадии 1,18.
- 7 ч. и 30 мин после шага 1.8, подготовить окончательный бактерий питательных сред. Используя стерильный 1 л Мерный цилиндр, передача 660 мл 2xYT + P СМИ яНТО каждой из шести 4 л колбы Эрленмейера и предварительно тепло до 37 ° С в течение 30 мин. Примечание: 4 л или больше колбы Эрленмейера рекомендуются для правильного аэрации.
- Добавить 6,6 мл культуры мини-2 в каждом 4 л колбу Эрленмейера. Инкубировать при 220 оборотах в минуту, 37 ° С, пока культура не достигает наружный диаметр 1,5-2,0 при 600 нм (что соответствует фазе роста середины логарифмической). Периодически проверяйте OD с разбавлением 1:10 культуры для точности Этот шаг должен занимать не более 3 ч - 3 ч 45 мин;. Быстрый рост и сбор во время середины логарифмической фазы имеет решающее значение для качества экстракта.
- Сразу после роста, передавать все культуры равномерно на четыре 1 L центрифужные флаконы и центрифуге при 5000 х г в течение 12 мин при 4 ° С для осаждения бактериальных клеток.
- В то время как центрифугирование, полную подготовку S30A буфер добавлением 4 мл 1М DTT до 2 л предварительно приготовленного S30A. Смешайте и поддерживать буфер на льду.
- Когда центрифугирования закончена, полностью удалить супернатант с шага 1,12 по декаnting и промокания центрифуг бутылки на стерильной бумажной салфеткой.
- Добавить 200 мл S30A буфере при 4 ° С в каждом из четырех центрифужных флаконах, и встряхивают бутылки энергично, пока осадок не будет полностью растворены, без комков остальных. Центрифуга четыре бутылки в 5000 г в течение 12 мин при 4 ° С.
- Полностью удалить супернатант из предыдущего шага отстаивают и промокания центрифуг бутылки на стерильной бумажной салфеткой.
- Повторите шаги 1,15 и 1,16.
- Добавить 40 мл S30A буфера при 4 ° С в центрифуге каждой бутылке. . Переезд каждый шарик и комбинацию S30A в охлажденный трубки Сокол с 1,9) Примечание: Этот шаг является передача гранул в меньшую емкость.
- Центрифугируйте пробирки Фалкон в 2000 г в течение 8 мин при 4 ° С. Удалить супернатант отстаивают.
- Re-центрифуге трубки Фалкон в 2000 г в течение 2 мин при 4 ° С. Полностью удалить остатки супернатант с помощью пипетки. Держите на льду.
- Взвесьте енаши Сокол труб с таблеткой и записи массы в таблице 3. Рассчитать гранул масса, объем S30A буфера нуждались, и массу шариков, необходимых на основе конкретных формул в таблице 3.
- Правильная загрузка и шарик избиение гранул имеет решающее значение для принятия экстракт качества, и является самым сложным шагом. Рекомендуется пересмотреть видео, прежде чем пытаться. Несоблюдение избежать воздушных пузырей и распространять бусы равномерно приведет к неэффективному экстракта.
- Добавить количество S30A буфера рассчитывается в таблице 3 для каждого Сокол трубки, вихря до получения однородной консистенции, и вернуться на лед.
- При сохранении других трубок Фалкон на льду, добавить шарики с перерывами к одной трубке сокола в три аликвотных частей, каждая с использованием 1/3 от общего числа шариков. После добавления каждой аликвоте шариков, вихрь в течение 30 сек. Поместите трубки сокола на льду между вихревых шагов и после окончательного вихря. После прошлой Аликвота добавляется, обеспеченияшарики равномерно распределены. Густой пасты должны быть сформированы.
- Подготовьте 5 мл (объем) пипетки с отрезанием конец с помощью стерильного лезвие, чтобы создать отверстие 3-4 мм. Наберите пипеткой 2 мл Примечание: Различные наборы для пипеток и наконечники обеспечивают разное количество всасывания, что не может быть достаточно, чтобы вытащить и отпустите толстый решение шарик-клеток; пипетки 1 мл с конца удалены может быть использован вместо..
- Наведите 20 шарик избиение труб на льду.
- Убедитесь, высокую вязкость клеточной борта решения с использованием модифицированной пипетки. Он должен быть вязким, чтобы точки едва выходе из пипетки во время ее выхода. Если слишком вязким, ее следует поправить пипетки в соответствии с этапом 1,25. Если не достаточно вязкая, бусы могут быть добавлены с шагом (пеллет массы * 0,05), до максимальной массы (пеллет масса * 5.1). После каждого добавления бисер, вихря в течение 30 сек и возврата в лед. См. рисунок 3а для демонстрации вязкости.
- Удалить решение шарик-клеток из трубки Сокол использованием модифицированной пипетки, и передать в стерильный шарик избиение трубки, заполняя его на три четверти раствором шарик-клеток. Спин чрезвычайно кратко (1S) на встречную мини-центрифуге для удаления пузырьков воздуха без перераспределения бусы. См. рисунки 3b-д для неподвижных изображений шарик избиение трубки нагрузки.
- Завершения добавления раствора шарик клеток, чтобы сформировать вогнутый мениск.
- Добавить очень маленький каплю раствора шарик-клеток на внутренней стороне борта избиение цилиндрического колпачка, будьте осторожны, чтобы не препятствовать вне губу колпачка, иначе шарик избиение трубка не закрывается sufficientl у. Нажмите на крышку на ровную поверхность и убедитесь, что нет никаких пузырьков воздуха в нижней части крышки.
- Закройте шарик избиение трубку с борта избиение крышкой из предыдущего шага. Из рук в помощника для бисера избиения. Если все сделано правильно, крышка должна быть плотно закрытыми, никаких пузырьков воздуха разделительнаяг будет видно, и мало (если таковые имеются) решение шарик-клетка должна переливаться. Повторить процесс загрузки, если могут видеть или крышка не полностью близко пузырьки воздуха.
- Vortex Сокол трубки с шага 1,24 с оставшегося раствора шарик-клеток, чтобы обеспечить равномерное распределение шариков. Повторите шаги 1,28 до 1,31, пока Сокол трубка не пуст, а затем повторите шаги 1,24 до 1,31 для каждого дополнительного трубки Сокол.
- Проведение шаги 1,33 до 1,38 одновременно. Были помощник взять заполнено шарик избиение трубки от 1,31 и место на льду. После того, как две заполненные шарик избиение трубы были собраны и были на льду в течение не менее одной минуты, начинают шарик избиение.
- Удар одну трубку в течение 30 сек при 46 оборотах в минуту. Наведите с ног на голову на льду в течение 30 сек, избивая другой трубки.
- Повторите предыдущий шаг такой, что каждый заполненный шарик избиение трубка была бить в течение 1 мин общей сложности.
- Повторяйте шаги 1,33 до 1,35 до 8 заполненных труб шарик избиение (или максимальной суммы центрифуга может содержать) чAVE были обработаны. Затем построить фильтрующее устройство с 15 мл сокола (рис. 3e). Добавить новый шарик-бить колпачок, плоским часть лицевой стороной вверх, на дно 15 мл Falcon. Затем снимите крышку с обработанной борта избиение трубы и пресс-колонки микро-хроматографии твердо на конце обрабатываемого борта избиение трубки до полного опечатаны. Привязать от элюирования конец колонны микро-хроматографии, и поместите колонку микро-хроматографии, элюирование концом вниз, в пустое шарик-бисером трубки. Поместите этот комплекс в 15 мл Falcon. Повторите эти действия для всех 8 заполненных бортовых избиение труб; держать на льду, когда завершена.
- Центрифуга 8 фильтр аппараты, трубки сокола раскрытый в 6000 г в течение 5 мин при 4 ° С, чтобы отделить экстракт и осадок из бисера.
- Убедитесь, каждая бусинка избиение трубка произвела жизнеспособной экстракта. Правильно бить экстракт не будет мутным, и осадок будет иметь два отдельных слоев. Отменять все мутные трубки, и передать супернатант от не-мутных труб яНТО отдельные 1,75 мл микро-лабораторными пробирками, принимая как можно меньше осадка, насколько это возможно. Держать на льду пока все шарик-бить трубки не будут обработаны. См. рисунок 3е сравнения правильно против неправильно обработанный шарик избиение трубку.
- Центрифуга микро-центрифужные пробирки с предыдущей стадии в 12000 г в течение 10 мин при 4 ° С.
- Передача гранул без супернатант в пустые шарик избиение труб с помощью пипетки, консолидации 500 мкл в новый шарик избиение трубки.
- Выдержите предыдущий шаг, с борта избиение снять крышки, при 220 оборотах в минуту, 37 ° С в течение 80 мин. Этот шаг переваривает остальные нуклеиновых кислот с помощью эндогенных экзонуклеаз выпущенные в процессе шарик-бисером, и может быть сделано, стоя борта избиение трубку в культуре ткани трубки.
- Подготовка диализа материалы. Полный S30B подготовка буфера путем добавления 2 мл 1 М DTT до 2 л предварительно приготовленного S30B. Перемешать и добавить 900 мл в каждую из двух улerile 1 L стаканы. Добавить стерильную магнитной мешалки в каждом стакане; держать при 4 ° С.
- После шага 1,41, экстракт должен выглядеть мутным. Объединение экстракт в 1,5 мл аликвотах в 1,75 мл микро-центрифужные пробирки и центрифуги при 12000 г в течение 10 мин при 4 ° С.
- С помощью пипетки, консолидировать гранул без супернатанта в 15 мл пробирки Фалкон на льду, и хорошо перемешать путем ограничения трубку и обращая. Сохранить 10 мкл супернатанта на льду в течение шагом 1,47.
- Определите общее количество экстракта производится, и увлажняют необходимое количество 10k MWCO диализных кассет по погружением в S30B в течение 2 мин, предполагая, 2,5 мл экстракта в кассеты.
- Загрузка кассеты с 2,5 мл экстракта. Каждый стакан может занять до 2 кассет; диализировать, помешивая, при 4 ° С в течение 3 ч Примечание: частичная загрузка кассет является приемлемым.. Диализа увеличивает белковый выход продукции.
- В предыдущем шаге, характеризуют белковый экстрактКонцентрация с Бредфорда, используя экстракт сохраненный на шаге 1,44. См. дополнительные материалы 2 для деталей.
- После диализа будет завершена, экстракт Аликвота по 1,5 мл в 1,75 мл микро-трубки центрифуги. Центрифуге при 12000 г в течение 10 мин при 4 ° С. Осадок образует в нижней части трубки.
- Объединение прозрачного супернатанта из предыдущего шага с помощью пипетки в 15 мл сокола трубки на льду. Гомогенизируют путем обращения 5-10x.
- На основании концентрации, определенной в шаге Bradford 1,47, определяют количество экстракта аликвоту в отдельных 1,75 мл пробирки. Каждый отдельный трубка должна иметь объем с 810-900 мг общего белка. Экстракт должен иметь общую концентрацию белка больше, чем 27 мг / мл. Этот шаг требует помощи целесообразно проводить. Примечание: аликвоту экстракта ниже 30 мг / мл в 30 мкл аликвоты и масштаб если концентрация выше, например, экстракт аликвоту в 28 мг / мл к 30 мкл, и экстракт аликвоту в 32мг / мл по 28,1 мкл.
- Экстракт Алиготе Следующим шагом 1,50, заботясь, чтобы избежать пузырей. Экстракт флэш-замораживание в жидком азоте. Примечание: Аликвоты с пузырьками может быть удален центрифугированием при 10000 х г в течение 30 сек при 4 ° С.
- Снимите трубки из жидкого азота, используя фильтр и сразу хранить при температуре -80 ° C. безопасности: Носите защитные очки; колпачки из экстракта труб может оторваться из-за разности температур жидкого азота и комнатной температуре.
2. Аминокислоты Подготовка решения
Аминокислоты Решение должно быть подготовлено в объеме. Следующий рецепт использует один полный комплект из РТС аминокислот Sampler, поставляя достаточно для примерно 11000 отдельных реакций. Если сворачивают, рекомендуется использовать не менее половины комплекта. Каждой аминокислоте в наличии подается на 1,5 мл, 168 мМ, для лейцин в 140 мМ кроме. Окончательный состав аминокислот Решение:лейцин, 5 мМ, все остальные аминокислоты, 6 мм. Это 4x рабочей концентрации.
- Удалить все 20 аминокислот от -20 ° C и оттаивают при комнатной температуре. После оттаивания вихревой до аминокислоты не растворяются, инкубации при 37 ° С, если необходимо. После аминокислоты растворяются, поместить все аминокислоты на льду в течение Asn, Phe, и Cys, которые хранятся при комнатной температуре кроме. Cys могут не растворяться.
- На льдом, добавляют 12 мл стерильной воды в стерильную 50 мл сокола трубки.
- Добавить 1,5 мл каждой аминокислоты в следующем порядке, обращая внимание на вихрь трубки сокола после каждого добавления и держать на льду раствор: Ala, Arg, Asn, Asp, Gln, Glu, Gly, His, Ile, Lys, Встретил, Phe, Pro, Ser, Тре, Вал, Trp, Tyr, лей, Cys. Cys могут быть добавлены в виде суспензии. После того, вихрь, пока раствор не станет относительно ясно, инкубации при 37 ° С, если необходимо. Cys могут не растворяться.
- Алиготе Аминокислоты Решение в 50 пробирок в26 мкл каждого на льду. Алиготе отдохнуть в 500 мкл на пробирку на льду. В 26 мкл аликвоты будет использоваться для калибровки экстракт, в то время как 500 мкл аликвоты будет использоваться для подготовки буфер. Несмотря на то, аликвоты, вихрь основной фондовый часто, чтобы избежать неравномерного распределения суспензии.
- Ледяная вспышка аликвоты в жидком азоте и хранить при температуре -80 ° C. безопасности: Носите защитные очки; колпачки из экстракта труб может оторваться из-за разности температур жидкого азота и комнатной температуре.
- Дополнительно: Проведение анализа активности в новоиспеченной аминокислот решение против ранее сделанных аминокислоты Solutions.
3. Подготовка решения Энергетика
Energy Solution используется как для калибровки неочищенного клеточного экстракта и для создания буфера, и должны быть подготовлены в объеме. Следующий рецепт поставляет достаточно для примерно 10000 отдельных реакций. Если сворачивают, это recommended использовать не менее 1/24 от значений, приведенных здесь. Как Energy Solution является важным денежная стоимость, пользователи первый раз, возможно, захотите, чтобы подготовить в 1/24 масштабе. Окончательный состав энергетическое решение является следующим: HEPES рН 8 700 мМ, АТФ 21 мм, GTP 21 мм, CTP 12,6 мМ, UTP 12,6 мМ, тРНК 2,8 мг / мл, 3,64 мМ СоА, 4,62 мМ NAD, 10,5 мМ цАМФ, фолиновой кислоты 0,95 мм, Спермидин 14 мм, 3-PGA 420 мм. Это 14x рабочей концентрации. Если желательно, каждый отдельный элемент в таблице 4 можно хранить при -80 ° С для последующего использования.
- Удалить все химические вещества в таблице 4 от -80 ° С, -20 ° С или 4 ° С до комнатной температуры в течение 30 мин.
- Подготовка исходных растворов, как описано в таблице 4. См. дополнительные материалы 1 для рецептов. Поместите все решения на льду после приготовления.
- В 15 мл трубки Сокол, добавить в следующем порядке, заботясь, чтобы вихрь трубки сокола после каждого добавления и держать решения он лед: 3,6 мл 2 М HEPES, 144 мкл воды, 1,39 мл нуклеотид смесь, 576 мкл 50 мг / мл тРНК, 576 мкл 65 мМ КоА, 276 мкл 175 мМ NAD, 170 мкл 650 мМ цАМФ, 288 мкл 33,9 мМ фолиевой кислотой , 144 мкл 1 М спермидин, и 3,09 мл 1,4 М 3-PGA.
- Алиготе Energy Solution на 50 трубок на 7 мкл каждого на льду. Алиготе отдохнуть в 150 мкл на пробирку на льду. В 7 мкл аликвоты будет использоваться для калибровки экстракт, в то время как 150 мкл аликвоты будет использоваться для подготовки буфер. Несмотря на то, аликвоты, вихрь основной фондовый часто.
- Ледяная вспышка аликвоты в жидком азоте и хранить при температуре -80 ° C. безопасности: Носите защитные очки; колпачки из экстракта труб может оторваться из-за разности температур жидкого азота и комнатной температуре.
- Дополнительно: Проведение анализа активности из новоиспеченного Energy Solution против ранее сделанных Energy Solutions.
4. Подготовка буфера
Bufфер Подготовка требует завершения неочищенного клеточного экстракта Приготовление, аминокислоты приготовления раствора и приготовления раствора Energy. Каждый буфер является уникальным для выпечки неочищенного экстракта клеток. Mg-глутамат, К-глутамат, и DTT (в таком порядке) оптимизированы в этом разделе для получения реакции с максимальными уровнями экспрессии. Следующий протокол использует предварительно письменное шаблон, TXTL_e (шаблон) _calibration_JoVE.xlsx (дополнительного материала 3), для калибровки предварительно подготовленный неочищенного клеточного экстракта и подготовить буфер. Однако, можно также калибровать неочищенного клеточного экстракта и подготовить буфер без шаблона путем оптимизации Mg-глутамат, K-глутамат, и DTT вручную и создание буфера такой, что вместе с экстрактом, он составляет 75% от общего объема реакционной смеси. Если калибровки вручную, конечные реакционные условия могут быть найдены в шаге 5.
- Заполните форму "Общие данные".
- Thaw на льду 100 мМ Mg-глутамат (4 ° C), 3 М К-глутамат (4 ° С), 6Аминокислотный мМ раствор (26 мкл, -80 ° С), Energy Solution (7 мкл, -80 ° С), 100 мМ DTT (-20 ° C), положительный контроль ДНК (-20 ° C), 40% ПЭГ- . 8000 (4 ° С), неочищенного клеточного экстракта (-80 ° C), и вода (4 ° С) Примечание: Используйте 1 нМ рабочей концентрации pBEST-OR 2-OR 1-Пр-UTR1-deGFP-T500 (Addgene плазмиды 40019) для положительного контроля (возбуждение 485 нм, эмиссии 525 нм), или другой опорной который производит высокую интенсивность сигнала. 4
- Подготовьте семь 10,5 мкл реакции, тестирование диапазон 4-10 мм Дополнительная Mg-глутамата, на аликвоты поставленных объемов фондового Mg-глутамата в отдельных трубок микро-центрифуги. Примечание: Хотя 10,5 мкл реакции первоначально подготовлены, конечную реакционную смесь 10 мкл.
- Приготовить базовую смесь, как указано в шаблоне под "Mg-глутамата калибровки", добавив дополнительное 80 мМ K-глутамата. Держите на льду и вихря после добавления каждого элемента. Примечание: Значения, приведенные здесь и в шаблоне,в дополнение к суммам Mg-глутамата, K-глутамат, и DTT в буфере S30B, используемого для изготовления неочищенного клеточного экстракта.
- Добавить мастер микс образцов, содержащих Mg-глутамат и подготовить реакции. См. шаги 5,10 до 5,13 для получения подробных инструкций.
- Запуск реакции при 29 ° С, либо в инкубаторе или планшет-ридере.
- . Определить оптимальную Mg-глутамата концентрацию на уровне конечного выражения и максимальной скорости экспрессии белка (рис. 4а) Примечание: Время автономной работы варьироваться в зависимости от эксперимента, но, как правило, в прошлом под 8 часов.
- Повторите шаги 4,2 до 4,7 для K-глутамата в разделе "К-глутамата калибровки," установка Mg-глутамата уровни тем, которые содержатся в пункте 4.7.
- Повторите шаги 4,2 до 4,7 для DTT под "калибровки DTT," установка Mg-глутамата уровни тем, которые содержатся в пункте 4.7 и K-глутамата уровней к тем, которые содержатся в пункте 4.8. Примечание: Мы обнаружили, что добавил DTT не оказывает существенного влияния конец- уровни экспрессии.
- Использованиезначения, найденные в калибровке под "Буферная состава", чтобы определить состав буфера, который будет подготовлен. На основе количества неочищенному клеточному экстракту, полученного, Master Mix рецепт производится для определенного количества буферов.
- Оттепель аликвоты, которые перечислены в мастер-микс рецепт на льду. После оттаивания подготовить основной смеси, сохраняя на льду и вортексе после добавления каждого элемента.
- Алиготе на сумму, указанную в разделе "буфера композиции." Вспышка от замерзания буферные трубки в жидком азоте. Несмотря на то, аликвоты, вихрь основной фондовый часто.
- Снимите трубки из жидкого азота, используя фильтр и сразу хранить при температуре -80 ° C. безопасности: Носите защитные очки; колпачки из экстракта труб может оторваться из-за разности температур жидкого азота и комнатной температуре.
5. Экспериментальный Выполнение реакции TX-TL
Окончательные условия реакции являются: 8.9-9.9 мг / мл PROTEв (из сырого экстракта), 4,5 мМ 10,5 мМ Mg-глутамат, 40-160 мМ K-глутамат, 0.33-3.33 мМ ДТТ, 1,5 мМ каждого аминокислоту, кроме лейцина, 1,25 мМ лейцина, 50 мМ HEPES, 1,5 мМ АТФ и ГТФ, 0,9 ммоль CTP и UTP, 0,2 мг / мл тРНК, 0,26 мМ КоА, 0,33 мМ NAD, 0,75 мМ цАМФ, 0,068 мМ фолиевой кислоты, 1 ммоль спермидин, 30 мМ 3-PGA, 2% ПЭГ-8000. Основной Техас -TL реакция состоит из 3 частей (трубы): неочищенного клеточного экстракта, буфера и ДНК. Отношение это: 75% буфера и экстракт, 25% ДНК Реакции могут варьироваться в объеме, и мы используем 10 мкл по соглашению, чтобы минимизировать объем реакционной смеси и позволяют работать в 384-луночный планшет.. Большие объемы требуют агитацию за правильной оксигенации. Следующий протокол использует предварительно письменное шаблон, TXTL_JoVE.xlsx (дополнительного материала 4), для проведения реакции 10 мкл. Продукты в фиолетовый указывают пользователем входные значения, и элементы в синий указать дополнительные реагенты для добавления в реакции. Тем не менее, можно также провести реакции остроумиеХаут шаблон, следуя условий реакции, описанные выше.
- Заполните форму "Общие данные".
- В разделе "Мастер Mix подготовки," вставить процент экстракт значение, начиная с шага 4.1 в фиолетовую коробку.
- Создай свой эксперимент в кремнии с помощью "Master Mix Подготовка" (строки 10-17) и «Подготовка ДНК" (строки 19-50) разделы. Как правило, константы можно поместить в раздел «Master Mix Подготовка к уроку", в то время как переменные могут быть введены в разделе "Подготовка к ДНК". Свернуть проб в эксперименте, чтобы избежать испарение образца и экспериментальную начальную времени уклон. См. Рисунок 6 для установки образца.
- В разделе "Мастер Mix подготовки," добавить реагенты, такие как индукторы или белков, которые пойдут во всех образцах при постоянной концентрации. Начиная с ряда 14, заполнить синие затененные области, сохраняя один реагент для каждой линии. Единицы относительные коэффициенты.
- В разделе "Подготовка ДНК," добавить ДНК, который будет образец удельныймикросхемы. Примеры идентификаторов # 1 и # 2 соответствуют положительным и отрицательным контролем, соответственно. Примеры идентификаторов № 3 и выше, пользователь модифицируемые для ДНК, концентрация акции в нг / мкл, длина в парах оснований, желаемой конечной концентрации в нМ, и повторы (из 10 реакций мкл). Количество на складе ДНК, чтобы достичь желаемой конечной концентрации рассчитывается автоматически. . Общая через сумм строк до 10,5 * п, где п число повторов Примечание: Хотя конечный объем реакции 10 мкл, расчеты предполагают общий объем 10,5 мкл на реакцию, для учета объема потерянной во время пипетки.
- В разделе "Подготовка ДНК," добавить реагенты или дополнительной ДНК, который будет от образца к синим столбцов. Концентрации со ДНК в нМ можно вычислить по «Подготовка ДНК," в то время как образец конкретные реагенты требуют ручного расчет основан на общем реакционном объеме 10,5 * п. Введенные объемы вычитают из объема воды в той же строке.
- Удалить необходимую NumbeR труб буфера, неочищенного клеточного экстракта, а также положительного контроля в разделе "Трубы для оттепели" от -20 ° С или -80 ° С и оттаивают на льду.
- Подготовка образцов ДНК. Для каждого образца ID, аликвотой вне указанный ДНК, вода, и компоненты, поставляемые пользователем в разделе «Подготовка к ДНК" в микро-центрифуге трубки, при комнатной температуре. Примечание: во избежание потери образца, недавно откалиброван пипец и бюджетных палку пипеток и микро-центрифужные пробирки рекомендуется.
- Когда трубки с этапа 5,7 оттаивают, подготовить основной смеси, состоящей из буфера, экстракт, а также любые глобальные компоненты, поставляемые пользователем на основе оранжево-затененных клетках, сохраняя на льду и вортексе после добавления каждого элемента. Примечание: Экстракт чрезвычайно вязкой. Аликвоты с пузырьками может быть удален центрифугированием при 10000 х г в течение 30 сек при 4 ° С.
- Добавить количество мастер-микса, указанный в ячейки оранжевого в разделе "Подготовка ДНК" (колонка O) к каждому образцу ДНК, и держать при комнатной температуры. Считайте это время начала реакции.
- Vortex каждого образца, и центрифуге при 10000 х г в течение 30 сек при комнатной температуре сбить любой остаточной образца и уменьшить пузырьков.
- Если проведение реакции в микро-трубки центрифуги, инкубировать непосредственно при 29 ° C. . В противном случае, пипетки 10 мкл образца в 384-луночный планшет Примечание: Реакции в объеме более 10 мкл может потребовать агитацию за оксигенации.
- Центрифуга пластина на 4000 мкг в течение 30 сек при комнатной температуре сбить любой остаточной образца и уменьшить пузырьков. Уплотнение тарелку после для предотвращения испарения.
- Запуск реакции при 29 ° C. Примечание: Время автономной работы варьируется в зависимости от эксперимента, но обычно длятся в 8 часов.
Результаты
Мы представили протокол пятидневный для подготовки эндогенного кишечной палочки система экспрессии бесклеточный TX-TL на базе. Образец сроки для создания реагентов - неочищенного клеточного экстракта и буферные - можно найти на рисунке 1. После создания, они могут храниться при температуре -80 ° С в течение до одного года. После реагенты создаются, экспериментальная установка и исполнение может быть произведено менее чем за 8 часов.
Кроме того, мы оптимизировали условия экспрессии системы экспрессии бесклеточной TX-TL. Другие предоставленные пользователем дополнения, такие как буферы или растворов ДНК, должен быть откалиброван на токсичность заранее. Например, различные методы обработки плазмид привести к различным выражения в связи с содержанием солей. Мы также проверили эффект Трис-Cl буфера для элюции на эффективность реакции (рис. 5).
Примером сырой клеточного экстракта калибровки, ссылаясь шаг 4,1 до 4,9, показанона рисунке 4а. В общем, наши эксперименты показывают, что неочищенного клеточного экстракта является наиболее чувствительным к Mg-глутамата уровней, а затем K-глутамата уровнях. Чтобы продемонстрировать системы экспрессии клеток-бесплатно, мы построили и протестировали отрицательной обратной связи на основе тет репрессий. 26 (рис. 6). В системе экспрессии бесклеточной, тот же самый пробег цепи с и без ATC показывает 7-кратное конечной точки изменения экспрессии deGFP репортера после восьми часов выражения. Хотя этот эксперимент не требует глобальных индукторов или репрессоры, в случае необходимости они могут быть добавлены в "Мастер Mix Подготовка».
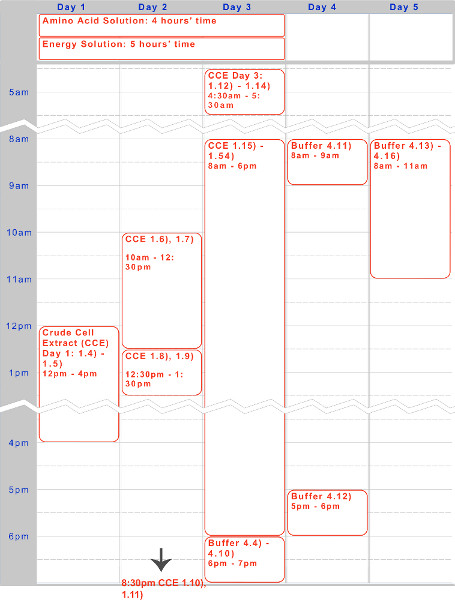
Рисунок 1. Срок неочищенного экстракта клеток, решения аминокислот, а также подготовка энергетического решения. Пятидневная timelin э для типичного выполнения протокола приведена выше, оптимизирован для ночлега инкубации и дневных этапов работы.
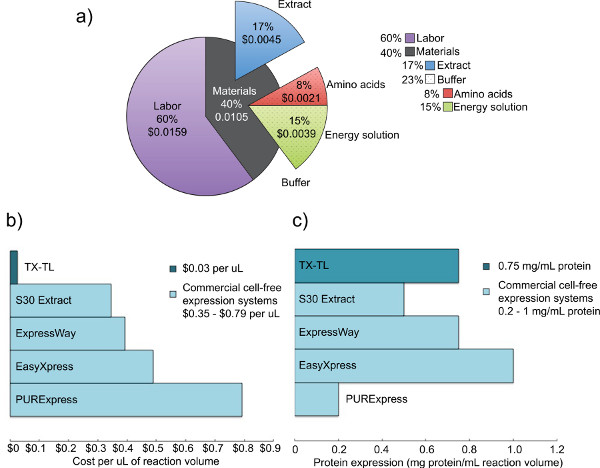
Рисунок 2. Анализ затрат и выражение конкурирующих сырых клеточных экстрактов,. а) Распределение затрат труда и материалов системы экспрессии бесклеточной TX-TL. На основе затрат реагентов на декабрь 2012 года, и расходов на оплату труда в размере $ 14 в час. Б) Сопоставление TX-TL системных затрат выражение бесклеточных против других коммерческих систем. Затраты разбиты на мкл, хотя объемы реакции могут варьироваться в зависимости от комплекта. С) Сравнение с TX-TL бесклеточной выходом системы выражение против других коммерческих систем. Выход выражение белка определяется стандартами производителя./ 50762fig2large.jpg "целевых =" _blank "> Нажмите здесь, чтобы увеличить рисунок.

Рисунок 3. Загрузка и обработка шарик избиение трубки. а) Демонстрация правильной вязкости клеточной борта решения. Cell-шарик решение будет иметь вязкость в зависимости от многих факторов, в том числе количества S30A буфера добавленной, количество шариков добавили, и время, проведенное на льду. Б) Загрузка из бисера избиение трубки до быстрого настольного центрифугирования. Центрифугирования удаляет пузыри накопленные во время загрузки. С) Пузыри наплавки после настольного центрифугирования. Размер пузырьков будет меняться, они могут быть очищен или удалить с помощью пипетки D) полностью заполнен шарик-бить трубку до укупорки.. Мениск формируется в шарик-бить тУбе, а крышка имеет достаточно, чтобы покрыть и вызвать небольшое количество переполнять. е) правильно загружена фильтрующее устройство. Они могут быть использованы повторно. Е) Сравнение правильно против неправильно обработанного борта избиение трубки. Трубка слева является хорошо бить труба - она имеет небольшой и хорошо очерченное верхний слой, и очень прозрачного супернатанта. Трубка справа не является оптимальным, по большему, туманной второго слоя и туманной супернатанта. Трубы, которые неоптимальным не должны подвергаться дополнительной обработке.
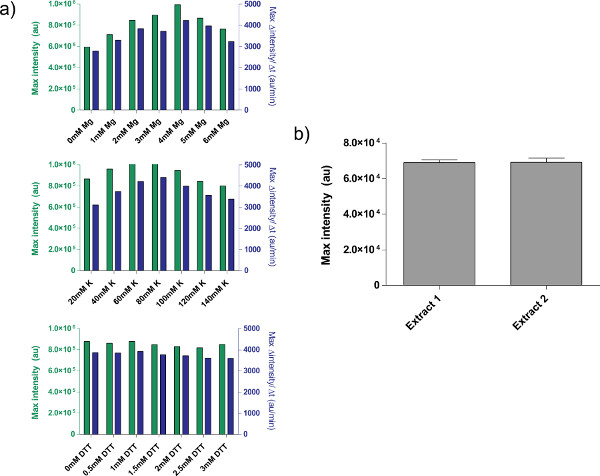
Рисунок 4. Свойства неочищенный экстракт препаратов. а) Типичные зависимости калибровки для неочищенного экстракта клеток. Сырой экстракт калибруется для дополнительного Mg-глутамата, K-глутамат, и уровни DTT, в указанном порядке. Показана конечная точка fluorescencе после 8 часов, а также максимальной скорости производства белка на основе 12 минут скользящего среднего. Основываясь на этих участках, приемлемый диапазон дополнительного Mg-глутамата составляет 4 мм, К-глутамат 60-80 мМ, и DTT 0-3 мм. Обратите внимание, что каждый сырой экстракт нуждается в калибровке независимо для этих трех переменных. Б) Отклонение от выписки препаратов. Конечная точка флуоресценции двух неочищенных экстрактов, приготовленных на разные даты показано; об ошибках бары 1 стандартное отклонение от трех независимых трасс в разные дни. Нажмите здесь, чтобы увеличить рисунок .
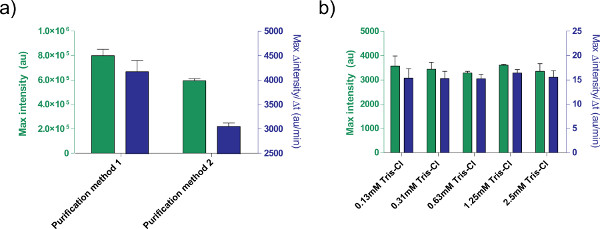
Рисунок 5. Влияние раствора ДНК на эффективность экспрессии. а) Сравнение двух различных очисткиметоды обработки плазмиды. 1 нМ pBEST-OR2-OR 1-PR-UTR1-deGFP-T500 получают, используя только комплект Qiaprep Спин Miniprep (способ очистки 1) или после обработки с набор для очистки ПЦР QIAquick (способ очистки 2). Показана конечной точки флуоресценции после 8 часов, а также максимальной скорости производства белка на основе 12 минут скользящего среднего. Столбики ошибок равны 1 стандартное отклонение от четырех независимых трасс в разные дни. Б) Влияние элюирующего буфера (Трис-Cl). Различные концентрации трис-Cl сопоставлены в реакции экспрессии бесклеточной на основе выражения 1 нМ pBEST-OR2-OR 1-PR-UTR1-deGFP-T500. Концентрации даны конечные концентрации трис-Cl в реакции; элюирование буфер, используемый в 10 мМ Трис-Cl. Усы являются 1 стандартное отклонение от трех независимых трасс в разные дни. Нажмите здесь, чтобы увеличить рисунок .
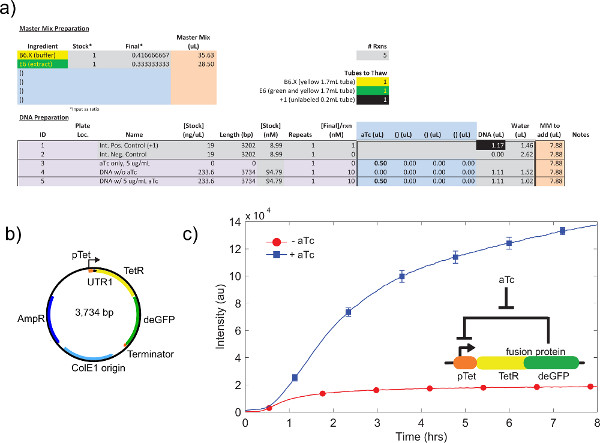
Рисунок 6. Образец TX-TL пробег отрицательной обратной связи. а) установки Образец реакции выполнения бесклеточной. Испытания "на" против "выключено" состояние отрицательной обратной связи, с положительным и отрицательным контролем. Б) карта плазмиды отрицательной обратной связи. С) Представитель результаты. Данные отражает эксперимент в а) и б), с отрицательным контролем вычитается из сигнала. Генетическая схема, показанная на вставке. Усы являются 1 стандартное отклонение от трех независимых трасс в разные дни. Нажмите здесь, чтобы увеличить рисунок .
| Название | Концентрация | Количество | Стерилизация | Примечания |
| Хлорамфеникол (См) | 34 мг / мл в этаноле | 1 мл | Фильтр стерилизуют (0,22 мкМ) | Могут быть сделаны в больших объемах хранили при -20 ° С для последующего использования. |
| 2xYT + Р + Ст агар | 31 г / л 2xYT, 40 мМ двухосновный фосфат калия, 22 мМ однозамещенный фосфат калия, 34 мкг / мл хлорамфеникола | 1 пластина | Автоклав | |
| 2xYT + Р СМИ | 31 г / л 2xYT, 40 мМ двухосновный фосфат калия, 22 мМ однозамещенный фосфат калия | 4 л | Автоклав |
Таблица 1. Реагенты для 1-й день протокола неочищенного клеточного экстракта.
| Название | Концентрация | Количество | Стерилизация | Примечания |
| Трис-основание | 2 М | 250 мл | Фильтр стерилизуют (0,22 мкМ) или автоклав | Может храниться при комнатной температуре. |
| DTT | 1 М | 6 мл | Фильтр стерилизуют (0,22 мкМ) | Могут быть сделаны в больших объемах и хранили при -20 ° С для последующего использования. |
| S30A буфер | 14 мМ Mg-глутамат, 60 мМ K-глутамат, 50 мМ Трис, рН 7,7 | 2 л | Автоклав | Для достижения рН 7,7, титруют уксусной кислоты. Добавить DTT 2 мМ конечной концентрации непосредственно перед использованием. Хранить при 4 ° С. |
| S30B буфер | 14 мМ Mg-глутамат, 60 мМ K-глутамат, ~ 5 мМ Трис, рН 8,2 | 2 л | Автоклав | Для достижения рН 8,2, титруют 2МТрис. Добавить DTT в 1 мМ конечной концентрации непосредственно перед использованием. Хранить при 4 ° С. |
Таблица 2. Реагенты для 2-й день протокола неочищенного клеточного экстракта.
| Сокол | ||||
| 1 | 2 | 3 | 4 | |
| Пустой 50 мл Falcon (г) | ||||
| 50 мл Сокол с таблеткой (г) | ||||
| Пелле масса (50 мл Сокол с таблеткой - пустая 50 мл Сокол) (г) | ||||
| S30A объем буфера, чтобы добавить (пеллет масса * 0,9) (мл) | ||||
| Общая масса шариков, чтобы добавить (пеллет масса * 5.0) (г) | ||||
Таблица 3. Буфера S30A и масса калькулятор шарик, за день 3 протокола неочищенного клеточного экстракта.
| Название | Концентрация | Количество | Стерилизация | Примечания |
| HEPES | 2 М, рН 8 | 4 мл | Ни один | Для достижения рН 8, титруют КОН. |
| Нуклеотидов Mix | 156 мМ АТФ и ГТФ, 94 мм CTP и UTP, рН 7,5 | 1,5 мл | Ни один | Для достижения рН 7,5, титруют КОН. |
| тРНК | 50 мг / мл | 600 мкл | Ни один | |
| КоА | 65 мм | 600 мкл | Ни один | |
| NAD | 175 мМ, рН 7,5-8 | 300 мкл | Ни один | Для достижения рН 7,5-8, титруют Трис на 2 М. |
| цАМФ | 650 мМ, рН 8 | 200 мкл | Ни один | Для достижения рН 8, титруют Трис на 2 М. |
| Фолиевой кислотой | 33,9 мМ | 300 мкл | Ни один | Хотя всего в 300 мкл необходима, рецепт на дополнительные для 1,15 мл. |
| Спермидин | 1 М | 150 мкл | Ни один | Хранить при 4 ° С, нагревают до 37 ° С, чтобы расплавить. |
| 3-PGA | 1,4 М, рН 7,5 | 3,2 мл | Ни один | Для достижения рН 7,5, титруют Трис на 2 М. |
Таблица 4. Реагенты для подготовки к протоколу Energy Solution.
Справочная Материал 1. Рецепты для элементов.
Хлорамфеникол, 34 мг / мл: Подготовка 0,51 г хлорамфеникол и добавить этанол до 15 мл. Фильтр стерилизуют (0,22 мкМ), аликвоту в 1 мл труб, хранить при -20 ° С для последующего использования.
2xYT + Р + Ст агар: Подготовка 1,24 г 2xYT, 1,6 мл двухосновного фосфата калия решение на расстоянии 1 м, 0,88 фосфат однозамещенный решение мл калия @ 1 M, 0,6 г агара и воды до 40 мл. Автоклав. Дайте остыть до 50 ° С и добавить 40 мкл Ст. Алиготе 25 мл в 100 х 15 мм чашки Петри, и дайте остыть в течение часа.
2xYT + P СМИ: Подготовка 124 г 2xYT, 160 фосфата мл калия двухосновную решение на расстоянии 1 м, 88 мл фосфат калия однозамещенный решение на расстоянии 1 м, и воды в 4 Л. AliquOT вне в 2 х 1,88 л и 0,24 L. Автоклав.
Трис-основание, 2 М: Подготовка 60,57 г трис-основание и воду до 250 мл. Стерилизовать, хранить при комнатной температуре для последующего использования.
DTT, 1 М: Подготовка 2,31 г DTT и воду до 15 мл. Фильтр стерилизуют (0,22 мкМ), аликвоту в 1 мл труб, хранить при -20 ° С для последующего использования.
S30A буфера: Подготовка 10,88 г Mg-глутамат и 24,39 г K-глутамат, 50 мл Трис на 2М, уксусной кислоты (до рН 7,7), и вода до 2 Л. Автоклав, хранят при температуре 4 ° С, добавить 4 мл 1 М DTT перед использованием.
S30B буфера: Подготовка 10,88 г Mg-глутамат и 24,39 г K-глутамат, Трис на 2 м (к рН 8,2), и вода до 2 Л. Автоклав, хранят при температуре 4 ° С, добавить 2 мл 1 М DTT перед использованием.
HEPES: Подготовка 1,91 г HEPES (MW 238,21), KOH (рН 8) и воду в 4 мл.
тРНК: Подготовка 30 мг тРНК и воду до 600 мкл.
КоА: Подготовка 30 мг кофермента (MW 767,53) и воду до 600 мкл.
NAD: Добавить 34,83 мг NAD (MW 663,43), трис на 2 м (до рН 7,5-8) и воду до 300 мкл. (Добавить 27 мкл Трис на 2 М довести раствор до рН 7,5-8).
цАМФ: Добавить 42,80 мг цАМФ (MW 329,22), трис на 2 м (до рН 8) и воду до 200 мкл. (Добавить 73 мкл Трис на 2 М довести раствор до рН 8).
Фолиновой кислоты (33,9 мм): 20 мг твердой соли кальция фолиновой кислоты (MW 511,5), добавьте 1,15 мл воды.
Спермидин: Подготовка 23,55 мкл спермидин (MW 145,25) и воду до 150 мкл. Подготовка при комнатной температуре после кратко плавления при 37 ° С
3-PGA: Добавить 1,03 г 3-ФГА (MW 230,02), трис на 2 м (до рН 7,5) и воды до 3,2 мл. (Добавить 1,73 мл трис на 2 М довести раствор до рН 7,5).
Nucleotязь Mix: Добавить 145 мг АТФ дикалиевой соли дигидрата (МВт 619,4), 133 мг GTP динатриевой соли (МВт 567,14), 79,4 мг CTP дигидрат динатриевой соли (МВт 563,16), 82,6 мг UTP тринатрия соли дигидрата (МВт 586,12) , KOH в 15% разбавления (до рН 7,5), и воды 1,5 мл. (Добавить 353 мкл КОН в 15% разведении довести раствор до рН 7,5).
Справочная Материал 2. Брэдфорд Анализ.
- Удалить Bradford агента от 4 ° С и установить при комнатной температуре.
- Подготовка 50 мкл BSA стандарт в концентрации 1 мг / мл и 0,1 мг / мл.
- Подготовка 40 мкл 20x разбавление экстракта с шага 1,47.
- Добавить 800 мкл воды до 7 кювет.
- Подготовка стандартных кюветы для 0 мг / мл, 1 мг / мл (10 мкл 0,1 мг / мл BSA), 2 мг / мл (20 мкл 0,1 мг / мл BSA), 4 мг / мл (4 мкл 1 мг / мл BSA) , 6 мг / мл (6 мкл 1 мг / мл BSA).
- Подготовка кюветы экспериментальные течение 2 мкл образца и 4 мкл образца.
- Добавить 200 мкл Брэдфорд агента в каждую кювету и хорошо перемешать бу пипетки. Инкубируют при комнатной температуре в течение по крайней мере 10 мин.
- Производить стандартную кривую на OD 595 нм с использованием кюветы с шага 6.5. Отклонить стандартную кривую, если г 2 <0,95.
- Определить концентрацию экстракта в OD 595 нм с использованием кюветы с шага 6.6.
Справочная Материал 3. Буфер калибровки таблицу.
Смотреть TXTL_e (шаблона) _calibration_JoVE.xlsx .
Справочная Материал 4. Выражение сотовый без запуска таблицу.
Обсуждение
Эндогенный кишечная палочка основе система экспрессии бесклеточный TX-TL, описанный здесь, простой в перспективе реакция три трубки, что может занять менее восьми часов от созданной для сбора данных. Процесс создания все реагенты требуется пять раз общей дней (с значительными потребностями труда на один день), но производит сырой экстракт для 3000 реакций и буфер решений реагенты для 10000 реакций (рис. 1). Кроме того, неочищенный экстракт и буфер решений реагенты стабильны в течение не менее 1 года при -80 ° С, что позволяет многократное использование одного препарата. 4 При цене $ 0,11 за 10 реакции мкл ($ 0.26 в том числе труда), расходы на 98% ниже, чем сравнимы коммерческие системы (рис. 2).
Есть некоторые нерешенные ограничений, однако, к системе. Конец эффективность каждого препарата неочищенного клеточного экстракта может меняться в зависимости от пользователя знания и от условий окружающей среды, хотя тypical изменение доходности между 5-10% (рис. 4, б). В результате, от партии к партии изменчивость как выражение конечной точки и в динамике экспрессии следует ожидать. Эти изменения, вероятно, останется до тех пор, экстракт не полностью характеризуется или пока создание экстракт не полностью автоматизирована. Если система экспрессии бесклеточной используется для проведения чувствительные количественные эксперименты, желательно, чтобы запустить все эксперименты с той же самой партии неочищенного экстракта клеток. Выход из одного неочищенного клеточного экстракта партии, около 3000 реакций, должно быть достаточно для типичных экспериментальных курсов. Хотя мы полагаем, изменение может быть удалена путем расширения и автоматизации процедуры, такие попытки предполагает значительные инвестиции ресурсов.
Кроме того, хотя уровни экспрессии конечная точка находятся достаточно легко определить, многое еще предстоит сделать в динамике понимание собственных в бесклеточной системе. Известно, что оба КОНКУРСОВ ресурсп и ресурс ограничение может повлиять на динамику экспрессии. Например, ограниченный эндогенный сигма 70 может привести к насыщающего режима с матричной ДНК увеличилась получения профиля экспрессии, аналогичную истощения нуклеотидной или аминокислотной последовательности. 9,27 Тем не менее, динамика не должны быть полностью поняты, чтобы использовать систему. Для чистых увеличивается доходности, оптимизация может быть сделано путем подходов машинного обучения. 28 Вопросы конкурса ресурсов и ограничения могут быть решены с помощью математических моделей проверяется с использованием экспериментальных данных.
Протокол, представленные здесь оптимизирован для штамма BL21-Rosetta2, но распространены на другой E. штаммы кишечной палочки. Изменения в BL21-Rosetta2, такие как удаление гена, кодирующего Lon-протеиназы и добавление генов, кодирующих редкие тРНК, позволяют для максимальной продукции белка. Мы попытались протокол с двумя другими штаммами выписки - BL21 только и BL21 trxA нокаутом-ANд найдено на 50% меньше выход белка. Мы предполагаем, что доходность же уменьшить при использовании других штаммов. Другие изменения в параметры, такие как переключение 2xYT питательную среду для LB и других богатых бульонов, привели к снижению урожайности белка.
Системы экспрессии Бесклеточные использованием как эндогенный и экзогенный механизм транскрипции-трансляции и механизмы регулирования имеют широкое применение в белка и выражения метаболита и в синтетической биологии. 3,29 Вместо того, чтобы ограничиваться T7-регулируется схем, можно представить себе производство сложных биомолекул в удобной для пользователя управляемой обстановке, используя сочетание родного Е. палочки промоутеры и экзогенно транскрипции и регулирования механизмов. Без ограничений разделения и клеточного метаболизма, изменчивость в синтетических схем, таких как repressilator или в метаболических путей инженерии, таких как тех, кто производит артемизинина может быть уменьшено или более понятными. 30,31 Мы ВГАэ использовали эти преимущества для реализации генетических переключателей, а также понять, сигма секвестр фактор 9,32 Такая технология может также формируют основу «минимальный» или «искусственных» клеток -. маленький, хорошо характеризуется и самодостаточных воплощенных единиц Экстракт. 33,34
В конечном счете, мы ожидаем немедленных использования этого эндогенного системы экспрессии бесклеточной как прототипирования среды для синтетической биологии. Прозвище "TX-TL биомолекулярных макет," система экспрессии бесклеточный обеспечивает контролируемый среду, в которой синтетические схемы в конечном счете, предназначенный для естественных выражения в может пройти раундов прототипирования - циклы тестирования по основам плазмиды, линейные, или химически синтезированные ДНК, а затем анализом и быстрого изменения. Прототипирования раундов можно опираясь на прогнозных математических моделей в настоящее время разрабатываются. Удаляя клонирование и в естественных условиях манипуляции для не-оконечных цепей, мы ожидаем, Энгираз neering цикла должны быть сокращены до 1-3 дней вместо стандарта что на данный момент недель.
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Благодарности
Мы благодарим Jongmin Ким, Дэн Сигал-Gaskins Ану Thubagere и Еноха Yeung за помощью рационализации протокол, и Клэр Чен и Barclay Ли за помощью на ранних стадиях проекта. Этот материал основан на работе, поддержанной частично обороны Агентства перспективных исследовательских проектов (DARPA / МТО) программа Жилая, литье номер контракта HR0011-12-C-0065 (DARPA / CMO.ZZS также поддерживается UCLA / Caltech ученый-медик общение Программа обучения и МО, ВВС Управления научных исследований, Национальной оборонной науки и инженерной Высшей (NDSEG) стипендий, 32 CFR 168а. Мнения и выводы, содержащиеся в этом документе, являются мнениями авторов и не должны интерпретироваться как представление официально политики, прямо или подразумеваемые, от перспективных исследований Министерства обороны агентства или американского правительства.
Материалы
| Name | Company | Catalog Number | Comments |
| 2xYT | MP biomedicals | 3012-032 | |
| 3-PGA | Sigma-Aldrich | P8877 | |
| ATP | Sigma-Aldrich | A8937 | |
| Bacto-agar | BD Diagnostics | 214010 | |
| Bead-beating tubes (polypropylene microvials) | BioSpec | 522S | |
| Beads, 0.1mm dia. | BioSpec | 11079101 | |
| BL21 Rosetta 2 E. coli strain | Novagen | 71402 | |
| Bradford BSA Protein Assay Kit | Bio-rad | 500-0201 | |
| cAMP | Sigma-Aldrich | A9501 | |
| Chloramphenicol | Sigma-Aldrich | C1919 | |
| CoA | Sigma-Aldrich | C4282 | |
| CTP | USB | 14121 | |
| Cuvettes, 1.5ml | Fisher | 14-955-127 | |
| DTT | Sigma-Aldrich | D0632 | |
| Folinic acid | Sigma-Aldrich | F7878 | |
| GTP | USB | 16800 | |
| HEPES | Sigma-Aldrich | H6147 | |
| K-glutamate | Sigma-Aldrich | G1149 | |
| Mg-glutamate | Sigma-Aldrich | 49605 | |
| Micro Bio-Spin Chromatography Columns | Bio-Rad | 732-6204 | |
| NAD | Sigma-Aldrich | N6522 | |
| Nunc 384-well optical bottom plates | Thermo-Scientific | 142761 | |
| Nunc sealing tape | Thermo-Scientific | 232701 | |
| PEG-8000 | Promega | V3011 | |
| Potassium phosphate dibasic solution | Sigma-Aldrich | P8584 | |
| Potassium phosphate monobasic solution | Sigma-Aldrich | P8709 | |
| RTS Amino Acid Sampler | 5 Prime | 2401530 | |
| Slide-A-Lyzer Dialysis Cassettes, 10k MWCO (Kit) | Thermo-Scientific | 66382 | |
| Spermidine | Sigma-Aldrich | 85558 | |
| Tris base | Fischer | BP1521 | |
| tRNA (from E. coli) | Roche Applied Science | MRE600 | |
| UTP | USB | 23160 | |
| 1L Centrifuge Bottle | Beckman-Coulter | A98813 | This is specific for Avanti J-series; obtain equivalent size for centrifuge in use. |
| 4L Erlenmeyer Flask | Kimble Chase | 26500-4000 | |
| Avanti J-26XP Centrifuge | Beckman-Coulter | 393127 | Or 1L-capable centrifuge equivalent. |
| Forma 480 Orbital Shaker | Thermo Scientific | 480 | Or chest-size 6x4L shaker equivalent. |
| JLA-8.1000 Rotor | Beckman-Coulter | 363688 | Or 1L-capable, 5000 x g rotor equivalent for centrifuge. |
| Mini-Beadbeater-1 | BioSpec | 3110BX | |
| Supplemental Material 1. Recipes for Items. Chloramphenicol, 34 mg/ml: Prepare 0.51 g chloramphenicol and add ethanol to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. 2xYT+P+Cm agar plate: Prepare 1.24 g 2xYT, 1.6 ml potassium phosphate dibasic solution @ 1 M, 0.88 ml potassium phosphate monobasic solution @ 1 M, 0.6 g agar, and water to 40 ml. Autoclave. Let cool to 50 °C and add 40 μl Cm. Aliquot 25 ml into a 100x15 mm petri dish, and let cool for an hour. 2xYT+P media: Prepare 124 g 2xYT, 160 ml potassium phosphate dibasic solution @1 M, 88 ml potassium phosphate monobasic solution @ 1 M, and water to 4 L. Aliquot out into 2x1.88 L and 0.24 L. Autoclave. Tris base, 2 M: Prepare 60.57 g Tris base and water to 250 ml. Sterilize, store at RT for later use. DTT, 1 M: Prepare 2.31 g DTT and water to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. S30A buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, 50 ml Tris at 2M, acetic acid (to pH 7.7), and water to 2 L. Autoclave, store at 4 °C, add 4 ml 1 M DTT before use. S30B buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, Tris at 2 M (to pH 8.2), and water to 2 L. Autoclave, store at 4 °C, add 2 ml 1 M DTT before use. HEPES: Prepare 1.91 g HEPES (MW 238.21), KOH (to pH 8), and water to 4 ml. tRNA: Prepare 30 mg of tRNA and water to 600 μl. CoA: Prepare 30 mg of CoA (MW 767.53) and water to 600 μl. NAD: Add 34.83 mg of NAD (MW 663.43), Tris at 2 M (to pH 7.5-8), and water to 300 μl. (Add 27 μl of Tris at 2 M to bring the solution to pH 7.5-8). cAMP: Add 42.80 mg of cAMP (MW 329.22), Tris at 2 M (to pH 8), and water to 200 μl. (Add 73 μl of Tris at 2 M to bring the solution to pH 8). Folinic Acid (33.9 mM): To 20 mg of solid folinic acid calcium salt (MW 511.5), add 1.15 ml water. Spermidine: Prepare 23.55 μl of spermidine (MW 145.25) and water to 150 μl. Prepare at room temperature after melting briefly at 37 °C. 3-PGA: Add 1.03 g of 3-PGA (MW 230.02), Tris at 2 M (to pH 7.5), and water to 3.2 ml. (Add 1.73 ml of Tris at 2 M to bring the solution to pH 7.5). Nucleotide Mix: Add 145 mg of ATP dipotassium salt dihydrate (MW 619.4), 133 mg of GTP disodium salt (MW 567.14), 79.4 mg of CTP disodium salt dihydrate (MW 563.16), 82.6 mg of UTP trisodium salt dihydrate (MW 586.12), KOH at 15% dilution (to pH 7.5), and water to 1.5 ml. (Add 353 μl of KOH at 15% dilution to bring the solution to pH 7.5). Supplemental Material 2. Bradford Assay.
See TXTL_e(template)_calibration_JoVE.xlsx. Supplemental Material 4. Cell-free expression run spreadsheet. See TXTL _JoVE.xlsx. | |||
Ссылки
- Noireaux, V., Bar-Ziv, R., Libchaber, A. Principles of cell-free genetic circuit assembly. Proceedings of the National Academy of Sciences of the United States of America. 100, 12672-12677 (2003).
- He, M. Y., He, Y. Z., Luo, Q., Wang, M. R. From DNA to protein: No living cells required. Process Biochem. 46, 615-620 (2011).
- Forster, A. C., Church, G. M. Synthetic biology projects in vitro. Genome Res. 17, 1-6 (1101).
- Shin, J., Noireaux, V. Efficient cell-free expression with the endogenous E. Coli RNA polymerase and sigma factor 70. Journal of biological engineering. 4, 8 (2010).
- Shimizu, Y., et al. Cell-free translation reconstituted with purified components. Nat Biotechnol. 19, 751-755 (2001).
- Shin, J., Noireaux, V. An E. coli Cell-Free Expression Toolbox: Application to Synthetic Gene Circuits and Artificial Cells. Acs Synth Biol. 1, 29-41 (2012).
- Shin, J., Noireaux, V. Study of messenger RNA inactivation and protein degradation in an Escherichia coli cell-free expression system. Journal of biological engineering. 4, 9 (2010).
- Shin, J., Jardine, P., Noireaux, V. Genome Replication, Synthesis, and Assembly of the Bacteriophage T7 in a Single Cell-Free Reaction. Acs Synth Biol. 1, 408-413 (2012).
- Siegal-Gaskins, D., Noireaux, V., Murray, R. M., Pao, L., Abramovitch, D. Biomolecular resource utilization in elementary cell-free gene circuits. , 1531-1536 (2013).
- Karzbrun, E., Shin, J., Bar-Ziv, R. H., Noireaux, V. Coarse-grained dynamics of protein synthesis in a cell-free system. Physical review letters. 106, 048104 (2011).
- Hoagland, M. B., Stephenson, M. L., Scott, J. F., Hecht, L. I., Zamecnik, P. C. Soluble Ribonucleic Acid Intermediate in Protein Synthesis. J Biol Chem. 231, 241-257 (1958).
- Wood, W. B., Berg, P. Effect of Enzymatically Synthesized Ribonucleic Acid on Amino Acid Incorporation by a Soluble Protein-Ribosome System from Escherichia Coli. Proceedings of the National Academy of Sciences of the United States of America. 48, 94 (1962).
- Zubay, G. In-Vitro Synthesis of Protein in Microbial Systems. Annu Rev Genet. 7, 267-287 (1973).
- Pratt, J. M., Hames, B. D., Higgins, S. J. . Transcription and Translation: A Practical Approach. , 179-209 (1984).
- Kim, H. C., Kim, D. M. Methods for energizing cell-free protein synthesis. Journal of bioscience and bioengineering. 108, 1-4 (2009).
- Michel-Reydellet, N., Calhoun, K., Swartz, J. Amino acid stabilization for cell-free protein synthesis by modification of the Escherichia coli genome. Metabolic engineering. 6, 197-203 (2004).
- Liu, D. V., Zawada, J. F., Swartz, J. R. Streamlining Escherichia coli S30 extract preparation for economical cell-free protein synthesis. Biotechnology progress. 21, 460-465 (2005).
- Andrianantoandro, E., Basu, S., Karig, D. K., Weiss, R. Synthetic biology: new engineering rules for an emerging discipline. Molecular systems biology. 2, 2006.0028 (2006).
- Kwok, R. Five hard truths for synthetic biology. Nature. 463, 288-290 (2010).
- Tabor, S., Richardson, C. C. A bacteriophage T7 RNA polymerase/promoter system for controlled exclusive expression of specific genes. Proceedings of the National Academy of Sciences of the United States of America. 82, 1074-1078 (1985).
- Lewicki, B. T., Margus, T., Remme, J., Nierhaus, K. H. Coupling of rRNA transcription and ribosomal assembly in vivo. Formation of active ribosomal subunits in Escherichia coli requires transcription of rRNA genes by host RNA polymerase which cannot be replaced by bacteriophage T7 RNA polymerase. Journal of molecular biology. 231, 581-593 (1993).
- Iskakova, M. B., Szaflarski, W., Dreyfus, M., Remme, J., Nierhaus, K. H. Troubleshooting coupled in vitro transcription-translation system derived from Escherichia coli cells: synthesis of high-yield fully active proteins. Nucleic acids research. 34, e135 (2006).
- Kigawa, T., et al. Preparation of Escherichia coli cell extract for highly productive cell-free protein expression. Journal of structural and. 5, 63-68 (2004).
- Matsuda, T., et al. Improving cell-free protein synthesis for stable-isotope labeling. Journal of biomolecular. NMR. 37, 225-229 (2007).
- Sitaraman, K., et al. A novel cell-free protein synthesis system. Journal of biotechnology. 110, 257-263 (2004).
- Becskei, A., Serrano, L. Engineering stability in gene networks by autoregulation. Nature. 405, 590-593 (2000).
- Maeda, H., Fujita, N., Ishihama, A. Competition among seven Escherichia coli sigma subunits: relative binding affinities to the core RNA polymerase. Nucleic acids research. 28, 3497-3503 (2000).
- Caschera, F., et al. Coping with complexity: machine learning optimization of cell-free protein synthesis. Biotechnology and bioengineering. 108, 2218-2228 (2011).
- Hodgman, C. E., Jewett, M. C. Cell-free synthetic biology: thinking outside the cell. Metabolic engineering. 14, 261-269 (2012).
- Elowitz, M. B., Leibler, S. A synthetic oscillatory network of transcriptional regulators. Nature. 403, 335-338 (2000).
- Tsuruta, H., et al. High-level production of amorpha-4,11-diene, a precursor of the antimalarial agent artemisinin, in Escherichia coli. Plos One. 4, e4489 (2009).
- Gardner, T. S., Cantor, C. R., Collins, J. J. Construction of a genetic toggle switch in Escherichia coli. Nature. 403, 339-342 (2000).
- Jewett, M. C., Forster, A. C. Update on designing and building minimal cells. Current opinion in biotechnology. 21, 697-703 (2010).
- Noireaux, V., Libchaber, A. A vesicle bioreactor as a step toward an artificial cell assembly. Proceedings of the National Academy of Sciences of the United States of America. 101, 17669-17674 (2004).
Erratum
Formal Correction: Erratum: Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology
Posted by JoVE Editors on 1/01/1970. Citeable Link.
A correction to Figure 5's legend has been made for the article Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology. Method 1 and method 2 have been switched.Z
The figure legend was update from:
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 1) or post-processed with a QiaQuick PCR purification kit (Purification method 2).
to
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 2) or post-processed with a QiaQuick PCR purification kit (Purification method 1).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены