Method Article
פרוטוקולים ליישום
* These authors contributed equally
In This Article
Erratum Notice
Summary
פרוטוקול של חמישה ימים זה מתאר את כל השלבים, ציוד ותוכנה נוספת דרושה ליצירה והפעלת מערכת ביטוי תא ללא TX-TL מאפס חיידקי Escherichia אנדוגני יעילים מבוססים. עם חומרים כימיים, הפרוטוקול לוקח 8 שעות או פחות להגדרת תגובה, לאסוף, ולעבד נתונים.
Abstract
מערכות ביטוי תא ללא אידיאלית באופן תיאורטי יכולות לחקות סביבה תאית in vivo שבשליטה בפלטפורמת מבחנה. 1 זו שימושית לביטוי חלבונים ומעגלים גנטיים באופן מבוקר, כמו גם למתן סביבת דיגום לביולוגיה סינתטית. 2,3 כדי להשיג את המטרה האחרונה, מערכות ביטוי תא ללא שלשמר מנגנוני שעתוק-תרגום חיידקי Escherichia אנדוגני הם מסוגלים לשקף בצורה מדויקת יותר in vivo דינמיקה הסלולר יותר מאלו המבוססים על שעתוק RNA פולימראז T7. אנו מתארים את ההכנה וביצוע של א אנדוגני יעיל מערכת ביטוי תמלול בתרגום מבוסס coli (TX-TL) ללא תא שיכול לייצר כמויות שווה של חלבון כמו מערכות מבוססות-T7 ב98% הפחתת עלויות למערכות מסחריות דומות. 4,5 הכנת מאגרים ותמצית תא הגולמי הן תואר, כמו גם ביצועתגובת TX-TL שלושה צינור. כל הפרוטוקול לוקח חמישה ימים להכין ומניב מספיק חומר לעד 3000 תגובות בודדות בהכנה אחד. מוכן ברגע, כל תגובה לוקחת פחות מ -8 שעות מהתקנה לאיסוף וניתוח הנתונים. מנגנונים של רגולציה ואקסוגניים שעתוק לE. coli, כגון repressors אק / ט ופולימראז T7-RNA, ניתן להשלים. 6 נכסים אנדוגני, כגון ה-mRNA ושיעורי השפלה DNA, יכול גם להיות מותאם. 7 מערכת ביטוי התא ללא TX-TL הוכח עבור גדול הרכבה בקנה מידה במעגל, לחקור תופעות ביולוגיות, וביטוי של חלבונים תחת שני היזמים T7-ואנדוגני. 6,8 מודלים מתמטיים נלווים זמינים. 9,10 המערכת וכתוצאה מכך יש לו יישומים ייחודיים בביולוגיה סינתטית כסביבת prototyping, או "TX- קרש חיתוך biomolecular TL. "
Introduction
טכנולוגית ביטוי תא ללא החלה ב1950s כגרידא translational, קידום שנים מאוחר יותר על מנת להקיף מנגנוני שעתוק-תרגום בשילוב באמצעות DNA bacteriophage T7. 11,12 מאז, מאמצים רבים נעשו כדי לייעל את הקמתה של תמצית תא גולמי (או E . תמצית coli S30). 13,14 אופטימיזציות אלו כוללות הארכת סינתזת חלבון ללא תא דרך התחדשות ATP או שינויי מתח, וצמצום זמן פרוטוקול ועלות. 15-17 מערכות ביטוי תא ללא אלטרנטיביים קיימות שרכיבי שימוש מחדש במקום גולמי תא תמצית לביטוי. 5 שתי תמצית תא גולמי ושיטות הכינון מחדש פותחו לשימוש מסחרי.
עם כניסתו של ביולוגיה סינתטית, יש צורך מוגבר פלטפורמה מאופיינת היטב כדי לבחון ולהביע את המודולים ביולוגיים מהונדסים ומעגלים. 18,19 פלטפורמה זו חייבת להיותתכליתי, מאופיין היטב, פשוט לתפעול, ומתמקד ברכיבים המסופק על ידי משתמש. למרות מפותח חצי מאה קודם לכן, מערכות תא ללא מבוססות על E. coli חולק באופן מהותי בדרישות אלה, כפי שהם פשוט יותר בייצוג מבחנה של תהליכים תאיים ללא המורכבות של צמיחה וחילוף חומרים. בנוסף, את כל הידע הבסיסי בעבודה מvivo על E. coli מתייחס בקלות לE. מערכות תא ללא coli.
למרות שמערכות ביטוי תא ללא יכולות להיות יישומים בביולוגיה סינתטית, עד היום המטרה של רוב מערכות ביטוי תא ללא כבר מיצוי החלבון ותשואת המטבוליט. המטרה זו מושגת על ידי שימוש בשעתוק bacteriophage T7 של רצפים מונעים על ידי היזמים T7. 20 למרות שהביטוי הוא יעיל וחזק, מערכות אלו לשרת מטרה מאוד מיוחדת. שיטות רגולציה סלולרי הן מוגבלות, תבניות ה-DNA יעד חייבת להיותreengineered לכלול יזמים T7, ולא ניתן עיבד רצפים מסוימים, כגון מתחמי ריבוזומלי ומורכבים. 21,22 מערכות ביטוי תא ללא קיימות לא מצליחות לשמור על תשואות גבוהות תוך שמירה על מנגנוני ויסות אנדוגני, צדדיות הכרחי לביולוגיה סינתטית.
פיתחנו ה אנדוגני מערכת תא ללא coli ביטוי שמשמרת את היעילות של ביטוי חלבון הודגמה על ידי מערכות קודמות, אך מוסיפה צדדיות נוסף על ידי המאפשר ביטוי ורגולציה מבוסס על שני במשק ומחוץ מנגנונים (T7 או אחרים). הפרוטוקול המתואר כאן מבוסס במקור על Kigawa et al. (2004) ויו et al. (2005), אבל יש שינויים משמעותיים. הוא מנצל Mg-ו-K-גלוטמט על Mg-ו-K-אצטט להתייעלות, מסיר 2-mercaptoethanol, וlyses תאים באמצעות חרוז-מקצף. 17,23,24 חרוזים מכות הוא נבחר על פני הומוגניזציה,שיטות המבוסס על לחץ, או sonication בשל עלותו נמוכה יותר ותשואות דומות למערכות מתחרות. 23 חומצת 3-phosphoglyceric (3-PGA) משמשת כמקור האנרגיה כפי שהוא נמצא לתת תשואות חלבון מעולים בהשוואה לקריאטין פוספט ו phosphoenolpyruvate. 4,25 המערכת שלנו יכולה לייצר עד 0.75 מ"ג / מיליליטר חלבון כתב של שימוש גם אמרגן מבוסס sigma70 עם מפעילי מבדה-הפאג או אמרגן מונע T7, בדומה לתשואות ממערכות מסחריות אחרות. 4,6 חמישה ימים נדרש כדי לייצר את כל חומרים כימיים הנחוצים (איור 1). יתר על כן, הוא מספק הפחתת עלויות 98% בהשוואה למערכות דומות מסחריות תא ללא - עלויות חומר הם 0.11 דולרים ל10 תגובת μl, המתנשא ל -0.26 $ עם עבודה כלולה (איור 2).
Protocol
1. הכנת תמצית תא גולמי
הכנת תמצית תא גולמי על פני שלושה ימים דורשת שני אנשים לנהל ביעילות. הפרוטוקול תפקודי מורכב משלושה חלקים: צמיחת התרבות (שלב 1.1 לשלב 1.11), תמוגה תא (שלב 1.12 לשלב 1.37), ולחלץ הבהרה (צעד 1.38 לשלב 1.52). הוא הציג מחולק לימים לנוחות. תמצית אידיאלית יכולה לייצר 0.75 מ"ג / מיליליטר של deGFP מפלסמיד pBEST-OR2-OR1-PR-UTR1-deGFP-T500 (Addgene # 40019), ויש לו ריכוז תמצית תא גולמי בין 27-30 מ"ג / מיליליטר של חלבון. 4 עם זאת , מאפיינים לחלץ משתנים מיצווה כדי אצווה. המתכון הבא מספק מספיק לכ 3,000 תגובות בודדות (6 מיליליטר תמצית תא גולמי). אם קנה מידה במורד, מומלץ שלא להשתמש כלל פחות מ 1/6 של ערכים הניתנים כאן. בשל אילוצי זמן, גמלון אינו מומלץ.
יום 1
- הכן תקשורת תרבות חיידקים, רחוב ללאתוספי צלחת ture, ותקשורת כפי שמתוארים בטבלה 1. ראה חומר משלים 1 למתכונים.
- . מתח Streak BL21-Rosetta2 מ-80 ° C על גבי צלחת אגר 2xYT + P + ס"מ ודגירה של לפחות 15 שעות על 37 מעלות צלזיוס או עד שמושבות הן לעין בקלות הערה: Chloramphenicol (ס"מ) משמש לבחירה לפלסמיד קידוד tRNAs הנדיר בזן BL21-Rosetta2.
יום 2
- הכן את המאגרים ותוספים כפי שמתואר בטבלה 2. ראה חומר משלים 1 למתכונים.
- להכין ולעקר חומרים הנדרשים ליום 3, כוללים: 6 x 4 צלוחיות L Erlenmeyer עם כיסוי רדיד אלומיניום (autoclaved), בקבוקי ליטר 4 x 1 סטרילי צנטריפוגות, משפך (autoclaved), של 0.1 חרוזי זכוכית מ"מ 100 g (autoclaved), 2 , L-1 לעורר ברים (autoclaved) ו500 מיליליטר סיימו גליל (autoclaved), 2 כוסות x 1 L (autoclaved), 3 מיליליטר במזרק עם 18 מחטי G (סטרילי), פלורידה 2-3מצופי שיבולת שועל, 2-3 10k קלטות דיאליזה MWCO (סטרילי), cuvettes.
- הכן מיני תרבות 1. הוסף 4 מיליליטר של תקשורת 2xYT + P ו4 μl של ס"מ לצינור 12 מיליליטר סטרילי תרבות וטרום חם 37 מעלות צלזיוס במשך 30 דקות.
- לחסן מיני תרבות 1 עם מושבה מ+ P + הצלחת אגר ס"מ 2xYT. לדגור על 220 סל"ד, C ° 37 במשך 8 שעות.
- 7 שעות ו30 דקות מאוחר יותר, להכין מיני תרבות 2. הוסף 50 מיליליטר של תקשורת 2xYT + P ו50 μl של ס"מ לבקבוק סטרילי 250 מיליליטר Erlenmeyer מראש חם 37 מעלות צלזיוס במשך 30 דקות.
- לחסן מיני תרבות 2 עם של מיני תרבות 1 100 μl ולדגור על 220 סל"ד, 37 מעלות צלזיוס במשך 8 שעות.
יום 3
- שוקל ארבע שפופרות ריקות סטרילי 50 מיליליטר פלקון ומסת שיא בטבלה 3. צ'יל צינורות פלקון על קרח; אלה ישמשו לאחר מכן בצעד 1.18.
- 7 שעות ו30 דקות אחרי צעד 1.8, להכין תקשורת תרבות חיידקים סופית. באמצעות 1 ליטר סטרילי סיים גליל, העברה 660 מיליליטר של תקשורת 2xYT + P in כדי כל אחד משש 4 צלוחיות L Erlenmeyer מראש חם 37 מעלות צלזיוס במשך 30 דקות הערה:. 4 L או גדול יותר צלוחיות Erlenmeyer מומלצות לאוורור נאות.
- הוספת 6.6 מיליליטר של מיני תרבות 2 לכל בקבוק Erlenmeyer 4 ליטר. לדגור על 220 סל"ד, 37 מעלות צלזיוס עד התרבות מגיעה OD של 1.5-2.0 ב600 ננומטר (המקביל ל שלב צמיחת אמצע יומן). בדוק OD מעת לעת עם דילול 1:10 תרבות לדיוק צעד זה אמור לקחת לא יותר מ 3 שעות - 3 שעות 45 דקות;. מהיר צמיחה וגבייה בשלב אמצע היומן היא קריטית לאיכות תמצית.
- מייד לאחר צמיחה, להעביר את כל התרבויות באופן שווה לארבעה בקבוקי צנטריפוגות L 1 ו צנטריפוגות ב XG 5000 ל12 דקות ב 4 ° C עד גלולה תאים חיידקיים.
- בעוד צנטריפוגה, הכנת חיץ S30A מלאה על ידי הוספת 4 מיליליטר של 1 M DTT ל -2 ליטר של S30A שהוכן קודם לכן. לערבב ולשמור על חיץ על קרח.
- כשהוא סיים צנטריפוגה, להסיר לחלוטין את supernatant משלב 1.12 ידי Decanting וסופג בקבוקי צנטריפוגות על מגבת נייר סטרילי.
- הוסף 200 מיליליטר של חיץ S30A על 4 מעלות צלזיוס לכל אחד מארבעת הבקבוקים צנטריפוגות, ולנער את הבקבוקים במרץ עד גלולה היא solubilized לחלוטין ללא גושים שנותרו. צנטריפוגה ארבעה בקבוקים בגרמו 5,000 ל12 דקות ב 4 ° C.
- לחלוטין להסיר supernatant משלב קודם, באמצעות אחסון וסופג בקבוקי צנטריפוגות על מגבת נייר סטרילי.
- חזור על שלבים 1.15 ו1.16.
- הוסף 40 מיליליטר חיץ S30A על 4 מעלות צלזיוס לכל בקבוק צנטריפוגות. . העבר את כל גלולה ושילוב S30A לתוך צינור פלקון צונן מ1.9) הערה: שלב זה הוא להעביר את כדורים למכל קטן יותר.
- צנטריפוגה צינורות פלקון ב2,000 גרם במשך 8 דקות ב 4 ° C. הסר supernatant באמצעות אחסון.
- צינורות פלקון Re-צנטריפוגות ב 2,000 גרם במשך 2 דקות ב 4 ° C. לחלוטין להסיר supernatant שיורית על ידי פיפטה. שמור על קרח.
- לשקול את fצינורות פלקון שלנו עם גלולה ומסת שיא בטבלה 3. חישוב מסת גלולה, S30A חיץ צורך נפח ומסה של חרוזים הדרושים המבוסס על נוסחאות הספציפיות בטבלה 3.
- מכות טעינה והחרוז נכונות של גלולה היא קריטיות לביצוע תמצית איכות, והינה הצעד המאתגר ביותר. מומלץ לבדוק את הווידאו לפני שתנסה. כישלון כדי למנוע בועות אוויר ולהפיץ באופן שווה חרוזים יגרום תמצית יעילה.
- הוסף את הכמות של חיץ S30A מחושבת בטבלה 3 לכל צינור פלקון, מערבולת עד הומוגנית, ולחזור לקרח.
- תוך שמירה על צינורות פלקון האחרים על קרח, להוסיף חרוזים לסירוגין לצינור פלקון אחת בשלושה aliquots, כל אחד באמצעות 1/3 מהחרוזים בסך הכל. לאחר תוספת של כל aliquot של חרוזים, מערבולת 30 שניות. הנח צינור פלקון על קרח בין שלבי מערבולת ולאחר מערבולת סופית. לאחר aliquot האחרון הוא הוסיף, להבטיחחרוזים מפוזרים באופן אחיד. עיסה סמיכה צריכה להיווצר.
- הכן 5 מיליליטר (נפח) קצה פיפטה ידי ניתוק הסוף באמצעות סכין גילוח סטרילי כדי ליצור פתח 3-4 מ"מ. חיוג פיפטה 2 מיליליטר הערה: סטי פיפטה שונים וטיפים לספק כמויות שונות של יניקה שעלולה שלא להספיק כדי למשוך ולשחרר פתרון חרוז תאים עבים; קצה פיפטה 1 מיליליטר עם הסוף הוסר יכול לשמש כתחליף..
- הנח 20 צינורות חרוז הכאה על קרח.
- ודא צמיגות גבוהה של פתרון תא חרוז באמצעות pipet שונה. זה צריך להיות צמיג לנקודה בקושי יוצא מקצה פיפטה במהלך פליטה. אם צמיג מדי, להתאים מחדש את קצה פיפטה פי צעד 1.25. אם לא צמיג מספיק, ניתן להוסיף חרוזים במרווחים של (מסת גלולה * 0.05), למסה המרבית של (מסת גלולה * 5.1). לאחר כל הוספה של חרוזים, מערבולת 30 שניות ולחזור לקרח. ראה איור 3 א להפגנה של צמיגות.
- הסר פתרון חרוז תאים מצינור פלקון באמצעות pipet שונה, ולהעביר לתוך צינור מכות חרוז סטרילי, ממלא אותו שלושה רבעים מלאים עם פתרון חרוז תאים. ספין בקצרה מאוד (1s) על מיני צנטריפוגות דלפק כדי להסיר בועות אוויר ללא חלוקה מחדש של חרוזים. ראה איורים 3 ב-d לתמונות סטילס של טעינת צינור חרוז-מכות.
- לסיים את הוספת פתרון חרוז תאים כדי ליצור המניסקוס קעור.
- הוסף טיפה קטנה מאוד של פתרון חרוז תאים על גבי החלק הפנימי של כובע צינור מכות חרוז, נזהר שלא לעכב את השפתיים מחוץ לכובע, אחרת צינור מכות החרוז לא יהיה y sufficientl קרוב. הקש הכובע על משטח שטוח ולוודא שאין בועות אוויר בחלק התחתון של הכובע.
- שווי צינור מכות החרוז עם כובע מכות החרוז מהשלב הקודם. יד לעזר למכות חרוז. אם נעשה בצורה נכונה, את הכובע צריך להיות סגור היטב, אין בועות אוויר, שאולאהיה גלוי, ופתרון חרוז תאים (אם בכלל) קטן צריך על גדותיה. בצע שוב את תהליך הטעינה אם בועות אוויר הן גלויות או הכובע לא נסגר באופן מלא.
- צינור פלקון וורטקס מצעד 1.24 עם הפתרון חרוז תאים שנותר כדי להבטיח חלוקה שווה של חרוזים. חזור על שלבים 1.28-1.31 עד צינור פלקון הוא ריק, ולאחר מכן לחזור על שלבים 1.24-1.31 עבור כל צינור פלקון נוסף.
- התנהלות צעדים 1.33-1.38 בו זמנית. האם לקחת עוזר מילא צינורות מ1.31 מכות חרוז ומניחים על קרח. ברגע ששני צינורות מכות חרוז מולא כבר נאספו והיה על קרח למשך דקה אחת לפחות, להתחיל מכות חרוז.
- מקציפים צינור אחד ל30 שניות ב46 סל"ד. מניחים במהופך על קרח למשך 30 שניות תוך שהם מכים את הצינור האחר.
- חזור על השלב קודם כך שכל צינור מכות חרוז מולא כבר הכה על סך 1 דקות.
- חזור על שלבים 1.33-1.35 עד 8 צינורות מלאים חרוז הכאה (או הסכום המקסימאלי צנטריפוגות יכולה להחזיק) hולהעיף כבר מעובד. לאחר מכן, לבנות מנגנון סינון מ15 מיליליטר פלקון (3E איור). להוסיף כובע מכות חרוז חדש, עם פנים כלפי מעלה שטוח חלק, לחלק התחתון של פלקון 15 מיליליטר. לאחר מכן, להסיר את המכסה מצינור מכות חרוז מעובד ועמודה מייקר כרומטוגרפיה לחץ בחוזקה על קצה צינור מכות חרוז מעובד עד אטום לחלוטין. הצמד את קצה elution של עמודת מייקר כרומטוגרפיה, ולמקם את עמודת מייקר כרומטוגרפיה, elution בסופו למטה, לתוך צינור חרוז-אגלים ריקים. מקום המורכב הזה לפלקון 15 מיליליטר. חזור על פעולה עבור כל 8 צינורות מכות החרוז מולא; לשמור על קרח כאשר הושלם.
- צנטריפוגה 8 מנגנוני סינון, צינור פלקון הסיר את המכסה, ב6,000 גרם במשך 5 דקות ב 4 ° C כדי להפריד תמצית וגלולה מחרוזים.
- ודא צינור כל חרוז הכאה ייצר תמצית בת קיימא. התמצית לנצח כמו שצריך לא תהיה עכורה, והגלולה תהיה שתי שכבות נפרדות. השלך כל הצינורות העכורים, ולהעביר את supernatant מצינורות שאינם עכורים i1.75 צינורות מיליליטר n כדי פרט מיקרו צנטריפוגות, לקחת גלולה קטנה ככל האפשר. שמור על קרח עד שכל צינורות מכות החרוז כבר מעובד. ראה איור 3F השוואת צינור חרוז הכאה בצורה נכונה מול שגוי מעובד.
- צנטריפוגה צינורות מיקרו צנטריפוגות משלב קודם ב12,000 גרם במשך 10 דקות ב 4 ° C.
- supernatant ללא גלולה העברה לתוך צינורות חרוז הכאה ריקים באמצעות pipet, איחוד 500 μl לתוך צינור מכות חרוז חדש.
- דגירה שלב קודם, עם כובעי מכות חרוז הוסרו, ב220 סל"ד, C ° 37 ל80 דקות. צעד זה מעכל שנותר חומצות גרעין באמצעות exonucleases אנדוגני שהשתחרר בתהליך חרוז-אגלים, וניתן לעשות זאת על ידי עמידת צינור מכות החרוז בצינור בתרבית רקמה.
- הכן את חומרי דיאליזה. הכנה מלאה S30B חיץ על ידי הוספת 2 מיליליטר של 1 M DTT ל -2 ליטר של S30B שהוכן קודם לכן. לערבב ולהוסיף 900 מיליליטר לכל אחד משני sterile כוסות 1 ליטר. הוספת stirrer המגנטי סטרילי לתוך כל כוס; לשמור על 4 ° C.
- לאחר שלב 1.41, תמצית צריכה להיראות עכורה. איחוד תמצית ל1.5 מיליליטר aliquots ב1.75 צינורות מיליליטר מיקרו צנטריפוגות, ו צנטריפוגות ב 12,000 גרם במשך 10 דקות ב 4 ° C.
- באמצעות pipet, לאחד supernatant ללא גלולה ל15 צינורות מיליליטר פלקון על קרח, ומערבבים היטב על ידי סגירת הצינור והופך. חסוך 10 μl של supernatant על קרח לצעד 1.47.
- קביעת סכום כולל של תמצית מיוצר, ומימה את המספר הדרוש של 10k קלטות דיאליזה MWCO ידי submersing בS30B למשך 2 דקות, בהנחת 2.5 מיליליטר של תמצית לקלטת.
- טען קלטות עם 2.5 מיליליטר של תמצית. כל כוס יכולה לקחת עד 2 קלטות; dialyze, תוך ערבוב, ב-C ° 4 עבור 3 שעות הערה: טעינה חלקית של קלטות היא קבילה.. Dialyzing מגדיל תשואת ייצור חלבון.
- במהלך השלב הקודם, לאפיין חלבון תמציתריכוז עם assay ברדפורד, תוך שימוש בתמצית שמרה בשלב 1.44. ראה חומר משלים 2 לקבלת פרטים.
- לאחר הדיאליזה היא מוחלטת, תמצית aliquot ידי 1.5 מיליליטר ב1.75 צינורות מיליליטר מיקרו צנטריפוגות. צנטריפוגה ב 12,000 גרם במשך 10 דקות ב 4 ° C. גלולה תהווה בחלק התחתון של הצינור.
- איחוד supernatant ברור משלב קודם על ידי pipetting לתוך צינור פלקון 15 מיליליטר על קרח. Homogenize ידי היפוך 5-10x.
- בהתבסס על ריכוז שנקבע על ידי ברדפורד בשלב 1.47, לקבוע סכום של תמצית לaliquot לתוך 1.75 מיליליטר צינורות בודדים. כל צינור בודד צריך להיות נפח עם 810-900 מ"ג של חלבון בסך הכל. תמצית צריכה ריכוז חלבון כולל גדול מ 27 מ"ג / מיליליטר. צעד זה דורש סיוע לנהל expediently הערה:. תמצית Aliquot להלן 30 מ"ג / מיליליטר ל30 aliquots μl, וקנה מידה, אם הריכוז הוא גבוה יותר, למשל, תמצית aliquot ב28 מ"ג / מיליליטר על ידי 30 μl, ותמצית aliquot ב32מ"ג / מיליליטר על ידי 28.1 μl.
- תמצית aliquot הבא צעד 1.50, לטפל כדי למנוע בועות. תמצית פלאש הקפאה בחנקן נוזלי הערה:. Aliquots עם בועות ניתן להסיר על ידי צנטריפוגה ב 10,000 XG במשך 30 שניות ב 4 ° C.
- הסר את הצינורות מחנקן נוזלי באמצעות מסננת ולאחסן מייד -80 בטיחות ג °: ללבוש משקפי מגן; כובעים של צינורות תמצית עשויים לרדת בשל הבדלי הטמפרטורה בין חנקן הנוזלי בטמפרטורת חדר.
2. חומצת אמינו פתרון הכנה
צריך להיות מוכן חומצת אמינו פתרון בתפזורת. המתכון הבא מנצל ערכה מלאה אחת RTS חומצת אמינו הדגם, לספק מספיק לכ 11,000 תגובות בודדות. אם קנה מידה במורד, מומלץ שלא להשתמש כלל פחות ממחצית ערכה. כל חומצת אמינו במנייה מסופקת ב1.5 מיליליטר, 168 מ"מ, פרט לאוצין ב140 מ"מ. ההרכב הסופי של חומצת אמינו פתרון הוא:לאוצין, 5 מ"מ, כל חומצות אמינו אחרות, 6 מ"מ. זהו ריכוז עובד 4x.
- הסר את כל 20 חומצות אמינו מ-20 מעלות צלזיוס ולהפשיר בטמפרטורת חדר. מופשר ברגע, מערבולת עד חומצות אמינו להתמוסס, דוגרות על 37 מעלות צלזיוס במידת צורך. לאחר חומצות אמינו הם מומסים, לשים את כל חומצות אמינו על קרח, פרט לASN, Phe, וCys, שנשמרים בטמפרטורת חדר. Cys לא יכול לפזר באופן מלא.
- על קרח, להוסיף 12 מיליליטר של מים סטריליים לצינור פלקון סטרילי 50 מיליליטר.
- הוסף 1.5 מיליליטר של כל חומצת אמינו לפי הסדר הבא, דואג למערבולת צינור פלקון לאחר כל הוספה ולשמור את הפתרון על קרח: עלא, Arg, ASN, ASP, Gln, Glu, גלאי, שלו, איל, יס, נפגש, Phe, Pro, Ser, Thr, ואל, TRP, Tyr, Leu, Cys. ניתן להוסיף Cys כהשעיה. לאחר בנוסף, מערבולת עד הפתרון היא ברורה יחסית, דוגרים על 37 מעלות צלזיוס במידת צורך. Cys לא יכול לפזר באופן מלא.
- Aliquot חומצת אמינו פתרון ל50 צינורות ב26 μl כל על קרח. Aliquot השאר ב500 μl לכל צינור על קרח. Aliquots μl 26 ישמשו לכיול תמצית, בעוד aliquots μl 500 ישמשו להכנת מאגר. בעוד aliquoting, מערבולת המניות העיקריות לעתים קרובות כדי למנוע חלוקה לא שוויונית של השעיה.
- aliquots פלאש להקפיא בחנקן הנוזלי ולאחסן ב -80 בטיחות ג °: ללבוש משקפי מגן; כובעים של צינורות תמצית עשויים לרדת בשל הבדלי הטמפרטורה בין חנקן הנוזלי בטמפרטורת חדר.
- אופציונאלי: ניהול assay פעילות חדשה מתוצרת חומצת אמינו פתרון כנגד פתרונות חומצת אמינו שנעשו בעבר.
3. אנרגיה פתרון הכנה
פתרון אנרגיה משמש הוא לכיול תמצית תא גולמי וליצירת חיץ, וצריך להיות מוכן בכמויות גדולות. המתכון הבא מספק מספיק לכ 10,000 תגובות בודדות. אם קנה מידה במורד, זה recommended להשתמש לא פחות מ 1/24 של ערכים הניתנים כאן. כפתרון האנרגיה הוא עלות כספית משמעותית, משתמשים בפעם הראשונה אולי כדאי להכין ב1/24 קנה מידה. ההרכב הסופי של אנרגיה פתרון הוא: HEPES pH 8 700 מ"מ, ה-ATP 21 מ"מ, GTP 21 מ"מ, CTP 12.6 מ"מ, UTP 12.6 מ"מ, tRNA 2.8 מ"ג / מיליליטר, CoA 3.64 מ"מ, NAD 4.62 מ"מ, cAMP 10.5 מ"מ, חומצת folinic 0.95 מ"מ, Spermidine 14 מ"מ, 420 3-PGA. זהו ריכוז עובד 14x. אם תרצה, כל פריט בודד בטבלה 4 ניתן לאחסן ב-80 ° C לשימוש מאוחר יותר.
- הסר את כל הכימיקלים בטבלה 4 מ-80 מעלות צלזיוס, -20 מעלות צלזיוס, או 4 ° C לטמפרטורת חדר במשך 30 דקות.
- הכן פתרונות מניות כמפורט בטבלה 4. ראה חומר משלים 1 למתכונים. מניחים את כל הפתרונות על קרח לאחר הכנה.
- בצינור פלקון 15 מיליליטר, להוסיף לפי הסדר הבא, דואג למערבולת צינור פלקון לאחר כל הוספה ולשמור את הפתרונות on קרח: 3.6 מיליליטר 2 M HEPES, 144 מים μl, 1.39 מיליליטר תערובת נוקלאוטיד, 576 μl 50 מ"ג / מיליליטר tRNA, 576 μl 65 מ"מ CoA, 276 μl 175 מ"מ NAD, 170 μl 650 מ"מ cAMP, 288 μl 33.9 חומצת מ"מ Folinic , 144 μl M 1 spermidine, ו3.09 מיליליטר 1.4 M 3-PGA.
- Aliquot אנרגיה פתרון ל50 צינורות ב 7 μl כל על קרח. Aliquot השאר ב150 μl לכל צינור על קרח. Aliquots μl 7 ישמשו לכיול תמצית, בעוד aliquots μl 150 ישמשו להכנת מאגר. בעוד aliquoting, מערבולת המניות העיקריות בתדירות גבוהה.
- aliquots פלאש להקפיא בחנקן הנוזלי ולאחסן ב -80 בטיחות ג °: ללבוש משקפי מגן; כובעים של צינורות תמצית עשויים לרדת בשל הבדלי הטמפרטורה בין חנקן הנוזלי בטמפרטורת חדר.
- אופציונאלי: ניהול assay פעילות של פתרון אנרגיה שנעשה לאחרונה נגד פתרונות אנרגיה שנעשו בעבר.
4. חיץ הכנה
Buffer ההכנה דורשת השלמת נייד גולמי חלץ הכנה, חומצת אמינו פתרון הכנה, ואנרגיה פתרון הכנה. כל חיץ הוא ייחודי לקבוצה של תמצית תא גולמי. Mg-גלוטמט, K-גלוטמט, וDTT (בסדר הזה) מותאם בסעיף זה כדי לייצר תגובות עם רמות המרביות של ביטוי. הפרוטוקול הבא מנצל תבנית מראש בכתב, TXTL_e (תבנית) _calibration_JoVE.xlsx (חומר משלימה 3), כדי לכייל תמצית תא גולמי שהוכנה מראש ולהכין מאגר. עם זאת, אפשר גם לכייל את תמצית תא גולמי ולהכין את החיץ ללא תבנית על ידי אופטימיזציה של Mg-גלוטמט, K-גלוטמט, וDTT אופן ידני והקמת חיץ כזה שיחד עם תמצית, זה 75% מסך נפח תגובה. אם כיול ידני, ניתן למצוא תנאי תגובה סופיים בשלב 5.
- מלא את הטופס "נתונים כלליים".
- הפשירו על קרח 100 מ"מ Mg-גלוטמט (4 ° C), 3 M K-גלוטמט (4 ° C), 6מ"מ חומצת אמינו פתרון (26 μl, -80 ° C), פתרון אנרגיה (7 μl, -80 ° C), 100 מ"מ DTT (-20 מעלות צלזיוס), ה-DNA בקרה החיובית (-20 מעלות צלזיוס), 40% PEG- . 8000 (4 ° C), תמצית תא גולמי (-80 ° C), ומים (4 ° C) הערה: השתמש 1 ננומטר ריכוז עובד pBEST-OR2-OR1-PR-UTR1-deGFP-T500 (פלסמיד Addgene 40019) לבקרה החיובית (עירור 485 ננומטר, פליטה 525 ננומטר), או התייחסות אחרת שמייצרת עוצמת אות גבוהה. 4
- הכן שבע 10.5 תגובות μl, בדיקת טווח של 4-10 מ"ג-גלוטמט נוסף מ"מ, על ידי aliquoting כמויות סט של המניה Mg-גלוטמט לתוך צינורות מיקרו צנטריפוגות פרט. הערה: למרות ש10.5 תגובות μl בתחילה הכינו, התגובה הסופית היא 10 μl.
- הכן תערובת אב כפי שצוין בתבנית תחת "כיול Mg-גלוטמט", והוסיף 80 מ"מ נוסף של K-גלוטמט. שמור על קרח ומערבולת לאחר התוספת של כל פריט הערה:. הערכים שניתנו כאן ובתבנית הםבנוסף לכמויות של Mg-גלוטמט, K-גלוטמט, והווה DTT במאגר S30B נהג להכין תמצית תא גולמי.
- להוסיף תערובת הורים לדגימות המכילות Mg-גלוטמט ולהכין תגובות. ראה צעדים 5.10-5.13 להוראות מפורטות.
- הפעל תגובה ב29 מעלות צלזיוס, או בחממה או קורא צלחת.
- . לקבוע ריכוז Mg-גלוטמט אופטימלי על ידי רמה של סוף הביטוי ושיעור מקסימאלי של ביטוי חלבון (איור 4 א) הערה: Runtimes להשתנות תלוי בניסוי, אך בדרך כלל שעבר מתחת לגיל 8 שעות.
- חזור על שלבים 4.2-4.7 עבור K-גלוטמט תחת "כיול K-גלוטמט," הגדרת רמות Mg-גלוטמט לאלה שנמצאו בשלב 4.7.
- חזור על שלבים 4.2-4.7 לDTT תחת "כיול DTT," הגדרת רמות Mg-גלוטמט לאלה שנמצאו בשלב 4.7 ורמות K-גלוטמט לאלה שנמצאו בשלב 4.8 הערה:. מצאנו כי הוסיף DTT אינו משפיע על קצה באופן משמעותי רמות ביטוי.
- להשתמשערכים שנמצאו בכיול תחת "הרכב מאגר" כדי לקבוע את ההרכב של חיץ כדי להיות מוכנות. בהתבסס על הכמות של תמצית תא הגולמי מיוצרת, מתכון תערובת הורים מופק לסכום קבוע של מאגרים.
- להפשיר aliquots כפי שמופיע במתכון תערובת הורים על קרח. מופשר ברגע, להכין תערובת הורים, שמירה על קרח וvortexing לאחר התוספת של כל פריט.
- Aliquot ידי הסכום האמור תחת "הרכב מאגר". צינורות חיץ פלאש הקפאה בחנקן נוזלי. בעוד aliquoting, מערבולת המניות העיקריות בתדירות גבוהה.
- הסר את הצינורות מחנקן נוזלי באמצעות מסננת ולאחסן מייד -80 בטיחות ג °: ללבוש משקפי מגן; כובעים של צינורות תמצית עשויים לרדת בשל הבדלי הטמפרטורה בין חנקן הנוזלי בטמפרטורת חדר.
5. ביצוע ניסויי של תגובת TX-TL
תנאי תגובה סופיים הם: הגנה של מחזור 8.9-9.9 מ"ג / מיליליטרב( מתמצית גולמי), 4.5 MM-10.5 מ"מ Mg-גלוטמט, 40-160 מ"מ K-גלוטמט, 0.33-3.33 מ"מ DTT, 1.5 מ"מ כל חומצת אמינו מלבד לאוצין, 1.25 לאוצין מ"מ, 50 HEPES מ"מ, 1.5 מ"מ ATP ו GTP, 0.9 מ"מ CTP ו UTP, 0.2 מ"ג / מיליליטר tRNA, 0.26 מ"מ CoA, 0.33 מ"מ NAD, 0.75 מ"מ cAMP, 0.068 מ"מ חומצת folinic, spermidine מ"מ, 1 מ"מ 3 30-PGA, 2% PEG-8000. TX בסיסי -TL יש תגובה 3 חלקים (צינורות): תמצית תא גולמי, חיץ, ו-DNA. היחס הוא: חיץ 75% ותמצית, ה-DNA 25% תגובות יכולות להשתנות בעוצמת קול, ואנו משתמשים 10 μl ידי ועידה כדי למזער את עוצמת תגובה ולאפשר פועלים בצלחת 384 גם.. נפחים גדולים יותר דורשים תסיסה לחמצון תקין. הפרוטוקול הבא מנצל תבנית מראש בכתב, TXTL_JoVE.xlsx (חומר משלימה 4), לנהל תגובת 10 μl. פריטים בסגול מעידים על ערכים של קלט המשתמש, ופריטים בכחול מצביעים על חומרים כימיים נוספים להוסיף לתגובה. עם זאת, אפשר גם לנהל שנינות תגובההאוט התבנית על ידי ביצוע תנאי תגובה שתוארו לעיל.
- מלא את הטופס "נתונים כלליים".
- תחת "מיקס מאסטר הכנה," יש להכניס את הערך באחוזי הקטע מתוך שלב 4.1 לתוך התיבה הסגולה.
- תכנן את הניסוי בסיליקו באמצעות "מיקס מאסטר ההכנה" (שורות 10-17) ואת "ה-DNA ההכנה" (שורות 19-50) חלקים. באופן כללי, ניתן לשים קבועים לסעיף "מיקס מאסטר ההכנה", בעוד שניתן לשים את המשתנים לסעיף "ה-DNA ההכנה". מזעור דגימות לניסוי, כדי למנוע אידוי מדגם והטיית זמן התחלת ניסוי. ראה איור 6 להגדרת מדגם.
- תחת "מיקס מאסטר הכנה", להוסיף חומרים כימיים כגון מעוררים או חלבונים, שילכו בכל הדגימות בריכוז קבוע. החל עם שורה 14, למלא את האזורים המוצלים הכחולים, שמירה מגיב אחד לכל שורה. יחידות הן יחס יחסי.
- תחת "DNA הכנה", מוסיף DNA אשר יהיה ספציפי מדגםic. תעודות זהות לדוגמא # 1 # 2 מתאימים לבקרות חיוביות ושליליות, בהתאמה. מזהי דוגמא # 3 ומעלה הם למשתמש לשינוי עבור ה-DNA, ריכוז המניה בng / μl, אורך בזוגות בסיסים, ריכוז סופי רצוי בננומטר, וחזרות (מתוך 10 תגובות μl). כמות ה-DNA המניה להגיע לריכוז סופי הרצוי מחושבת באופן אוטומטי. . הכולל על פני סכומי השורה ל10.5 * n, כאשר n הוא מספר חזרות הערה: למרות סופי נפח התגובה הוא 10 μl, החישובים מניחים בנפח כולל של 10.5 μl לכל תגובה, כדי להסביר את נפח שאבד במהלך pipetting.
- תחת "DNA הכנה", להוסיף חומרים כימיים או דנ"א נוסף שיהיה ספציפי לדוגמא לעמודות כחולות. ריכוזי המניות ה-DNA בננומטר יכולים להיות מחושבים על פי "ה-DNA הכנה", ואילו חומרים כימיים מסוימים מדגם דורשים חישוב ידני מבוססים על סך נפח תגובה של 10.5 n *. הכרכים נכנסו מופחתים מחוץ למים בנפח של אותה השורה.
- הסר numbe הדרושr של צינורות של חיץ, תמצית תא גולמי, וביקורת חיובית תחת "צינורות להפשיר," מ-20 מעלות צלזיוס או -80 ° C ו להפשיר על קרח.
- הכן את דגימות ה-DNA. עבור כל אחד מזהה לדוגמה, aliquot את ה-DNA שצוין, מים, ופריטים המסופק על משתמש לסעיף "ה-DNA ההכנה" לתוך צינור מיקרו צנטריפוגות, בטמפרטורת חדר הערה:. כדי למנוע אובדן מדגם, לאחרונה מכוילים pipets ונמוך מקל טיפים פיפטה וצינורות מיקרו צנטריפוגות מומלצים.
- כאשר צינורות מצעד 5.7 הם הפשירו, להכין את התערובת מאסטר בהיקף של חיץ, לחלץ, ואת כל פריטים המסופק על משתמש גלובליים המבוססים על התיבות מוצלות הכתומים, שמירה על קרח וvortexing לאחר התוספת של כל פריט הערה:. חלץ הוא מאוד צמיג. Aliquots עם בועות ניתן להסיר על ידי צנטריפוגה ב 10,000 XG במשך 30 שניות ב 4 ° C.
- מוסיף את כמות תערובת ההורים הצביעה בתאים הכתומים תחת "DNA הכנה" (O עמודה) לכל דגימת DNA, ולשמור בטמפרה החדרture. פנק את זה כתגובת שעת ההתחלה.
- ורטקס כל מדגם, ו צנטריפוגות ב XG 10,000 במשך 30 שניות בטמפרטורת חדר כדי להפיל כל דגימת שייר ולהפחית את הבועות.
- אם ביצוע תגובה בצינורות מיקרו צנטריפוגות, דגירה ישירות ב29 ° C. . אחרת, פיפטה 10 μl של מדגם לתוך צלחת 384 גם הערה: תגובות בהיקפים גדולים יותר מ10 μl עשויות לדרוש תסיסה לחמצון.
- צלחת צנטריפוגה ב 4,000 XG במשך 30 שניות בטמפרטורת חדר כדי להפיל כל דגימת שייר ולהפחית את הבועות. לאטום צלחת לאחר מכן על מנת למנוע אידוי.
- תגובה לרוץ בהערה 29 ° C.: Runtimes משתנים בהתאם לניסוי אך נמשכים בדרך כלל פחות מ -8 שעות.
תוצאות
יש לנו הצגנו פרוטוקול של חמישה ימים להכנת חיידקי Escherichia אנדוגני מערכת ביטוי תא ללא TX-TL מבוסס. ניתן למצוא באיור 1 - ציר זמן לדוגמא ליצירת חומרים כימיים - תמצית תא גולמי וחיץ. לאחר שנוצר, אלה יכולים להיות מאוחסנים ב -80 מעלות צלזיוס למשך עד שנה אחת. לאחר ריאגנטים נוצרים, הגדרה וביצוע ניסויים ניתן לעשות זאת בפחות מ -8 שעות.
בנוסף, אנו מותאמים תנאי הביטוי של מערכת ביטוי התא ללא TX-TL. תוספות המסופק משתמש אחרים, כגון מאגרים או פתרונות DNA, צריכה להיות מכוילת לרעילות מראש. לדוגמא, שיטות שונות של פלסמידים עיבוד לגרום לביטוי שונה בשל תכולת המלח. אנחנו גם בדקנו את ההשפעה של חיץ elution טריס-Cl ביעילות תגובה (איור 5).
דוגמא לכיול תמצית תא גולמי, בהתייחסו צעד 4.1-4.9, מוצגתבאיור 4 א. באופן כללי, הניסויים שלנו מראים כי תמצית התא הגולמי היא רגישה ביותר לרמות Mg-גלוטמט, ואחרי רמות K-גלוטמט. כדי להדגים את מערכת ביטוי ללא תא, בנינו ונבדקו לולאת משוב שלילית המבוססת על דיכוי ט. 26 (איור 6). במערכת הביטוי ללא תא, אותו ריצה במעגל עם ובלי ATC מציגה שינוי פי 7 נקודת סיום ביטוי של כתב deGFP אחרי שמונה שעות של ביטוי. למרות שהניסוי הזה אינו דורש מעוררים או repressors הגלובליים, במידת צורך ניתן להוסיף תחת "מיקס מאסטר הכנה".
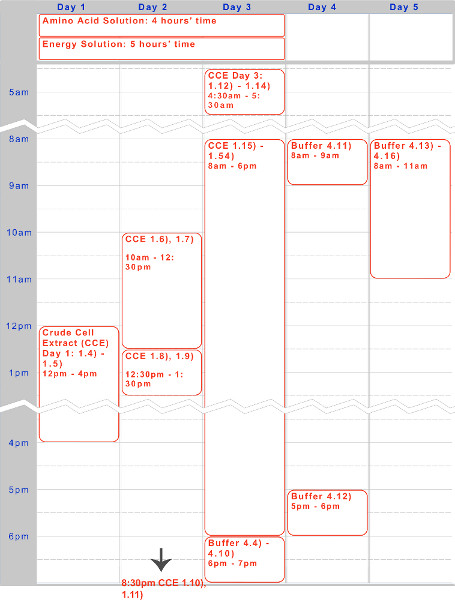
איור 1. ציר זמן לתמצית תא גולמי, פתרון חומצת אמינו, והכנת פתרון אנרגיה. Timelin חמישה ימים דואר לביצוע טיפוסי של הפרוטוקול הוא שניתן לעיל, אופטימיזציה עבור incubations הלילה וצעדי עבודה בשעות היום.
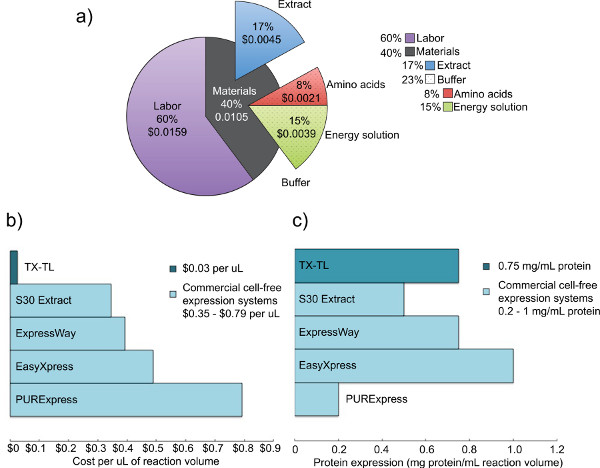
איור 2. עלות ניתוח וביטוי של מתחרה תמציות תא גולמי. א) פילוח העלויות של עבודה וחומרים של מערכת ביטוי התא ללא TX-TL. בהתבסס על עלויות של חומרים כימיים לדצמבר 2012, ועלויות עבודה של 14 $ לשעה. ב) השוואה של עלויות מערכת ביטוי תא ללא TX-TL לעומת מערכות מסחריות אחרות. עלויות מפורקים לμl, אם כי כמויות תגובה עשויות להשתנות לערכה. ג) השוואה בין תשואת מערכת ביטוי תא ללא TX-TL לעומת מערכות מסחריות אחרות. תשואת ביטוי חלבון נקבעה על פי אמות מידה של יצרן./ "= היעד" _blank 50762fig2large.jpg "> לחץ כאן כדי להציג דמות גדולה.

איור 3. טעינה ועיבוד של צינור חרוז-מכות. א) הפגנה של צמיגות הנכונה של פתרון תא חרוז. פתרון תא חרוז יהיה צמיגות תלויה בגורמים רבים, ובכלל זה סכום של חיץ S30A הוסיף, כמות חרוזים הוסיפו, ואת משך זמן על קרח. ב) טעינה של צינור מכות חרוז לפני צנטריפוגה שולחן מהירה. צנטריפוגה מסירה בועות שנצברו במהלך טעינה. ג) בועות על פני השטח לאחר צנטריפוגה השולחן. גודל הבועות ישתנה, הם יכולים להיות צצו או להסיר באמצעות פיפטה קצה ד) צינור מכות חרוז מלא לחלוטין לפני הסגירה.. המניסקוס נוצר בt להכות את החרוזיש אופה, והכובע מספיק כדי לכסות ולגרום לכמויות קטנות ימלא יותר מדי. ה) מכשירי סינון נטענו כהלכה. אלה ניתן לעשות שימוש חוזר. ו) השוואה נכונה לעומת צינור מכות חרוז מעובד באופן שגוי. הצינור בצד השמאל הוא צינור היטב פעימה - הוא כולל שכבה קטנה ופירט היטב עליונה, וsupernatant מאוד ברור. הצינור בצד הימין הוא הכי מוצלח, המבוסס על השכבה הגדולה יותר, מעורפלת השנייה ואת supernatant המעורפל. צינורות שהם לא טובים לא צריכים לעבור עיבוד נוסף.
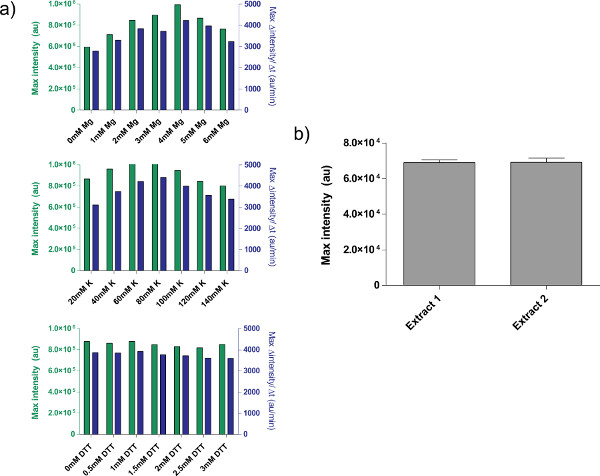
איור 4. מאפיינים של הכנות תמצית גולמי. א) חלקות כיול אופייניות לתמצית תא גולמי. תמצית גולמי היא מכוילת לMg-גלוטמט נוסף, K-גלוטמט, ורמות DTT, בסדר הזה. מוצג הוא fluorescenc נקודת הסיוםדואר לאחר 8 שעות, כמו גם שיעור מקסימאלי של ייצור חלבון המבוסס על ממוצע נע 12 דקות. בהתבסס על חלקות אלה, טווח מקובל של Mg-גלוטמט נוסף הוא 4 מ"מ, K-גלוטמט הוא 60-80 מ"מ, וDTT הוא 0-3 מ"מ. שים לב שכל תמצית גולמי צריכה להיות מכוילת באופן עצמאי במשך שלושת המשתנים הללו. ב) וריאציה מהכנות לחלץ. הקרינה נקודת סיום של שתי תמציות גולמיים מוכנות בתאריכים שונים מוצגת; סורגי שגיאה 1 סטיית תקן משלוש ריצות עצמאיות בימים שונים. לחץ כאן כדי להציג דמות גדולה.
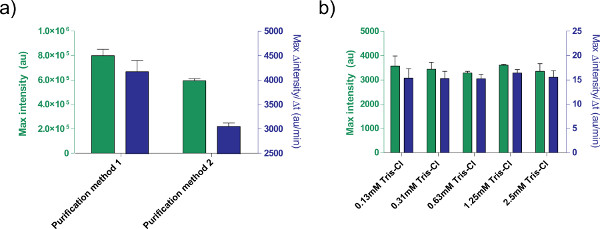
איור 5. השפעות של פתרון ה-DNA ביעילות ביטוי. א) השוואה בין שתי טיהור שונה שיטות לעיבוד פלסמידים. 1 ננומטר של pBEST-OR2-OR1-PR-UTR1-deGFP-T500 הוא מוכן רק באמצעות ערכת הספין Miniprep QiaPrep (שיטת טיהור 1) או שלאחר מעובד עם ערכת טיהור Qiaquick PCR (שיטת טיהור 2). מוצג היא הקרינה נקודת סיום לאחר 8 שעות, כמו גם שיעור מקסימאלי של ייצור חלבון המבוסס על ממוצע נע 12 דקות. ברים שגיאה הם 1 סטיית תקן מארבע ריצות עצמאיות בימים שונים. ב) השפעת חיץ elution (טריס-Cl). ריכוזים שונים של טריס-Cl הם בהשוואה בתגובת ביטוי ללא תא הבוסס על הביטוי של 1 ננומטר של pBEST-OR2-OR1-PR-UTR1-deGFP-T500. ריכוזים נתון ריכוזים סופיים של טריס-Cl בתגובה; חיץ elution משמש הוא 10 מ"מ טריס-Cl. ברים שגיאה הם 1 סטיית תקן משלוש ריצות עצמאיות בימים שונים. לחצו כאן כדי להציג דמות גדולה.
לשמור-together.within-page = "תמיד"> 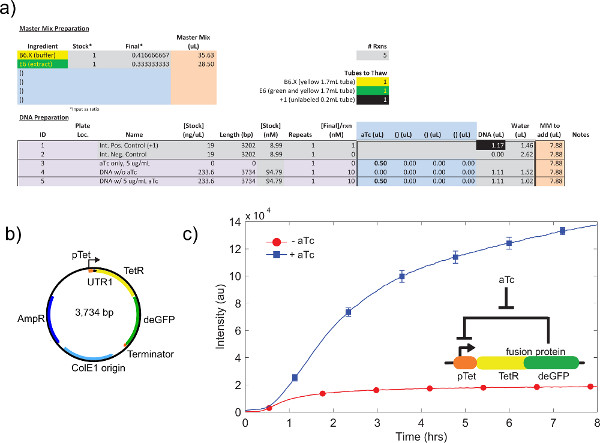
איור 6. ריצת TX-TL מדגם של לולאת משוב שלילית. א) התקנה לדוגמה בתגובת ביצוע ללא תא. בדיקות "על" לעומת "את" מצב של לולאת המשוב השלילית, עם בקרות חיוביות ושליליות.) נציג תוצאות ב) מפת פלסמיד של לולאת משוב שלילית. ג. הנתונים משקפים את הניסוי ב) ו-B), עם ביקורת שלילית יופחתו מאות. מעגל גנטי שמוצג בכנס. ברים שגיאה הם 1 סטיית תקן משלוש ריצות עצמאיות בימים שונים. לחצו כאן כדי להציג דמות גדולה.
| שם | התרכזות | הסכום | סטריליזציה | הערות |
| כלורמפניקול (ס"מ) | 34 מ"ג / מיליליטר באתנול | 1 מיליליטר | סנן לעקר (מיקרומטר 0.22) | יכול להתבצע בכמויות גדולות מאוחסנות ב -20 ° C לשימוש מאוחר יותר. |
| 2xYT + P + צלחת אגר ס"מ | ביום 31 גר '/ ל' 2xYT, dibasic אשלגן זרחה 40 מ"מ, monobasic אשלגן זרחה 22 מ"מ, 34 מיקרוגרם / מיליליטר כלורמפניקול | צלחת 1 | דוד לחץ | |
| 2xYT + P תקשורת | ביום 31 גר '/ ל' 2xYT, dibasic אשלגן זרחה 40 מ"מ, monobasic אשלגן זרחה 22 מ"מ | 4 L | דוד לחץ |
טבלת 1. ריאגנטים ליום 1 בפרוטוקול תמצית תא גולמי.
| שם | התרכזות | הסכום | סטריליזציה | הערות |
| בסיס טריס | 2 M | 250 מיליליטר | סנן לעקר (0.22 מיקרומטר) או החיטוי | ניתן לאחסן בטמפרטורת חדר. |
| DTT | 1 M | 6 מיליליטר | סנן לעקר (מיקרומטר 0.22) | יכול להתבצע בנפחים גדולים יותר ולאחסן ב-20 ° C לשימוש מאוחר יותר. |
| חיץ S30A | 14 מ"מ Mg-גלוטמט, 60 מ"מ K-גלוטמט, 50 מ"מ טריס, pH 7.7 | 2 L | דוד לחץ | כדי להגיע לרמת חומציות 7.7, לכיל עם חומצה אצטית. הוספת DTT ל2 מ"מ ריכוז סופי רק לפני השימוש. חנות ב 4 ° C. |
| חיץ S30B | 14 מ"מ Mg-גלוטמט, 60 מ"מ K-גלוטמט, ~ 5 מ"מ טריס, pH 8.2 | 2 L | דוד לחץ | כדי להגיע לרמת חומציות 8.2, לכיל עם 2Mטריס. הוספת DTT עד 1 מ"מ ריכוז סופי רק לפני השימוש. חנות ב 4 ° C. |
טבלה 2. ריאגנטים ליום 2 של פרוטוקול תמצית תא גולמי.
| בז | ||||
| 1 | 2 | 3 | 4 | |
| פלקון 50 מיליליטר הריק (ז) | ||||
| פלקון 50 מיליליטר עם גלולה (ז) | ||||
| מסת גלולה (50 מיליליטר פלקון עם גלולה - ריק 50 מיליליטר פלקון) (ז) | ||||
| S30A חיץ נפח להוסיף (מסת גלולה * 0.9) (מיליליטר) | ||||
| מסה כוללת של חרוזים להוסיף (מסת גלולה * 5.0) (ז) | ||||
לוח 3. חיץ S30A ומחשבון מסת חרוז, ליום 3 של פרוטוקול תמצית תא גולמי.
| שם | התרכזות | הסכום | סטריליזציה | הערות |
| HEPES | 2 מ ', pH 8 | 4 מיליליטר | אף לא אחד | כדי להגיע pH 8, לכיל עם KOH. |
| נוקלאוטיד Mix | 156 מ"מ ATP ו GTP, 94 מ"מ CTP ו UTP, pH 7.5 | 1.5 מיליליטר | אף לא אחד | כדי להגיע pH 7.5, לכיל עם KOH. |
| tRNA | 50 מ"ג / מיליליטר | 600 μl | אף לא אחד | |
| CoA | 65 מ"מ | 600 μl | אף לא אחד | |
| NAD | 175 מ"מ, pH 7.5-8 | 300 μl | אף לא אחד | כדי להגיע לרמת חומציות 7.5-8, לכיל עם טריס ב2 מ ' |
| מחנה | 650 מ"מ, pH 8 | 200 μl | אף לא אחד | כדי להגיע pH 8, לכיל עם טריס ב2 מ ' |
| Folinic חומצה | 33.9 מ"מ | 300 μl | אף לא אחד | אמנם יש צורך רק 300 μl, מתכון במשלימה הוא ל1.15 מיליליטר. |
| Spermidine | 1 M | 150 μl | אף לא אחד | חנות ב 4 מעלות צלזיוס, חום ל37 מעלות צלזיוס כדי להמס. |
| 3-PGA | 1.4 מ ', pH 7.5 | 3.2 מיליליטר | אף לא אחד | כדי להגיע pH 7.5, לכיל עם טריס ב2 מ ' |
לוח 4. ריאגנטים להתכונן לפרוטוקול אנרגיה פתרון.
חומר משלים 1. מתכונים לפריטים.
כלורמפניקול, 34 מ"ג / מיליליטר: הכן 0.51 כלורמפניקול גרם ולהוסיף אתנול ל15 מיליליטר. סנן לעקר (0.22 מיקרומטר), aliquot 1 מיליליטר צינורות, לאחסן ב-20 ° C לשימוש מאוחר יותר.
2xYT + P + צלחת אגר ס"מ: הכן 1.24 גרם 2xYT, פתרון dibasic 1.6 אשלגן זרחה מיליליטר @ 1 M, 0.88 פתרון מיליליטר אשלגן monobasic פוספט @ 1 M, 0.6 אגר גרם, ומים ל40 מיליליטר. החיטוי. בוא מגניב 50 מעלות צלזיוס ולהוסיף 40 μl ס"מ. Aliquot 25 מיליליטר לתוך צלחת פטרי 100 x 15 מ"מ, ולתת מגניבים לשעה.
2xYT + P מדיה: הכן 124 גרם 2xYT, פתרון dibasic 160 פוספט מיליליטר אשלגן @ 1 M, פתרון 88 monobasic מיליליטר אשלגן זרחה @ 1 M, ומים עד 4 L. Aliquot אל 2 x 1.88 L ו0.24 ל החיטוי.
בסיס טריס, 2 M: הכן את בסיס טריס 60.57 גרם ומים ל250 מיליליטר. לעקר, חנות ב RT לשימוש מאוחר יותר.
DTT, 1 M: הכן 2.31 DTT גרם ומים ל15 מיליליטר. סנן לעקר (0.22 מיקרומטר), aliquot 1 מיליליטר צינורות, לאחסן ב-20 ° C לשימוש מאוחר יותר.
חיץ S30A: הכן 10.88 גרם Mg-גלוטמט ו24.39 K-גלוטמט גרם, 50 מיליליטר טריס ב2M, חומצה אצטית (ל-pH 7.7), ומים ל2 ל 'החיטוי, לאחסן ב 4 ° C, להוסיף 4 מיליליטר 1 M DTT לפני השימוש.
חיץ S30B: הכן 10.88 גרם Mg-גלוטמט ו24.39 K-גלוטמט גרם, טריס ב2 M (לpH 8.2), ומים ל2 ל 'החיטוי, לאחסן ב 4 ° C, להוסיף 2 מיליליטר 1 M DTT לפני השימוש.
HEPES: הכן 1.91 גרם HEPES (MW 238.21), KOH (ל-pH 8), ומים עד 4 מיליליטר.
tRNA: הכן 30 מ"ג של tRNA ומים ל600 μl.
CoA: הכן 30 מ"ג CoA (MW 767.53) ומים ל600 μl.
NAD: הוסף 34.83 מ"ג של NAD (MW 663.43), טריס ב2 M (לpH 7.5-8), ומים ל300 μl. (הוסף 27 μl של טריס ב2 M כדי להביא את הפתרון לpH 7.5-8).
cAMP: הוסף 42.80 מ"ג של cAMP (MW 329.22), טריס ב2 M (ל-pH 8), ומים ל200 μl. (הוסף 73 μl של טריס ב2 M כדי להביא את הפתרון לpH 8).
Folinic חומצה (33.9 מ"מ): כדי 20 מ"ג של מלח המוצק סידן חומצת folinic (MW 511.5), להוסיף 1.15 מיליליטר מים.
Spermidine: הכן 23.55 μl של spermidine (MW 145.25) ומים ל150 μl. הכן בטמפרטורת חדר לאחר המסת בקצרה על 37 ° C.
3-PGA: הוסף 1.03 גרם של 3-PGA (MW 230.02), טריס ב2 M (לpH 7.5), ומים ל3.2 מיליליטר. (הוסף 1.73 מיליליטר של טריס ב2 M כדי להביא את הפתרון לpH 7.5).
Nucleotide מיקס: הוסף 145 מ"ג dihydrate מלח dipotassium ATP (MW 619.4), 133 מ"ג מלח disodium GTP (MW 567.14), 79.4 מ"ג dihydrate מלח disodium CTP (MW 563.16), 82.6 מ"ג dihydrate מלח trisodium UTP (MW 586.12) , KOH בדילול 15% (ל pH 7.5), ומים ל1.5 מיליליטר. (הוסף 353 μl של KOH בדילול 15% כדי להביא את הפתרון לpH 7.5).
חומר משלים 2. ברדפורד Assay.
- הסר סוכן רדפורד מ4 ° C ולהגדיר בטמפרטורת חדר.
- הכן 50 BSA תקן μl ב1 מ"ג / מ"ל וב0.1 מ"ג / מיליליטר.
- הכן 40 μl 20x דילול של תמצית מהצעד 1.47.
- הוספת 800 מים μl ל7 cuvettes.
- הכן cuvettes הסטנדרטי ל0 מ"ג / מיליליטר, 1 מ"ג / מיליליטר (10 μl 0.1 מ"ג / מיליליטר BSA), 2 מ"ג / מיליליטר (20 μl 0.1 מ"ג / מיליליטר BSA), 4 מ"ג / מיליליטר (4 μl 1 מ"ג / מיליליטר BSA) , 6 מ"ג / מיליליטר (מ"ג 6 μl 1 / מיליליטר BSA).
- הכן cuvettes הניסיוני ל2 μl של מדגם ו4 μl של מדגם.
- הוסף 200 μl של סוכן ברדפורד לכל קובט ומערבבים היטב בpipetting y. דגירה בטמפרטורת חדר למשך דקות לפחות 10.
- לייצר עקומת סטנדרט בננומטר OD 595 באמצעות cuvettes מצעד 6.5. לדחות את עקומת סטנדרט אם r 2 <0.95.
- לקבוע את ריכוז תמצית בננומטר OD 595 באמצעות cuvettes מצעד 6.6.
חומר משלים 3. חיץ גיליון אלקטרוני כיול.
ראה TXTL_e (תבנית) _calibration_JoVE.xlsx.
חומר משלימה 4. ביטוי תא ללא להריץ גיליון אלקטרוני.
Discussion
מערכת ביטוי תא ללא TX-TL מבוסס חיידקי Escherichia אנדוגני שתוארה כאן היא תגובה שלושה צינור קלה לטווח שיכול לקחת פחות משמונה שעות מלהגדיר לאיסוף נתונים. התהליך של יצירת כל ריאגנטים דורש חמישה בסך הכל 'ימי זמן (עם דרישות עבודה משמעותיות על יום אחד בלבד), אבל מייצר תמצית גולמי ל3,000 תגובות וריאגנטים ל10,000 תגובות (איור 1), מה שהופך את החיץ. יתר על כן, תמצית גולמי וחומרים כימיים יציבים במשך שנה לפחות 1 ב -80 מעלות צלזיוס, דבר המאפשרים לשימושים מרובים של הכנה אחד קבלת חיץ. 4 ב0.11 דולרים ל10 תגובת μl (0.26 $ כוללים עבודה), עלויות הן 98% בהשוואה להשוואה מערכות מסחריות (איור 2).
ישנן מספר מגבלות בלתי פתורות, עם זאת, למערכת. יעילות סוף כל הכנת תמצית תא גולמי יכולה להשתנות על סמך בקיאות משתמש ועל תנאים סביבתיים, אם כי לאוריאציה תשואת ypical היא בין 5-10% (איור 4). כתוצאה מכך, השתנות אצווה כדי אצווה בשני ביטוי נקודת הסיום ובדינמיקת ביטוי הן צפויות. וריאציות אלו צפויות להישאר עד התמצית מאופיינת או עד יצירת תמצית היא אוטומטית לחלוטין באופן מלא. אם מערכת הביטוי ללא תא משמשת לבצע ניסויים כמותיים רגישים, רצוי להפעיל את כל הניסויים עם אותה הקבוצה של תמצית תא גולמי. התשואה מתצווה אחת תמצית תא גולמי, על 3000 תגובות, צריכה להיות מספיק עבור קורסים ניסיוניים טיפוסיים. למרות שאנו חושדים וריאציה ניתן להסיר על ידי דרוג את ומיכון ההליך, ניסיונות כאלה היינו כרוכים בהשקעת משאבים משמעותית.
בנוסף, למרות שרמות ביטוי נקודת סיום הן קלים באופן סביר על מנת לקבוע, עוד עבודה שצריכה לעשות בדינמיקת הבנה פנימית למערכת ללא תא. זה ידוע כי שניהם competitio המשאבהגבלת n ומשאבים יכולה להשפיע על דינמיקת ביטוי. לדוגמא, סיגמא אנדוגני המוגבל 70 יכול לגרום למשטר להרוות עם תבנית ה-DNA מוגבר לייצר פרופיל ביטוי מקביל לזה של דלדול נוקלאוטיד או חומצת אמינו. 9,27 עם זאת, דינמיקה לא צריך להיות מובנת במלוא לנצל את המערכת. לעלייה טהורה של תשואה, אופטימיזציה יכולה להיעשות על ידי גישות למידה מכונה. 28 שאלות של תחרות משאבים והגבלה ניתן לטפל על ידי מודלים מתמטיים לאמת באמצעות נתונים ניסיוניים.
הפרוטוקול המובא כאן הוא מותאם לזן BL21-Rosetta2, אבל הוא להכליל את א 'אחרת זני חיידק. שינויים בBL21-Rosetta2, כגון הסרת פרוטאז גן הקידוד לון והתוספת של הגנים המקודדים tRNAs הנדיר, לאפשר לייצור חלבון מקסימאלי. יש לנו ניסיון בפרוטוקול עם שני זני תמצית אחרים - BL21 בלבד ונוקאאוט-BL21 trxAד מצא תשואת חלבון 50% פחות. אנו משערים כי תשואות דומות להקטין בעת שימוש בזנים אחרים. שינויים אחרים בפרמטרים, כגון החלפת מדיום גידול 2xYT עבור LB ומרקים עשירים אחרים, הביאו לתשואת חלבון ירד.
יש מערכות ביטוי תא ללא ניצול שני מכונות שעתוק-תרגום אנדוגני ואקסוגני ומנגנוני רגולציה יישומים רחבים בחלבון וגם ביטוי המטבוליט ובביולוגיה סינתטית. 3,29 במקום להיות מוגבל למעגלים מוסדרים T7, אפשר לדמיין הפקת ביומולקולות המורכבת בהגדרת משתמש לשליטה באמצעות שילוב של א 'ילידים יזמים coli ומנגנוני שעתוק ורגולציה מסופקים אקסוגני. ללא מגבלות של חלוקת תא וחילוף חומרים, השתנות במעגלים סינטטיים כגון repressilator או במסלולים מטבוליים מהונדס כגון ארטמיסינין הייצור אלה יכולים להיות מופחתים או להבין טובים יותר. 30,31 אנו havדואר משמש יתרונות אלה ליישם מתגים גנטיים, כמו גם להבין את תפיסת גורם סיגמא טכנולוגיה זו 9,32 יכולה גם מהווה את עמוד השדרה של תאים "מלאכותיים" "מינימאלי" או -. קטן, מאופיין היטב ויחידות גלומות עצמאית של תמצית. 33,34
סופו של דבר, אנו צופים שימושים מיידיים של מערכת ביטוי זה אנדוגני תא ללא כסביבת דיגום לביולוגיה סינתטית. כינוי "קרש חיתוך biomolecular TX-TL," מערכת ביטוי התא ללא מספקת סביבה לשליטה בו מעגלים סינטטיים נועדו סופו של דבר לin vivo ביטוי יכול לעבור סיבובים של בניית אב טיפוס - מחזורים של בדיקות על פלסמיד הבסיסי, ליניארי, או דנ"א synthetized כימי, ואחריו על ידי ניתוח ושינוי מהיר. יכולים להיות בעזרת סיבובים prototyping על ידי מודלים מתמטיים חזוי כרגע בשלבי פיתוח. על ידי הסרת שיבוט ובמניפולצית vivo למעגלים שאינם סופיים, אנו צופים engiזמני מחזור חלוצית ליופחתו ל 1-3 ימים במקום סטנדרטית 'השבועות הנוכחיים.
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
אנו מודים Jongmin קים, דן סיגל-Gaskins, Anu Thubagere, וחנוך Yeung לסיוע התייעלות הפרוטוקול, וקלייר חן וברקלי לי לסיוע בשלבים המוקדמים של הפרויקט בשלבים. חומר זה מבוסס על נתמך בחלקו על ידי ההגנה מחקר מתקדם פרויקטים הסוכנות (DARPA / MTO) תכנית החיים יציקה, מספר חוזה HR0011-12-C-0065 (DARPA / CMO.ZZS נתמך גם על ידי מדען רפואי UCLA / קלטק העבודה מלגת תכנית אימונים ועל ידי משרד ההגנה, חיל אוויר Office של מחקר מדעי, ביטחון הלאומי, מדע והנדסה לתואר שני (NDSEG) מלגה, 32 168a CFR. הדעות והמסקנות הכלולות במסמך זה הן על דעת המחברים ולא צריך להתפרש כמייצג באופן רשמי מדיניות, במפורש או במשתמע, של הסוכנות לפרויקטי מחקר מתקדם הביטחון או ממשלת ארה"ב.
Materials
| Name | Company | Catalog Number | Comments |
| 2xYT | MP biomedicals | 3012-032 | |
| 3-PGA | Sigma-Aldrich | P8877 | |
| ATP | Sigma-Aldrich | A8937 | |
| Bacto-agar | BD Diagnostics | 214010 | |
| Bead-beating tubes (polypropylene microvials) | BioSpec | 522S | |
| Beads, 0.1mm dia. | BioSpec | 11079101 | |
| BL21 Rosetta 2 E. coli strain | Novagen | 71402 | |
| Bradford BSA Protein Assay Kit | Bio-rad | 500-0201 | |
| cAMP | Sigma-Aldrich | A9501 | |
| Chloramphenicol | Sigma-Aldrich | C1919 | |
| CoA | Sigma-Aldrich | C4282 | |
| CTP | USB | 14121 | |
| Cuvettes, 1.5ml | Fisher | 14-955-127 | |
| DTT | Sigma-Aldrich | D0632 | |
| Folinic acid | Sigma-Aldrich | F7878 | |
| GTP | USB | 16800 | |
| HEPES | Sigma-Aldrich | H6147 | |
| K-glutamate | Sigma-Aldrich | G1149 | |
| Mg-glutamate | Sigma-Aldrich | 49605 | |
| Micro Bio-Spin Chromatography Columns | Bio-Rad | 732-6204 | |
| NAD | Sigma-Aldrich | N6522 | |
| Nunc 384-well optical bottom plates | Thermo-Scientific | 142761 | |
| Nunc sealing tape | Thermo-Scientific | 232701 | |
| PEG-8000 | Promega | V3011 | |
| Potassium phosphate dibasic solution | Sigma-Aldrich | P8584 | |
| Potassium phosphate monobasic solution | Sigma-Aldrich | P8709 | |
| RTS Amino Acid Sampler | 5 Prime | 2401530 | |
| Slide-A-Lyzer Dialysis Cassettes, 10k MWCO (Kit) | Thermo-Scientific | 66382 | |
| Spermidine | Sigma-Aldrich | 85558 | |
| Tris base | Fischer | BP1521 | |
| tRNA (from E. coli) | Roche Applied Science | MRE600 | |
| UTP | USB | 23160 | |
| 1L Centrifuge Bottle | Beckman-Coulter | A98813 | This is specific for Avanti J-series; obtain equivalent size for centrifuge in use. |
| 4L Erlenmeyer Flask | Kimble Chase | 26500-4000 | |
| Avanti J-26XP Centrifuge | Beckman-Coulter | 393127 | Or 1L-capable centrifuge equivalent. |
| Forma 480 Orbital Shaker | Thermo Scientific | 480 | Or chest-size 6x4L shaker equivalent. |
| JLA-8.1000 Rotor | Beckman-Coulter | 363688 | Or 1L-capable, 5000 x g rotor equivalent for centrifuge. |
| Mini-Beadbeater-1 | BioSpec | 3110BX | |
| Supplemental Material 1. Recipes for Items. Chloramphenicol, 34 mg/ml: Prepare 0.51 g chloramphenicol and add ethanol to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. 2xYT+P+Cm agar plate: Prepare 1.24 g 2xYT, 1.6 ml potassium phosphate dibasic solution @ 1 M, 0.88 ml potassium phosphate monobasic solution @ 1 M, 0.6 g agar, and water to 40 ml. Autoclave. Let cool to 50 °C and add 40 μl Cm. Aliquot 25 ml into a 100x15 mm petri dish, and let cool for an hour. 2xYT+P media: Prepare 124 g 2xYT, 160 ml potassium phosphate dibasic solution @1 M, 88 ml potassium phosphate monobasic solution @ 1 M, and water to 4 L. Aliquot out into 2x1.88 L and 0.24 L. Autoclave. Tris base, 2 M: Prepare 60.57 g Tris base and water to 250 ml. Sterilize, store at RT for later use. DTT, 1 M: Prepare 2.31 g DTT and water to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. S30A buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, 50 ml Tris at 2M, acetic acid (to pH 7.7), and water to 2 L. Autoclave, store at 4 °C, add 4 ml 1 M DTT before use. S30B buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, Tris at 2 M (to pH 8.2), and water to 2 L. Autoclave, store at 4 °C, add 2 ml 1 M DTT before use. HEPES: Prepare 1.91 g HEPES (MW 238.21), KOH (to pH 8), and water to 4 ml. tRNA: Prepare 30 mg of tRNA and water to 600 μl. CoA: Prepare 30 mg of CoA (MW 767.53) and water to 600 μl. NAD: Add 34.83 mg of NAD (MW 663.43), Tris at 2 M (to pH 7.5-8), and water to 300 μl. (Add 27 μl of Tris at 2 M to bring the solution to pH 7.5-8). cAMP: Add 42.80 mg of cAMP (MW 329.22), Tris at 2 M (to pH 8), and water to 200 μl. (Add 73 μl of Tris at 2 M to bring the solution to pH 8). Folinic Acid (33.9 mM): To 20 mg of solid folinic acid calcium salt (MW 511.5), add 1.15 ml water. Spermidine: Prepare 23.55 μl of spermidine (MW 145.25) and water to 150 μl. Prepare at room temperature after melting briefly at 37 °C. 3-PGA: Add 1.03 g of 3-PGA (MW 230.02), Tris at 2 M (to pH 7.5), and water to 3.2 ml. (Add 1.73 ml of Tris at 2 M to bring the solution to pH 7.5). Nucleotide Mix: Add 145 mg of ATP dipotassium salt dihydrate (MW 619.4), 133 mg of GTP disodium salt (MW 567.14), 79.4 mg of CTP disodium salt dihydrate (MW 563.16), 82.6 mg of UTP trisodium salt dihydrate (MW 586.12), KOH at 15% dilution (to pH 7.5), and water to 1.5 ml. (Add 353 μl of KOH at 15% dilution to bring the solution to pH 7.5). Supplemental Material 2. Bradford Assay.
See TXTL_e(template)_calibration_JoVE.xlsx. Supplemental Material 4. Cell-free expression run spreadsheet. See TXTL _JoVE.xlsx. | |||
References
- Noireaux, V., Bar-Ziv, R., Libchaber, A. Principles of cell-free genetic circuit assembly. Proceedings of the National Academy of Sciences of the United States of America. 100, 12672-12677 (2003).
- He, M. Y., He, Y. Z., Luo, Q., Wang, M. R. From DNA to protein: No living cells required. Process Biochem. 46, 615-620 (2011).
- Forster, A. C., Church, G. M. Synthetic biology projects in vitro. Genome Res. 17, 1-6 (1101).
- Shin, J., Noireaux, V. Efficient cell-free expression with the endogenous E. Coli RNA polymerase and sigma factor 70. Journal of biological engineering. 4, 8 (2010).
- Shimizu, Y., et al. Cell-free translation reconstituted with purified components. Nat Biotechnol. 19, 751-755 (2001).
- Shin, J., Noireaux, V. An E. coli Cell-Free Expression Toolbox: Application to Synthetic Gene Circuits and Artificial Cells. Acs Synth Biol. 1, 29-41 (2012).
- Shin, J., Noireaux, V. Study of messenger RNA inactivation and protein degradation in an Escherichia coli cell-free expression system. Journal of biological engineering. 4, 9 (2010).
- Shin, J., Jardine, P., Noireaux, V. Genome Replication, Synthesis, and Assembly of the Bacteriophage T7 in a Single Cell-Free Reaction. Acs Synth Biol. 1, 408-413 (2012).
- Siegal-Gaskins, D., Noireaux, V., Murray, R. M., Pao, L., Abramovitch, D. Biomolecular resource utilization in elementary cell-free gene circuits. , 1531-1536 (2013).
- Karzbrun, E., Shin, J., Bar-Ziv, R. H., Noireaux, V. Coarse-grained dynamics of protein synthesis in a cell-free system. Physical review letters. 106, 048104 (2011).
- Hoagland, M. B., Stephenson, M. L., Scott, J. F., Hecht, L. I., Zamecnik, P. C. Soluble Ribonucleic Acid Intermediate in Protein Synthesis. J Biol Chem. 231, 241-257 (1958).
- Wood, W. B., Berg, P. Effect of Enzymatically Synthesized Ribonucleic Acid on Amino Acid Incorporation by a Soluble Protein-Ribosome System from Escherichia Coli. Proceedings of the National Academy of Sciences of the United States of America. 48, 94 (1962).
- Zubay, G. In-Vitro Synthesis of Protein in Microbial Systems. Annu Rev Genet. 7, 267-287 (1973).
- Pratt, J. M., Hames, B. D., Higgins, S. J. . Transcription and Translation: A Practical Approach. , 179-209 (1984).
- Kim, H. C., Kim, D. M. Methods for energizing cell-free protein synthesis. Journal of bioscience and bioengineering. 108, 1-4 (2009).
- Michel-Reydellet, N., Calhoun, K., Swartz, J. Amino acid stabilization for cell-free protein synthesis by modification of the Escherichia coli genome. Metabolic engineering. 6, 197-203 (2004).
- Liu, D. V., Zawada, J. F., Swartz, J. R. Streamlining Escherichia coli S30 extract preparation for economical cell-free protein synthesis. Biotechnology progress. 21, 460-465 (2005).
- Andrianantoandro, E., Basu, S., Karig, D. K., Weiss, R. Synthetic biology: new engineering rules for an emerging discipline. Molecular systems biology. 2, 2006.0028 (2006).
- Kwok, R. Five hard truths for synthetic biology. Nature. 463, 288-290 (2010).
- Tabor, S., Richardson, C. C. A bacteriophage T7 RNA polymerase/promoter system for controlled exclusive expression of specific genes. Proceedings of the National Academy of Sciences of the United States of America. 82, 1074-1078 (1985).
- Lewicki, B. T., Margus, T., Remme, J., Nierhaus, K. H. Coupling of rRNA transcription and ribosomal assembly in vivo. Formation of active ribosomal subunits in Escherichia coli requires transcription of rRNA genes by host RNA polymerase which cannot be replaced by bacteriophage T7 RNA polymerase. Journal of molecular biology. 231, 581-593 (1993).
- Iskakova, M. B., Szaflarski, W., Dreyfus, M., Remme, J., Nierhaus, K. H. Troubleshooting coupled in vitro transcription-translation system derived from Escherichia coli cells: synthesis of high-yield fully active proteins. Nucleic acids research. 34, e135 (2006).
- Kigawa, T., et al. Preparation of Escherichia coli cell extract for highly productive cell-free protein expression. Journal of structural and. 5, 63-68 (2004).
- Matsuda, T., et al. Improving cell-free protein synthesis for stable-isotope labeling. Journal of biomolecular. NMR. 37, 225-229 (2007).
- Sitaraman, K., et al. A novel cell-free protein synthesis system. Journal of biotechnology. 110, 257-263 (2004).
- Becskei, A., Serrano, L. Engineering stability in gene networks by autoregulation. Nature. 405, 590-593 (2000).
- Maeda, H., Fujita, N., Ishihama, A. Competition among seven Escherichia coli sigma subunits: relative binding affinities to the core RNA polymerase. Nucleic acids research. 28, 3497-3503 (2000).
- Caschera, F., et al. Coping with complexity: machine learning optimization of cell-free protein synthesis. Biotechnology and bioengineering. 108, 2218-2228 (2011).
- Hodgman, C. E., Jewett, M. C. Cell-free synthetic biology: thinking outside the cell. Metabolic engineering. 14, 261-269 (2012).
- Elowitz, M. B., Leibler, S. A synthetic oscillatory network of transcriptional regulators. Nature. 403, 335-338 (2000).
- Tsuruta, H., et al. High-level production of amorpha-4,11-diene, a precursor of the antimalarial agent artemisinin, in Escherichia coli. Plos One. 4, e4489 (2009).
- Gardner, T. S., Cantor, C. R., Collins, J. J. Construction of a genetic toggle switch in Escherichia coli. Nature. 403, 339-342 (2000).
- Jewett, M. C., Forster, A. C. Update on designing and building minimal cells. Current opinion in biotechnology. 21, 697-703 (2010).
- Noireaux, V., Libchaber, A. A vesicle bioreactor as a step toward an artificial cell assembly. Proceedings of the National Academy of Sciences of the United States of America. 101, 17669-17674 (2004).
Erratum
Formal Correction: Erratum: Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology
Posted by JoVE Editors on 1/01/1970. Citeable Link.
A correction to Figure 5's legend has been made for the article Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology. Method 1 and method 2 have been switched.Z
The figure legend was update from:
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 1) or post-processed with a QiaQuick PCR purification kit (Purification method 2).
to
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 2) or post-processed with a QiaQuick PCR purification kit (Purification method 1).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved