Method Article
Protocoles pour la mise en œuvre d'un
* Ces auteurs ont contribué à parts égales
Dans cet article
Erratum Notice
Résumé
Ce protocole de cinq jours décrit toutes les étapes, de l'équipement et des logiciels supplémentaires nécessaires pour la création et l'exécution d'une Escherichia coli endogène efficace basé TX-TL système d'expression acellulaire à partir de zéro. Avec des réactifs, le protocole prend 8 heures ou moins de configurer une réaction, collecter et traiter les données.
Résumé
Systèmes d'expression sans cellules idéales peuvent théoriquement émuler un environnement cellulaire in vivo dans un contrôle dans la plate-forme vitro. 1 Ceci est utile pour exprimer des protéines et des circuits génétiques d'une manière contrôlée, ainsi que pour fournir un environnement de prototypage pour la biologie synthétique. 2,3 Pour atteindre ce dernier objectif, les systèmes d'expression sans cellules qui préservent les mécanismes de transcription-traduction endogène Escherichia coli sont capables de refléter plus fidèlement la dynamique cellulaire in vivo que ceux basés sur l'ARN polymérase T7 transcription. Nous décrivons la préparation et l'exécution d'un endogène E. efficace transcription-traduction basée coli (TX-TL) système d'expression acellulaire qui peut produire des quantités équivalentes de protéines comme des systèmes à base de T7 à une réduction de coût de 98% pour les systèmes commerciaux similaires. 4,5 La préparation des tampons et extrait cellulaire brut sont décrit, ainsi que l'exécution d'untrois tube, de réaction TX-TL. Le protocole complet dure cinq jours pour préparer et donne suffisamment de matière pour un maximum de 3000 réactions simples dans une préparation. Une fois préparé, chaque réaction a moins de 8 heures de configuration à la collecte et l'analyse des données. Mécanismes de régulation et de transcription exogène à E. coli, telles que des répresseurs lac / tet et la T7 ARN polymerase, peut être complétée. six propriétés endogènes, telles que l'ARNm et les taux de dégradation de l'ADN, peut également être ajustée. 7 Le système d'expression acellulaire TX-TL a été démontré pour de gros ensemble à l'échelle du circuit, explorer des phénomènes biologiques, et l'expression de protéines dans les deux promoteurs T7 et endogènes. 6,8 modèles mathématiques d'accompagnement sont disponibles. 9,10 Le système résultant a des applications uniques dans la biologie synthétique comme un environnement de prototypage, ou «TX- TL biomoléculaire maquette. "
Introduction
Technologie d'expression acellulaire a commencé dans les années 1950 comme purement translationnelle, avançant ans plus tard pour englober des mécanismes de transcription-traduction couplées en utilisant l'ADN du bactériophage T7. 11,12 Depuis lors, de nombreux efforts ont été faits pour optimiser la création de l'extrait cellulaire brut (ou E . extrait coli S30). 13,14 Ces optimisations incluent prolonger la synthèse des protéines sans cellule grâce à la régénération de l'ATP ou modifications de contrainte, et la réduction du temps de protocole et de coût. 15-17 Autres systèmes d'expression sans cellules existent qui utilisent reconstitué composants en lieu et place de brut extrait de cellules pour l'expression. Tant 5 extrait cellulaire brut et des procédés de reconstitution ont été développés pour une utilisation commerciale.
Avec l'avènement de la biologie synthétique, il ya un besoin accru pour une plate-forme bien caractérisé de tester et d'exprimer modules et circuits biologiques fabriqués. 18,19 Cette plate-forme doit êtrepolyvalent, bien caractérisé, simple à manipuler, et mis l'accent sur les éléments fournis par l'utilisateur. En dépit d'être mis au point d'un demi-siècle plus tôt, les systèmes exempts de cellules basées sur E. coli part intrinsèquement à ces exigences, car elles sont une représentation simplifiée en vitro de processus cellulaires, sans la complexité de la croissance et du métabolisme. En outre, toutes les connaissances de base de travail en vivo sur E. coli s'applique facilement à E. systèmes sans cellules coli.
Bien que les systèmes d'expression sans cellules peuvent avoir des applications dans la biologie synthétique, à ce jour, l'objectif de la plupart des systèmes d'expression sans cellule a été la maximisation de la protéine et le rendement de métabolite. Ceci est accompli en utilisant le bactériophage T7 transcription de séquences commandés par des promoteurs T7. Bien que 20 l'expression est efficace et robuste, ces systèmes ont un but hautement spécialisé. méthodes de régulation cellulaire sont limitées, des modèles d'ADN cibles doivent êtrerepensées pour inclure des promoteurs T7, et certaines séquences telles que les complexes ribosomiques ne peuvent être transcrites et assemblées. 21,22 systèmes d'expression sans cellules existantes sont incapables de maintenir des rendements élevés tout en conservant les mécanismes de régulation endogènes, une polyvalence nécessaire pour la biologie synthétique.
Nous avons développé un E. endogène coli système d'expression acellulaire qui préserve l'efficacité de l'expression de la protéine démontré par les systèmes précédents, mais ajoute à la polyvalence supplémentaire en permettant l'expression et la réglementation fondée sur deux (T7 ou autres) des mécanismes endogènes et exogènes. Le protocole décrit ici est à l'origine basé sur Kigawa et al. (2004) et Liu et al. (2005), mais a des modifications importantes. Il utilise Mg et K-glutamate sur Mg et K-acétate pour une efficacité accrue, élimine le 2-mercaptoéthanol, et lyse des cellules à l'aide d'un cordon-batteur. 17,23,24 Bead-coups est choisi sur l'homogénéisation,procédés basés sur la pression, ou sonication en raison de son faible coût et des rendements comparables aux systèmes concurrents. 23 l'acide 3-phosphoglycérique (3-PGA) est utilisé comme source d'énergie comme il a été constaté pour donner des rendements en protéines supérieure par rapport à la créatine phosphate et phosphoénolpyruvate. 4,25 Notre système peut produire jusqu'à 0,75 mg / ml de protéine rapporteur utilisant un promoteur à base sigma70-avec les opérateurs de lambda-phage ou un promoteur T7-entraîné, rendement similaire à ceux d'autres systèmes commerciaux. 4,6 Cinq jours sont nécessaires pour produire tous les réactifs nécessaires (figure 1). En outre, il permet une réduction des coûts de 98% par rapport aux systèmes sans cellules commerciales comparables - les coûts matériels sont de 0,11 $ par 10 réaction de pi, qui s'élève à 0,26 $ et le travail inclus (Figure 2).
Protocole
Une. Préparation extrait cellulaire brut
Préparation extrait cellulaire brut sur trois jours nécessite deux personnes de mener efficacement. Le protocole consiste fonctionnellement de trois parties: la croissance de la culture (étape 1.1 à l'étape 1.11), lyse cellulaire (étape 1.12 à l'étape 1.37), et extraire clarification (étape 1.38 à l'étape 1.52). Il est présenté divisé en jours pour plus de commodité. Extrait idéal peut produire 0,75 mg / ml de plasmide à partir de deGFP pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 (Addgene # 40019), et a une concentration de l'extrait cellulaire brut entre 27 à 30 mg / ml de protéine. Toutefois 4 , les caractéristiques d'extraction varient d'un lot à l'. La recette suivante fournit assez pour environ 3.000 réactions simples (6 ml d'extrait cellulaire brut). Si révision à la baisse, il est recommandé d'utiliser pas moins de 1/6 de valeurs données ici. En raison de contraintes de temps, mise à l'échelle vers le haut n'est pas recommandé.
Jour 1
- Préparer des milieux de culture bactérienne, culplaque de ture, et les médias des suppléments tels que décrits dans le Tableau 1. Voir complémentaire Matériel 1 pour les recettes.
- . Souche BL21-Streak Rosetta2 de -80 ° C sur une plaque de gélose YT 2x + P + Cm et incuber pendant au moins 15 heures à 37 ° C ou jusqu'à ce que les colonies soient bien visibles Remarque: chloramphénicol (Cm) est utilisée pour sélectionner un plasmide codant pour les ARNt rares dans la souche BL21-Rosetta2.
Jour 2
- Préparation des tampons et des suppléments tels que décrits dans le tableau 2. Voir complémentaire Matériel 1 pour les recettes.
- Préparer et stériliser le matériel nécessaire pour le jour 3, y compris: 6 x 4 flacons L Erlenmeyer avec une couverture de papier d'aluminium (autoclave), 4 x 1 L bouteilles à centrifuger stériles, entonnoir (autoclave), 100 g de 0,1 perles mm de verre (autoclave), 2 remuer-barres (autoclave), 1 L et 500 ml graduée (autoclave), 2 x 1 L béchers (autoclave), 3 ml seringue avec 18 g d'aiguilles (stériles), 2-3 flbouées d'avoine, 2-3 10k MWCO cassettes de dialyse (stérile), des cuvettes.
- Préparer une mini-culture. Ajouter 4 ml de 2xYT + P médias et 4 pi de cm pour un tube de culture stérile de 12 ml et préchauffer à 37 ° C pendant 30 min.
- Inoculer mini-culture 1 avec une colonie de la 2xYT + P + plaque de gélose cm. Incuber à 220 tours par minute, 37 ° C pendant 8 heures.
- 7 h et 30 min plus tard, préparer mini-culture 2. Ajouter 50 ml de 2 x YT + P médias et 50 ul de CM à une fiole Erlenmeyer de 250 ml stérile, et le pré-chauffer à 37 ° C pendant 30 min.
- Ensemencer mini-culture 2 avec 100 ul de mini-culture et une incubation à 220 tours par minute, 37 ° C pendant 8 heures.
Jour 3
- Peser quatre vides stériles 50 ml tubes Falcon et de la masse d'enregistrement dans le tableau 3. Réfrigérer tubes Falcon sur la glace; celles-ci seront utilisées par la suite à l'étape 1.18.
- 7 h et 30 min après l'étape 1.8, préparer médias finale de culture bactérienne. L'utilisation d'un stérile 1 L graduée, le transfert de 660 ml de 2xYT + P médias into chacun des six flacons 4 L Erlenmeyer et préchauffer à 37 ° C pendant 30 min. Note: 4 L ou plus erlenmeyers sont recommandés pour une bonne aération.
- Ajouter 6,6 ml de mini-culture 2 dans chaque 4 L Erlenmeyer de. Incuber à 220 tours par minute, 37 ° C jusqu'à ce que la culture atteigne une densité optique de 1,5 à 2,0 à 600 nm (correspondant à la phase de croissance semi-logarithmique). Vérifiez OD périodiquement avec une dilution 1:10 de la culture pour l'exactitude Cette étape ne devrait pas prendre plus de 3 h - 3 h 45 min;. La croissance et la collecte lors de la phase semi-logarithmique rapide est essentiel pour la qualité de l'extrait.
- Immédiatement après la croissance, de transférer toutes les cultures de manière égale en quatre flacons de centrifugation 1 L et centrifuger à 5000 g pendant 12 min à 4 ° C pour sédimenter les cellules bactériennes.
- Alors que la centrifugation, la préparation complète de tampon S30A en ajoutant 4 ml de 1 M DTT à 2 L de préalablement préparé S30A. Mélanger et maintenir tampon sur la glace.
- Lorsque la centrifugation est terminée, retirez complètement surnageant de l'étape 1.12 par décanting et buvard les bouteilles de centrifugation sur une serviette en papier stérile.
- Ajouter 200 ml de tampon S30A à 4 ° C pour chacune des quatre bouteilles de centrifugation, et agiter vigoureusement jusqu'à ce que les bouteilles culot est complètement solubilisé sans grumeaux restants. Centrifuger les quatre bouteilles à 5000 g pendant 12 min à 4 ° C.
- Supprimer complètement surnageant de l'étape précédente par décantation et buvard les bouteilles de centrifugation sur une serviette en papier stérile.
- Répétez les étapes 1.15 et 1.16.
- Ajouter 40 ml de tampon S30A à 4 ° C à chaque flacon à centrifuger. . Transférer chaque pastille et la combinaison S30A dans un tube Falcon réfrigérée de 1,9) Remarque: Cette étape consiste à transférer les pastilles dans un petit récipient.
- Centrifuger les tubes Falcon à 2000 g pendant 8 min à 4 ° C. Retirer le surnageant par décantation.
- Re-centrifuger les tubes Falcon à 2000 g pendant 2 min à 4 ° C. Supprimer complètement le surnageant résiduel par pipette. Garder sur la glace.
- Peser le fnos tubes Falcon avec culot et de la masse d'enregistrement dans le tableau 3. Calculer la masse de granulés, le volume de tampon nécessaire S30A, et la masse de billes nécessaires sur la base des formules spécifiques dans le tableau 3.
- Chargement correct et perle coups de la pastille est essentielle à la prise d'extrait de qualité, et est l'étape la plus difficile. Il est recommandé de revoir la vidéo avant de tenter. Le défaut d'éviter les bulles d'air et répartir uniformément les perles se traduira par extrait inefficace.
- Ajouter la quantité de tampon S30A calculé dans le tableau 3 pour chaque tube Falcon, vortex jusqu'à homogénéité, et retourner à la glace.
- Tout en gardant les autres tubes Falcon sur de la glace, ajouter des perles de façon intermittente à un tube Falcon unique en trois fractions aliquotes, chacune utilisant 1/3 du total des perles. Après l'addition de chaque fraction aliquote de perles, vortex pendant 30 s. Placez Falcon tube sur la glace entre les étapes de vortex et après vortex final. Après la dernière aliquote est ajouté, assurerbilles sont réparties uniformément. Une pâte épaisse doit être formé.
- Préparer un 5 ml (volume) pointe de la pipette en coupant l'extrémité à l'aide d'une lame de rasoir stérile pour créer une ouverture de 3-4 mm. Composez pipette 2 ml Remarque: Différents ensembles de pipettes et des conseils fournissent des quantités différentes de succion qui peut ne pas être suffisante pour tirer et libérer solution perles de cellules d'épaisseur; une pointe de pipette de 1 ml avec embout retiré peut être utilisé à la place..
- Placez 20 tubes de perles battant sur la glace.
- Vérifiez haute viscosité de la solution cellulaire perle en utilisant une pipette modifié. Il devrait être visqueuse au point de la sortie à peine la pointe de la pipette lors de l'éjection. Si trop visqueux, réglez pointe de pipette selon l'étape 1.25. Si ce n'est pas assez visqueux, perles peuvent être ajoutés par incréments de (granulés de masse * 0,05), pour une masse maximale (masse de granulés * 5.1). Après chaque ajout de perles, vortex pendant 30 secondes et revenir à glace. Voir la figure 3a pour une démonstration de la viscosité.
- Retirer la solution de perles cellule de Falcon tube en utilisant une pipette modifié, et de les transférer dans un tube stérile de perles de battre, de le remplir aux trois quarts avec une solution de perles cellule. Spin très brièvement (1 seconde) sur un compteur mini-centrifugeuse pour éliminer les bulles d'air sans redistribution des perles. Voir les figures 3b-d pour les images fixes d'un tube de perles de battre le chargement.
- Terminez en ajoutant une solution de perles cellule pour former un ménisque concave.
- Ajouter une très petite goutte de solution de perles cellule sur l'intérieur d'un bouchon de tube de perles en battant, en faisant attention à ne pas gêner la lèvre à l'extérieur de la capsule, sinon le tube de perles à-coups ne se ferme pas sufficientl y. Appuyez sur le bouchon sur une surface plane et vérifiez qu'il n'y a pas de bulles d'air sur le fond de la capsule.
- Boucher le tube en forme de bourrelet battant avec le capuchon de talon de battre de l'étape précédente. Main pour assistant pour perle battre. Si fait correctement, le couvercle doit être fermé hermétiquement, sans bulles d'air should être visible, et peu (le cas échéant) solution perles cellule doit déborder. Refaire le processus de chargement si les bulles d'air sont visibles ou le bouchon ne se ferme pas complètement.
- Vortex tube Falcon de l'étape avec la solution 1,24 bourrelet cellules restantes pour assurer une distribution uniforme de billes. Répétez les étapes 1.28 à 1.31 jusqu'à Falcon tube est vide, puis répétez les étapes 1.24 à 1.31 pour chaque tube Falcon supplémentaire.
- Conduite étapes de 1,33 à 1,38 fois. Avez-assistant prise rempli de perles de battre les tubes de 1,31 et placer sur la glace. Une fois que deux tubes de perles de battre remplis ont été recueillis et ont été sur la glace pendant au moins une minute, commencer perle battre.
- Battre un tube de 30 sec à 46 min. Placez la tête en bas sur la glace pendant 30 secondes en battant l'autre tube.
- Répétez l'étape précédente de telle sorte que chaque tube rempli de billes de battre a été battu pendant 1 min au total.
- Répétez les étapes de 1,33 à 1,35 jusqu'à 8 tubes remplis de perles battement (ou le montant maximal de la centrifugeuse peut contenir) have été traitées. Ensuite, construire un appareil de filtration de 15 ml Falcon (figure 3e). Ajouter un nouveau chapeau de perle-battant, volets plat face vers le haut, vers le bas d'un Falcon 15 ml. Ensuite, retirer le bouchon de tube de perles à-coups et traités colonne micro-chromatographie appuyez fermement sur l'extrémité du tube traité de perles de battre jusqu'à ce que complètement scellé. Casser la fin de l'élution de la colonne micro-chromatographie, et placer la colonne micro-chromatographie, élution tourné vers le bas, en tube vide perles perles. Placez ce complexe dans 15 ml Falcon. Répétez l'opération pour tous les 8 tubes de perles de battre remplis; garder sur la glace lorsque vous avez terminé.
- Centrifugeuse 8 appareils de filtrage, tube Falcon non plafonnés, à 6000 g pendant 5 min à 4 ° C pour séparer l'extrait et le culot de perles.
- Vérifiez chaque tube perle de battre a produit extrait viable. Extrait correctement battre ne sera pas trouble, et le culot aura deux couches distinctes. Jeter tous les tubes troubles, et transférer le surnageant de tubes non turbides into individuels 1,75 ml tubes micro-centrifugeuse, en prenant aussi peu que possible. culot Garder sur la glace jusqu'à ce que tous les tubes de perles de battre ont été traitées. Voir Figure 3f comparant un tube perle de battre correctement contre mal traitée.
- Centrifuger les tubes de micro-centrifugation de l'étape précédente à 12 000 g pendant 10 min à 4 ° C.
- Transfert surnageant sans granulés dans des tubes de perles battement vides à l'aide d'une pipette, la consolidation de 500 pi dans un nouveau tube de perles de battre.
- Incuber étape précédente, avec caps-battant supprimé, à 220 tours par minute, 37 ° C pendant 80 min. Cette étape digère les acides nucléiques restants en utilisant des exonucléases endogènes libérés pendant le processus de perles perles, et peut être fait en tenant le tube de perles à-coups dans un tube de culture de tissus.
- Préparer le matériel de dialyse. La préparation complète tampon S30B en ajoutant 2 ml de 1 M DTT à 2 L de préalablement préparé S30B. Mélanger et ajouter 900 ml dans chacun des deux rerile 1 L béchers. Ajouter agitateur magnétique stérile dans chaque bécher; garder à 4 ° C.
- Après l'étape 1.41, extrait devrait ressembler trouble. Consolider extrait dans 1,5 ml aliquotes à 1,75 ml tubes micro-centrifugeuse et centrifuger à 12000 g pendant 10 min à 4 ° C.
- Aide d'une pipette, consolider surnageant sans pastille en tubes de 15 ml Falcon sur la glace, et bien mélanger en plafonnant le tube et inverseur. Économisez 10 pi de surnageant sur la glace pour l'étape 1.47.
- Déterminer la quantité totale de produit extrait, et hydrater le nombre nécessaire de 10k MWCO cassettes de dialyse par submersion dans S30B pendant 2 min, en supposant que 2,5 ml d'extrait par cassette.
- Chargez cassettes avec 2,5 ml d'extrait. Chaque gobelet peut prendre jusqu'à deux cassettes; dialyser, agitation, à 4 ° C pendant 3 heures Note: chargement partiel de cassettes est acceptable.. Dialyse augmente le rendement de production de protéines.
- Au cours de l'étape précédente, de caractériser la protéine de l'extraitconcentration d'un dosage de Bradford, en utilisant un extrait enregistré à l'étape 1.44. Voir Matériel supplémentaire 2 pour plus de détails.
- Après dialyse terminée, extrait aliquote de 1,5 ml à 1,75 ml tubes micro-centrifugeuse. Centrifuger à 12 000 g pendant 10 min à 4 ° C. Un culot se forme au fond du tube.
- Consolider surnageant clair de l'étape précédente à la pipette dans un tube Falcon de 15 ml sur la glace. Homogénéiser par retournement 5-10x.
- Sur la base de la concentration déterminée dans l'étape par Bradford 1,47, déterminer quantité d'extrait pour aliquoter dans des tubes individuels 1,75 ml. Chaque tube individuel doit avoir un volume de 810 à 900 mg de protéine totale. Extrait doit avoir une concentration totale en protéines supérieure à 27 mg / ml. Cette étape nécessite l'assistance d'effectuer de manière appropriée. Remarque: extrait aliquote en dessous de 30 mg / ml en 30 aliquotes, et échelle si la concentration est plus élevée, par exemple, extrait aliquote à 28 mg / ml par 30 pi, et extrait aliquote à 32mg / ml de 28,1 pi.
- extrait aliquote après l'étape 1.50, en prenant soin d'éviter les bulles. Extrait Flash gel dans de l'azote liquide. Remarque: aliquotes avec des bulles peuvent être éliminés par centrifugation à 10 000 g pendant 30 sec à 4 ° C.
- Retirer les tubes de l'azote liquide à l'aide d'une passoire et stocker immédiatement à -80 ° C. Sécurité: Porter des lunettes de protection, les bouchons de tubes d'extraction peuvent se détacher en raison de la différence de température entre l'azote liquide et à température ambiante.
2. Préparation de la solution d'acide aminé
Solution d'acide aminé doit être préparé en vrac. La recette suivante utilise un kit complet de RTS acides aminés Sampler, fournissant suffisant pour environ 11 000 réactions simples. Si révision à la baisse, il est recommandé de ne pas utiliser moins de la moitié d'un kit. Chaque acide aminé dans le stock est alimenté à 1,5 ml, 168 mM, sauf pour la leucine à 140 mM. La composition finale de la solution d'acides aminés est la suivante:leucine, 5 mM, tous les autres acides aminés, 6 mM. C'est la concentration de travail 4x.
- Retirer tous les 20 acides aminés à partir de -20 ° C et décongélation à température ambiante. Une fois décongelé, vortex jusqu'à ce que les acides aminés se dissolvent, l'incubation à 37 ° C si nécessaire. Après acides aminés sont dissous, mettre tous les acides aminés sur de la glace à l'exception de Asn, Phe, et Cys, qui sont conservés à la température ambiante. Cys peuvent pas dissoudre complètement.
- Sur de la glace, ajouter 12 ml d'eau stérile à 50 ml d'un tube Falcon stérile.
- Ajouter 1,5 ml de chaque acide aminé dans l'ordre suivant, en prenant soin de vortex le tube Falcon après chaque addition et de maintenir la solution sur de la glace: Ala, Arg, Asn, Asp, Gln, Glu, Gly, His, Ile, Lys, Met, Phe, Pro, Ser, Thr, Val, Trp, Tyr, Leu, Cys. Cys peuvent être ajoutés sous forme de suspension. Après l'addition, vortex jusqu'à dissolution est relativement claire, l'incubation à 37 ° C si nécessaire. Cys peuvent pas dissoudre complètement.
- Aliquote de solution d'acides aminés dans 50 tubes à26 pi de chacun sur la glace. Aliquoter le reste à 500 pi par tube sur la glace. Les 26 aliquotes seront utilisées pour calibrer extrait, alors que les aliquotes de 500 seront utilisés pour la préparation de tampon. Bien aliquotage, vortex le stock principal fréquemment pour éviter une répartition inégale de la suspension.
- aliquotes de gel de Flash dans l'azote liquide et conserver à -80 ° C. Sécurité: Porter des lunettes de protection, les bouchons de tubes d'extraction peuvent se détacher en raison de la différence de température entre l'azote liquide et à température ambiante.
- Facultatif: Effectuer une analyse de l'activité de nouveau fait une solution d'acide aminé contre précédemment faites Solutions des acides aminés.
3. Préparation de la solution de l'énergie
Solution de l'énergie est utilisée à la fois pour l'étalonnage extrait cellulaire brut et pour la création de tampon, et doit être préparée en vrac. La recette suivante fournit suffisant pour environ 10 000 réactions simples. Si révision à la baisse, il est recommeDEMVSO d'utiliser pas moins de 1/24 des valeurs indiquées ici. Comme la solution de l'énergie est un coût monétaire importante, les utilisateurs première fois peuvent veulent se préparer au 1/24 échelle. La composition finale de la solution de l'énergie est la suivante: HEPES 700 mM pH 8, 21 mM ATP, GTP 21 mM, 12,6 mM de CTP, UTP 12,6 mM, ARNt de 2,8 mg / ml, 3,64 mM de CoA, NAD 4,62 mM, AMPc 10,5 mM, acide folinique 0,95 mM, spermidine 14 mM, 3-PGA 420 mM. C'est 14x concentration de travail. Si on le souhaite, chaque élément individuel dans le tableau 4 peuvent être stockées à -80 ° C pour une utilisation ultérieure.
- Retirer tous les produits chimiques dans le tableau 4 de -80 ° C, -20 ° C, ou 4 ° C à la température ambiante pendant 30 min.
- Préparer des solutions de la manière décrite dans le tableau 4. Voir complémentaire Matériel 1 pour les recettes. Placez toutes les solutions sur la glace après la préparation.
- Dans un tube Falcon de 15 ml, ajouter dans l'ordre suivant, en prenant soin de vortex le tube Falcon après chaque addition et de conserver les solutions on glace: 3,6 ml 2 M HEPES, 144 pi d'eau, 1,39 ml nucléotide mélange, 576 ul de 50 mg / ml d'ARNt, 576 ul de 65 mM CoA, 276 pi mM NAD 175, 170 pi mM AMPc 650, 288 pl 33,9 acide mM folinique , 144 pi de 1 M de spermidine, et de 3,09 ml de 1,4 M de 3-PGA.
- Energy Solution aliquote dans 50 tubes à 7 pi de chacun sur la glace. Aliquoter le reste à 150 pi par tube sur la glace. Les 7 aliquotes seront utilisées pour calibrer extrait, tandis que les 150 aliquotes seront utilisés pour la préparation de tampon. Bien aliquotage, vortex le stock principal fréquemment.
- aliquotes de gel de Flash dans l'azote liquide et conserver à -80 ° C. Sécurité: Porter des lunettes de protection, les bouchons de tubes d'extraction peuvent se détacher en raison de la différence de température entre l'azote liquide et à température ambiante.
- Facultatif: Effectuer une analyse de l'activité des nouveaux faits Energy Solution contre précédemment faites Energy Solutions.
4. Préparation tampon
BufPréparation fer nécessite la réalisation de cellules brut Extrait Préparation, acides aminés Préparation de la solution, et Préparation de la solution de l'énergie. Chaque tampon est unique à un lot d'extrait cellulaire brut. Mg-glutamate, K-glutamate, et TNT (dans cet ordre) sont optimisés dans cette section pour produire des réactions des teneurs maximales d'expression. Le protocole suivant utilise un modèle pré-écrit, TXTL_e (modèle) _calibration_JoVE.xlsx (Matériau supplémentaire 3), de calibrer extrait cellulaire brut préparé à l'avance et préparer tampon. Cependant, on peut également étalonner l'extrait cellulaire brut, et préparer un tampon sans le gabarit en optimisant Mg-glutamate, K-glutamate, et DTT manuellement et la mise en place du tampon de telle sorte que le long de l'extrait, il est de 75% d'un volume total de réaction. Si calibrer manuellement, les conditions de réaction finaux peuvent être trouvés à l'étape 5.
- Remplissez le formulaire "Données générales".
- Dégel de la glace 100 mM Mg-glutamate (4 ° C), 3 M K-glutamate (4 ° C), 6Solution mM d'acides aminés (de 26 pi, 80 ° C), la solution de l'énergie (7 pi, 80 ° C), 100 mM de DTT (-20 ° C), l'ADN témoin positif (-20 ° C), 40% de PEG- . 8000 (4 ° C), extrait cellulaire brut (-80 ° C), et de l'eau (4 ° C) Remarque: Utilisez 1 nM concentration de travail pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 (Addgene plasmide 40019) pour le contrôle positif (excitation 485 nm, émission 525 nm), ou une autre référence qui produit une intensité de signal élevée. 4
- Préparer sept réactions 10,5 pi, tester une gamme de 4-10 mM supplémentaire Mg-glutamate, en aliquotant montants fixes d'actions Mg-glutamate dans des tubes individuels micro-centrifugeuse. Remarque: Bien que 10,5 pi réactions sont d'abord préparés, la réaction finale est de 10 pi.
- Préparer mélange maître, comme indiqué dans le modèle sous "calibrage Mg-glutamate", ajoutant un supplément de 80 mM de K-glutamate. Gardez sur la glace et vortex après l'ajout de chaque élément. Remarque: Les valeurs données ici et dans le modèle sonten plus des quantités de Mg-glutamate, K-glutamate, et DTT présent dans le tampon S30B utilisé pour fabriquer l'extrait cellulaire brut.
- Ajouter master mix à des échantillons contenant Mg-glutamate et préparer réactions. Voir les étapes 5.10 à 5.13 pour les instructions détaillées.
- Exécutez réaction à 29 ° C, soit dans un incubateur ou un lecteur de plaques.
- . Déterminer la concentration de Mg-glutamate optimale par niveau de fin d'expression et le taux maximal de l'expression de la protéine (figure 4a) Note: Temps d'exécution varient en fonction de l'expérience, mais durent généralement moins de 8 heures.
- Répétez les étapes 4.2 à 4.7 pour K-glutamate sous "Calibrage du K-glutamate," la définition des niveaux de Mg-glutamate à ceux trouvés dans l'étape 4.7.
- Répétez les étapes 4.2 à 4.7 pour la TNT sous "calibrage TNT," la définition des niveaux de Mg-glutamate à ceux trouvés dans l'étape 4.7 et les niveaux de K-glutamate à ceux trouvés dans l'étape 4.8. Remarque: Nous avons constaté que ajouté TNT n'affecte pas significativement la fin les niveaux d'expression.
- Utilisezvaleurs trouvées dans l'étalonnage dans "composition tampon" afin de déterminer la composition du tampon d'être préparé. Sur la base de la quantité d'extrait cellulaire brut produit, un mélange recette de base est produite pour une quantité déterminée de tampons.
- Décongeler aliquotes comme indiqué mélange maître recette sur la glace. Une fois décongelé, préparer mélange maître, en restant sur la glace et vortex après l'addition de chaque article.
- Aliquote par montant indiqué sous la rubrique «composition tampon." Tubes tampons Flash de gel dans de l'azote liquide. Bien aliquotage, vortex le stock principal fréquemment.
- Retirer les tubes de l'azote liquide à l'aide d'une passoire et stocker immédiatement à -80 ° C. Sécurité: Porter des lunettes de protection, les bouchons de tubes d'extraction peuvent se détacher en raison de la différence de température entre l'azote liquide et à température ambiante.
5. Exécution expérimentale d'une réaction TX-TL
Conditions réactionnelles finales sont: 8.9 à 9.9 mg / ml prote(à partir de l'extrait brut), 4,5 mM 10,5 mM-Mg-glutamate, 40 à 160 mM de K-glutamate, de 0,33 à 3,33 mM de DTT, 1,5 mM de chaque acide aminé à l'exception de la leucine, leucine 1,25 mM, HEPES 50 mM, ATP 1,5 mM et GTP, mM CTP 0,9 et UTP, 0,2 mg / ml d'ARNt, 0,26 mM de CoA, mM NAD 0,33 mM cAMP 0,75, 0,068 mM d'acide folinique, 1 mM de spermidine, 30 mM de 3-PGA, 2% de PEG-8000. Un TX base -TL réaction a trois parties (tubes): extrait cellulaire brut, tampons, et d'ADN. Le ratio est de: 75% de tampon et de l'extrait, de l'ADN de 25% Les réactions peuvent varier en volume, et nous utilisons 10 pi par convention pour minimiser le volume de réaction et permet d'exécuter dans une plaque de 384 puits.. Les volumes plus importants nécessitent l'agitation pour l'oxygénation correcte. Le protocole suivant utilise un modèle pré-écrit, TXTL_JoVE.xlsx (Supplemental Matériel 4), pour conduire une réaction de 10 ul. Articles en violet indiquent les valeurs saisies par l'utilisateur, et articles en bleu indiquent des réactifs supplémentaires à ajouter à la réaction. Cependant, on peut aussi procéder à un esprit de réactionhout le modèle en suivant les conditions de réaction décrites ci-dessus.
- Remplissez le formulaire "Données générales".
- Sous "Master Mix Préparation», insérer le pourcentage d'extrait de l'étape 4.1 dans la boîte violette.
- Concevez votre expérience in silico en utilisant le «Master Mix Préparation» (lignes 10-17) et «Préparation de l'ADN" (lignes 19-50) sections. En général, les constantes peuvent être mis dans la section "Master Mix Préparation", tandis que les variables peuvent être mis dans la section "Préparation de l'ADN". Réduire échantillons par expérience pour éviter l'évaporation échantillon et les préjugés du temps de démarrage expérimental. Voir la figure 6 pour un exemple de configuration.
- Sous "Master Mix Préparation», ajouter des réactifs tels que des inducteurs ou des protéines, qui iront dans tous les échantillons à une concentration constante. A partir de la ligne 14, de remplir les zones ombragées bleu, en gardant un réactif à chaque ligne. Les unités sont des rapports relatifs.
- Sous la rubrique «Préparation de l'ADN», ajouter l'ADN qui sera spéci échantillonic. ID échantillon de n ° 1 et n ° 2 correspondent aux contrôles positifs et négatifs, respectivement. ID échantillon n ° 3 et au-dessus sont pour l'ADN, la concentration du stock en ng / ul, longueur en paires de bases, la concentration finale souhaitée en nM, et répétitions (de 10 réactions ul)-modifiable par l'utilisateur. La quantité d'ADN d'actions pour atteindre la concentration finale désirée est calculée automatiquement. . Total pour les sommes des lignes à 10,5 * n, où n est le nombre de répétitions Remarque: Bien que le volume de réaction final est de 10 ul, les calculs supposent un volume total de 10,5 ul par réaction, pour tenir compte de la perte de volume pendant le pipetage.
- Sous la rubrique «Préparation de l'ADN», ajouter les réactifs ou les ADN supplémentaire qui sera spécifique échantillon de colonnes bleues. Concentrations Stock ADN en nM peuvent être calculés sous la rubrique «Préparation de l'ADN», tandis que les réactifs spécifiques d'exemple requièrent le calcul manuel basé sur un volume total de réaction de 10,5 * n. Les volumes introduits sont soustraites hors du volume d'eau de la même rangée.
- Retirer numbe nécessairer de tubes de tampon, extrait cellulaire brut, et le contrôle positif à la rubrique «Tubes à décongeler," de -20 ° C ou -80 ° C et le dégel de la glace.
- Préparer des échantillons d'ADN. Pour chaque échantillon, ID, aliquote sur l'ADN indiqué, l'eau et les éléments fournis par l'utilisateur par la section "Préparation de l'ADN" dans un tube de micro-centrifugeuse, à la température ambiante. Remarque: pour éviter la perte de l'échantillon, récemment pipettes et bas-bâton calibrés embouts de pipette et tubes de micro-centrifugation sont recommandés.
- Lorsque les tubes de l'étape 5.7 sont décongelés, préparer le mélange maître constitué de tampon, extrait, et des éléments globaux fournis par l'utilisateur sur la base des boîtes orange-ombragée, gardant sur la glace et vortex après l'ajout de chaque élément. Remarque: Extract est extrêmement visqueux. Des aliquotes avec des bulles peuvent être éliminées par centrifugation à 10 000 xg pendant 30 s à 4 ° C.
- Ajouter la quantité de mélange maître indiqué dans les cellules oranges sous «Préparation de l'ADN" (colonne O) pour chaque échantillon d'ADN, et de garder à température. Traiter ce que l'heure de début de réaction.
- Vortexer chaque échantillon, et centrifuger à 10 000 g pendant 30 sec à la température ambiante pour faire tomber n'importe quel échantillon résiduel et pour réduire les bulles.
- Si la conduite réaction dans des tubes de micro-centrifugation, incuber directement à 29 ° C. . Sinon, pipette 10 ul d'échantillon dans une plaque 384 puits Remarque: Réactions des volumes de plus de 10 pi peuvent nécessiter l'agitation pour l'oxygénation.
- Plaque centrifuger à 4000 g pendant 30 secondes à la température ambiante pour faire tomber n'importe quel échantillon résiduel et à réduire les bulles. Sceller la plaque après pour éviter l'évaporation.
- Réaction de fonctionner à 29 ° C. Note: Temps d'exécution varient selon l'expérience, mais durent généralement moins de 8 heures.
Résultats
Nous avons présenté un protocole de cinq jours pour la préparation d'un Escherichia coli endogène fondé TX-TL système d'expression acellulaire. Un calendrier de l'échantillon pour créer les réactifs - extrait cellulaire brut et tampons - peut être trouvé dans la figure 1. Une fois créés, ceux-ci peuvent être stockés à -80 ° C pendant jusqu'à un an. Après réactifs sont créés, expérimental et l'exécution peut être fait en moins de 8 heures.
En outre, nous avons optimisé les conditions d'expression du système d'expression acellulaire TX-TL. Autres ajouts fournies par l'utilisateur, tels que des tampons ou des solutions d'ADN, doivent être calibrés pour la toxicité au préalable. Par exemple, les différentes méthodes de transformation conduisent à des plasmides d'expression différents en raison de la teneur en sel. Nous avons également testé l'effet de tampon d'élution de Tris-Cl sur l'efficacité de réaction (figure 5).
Un exemple d'étalonnage de brut extrait cellulaire, l'étape de renvoi 4.1 à 4.9, est illustréla figure 4a. En général, nos expériences montrent que l'extrait cellulaire brut est le plus sensible à des niveaux de Mg-glutamate, suivie de niveaux K-glutamate. Pour démontrer le système d'expression acellulaire, nous avons construit et testé une boucle de rétroaction négative fondée sur tet répression. 26 (figure 6). Dans le système d'expression acellulaire, le même circuit course avec et sans ATC montre un point final changement d'expression 7 fois de deGFP journaliste après huit heures d'expression. Bien que cette expérience ne nécessite pas des inducteurs ou des répresseurs mondiaux, si nécessaire, ils peuvent être ajoutés sous la rubrique «Master Mix Préparation."
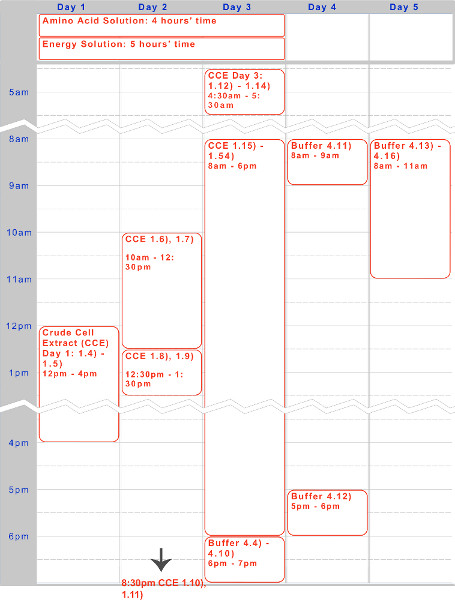
Figure 1. Chronologie de l'extrait cellulaire brut, une solution d'acide aminé, et de l'énergie préparation de la solution. Timelin A cinq jours e pour une exécution typique du protocole est donnée ci-dessus, optimisé pour des incubations d'une nuit et les phases de travail pendant la journée.
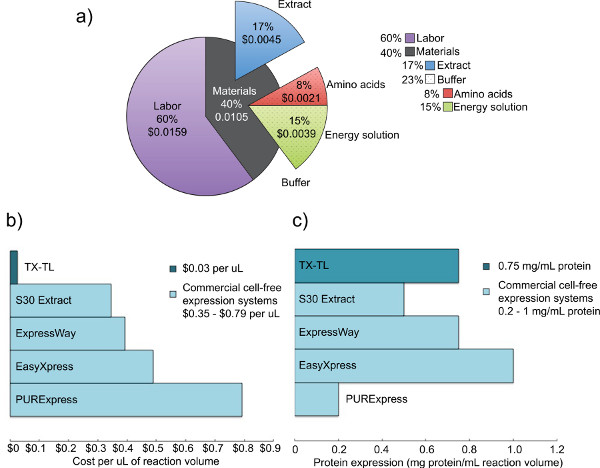
Figure 2. Coût et analyse de l'expression des extraits cellulaires bruts concurrence. a) Répartition des coûts de main-d'œuvre et les matériaux du système d'expression acellulaire TX-TL. Sur la base de coûts de réactifs que de Décembre 2012, et les coûts de main-d'œuvre de 14 $ par heure. B) Comparaison de TX-TL coûts du système de la libre expression des cellules contre d'autres systèmes commerciaux. Les coûts sont ventilés par ml, bien que les volumes de réaction peuvent varier selon le kit. C) Comparaison de TX-TL rendement du système de la libre expression des cellules par rapport aux autres systèmes commerciaux. rendement d'expression de la protéine déterminée par les normes du fabricant./ 50762fig2large.jpg "target =" _blank "> Cliquez ici pour agrandir la figure.

Figure 3. Chargement en cours et le traitement d'un tube de perles de battre. a) Démonstration de viscosité correcte de solution cellulaire perle. Solution Cell-perle aura une viscosité dépend de nombreux facteurs, y compris quantité de tampon S30A ajouté, la quantité de billes ajoutées, et le temps passé sur la glace. B) Chargement de tube de perles à-coups avant rapide table centrifugation. La centrifugation élimine les bulles accumulées pendant le chargement. C) Bulles de surfaçage après centrifugation table. La taille des bulles varie, ils peuvent être sauté ou éliminées à l'aide d'une pipette d) le tube complètement rempli de billes de battre avant bouchage.. Un ménisque est formé dans le bourrelet battant t-ube, et le bouchon a assez pour couvrir et provoquer de petites quantités à remplir. e) appareil de filtre correctement chargé. Ceux-ci peuvent être réutilisés. F) Comparaison de correctement contre le tube mal traitées de perles battre. Le tube sur la gauche est un tube bien-beat - il dispose d'une petite et bien délimitée couche supérieure, et un surnageant clair. Le tube situé sur la droite est sous-optimale, en fonction de la plus grande, et la deuxième couche trouble du surnageant trouble. Tubes qui sont sous-optimale ne devraient pas subir de traitement supplémentaire.
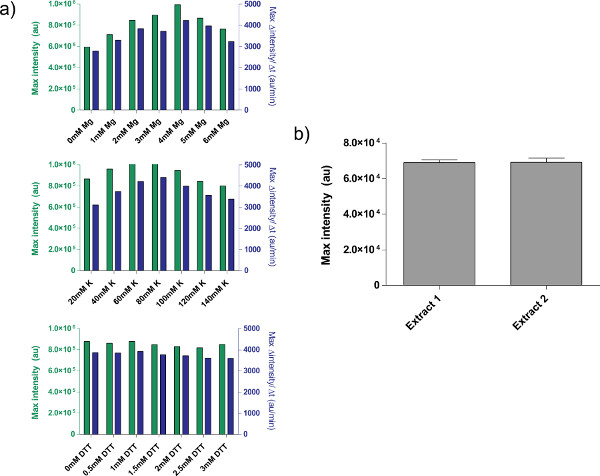
Figure 4. Propriétés des préparations d'extraits brut. a) les parcelles d'étalonnage typiques pour l'extrait cellulaire brut. Extrait brut est calibré pour Mg-glutamate supplémentaire, K-glutamate, et les niveaux de DTT, dans cet ordre. Montré est extrémité fluorescence après 8 h, ainsi que le taux maximal de production de protéines basée sur une moyenne mobile de 12 minutes. Sur la base de ces parcelles, une gamme acceptable de plus Mg-glutamate est de 4 mm, K-glutamate est de 60-80 mM, et la TNT est de 0-3 mM. Notez que chaque extrait brut doit être calibré indépendamment de ces trois variables. B) Variation de préparations d'extraits. Endpoint fluorescence de deux extraits bruts préparés à des dates différentes est montré; barres d'erreur sont une déviation standard de trois essais indépendants sur différents jours. Cliquez ici pour agrandir la figure .
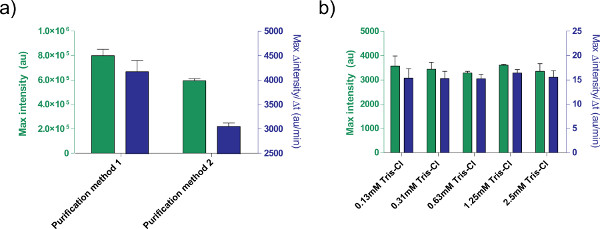
Figure 5. Effets de la solution d'ADN sur l'efficacité de l'expression. a) Comparaison de deux purification différentdes procédés pour le traitement de plasmides. 1 nM de pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 est préparé en utilisant uniquement un kit QiaPrep Spin Miniprep (méthode de purification 1) ou post-traitement avec un kit de purification PCR QiaQuick (méthode de purification 2). Montré est extrémité fluorescence après 8 h, ainsi que le taux maximal de production de protéines sur la base d'une moyenne mobile de 12 minutes. Les barres d'erreur sont une déviation standard de quatre essais indépendants sur des jours différents. b) Effet de tampon d'élution (Tris-Cl). Différentes concentrations de Tris-Cl sont comparées dans une réaction d'expression sans cellule sur la base de l'expression de 1 nM de pBEST-OR2-OR1-Pr-UTR1-deGFP-T500. Les concentrations indiquées sont des concentrations finales de Tris-Cl dans la réaction; tampon d'élution utilisé est 10 mM Tris-Cl. Les barres d'erreur sont une déviation standard de trois essais indépendants sur différents jours. Cliquez ici pour agrandir la figure .
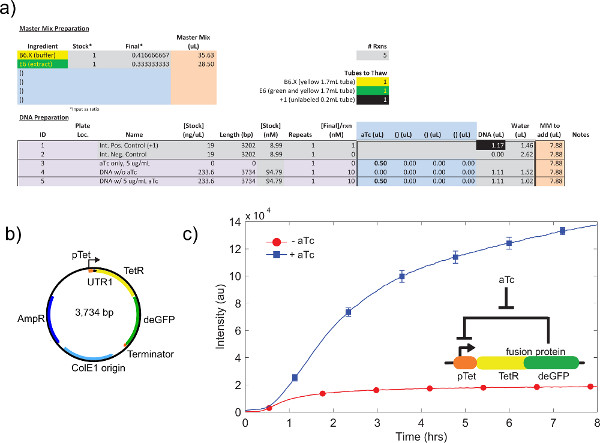
Figure 6. Échantillon TX-TL terme d'une boucle de rétroaction négative. a) installation de démonstration d'une réaction d'exécution acellulaire. Tests "sur" vs état "off" de la boucle de rétroaction négative, avec des contrôles positifs et négatifs. B) la carte de plasmide de boucle de rétroaction négative. C) Les résultats représentatifs. Les données reflètent l'expérience en a) et b), avec un contrôle négatif soustrait le signal. Circuit génétique montre insert. Les barres d'erreur sont une déviation standard de trois essais indépendants sur différents jours. Cliquez ici pour agrandir la figure .
| Nom | Concentration | Montant | Stérilisation | Remarques |
| Chloramphénicol (Cm) | 34 mg / ml dans l'éthanol | 1 ml | Stériliser par filtration (0,22 uM) | Peut être fait dans de plus grands volumes stockés à -20 ° C pour une utilisation ultérieure. |
| 2xYT + P + plaque de gélose cm | 31 g / L 2xYT, 40 mM de phosphate de potassium dibasique, 22 mM de phosphate de potassium monobasique, 34 ug / ml de chloramphenicol | 1 plaque | Autoclave | |
| 2xYT + P médias | 31 g / L 2xYT, 40 mM de phosphate de potassium dibasique, 22 mM de phosphate de potassium monobasique | 4 L | Autoclave |
Tableau 1. Réactifs pour jour 1 de la cellule brut protocole d'extraction.
| Nom | Concentration | Montant | Stérilisation | Remarques |
| Tris base | 2 M | 250 ml | Stériliser par filtration (0,22 uM) ou autoclave | Peut être conservé à température ambiante. |
| TNT | 1 M | 6 ml | Stériliser par filtration (0,22 uM) | Peut être fait dans des volumes plus importants et stockés à -20 ° C pour une utilisation ultérieure. |
| Tampon S30A | 14 mM Mg-glutamate, 60 mM de K-glutamate, Tris 50 mM, pH 7,7 | 2 L | Autoclave | Pour atteindre un pH de 7,7, titrer avec de l'acide acétique. Ajouter du DTT à 2 mM de concentration finale juste avant utilisation. Stocker à 4 ° C. |
| Tampon S30B | 14 mM Mg-glutamate, 60 mM de K-glutamate, ~ mM Tris, pH 8,2 5 | 2 L | Autoclave | Pour atteindre un pH de 8,2, titrer avec 2MTris. Ajouter du DTT à 1 mM de concentration finale juste avant utilisation. Stocker à 4 ° C. |
Tableau 2. Réactifs pour le jour 2 de la cellule brut protocole d'extraction.
| Faucon | ||||
| 1 | 2 | 3 | 4 | |
| Vide de 50 ml Falcon (g) | ||||
| 50 ml Falcon avec culot (g) | ||||
| Masse Pellet (50 ml Falcon avec culot - vide de 50 ml Falcon) (g) | ||||
| Volume tampon S30A pour ajouter (masse de granulés * 0,9) (ml) | ||||
| La masse totale de billes à ajouter (masse de granulés * 5.0) (g) | ||||
Tableau 3. Tampon S30A et perle calculateur de masse, pour le jour 3 de la cellule brut protocole d'extraction.
| Nom | Concentration | Montant | Stérilisation | Remarques |
| HEPES | 2 M, pH 8, | 4 ml | Aucun | Pour atteindre un pH de 8, titrer avec KOH. |
| Nucleotide Mix | MM ATP 156 et GTP, CTP 94 mM et UTP, pH 7,5 | 1,5 ml | Aucun | Pour atteindre un pH de 7,5, titrer avec KOH. |
| ARNt | 50 mg / ml | 600 pl | Aucun | |
| CoA | 65 mM | 600 pl | Aucun | |
| NAD | 175 mM, pH 7,5-8 | 300 pl | Aucun | Pour atteindre un pH 7,5-8, titrer avec Tris à 2 M. |
| AMPc | 650 mM, pH 8 | 200 pl | Aucun | Pour atteindre un pH de 8, titrer avec Tris à 2 M. |
| Acide folinique | 33,9 mM | 300 pl | Aucun | Bien que seulement 300 pi est nécessaire, recette supplémentaire est de 1,15 ml. |
| Spermidine | 1 M | 150 pl | Aucun | Conserver à 4 ° C, la chaleur à 37 ° C pour faire fondre. |
| 3-PGA | 1,4 M, pH 7,5 | 3,2 ml | Aucun | Pour atteindre un pH de 7,5, titrer avec Tris à 2 M. |
Tableau 4. Réactifs pour préparer protocole Energy Solution.
Matériel supplémentaire 1. Recettes pour des articles.
Chloramphénicol, 34 mg / ml: Préparer 0,51 g chloramphénicol et ajouter de l'éthanol à 15 ml. Stériliser par filtration (0,22 uM), aliquote de 1 ml tubes, conserver à -20 ° C pour une utilisation ultérieure.
YT 2x + P + Cm plaque de gélose: Préparer 1,24 g 2xYT, solution dibasique 1,6 ml de phosphate de potassium 1 M @, 0,88 ml de solution de phosphate de potassium monobasique @ 1 M, 0,6 g d'agar et de l'eau à 40 ml. Autoclave. Laisser refroidir à 50 ° C et ajouter 40 ul cm. Aliquote de 25 ml dans une boîte de 100 x 15 mm Petri, et laisser refroidir pendant une heure.
2xYT + P médias: Préparez 124 g 2xYT, solution dibasique 160 ml de phosphate de potassium @ 1 M, 88 ml solution de phosphate de potassium monobasique @ 1 M, et de l'eau à 4 L. Aliquot sortir dans 2 x 1,88 L et 0,24 L. autoclave.
Tris base, 2 M: Préparez 60,57 g de Tris base et de l'eau à 250 ml. Stériliser, magasin à la température ambiante pour une utilisation ultérieure.
TNT, 1 M: Préparer 2,31 g TNT et de l'eau à 15 ml. Stériliser par filtration (0,22 uM), aliquote de 1 ml tubes, conserver à -20 ° C pour une utilisation ultérieure.
Tampon S30A: Préparer 10,88 g Mg-glutamate et 24,39 g K-glutamate, 50 ml de Tris à 2M, de l'acide acétique (à pH 7,7), et de l'eau à 2 L. autoclave, conserver à 4 ° C, ajouter 4 ml 1 M DTT avant utilisation.
Tampon S30B: Préparer 10,88 g Mg-glutamate et 24,39 g K-glutamate, Tris à 2 M (pH 8,2), et de l'eau à 2 L. autoclave, conserver à 4 ° C, ajouter 2 ml 1 M DTT avant utilisation.
HEPES: Préparation de 1,91 g d'HEPES (MW 238,21), KOH (pH 8), et de l'eau à 4 ml.
ARNt: Préparer 30 mg de l'ARNt et de l'eau à 600 pi.
CoA: Préparer 30 mg de CoA (MW 767,53) et de l'eau à 600 pi.
NAD: Ajouter 34,83 mg de NAD (MW 663,43), Tris à 2 M (pH 7,5-8), et de l'eau à 300 pi. (Ajouter 27 ul de Tris à 2 M pour amener la solution à un pH de 7,5 à 8).
AMPc: Ajouter 42,80 mg de l'AMPc (MW 329.22), Tris à 2 M (pH 8), et de l'eau à 200 pi. (Ajouter 73 ul de Tris à 2 M pour amener la solution à pH 8).
Acide folinique (33,9 mm): à 20 mg de sel de calcium d'acide folinique solide (511,5 MW), ajouter 1,15 ml d'eau.
Spermidine: Préparer 23,55 pi de spermidine (MW 145.25) et de l'eau à 150 pi. Préparer à la température ambiante après la fusion brièvement à 37 ° C.
3-PGA: ajouter 1,03 g de 3-PGA (MW 230,02), au Tris 2 M (pH de 7,5), et de l'eau à 3,2 ml. (Ajouter 1,73 ml de Tris à 2 M pour amener la solution à un pH de 7,5).
Nucleotide Mix: Ajouter 145 mg de sel de dihydrate de l'ATP (MW 619,4), 133 mg de GTP sel disodique (MW 567,14), 79,4 mg de CTP sel disodique dihydraté (MW 563,16), 82,6 mg de dihydrate UTP trisodique de sel (MW 586,12) , KOH à 15% de dilution (à pH 7,5), et de l'eau à 1,5 ml. (Ajouter 353 ul de KOH à 15% de dilution pour amener la solution à un pH de 7,5).
Matériel supplémentaire 2. Dosage de Bradford.
- Éliminer l'agent Bradford de 4 ° C et mis à température ambiante.
- Préparer 50 ul de BSA standard à 1 mg / ml et à raison de 0,1 mg / ml.
- Préparer 40 ul 20x dilution de l'extrait de l'étape 1.47.
- Ajouter 800 ul d'eau pour 7 cuvettes.
- Préparer cuvettes standard pour 0 mg / ml, 1 mg / ml (10 ul de 0,1 mg / ml BSA), 2 mg / ml (20 ul de 0,1 mg / ml BSA), 4 mg / ml (4 ul de 1 mg / ml BSA) , 6 mg / ml (6 pi de 1 mg / ml BSA).
- Préparer cuves expérimentales pour 2 ul d'échantillon et 4 ul d'échantillon.
- Ajouter 200 ul d'agent Bradford à chaque cuvette et mélangez bien by pipetage. Incuber à température ambiante pendant au moins 10 min.
- Produire courbe standard à DO 595 nm en utilisant des cuves de l'étape 6.5. Rejeter courbe standard si r 2 <0,95.
- Déterminer la concentration d'extrait à DO 595 nm en utilisant des cuves de l'étape 6.6.
Matériel supplémentaire 3. Tampon calibrage feuille de calcul.
Voir TXTL_e (modèle) _calibration_JoVE.xlsx .
Matériel supplémentaire 4. Expression acellulaire feuille de calcul exécuté.
Discussion
La base de Escherichia coli endogène TX-TL système d'expression acellulaire décrit ici est une réaction facile à terme de trois tube qui peut prendre moins de huit heures de mise en place pour la collecte des données. Le processus de création tous les réactifs nécessite cinq temps total de «jours (avec les exigences de travail importantes sur un seul jour), mais produit extrait brut pour 3000 et les réactions tampon fabrication des réactifs pour 10 000 réactions (figure 1). En outre, l'extrait brut et tampon de décision réactifs sont stables pendant au moins 1 an à -80 ° C, ce qui permet des utilisations multiples d'une préparation 4. Lors de 0,11 $ par 10 réaction de pi ($ 0,26 y compris le travail), les coûts sont de 98% inférieurs à ceux comparable systèmes commerciaux (Figure 2).
Il existe certaines limitations non résolus, cependant, dans le système. L'efficacité de chaque préparation d'extrait cellulaire brut final peut varier en fonction du mode d'aptitude et des conditions environnementales, bien que typical variation du rendement est compris entre 5 à 10% (figure 4b). Par conséquent, la variabilité lot à lot à la fois dans l'expression du point final et dans la dynamique d'expression sont à prévoir. Ces variations devraient rester jusqu'à ce que l'extrait est entièrement caractérisée ou jusqu'à ce que la création d'extrait est entièrement automatisé. Si le système d'expression acellulaire est utilisé pour mener des expériences quantitatives sensibles, il est recommandé d'effectuer toutes les expériences avec le même lot d'extrait cellulaire brut. Le rendement d'un seul lot d'extrait cellulaire brut, environ 3000 réactions, devrait être suffisant pour les cours expérimentaux typiques. Bien que nous soupçonnons variation peut être éliminé par l'intensification et l'automatisation de la procédure, de telles tentatives impliquerait un investissement substantiel de ressources.
En outre, bien que les niveaux de point final expression sont relativement faciles à déterminer, encore du travail à faire pour comprendre la dynamique intrinsèque au système acellulaire. Il est connu que les deux CONCURRENC des ressourcesn et ressources limitation peut affecter la dynamique d'expression. Par exemple, Sigma endogène limité 70 peut se traduire par un régime de saturation avec augmentation de la production de matrice d'ADN d'un profil d'expression analogue à celle de nucléotides ou d'acides aminés épuisement. 9,27 Toutefois, la dynamique n'ont pas à être entièrement comprise à utiliser le système. Pour les augmentations pures de rendement, l'optimisation peut se faire par des approches d'apprentissage automatique. 28 Questions de compétition pour les ressources et la limitation peuvent être traitées par des modèles mathématiques vérifiée à l'aide des données expérimentales.
Le protocole présenté ici est optimisé pour une souche BL21-Rosetta2, mais est généralisable à d'autres E. souches de E. coli. Des modifications dans BL21-Rosetta2, telles que la suppression du gène codant pour la protéase lon et l'addition de gènes codant pour des ARNt rares, permettent une production maximale de protéine. Nous avons essayé le protocole avec deux autres souches d'extraction - BL21 seulement et un BL21 trxA KO-und trouvé le rendement en protéines de 50% de moins. Nous émettons l'hypothèse que les rendements diminuent de même lors de l'utilisation d'autres souches. D'autres changements dans les paramètres, tels que la commutation du milieu de croissance LB et 2xYT pour d'autres bouillons riches, ont donné lieu à une diminution du rendement en protéines.
Systèmes d'expression sans cellules utilisant à la fois des machines de transcription-traduction endogène et exogène et les mécanismes de régulation ont de larges applications dans les protéines et l'expression de métabolite et de la biologie synthétique. 3,29 lieu d'être limité à des circuits de T7-réglementé, on peut envisager de réaliser des biomolécules complexes dans un environnement contrôlable par l'utilisateur en utilisant un mélange de natif E. promoteurs coli et les mécanismes de transcription et de régulation exogène fournis. Sans limitation de la division cellulaire et du métabolisme, de la variabilité dans les circuits de synthèse tels que la repressilator ou en ingénierie des voies métaboliques telles que celles artémisinine production peut être réduit ou mieux comprise. 30,31 Nous VHAe utilisé ces avantages à mettre en œuvre des commutateurs génétiques, ainsi que de comprendre facteur sigma séquestration 9,32 Cette technologie peut également former l'épine dorsale de «minime» ou cellules "artificielles" -. petite, bien caractérisé et les unités incorporées autonomes de extrait. 33,34
En fin de compte, nous nous attendons à des usages immédiats de ce système d'expression acellulaire endogène comme un environnement de prototypage pour la biologie synthétique. Surnommée la "planche à pain biomoléculaire TX-TL," le système d'expression acellulaire fournit un environnement contrôlable où les circuits de synthèse en fin de compte destinés à l'expression in vivo peut subir tours de prototypage - cycles d'essais sur le plasmide de base, linéaire, ou d'ADN synthétisé chimiquement, puis par l'analyse et la modification rapide. Tours de prototypage peuvent être aidés par des modèles mathématiques prédictifs en cours de développement. En supprimant le clonage et des manipulations in vivo pour les circuits non-finales, nous prévoyons ingénieurstemps de cycle de nierie à être réduits à 1-3 jours au lieu de la norme de la semaine en cours.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
Nous remercions Jongmin Kim, Dan Siegal-Gaskins, Anu Thubagere, et Enoch Yeung à l'aide de rationaliser le protocole, et Clare Chen et Lee Barclay pour l'assistance dans les premiers stades du projet. Ce matériau est basé sur les travaux pris en charge en partie par l'Agence pour les projets de recherche avancée de défense (DARPA / MTO) programme Living Fonderies, numéro de contrat HR0011-12-C-0065 (DARPA / CMO.ZZS est également soutenue par un scientifique médical UCLA / Caltech bourse du programme de formation et par un DoD, la Force aérienne Bureau de la recherche scientifique, des sciences de la Défense nationale et études supérieures en génie (NDSEG) Fellowship, 32 CFR 168. Les points de vue et les conclusions contenues dans ce document sont celles des auteurs et ne doit pas être interprété comme représentant officiellement politiques, que ce soit expressément ou implicitement, de l'Advanced Research Projects Agency Défense ou le gouvernement des États-Unis.
matériels
| Name | Company | Catalog Number | Comments |
| 2xYT | MP biomedicals | 3012-032 | |
| 3-PGA | Sigma-Aldrich | P8877 | |
| ATP | Sigma-Aldrich | A8937 | |
| Bacto-agar | BD Diagnostics | 214010 | |
| Bead-beating tubes (polypropylene microvials) | BioSpec | 522S | |
| Beads, 0.1mm dia. | BioSpec | 11079101 | |
| BL21 Rosetta 2 E. coli strain | Novagen | 71402 | |
| Bradford BSA Protein Assay Kit | Bio-rad | 500-0201 | |
| cAMP | Sigma-Aldrich | A9501 | |
| Chloramphenicol | Sigma-Aldrich | C1919 | |
| CoA | Sigma-Aldrich | C4282 | |
| CTP | USB | 14121 | |
| Cuvettes, 1.5ml | Fisher | 14-955-127 | |
| DTT | Sigma-Aldrich | D0632 | |
| Folinic acid | Sigma-Aldrich | F7878 | |
| GTP | USB | 16800 | |
| HEPES | Sigma-Aldrich | H6147 | |
| K-glutamate | Sigma-Aldrich | G1149 | |
| Mg-glutamate | Sigma-Aldrich | 49605 | |
| Micro Bio-Spin Chromatography Columns | Bio-Rad | 732-6204 | |
| NAD | Sigma-Aldrich | N6522 | |
| Nunc 384-well optical bottom plates | Thermo-Scientific | 142761 | |
| Nunc sealing tape | Thermo-Scientific | 232701 | |
| PEG-8000 | Promega | V3011 | |
| Potassium phosphate dibasic solution | Sigma-Aldrich | P8584 | |
| Potassium phosphate monobasic solution | Sigma-Aldrich | P8709 | |
| RTS Amino Acid Sampler | 5 Prime | 2401530 | |
| Slide-A-Lyzer Dialysis Cassettes, 10k MWCO (Kit) | Thermo-Scientific | 66382 | |
| Spermidine | Sigma-Aldrich | 85558 | |
| Tris base | Fischer | BP1521 | |
| tRNA (from E. coli) | Roche Applied Science | MRE600 | |
| UTP | USB | 23160 | |
| 1L Centrifuge Bottle | Beckman-Coulter | A98813 | This is specific for Avanti J-series; obtain equivalent size for centrifuge in use. |
| 4L Erlenmeyer Flask | Kimble Chase | 26500-4000 | |
| Avanti J-26XP Centrifuge | Beckman-Coulter | 393127 | Or 1L-capable centrifuge equivalent. |
| Forma 480 Orbital Shaker | Thermo Scientific | 480 | Or chest-size 6x4L shaker equivalent. |
| JLA-8.1000 Rotor | Beckman-Coulter | 363688 | Or 1L-capable, 5000 x g rotor equivalent for centrifuge. |
| Mini-Beadbeater-1 | BioSpec | 3110BX | |
| Supplemental Material 1. Recipes for Items. Chloramphenicol, 34 mg/ml: Prepare 0.51 g chloramphenicol and add ethanol to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. 2xYT+P+Cm agar plate: Prepare 1.24 g 2xYT, 1.6 ml potassium phosphate dibasic solution @ 1 M, 0.88 ml potassium phosphate monobasic solution @ 1 M, 0.6 g agar, and water to 40 ml. Autoclave. Let cool to 50 °C and add 40 μl Cm. Aliquot 25 ml into a 100x15 mm petri dish, and let cool for an hour. 2xYT+P media: Prepare 124 g 2xYT, 160 ml potassium phosphate dibasic solution @1 M, 88 ml potassium phosphate monobasic solution @ 1 M, and water to 4 L. Aliquot out into 2x1.88 L and 0.24 L. Autoclave. Tris base, 2 M: Prepare 60.57 g Tris base and water to 250 ml. Sterilize, store at RT for later use. DTT, 1 M: Prepare 2.31 g DTT and water to 15 ml. Filter sterilize (0.22 μM), aliquot to 1 ml tubes, store at -20 °C for later use. S30A buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, 50 ml Tris at 2M, acetic acid (to pH 7.7), and water to 2 L. Autoclave, store at 4 °C, add 4 ml 1 M DTT before use. S30B buffer: Prepare 10.88 g Mg-glutamate and 24.39 g K-glutamate, Tris at 2 M (to pH 8.2), and water to 2 L. Autoclave, store at 4 °C, add 2 ml 1 M DTT before use. HEPES: Prepare 1.91 g HEPES (MW 238.21), KOH (to pH 8), and water to 4 ml. tRNA: Prepare 30 mg of tRNA and water to 600 μl. CoA: Prepare 30 mg of CoA (MW 767.53) and water to 600 μl. NAD: Add 34.83 mg of NAD (MW 663.43), Tris at 2 M (to pH 7.5-8), and water to 300 μl. (Add 27 μl of Tris at 2 M to bring the solution to pH 7.5-8). cAMP: Add 42.80 mg of cAMP (MW 329.22), Tris at 2 M (to pH 8), and water to 200 μl. (Add 73 μl of Tris at 2 M to bring the solution to pH 8). Folinic Acid (33.9 mM): To 20 mg of solid folinic acid calcium salt (MW 511.5), add 1.15 ml water. Spermidine: Prepare 23.55 μl of spermidine (MW 145.25) and water to 150 μl. Prepare at room temperature after melting briefly at 37 °C. 3-PGA: Add 1.03 g of 3-PGA (MW 230.02), Tris at 2 M (to pH 7.5), and water to 3.2 ml. (Add 1.73 ml of Tris at 2 M to bring the solution to pH 7.5). Nucleotide Mix: Add 145 mg of ATP dipotassium salt dihydrate (MW 619.4), 133 mg of GTP disodium salt (MW 567.14), 79.4 mg of CTP disodium salt dihydrate (MW 563.16), 82.6 mg of UTP trisodium salt dihydrate (MW 586.12), KOH at 15% dilution (to pH 7.5), and water to 1.5 ml. (Add 353 μl of KOH at 15% dilution to bring the solution to pH 7.5). Supplemental Material 2. Bradford Assay.
See TXTL_e(template)_calibration_JoVE.xlsx. Supplemental Material 4. Cell-free expression run spreadsheet. See TXTL _JoVE.xlsx. | |||
Références
- Noireaux, V., Bar-Ziv, R., Libchaber, A. Principles of cell-free genetic circuit assembly. Proceedings of the National Academy of Sciences of the United States of America. 100, 12672-12677 (2003).
- He, M. Y., He, Y. Z., Luo, Q., Wang, M. R. From DNA to protein: No living cells required. Process Biochem. 46, 615-620 (2011).
- Forster, A. C., Church, G. M. Synthetic biology projects in vitro. Genome Res. 17, 1-6 (1101).
- Shin, J., Noireaux, V. Efficient cell-free expression with the endogenous E. Coli RNA polymerase and sigma factor 70. Journal of biological engineering. 4, 8 (2010).
- Shimizu, Y., et al. Cell-free translation reconstituted with purified components. Nat Biotechnol. 19, 751-755 (2001).
- Shin, J., Noireaux, V. An E. coli Cell-Free Expression Toolbox: Application to Synthetic Gene Circuits and Artificial Cells. Acs Synth Biol. 1, 29-41 (2012).
- Shin, J., Noireaux, V. Study of messenger RNA inactivation and protein degradation in an Escherichia coli cell-free expression system. Journal of biological engineering. 4, 9 (2010).
- Shin, J., Jardine, P., Noireaux, V. Genome Replication, Synthesis, and Assembly of the Bacteriophage T7 in a Single Cell-Free Reaction. Acs Synth Biol. 1, 408-413 (2012).
- Siegal-Gaskins, D., Noireaux, V., Murray, R. M., Pao, L., Abramovitch, D. Biomolecular resource utilization in elementary cell-free gene circuits. , 1531-1536 (2013).
- Karzbrun, E., Shin, J., Bar-Ziv, R. H., Noireaux, V. Coarse-grained dynamics of protein synthesis in a cell-free system. Physical review letters. 106, 048104 (2011).
- Hoagland, M. B., Stephenson, M. L., Scott, J. F., Hecht, L. I., Zamecnik, P. C. Soluble Ribonucleic Acid Intermediate in Protein Synthesis. J Biol Chem. 231, 241-257 (1958).
- Wood, W. B., Berg, P. Effect of Enzymatically Synthesized Ribonucleic Acid on Amino Acid Incorporation by a Soluble Protein-Ribosome System from Escherichia Coli. Proceedings of the National Academy of Sciences of the United States of America. 48, 94 (1962).
- Zubay, G. In-Vitro Synthesis of Protein in Microbial Systems. Annu Rev Genet. 7, 267-287 (1973).
- Pratt, J. M., Hames, B. D., Higgins, S. J. . Transcription and Translation: A Practical Approach. , 179-209 (1984).
- Kim, H. C., Kim, D. M. Methods for energizing cell-free protein synthesis. Journal of bioscience and bioengineering. 108, 1-4 (2009).
- Michel-Reydellet, N., Calhoun, K., Swartz, J. Amino acid stabilization for cell-free protein synthesis by modification of the Escherichia coli genome. Metabolic engineering. 6, 197-203 (2004).
- Liu, D. V., Zawada, J. F., Swartz, J. R. Streamlining Escherichia coli S30 extract preparation for economical cell-free protein synthesis. Biotechnology progress. 21, 460-465 (2005).
- Andrianantoandro, E., Basu, S., Karig, D. K., Weiss, R. Synthetic biology: new engineering rules for an emerging discipline. Molecular systems biology. 2, 2006.0028 (2006).
- Kwok, R. Five hard truths for synthetic biology. Nature. 463, 288-290 (2010).
- Tabor, S., Richardson, C. C. A bacteriophage T7 RNA polymerase/promoter system for controlled exclusive expression of specific genes. Proceedings of the National Academy of Sciences of the United States of America. 82, 1074-1078 (1985).
- Lewicki, B. T., Margus, T., Remme, J., Nierhaus, K. H. Coupling of rRNA transcription and ribosomal assembly in vivo. Formation of active ribosomal subunits in Escherichia coli requires transcription of rRNA genes by host RNA polymerase which cannot be replaced by bacteriophage T7 RNA polymerase. Journal of molecular biology. 231, 581-593 (1993).
- Iskakova, M. B., Szaflarski, W., Dreyfus, M., Remme, J., Nierhaus, K. H. Troubleshooting coupled in vitro transcription-translation system derived from Escherichia coli cells: synthesis of high-yield fully active proteins. Nucleic acids research. 34, e135 (2006).
- Kigawa, T., et al. Preparation of Escherichia coli cell extract for highly productive cell-free protein expression. Journal of structural and. 5, 63-68 (2004).
- Matsuda, T., et al. Improving cell-free protein synthesis for stable-isotope labeling. Journal of biomolecular. NMR. 37, 225-229 (2007).
- Sitaraman, K., et al. A novel cell-free protein synthesis system. Journal of biotechnology. 110, 257-263 (2004).
- Becskei, A., Serrano, L. Engineering stability in gene networks by autoregulation. Nature. 405, 590-593 (2000).
- Maeda, H., Fujita, N., Ishihama, A. Competition among seven Escherichia coli sigma subunits: relative binding affinities to the core RNA polymerase. Nucleic acids research. 28, 3497-3503 (2000).
- Caschera, F., et al. Coping with complexity: machine learning optimization of cell-free protein synthesis. Biotechnology and bioengineering. 108, 2218-2228 (2011).
- Hodgman, C. E., Jewett, M. C. Cell-free synthetic biology: thinking outside the cell. Metabolic engineering. 14, 261-269 (2012).
- Elowitz, M. B., Leibler, S. A synthetic oscillatory network of transcriptional regulators. Nature. 403, 335-338 (2000).
- Tsuruta, H., et al. High-level production of amorpha-4,11-diene, a precursor of the antimalarial agent artemisinin, in Escherichia coli. Plos One. 4, e4489 (2009).
- Gardner, T. S., Cantor, C. R., Collins, J. J. Construction of a genetic toggle switch in Escherichia coli. Nature. 403, 339-342 (2000).
- Jewett, M. C., Forster, A. C. Update on designing and building minimal cells. Current opinion in biotechnology. 21, 697-703 (2010).
- Noireaux, V., Libchaber, A. A vesicle bioreactor as a step toward an artificial cell assembly. Proceedings of the National Academy of Sciences of the United States of America. 101, 17669-17674 (2004).
Erratum
Formal Correction: Erratum: Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology
Posted by JoVE Editors on 1/01/1970. Citeable Link.
A correction to Figure 5's legend has been made for the article Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology. Method 1 and method 2 have been switched.Z
The figure legend was update from:
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 1) or post-processed with a QiaQuick PCR purification kit (Purification method 2).
to
Figure 5. Effects of DNA solution on expression efficiency. a) Comparison of two different purification methods for processing plasmids. 1 nM of pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 is prepared using only a QiaPrep Spin Miniprep Kit (Purification method 2) or post-processed with a QiaQuick PCR purification kit (Purification method 1).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon