需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
角膜胶原交联的圆锥角膜的三种不同的协议:常规,加速和离子导入
摘要
Corneal collagen cross-linking (CXL) is the only conservative treatment currently available to halt keratoconus progression by improving the biomechanical rigidity of the corneal stroma. The aim of this manuscript is to highlight the methods of three different protocols of CXL: conventional CXL (C-CXL), accelerated CXL (A-CXL), and iontophoresis CXL (I-CXL).
摘要
圆锥角膜是双边和渐进的角膜扩张。为了减缓其进展,角膜胶原交联(CXL)最近已推出了作为有效的治疗选择。在生物和化学科学,交联是指活性分子之间形成新的化学键。因此,角膜胶原CXL的目的是合成地增加在角膜基质中的交联的胶原原纤维之间的形成。尽管常规CXL(C-CXL)协议的效率已经在若干临床研究表明,它可能会受益于改进的过程和除去角膜上皮的持续时间。因此,为了提供两个新的和优化的CXL协议一致的评估,我们研究圆锥角膜患者谁经历了三个CXL治疗之一:离子电渗疗法(Ⅰ-CXL),加速CXL(A-CXL),和常规CXL( C-CXL)。 A-CXL是6时间快CXL程序ü唱了十次提高的UVA辐射,但仍然包括上皮去除。离子电渗疗法是在其中一个小电流施加到改善整个角膜核黄素渗透跨上皮非侵入性技术。使用眼前段光学相干断层扫描(AS OCT)和体内共焦显微镜(IVCM),我们的结论是关于治疗穿透深度,常规CXL协议仍然用于治疗进行性圆锥形角膜的标准。加速CXL似乎是一个快速,有效,安全的替代治疗角膜薄。利用离子导入还在调查中,应该考虑更加谨慎。
引言
圆锥角膜是一个双边和渐进的角膜扩张通常在一般人群1导致角膜形状的变形例中报告1 2000,从而视力下降2。圆锥角膜通常存在于早期青春期的进展,直到第三次生命不惑之年发病时通常趋于稳定,但进展可以在整个病人的生命变量。通过阻止圆锥角膜进展,交联的目的是推迟或避免角膜移植术。
到目前为止,唯一的有效和安全的治疗进步圆锥角膜证明在临床研究中是常规的角膜胶原交联(C-CXL)协议,其目的是提高刚度,从而制止圆锥角膜级数3-8。为了减少操作时间和对C-CXL其它可能的危险因素,如感染性角膜炎或基质混浊9,几种改进协议具有已有描述。首先,在加速CXL(A-CXL),UVA的更高的辐照度被传递到角膜通过减少的时间10。其次,为了避免的必要性上皮清创,跨上皮的方法已被采用。遗憾的是,他们已经时比现有协议11有限的成功。最近的跨上皮方法CXL期间角膜核黄素递送是离子电渗疗法(Ⅰ-CXL),但这种治疗方法的严格评价还未执行的12。离子电渗疗法是一种在其中一个小电流被施加穿过组织来提高离子化的药物的渗透非侵入性技术。在CXL通过离子电渗,核黄素被离子化通过上皮渗透角膜。
体内共焦显微镜(IVCM)是成像,可以突出显示异常的角膜中的疾病,如圆锥角膜13的细胞改变角膜的方法。事实上,IVCM已经证明改建在圆锥角膜的角膜所有层与在子基底神经丛的密度特定还原和基质角膜13-15。加,IVCM已被证明是对后的C-16 CXL角膜微观结构分析非常方便。
角膜分界线被描述为一个高反射线见于眼前段光学相干断层扫描(OCT AS)1个月后的C-CXL在300微米17,18的深度。 IVCM下面的C-CXL提供有关角膜的结构改变,包括缺乏角膜基质的至300μm的深度信息。此无细胞区域的深度,以及在角膜基质内的分界线的深度显示在AS OCT中,似乎与CXL治疗19和角膜分界线深度的测量的有效深度的AS OCT中1到相关联的一个月后CXL已被提出作为一种有效的临床方法的CXL效力18的评价。
在本研究中,我们使用角膜基质分界线测量由AS OCT和共聚焦显微镜研究了三种不同的角膜胶原交联的协议(常规的,加速,离子电渗疗法)的效率。此外,我们使用IVCM定量分析的三种治疗后,角膜组织变化。
研究方案
这些协议遵循我院的人类研究伦理委员会的指导方针。
1.常规角膜胶原蛋白CXL(C-CXL)
1.患者准备
- 在手术前5天,放了一天的治疗眼1%毛果芸香碱滴两次。
- 在手术室,在无菌条件下,趴在他/她的背部病人。
- 辖表面麻醉,如奥布卡0.4%。
- 清洁眼睛和眼睛周围的皮肤用碘防腐剂两次。
- 使用盖窥器,以保持眼睛睁开。
2.上皮去除
- 马可中心9.0毫米用圆圈标记角膜角膜。
- 取出角膜上皮用生硬的抹刀中央7.0至9.0毫米乘机械清除。
3.核黄素应用
- 适用于日与20%葡聚糖0.1%核黄素 Ë角膜每分钟为20分钟。
4. UVA照射
- 照射具有370nm的波长的UVA光的角膜以3毫瓦/厘米2(5.4焦耳/厘米2表面剂量)的辐照,并在一个5厘米的工作距离为30分钟。

图1:在C-CXL UVA照射的角膜以3毫瓦/厘米2(5.4焦耳/厘米2表面剂量)的辐照,并在一个5厘米的工作距离30分钟照射370nm的波长的UVA光。 请点击此处查看该图的放大版本。
- 在辐照过程中,应用核黄素角膜每隔5分钟滴。
- 在辐照过程中,添加表面麻醉(奥布卡0.4%),如果有必要的。
- 把抗生素滴眼液(妥布霉素0.3%)和人工泪液(透明质酸下降0.18%),到运营的眼睛。
- 将软绷带隐形眼镜在手术结束,直到再上皮化完成。再上皮化通常需要3天。
- 处方止痛药如对乙酰氨基酚(500毫克)加可待因(30毫克),每日6药片。
- 后角膜再上皮,发起局部治疗与类固醇(地塞米松局部为1mg / ml),并继续进行3-4周。此外,使用人工泪液,每天4次,1个月。
2.加速角膜胶原CXL(A-CXL)
1.患者准备
- 在手术前5天,放了一天的治疗眼1%毛果芸香碱滴两次。
- 在手术室,在无菌条件下,趴在他/她的背部病人。
- 辖表面麻醉,如奥布卡0.4%。
- 清洁电子你们和眼睛周围的碘消毒剂皮肤的两倍。
- 使用盖窥器,以保持眼睛睁开。
2.上皮去除
- 标记中央9.0毫米角膜的带圈角膜标记
- 取出角膜上皮用生硬的抹刀中央7.0至9.0毫米乘机械清除。
3.核黄素应用
- 在角膜上施加0.1%的核黄素,而不葡聚糖每2分钟进行10分钟。
4. UVA照射
- 照射具有370nm的波长的UVA光的角膜以30毫瓦/厘米2(5.4焦耳/厘米2表面剂量),并在一个5厘米的工作距离为3分钟的辐照。
- 在照射,增加局部麻醉(oxybuproca&#239,是ne 0.4%),如果有必要的。
5.结束手术
- 将抗生素滴眼液(妥布霉素0.3%)和人工泪液(透明质酸下降0 0.18%)进入操作眼睛。
- 将软绷带隐形眼镜在手术结束,直到再上皮化完成。再上皮化通常需要3天。
- 处方止痛药如对乙酰氨基酚(500毫克)加可待因(30毫克),每日6药片。
- 后角膜再上皮,发起局部治疗与类固醇(地塞米松局部为1mg / ml),并继续进行3-4周。此外,使用人工泪液,每天4次,1个月。
3,离子透入(I-CXL)
1.患者准备
- 在手术前5天,放了一天的治疗眼1%毛果芸香碱滴两次。
- 在手术室,在无菌条件下,趴在他/她的背部病人。
- 辖表面麻醉,如奥布卡0.4%。
- 清洁眼睛和眼睛周围的皮肤用碘防腐剂两次。
- 使用盖窥器,以保持眼睛睁开。
- 应用粘被动电极的手术视野下的额头。
- 应用活性电极,一个吸环,到打开眼。释放所述抽吸之前围绕角膜的周边上的吸环。

图2.离子导入装置,该无源电极施加在手术视野下的额头和活性电极,一个吸环,适用于开放的眼睛。 请点击此处查看该图的放大版本。
3.核黄素应用
- 填写吸入环与低渗0.1%核黄素无葡聚糖。
JPG"/>
在I-CXL图3.核黄素的应用 。吸入环充满了低渗0.1%核黄素没有葡聚糖。 请点击此处查看该图的放大版本。
- 启动电流在0.2 mA和逐步增加至1.0毫安的5分钟(图4),总离子电渗疗法的时间。
图4.离子导入设备核黄素渗透的电流最初是0.2 mA和逐渐增加至1.0毫安。总离子导入时间为5分钟。 请点击此处查看该图的放大版本。
EP"> 4。UVA照射- 照射具有370nm的波长的UVA光的角膜以10毫瓦/厘米2(5.4焦耳/厘米2表面剂量),并在一个5厘米的工作距离为9分钟的辐照。
- 在照射,增加局部麻醉(oxybuproca&#239,是ne 0.4%),如果有必要的。
5.结束手术
- 将抗生素滴眼液(妥布霉素0.3%)和人工泪液(透明质酸下降0.18%),到运营的眼睛。
- 处方止痛药如对乙酰氨基酚(500毫克)加可待因(30毫克),每日6药片。
- 手术后,发起局部治疗与类固醇(地塞米松局部为1mg / ml)和持续3-4周。此外,使用人工泪液,每天4次,1个月。
结果
角膜分界线是华侨城可见的情况下,92%在301.6微米的平均深度(SD,73.6)
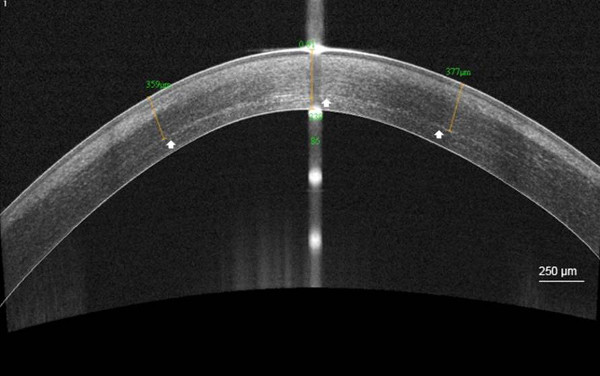
C-CXL后图5.分界线。高分辨率的角膜眼前段光学相干断层扫描(华侨城)可视化角膜基质分界线在358微米(白色箭头)1个月传统的角膜胶原蛋白交叉后,平均深度链接(C-CXL)。比例尺250微米。
讨论
用UVA照射和核黄素CXL的标准治疗为阻止圆锥角膜的进展。核黄素是光敏剂诱导化学共价键(交联)时的UVA 3照射。在角膜上,这种现象造成的胶原纤维能够提高角膜刚度之间交联。虽然这种现象被很好地描述,到现在为止已有角膜内交联的直接证据。然而,一些研究已经报道了的Kmax的稳定化从而显示出的C-CXL 3-8的有效性的步骤之后。这个效果是否是由于交联或在角膜基质等微观结...
披露声明
The authors have nothing to disclose.
致谢
The authors have no acknowledgements.
材料
| Name | Company | Catalog Number | Comments |
| Riboflavin Product number | |||
| C-CXL | Sooft SPA, Montegiorgio, Italy | Ricrolin 468465-6 | |
| A-CXL | Avedro Inc, Waltham, Massachusetts | VibeX 520-01863-006 | |
| I-CXL | Sooft SPA, Montegiorgio, Italy | Ricrolin+ 975481-6 | Passive electrode: PROTENS ELITE 4848LE/ Active electrode: IONTOFOR CXL |
| UVA Machine | |||
| X-Vega | UVA: 3 mW/cm2 30 min | ||
| KXL System | UVA: 30 mW/cm2 10 min | ||
| X-Vega | UVA: 10 mW/cm2 9 min |
参考文献
- Rabinowitz, Y. S. Keratoconus. Surv Ophthalmol. 42 (4), 297-319 (1998).
- Tuori, A. J., et al. The immunohistochemical composition of corneal basement membrane in keratoconus. Curr Eye Res. 16 (8), 792-801 (1997).
- Wollensak, G., Spoerl, E., Seiler, T. Riboflavin/ultraviolet-A-induced collagen cross-linking for the treatment of keratoconus. Am J Ophthalmol. 135 (5), 620-627 (2003).
- Raiskup-Wolf, F., Hoyer, A., Spoerl, E., Pillunat, L. E. Collagen cross-linking with riboflavin and ultraviolet-A light in keratoconus: long-term results. J Cataract Refract Surg. 34 (5), 796-801 (2008).
- Vinciguerra, P., et al. topographic, tomographic, and aberrometric analysis of keratoconic eyes undergoing corneal cross-linking. Ophthalmology. 116 (3), 369-378 (2009).
- Caporossi, A., Mazzotta, C., Baiocchi, S., Caporossi, T. Long-term results of riboflavin ultraviolet-A corneal collagen cross-linking for keratoconus in Italy: the Siena eye cross study. Am J Ophthalmol. 149 (4), 585-593 (2010).
- Greenstein, S. A., Fry, K. L., Hersh, P. S. Corneal topography indices after corneal collagen cross-linking for keratoconus and corneal ectasia: one-year results. J Cataract Refract Surg. 37 (7), 1282-1290 (2011).
- Ghanem, R. C., Santhiago, M. R., Berti, T., Netto, M. V., Ghanem, V. C. Topographic corneal wavefront, and refractive outcomes 2 years after collagen cross-linking for progressive keratoconus. Cornea. 33 (1), 43-48 (2014).
- Koller, T., Mrochen, M., Seiler, T. Complication and failure rates after corneal cross-linking. J Cataract Refract Surg. 35 (8), 1358-1362 (2009).
- Rocha, K. M., Ramos-Esteban, J. C., Qian, Y., Herekar, S., Krueger, R. R. Comparative study of riboflavin-UVA cross-linking and “flash-linking” using surface wave elastometry. J Refract Surg. 24 (7), 748-751 (2008).
- Caporossi, A., et al. Transepithelial corneal collagen crosslinking for progressive keratoconus: 24-month clinical results. J Cataract Refract Surg. 39 (8), 1157-1163 (2013).
- Bikbova, G., Bikbov, M. Transepithelial corneal collagen cross-linking by iontophoresis of riboflavin. Acta Ophthalmol. 92 (1), 30-34 (2014).
- Efron, N., Hollingsworth, J. G. New perspectives on keratoconus as revealed by corneal confocal microscopy. Clin Exp Optom. 91 (1), 34-55 (2008).
- Patel, D. V., McGhee, C. N. Mapping the corneal sub-basal nerve plexus in keratoconus by in vivo laser scanning confocal microscopy. Invest Ophthalmol Vis Sci. 47 (4), 1348-1351 (2006).
- Ku, J. Y., Niederer, R. L., Patel, D. V., Sherwin, T., McGhee, C. N. Laser scanning in vivo confocal analysis of keratocyte density in keratoconus. Ophthalmology. 115 (5), 845-850 (2008).
- Mazzotta, C., et al. Corneal healing after riboflavin ultraviolet-A collagen cross-linking determined by confocal laser scanning microscopy in vivo: early and late modifications. Am J Ophthalmol. 146 (4), 527-533 (2008).
- Seiler, T., Hafezi, F. Corneal cross-linking-induced stromal demarcation line. Cornea. 25 (9), 1057-1059 (2006).
- Doors, M., et al. Use of anterior segment optical coherence tomography to study corneal changes after collagen cross-linking. Am J Ophthalmol. 148 (6), 844-851 (2009).
- Mazzotta, C., et al. Treatment of progressive keratoconus by riboflavin-UVA-induced cross-linking of corneal collagen: ultrastructural analysis by Heidelberg Retinal Tomograph II in vivo confocal microscopy in humans. Cornea. 26 (4), 390-397 (2007).
- Kymionis, G. D., et al. Correlation of the corneal collagen cross-linking demarcation line using confocal microscopy and anterior segment optical coherence tomography in keratoconic patients. Am J Ophthalmol. 157 (1), 110-115 (2014).
- Yam, J. C., Chan, C. W., Cheng, A. C. Corneal collagen cross-linking demarcation line depth assessed by Visante OCT After CXL for keratoconus and corneal ectasia. J Refract Surg. 28 (7), 475-481 (2012).
- Jordan, C., Patel, D. V., Abeysekera, N., McGhee, C. .. N. .. In vivo confocal microscopy analyses of corneal microstructural changes in a prospective study of collagen cross-linking in keratoconus. Ophthalmology. 121 (2), 469-474 (2014).
- Touboul, D., et al. Corneal confocal microscopy following conventional, transepithelial, and accelerated corneal collagen cross-linking procedures for keratoconus. J Refract Surg. 28 (11), 769-776 (2012).
- Bouheraoua, N., et al. Optical coherence tomography and confocal microscopy following three different protocols of corneal collagen-crosslinking in keratoconus. Invest Ophthalmol Vis Sci. 55 (11), 7601-7609 (2014).
- Hafezi, F., Mrochen, M., Iseli, H. P., Seiler, T. Collagen crosslinking with ultraviolet-A and hypoosmolar riboflavin solution in thin corneas. J Cataract Refract Surg. 35 (4), 621-624 (2009).
- Cınar, Y., et al. Comparison of accelerated and conventional corneal collagen cross-linking for progressive keratoconus. Cutan Ocul Toxicol. 33 (3), 218-222 (2013).
- Cingü, A. K., et al. Transient corneal endothelial changes following accelerated collagen cross-linking for the treatment of progressive keratoconus. Cutan Ocul Toxicol. 33 (2), 127-131 (2013).
- Spoerl, E., Mrochen, M., Sliney, D., Trokel, S., Seiler, T. Safety of UVA-riboflavin cross-linking of the cornea. Cornea. 26 (4), 385-389 (2007).
- Gokhale, N. S. Corneal endothelial damage after collagen cross-linking treatment. Cornea. 30 (12), 1495-1498 (2011).
- Rootman, D. S., et al. Pharmacokinetics and safety of transcorneal iontophoresis of tobramycin in the rabbit. Invest Ophthalmol Vis Sci. 29 (9), 1397-1401 (1998).
- Vinciguerra, P., et al. Transepithelial iontophoresis corneal collagen cross-linking for progressive keratoconus: initial clinical outcomes. J Refract Surg. 30 (11), 746-753 (2014).
- Caporossi, A., et al. Riboflavin-UVA-induced corneal collagen cross-linking in pediatric patients. Cornea. 31 (3), 227-231 (2012).
- Buzzonetti, L., Petrocelli, G., Valente, P., Larossi, G., Ardia, R., Petroni, S. Iontophoretic transepithelial corneal cross-linking to halt keratoconus in pediatric cases: 15-month follow-up. Cornea. 34 (5), 512-515 (2015).
- Baiocchi, S., Mazzotta, C., Cerretani, D., Caporossi, T., Caporossi, A. Corneal crosslinking: riboflavin concentration in corneal stroma exposed with and without epithelium. J Cataract Refract Surg. 35 (5), 893-899 (2009).
- Wollensak, G., Iomdina, E. Biomechanical and histological changes after corneal crosslinking with and without epithelial debridement. J Cataract Refract Surg. 35 (3), 540-546 (2009).
- Soeters, N., Wisse, R. P., Godefrooij, D. A., Imhof, S. M., Tahzib, N. G. Transepithelial versus epithelium-off corneal cross-linking for the treatment of progressive keratoconus: a randomized controlled trial. Am J Ophthalmol. 159 (5), 821-828 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。