A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שלושה פרוטוקולים שונים של קרנית קולגן Crosslinking בקרטוקונוס: קונבנציונלי, מואץ וIontophoresis
In This Article
Summary
Corneal collagen cross-linking (CXL) is the only conservative treatment currently available to halt keratoconus progression by improving the biomechanical rigidity of the corneal stroma. The aim of this manuscript is to highlight the methods of three different protocols of CXL: conventional CXL (C-CXL), accelerated CXL (A-CXL), and iontophoresis CXL (I-CXL).
Abstract
קרטוקונוס הוא ectasia קרני דו-צדדי ומתקדם. כדי להאט את התקדמותה, מקשרים בין-קרני קולגן (CXL) לאחרונה הציגו כאפשרות טיפול יעילה. במדעים ביולוגיים וכימיים, crosslinking מתייחס לקשרים כימיים חדשים שנוצרו בין מולקולות. לפיכך, המטרה של CXL קולגן בקרנית היא להגדיל באופן סינטטי היווצרות crosslinks בין סיבי קולגן בסטרומה הקרנית. למרות שהיעילות של CXL הקונבנציונלי הפרוטוקול (C-CXL) כבר הוכחה בכמה מחקרים קליניים, היא עשויה להפיק תועלת משיפורים במשך ההליך והסרת האפיתל של קרנית. לפיכך, על מנת לספק הערכה עקבית של שני פרוטוקולי CXL חדשים ומותאמים, שחקרנו חולי קרטוקונוס שעבר אחד משלושת טיפולי CXL: iontophoresis (I-CXL), מואץ CXL (CXL-), וCXL הקונבנציונלי ( C-CXL). -CXL הוא CXL מהר הליך 6 זמן uלשיר irradiance UVA עשרה זמן גבוהה יותר אבל עדיין כולל הסרת האפיתל. Iontophoresis הוא טכניקה לא פולשנית transepithelial בי זרם חשמלי קטן מיושם כדי לשפר את חדירת ריבופלאבין לאורך הקרנית. שימוש בטומוגרפיה לכידות קדמית קטע אופטית (AS אוקטובר) ובמיקרוסקופיה confocal vivo (IVCM), אנו מגיעים למסקנה כי בעניין עומק חדירת טיפול, פרוטוקול CXL קונבנציונלי נשאר סטנדרטי לטיפול בקרטוקונוס המתקדם. נראה CXL המואץ להיות אלטרנטיבה מהירה, יעילה ובטוחה לטיפול בקרניות דקות. השימוש בiontophoresis עדיין נחקר ויש לשקול בזהירות רבה יותר.
Introduction
קרטוקונוס הוא ectasia קרני דו-צדדי ומתקדם בדרך כלל דיווח ב 1 ב2,000 באוכלוסייה הכללית 1 וכתוצאה מכך השינוי של צורת הקרנית ולכן ירידה בראייה 2. קרטוקונוס הוא בדרך כלל נמצא בגיל ההתבגרות המוקדמת ומתקדם עד השלישי לעשור הרביעי של חיים כאשר המחלה בדרך כלל נוטה לייצב, למרות התקדמות יכולה להיות משתנה במהלך חייו של מטופל. על ידי עצירת התקדמות קרטוקונוס, מקשרים צלב מטרה על keratoplasty לדחות או להימנע.
עד כה, הטיפול יעיל ובטוח היחיד של קרטוקונוס המתקדם המוכח במחקרים קליניים הוא הפרוטוקול הקונבנציונלי קולגן בקרנית קישור הצולב (C-CXL), שמטרתו להגביר את הקשיחות ולכן לעצור את התקדמות קרטוקונוס 3-8. על מנת לקצר את זמן פעולה וגורמים אחרים סיכון האפשרי של C-CXL, כגון קרנית מדבקת או סטרומה אובך 9, יש כמה פרוטוקולים משופריםתואר. ראשית, בCXL המואץ (CXL-), irradiance גבוהה יותר של UVA מועברת לקרנית מעל מופחת זמן 10. שנית, כדי למנוע את הצורך בהטריה אפיתל, גישות transepithelial להיות מועסקים. למרבה הצער, הם הצלחה מוגבלת בהשוואה לפרוטוקול המקובל 11. שיטת transepithelial האחרונה למסירת ריבופלאבין קרנית במהלך CXL היא iontophoresis (I-CXL), אבל הערכה קפדנית של טיפול זה עדיין לא ביצעה 12. Iontophoresis הוא טכניקה לא פולשנית שבזרם חשמלי קטן מיושם כדי לשפר את החדירה של תרופה המיוננת דרך רקמות. בCXL ידי iontophoresis, ריבופלבין הוא מיונן לחדור הקרנית באמצעות אפיתל.
במיקרוסקופיה confocal vivo (IVCM) היא שיטת ההדמיה הקרנית שיכול להדגיש את השינויים התאיים של קרניות חריגות במחלות כגון קרטוקונוס 13. ואכן, IVCMהוכיח שינויים לכל השכבות של הקרנית בקרטוקונוס עם ירידה מסוימת בצפיפות של מקלעת תת-בסיס העצב וסטרומה keratocytes 13-15. בנוסף, IVCM הוכיח להיות נוח מאוד לניתוח microstructural של הקרנית לאחר C-CXL 16.
קו התיחום קרני מתואר כקו hyperreflective ראה בטומוגרפיה קוהרנטיות אופטית מקטע קדמי (AS אוקטובר) 1 חודש לאחר C-CXL בעומק של 300 מיקרומטר 17,18. IVCM C-CXL הבא מספק מידע על שינויים מבניים בקרנית, לרבות העדר keratocytes קרני עד לעומק של 300 מיקרומטר. העומק של אזור acellular זה, כמו גם את העומק של קו התיחום בתוך סטרומה הקרנית חשף כאוקטובר, נראה להיות קשורים לעומק האפקטיבי של טיפול CXL 19, ומדידה של עומק קו התיחום קרני בAS אוקטובר 1 חודש לאחר CXL הוצע כיעיל קלינישיטה להערכת אפקטיבי CXL 18.
במחקר הנוכחי אנו חוקרים את היעילות של שלושה פרוטוקולים שונים של crosslinking קולגן בקרנית (קונבנציונליים, מואץ, וiontophoresis) באמצעות מדידה של קו תיחום סטרומה הקרנית על ידי AS OCT ומיקרוסקופיה confocal. אנחנו יתר על כן משמשים IVCM לנתח כמותית קרני מיקרו שינויים לאחר שלושה הטיפולים.
Protocol
פרוטוקולים אלה פעלו בהתאם להנחיות של ועדת האתיקה במחקר האנושית של המוסד שלנו.
1. קונבנציונלי קרנית קולגן CXL (C-CXL)
1. הכנת החולה
- 5 ימים לפני הניתוח, לשים pilocarpine% 1 טיפות פעמיים ביום בעיניים שטופלו.
- בחדר הניתוח, בתנאים אספטיים, לשכב על גב המטופל שלו / שלה.
- לנהל הרדמה מקומית כגון oxybuprocaine 0.4%.
- לנקות את העין ואת העור סביב העין עם יוד חיטוי פעמיים.
- השתמש בספקולום מכסה כדי לשמור על העיניים פתוחות.
2. הסרת אפיתל
- סמן 9.0 מ"מ של הקרנית עם סמן קרני מעגל המרכזי.
- הסר את 7.0-9.0 מ"מ המרכזי של אפיתל קרני על ידי הטריה מכאנית בעזרת מרית בוטה.
3. ריבופלבין יישום
- החל 0.1% ריבופלבין עם 20% Dextran על ה קרנית דואר בכל דקות במשך 20 דקות.
הקרנת 4. UVA
- מכשיר את הקרנית עם אור באורך גל UVA 370 ננומטר בirradiance של 3 mW / 2 סנטימטר (5.4 מנת משטח / 2 סנטימטר J) ובמרחק 5 סנטימטר עובד למשך 30 דקות.

איור 1:. הקרנת UVA בC-CXL הקרנית מוקרן עם אור באורך גל UVA 370 ננומטר בirradiance של 3 mW / 2 סנטימטר (5.4 מנת משטח / 2 סנטימטר J) ובמרחק 5 סנטימטר עובד במשך 30 דקות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- במהלך הקרנה, חלים טיפות ריבופלבין לקרנית כל 5 דקות.
- במהלך הקרנה, להוסיף הרדמה מקומית (oxybuprocaine 0.4%) במידת צורך.
- טיפות לשים אנטיביוטיקה (tobramycin 0.3%) ודמעות מלאכותיות (Hyaluronate טיפות 0.18%) לתוך העין פעלה.
- מניחים עדשות מגע תחבושת רכות בסוף הניתוח עד מחדש epithelialization הוא מלא. Epithelialization-מחדש בדרך כלל לוקח 3 ימים.
- לרשום משככי כאבים כגון אקמול (500 מ"ג) בתוספת קודאין (30 מ"ג), 6 כדורים ביום.
- לאחר epithelialization מחדש של הקרנית, ליזום טיפול מקומי בסטרואידים (מ"ג / מיליליטר dexamethasone 1 אקטואלי) ולהמשיך במשך 3-4 שבועות. בנוסף, השתמש דמעות מלאכותיות 4 פעמים ביום למשך 1 חודש.
2. קרנית מואצת קולגן CXL (CXL-)
1. הכנת החולה
- 5 ימים לפני הניתוח, לשים pilocarpine% 1 טיפות פעמיים ביום בעיניים שטופלו.
- בחדר הניתוח, בתנאים אספטיים, לשכב על גב המטופל שלו / שלה.
- לנהל הרדמה מקומית כגון oxybuprocaine 0.4%.
- נקה את הדואראתם והעור סביב העין עם יוד חיטוי פעמיים.
- השתמש בספקולום מכסה כדי לשמור על העיניים פתוחות.
2. הסרת אפיתל
- סמן 9.0 מ"מ המרכזי של הקרנית עם סמן קרני מעגל
- הסר את 7.0-9.0 מ"מ המרכזי של אפיתל קרני על ידי הטריה מכאנית בעזרת מרית בוטה.
3. ריבופלבין יישום
- החל ריבופלבין 0.1% ללא Dextran על הקרנית כל 2 דקות במשך 10 דקות.
הקרנת 4. UVA
- מכשיר את הקרנית עם אור באורך גל UVA 370 ננומטר בirradiance של 30 mW / 2 סנטימטר (5.4 J / 2 סנטימטר מינון פני השטח) ובמרחק עבודה 5 סנטימטר 3 דקות.
- במהלך ההקרנה, להוסיף הרדמה מקומית (oxybuproca & # 239; ne 0.4%) במידת צורך.
5. סוף הניתוח
- הנח טיפות אנטיביוטיות (tobramycin 0.3%) ודמעות מלאכותיות (Hyaluronate טיפות 0 .18%) לתוך העין פעלה.
- מניחים עדשות מגע תחבושת רכות בסוף הניתוח עד מחדש epithelialization הוא מלא. Epithelialization-מחדש בדרך כלל לוקח 3 ימים.
- לרשום משככי כאבים כגון אקמול (500 מ"ג) בתוספת קודאין (30 מ"ג), 6 כדורים ביום.
- לאחר epithelialization מחדש של הקרנית, ליזום טיפול מקומי בסטרואידים (מ"ג / מיליליטר dexamethasone 1 אקטואלי) ולהמשיך במשך 3-4 שבועות. בנוסף, השתמש דמעות מלאכותיות 4 פעמים ביום למשך 1 חודש.
3. Iontophoresis (I-CXL)
1. הכנת החולה
- 5 ימים לפני הניתוח, לשים pilocarpine% 1 טיפות פעמיים ביום בעיניים שטופלו.
- בחדר הניתוח, בתנאים אספטיים, לשכב על גב המטופל שלו / שלה.
- לנהל הרדמה מקומית כגון oxybuprocaine 0.4%.
- לנקות את העין ואת העור סביב העין עם יוד חיטוי פעמיים.
- השתמש בספקולום מכסה כדי לשמור על העיניים פתוחות.
- החל האלקטרודה הפסיבית הדביקה על המצח מתחת לשדה האופרטיבי.
- החל האלקטרודה הפעילה, טבעת יניקה, לעין הפתוחה. מרכז את טבעת היניקה בפריפריה של הקרנית לפני שחרור היניקה.

איור 2. מכשיר Iontophoresis. אלקטרודה הפסיבית מוחלת על המצח מתחת לשדה האופרטיבי ואלקטרודה הפעילה, טבעת יניקה, מוחל על העיניים פתוחות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
3. ריבופלבין יישום
- מלא את טבעת היניקה עם% 0.1 hypoosmolar ריבופלבין ללא Dextran.
jpg "/>
איור 3. יישום ריבופלבין באני-CXL. טבעת היניקה מלאה בriboflavine 0.1% hypoosmolar ללא Dextran. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- התחל הזרם החשמלי על 0.2 מילי-אמפר ולהגדיל בהדרגה עד 1.0 מילי-אמפר לשעת iontophoresis כולל של 5 דקות (איור 4).
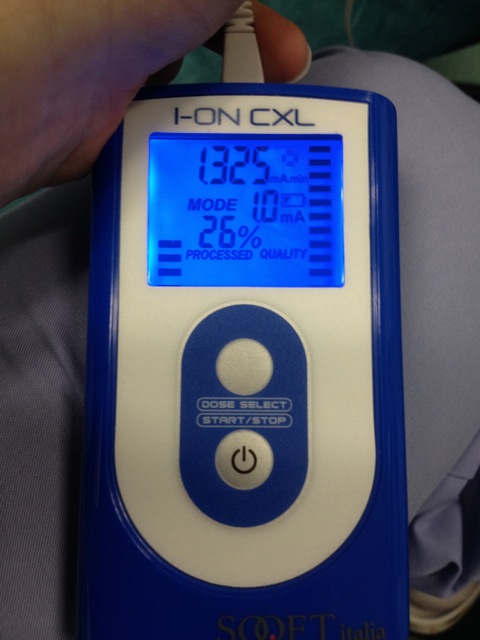
איור 4. מכשיר Iontophoresis לריבופלבין חדירה. הזרם החשמלי הוא בתחילה 0.2 מילי-אמפר וגדל בהדרגה עד 1.0 מילי-אמפר. זמן iontophoresis הכולל הוא 5 דקות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
EP "> 4. UVA הקרנה- מכשיר את הקרנית עם אור באורך גל UVA 370 ננומטר בirradiance של 10 mW / 2 סנטימטר (5.4 J / 2 סנטימטר מינון פני השטח) ובמרחק עבודה 5 סנטימטר ל9 דקות.
- במהלך ההקרנה, להוסיף הרדמה מקומית (oxybuproca & # 239; ne 0.4%) במידת צורך.
5. סוף הניתוח
- הנח טיפות אנטיביוטיות (tobramycin 0.3%) ודמעות מלאכותיות (Hyaluronate טיפות 0.18%) לתוך העין פעלה.
- לרשום משככי כאבים כגון אקמול (500 מ"ג) בתוספת קודאין (30 מ"ג), 6 כדורים ביום.
- לאחר ניתוח, ליזום טיפול מקומי בסטרואידים (1 מ"ג / מיליליטר dexamethasone אקטואלי) ולהמשיך במשך 3-4 שבועות. בנוסף, השתמש דמעות מלאכותיות 4 פעמים ביום למשך 1 חודש.
תוצאות
קו התיחום קרני היה גלוי בAS אוקטובר ב -92% מהמקרים בעומק ממוצע של 301.6 מיקרומטר (SD, 73.6)
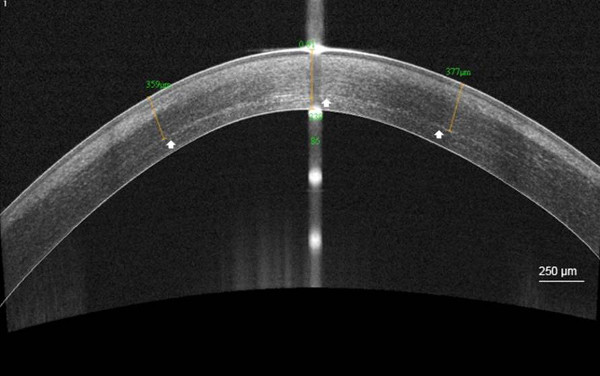
איור קו 5. תיחום לאחר C-CXL. סריקה ברזולוציה גבוהה מקטע הקדמי של קרנית קוהרנט?...
Discussion
CXL באמצעות קרינת UVA וריבופלבין הוא הטיפול הסטנדרטי למעצר ההתקדמות של קרטוקונוס. ריבופלבין הוא הפוטוסנסיטייזר אשר גורם קשרים קוולנטיים (קישורים צולבים) כימיים כאשר מוקרן עם UVA 3. בקרנית, תופעה זו יוצרת צלב קישורים בין סיבי קולגן המגבירים קשיחות קרנית. למרות שתופע...
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors have no acknowledgements.
Materials
| Name | Company | Catalog Number | Comments |
| Riboflavin Product number | |||
| C-CXL | Sooft SPA, Montegiorgio, Italy | Ricrolin 468465-6 | |
| A-CXL | Avedro Inc, Waltham, Massachusetts | VibeX 520-01863-006 | |
| I-CXL | Sooft SPA, Montegiorgio, Italy | Ricrolin+ 975481-6 | Passive electrode: PROTENS ELITE 4848LE/ Active electrode: IONTOFOR CXL |
| UVA Machine | |||
| X-Vega | UVA: 3 mW/cm2 30 min | ||
| KXL System | UVA: 30 mW/cm2 10 min | ||
| X-Vega | UVA: 10 mW/cm2 9 min |
References
- Rabinowitz, Y. S. Keratoconus. Surv Ophthalmol. 42 (4), 297-319 (1998).
- Tuori, A. J., et al. The immunohistochemical composition of corneal basement membrane in keratoconus. Curr Eye Res. 16 (8), 792-801 (1997).
- Wollensak, G., Spoerl, E., Seiler, T. Riboflavin/ultraviolet-A-induced collagen cross-linking for the treatment of keratoconus. Am J Ophthalmol. 135 (5), 620-627 (2003).
- Raiskup-Wolf, F., Hoyer, A., Spoerl, E., Pillunat, L. E. Collagen cross-linking with riboflavin and ultraviolet-A light in keratoconus: long-term results. J Cataract Refract Surg. 34 (5), 796-801 (2008).
- Vinciguerra, P., et al. topographic, tomographic, and aberrometric analysis of keratoconic eyes undergoing corneal cross-linking. Ophthalmology. 116 (3), 369-378 (2009).
- Caporossi, A., Mazzotta, C., Baiocchi, S., Caporossi, T. Long-term results of riboflavin ultraviolet-A corneal collagen cross-linking for keratoconus in Italy: the Siena eye cross study. Am J Ophthalmol. 149 (4), 585-593 (2010).
- Greenstein, S. A., Fry, K. L., Hersh, P. S. Corneal topography indices after corneal collagen cross-linking for keratoconus and corneal ectasia: one-year results. J Cataract Refract Surg. 37 (7), 1282-1290 (2011).
- Ghanem, R. C., Santhiago, M. R., Berti, T., Netto, M. V., Ghanem, V. C. Topographic corneal wavefront, and refractive outcomes 2 years after collagen cross-linking for progressive keratoconus. Cornea. 33 (1), 43-48 (2014).
- Koller, T., Mrochen, M., Seiler, T. Complication and failure rates after corneal cross-linking. J Cataract Refract Surg. 35 (8), 1358-1362 (2009).
- Rocha, K. M., Ramos-Esteban, J. C., Qian, Y., Herekar, S., Krueger, R. R. Comparative study of riboflavin-UVA cross-linking and “flash-linking” using surface wave elastometry. J Refract Surg. 24 (7), 748-751 (2008).
- Caporossi, A., et al. Transepithelial corneal collagen crosslinking for progressive keratoconus: 24-month clinical results. J Cataract Refract Surg. 39 (8), 1157-1163 (2013).
- Bikbova, G., Bikbov, M. Transepithelial corneal collagen cross-linking by iontophoresis of riboflavin. Acta Ophthalmol. 92 (1), 30-34 (2014).
- Efron, N., Hollingsworth, J. G. New perspectives on keratoconus as revealed by corneal confocal microscopy. Clin Exp Optom. 91 (1), 34-55 (2008).
- Patel, D. V., McGhee, C. N. Mapping the corneal sub-basal nerve plexus in keratoconus by in vivo laser scanning confocal microscopy. Invest Ophthalmol Vis Sci. 47 (4), 1348-1351 (2006).
- Ku, J. Y., Niederer, R. L., Patel, D. V., Sherwin, T., McGhee, C. N. Laser scanning in vivo confocal analysis of keratocyte density in keratoconus. Ophthalmology. 115 (5), 845-850 (2008).
- Mazzotta, C., et al. Corneal healing after riboflavin ultraviolet-A collagen cross-linking determined by confocal laser scanning microscopy in vivo: early and late modifications. Am J Ophthalmol. 146 (4), 527-533 (2008).
- Seiler, T., Hafezi, F. Corneal cross-linking-induced stromal demarcation line. Cornea. 25 (9), 1057-1059 (2006).
- Doors, M., et al. Use of anterior segment optical coherence tomography to study corneal changes after collagen cross-linking. Am J Ophthalmol. 148 (6), 844-851 (2009).
- Mazzotta, C., et al. Treatment of progressive keratoconus by riboflavin-UVA-induced cross-linking of corneal collagen: ultrastructural analysis by Heidelberg Retinal Tomograph II in vivo confocal microscopy in humans. Cornea. 26 (4), 390-397 (2007).
- Kymionis, G. D., et al. Correlation of the corneal collagen cross-linking demarcation line using confocal microscopy and anterior segment optical coherence tomography in keratoconic patients. Am J Ophthalmol. 157 (1), 110-115 (2014).
- Yam, J. C., Chan, C. W., Cheng, A. C. Corneal collagen cross-linking demarcation line depth assessed by Visante OCT After CXL for keratoconus and corneal ectasia. J Refract Surg. 28 (7), 475-481 (2012).
- Jordan, C., Patel, D. V., Abeysekera, N., McGhee, C. .. N. .. In vivo confocal microscopy analyses of corneal microstructural changes in a prospective study of collagen cross-linking in keratoconus. Ophthalmology. 121 (2), 469-474 (2014).
- Touboul, D., et al. Corneal confocal microscopy following conventional, transepithelial, and accelerated corneal collagen cross-linking procedures for keratoconus. J Refract Surg. 28 (11), 769-776 (2012).
- Bouheraoua, N., et al. Optical coherence tomography and confocal microscopy following three different protocols of corneal collagen-crosslinking in keratoconus. Invest Ophthalmol Vis Sci. 55 (11), 7601-7609 (2014).
- Hafezi, F., Mrochen, M., Iseli, H. P., Seiler, T. Collagen crosslinking with ultraviolet-A and hypoosmolar riboflavin solution in thin corneas. J Cataract Refract Surg. 35 (4), 621-624 (2009).
- Cınar, Y., et al. Comparison of accelerated and conventional corneal collagen cross-linking for progressive keratoconus. Cutan Ocul Toxicol. 33 (3), 218-222 (2013).
- Cingü, A. K., et al. Transient corneal endothelial changes following accelerated collagen cross-linking for the treatment of progressive keratoconus. Cutan Ocul Toxicol. 33 (2), 127-131 (2013).
- Spoerl, E., Mrochen, M., Sliney, D., Trokel, S., Seiler, T. Safety of UVA-riboflavin cross-linking of the cornea. Cornea. 26 (4), 385-389 (2007).
- Gokhale, N. S. Corneal endothelial damage after collagen cross-linking treatment. Cornea. 30 (12), 1495-1498 (2011).
- Rootman, D. S., et al. Pharmacokinetics and safety of transcorneal iontophoresis of tobramycin in the rabbit. Invest Ophthalmol Vis Sci. 29 (9), 1397-1401 (1998).
- Vinciguerra, P., et al. Transepithelial iontophoresis corneal collagen cross-linking for progressive keratoconus: initial clinical outcomes. J Refract Surg. 30 (11), 746-753 (2014).
- Caporossi, A., et al. Riboflavin-UVA-induced corneal collagen cross-linking in pediatric patients. Cornea. 31 (3), 227-231 (2012).
- Buzzonetti, L., Petrocelli, G., Valente, P., Larossi, G., Ardia, R., Petroni, S. Iontophoretic transepithelial corneal cross-linking to halt keratoconus in pediatric cases: 15-month follow-up. Cornea. 34 (5), 512-515 (2015).
- Baiocchi, S., Mazzotta, C., Cerretani, D., Caporossi, T., Caporossi, A. Corneal crosslinking: riboflavin concentration in corneal stroma exposed with and without epithelium. J Cataract Refract Surg. 35 (5), 893-899 (2009).
- Wollensak, G., Iomdina, E. Biomechanical and histological changes after corneal crosslinking with and without epithelial debridement. J Cataract Refract Surg. 35 (3), 540-546 (2009).
- Soeters, N., Wisse, R. P., Godefrooij, D. A., Imhof, S. M., Tahzib, N. G. Transepithelial versus epithelium-off corneal cross-linking for the treatment of progressive keratoconus: a randomized controlled trial. Am J Ophthalmol. 159 (5), 821-828 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved