JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
원추 각막의 각막 콜라겐 가교의 세 가지 서로 다른 프로토콜 : 기존의가, 가속 및 이온 토 포레 시스
요약
Corneal collagen cross-linking (CXL) is the only conservative treatment currently available to halt keratoconus progression by improving the biomechanical rigidity of the corneal stroma. The aim of this manuscript is to highlight the methods of three different protocols of CXL: conventional CXL (C-CXL), accelerated CXL (A-CXL), and iontophoresis CXL (I-CXL).
초록
원추 각막은 양자 및 진보적 인 각막 확장증입니다. 그 진행을 느리게하기 위하여, 각막 콜라겐 가교 (CXL)은 최근 효율적인 치료 방법으로 도입되었다. 생물학적 및 화학적 과학, 가교 반응 분자 사이에 형성되는 새로운 화학 결합을 의미한다. 따라서, 각막 콜라겐 CXL의 목적은 합성 각막 기질에 콜라겐 섬유 사이의 가교의 형성을 증가시키는 것이다. 종래 CXL (C-CXL) 프로토콜의 효율은 이미 여러 임상 연구에 도시되었다는 사실에도 불구하고, 절차 및 각막 상피의 제거 기간에도 향상 것이다. 따라서, 두 개의 새로운 최적화 CXL 프로토콜 응집성 평가를 제공하기 위해, 우리는 세 CXL 치료의 하나받은 원추 각막 환자 연구 : 이온 도입 (I-CXL)를 CXL (A-CXL), 및 종래 CXL을 (가속 C-CXL). - CXL는 6 시간 빠른 CXL 절차 U입니다여전히 상피 제거하는 등 10 시간 더 높은 UVA의 조도를 노래하지만. 이온 삼투 요법은 작은 전류가 각막에 걸쳐 리보플라빈 침투를 개선하기 위해인가되는 transepithelial 비 침습 기술이다. OCT (AS) 및 생체 공 초점 현미경 (IVCM)에서 전 안부 빛 간섭 단층 촬영을 사용하여, 우리는 치료 침투의 깊이에 대해 기존의 CXL 프로토콜은 진보적 인 원추 각막 치료를위한 표준 유지 결론 지었다. 가속 CXL은 얇은 각막을 치료하는, 빠르고 효과적이고 안전한 대안이 될 것으로 보인다. 이온 삼투 요법의 사용은 여전히 연구되고 있으며 더욱 신중 고려되어야한다.
서문
원추 각막은 일반적으로 각막 모양의 변형의 결과로 일반 인구 1 천 1에보고 된 양자 및 진보적 인 각막 확장증이며, 따라서 시력이 감소했다. 각막 조기 사춘기에 보통 존재하는 질병은 일반적으로 안정 될 때 진행하는 경향이 환자의 일생 동안 가변 될 수 있지만, 삶의 제 십년에 셋째까지 진행한다. 원추 각막의 진행을 중단함으로써, 가교는 연기 또는 회피 각막 목표로하고있다.
현재까지 임상 연구에서 입증 된 진보적 인 원추 각막의 유일한 안전하고 효과적으로 치료 강성을 증가시키고 따라서 원추 각막의 진행 3-8을 중단하는 것을 목표로 기존의 각막 콜라겐 교차 결합 (C-CXL) 프로토콜입니다. 수술 시간 및 감염성 각막염이나 각막 안개 9로 C-CXL의 다른 가능한 위험 요인을 줄이기 위해 몇 가지 개선 된 프로토콜이에설명. 첫째, 가속 CXL (A-CXL)에, UVA의 높은 조도는 시간을 단축 (10)를 통해 각막에 전달된다. 둘째, 상피 괴사에 대한 필요성을 피하기 위해, transepithelial 접근법이 이용되어왔다. 종래의 프로토콜 (11)에 비교할 때 불행히도, 이들은 제한된 성공. CXL 동안 각막 리보플라빈 배달 최근 transepithelial 방법은 이온 토 포레 시스 (I-CXL)이지만,이 처리의 엄격한 평가는 아직 12 실시되지 않았다. 이온 토 포레 시스는 작은 전류를 조직을 통하여 이온화 약물의 침투를 향상시키기 위해 적용되는 비 침습 기술이다. 이온 삼투압에 의한 CXL에서, 리보플라빈은 각막 상피를 통해 침투하는 이온화된다.
생체 공 초점 현미경 (IVCM)는 같은 원추 각막 (13) 등의 질환에서 비정상적인 각막의 세포 변화를 강조 할 수있는 각막을 영상화하는 방법이다. 사실, IVCM서브 기저 신경 얼기의 밀도에서 특정 감소 원추 각막에서 각막의 모든 레이어에 변경을 증명하고 기질은 13-15 각막 간질했다. 또한, IVCM는 C-CXL (16) 후 각막의 미세 구조 분석을위한 매우 편리한 것으로 입증되었습니다.
각막 분계선은 300 μm의 (17, 18)의 깊이에서 C-CXL 후 hyperreflective OCT (AS) 전 안부 빛 간섭 단층 촬영에서 볼 줄 1개월으로 설명되어 있습니다. IVCM 다음의 C-CXL 300 ㎛의 깊이로 각막 실질 세포의 부재를 포함하여 각막의 구조 변경에 대한 정보를 제공합니다. 이 무 세포 영역의 깊이뿐만 아니라 각막 간질 내에서 경계선의 깊이가 간섭 단층 1과의 CXL 처리 (19), 및 각막 분계선 깊이 측정의 유효 깊이와 관련이있는 것으로 보인다 10월로 밝혀 CXL 개월 후에는 효과적인 임상 적으로 제안되어왔다CXL 효과 (18)의 평가 방법.
본 연구에서 우리는 10월 및 공 초점 현미경 AS에 의해 각막 간질 분계선의 측정을 사용하여 세 가지 (기존, 가속 및 이온 토 포레 시스) 각막 콜라겐 가교 프로토콜의 효율성을 조사합니다. 우리는 또한 정량적으로 세 가지 치료 후 각막 미세 구조 변화를 분석하기 위해 IVCM을 사용했다.
프로토콜
이러한 프로토콜은 우리 기관의 인간 연구 윤리위원회의 지침을 따르십시오.
1. 기존의 각막 콜라겐 CXL (C-CXL)
환자 (1)의 제조
- 오일 수술 전, 1 % 필로 카핀 두 번 처리 된 눈의 날을 삭제했습니다.
- 수술실에서 무균 조건에서, 그 / 그녀를 다시 환자 거짓말.
- 국소 마취에게 같은 oxybuprocaine 0.4 %를 관리.
- 눈과 두 번 살균 요오드와 눈 주위의 피부를 청소합니다.
- 열린 눈을 유지하기 위해 뚜껑 검경을 사용합니다.
2. 상피 제거
- 원 각막 마커 각막의 중앙 9.0 mm로 표시합니다.
- 무딘 주걱을 사용하여 기계적인 변연 절제술에 의한 각막 상피의 중심 7.0-9.0 mm를 제거합니다.
3. 리보플라빈 응용 프로그램
- 0.1 %가 일에 20 % 덱스 트란과 리보플라빈 적용 전자 각막 20 분마다 분.
4. UVA 조사
- 3 mW의 / cm 2 (5.4 J / cm 2 표면 도즈)의 조도로 30 분간 작동 거리 5cm에서 370 nm 파장의 빛으로 UVA 각막을 조사.

그림 1. C-CXL의 UVA 조사 각막 3 mW의 / cm 2 (5.4 J / cm 2 표면 도즈)의 조도로 30 분간 5cm 작동 거리에서 370 nm 파장의 UVA 광 조사한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 조사 기간 동안, 각막에 매 5 분 리보플라빈 방울을 적용합니다.
- 조사 기간 동안, 국소 마취 (oxybuprocaine 0.4 %) 필요한 경우를 추가합니다.
- 넣어 항생제 방울 (토 브라 마이신 0.3 %) 및 운영의 눈에 인공 눈물 (히알루 론산은 0.18 % 방울).
- 재 상피화가 완료 될 때까지 수술 끝에 붕대 소프트 콘택트 렌즈를 배치했다. 재 상피화는 일반적으로 삼일 소요됩니다.
- 같은 해열 (500 mg)을 더한 코데인 (30 mg)을, 6 약을 하루에 같은 진통제를 처방.
- 각막의 재 상피화 후, 스테로이드와 국소 치료 (국소 덱사메타손 1 ㎎ / ㎖)을 시작 3-4 주 동안 계속합니다. 또한, 1 개월 인공 눈물을 하루에 4 번을 사용합니다.
2. 가속 각막 콜라겐 CXL (A-CXL)
환자 (1)의 제조
- 오일 수술 전, 1 % 필로 카핀 두 번 처리 된 눈의 날을 삭제했습니다.
- 수술실에서 무균 조건에서, 그 / 그녀를 다시 환자 거짓말.
- 국소 마취에게 같은 oxybuprocaine 0.4 %를 관리.
- 전자를 청소너희 두 번 살균 요오드와 눈 주위의 피부.
- 열린 눈을 유지하기 위해 뚜껑 검경을 사용합니다.
2. 상피 제거
- 각막 원 마커로 각막의 중앙 9.0 mm 마크
- 무딘 주걱을 사용하여 기계적인 변연 절제술에 의한 각막 상피의 중심 7.0-9.0 mm를 제거합니다.
3. 리보플라빈 응용 프로그램
- 10 분 동안 각막에 덱스 트란없이 매 2 분 0.1 % 리보플라빈을 적용합니다.
4. UVA 조사
- 30 mW의 / cm 2 (5.4 J / cm 2 표면 선량)와 3 분간 5cm 작동 거리에서의 방사 조도에서 370 nm 파장의 빛으로 UVA 각막을 조사.
- (oxybuproca & # 239; 0.4 %를 북동) 조사하는 동안, 국소 마취를 추가 필요.
수술 5. 끝
- 항생제 방울 (토 브라 마이신 0.3 %), 인공 눈물을 (히알루 론산은 0을 삭제 배치 작동 눈에 0.18 %).
- 재 상피화가 완료 될 때까지 수술 끝에 붕대 소프트 콘택트 렌즈를 배치했다. 재 상피화는 일반적으로 삼일 소요됩니다.
- 같은 해열 (500 mg)을 더한 코데인 (30 mg)을, 6 약을 하루에 같은 진통제를 처방.
- 각막의 재 상피화 후, 스테로이드와 국소 치료 (국소 덱사메타손 1 ㎎ / ㎖)을 시작 3-4 주 동안 계속합니다. 또한, 1 개월 인공 눈물을 하루에 4 번을 사용합니다.
3. 이온 토 포레 시스 (I-CXL)
환자 (1)의 제조
- 오일 수술 전, 1 % 필로 카핀 두 번 처리 된 눈의 날을 삭제했습니다.
- 수술실에서 무균 조건에서, 그 / 그녀를 다시 환자 거짓말.
- 국소 마취에게 같은 oxybuprocaine 0.4 %를 관리.
- 눈과 두 번 살균 요오드와 눈 주위의 피부를 청소합니다.
- 열린 눈을 유지하기 위해 뚜껑 검경을 사용합니다.
- 수술 분야에서 이마에 스티커 수동 전극을 적용합니다.
- 열린 눈, 활성 전극, 흡입 링을 적용합니다. 흡인을 해제하기 전에 각막의 주변에 흡입 링의 중심.

그림 2. 이온 토 포레 시스 장치. 수동 전극은 수술 분야에서 이마와 활성 전극, 흡입 링에 적용되는, 열린 눈에 적용된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 리보플라빈 응용 프로그램
- 0.1 hypoosmolar %는 덱스 트란없이 리보플라빈과 흡입 반지를 입력합니다.
JPG "/>
I-CXL 그림 3. 리보플라빈 응용 프로그램입니다. 흡입 링은 덱스 트란없이 hypoosmolar 0.1 % riboflavine으로 가득합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 0.2 mA의 전류를 시작하고 점차적으로 5 분 (그림 4)의 총 이온 토 포레 시스 시간을 1.0 mA로 증가.
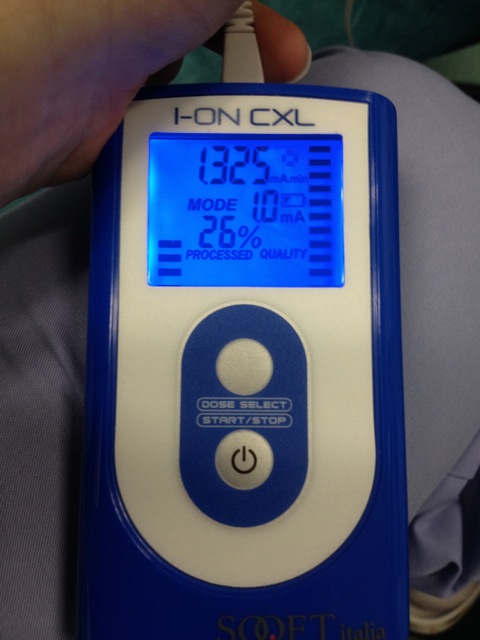
침투 리보플라빈 그림 4. 이온 삼투압 장치. 전류가 처음에 0.2 mA이며, 점차적으로 1.0 mA로 증가. 총 이온 토 포레 시스 시간은 5 분입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
EP "> 4. UVA 조사- 경우 10mW / ㎠ (5.4 J / cm 2 표면 도즈), 9 분 동안 5cm 작동 거리에서의 방사 조도에서 370 nm 파장의 빛으로 UVA 각막을 조사.
- (oxybuproca & # 239; 0.4 %를 북동) 조사하는 동안, 국소 마취를 추가 필요.
수술 5. 끝
- 항생제 방울 (토 브라 마이신 0.3 %) 및 운영의 눈에 인공 눈물을 (히알루 론산은 0.18 % 방울) 놓습니다.
- 같은 해열 (500 mg)을 더한 코데인 (30 mg)을, 6 약을 하루에 같은 진통제를 처방.
- 수술 후 스테로이드와 국소 치료 (국소 덱사메타손 1 ㎎ / ㎖)을 시작 3-4 주 동안 계속합니다. 또한, 1 개월 인공 눈물을 하루에 4 번을 사용합니다.
결과
각막 경계 라인 (73.6 SD) 301.6 ㎛의 평균 깊이의 경우 92 %에 10월로 볼 수 있었다
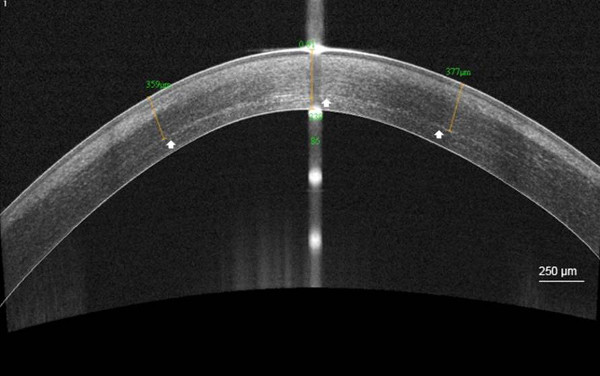
C-CXL 후 그림 5. 분계선. OCT (AS) 고해상도 각막 전 안부 빛 간섭 단층 촬영 검사 기존의 각막 콜라겐 교차 후 358 μm의 (흰색 화살표), 1 개월 평균 깊이에서 각막 기질 분계선을 시각화 연결 (C-CXL). 스케...
토론
UVA 조사 및 리보플라빈을 사용하여 CXL은 원추 각막의 진행을 체포에 대한 표준 치료입니다. 리보플라빈 3 UVA 조사에 화학적 공유 결합 (가교)을 유도 감광제이다. 각막,이 현상은 각막 강성을 증가 콜라겐 섬유 사이의 상호 링크를 작성합니다. 이 현상을 잘 설명 하였지만, 지금까지 intracorneal 가교의 직접적인 증거는 없었다. 그럼에도 불구하고, 여러 연구 CXL 따라서 C-3-8의 효과를 ...
공개
The authors have nothing to disclose.
감사의 말
The authors have no acknowledgements.
자료
| Name | Company | Catalog Number | Comments |
| Riboflavin Product number | |||
| C-CXL | Sooft SPA, Montegiorgio, Italy | Ricrolin 468465-6 | |
| A-CXL | Avedro Inc, Waltham, Massachusetts | VibeX 520-01863-006 | |
| I-CXL | Sooft SPA, Montegiorgio, Italy | Ricrolin+ 975481-6 | Passive electrode: PROTENS ELITE 4848LE/ Active electrode: IONTOFOR CXL |
| UVA Machine | |||
| X-Vega | UVA: 3 mW/cm2 30 min | ||
| KXL System | UVA: 30 mW/cm2 10 min | ||
| X-Vega | UVA: 10 mW/cm2 9 min |
참고문헌
- Rabinowitz, Y. S. Keratoconus. Surv Ophthalmol. 42 (4), 297-319 (1998).
- Tuori, A. J., et al. The immunohistochemical composition of corneal basement membrane in keratoconus. Curr Eye Res. 16 (8), 792-801 (1997).
- Wollensak, G., Spoerl, E., Seiler, T. Riboflavin/ultraviolet-A-induced collagen cross-linking for the treatment of keratoconus. Am J Ophthalmol. 135 (5), 620-627 (2003).
- Raiskup-Wolf, F., Hoyer, A., Spoerl, E., Pillunat, L. E. Collagen cross-linking with riboflavin and ultraviolet-A light in keratoconus: long-term results. J Cataract Refract Surg. 34 (5), 796-801 (2008).
- Vinciguerra, P., et al. topographic, tomographic, and aberrometric analysis of keratoconic eyes undergoing corneal cross-linking. Ophthalmology. 116 (3), 369-378 (2009).
- Caporossi, A., Mazzotta, C., Baiocchi, S., Caporossi, T. Long-term results of riboflavin ultraviolet-A corneal collagen cross-linking for keratoconus in Italy: the Siena eye cross study. Am J Ophthalmol. 149 (4), 585-593 (2010).
- Greenstein, S. A., Fry, K. L., Hersh, P. S. Corneal topography indices after corneal collagen cross-linking for keratoconus and corneal ectasia: one-year results. J Cataract Refract Surg. 37 (7), 1282-1290 (2011).
- Ghanem, R. C., Santhiago, M. R., Berti, T., Netto, M. V., Ghanem, V. C. Topographic corneal wavefront, and refractive outcomes 2 years after collagen cross-linking for progressive keratoconus. Cornea. 33 (1), 43-48 (2014).
- Koller, T., Mrochen, M., Seiler, T. Complication and failure rates after corneal cross-linking. J Cataract Refract Surg. 35 (8), 1358-1362 (2009).
- Rocha, K. M., Ramos-Esteban, J. C., Qian, Y., Herekar, S., Krueger, R. R. Comparative study of riboflavin-UVA cross-linking and “flash-linking” using surface wave elastometry. J Refract Surg. 24 (7), 748-751 (2008).
- Caporossi, A., et al. Transepithelial corneal collagen crosslinking for progressive keratoconus: 24-month clinical results. J Cataract Refract Surg. 39 (8), 1157-1163 (2013).
- Bikbova, G., Bikbov, M. Transepithelial corneal collagen cross-linking by iontophoresis of riboflavin. Acta Ophthalmol. 92 (1), 30-34 (2014).
- Efron, N., Hollingsworth, J. G. New perspectives on keratoconus as revealed by corneal confocal microscopy. Clin Exp Optom. 91 (1), 34-55 (2008).
- Patel, D. V., McGhee, C. N. Mapping the corneal sub-basal nerve plexus in keratoconus by in vivo laser scanning confocal microscopy. Invest Ophthalmol Vis Sci. 47 (4), 1348-1351 (2006).
- Ku, J. Y., Niederer, R. L., Patel, D. V., Sherwin, T., McGhee, C. N. Laser scanning in vivo confocal analysis of keratocyte density in keratoconus. Ophthalmology. 115 (5), 845-850 (2008).
- Mazzotta, C., et al. Corneal healing after riboflavin ultraviolet-A collagen cross-linking determined by confocal laser scanning microscopy in vivo: early and late modifications. Am J Ophthalmol. 146 (4), 527-533 (2008).
- Seiler, T., Hafezi, F. Corneal cross-linking-induced stromal demarcation line. Cornea. 25 (9), 1057-1059 (2006).
- Doors, M., et al. Use of anterior segment optical coherence tomography to study corneal changes after collagen cross-linking. Am J Ophthalmol. 148 (6), 844-851 (2009).
- Mazzotta, C., et al. Treatment of progressive keratoconus by riboflavin-UVA-induced cross-linking of corneal collagen: ultrastructural analysis by Heidelberg Retinal Tomograph II in vivo confocal microscopy in humans. Cornea. 26 (4), 390-397 (2007).
- Kymionis, G. D., et al. Correlation of the corneal collagen cross-linking demarcation line using confocal microscopy and anterior segment optical coherence tomography in keratoconic patients. Am J Ophthalmol. 157 (1), 110-115 (2014).
- Yam, J. C., Chan, C. W., Cheng, A. C. Corneal collagen cross-linking demarcation line depth assessed by Visante OCT After CXL for keratoconus and corneal ectasia. J Refract Surg. 28 (7), 475-481 (2012).
- Jordan, C., Patel, D. V., Abeysekera, N., McGhee, C. .. N. .. In vivo confocal microscopy analyses of corneal microstructural changes in a prospective study of collagen cross-linking in keratoconus. Ophthalmology. 121 (2), 469-474 (2014).
- Touboul, D., et al. Corneal confocal microscopy following conventional, transepithelial, and accelerated corneal collagen cross-linking procedures for keratoconus. J Refract Surg. 28 (11), 769-776 (2012).
- Bouheraoua, N., et al. Optical coherence tomography and confocal microscopy following three different protocols of corneal collagen-crosslinking in keratoconus. Invest Ophthalmol Vis Sci. 55 (11), 7601-7609 (2014).
- Hafezi, F., Mrochen, M., Iseli, H. P., Seiler, T. Collagen crosslinking with ultraviolet-A and hypoosmolar riboflavin solution in thin corneas. J Cataract Refract Surg. 35 (4), 621-624 (2009).
- Cınar, Y., et al. Comparison of accelerated and conventional corneal collagen cross-linking for progressive keratoconus. Cutan Ocul Toxicol. 33 (3), 218-222 (2013).
- Cingü, A. K., et al. Transient corneal endothelial changes following accelerated collagen cross-linking for the treatment of progressive keratoconus. Cutan Ocul Toxicol. 33 (2), 127-131 (2013).
- Spoerl, E., Mrochen, M., Sliney, D., Trokel, S., Seiler, T. Safety of UVA-riboflavin cross-linking of the cornea. Cornea. 26 (4), 385-389 (2007).
- Gokhale, N. S. Corneal endothelial damage after collagen cross-linking treatment. Cornea. 30 (12), 1495-1498 (2011).
- Rootman, D. S., et al. Pharmacokinetics and safety of transcorneal iontophoresis of tobramycin in the rabbit. Invest Ophthalmol Vis Sci. 29 (9), 1397-1401 (1998).
- Vinciguerra, P., et al. Transepithelial iontophoresis corneal collagen cross-linking for progressive keratoconus: initial clinical outcomes. J Refract Surg. 30 (11), 746-753 (2014).
- Caporossi, A., et al. Riboflavin-UVA-induced corneal collagen cross-linking in pediatric patients. Cornea. 31 (3), 227-231 (2012).
- Buzzonetti, L., Petrocelli, G., Valente, P., Larossi, G., Ardia, R., Petroni, S. Iontophoretic transepithelial corneal cross-linking to halt keratoconus in pediatric cases: 15-month follow-up. Cornea. 34 (5), 512-515 (2015).
- Baiocchi, S., Mazzotta, C., Cerretani, D., Caporossi, T., Caporossi, A. Corneal crosslinking: riboflavin concentration in corneal stroma exposed with and without epithelium. J Cataract Refract Surg. 35 (5), 893-899 (2009).
- Wollensak, G., Iomdina, E. Biomechanical and histological changes after corneal crosslinking with and without epithelial debridement. J Cataract Refract Surg. 35 (3), 540-546 (2009).
- Soeters, N., Wisse, R. P., Godefrooij, D. A., Imhof, S. M., Tahzib, N. G. Transepithelial versus epithelium-off corneal cross-linking for the treatment of progressive keratoconus: a randomized controlled trial. Am J Ophthalmol. 159 (5), 821-828 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유