È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Tre diversi protocolli di collagene corneale reticolazione in Cheratocono: Convenzionale, accelerate e ionoforesi
In questo articolo
Riepilogo
Corneal collagen cross-linking (CXL) is the only conservative treatment currently available to halt keratoconus progression by improving the biomechanical rigidity of the corneal stroma. The aim of this manuscript is to highlight the methods of three different protocols of CXL: conventional CXL (C-CXL), accelerated CXL (A-CXL), and iontophoresis CXL (I-CXL).
Abstract
Il cheratocono è una ectasia corneale bilaterale e progressivo. Al fine di rallentare la sua progressione, corneale collagene cross-linking (CXL) è stato recentemente introdotto come un'opzione di trattamento efficace. Nelle scienze biologiche e chimiche, reticolazione si riferisce a nuovi legami chimici formati tra molecole reattive. Quindi, l'obiettivo di collagene corneale CXL è aumentare sinteticamente la formazione di legami crociati tra fibrille di collagene nel stroma corneale. Nonostante il fatto che l'efficienza del protocollo CXL convenzionale (C-CXL) è già stato dimostrato in diversi studi clinici, potrebbe beneficiare di miglioramenti durata del procedimento e la rimozione dell'epitelio corneale. Pertanto, al fine di fornire una valutazione coerente dei due protocolli nuovi e ottimizzati CXL, abbiamo studiato i pazienti con cheratocono che avevano subito uno dei tre trattamenti CXL: ionoforesi (I-CXL), accelerata CXL (A-CXL), e CXL convenzionale ( C-CXL). A-CXL è un 6 volta procedura più rapida CXL ucantare un dieci volte superiore irradianza UVA ma ancora compreso la rimozione dell'epitelio. Ionoforesi è una tecnica non invasiva transepiteliale in cui viene applicata una piccola corrente elettrica per migliorare la penetrazione riboflavina tutta la cornea. Utilizzando anteriore segmento tomografia a coerenza ottica (OCT AS) e in vivo microscopia confocale (IVCM), possiamo concludere che per quanto riguarda la profondità di penetrazione trattamento, protocollo CXL convenzionale rimane lo standard per il trattamento di cheratocono progressivo. CXL accelerata sembra essere un rapido, efficace e sicuro alternativa per il trattamento di cornee sottili. L'uso di ionoforesi è ancora oggetto di indagine e dovrebbe essere considerata con maggiore cautela.
Introduzione
Il cheratocono è una ectasia corneale bilaterale e progressivo di solito riportati da 1 a 2.000 nella popolazione generale 1 con conseguente modifica della forma della cornea e diminuito quindi la visione 2. Il cheratocono è di solito presente in pubertà precoce e progredisce fino alla terza-quarta decade di vita quando la malattia tende di solito a stabilizzarsi, anche se la progressione può essere variabile per tutta la vita di un paziente. Da arrestare la progressione del cheratocono, reticolazione mira a ritardare o evitare cheratoplastica.
Ad oggi, l'unico trattamento efficace e sicuro di cheratocono progressivo dimostrato negli studi clinici è il protocollo tradizionale Cross-linking (C-CXL), che mira ad aumentare la rigidità e quindi arrestare la progressione del cheratocono 3-8. Al fine di ridurre il tempo di funzionamento e di altri fattori di rischio di possibili C-CXL, come cheratite stromale infettiva o foschia 9, diversi protocolli migliorati hannodescritto. In primo luogo, in CXL accelerata (A-CXL), un più elevato di irradianza UVA è consegnato alla cornea in un tempo ridotto 10. In secondo luogo, per evitare la necessità di debridement epiteliale, approcci transepiteliali sono stati impiegati. Purtroppo, essi hanno un successo limitato rispetto al protocollo convenzionale 11. Il metodo transepiteliale più recente per la consegna riboflavina corneale durante CXL è iontoforesi (I-CXL), ma rigorosa valutazione di questo trattamento non è ancora stata eseguita 12. Ionoforesi è una tecnica non invasiva in cui viene applicata una piccola corrente elettrica per migliorare la penetrazione di un farmaco ionizzato attraverso un tessuto. In CXL dalla ionoforesi, la riboflavina viene ionizzato a penetrare la cornea attraverso l'epitelio.
In vivo microscopia confocale (IVCM) è un metodo di immaginare cornea che può evidenziare i cambiamenti cellulari di cornee anomali in malattie come il cheratocono 13. Infatti, IVCMha dimostrato alterazioni tutti gli strati della cornea nel cheratocono con una particolare riduzione della densità del plesso nervosi sub-basale e stromale cheratociti 13-15. Inoltre, IVCM ha dimostrato di essere altamente conveniente per l'analisi microstrutturale della cornea dopo C-CXL 16.
La linea di demarcazione della cornea è descritto come una linea hyperreflective visto nel segmento anteriore tomografia a coerenza ottica (OCT AS) 1 mese dopo la C-CXL a una profondità di 300 micron 17,18. IVCM seguente C-CXL fornisce informazioni sulle alterazioni strutturali corneali, compresa l'assenza di cheratociti corneali ad una profondità di 300 micron. La profondità di questa zona acellulare, nonché la profondità della linea di demarcazione nello stroma corneale rivelato AS PTOM, sembra essere associato con profondità effettiva del trattamento CXL 19, e la misurazione della profondità della linea di demarcazione corneale AS PTOM 1 mese dopo CXL è stata proposta come un efficiente clinicametodologia di valutazione del CXL efficacia 18.
Nel presente studio indaghiamo l'efficienza di tre diversi protocolli di collagene corneale reticolazione (convenzionali, accelerato, e ionoforesi), utilizzando la misurazione della linea di demarcazione stromale corneale da AS ottobre e microscopia confocale. Abbiamo utilizzato, inoltre, per analizzare quantitativamente IVCM cambiamenti microstruttura della cornea dopo le tre trattamenti.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Questi protocolli seguono le linee guida del comitato etico della ricerca umana della nostra istituzione.
1. convenzionale collagene corneale CXL (C-CXL)
1. Preparazione del paziente
- 5 giorni prima dell'intervento, ha messo 1% pilocarpina gocce due volte al giorno negli occhi trattata.
- In sala operatoria, in condizioni asettiche, si trovano il paziente sulla sua / schiena.
- Somministrare anestesia topica come ossibuprocaina 0,4%.
- Pulire l'occhio e la pelle attorno agli occhi con iodio antisettico due volte.
- Utilizzare uno speculum coperchio per tenere l'occhio aperto.
2. Rimozione epiteliale
- Segnare il centro 9,0 millimetri della cornea con un pennarello corneale cerchio.
- Rimuovere le centrali 7,0 a 9,0 mm di epitelio corneale di pulizia meccanica utilizzando una spatola smussato.
3. Applicazione Riboflavina
- Applicare 0,1% riboflavina con il 20% Dextran su Th e cornea ogni min per 20 min.
4. UVA irradiazione
- Irradiare la cornea con una lunghezza d'onda di luce UVA 370 nm a un flusso energetico di 3 mW / cm 2 (5,4 dosi J / cm2 di superficie) ed a 5 cm di distanza che lavorano per 30 min.

Figura 1:. UVA irradiazione in C-CXL La cornea viene irradiato con una lunghezza d'onda di luce UVA 370 nm a un irradiamento di 3 mW / cm 2 (5,4 dosi J / cm 2 di superficie) e ad una distanza di lavoro 5 cm per 30 minuti. Cliccate qui per vedere una versione più grande di questa figura.
- Durante l'irradiazione, applicare gocce di riboflavina alla cornea ogni 5 min.
- Durante l'irradiazione, aggiungere anestesia topica (ossibuprocaina 0,4%) se necessario.
- Metti gocce antibiotiche (tobramicina 0,3%) e lacrime artificiali (ialuronato scende 0,18%) nell'occhio operato.
- Posizionare una lente a contatto morbida fasciatura alla fine della chirurgia fino riepitelizzazione è completa. Riepitelizzazione richiede solitamente 3 giorni.
- Prescriva analgesici come il paracetamolo (500 mg) più codeina (30 mg), 6 capsule al giorno.
- Dopo corneale riepitelizzazione, avviare la terapia topica con steroidi (topica desametasone 1 mg / ml) e proseguire per 3-4 settimane. Inoltre, utilizzare lacrime artificiali 4 volte al giorno per 1 mese.
2. accelerata collagene corneale CXL (A-CXL)
1. Preparazione del paziente
- 5 giorni prima dell'intervento, ha messo 1% pilocarpina gocce due volte al giorno negli occhi trattata.
- In sala operatoria, in condizioni asettiche, si trovano il paziente sulla sua / schiena.
- Somministrare anestesia topica come ossibuprocaina 0,4%.
- Pulire la postavoi e la pelle attorno agli occhi con iodio antisettico due volte.
- Utilizzare uno speculum coperchio per tenere l'occhio aperto.
2. Rimozione epiteliale
- Segnare il centro 9,0 millimetri della cornea con un pennarello corneale cerchio
- Rimuovere le centrali 7,0 a 9,0 mm di epitelio corneale di pulizia meccanica utilizzando una spatola smussato.
3. Applicazione Riboflavina
- Applicare 0,1% riboflavina senza Destrano sulla cornea ogni 2 min per 10 min.
4. UVA irradiazione
- Irradiare la cornea con una lunghezza d'onda di luce UVA 370 nm ad un irraggiamento di 30 mW / cm 2 (5,4 / cm 2 dose superficiale J) e ad una distanza di lavoro 5 cm per 3 min.
- Durante l'irradiazione, aggiungere anestesia topica (oxybuproca & # 239; NE 0,4%), se necessario.
5. Fine della Chirurgia
- Mettere gocce antibiotiche (tobramicina 0,3%) e lacrime artificiali (ialuronato gocce 0 0,18%) nell'occhio operato.
- Posizionare una lente a contatto morbida fasciatura alla fine della chirurgia fino riepitelizzazione è completa. Riepitelizzazione richiede solitamente 3 giorni.
- Prescriva analgesici come il paracetamolo (500 mg) più codeina (30 mg), 6 capsule al giorno.
- Dopo corneale riepitelizzazione, avviare la terapia topica con steroidi (topica desametasone 1 mg / ml) e proseguire per 3-4 settimane. Inoltre, utilizzare lacrime artificiali 4 volte al giorno per 1 mese.
3. ionoforesi (I-CXL)
1. Preparazione del paziente
- 5 giorni prima dell'intervento, ha messo 1% pilocarpina gocce due volte al giorno negli occhi trattata.
- In sala operatoria, in condizioni asettiche, si trovano il paziente sulla sua / schiena.
- Somministrare anestesia topica come ossibuprocaina 0,4%.
- Pulire l'occhio e la pelle attorno agli occhi con iodio antisettico due volte.
- Utilizzare uno speculum coperchio per tenere l'occhio aperto.
- Applicare l'elettrodo passivo appiccicoso sulla fronte sotto il campo operatorio.
- Applicare l'elettrodo attivo, un anello di aspirazione, per l'occhio aperto. Centrare l'anello di aspirazione sulla periferia della cornea prima di rilasciare l'aspirazione.

Figura 2. Dispositivo ionoforesi. L'elettrodo passivo viene applicato sulla fronte sotto il campo operatorio e l'elettrodo attivo, un anello di aspirazione, viene applicata all'occhio aperta. Fare click qui per visualizzare una versione più grande di questa figura.
3. Applicazione Riboflavina
- Riempire l'anello di aspirazione con hypoosmolar 0,1% riboflavina senza Dextran.
jpg "/>
Figura 3. applicazione Riboflavina in I-CXL. L'anello di aspirazione è pieno di hypoosmolar 0,1% riboflavina senza Dextran. Cliccate qui per vedere una versione più grande di questa figura.
- Avviare la corrente elettrica a 0,2 mA e aumentare gradualmente a 1,0 mA per un tempo totale di ionoforesi 5 min (Figura 4).
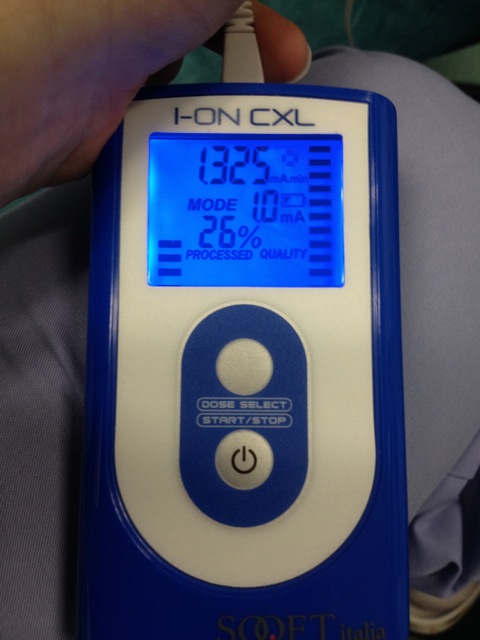
Figura 4. Dispositivo per iontoforesi riboflavina penetrazione. La corrente elettrica è inizialmente 0,2 mA e gradualmente aumentata a 1,0 mA. Tempo ionoforesi totale è di 5 minuti. Clicca qui per vedere una versione più grande di questa figura.
ep "> 4. UVA irradiazione- Irradiare la cornea con una lunghezza d'onda di luce UVA 370 nm ad un irraggiamento di 10 mW / cm 2 (5,4 / cm 2 dose superficiale J) e ad una distanza di lavoro 5 cm per 9 min.
- Durante l'irradiazione, aggiungere anestesia topica (oxybuproca & # 239; NE 0,4%), se necessario.
5. Fine della Chirurgia
- Mettere gocce antibiotiche (tobramicina 0,3%) e le lacrime artificiali (ialuronato scende 0,18%) nell'occhio operato.
- Prescriva analgesici come il paracetamolo (500 mg) più codeina (30 mg), 6 capsule al giorno.
- Dopo l'intervento chirurgico, avviare la terapia topica con steroidi (topica desametasone 1mg / ml) e proseguire per 3-4 settimane. Inoltre, utilizzare lacrime artificiali 4 volte al giorno per 1 mese.
Access restricted. Please log in or start a trial to view this content.
Risultati
La linea di demarcazione corneale era visibile in AS ottobre nel 92% dei casi, a una profondità media di 301,6 micron (SD, 73.6)
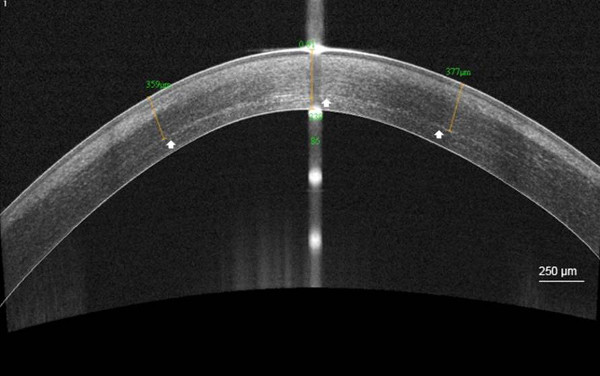
Figura 5. linea di delimitazione dopo C-CXL. Ad alta risoluzione del segmento anteriore della cornea a coerenza ottica tomografia (AS ottobre) la visualizzazione della linea di demarcazione stromale corneale a una profondità media d...
Access restricted. Please log in or start a trial to view this content.
Discussione
CXL utilizzando UVA irradiazione e riboflavina è il trattamento standard per arrestare la progressione del cheratocono. Riboflavina è un fotosensibilizzante che induce chimiche legami covalenti (legami incrociati) quando irradiati con raggi UVA 3. Nella cornea, questo fenomeno crea legami incrociati tra fibrille di collagene che aumentano la rigidità corneale. Anche se questo fenomeno è ben descritto, fino ad ora non vi è stata alcuna prova diretta di intracorneali legami incrociati. Tuttavia, diversi st...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
The authors have no acknowledgements.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Riboflavin Product number | |||
| C-CXL | Sooft SPA, Montegiorgio, Italy | Ricrolin 468465-6 | |
| A-CXL | Avedro Inc, Waltham, Massachusetts | VibeX 520-01863-006 | |
| I-CXL | Sooft SPA, Montegiorgio, Italy | Ricrolin+ 975481-6 | Passive electrode: PROTENS ELITE 4848LE/ Active electrode: IONTOFOR CXL |
| UVA Machine | |||
| X-Vega | UVA: 3 mW/cm2 30 min | ||
| KXL System | UVA: 30 mW/cm2 10 min | ||
| X-Vega | UVA: 10 mW/cm2 9 min |
Riferimenti
- Rabinowitz, Y. S. Keratoconus. Surv Ophthalmol. 42 (4), 297-319 (1998).
- Tuori, A. J., et al. The immunohistochemical composition of corneal basement membrane in keratoconus. Curr Eye Res. 16 (8), 792-801 (1997).
- Wollensak, G., Spoerl, E., Seiler, T. Riboflavin/ultraviolet-A-induced collagen cross-linking for the treatment of keratoconus. Am J Ophthalmol. 135 (5), 620-627 (2003).
- Raiskup-Wolf, F., Hoyer, A., Spoerl, E., Pillunat, L. E. Collagen cross-linking with riboflavin and ultraviolet-A light in keratoconus: long-term results. J Cataract Refract Surg. 34 (5), 796-801 (2008).
- Vinciguerra, P., et al. topographic, tomographic, and aberrometric analysis of keratoconic eyes undergoing corneal cross-linking. Ophthalmology. 116 (3), 369-378 (2009).
- Caporossi, A., Mazzotta, C., Baiocchi, S., Caporossi, T. Long-term results of riboflavin ultraviolet-A corneal collagen cross-linking for keratoconus in Italy: the Siena eye cross study. Am J Ophthalmol. 149 (4), 585-593 (2010).
- Greenstein, S. A., Fry, K. L., Hersh, P. S. Corneal topography indices after corneal collagen cross-linking for keratoconus and corneal ectasia: one-year results. J Cataract Refract Surg. 37 (7), 1282-1290 (2011).
- Ghanem, R. C., Santhiago, M. R., Berti, T., Netto, M. V., Ghanem, V. C. Topographic corneal wavefront, and refractive outcomes 2 years after collagen cross-linking for progressive keratoconus. Cornea. 33 (1), 43-48 (2014).
- Koller, T., Mrochen, M., Seiler, T. Complication and failure rates after corneal cross-linking. J Cataract Refract Surg. 35 (8), 1358-1362 (2009).
- Rocha, K. M., Ramos-Esteban, J. C., Qian, Y., Herekar, S., Krueger, R. R. Comparative study of riboflavin-UVA cross-linking and “flash-linking” using surface wave elastometry. J Refract Surg. 24 (7), 748-751 (2008).
- Caporossi, A., et al. Transepithelial corneal collagen crosslinking for progressive keratoconus: 24-month clinical results. J Cataract Refract Surg. 39 (8), 1157-1163 (2013).
- Bikbova, G., Bikbov, M. Transepithelial corneal collagen cross-linking by iontophoresis of riboflavin. Acta Ophthalmol. 92 (1), 30-34 (2014).
- Efron, N., Hollingsworth, J. G. New perspectives on keratoconus as revealed by corneal confocal microscopy. Clin Exp Optom. 91 (1), 34-55 (2008).
- Patel, D. V., McGhee, C. N. Mapping the corneal sub-basal nerve plexus in keratoconus by in vivo laser scanning confocal microscopy. Invest Ophthalmol Vis Sci. 47 (4), 1348-1351 (2006).
- Ku, J. Y., Niederer, R. L., Patel, D. V., Sherwin, T., McGhee, C. N. Laser scanning in vivo confocal analysis of keratocyte density in keratoconus. Ophthalmology. 115 (5), 845-850 (2008).
- Mazzotta, C., et al. Corneal healing after riboflavin ultraviolet-A collagen cross-linking determined by confocal laser scanning microscopy in vivo: early and late modifications. Am J Ophthalmol. 146 (4), 527-533 (2008).
- Seiler, T., Hafezi, F. Corneal cross-linking-induced stromal demarcation line. Cornea. 25 (9), 1057-1059 (2006).
- Doors, M., et al. Use of anterior segment optical coherence tomography to study corneal changes after collagen cross-linking. Am J Ophthalmol. 148 (6), 844-851 (2009).
- Mazzotta, C., et al. Treatment of progressive keratoconus by riboflavin-UVA-induced cross-linking of corneal collagen: ultrastructural analysis by Heidelberg Retinal Tomograph II in vivo confocal microscopy in humans. Cornea. 26 (4), 390-397 (2007).
- Kymionis, G. D., et al. Correlation of the corneal collagen cross-linking demarcation line using confocal microscopy and anterior segment optical coherence tomography in keratoconic patients. Am J Ophthalmol. 157 (1), 110-115 (2014).
- Yam, J. C., Chan, C. W., Cheng, A. C. Corneal collagen cross-linking demarcation line depth assessed by Visante OCT After CXL for keratoconus and corneal ectasia. J Refract Surg. 28 (7), 475-481 (2012).
- Jordan, C., Patel, D. V., Abeysekera, N., McGhee, C. .N. . In vivo confocal microscopy analyses of corneal microstructural changes in a prospective study of collagen cross-linking in keratoconus. Ophthalmology. 121 (2), 469-474 (2014).
- Touboul, D., et al. Corneal confocal microscopy following conventional, transepithelial, and accelerated corneal collagen cross-linking procedures for keratoconus. J Refract Surg. 28 (11), 769-776 (2012).
- Bouheraoua, N., et al. Optical coherence tomography and confocal microscopy following three different protocols of corneal collagen-crosslinking in keratoconus. Invest Ophthalmol Vis Sci. 55 (11), 7601-7609 (2014).
- Hafezi, F., Mrochen, M., Iseli, H. P., Seiler, T. Collagen crosslinking with ultraviolet-A and hypoosmolar riboflavin solution in thin corneas. J Cataract Refract Surg. 35 (4), 621-624 (2009).
- Cınar, Y., et al. Comparison of accelerated and conventional corneal collagen cross-linking for progressive keratoconus. Cutan Ocul Toxicol. 33 (3), 218-222 (2013).
- Cingü, A. K., et al. Transient corneal endothelial changes following accelerated collagen cross-linking for the treatment of progressive keratoconus. Cutan Ocul Toxicol. 33 (2), 127-131 (2013).
- Spoerl, E., Mrochen, M., Sliney, D., Trokel, S., Seiler, T. Safety of UVA-riboflavin cross-linking of the cornea. Cornea. 26 (4), 385-389 (2007).
- Gokhale, N. S. Corneal endothelial damage after collagen cross-linking treatment. Cornea. 30 (12), 1495-1498 (2011).
- Rootman, D. S., et al. Pharmacokinetics and safety of transcorneal iontophoresis of tobramycin in the rabbit. Invest Ophthalmol Vis Sci. 29 (9), 1397-1401 (1998).
- Vinciguerra, P., et al. Transepithelial iontophoresis corneal collagen cross-linking for progressive keratoconus: initial clinical outcomes. J Refract Surg. 30 (11), 746-753 (2014).
- Caporossi, A., et al. Riboflavin-UVA-induced corneal collagen cross-linking in pediatric patients. Cornea. 31 (3), 227-231 (2012).
- Buzzonetti, L., Petrocelli, G., Valente, P., Larossi, G., Ardia, R., Petroni, S. Iontophoretic transepithelial corneal cross-linking to halt keratoconus in pediatric cases: 15-month follow-up. Cornea. 34 (5), 512-515 (2015).
- Baiocchi, S., Mazzotta, C., Cerretani, D., Caporossi, T., Caporossi, A. Corneal crosslinking: riboflavin concentration in corneal stroma exposed with and without epithelium. J Cataract Refract Surg. 35 (5), 893-899 (2009).
- Wollensak, G., Iomdina, E. Biomechanical and histological changes after corneal crosslinking with and without epithelial debridement. J Cataract Refract Surg. 35 (3), 540-546 (2009).
- Soeters, N., Wisse, R. P., Godefrooij, D. A., Imhof, S. M., Tahzib, N. G. Transepithelial versus epithelium-off corneal cross-linking for the treatment of progressive keratoconus: a randomized controlled trial. Am J Ophthalmol. 159 (5), 821-828 (2015).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon