このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
円錐角膜で角膜コラーゲン架橋の三つの異なるプロトコル:従来は、加速してイオントフォレーシス
要約
Corneal collagen cross-linking (CXL) is the only conservative treatment currently available to halt keratoconus progression by improving the biomechanical rigidity of the corneal stroma. The aim of this manuscript is to highlight the methods of three different protocols of CXL: conventional CXL (C-CXL), accelerated CXL (A-CXL), and iontophoresis CXL (I-CXL).
要約
円錐角膜は、二国間及び進歩的な角膜拡張症です。その進行を遅くするために、角膜コラーゲン架橋(CXL)は最近、効率的な治療オプションとして導入されました。生物学的および化学的科学では、架橋は、反応性分子との間に形成された新たな化学結合を指します。したがって、角膜コラーゲンCXLの目的は、合成角膜基質中のコラーゲン原線維間の架橋の形成を増加させることです。従来のCXL(C-CXL)プロトコルの効率は、既にいくつかの臨床研究で示されているという事実にもかかわらず、それは、プロシージャと角膜上皮の除去の持続時間の改善から利益を得るかもしれません。したがって、二つの新しい及び最適化されたCXLプロトコルのコヒーレントな評価を提供するために、我々三CXL治療の受けていた円錐角膜の患者検討:イオン導入(I-CXL)を、CXL(-CXL)を加速し、そして従来のCXL( C-CXL)。 -CXLは6時間より早くCXL手順Uです10時間、より高いUVA放射照度を歌うが、それでも上皮の除去を含みます。イオントフォレーシスは、小電流が角膜を通じてリボフラビン浸透を改善するために適用された上皮の非侵襲的技術です。 (OCT)およびインビボ共焦点顕微鏡(IVCM) に前部光コヒーレンストモグラフィを用いて、治療の浸透の深さについては、従来のCXLプロトコルはプログレッシブ円錐角膜を治療するための標準的なままであることを結論付けています。加速CXLは薄い角膜を治療するために、迅速、効果的かつ安全な代替手段であると思われます。イオントフォレーシスの使用はまだ調査されている、より大きな慎重に検討する必要があります。
概要
円錐角膜は通常、角膜形状の変更の結果、一般集団1に2000で1に報告二国間及びプログレッシブ角膜拡張であるため、ビジョン2を減少させました 。円錐角膜は通常、早期思春期に存在し、進行は、患者の生涯にわたって可変とすることができるが、この疾患は、通常、安定化する傾向があるとき、人生の第四十年に第三まで進行します。円錐角膜の進行を停止させることにより、架橋は、延期または角膜移植を回避することを目的としています。
現在まで、臨床試験で証明された進歩的な円錐角膜の唯一の効率的かつ安全な治療は、剛性を高めるので、円錐角膜の進行3-8を停止することを目指し、従来の角膜コラーゲン架橋(C-CXL)プロトコルです。動作時間などの感染性角膜炎または間質ヘイズ9と C-CXLの他の可能な危険因子を減らすために、いくつかの改良されたプロトコルを持っています記載されて。まず、加速CXL(A-CXL)は、UVAのより高い放射照度は減少し、時間10にわたって角膜に送達されます。第二に、上皮の創面切除の必要性を回避するために、経上皮のアプローチが採用されています。従来のプロトコル11と比較した場合、残念ながら、それらは成功が限られています。 CXL中角膜リボフラビン送達のための最新の方法は、経上皮イオントフォレーシス(I-CXL)であるが、この治療法の厳密な評価はまだ12に行われていません。イオントフォレーシスは、小電流が組織を通ってイオン化された薬物の浸透を改善するために適用された非侵襲的技術です。イオントフォレーシスによりCXLでは、リボフラビンは上皮を介して角膜を貫通するようにイオン化されます。
生体内では、共焦点顕微鏡(IVCM)は、円錐角膜13のような疾患における異常な角膜の細胞の変化を強調することができ、角膜を画像化する方法です。実際、IVCMサブ基底神経叢および間質角膜実質13〜15の密度の特定の減少と円錐角膜で角膜のすべての層に変化を実証してきました。さらに、IVCMは、C-CXL 16後の角膜の微細構造解析のために非常に便利であることが証明されました。
角膜境界線は300ミクロン17,18の深さで、C-CXL後1ヶ月(10月AS)前眼部光干渉断層撮影で見hyperreflectiveラインとして記載されています。 IVCM次のC-CXLは、300ミクロンの深さに角膜実質細胞の不在を含む角膜の構造変化に関する情報を提供します。この無細胞ゾーンの深さだけでなく、角膜実質内の境界線の深さは、10月1日としてCXL処理19、及び角膜境界線の深さの測定の有効深さに関連すると思われる10月AS上で明らかにしましたCXLは、効率的な臨床として提案された後月CXL効果18の評価のための方法。
本研究では、10月、共焦点顕微鏡ASによって角膜実質境界線の測定を使用して、3つの異なる(従来、加速され、イオン導入)角膜コラーゲン架橋のプロトコルの効率を調査します。我々は、さらに定量的に3治療後の角膜の微細構造の変化を分析するためにIVCMを使用していました。
プロトコル
これらのプロトコルは、当院の人間研究倫理委員会のガイドラインに従ってください。
1.従来の角膜コラーゲンCXL(C-CXL)
患者の調製
- 手術前の5日は、ピロカルピンは、処置した眼で一日二回低下1%を置きます。
- 手術室では、無菌条件下で、彼/彼女の背中に患者を横になります。
- このようなオキシブプロカイン0.4%などの局所麻酔を管理します。
- 目と二回消毒ヨウ素と目の周りの皮膚をきれいにしてください。
- 開いている目を保つために蓋鏡を使用してください。
2.上皮の除去
- マーク・サークル角膜マーカーで角膜の中央9.0ミリメートル。
- 鈍いスパチュラを使用して機械的デブリドマンによって角膜上皮の中央7.0〜9.0ミリメートルを削除します。
3.リボフラビンアプリケーション
- 目に20%デキストランでリボフラビン0.1%を適用します Eの角膜20分間毎分。
4. UVA照射
- 3ミリワット/ cm 2の(5.4 J / cm 2の表面線量)の照度で30分間5cmの作動距離で370 nmの波長のUVA光を角膜に照射。

図1:C-CXL中でUVA照射角膜は、3ミリワット/ cm 2の(5.4 J / cm 2の表面線量)の照度で30分間、5 cmの作動距離で370 nmの波長のUVA光を照射します。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 照射中、角膜に5分ごとリボフラビンの滴を適用します。
- 照射中、局所麻酔(オキシブプロカイン0.4%)は必要に応じて追加します。
- 入れ抗生物質滴(トブラマイシン0.3%)、運営の目に人工涙液(ヒアルロン酸0.18%低下)。
- 再上皮が完了するまで、手術の終了時に、ソフト包帯コンタクトレンズを配置します。再上皮化は、通常は3日かかります。
- そのようなパラセタモール(500 mg)を加えたコデイン(30 mg)を、6丸薬日と鎮痛剤を処方します。
- 角膜上皮再形成した後、ステロイドと局所療法(局所デキサメタゾン1 mg / mlの)を開始し、3〜4週間継続します。さらに、1月の人工涙液を1日4回を使用しています。
2.加速角膜コラーゲンCXL( - CXL)
患者の調製
- 手術前の5日は、ピロカルピンは、処置した眼で一日二回低下1%を置きます。
- 手術室では、無菌条件下で、彼/彼女の背中に患者を横になります。
- このようなオキシブプロカイン0.4%などの局所麻酔を管理します。
- 電子メールをきれいにあなたがた二回消毒ヨウ素と目の周りの皮膚。
- 開いている目を保つために蓋鏡を使用してください。
2.上皮の除去
- マーク・サークル角膜マーカーで角膜の中央9.0ミリメートル
- 鈍いスパチュラを使用して機械的デブリドマンによって角膜上皮の中央7.0〜9.0ミリメートルを削除します。
3.リボフラビンアプリケーション
- 10分毎に2分角膜上デキストランなしリボフラビン0.1%を適用します。
4. UVA照射
- 30 mWの/ cm 2の(5.4 J / cm 2の表面線量)の照度で3分間5cmの作動距離で370 nmの波長のUVA光を角膜に照射。
- (oxybuprocaï 0.4%NE)照射中、局所麻酔を追加し、必要に応じて。
外科5.終了
- 抗生物質滴(0.3%トブラマイシン)と人工涙液を配置(ヒアルロン酸が0をドロップ操作の目に0.18パーセント)。
- 再上皮が完了するまで、手術の終了時に、ソフト包帯コンタクトレンズを配置します。再上皮化は、通常は3日かかります。
- そのようなパラセタモール(500 mg)を加えたコデイン(30 mg)を、6丸薬日と鎮痛剤を処方します。
- 角膜上皮再形成した後、ステロイドと局所療法(局所デキサメタゾン1 mg / mlの)を開始し、3〜4週間継続します。さらに、1月の人工涙液を1日4回を使用しています。
3.イオントフォレーシス(I-CXL)
患者の調製
- 手術前の5日は、ピロカルピンは、処置した眼で一日二回低下1%を置きます。
- 手術室では、無菌条件下で、彼/彼女の背中に患者を横になります。
- このようなオキシブプロカイン0.4%などの局所麻酔を管理します。
- 目と二回消毒ヨウ素と目の周りの皮膚をきれいにしてください。
- 開いている目を保つために蓋鏡を使用してください。
- 術野の下で額に粘着性のパッシブ電極を適用します。
- 開いた目に、活性電極、吸引リングを適用します。吸引をリリースする前に、角膜の周囲に吸引リングを中央に配置します。

図2.イオントフォレーシス装置。受動電極は、術野の下で額と活性電極、吸引リング、開いた目に適用されるに適用されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
3.リボフラビンアプリケーション
- デキストランのない低浸透圧0.1%のリボフラビンと吸引リングを入力します。
JPG "/>
I-CXL図3.リボフラビンアプリケーション 。吸引リングは、デキストランずに低浸透圧0.1%のリボフラビンが充填されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 0.2ミリアンペアでの電流をスタートし、徐々に5分( 図4)の総イオン導入時間を1.0ミリアンペアに増加します。
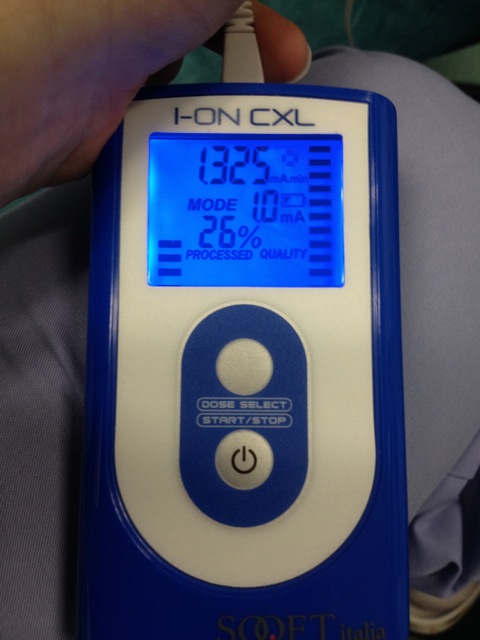
浸透リボフラビン図4.イオントフォレーシス装置。電流は、最初は0.2ミリアンペアで、徐々に1.0ミリアンペアに増加しました。総イオン導入時間は5分である。 この図の拡大版をご覧になるにはこちらをクリックしてください。
EP "> 4。UVA照射- 10ミリワット/ cm 2の(5.4 J / cm 2の表面線量)と9分間5cmの作動距離での放射照度で370 nmの波長のUVA光で角膜を照射。
- (oxybuprocaï 0.4%NE)照射中、局所麻酔を追加し、必要に応じて。
外科5.終了
- 抗生物質滴(トブラマイシン0.3%)、運営の目に人工涙液を(ヒアルロン酸0.18%低下)を配置します。
- そのようなパラセタモール(500 mg)を加えたコデイン(30 mg)を、6丸薬日と鎮痛剤を処方します。
- 手術後、ステロイドと局所療法(局所デキサメタゾン1mgの/ ml)を開始し、3〜4週間継続します。さらに、1月の人工涙液を1日4回を使用しています。
結果
角膜境界線は301.6ミクロン(SD、73.6)の平均深さで例92%で10月ASに見えました
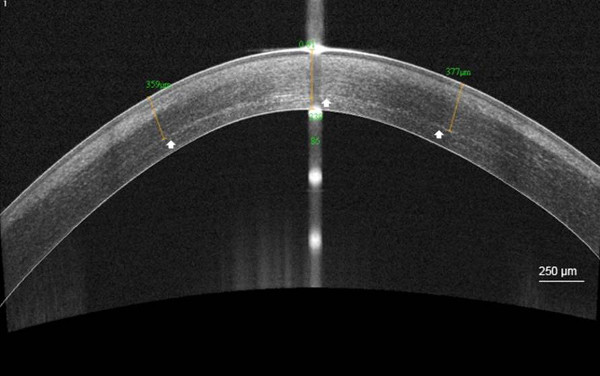
358ミクロン(白矢印)の平均深さで角膜実質境界線を可視化(10月AS) のC-CXL。高解像度角膜前眼部光干渉断層撮影スキャン後の図5.境界線 、従来の角膜コラーゲンクロス後1ヶ月リン?...
ディスカッション
UVA照射及びリボフラビンを用いCXLは、円錐角膜の進行を阻止するための標準的な治療です。リボフラビンは、UVA 3を照射したときの化学共有結合(架橋)を誘導光増感剤です。角膜では、この現象は、角膜の剛性を高めるコラーゲン原線維間の架橋を生成します。この現象はよく記載されているが、今まで角膜内架橋の直接的な証拠はなかったです。それにもかかわらず、いくつか?...
開示事項
The authors have nothing to disclose.
謝辞
The authors have no acknowledgements.
資料
| Name | Company | Catalog Number | Comments |
| Riboflavin Product number | |||
| C-CXL | Sooft SPA, Montegiorgio, Italy | Ricrolin 468465-6 | |
| A-CXL | Avedro Inc, Waltham, Massachusetts | VibeX 520-01863-006 | |
| I-CXL | Sooft SPA, Montegiorgio, Italy | Ricrolin+ 975481-6 | Passive electrode: PROTENS ELITE 4848LE/ Active electrode: IONTOFOR CXL |
| UVA Machine | |||
| X-Vega | UVA: 3 mW/cm2 30 min | ||
| KXL System | UVA: 30 mW/cm2 10 min | ||
| X-Vega | UVA: 10 mW/cm2 9 min |
参考文献
- Rabinowitz, Y. S. Keratoconus. Surv Ophthalmol. 42 (4), 297-319 (1998).
- Tuori, A. J., et al. The immunohistochemical composition of corneal basement membrane in keratoconus. Curr Eye Res. 16 (8), 792-801 (1997).
- Wollensak, G., Spoerl, E., Seiler, T. Riboflavin/ultraviolet-A-induced collagen cross-linking for the treatment of keratoconus. Am J Ophthalmol. 135 (5), 620-627 (2003).
- Raiskup-Wolf, F., Hoyer, A., Spoerl, E., Pillunat, L. E. Collagen cross-linking with riboflavin and ultraviolet-A light in keratoconus: long-term results. J Cataract Refract Surg. 34 (5), 796-801 (2008).
- Vinciguerra, P., et al. topographic, tomographic, and aberrometric analysis of keratoconic eyes undergoing corneal cross-linking. Ophthalmology. 116 (3), 369-378 (2009).
- Caporossi, A., Mazzotta, C., Baiocchi, S., Caporossi, T. Long-term results of riboflavin ultraviolet-A corneal collagen cross-linking for keratoconus in Italy: the Siena eye cross study. Am J Ophthalmol. 149 (4), 585-593 (2010).
- Greenstein, S. A., Fry, K. L., Hersh, P. S. Corneal topography indices after corneal collagen cross-linking for keratoconus and corneal ectasia: one-year results. J Cataract Refract Surg. 37 (7), 1282-1290 (2011).
- Ghanem, R. C., Santhiago, M. R., Berti, T., Netto, M. V., Ghanem, V. C. Topographic corneal wavefront, and refractive outcomes 2 years after collagen cross-linking for progressive keratoconus. Cornea. 33 (1), 43-48 (2014).
- Koller, T., Mrochen, M., Seiler, T. Complication and failure rates after corneal cross-linking. J Cataract Refract Surg. 35 (8), 1358-1362 (2009).
- Rocha, K. M., Ramos-Esteban, J. C., Qian, Y., Herekar, S., Krueger, R. R. Comparative study of riboflavin-UVA cross-linking and “flash-linking” using surface wave elastometry. J Refract Surg. 24 (7), 748-751 (2008).
- Caporossi, A., et al. Transepithelial corneal collagen crosslinking for progressive keratoconus: 24-month clinical results. J Cataract Refract Surg. 39 (8), 1157-1163 (2013).
- Bikbova, G., Bikbov, M. Transepithelial corneal collagen cross-linking by iontophoresis of riboflavin. Acta Ophthalmol. 92 (1), 30-34 (2014).
- Efron, N., Hollingsworth, J. G. New perspectives on keratoconus as revealed by corneal confocal microscopy. Clin Exp Optom. 91 (1), 34-55 (2008).
- Patel, D. V., McGhee, C. N. Mapping the corneal sub-basal nerve plexus in keratoconus by in vivo laser scanning confocal microscopy. Invest Ophthalmol Vis Sci. 47 (4), 1348-1351 (2006).
- Ku, J. Y., Niederer, R. L., Patel, D. V., Sherwin, T., McGhee, C. N. Laser scanning in vivo confocal analysis of keratocyte density in keratoconus. Ophthalmology. 115 (5), 845-850 (2008).
- Mazzotta, C., et al. Corneal healing after riboflavin ultraviolet-A collagen cross-linking determined by confocal laser scanning microscopy in vivo: early and late modifications. Am J Ophthalmol. 146 (4), 527-533 (2008).
- Seiler, T., Hafezi, F. Corneal cross-linking-induced stromal demarcation line. Cornea. 25 (9), 1057-1059 (2006).
- Doors, M., et al. Use of anterior segment optical coherence tomography to study corneal changes after collagen cross-linking. Am J Ophthalmol. 148 (6), 844-851 (2009).
- Mazzotta, C., et al. Treatment of progressive keratoconus by riboflavin-UVA-induced cross-linking of corneal collagen: ultrastructural analysis by Heidelberg Retinal Tomograph II in vivo confocal microscopy in humans. Cornea. 26 (4), 390-397 (2007).
- Kymionis, G. D., et al. Correlation of the corneal collagen cross-linking demarcation line using confocal microscopy and anterior segment optical coherence tomography in keratoconic patients. Am J Ophthalmol. 157 (1), 110-115 (2014).
- Yam, J. C., Chan, C. W., Cheng, A. C. Corneal collagen cross-linking demarcation line depth assessed by Visante OCT After CXL for keratoconus and corneal ectasia. J Refract Surg. 28 (7), 475-481 (2012).
- Jordan, C., Patel, D. V., Abeysekera, N., McGhee, C. .. N. .. In vivo confocal microscopy analyses of corneal microstructural changes in a prospective study of collagen cross-linking in keratoconus. Ophthalmology. 121 (2), 469-474 (2014).
- Touboul, D., et al. Corneal confocal microscopy following conventional, transepithelial, and accelerated corneal collagen cross-linking procedures for keratoconus. J Refract Surg. 28 (11), 769-776 (2012).
- Bouheraoua, N., et al. Optical coherence tomography and confocal microscopy following three different protocols of corneal collagen-crosslinking in keratoconus. Invest Ophthalmol Vis Sci. 55 (11), 7601-7609 (2014).
- Hafezi, F., Mrochen, M., Iseli, H. P., Seiler, T. Collagen crosslinking with ultraviolet-A and hypoosmolar riboflavin solution in thin corneas. J Cataract Refract Surg. 35 (4), 621-624 (2009).
- Cınar, Y., et al. Comparison of accelerated and conventional corneal collagen cross-linking for progressive keratoconus. Cutan Ocul Toxicol. 33 (3), 218-222 (2013).
- Cingü, A. K., et al. Transient corneal endothelial changes following accelerated collagen cross-linking for the treatment of progressive keratoconus. Cutan Ocul Toxicol. 33 (2), 127-131 (2013).
- Spoerl, E., Mrochen, M., Sliney, D., Trokel, S., Seiler, T. Safety of UVA-riboflavin cross-linking of the cornea. Cornea. 26 (4), 385-389 (2007).
- Gokhale, N. S. Corneal endothelial damage after collagen cross-linking treatment. Cornea. 30 (12), 1495-1498 (2011).
- Rootman, D. S., et al. Pharmacokinetics and safety of transcorneal iontophoresis of tobramycin in the rabbit. Invest Ophthalmol Vis Sci. 29 (9), 1397-1401 (1998).
- Vinciguerra, P., et al. Transepithelial iontophoresis corneal collagen cross-linking for progressive keratoconus: initial clinical outcomes. J Refract Surg. 30 (11), 746-753 (2014).
- Caporossi, A., et al. Riboflavin-UVA-induced corneal collagen cross-linking in pediatric patients. Cornea. 31 (3), 227-231 (2012).
- Buzzonetti, L., Petrocelli, G., Valente, P., Larossi, G., Ardia, R., Petroni, S. Iontophoretic transepithelial corneal cross-linking to halt keratoconus in pediatric cases: 15-month follow-up. Cornea. 34 (5), 512-515 (2015).
- Baiocchi, S., Mazzotta, C., Cerretani, D., Caporossi, T., Caporossi, A. Corneal crosslinking: riboflavin concentration in corneal stroma exposed with and without epithelium. J Cataract Refract Surg. 35 (5), 893-899 (2009).
- Wollensak, G., Iomdina, E. Biomechanical and histological changes after corneal crosslinking with and without epithelial debridement. J Cataract Refract Surg. 35 (3), 540-546 (2009).
- Soeters, N., Wisse, R. P., Godefrooij, D. A., Imhof, S. M., Tahzib, N. G. Transepithelial versus epithelium-off corneal cross-linking for the treatment of progressive keratoconus: a randomized controlled trial. Am J Ophthalmol. 159 (5), 821-828 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved