Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Три различных протоколов коллагена роговицы Сшивание в Кератоконус: Обычные, Ускоренные и ионофореза
В этой статье
Резюме
Corneal collagen cross-linking (CXL) is the only conservative treatment currently available to halt keratoconus progression by improving the biomechanical rigidity of the corneal stroma. The aim of this manuscript is to highlight the methods of three different protocols of CXL: conventional CXL (C-CXL), accelerated CXL (A-CXL), and iontophoresis CXL (I-CXL).
Аннотация
Кератоконус является двусторонним и прогрессивная роговицы эктазия. Для того, чтобы замедлить его прогрессирование, коллагена роговицы сшивки (CXL) недавно была введена в качестве опции эффективного лечения. В биологических и химических наук, сшивание относится к новых химических связей, образованных между реактивных молекул. Следовательно, цель коллагена роговицы CXL является синтетическим увеличить образование поперечных связей между коллагеновых фибрилл в строму роговицы. Несмотря на то, что эффективность обычных CXL (C-CXL) протокола уже было показано в нескольких клинических исследованиях, он может извлечь выгоду из улучшения продолжительности процедуры и удаления эпителия роговицы. Следовательно, для того, чтобы обеспечить последовательную оценку двух новых и оптимизированных протоколов CXL, мы изучали кератоконуса пациентов, перенесших один из трех CXL процедуры: ионофорез (I-CXL), ускоренное CXL (А-CXL), так и обычные CXL ( С-CXL). А-CXL является 6 раз быстрее, CXL процедура упеть десять раз более высокую UVA освещенности, но все еще в том числе удаления эпителия. Электрофорез является трансэпителиальная неинвазивным метод, в котором небольшой электрический ток подводится к улучшения проникновения рибофлавина всей роговице. Использование переднего сегмента оптической когерентной томографии (ОКТ КАК) и в естественных условиях конфокальной микроскопии (IVCM), мы заключаем, что в отношении глубины проникновения лечения, обычный протокол CXL остается стандартом для лечения прогрессивного кератоконуса. Ускоренное CXL, кажется, быстро, эффективной и безопасной альтернативой для лечения тонких роговиц. Использование ионофореза до сих пор расследуется и должны рассматриваться с большей осторожностью.
Введение
Кератоконус является двусторонним и прогрессивная роговицы эктазия обычно сообщается в 1 в 2000 среди населения в целом 1, в результате модификации формы роговицы и таким образом снижение зрения 2. Кератоконус, как правило, присутствует в начале полового созревания и до тех пор, пока прогрессирует третий четвертом десятилетии жизни, когда болезнь, как правило, имеет тенденцию к стабилизации, хотя прогрессирование может быть переменной в течение всей жизни пациента. Остановив прогрессирование кератоконуса, сшивание направлена на отсрочки или избежать кератопластики.
На сегодняшний день, единственным эффективным и безопасным методом лечения прогрессирующего кератоконуса доказана в клинических исследованиях является обычным коллагена роговицы сшивания (С-CXL) протокол, который направлен на повышение жесткости и, следовательно, остановить прогрессирование кератоконуса 3-8. Для того, чтобы сократить время операции и другие факторы риска можно C-CXL, такие как инфекционный кератит или стромы дымке 9 несколько улучшенные протоколыбыли описаны. Во-первых, в ускоренном CXL (A-CXL), более высокая освещенность УФА доставляется к роговице над уменьшенным временем 10. Во-вторых, чтобы избежать необходимости в эпителии, были использованы трансэпителиальная подходы. К сожалению, они ограниченный успех, когда по сравнению с обычным протоколом 11. Наиболее современный способ трансэпителиальная для роговицы доставки рибофлавина во CXL является ионофорез (я-CXL), но строгая оценка этого лечения еще не были выполнены 12. Ионофорез является неинвазивным методом в котором маленький электрический ток подводится к улучшения проникновения ионизированного препарата через ткани. В CXL путем ионофореза, рибофлавин ионизируется проникать в роговицу через эпителий.
В естественных конфокальной микроскопии (IVCM) представляет собой метод визуализации роговицы, что можно выделить клеточные изменения аномальных роговицы в таких заболеваний, как кератоконуса 13. Действительно, IVCMпродемонстрировала изменения для всех слоев роговицы кератоконуса в частности с сокращением плотности суб-базальной нервных сплетений и стромальных кератоцитов 13-15. Кроме того, IVCM оказалась весьма удобной для анализа микроструктуры роговицы после C-CXL 16.
Роговицы демаркационная линия описывается как hyperreflective линии видели в переднего сегмента оптической когерентной томографии (ОКТ) AS 1 месяц после C-CXL на глубине 300 мкм 17,18. IVCM следующие С-CXL предоставляет информацию о структурных изменений роговицы, в том числе отсутствие роговицы кератоцитами на глубину 300 мкм. Глубина этой бесклеточной зоны, а также глубина линии разграничения внутри стромы роговицы показал в качестве OCT, кажется, связаны с эффективной глубины CXL лечения 19 и измерения роговицы глубины демаркационной линии в AS 1 окт месяц после CXL был предложен в качестве эффективной клиническойМетод оценки эффективности CXL 18.
В настоящем исследовании мы исследуем эффективность трех различных протоколов коллагена роговицы сшивания (обычных, ускоряется, и ионофореза), используя измерения роговицы стромальных демаркационной линии А. С. ОКТ и конфокальной микроскопии. Кроме того, мы использовали IVCM количественно проанализировать изменения роговицы микроструктуры после трех процедур.
протокол
Эти протоколы следуйте рекомендациям комитета по этике человека нашей организации.
1. Обычные роговицы Коллаген CXL (С-CXL)
1. подготовка пациента
- 5 дней до операции, положить 1% пилокарпина падает дважды в день в очищенных глаз.
- В операционной комнате, в асептических условиях, лежат пациента на его / ее спине.
- Администрирование местной анестезией, таких как оксибупрокаина 0,4%.
- Очистите глаз и кожи вокруг глаз с йодом антисептическим вдвое.
- Используйте векорасширитель держать глаза открытыми.
2. Эпителиальные удаления
- Отметить центральную 9,0 мм роговицы с окружности роговицы маркера.
- Снимите центральную 7,0 до 9,0 мм от эпителия роговицы механической санации с использованием тупой шпатель.
3. Применение рибофлавин
- Применение 0,1% рибофлавин 20% декстрана на го е роговицы каждый мин в течение 20 мин.
4. Облучение УФА
- Облучают роговицу с 370 нм длины волны света UVA излучения на 3 мВт / см 2 (5,4 Дж / см 2 поверхности доза) и в 5 см Рабочее расстояние в течение 30 мин.

Рисунок 1:. UVA облучения в C-CXL Роговица облучают 370 нм длины волны УФ света на излучения 3 мВт / см 2 (5,4 Дж / см 2 поверхности доза) и по 5 см рабочей дистанции в течение 30 минут. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Во время облучения, применяются капли рибофлавина в роговицу каждые 5 мин.
- Во время облучения, добавить местной анестезией (оксибупрокаина 0,4%), если это необходимо.
- Антибиотик, капли (тобрамицина 0,3%) и искусственные слезы (гиалуронат падает на 0,18%) в оперированного глаза.
- Поместите мягкую повязку контактные линзы в конце операции до тех пор, реэпителизации не будет завершена. Реэпителизацию обычно занимает 3 дня.
- Назначают анальгетики, такие как парацетамол (500 мг) с кодеином (30 мг), 6 таблеток в день.
- После роговицы реэпителизации, инициировать местную терапию стероидами (как местное назначение дексаметазона 1 мг / мл) и продолжают в течение 3-4 недель. Кроме того, использовать искусственные слезы 4 раза в день в течение 1 месяца.
2. Ускоренное роговицы Коллаген CXL (А-CXL)
1. подготовка пациента
- 5 дней до операции, положить 1% пилокарпина падает дважды в день в очищенных глаз.
- В операционной комнате, в асептических условиях, лежат пациента на его / ее спине.
- Администрирование местной анестезией, таких как оксибупрокаина 0,4%.
- Очистите евы и кожа вокруг глаз с йодом антисептическим дважды.
- Используйте векорасширитель держать глаза открытыми.
2. Эпителиальные удаления
- Отметить центральную 9,0 мм роговицы с окружности роговицы маркера
- Снимите центральную 7,0 до 9,0 мм от эпителия роговицы механической санации с использованием тупой шпатель.
3. Применение рибофлавин
- Применение 0,1% рибофлавин без декстрана на роговице каждые 2 мин в течение 10 мин.
4. Облучение УФА
- Облучают роговицу с 370 нм длины волны света UVA излучения на 30 мВт / см 2 (5,4 Дж / см 2 поверхности дозы) и на рабочей дистанции 5 см в течение 3 мин.
- Во время облучения, добавить местной анестезией (oxybuproca & # 239; пе на 0,4%), если это необходимо.
5. Конец хирургии
- Поместите антибиотика тобрамицина капли (0,3%) и искусственные слезы (гиалуронат падает 0 .18%) В оперированного глаза.
- Поместите мягкую повязку контактные линзы в конце операции до тех пор, реэпителизации не будет завершена. Реэпителизацию обычно занимает 3 дня.
- Назначают анальгетики, такие как парацетамол (500 мг) с кодеином (30 мг), 6 таблеток в день.
- После роговицы реэпителизации, инициировать местную терапию стероидами (как местное назначение дексаметазона 1 мг / мл) и продолжают в течение 3-4 недель. Кроме того, использовать искусственные слезы 4 раза в день в течение 1 месяца.
3. Ионофорез (я-CXL)
1. подготовка пациента
- 5 дней до операции, положить 1% пилокарпина падает дважды в день в очищенных глаз.
- В операционной комнате, в асептических условиях, лежат пациента на его / ее спине.
- Администрирование местной анестезией, таких как оксибупрокаина 0,4%.
- Очистите глаз и кожи вокруг глаз с йодом антисептическим вдвое.
- Используйте векорасширитель держать глаза открытыми.
- Нанесите липкую пассивный электрод на лбу под операционного поля.
- Применение активного электрода, всасывающий кольцо, к открытому глазу. Центрирование всасывания кольцо на периферии роговицы перед выпуском всасывание.

Рисунок 2. Ионофорез устройства. Пассивный электрод наносится на лоб под операционного поля и активного электрода, всасывающей кольца, применяется к открытым глазом. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
3. Применение рибофлавин
- Заполните всасывающий кольцо с hypoosmolar 0,1% рибофлавина без декстрана.
JPG "/>
Рисунок 3. Приложение рибофлавин в I-CXL. Всасывания кольцо наполнен hypoosmolar 0,1% рибофлавина без декстрана. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Начните электрический ток в 0,2 мА и постепенно увеличивать до 1,0 мА в течение всего времени ионофореза 5 мин (рисунок 4).
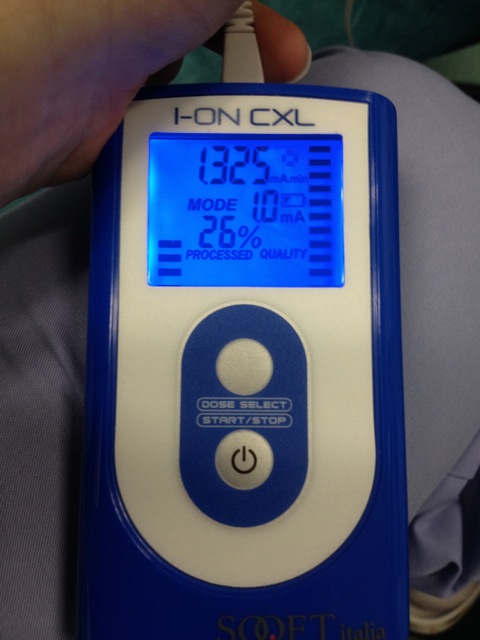
Рисунок 4. Устройство для ионтофореза по рибофлавин проникновение. Электрический ток 0,2 мА изначально и постепенно увеличивают до 1.0 мА. Общее время ионофорез 5 минут. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
ер "> 4. УФА облучение- Облучают роговицу с 370 нм длины волны света UVA излучения на 10 мВт / см 2 (5,4 Дж / см 2 поверхности дозы) и на рабочей дистанции 5 см на 9 мин.
- Во время облучения, добавить местной анестезией (oxybuproca & # 239; пе на 0,4%), если это необходимо.
5. Конец хирургии
- Поместите антибиотиков капель (тобрамицин 0,3%) и искусственные слезы (гиалуронат падает на 0,18%) в оперированного глаза.
- Назначают анальгетики, такие как парацетамол (500 мг) с кодеином (30 мг), 6 таблеток в день.
- После операции, инициировать местную терапию стероидами (дексаметазон 1 мг актуальной / мл) и продолжают в течение 3-4 недель. Кроме того, использовать искусственные слезы 4 раза в день в течение 1 месяца.
Результаты
Роговицы демаркационная линия была видна в АО ОКТ в 92% случаев при средней глубине 301,6 мкм (SD, 73,6)
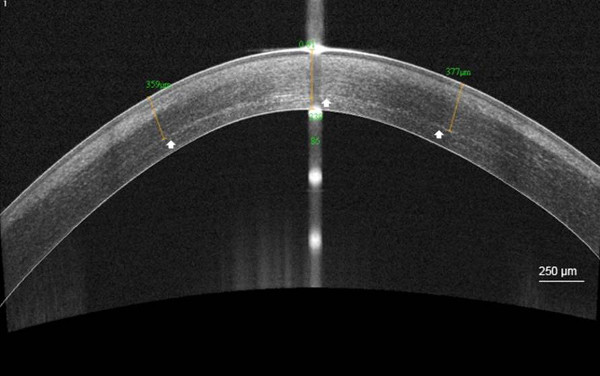
Рисунок 5. демаркационная линия после C-CXL. Высокое разрешение роговицы переднего сегмента оптичес?...
Обсуждение
CXL с помощью UVA излучения и рибофлавин является стандартом лечения на арест прогрессирования кератоконуса. Рибофлавин является фотосенсибилизатора, который индуцирует химические ковалентные связи (поперечные связи) при облучении УФ 3. В роговице, это явление создает поперечные ?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The authors have no acknowledgements.
Материалы
| Name | Company | Catalog Number | Comments |
| Riboflavin Product number | |||
| C-CXL | Sooft SPA, Montegiorgio, Italy | Ricrolin 468465-6 | |
| A-CXL | Avedro Inc, Waltham, Massachusetts | VibeX 520-01863-006 | |
| I-CXL | Sooft SPA, Montegiorgio, Italy | Ricrolin+ 975481-6 | Passive electrode: PROTENS ELITE 4848LE/ Active electrode: IONTOFOR CXL |
| UVA Machine | |||
| X-Vega | UVA: 3 mW/cm2 30 min | ||
| KXL System | UVA: 30 mW/cm2 10 min | ||
| X-Vega | UVA: 10 mW/cm2 9 min |
Ссылки
- Rabinowitz, Y. S. Keratoconus. Surv Ophthalmol. 42 (4), 297-319 (1998).
- Tuori, A. J., et al. The immunohistochemical composition of corneal basement membrane in keratoconus. Curr Eye Res. 16 (8), 792-801 (1997).
- Wollensak, G., Spoerl, E., Seiler, T. Riboflavin/ultraviolet-A-induced collagen cross-linking for the treatment of keratoconus. Am J Ophthalmol. 135 (5), 620-627 (2003).
- Raiskup-Wolf, F., Hoyer, A., Spoerl, E., Pillunat, L. E. Collagen cross-linking with riboflavin and ultraviolet-A light in keratoconus: long-term results. J Cataract Refract Surg. 34 (5), 796-801 (2008).
- Vinciguerra, P., et al. topographic, tomographic, and aberrometric analysis of keratoconic eyes undergoing corneal cross-linking. Ophthalmology. 116 (3), 369-378 (2009).
- Caporossi, A., Mazzotta, C., Baiocchi, S., Caporossi, T. Long-term results of riboflavin ultraviolet-A corneal collagen cross-linking for keratoconus in Italy: the Siena eye cross study. Am J Ophthalmol. 149 (4), 585-593 (2010).
- Greenstein, S. A., Fry, K. L., Hersh, P. S. Corneal topography indices after corneal collagen cross-linking for keratoconus and corneal ectasia: one-year results. J Cataract Refract Surg. 37 (7), 1282-1290 (2011).
- Ghanem, R. C., Santhiago, M. R., Berti, T., Netto, M. V., Ghanem, V. C. Topographic corneal wavefront, and refractive outcomes 2 years after collagen cross-linking for progressive keratoconus. Cornea. 33 (1), 43-48 (2014).
- Koller, T., Mrochen, M., Seiler, T. Complication and failure rates after corneal cross-linking. J Cataract Refract Surg. 35 (8), 1358-1362 (2009).
- Rocha, K. M., Ramos-Esteban, J. C., Qian, Y., Herekar, S., Krueger, R. R. Comparative study of riboflavin-UVA cross-linking and “flash-linking” using surface wave elastometry. J Refract Surg. 24 (7), 748-751 (2008).
- Caporossi, A., et al. Transepithelial corneal collagen crosslinking for progressive keratoconus: 24-month clinical results. J Cataract Refract Surg. 39 (8), 1157-1163 (2013).
- Bikbova, G., Bikbov, M. Transepithelial corneal collagen cross-linking by iontophoresis of riboflavin. Acta Ophthalmol. 92 (1), 30-34 (2014).
- Efron, N., Hollingsworth, J. G. New perspectives on keratoconus as revealed by corneal confocal microscopy. Clin Exp Optom. 91 (1), 34-55 (2008).
- Patel, D. V., McGhee, C. N. Mapping the corneal sub-basal nerve plexus in keratoconus by in vivo laser scanning confocal microscopy. Invest Ophthalmol Vis Sci. 47 (4), 1348-1351 (2006).
- Ku, J. Y., Niederer, R. L., Patel, D. V., Sherwin, T., McGhee, C. N. Laser scanning in vivo confocal analysis of keratocyte density in keratoconus. Ophthalmology. 115 (5), 845-850 (2008).
- Mazzotta, C., et al. Corneal healing after riboflavin ultraviolet-A collagen cross-linking determined by confocal laser scanning microscopy in vivo: early and late modifications. Am J Ophthalmol. 146 (4), 527-533 (2008).
- Seiler, T., Hafezi, F. Corneal cross-linking-induced stromal demarcation line. Cornea. 25 (9), 1057-1059 (2006).
- Doors, M., et al. Use of anterior segment optical coherence tomography to study corneal changes after collagen cross-linking. Am J Ophthalmol. 148 (6), 844-851 (2009).
- Mazzotta, C., et al. Treatment of progressive keratoconus by riboflavin-UVA-induced cross-linking of corneal collagen: ultrastructural analysis by Heidelberg Retinal Tomograph II in vivo confocal microscopy in humans. Cornea. 26 (4), 390-397 (2007).
- Kymionis, G. D., et al. Correlation of the corneal collagen cross-linking demarcation line using confocal microscopy and anterior segment optical coherence tomography in keratoconic patients. Am J Ophthalmol. 157 (1), 110-115 (2014).
- Yam, J. C., Chan, C. W., Cheng, A. C. Corneal collagen cross-linking demarcation line depth assessed by Visante OCT After CXL for keratoconus and corneal ectasia. J Refract Surg. 28 (7), 475-481 (2012).
- Jordan, C., Patel, D. V., Abeysekera, N., McGhee, C. .. N. .. In vivo confocal microscopy analyses of corneal microstructural changes in a prospective study of collagen cross-linking in keratoconus. Ophthalmology. 121 (2), 469-474 (2014).
- Touboul, D., et al. Corneal confocal microscopy following conventional, transepithelial, and accelerated corneal collagen cross-linking procedures for keratoconus. J Refract Surg. 28 (11), 769-776 (2012).
- Bouheraoua, N., et al. Optical coherence tomography and confocal microscopy following three different protocols of corneal collagen-crosslinking in keratoconus. Invest Ophthalmol Vis Sci. 55 (11), 7601-7609 (2014).
- Hafezi, F., Mrochen, M., Iseli, H. P., Seiler, T. Collagen crosslinking with ultraviolet-A and hypoosmolar riboflavin solution in thin corneas. J Cataract Refract Surg. 35 (4), 621-624 (2009).
- Cınar, Y., et al. Comparison of accelerated and conventional corneal collagen cross-linking for progressive keratoconus. Cutan Ocul Toxicol. 33 (3), 218-222 (2013).
- Cingü, A. K., et al. Transient corneal endothelial changes following accelerated collagen cross-linking for the treatment of progressive keratoconus. Cutan Ocul Toxicol. 33 (2), 127-131 (2013).
- Spoerl, E., Mrochen, M., Sliney, D., Trokel, S., Seiler, T. Safety of UVA-riboflavin cross-linking of the cornea. Cornea. 26 (4), 385-389 (2007).
- Gokhale, N. S. Corneal endothelial damage after collagen cross-linking treatment. Cornea. 30 (12), 1495-1498 (2011).
- Rootman, D. S., et al. Pharmacokinetics and safety of transcorneal iontophoresis of tobramycin in the rabbit. Invest Ophthalmol Vis Sci. 29 (9), 1397-1401 (1998).
- Vinciguerra, P., et al. Transepithelial iontophoresis corneal collagen cross-linking for progressive keratoconus: initial clinical outcomes. J Refract Surg. 30 (11), 746-753 (2014).
- Caporossi, A., et al. Riboflavin-UVA-induced corneal collagen cross-linking in pediatric patients. Cornea. 31 (3), 227-231 (2012).
- Buzzonetti, L., Petrocelli, G., Valente, P., Larossi, G., Ardia, R., Petroni, S. Iontophoretic transepithelial corneal cross-linking to halt keratoconus in pediatric cases: 15-month follow-up. Cornea. 34 (5), 512-515 (2015).
- Baiocchi, S., Mazzotta, C., Cerretani, D., Caporossi, T., Caporossi, A. Corneal crosslinking: riboflavin concentration in corneal stroma exposed with and without epithelium. J Cataract Refract Surg. 35 (5), 893-899 (2009).
- Wollensak, G., Iomdina, E. Biomechanical and histological changes after corneal crosslinking with and without epithelial debridement. J Cataract Refract Surg. 35 (3), 540-546 (2009).
- Soeters, N., Wisse, R. P., Godefrooij, D. A., Imhof, S. M., Tahzib, N. G. Transepithelial versus epithelium-off corneal cross-linking for the treatment of progressive keratoconus: a randomized controlled trial. Am J Ophthalmol. 159 (5), 821-828 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены